3 概述
浸潤性宮頸癌往往在婦科檢查中被發現並通過病理活檢組織學檢查證實。部分宮頸癌無症狀和肉眼異常所見,稱爲臨牀前浸潤性宮頸癌。在發展中國家有90%~95%的宮頸浸潤癌爲鱗癌,2%~8%是腺癌。
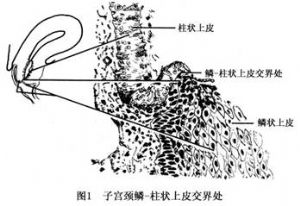
子宮位於骨盆的中央,外形像一個前後略扁、倒置、梨形的有腔器官。分子宮體和子宮頸兩部分。子宮頸位於子宮的最下面,約佔整個子宮的1/3,長2.5~3cm,分陰道上段和陰道段,即宮頸管和宮頸陰道部。陰道內的宮頸部分通過窺具檢查可以暴露,中間爲宮頸外口,其內腔呈梭形。頸管黏膜爲高柱狀上皮細胞,陰道內的子宮頸表面爲復層扁平上皮細胞,鱗、柱狀上皮細胞交界處是腫瘤的易發部位。
6 別名
invasive carcinoma of cervix;子宮頸浸潤性癌變
9 流行病學
宮頸浸潤癌的發病年齡跨度較大,20~90歲之間均有發病。FIGO 1995年報道,22428例浸潤性宮頸癌的年齡分佈:40歲以下佔26%,40~60歲佔40%,60歲以上佔34%,20~50歲發病增長較快,其後發病幅度下降,患病的高峯年齡在50歲左右,近10年來30~40歲左右的婦女患病率有明顯增加,不同地區間的發病率因年齡變化存在一定差異。
10 宮頸浸潤癌的病因
有關宮頸癌的流行因素國內外已進行了大量研究,如婚產因素、宮頸糜爛、包皮垢等。近年來則集中於性行爲、性傳播疾病以及病毒病因的研究。其病因包括:
10.1 性行爲
初次性交年齡過早、多個性伴侶及男性伴侶的性行爲,都被認爲和宮頸癌的發生相關。認爲這與青春期宮頸處於扁平上皮化生時期,對致癌物較爲敏感有關。
50多年前人們就發現在修女中宮頸癌極罕見。繼之許多研究指出婚產情況及性混亂,如初次性交過早、多個性伴侶和宮頸癌密切相關。20世紀70年代有報道宮頸癌的死亡率和淋病的發病率之間有關,因而認爲宮頸癌大多是由性傳播疾病感染所引起的。在這些性因素中和宮頸癌關係最恆定的是性伴侶數(表1),表中列舉的是病例對照研究結果。研究結果指出宮頸癌婦女較對照組婦女有更多的性伴侶,且患病的危險性直接與性伴侶數成正比。有≥10個性伴侶者較≤1個性伴侶者的相對危險性高3倍以上。事實說明多個性伴侶與CIN及宮頸癌均有明顯的相關性,但與前者的相關性更明顯。Slattery曾在一項研究中推算,性伴侶數≥10個者在宮頸癌新病例中佔36%。當性伴侶數≥6個且初次性交年齡在15歲以前時,則患宮頸癌的危險性上升5~10倍以上。


流行病學研究還發現初次性交年齡爲16歲者,其相對危險性爲20歲以上的兩倍(表2)。有學者指出初婚年齡在18歲以下者,比25歲以上者的患病率高13.3倍。Biswas(1997)報道初次性交年齡在12歲以下和≥18歲者相比,OR值爲3.5,且與宮頸癌的關係不依賴其他因素而獨立存在。


性關係的特徵可能也影響宮頸癌的危險性。一些學者對不同年齡階段的性伴侶數也進行了分析。Brinton(1987)及Herrero(1990)未發現20歲前的性伴侶數比終生性伴侶具有更多的意義,但Peter(1986)發現終生性伴侶的作用可全部歸於20歲前多個性伴侶的作用,他還發現月經初潮及初次性交間隔時間短可提高危險性,較初次性交過早的單獨作用還強,但後人未能證實。穩定的性伴侶(時間≥3個月),較不穩定的性伴侶對宮頸癌危險的相關性更大(Brinton,1987;Herrero,1990)。這個現象提示,可能需要更長期地、重複地接觸攜帶性傳播疾病的性伴侶,其危險性才增加。Herrero(1990)發現進行肛門性交者患宮頸癌的危險性亦增加,此種相關性是真實的還是僅僅反映了雙方性行爲的其他方面,還是與性衛生有關還不清楚。
10.2 人乳頭瘤病毒感感染
人乳頭瘤病毒(human papilloma virus,HPV)感染是宮頸癌的主要危險因素。流行病學調查及臨牀資料分析顯示,在目前發現的80餘種HPV型別中約有30餘型與性生殖道病變有關。
根據HPV致病力的大小及不同CIN和宮頸癌組織中HPV感染的分佈情況,HPV分爲高危型和低危型兩大類。低危型多導致低度宮頸上皮內瘤變(CIN I)及扁平疣類病變,主要有HPV 6,11,30,39,42,43及44。高危型主要導致CINⅡ~Ⅲ及宮頸癌的發生,主要有HPV 16,18,31,33,35,45,、52,56等。表3中所示與正常宮頸及CIN相比,宮頸浸潤癌中HPV 16及18型的陽性率最高,CIN次之。而HPV 6/11型則多見於CIN中。HPV 16、18型在CINⅡ、Ⅲ級中較常見,而HPV 6,11型則在CIN Ⅰ級中多見。HPV各亞型在宮頸浸潤癌中的分佈如表4,以16型最多見,其次爲18型,45,31,33型佔2%~5%。另有研究指出,宮頸腺癌中以HPV 18型最常見,而與鱗癌關係最大的是HPV 16型。


生殖道HPV感染主要通過性傳播,在性行爲活躍的年輕女性中最常見,感染高峯年齡範圍爲18~30歲。作爲一種常見的性傳播疾病,HPV感染多爲短暫性。大多數研究報道宮頸HPV感染的自然清除時間在7~12個月左右,只有少部分爲持續感染。許多研究顯示,持續性高危型HPV感染是發生宮頸病變的必要條件。有報道稱,高危型HPV的持續性感染者患CIN Ⅲ的風險增加100~300倍,而高危型HPV陰性者在隨後的2年內發生HGSIL(包括CINⅡ和CINⅢ)的可能性很小,隨診中細胞學結果也由輕度或交界性異常轉歸爲正常。
Dalstein等(2003)報道了一項對781名宮頸細胞學爲正常/ASCUS/LSIL的婦女的前瞻性研究。作者對這781名婦女應用第二代雜交捕獲法(HCⅡ)進行了高危型HPV (HR-IPV)檢測,然後每6個月隨訪1次,平均隨訪22個月。結果顯示高危型HPV陽性患者平均感染時間爲7.5個月(3~42個月),大於50%的感染者在7.5個月內清除。與高危型HPV陰性者相比,HPV短暫感染和持續感染者發生宮頸細胞學ASCUS和SlL的可能性大,其相對危險度(RR)分別爲2.38和9.13,所有進展到CIN2/3以上的患者都是高危型HPV持續感染者。同時作者發現,與高危型HPV陰性者相比,高危型HPV低度到中度病毒負荷者和高度病毒負荷者更易發生宮頸細胞學異常,其相對危險度(RR)分別爲1.65和8.66。
Schlecht等(2001)年報道了一項前瞻性HPV持續性感染的研究結果。該研究自1993~2000年對1611名婦女進行了HPV和宮頸細胞學檢查,第1年每4個月1次,隨後每年2次,將初始連續兩次HPV-DNA陽性定義爲持續感染。結果顯示與HPV陰性的患者相比,HPV16或18型持續感染患者發生SIL的相對危險度爲8.68(95% CI,5.9~17.6);和高危型HPV陰性者相比,任何高危型HPV持續感染發生SIL的相對危險度爲10.17,而發生HSIL的相對危險度爲11.6。
近30年生殖道HPV感染的發病率明顯升高,在1950~1978年間美國Rockester地區HPV感染的發病率上升了8倍,1978年爲106/10萬(Chuang,1984)。1966~1984年間在美國因溼疣而就診者上升了4.5倍。
我國6省市不同地區的調查結果發現,用核酸雜交法檢測宮頸癌組織中HPV 16型DNA的陽性率爲36%~64%。高發區山西省爲64%,低發區四川省爲36%。兩地間HPV 16的檢出率有明顯差異(章文華,1987)。司靜懿等(1992)對宮頸癌高發區新疆、華北,中發區湖北、黑龍江,低發區貴州的調查結果顯示,宮頸癌中HPV 16型陽性率平均爲60.4%,且各地宮頸癌中HPV16陽性率差異明顯,並與各地宮頸癌的死亡率水平一致。如新疆高達77%(死亡率爲15.78/10萬),而貴州則爲45%(死亡率爲4.92/10萬)。進一步分析發現新疆農村宮頸癌HPV 16陽性率爲88%,明顯高於城市(66%)。
在幾組病例-對照研究中,均顯示HPV感染和CIN及宮頸癌的發生密切相關。在拉丁美洲四個國家進行的一組大的病例-對照研究,包括759例宮頸浸潤癌及1467例對照,用FISH法對HPV 6/11、16/18進行檢測,結果說明HPV 16/18和宮頸癌間有明顯的相關性。當HPV 6/11及HPV 16/18均呈陽性時其相對危險性最高,另外還觀察到性行爲及HPV感染的作用均不依賴其他因素而獨立存在(Reeves,1989)。
美國的兩組病例-對照研究(Manos,1991;Morrison,1991)也都說明,HPV感染與CINⅠ~Ⅲ級均有很強的相關性。當多種型別的HPV感染同時存在時則危險性更高,在調整了HPV感染因素後,兩組中的初次性交過早、多個性伴侶、口服避孕藥及吸菸等因素的相關性消失或明顯下降。Eileen 2003年綜述文獻認爲,生殖道HPV感染中存在不同類型的HPV多重感染,多重感染率可以達39%,並且多重感染與病變的嚴重程度相關。在大約11.8%的細胞學爲正常或意義不明的不典型鱗狀細胞(ASCUS)的女性和35.4%輕到中度不典型增生的女性中,可以見到多重感染,並且其中至少有1種爲高危型HPV。
Schellekens等在74例宮頸癌樣本中檢測12種HPV-DNA,HPV感染率爲96%,14.1%爲2~3種HPV感染,其中至少有1種爲高危型HPV,同時發現多重感染在腺鱗癌中較在鱗癌和腺癌中明顯多見(P=0.014)。
Morrison(1991)還指出根據雜交信號的強度推測病毒負荷增加時危險性也增加,二者間呈具統計學意義的劑量效應關係。Munonz等(1992)近年在哥倫比亞及西班牙的病例-對照研究中用三種不同的雜交法檢測HPV-DNA,在兩國中均顯示HPV與宮頸癌間有很強的相關性,並觀察到病毒負荷增加時宮頸癌的危險性亦上升。Josefssonzai等2000年報道了對478例宮頸原位癌和608例正常對照應用PCR技術進行HPV 16病毒負荷測定的結果。他們根據病毒負荷由低到高將患者分爲五組,與HPV 16陰性者相比,發生宮頸原位癌的OR值從病毒負荷低水平組到高水平組逐漸上升,分別爲2.0,4.4,8.1,18.7,68.8。Ho等在1999年對100名女性進行隨訪,前3個月每6周隨訪1次,之後每3個月隨訪1次,共15個月,將連續兩次HPV陽性定義爲持續感染。HPV持續性感染與SIL的持續存在相關,其OR值爲3.91(95%CI,1.58~9.65),而持續性高病毒負荷的OR爲4.97(95%CI,1.45~17.02)。在調整了HPV因素後,口服避孕藥、初次性交過早及教育水平低下仍與宮頸癌密切相關。
隊列研究是確定HPV和宮頸癌自然關係的理想方法。Campion(1986)對100例CIN婦女長期觀察2年,每間隔8個月用FISH法檢測HPV-DNA,結果HPV 16/18陽性者56%發展爲CIN Ⅲ,而HPV 6陽性者僅爲20%。Schneider(1987)也有相似的報告,有趣的是3例宮頸CINⅠ~Ⅱ伴HPV 16/18感染者,在其性伴侶去除了伴有HPV 16型感染之後,她們的病變也消失了。芬蘭對530例宮頸HPV陽性婦女平均隨訪60個月,以細胞異型性HPV型別作爲病情惡化的觀察指標,其結果說明HPV16型較其他型別更易誘導CIN的惡化(HPV 16型有45%惡化,HPV 18型爲27%,HPV 6/11各爲0及13%)(Syranen,1990)。Murthy(1990)的研究結果指出63例由CIN進展爲CIS的婦女,在診斷爲CIS的活檢標本中HPV 16/18陽性率爲68.3%,而在44例無進展的CIN婦女中,在隨訪結束時HPV 16/18陽性率爲27.3%,OR爲5.9,具有統計學意義。
中國醫學科學院腫瘤研究所腫瘤醫院在宮頸癌高發區山西省襄垣縣的調查研究顯示,生殖道感染高危型HPV是當地婦女宮頸癌和宮頸上皮內瘤變的主要危險因素。通過對年齡爲35~45歲1997例已婚婦女的調查研究,其中宮頸癌12例,CIN Ⅲ 31例,CINⅡ43例,CINⅠ127例。宮頸浸潤癌和CIN Ⅲ HPV的感染率均爲100%(12/12,31/31),CINⅡ爲95.3%(41/43),CINⅠ爲61.4%(78/127),正常人羣爲14.2%(253/1784)。Bosch和Manos等通過收集來自22個國家的1008份宮頸癌活檢標本進行PCR檢測,發現93%的腫瘤中可以檢測到HPV-DNA,而且各國之間無顯著差異(Bosch FX,1995)。新近Manos等(Walboomers JM,1999)又重新分析了該研究中HPV陰性的病例,結合先前的數據,排除樣本量不足的因素,發現在世界範圍內宮頸癌的HPV檢出率達99.7%。
綜上所述,HPV與宮頸癌的病因關係可概括如下:①上述幾組研究說明二者的相關性是強的,且爲一致的;②其相關性主要表現在與少數特殊型別的病毒,即高危型病毒。
10.3 月經及分娩因素
有關初潮年齡、絕經年齡及衛生因素與宮頸癌的關係很少報道,Zhang等(1989)指出在中國農村(靖安縣)衛生不良(不洗外陰等)以及月經經期延長的婦女,宮頸癌的危險明顯升高;另一組調查亦發現經期、產褥期衛生不良,在病例組及對照組間的RR爲2.27(廖彩森,1986),有顯著的統計學意義。此外,越來越多的事實說明多產和宮頸癌密切相關。我國許多省市報道分娩1~3次患病率最低(110.38/10萬),4~6次漸高(192.36/10萬),7次以上明顯增高(377.52/10萬)(楊大望,1985)。Brinton(1989)在拉丁美洲的調查,在調整了社會經濟因素及性因素後發現,在宮頸浸潤癌中分娩≥12胎的比分娩0~1胎者的危險性高4倍。Wang(1996)報道,我國臺灣地區1991~1994年資料顯示,陰道分娩≥4次者較≤1者的患病危險性增加2倍。此相關性可能爲分娩對宮頸的創傷及妊娠時內分泌及營養的作用。此外還發現妊娠婦女HPV的檢出率很高,很可能是妊娠期免疫功能低下促使病毒的活性增高所致。
10.4 男性性行爲及有關因素
一些研究說明男性性行爲與宮頸癌關係密切。一些學者對比了宮頸癌及健康婦女配偶的性行爲及其他行爲方面的特點,以研究男性在宮頸癌發病中的作用。所有這些研究均得出了一致的結論:即宮頸癌配偶的性伴侶數遠較對照組配偶的性伴侶數爲多。研究還指出宮頸癌患者的配偶大多有各種性病史,包括生殖器疣、淋病、生殖器皰疹,而配偶經常用避孕套的婦女則宮頸癌危險性低。對靖安縣415例宮頸癌的隊列研究結果表明,隨着初次性交年齡的提前、本人及丈夫婚外性伴侶的增加,宮頸癌的相對危險性亦上升,丈夫有兩個婚外性伴侶者,其妻子宮頸癌的相對危險性上升5倍,306對配對調查(廖彩森,1986)也說明本人及配偶性混亂不論在配對調查中或高、低發區正常人羣的對比調查中,病例組均高於對照組,高發區高於低發區。
一些學者又進一步研究了宮頸癌的危險度和配偶性行爲類型的關係。在歐洲、泰國及我國臺灣地區的一些研究者發現,宮頸癌的高度危險性和其配偶嫖娼的次數有關(Buckley,1981;Kjaer,1991;Wang,1996)。Reeves及Quiroz(1987)報道,在拉丁美洲男性配偶嫖娼可以影響性病的流行,因此在高發區更重要的是調查上述性行爲的情況,最具說服力的證據是一夫一妻制的婦女患宮頸癌的危險性和她丈夫的性伴侶數直接相關(Buckley,1981)。Skegg(1982)認爲傳統上婚前保持貞操的婦女(印尼穆斯林)宮頸癌的發病率很高,這是因爲其丈夫嫖娼而將致癌因子傳給了這些婦女所致。男性生殖器HPV感染與其配偶患宮頸癌的危險亦密切相關。Barrasso等(1987)用陰道鏡檢查了294例患宮頸扁平溼疣及186例宮頸上皮內瘤變患者的男性伴侶480例,其中64%的男性生殖器有尖銳溼疣及丘疹。宮頸上皮內瘤變患者的性伴侶中32.8%(61例)亦同時有陰莖上皮內瘤變,而扁平疣患者的性伴侶中則僅有1.4%(4例)。60例陰莖丘疹患者中60%(36例)檢測出HPV-DNA序列,幾乎全部陰莖上皮內瘤變中均發現HPV 16及33型,而HPV6,11及42型則只存在於溼疣中。上述事實亦支持宮頸癌及其癌前病變和其男性性伴HPV感染相關的看法。
男性陰莖癌對其配偶患宮頸癌的影響亦有不少報道。在中國20世紀70年代死亡回顧調查中發現,兩種癌症在地理分佈上的一致性在統計學上具有非常顯著的意義(P<0.01,李冰,1987)。Creham(1979)及Smith(1980)報道陰莖癌患者的妻子較其他婦女患宮頸癌的危險性高3~6倍,其次前妻患宮頸癌的男性,其現在妻子患宮頸癌的危險性較對照組婦女高2倍。
男性包皮環切術與宮頸癌的關係尚無明確結論,有的學者統計,包皮環切者的妻子患宮頸癌的相對危險性極低(RR 0.3)。
10.5 吸菸
吸菸可能是宮頸癌的發病因素之一。不同的流行病學調查均顯示,吸菸者中浸潤前癌及浸潤癌的危險性均增加。在控制了其他各種因素後,發現吸菸的影響仍然存在。大多數研究中吸菸者宮頸癌的危險性增加2倍,高危患者多爲長期大量吸菸者,並提示有可能產生晚期效應。認爲吸菸的效應只表現在鱗癌患者,而與腺癌或腺鱗癌無關。在對吸菸者宮頸黏液的檢測中發現,吸菸引起的尼古丁及可鐵寧(cotinine)含量很高。有研究表明吸菸年限、每天吸菸量及初始吸菸年齡均與宮頸癌相關。雖然應考慮到吸菸對機體免疫的抑制作用,但也應考慮到其生物作用,尤其是吸菸加強了感染因素包括HPV的效應,ZurHausen(1982)認爲吸菸對HPV的促癌作用需進一步研究。
10.6 避孕方法
口服避孕藥和宮頸癌危險度的關係受多種因素的影響,尤其是性行爲的影響。大多數研究在考慮到有關因素作用後,證明其危險性仍然增加。口服避孕藥≥8年者,危險性增加2倍。一些研究指出口服避孕藥者發生腺癌的危險性較高,這與描述性調查中顯示在年輕婦女中腺癌發病率增加是一致的。應用屏障避孕法(子宮帽、避孕套)者宮頸癌的危險性很低,推測很可能是由於減少了接觸感染的機會,子宮帽的保護作用可能部分是由於同時應用了具有抗病毒作用的精子殺滅劑。
10.7 皰疹病毒Ⅱ型(HSV-Ⅱ)及其他
HSV-Ⅱ是最早被認爲在宮頸癌病因中起重要作用的一種病毒。國內一些單位採用多種方法進行了HSV-Ⅱ與宮頸癌的血清流行病學調查,發現宮頸癌患者中HSV-Ⅱ抗體陽性率高達80%以上,而對照組則僅爲14.14%~57.14%,其抗原陽性率也遠較正常對照及慢性宮頸炎者爲高。應用核酸原位雜交及HSV-ⅡDNA探針檢測,亦發現宮頸癌組織中HSV-ⅡDNA相關序列遠較正常宮頸組織爲高。此外,湖北、湖南、江西、北京等地均從宮頸癌患者宮頸刮取物中分離出HSV-Ⅱ病毒顆粒,經鑑定大多爲HSV-Ⅱ型。有學者將分離的病毒株進行細胞轉化及小鼠誘發宮頸癌的研究,均獲陽性結果。以PAP法進行城市及山區(高發區)人羣及宮頸癌患者宮頸脫落細胞HSV-Ⅱ抗原及血清學檢測,證明山區HSV-Ⅱ感染率高,且山區宮頸癌及癌前病變的HSV-Ⅱ抗原陽性率較當地正常人高,說明宮頸癌在HSV-Ⅱ流行地區的發病率高。進一步研究發現HSV-Ⅱ的抗體滴度在高發區明顯高於城市,同時男性血清HSV-Ⅱ抗體滴度的幾何均值兩地亦有明顯差異。有研究發現,血清HSV-Ⅱ抗體水平和宮頸癌的死亡率明顯相關。
國外一些研究也觀察到HSV-Ⅱ抗體陽性的婦女中,CIN、CIS及浸潤癌均較正常婦女爲高,且HSV-Ⅱ與宮頸浸潤癌的相關性較CIN爲強。美國的兩組研究(Graham,1982;Thomas,1978)在調整了其他混雜因素影響後,仍然顯示出HSV-Ⅱ抗體陽性者患CIS及浸潤癌的危險性均增高。另一項對2.3萬婦女的病例-對照研究顯示,在HSV-Ⅱ抗體陽性的婦女中宮頸癌的危險性上升2倍(Choi,1977),但Vonka(1984)及Adam(1985)的兩組相似的研究則未能證明其相關性。Armstrong(1986)觀察到HSV-Ⅱ感染與性傳播疾病門診的年輕婦女的CIN呈短暫正相關,但用細胞學方法檢查則未證實其相關性,在丹麥及格陵蘭婦女中,隨機取樣的調研結果顯示格陵蘭(宮頸癌發病率較丹麥高6倍)婦女中HSV-Ⅱ抗體的陽性率較丹麥高。
綜上所述,雖然HSV-Ⅱ與宮頸癌的病因聯繫不能肯定,但亦不能排除,尤其是可能與HPV之間的相互作用。Hildesheim等(1991年)發現HSV-Ⅱ與HPV有協同作用。與此兩種病毒均陰性者比較,HSV-Ⅱ陽性者的RR爲1.2,HPV 16/18陽性者的RR爲4.3,而當HSV-Ⅱ及HPV 16/18均陽性時則RR爲8.8。孟祥金等(1989)分別用DNA雜交法及PAP法,對50例慢性宮頸炎、CIN及宮頸癌的HPV-DNA及HSV-Ⅱ抗原同時進行檢測,在部分病例中兩種病毒同時存在,提示二者間可能存在某些聯繫。
其他和宮頸癌有關的性傳播疾病如梅毒、淋病、滴蟲病、沙眼等均曾有報道,但也有相反的結果。有學者在宮頸癌及對照組中對五種感染性疾病HPV、HSV-Ⅰ、Ⅱ、HCMV、EB病毒及衣原體感染進行了檢測分析,發現HPV、HSV、HCMV、衣原體感染和宮頸癌都有很強的相關性,當感染的種類增加時危險性亦隨之增高,35.5%的患者有4種或4種以上感染,而對照組則無。
11 發病機制
11.1 病理特徵
根據腫瘤的組織來源,宮頸浸潤癌的主要病理類型爲鱗狀細胞癌、腺癌和未分化癌。近年來宮頸腺癌和黏液腺癌有上升趨勢,原因是在常規染色中增加了黏液染色,發現用黏液染色後的切片中的鱗癌組織實際上是分化差的腺癌或腺鱗癌,因此鱗癌的定義不再僅僅是腫瘤象復層扁平上皮,而應該明確爲:鱗癌是指一種癌,該癌具有扁平上皮分化即角化和有細胞間橋,而無腺體分化或黏液分泌。無腺體分化或黏液分泌很重要,根據這兩點就可以除外分化差的腺癌和腺鱗癌。這一新的分類不僅糾正了宮頸癌的診斷、組織發生和不同病理類型宮頸癌的比例,更重要的是爲臨牀指出了預後。因爲低分化腺癌和腺鱗癌的惡性程度高,預後比鱗癌差,而且多發生在年輕患者,是預後差、轉移快的主要原因。從目前的臨牀診斷來看,鱗癌僅佔70%左右,腺癌佔20%左右,腺鱗癌佔10%左右。此外鱗癌又有疣狀鱗癌、乳頭狀鱗癌等亞型。腺癌又有乳頭狀腺癌、宮內膜樣腺癌、透明細胞癌等,臨牀上均少見。
11.1.1 (1)宮頸鱗癌的分化程度
根據宮頸鱗癌的組織學形態,概括分化程度分爲3級即:高分化、中分化、低分化。50%~60%的宮頸癌爲中分化,其餘高分化和低分化各佔一半。
11.1.1.1 ①高分化鱗癌(鱗狀細胞癌Ⅰ級)
大細胞,有明顯的角化珠形成,可見細胞間橋,癌細胞異型性較輕,核分裂較少,無不正常核分裂。
11.1.1.2 ②中分化鱗癌(鱗狀細胞癌Ⅱ級)
大細胞,細胞異型性明顯,核深染,不規則,核漿比例高,核分裂較多見,細胞間橋不明顯,有少量或無角化珠,有單個角化不良細胞。
11.1.1.3 ③低分化鱗癌(鱗狀細胞癌Ⅲ級)
大細胞或小細胞,無角化珠形成,亦無細胞間橋,偶爾可找到散在的單個角化不良細胞,細胞異型性和核分裂多見,此型癌不易確診爲鱗癌,但可利用免疫組織化學以及電鏡來鑑別。有些低分化鱗癌經黏液染色證實爲腺癌或腺鱗癌。癌巢周圍間質可有不等量的淋巴細胞、漿細胞或嗜酸性粒細胞浸潤。從組織學的角度分析,有大量淋巴細胞或嗜酸性粒細胞浸潤者預後較好。
在顯微鏡下,大部分鱗癌表現爲腫瘤細胞中的間質呈條索樣的網狀浸潤。並且表現爲各種各樣的腫瘤狀態、細胞形態和分化程度。由索狀的惡性細胞分開的宮頸間質被淋巴細胞、漿細胞浸潤。這些癌細胞可再分爲角化型和非角化型。
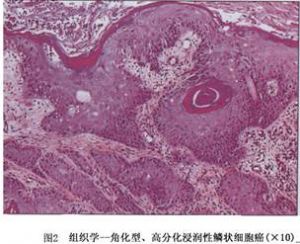
角化型鱗狀細胞癌是由特徵性的旋渦狀上皮細胞包含中央角化細胞巢(角化珠)組成(圖2)。細胞核大、染色質顆粒增粗、核深染、除透明角質性的顆粒和細胞質的角化以外,細胞間橋明顯。僅可見少量核分裂象。
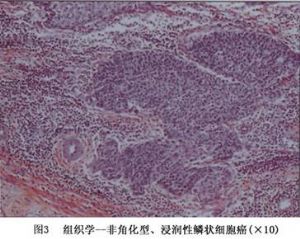
非角化型鱗狀細胞癌(圖3)表現爲不規則的、膨大的多邊形細胞鋸齒狀浸潤間質,可能有角化不良和細胞間橋。細胞和核的多型性明顯,核分裂象多見,無角化珠。
其他不常見的鱗狀細胞癌類型有:溼疣樣鱗癌(又稱疣狀鱗癌)、乳頭狀鱗狀細胞癌、淋巴上皮瘤樣癌、鱗狀透明細胞癌。
無論宮頸鱗癌還是腺癌,發現脈管瘤栓是潛在性侵襲性生長的證據,與區域淋巴結轉移的危險性有關。偶爾發生的血管浸潤是預後不佳的徵象,與遠處轉移或血行轉移有關。雖然浸潤性宮頸癌的脫落細胞學特徵已經被很好地描述,但細胞學並不是診斷浸潤性病變的可靠方法。在細胞學塗片中確認病變需要豐富的經驗,因爲在一張宮頸塗片的碎片細胞及血細胞中僅有數個癌細胞。宮頸腺癌很難由細胞學家識別:只有在其細胞極度異型時纔有可能被細胞學家發現。對個別細胞類型的認識更復雜。所以,宮頸浸潤癌最終確診總是要基於組織病理學診斷。腫瘤周圍的組織標本對診斷是最好的,因爲更可能包含了形態完整的腫瘤組織。從腫瘤中心取的活檢標本,可能有壞死組織,影響組織學診斷的準確性。
11.1.2 (2)宮頸鱗癌的大體分型
11.1.2.1 ①糜爛型
宮頸外形可見肉眼看不到腫瘤,表面糜爛樣,也可呈顆粒樣粗糙不平,質地較硬,觸摸容易出血,這種類型多見於早期浸潤癌。
11.1.2.2 ②結節型
結節型爲外生型腫瘤,癌瘤自宮頸外口向宮頸表面形成結節樣團塊,或者多個結節融合在一起形成大團塊,有明顯的突起,瘤竈凹凸不平,常常伴有深淺不等的潰瘍形成,質地較硬或堅硬,觸診時出血明顯。
11.1.2.3 ③菜花型
菜花型同屬外生型腫瘤,癌瘤像菜花樣自宮頸向陰道內生長,瘤體較大,血管豐富,質地較脆,接觸出血明顯,常伴有感染和存在壞死竈,此型癌瘤較少侵犯宮頸旁組織,預後相對較好。
11.1.2.4 ④潰瘍型
潰瘍型屬內生型腫瘤,癌瘤自宮頸向宮腔內呈侵蝕性生長,形成潰瘍竈和空洞,有時整個宮頸及陰道穹隆部組織潰爛而完全消失,邊緣不規則,組織壞死,質地較硬,分泌物惡臭,此型多見於體質虛弱、體形消瘦、一般狀況較差的患者。
根據腫瘤發展規律和術後標本病理檢查,血管、淋巴結轉移者以內生型較多見,而且內生型多有宮頸管和宮體受侵,外生型腫瘤侵犯宮體較少見。
一般來講,腺癌較多發生在頸管內,向四周生長形成桶狀,腫瘤細胞具有腺上皮細胞特徵,形成腺狀結構,浸潤間質,鱗狀上皮癌較多地發生在宮頸表面,特別是鱗-柱狀上皮交界處。瞭解癌瘤的生長方式和大體病理分型,結合臨牀分期,對決定治療方案、判斷預後有參考價值。
11.2 臨牀分期
子宮頸癌的臨牀分期開始於1929年,由國際婦產科聯盟(FIGO)、美國癌症聯合會(AJCC)及國際抗癌協會(UICC)制定分期標準。分期的目的是對不同醫院、不同方法治療的結果有一個統一的評定標準,以使統計資料有可比性。嚴格準確地進行臨牀分期,可以依據病變的範圍選擇恰當的治療方案,正確評估治療效果和判斷預後。
11.2.1 (1)分期原則
①臨牀分期應根據仔細的臨牀檢查,由有經驗的醫師於治療前確定,盆腔檢查、三合診檢查具特殊重要性。分期一經確立,不能因治療後有新的發現而改變已確定的分期。
②確定分期的基礎是進行細緻的臨牀檢查:這些檢查包括視診、觸診、陰道鏡檢查、宮頸管刮取術、宮腔鏡、膀胱鏡、直腸鏡、靜脈腎盂造影、肺及骨的X線檢查。可疑直腸、膀胱受累者,要有病理學檢查證實。
③血管造影、淋巴造影、腹腔鏡檢查對確定治療方案有幫助,但對所發現的問題不作爲確定分期的依據。
④當無法確定具體分期的期別時,應將分期定於較早的期別。
11.2.2 (2)臨牀分期
宮頸癌的臨牀分期已有70多年的歷史,歷經數次修改、逐步完善,開始時將腫瘤浸潤到盆壁即“冰凍骨盆”列爲Ⅳ期,在1937年修改分期時定爲Ⅲ期;1950年修改分期時決定將宮體受侵不作爲分期的標準(原分期宮體受侵定爲Ⅱ期);1961年的分期標準明確0期癌爲原位癌、上皮內癌,並指出0期癌病例不包括在任何治療統計中。1970年、1985年又有了隱匿癌(OCC)的概念,以及在Ⅲ期中增加了腎盂積水或腎無功能。以後又將0期和Ⅳ期的標準做了說明等。2003年在聖地亞哥(智利)召開的FIGO會議上,又對Ⅰ期的分期標準進行了修訂。此次修訂後的宮頸癌臨牀分期標準即爲目前國際統一使用的分期標準,內容如下(圖4):
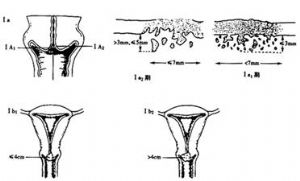

0期:原位癌、上皮內癌(此期病例不列入任何治療統計中)。
Ⅰ期:病變侷限於宮頸(宮體是否受累不予考慮)。
Ⅰa期:僅在顯微鏡下鑑別的浸潤癌。肉眼所能見到的病變,即使淺表浸潤,也屬Ⅰb期;間質浸潤的深度<5mm,寬度<7mm(浸潤深度從腫瘤部位上皮或腺體基底膜向下<5mm),靜脈或淋巴管區的浸潤不改變分期。
Ⅰa1期:間質浸潤深度<3mm,寬度<7mm。
Ⅰa2期:間質浸潤深度爲3~5mm,寬度<7mm。
Ⅰb期:臨牀檢查病變侷限於宮頸或臨牀前病變大於Ⅰa期。
Ⅰb1期:臨牀可見病變直徑<4cm。
Ⅰb2期:臨牀可見病變直徑>4cm。
Ⅱa期:無明顯宮旁浸潤。
Ⅱb期:有明顯宮旁浸潤。
Ⅲ期:病變浸潤達盆壁,直腸檢查時腫瘤與盆壁間無間隙;癌累及陰道下1/3;無其他原因的腎盂積水或腎無功能。
Ⅲa期:病變未達盆壁,但累及陰道下1/3。
11.2.3 (3)分期注意事項
③Ⅲ期的診斷應爲宮旁浸潤達盆壁、腫瘤與盆壁間無間隙,而且增厚爲結節狀時,方能確定。
④即使根據其他檢查定爲Ⅰ或Ⅱ期,但有癌性輸尿管狹窄而產生腎盂積水或腎無功能時,亦應列爲Ⅲ期。
⑤膀胱泡樣水腫不能列爲Ⅳ期。膀胱鏡檢查見到隆起及溝裂,並在同時通過陰道或直腸能確診證實該隆起或溝裂與腫瘤固定時,應視爲膀胱黏膜下受侵,膀胱沖洗液有惡性細胞時,應在膀胱壁取活體組織病理檢查證實。
11.3 轉移途徑
宮頸浸潤癌的轉移途徑主要是直接蔓延和淋巴轉移,血行播散較少見,但是晚期病例可以幾種情況同時存在。
11.3.1 (1)直接蔓延
是宮頸癌最常見的擴散方式。癌瘤自宮頸向下浸潤,穹隆最易受累。由於前穹隆淺,所以侵犯陰道前壁早於陰道後壁。一旦穹隆受累,癌瘤就可以迅速地向陰道擴散,有時呈間隔或跳躍式播散。向上蔓延可侵犯宮體,此種情況出現相對較晚。由於宮旁組織較疏鬆,淋巴管豐富,很易受累。癌瘤由宮頸兩側沿宮旁組織和主韌帶蔓延,向後沿宮骶韌帶蔓延,以片狀、條索樣、結節或團塊狀形成轉移竈。往往與淋巴結轉移同時出現。癌瘤向前侵犯膀胱,向後侵犯直腸。
臨牀上腫瘤浸潤常與炎症同時存在,需全身抗炎處理後方可鑑別。因此盆腔檢查時,組織增厚不一定是癌浸潤,只有當宮旁組織硬,形成結節、團塊、彈性消失或粗條索樣時,方可診爲癌浸潤。
11.3.2 (2)淋巴轉移
是宮頸浸潤癌的主要轉移途徑。癌瘤沿宮頸旁組織中的小淋巴管轉移到閉孔區,經髂內、髂外血管區淋巴結再轉移到髂總淋巴結,經盆腔淋巴到達腹主動脈周圍淋巴結,甚至上行達鎖骨上淋巴結或逆行轉移至腹股溝區淋巴結,此種情況多見於晚期病例。癌瘤亦可沿宮骶韌帶內的淋巴管轉移至骶前淋巴結。當癌瘤浸潤到陰道下1/3或外陰時,沿淋巴走向轉移到腹股溝淋巴結。圖5示宮頸癌的淋巴轉移途徑。
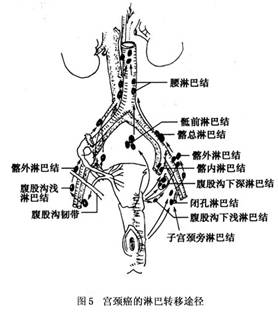
淋巴結轉移的發生率與臨牀分期情況成比例增加,即隨着臨牀期別的增高而上升(劉熾明,1994),但臨牀上發現,有的是很早期的病例就出現淋巴結轉移,也有部分晚期病例並無淋巴結轉移的情況,可能與自身的淋巴免疫功能有關。
11.3.3 (3)血行播散
比較少見,一旦血行擴散就形成遠處轉移竈,常見的轉移部位是肺臟、肝臟、骨骼和腦,此種情況多發生於晚期宮頸癌病例,多見於小細胞型鱗癌。
12 宮頸浸潤癌的臨牀表現
宮頸浸潤癌臨牀症狀的輕與重和病情的早、晚有關。宮頸癌早期可無症狀,隨着病情的發展及腫瘤的生長方式不同,症狀逐漸顯現出來。宮頸浸潤癌的主要臨牀症狀是不規則陰道出血、陰道分泌物增多和疼痛。這些症狀的輕重,與病變的早晚、腫瘤的生長方式、組織病理類型及患者的全身狀況有直接關係。
不規則陰道出血是宮頸癌患者的主要臨牀症狀,佔80%~85%,尤其是絕經後陰道出血更應引起注意。陰道出血往往是腫瘤血管破裂所致,尤其是菜花型腫瘤出現流血症狀較早、量也較多,如果頻發出血、失血過多可導致嚴重的貧血。晚期病例可因陰道大出血導致休克,多見於侵蝕性生長的腫瘤。
陰道分泌物增多亦是宮頸癌患者的主要症狀,多發生在陰道出血以前。初期陰道分泌物可以沒有任何氣味,隨着癌瘤的生長,癌組織繼發感染、壞死,分泌物量增多,如淘米水樣或血水樣,並帶有惡臭味。腫瘤向上蔓延累及子宮內膜時,分泌物被頸管癌組織阻塞不能排出,可以形成宮腔積液或宮腔積膿,患者可有下腹不適、疼痛、腰痠腹痛及發燒等症狀。
疼痛是晚期宮頸癌的症狀,癌瘤沿宮旁組織延伸,侵犯骨盆壁,壓迫周圍神經,臨牀表現爲坐骨神經痛或一側骶、髂部位持續性疼痛。腫瘤壓迫(侵蝕)輸尿管使管道狹窄、阻塞導致腎盂積水,表現爲腰痛甚至劇痛,進一步發展爲腎衰竭,以致尿毒症。淋巴系統受侵導致淋巴管阻塞、淋巴液迴流受阻,則出現下肢水腫和疼痛等症狀。
癌瘤向前方擴散可侵犯到膀胱,患者出現尿頻、尿急、尿痛甚至下墜和血尿,常常被誤診爲泌尿系統感染而延誤病情,嚴重的形成膀胱-陰道瘻。癌瘤向後蔓延可以侵犯直腸,有腹脹、下墜、排便困難、裏急後重、黏液便,血便等症狀,進一步發展可出現直腸-陰道瘻。長期的不規則出血、慢性消耗可繼發貧血,伴有惡病質,患者明顯消瘦。病變晚期可出現遠處轉移,轉移的部位不同,出現的症狀也不同。較常見的轉移部位是鎖骨上淋巴結,在該部位形成結節竈或腫塊。癌瘤浸潤可以通過血管或淋巴系統擴散到遠處器官,而出現相應部位的轉移竈。
宮頸癌晚期可通過血行播散轉移到遠處器官,最常見的部位是肺、骨骼、肝臟和腦等。肺轉移患者可有胸悶、胸痛、咳嗽和血痰等症狀。骨骼轉移常見於腰椎、恥骨、胸椎等部位,引起相應部位疼痛和運動障礙。肝轉移時可有肝區不適感、上腹脹滿、食慾不振、肝區疼痛等症狀。
14 實驗室檢查
14.1 宮頸脫落細胞學檢查
目前是國內、外發現早期宮頸癌最有效的檢查方法。由於早期癌患者大多數沒有症狀,臨牀檢查時醫生單憑肉眼觀察很難辨認有無腫瘤的存在,因此早期癌很少能及時被發現。宮頸暴露於陰道頂端,易於觀察和取材,所以目前在臨牀對凡已婚婦女,婦科檢查或人羣防癌普查時都常規進行陰道脫落細胞檢查,作爲篩查手段。由於巴氏塗片法的不足,可有高達25%的假陰性率,1988年Bathesda TBS系統和液基細胞學薄片的應用,使早期宮頸癌的診斷陽性率大大提高,達90%以上。爲了提高塗片診斷的準確率,特別注意要從宮頸癌的好發部位即扁平上皮與柱狀上皮交界處取材。由於老年婦女扁平、柱狀上皮交界區向頸管內上移,取材時除了從宮頸陰道部刮取塗片外,特別要注意從宮頸管處取材,能夠發現頸管內的癌瘤,以免漏診。過去宮頸刮片多用小腳板,後來採用雙取器,現在有了液基細胞學薄片技術,在很大程度上提高了細胞學的陽性診斷率。
(3)送檢單如患者姓名、年齡、病案號、末次經期、避孕措施、是否經內分泌治療及物理療法等,應認真填寫。
(4)以窺器輕輕暴露宮頸,以棉棍輕輕沾取宮頸表面的黏液,避免碰傷出血影響取材。
(5)將取材器放入宮頸管內,順時旋轉360°,塗片時應朝一個方向均勻塗抹,切忌反覆塗抹以至標本製片太厚或重疊,影響診斷。
(6)如爲常規塗片,則待塗片晾乾約1~2min後將塗片放入95%酒精裏固定。
陰道脫落細胞檢查異常時,並不一定都是宮頸癌。慢性炎症、重度感染、物理療法的影響、避孕工具等引起細胞形態改變,以及細胞學製片欠佳、染色過淡及污染等造成的假陽性或異常時,應做進一步檢查。如果陰道明顯存在炎症或原蟲感染,應給予抗炎和對症處理後再取宮頸刮片。必要時定期檢查或隔3個月重複細胞學塗片。
凡是細胞學檢查在巴氏Ⅱ級以上、或是ASCUS(沒有決定意義的非典型鱗狀細胞)、或宮頸上皮內低度瘤變(CINI)、或塗片發現癌細胞者(相當於巴氏Ⅳ~V級),都應在陰道鏡下多點活檢,送病理檢查。
14.2 碘試驗
將濃度爲2%的碘溶液直接塗於子宮頸和陰道黏膜上,觀察碘染色的情況,不着色處爲陽性,以幫助提供活檢的部位。此方法在無條件開展陰道鏡檢查的地方,當宮頸細胞塗片檢查異常或臨牀可疑時,可以藉助碘試驗幫助發現異常部位。
14.3 鱗狀上皮細胞癌抗抗原(SCC)
當腫瘤細胞產生的蛋白進入血液循環時,可以從周邊血液測出這些蛋白的含量,作爲一種腫瘤標誌目前在臨牀較廣泛使用。SCC主要存在於鱗癌成分的宮頸癌中,與臨牀分期、腫瘤大小及預後有關。許多學者的研究表明:SCC>4ng/ml者淋巴結轉移的危險性是SCC<4ng/ml者的8倍,提示約2/3的SCC升高患者中有淋巴結轉移。儘管這種指標在血中的濃度治療後下降,病情復發時可上升,有助於臨牀判斷病情的變化,但是SCC僅在部分患者中有所反映,SCC低或正常並不能排除淋巴結轉移問題。因此臨牀只作爲參考,要結合其他檢查綜合分析,才能做出診斷。
15 輔助檢查
15.1 陰道鏡檢查
陰道鏡是一種內窺鏡,在強光源下用雙目立體放大鏡(6~40倍),一般放大20倍左右直接觀察宮頸上皮和血管的細微形態變化。凡陰道(宮頸)脫落細胞學巴氏Ⅱ級以上、ASCUS或宮頸上皮內低度瘤變以及臨牀可疑癌或癌前病變時均應進行陰道鏡檢查。目的是協助定位活檢,提高取材的陽性率。此外亦可用於宮頸癌術後、放療後的隨診觀察。
15.2 活體組織檢查
宮頸癌在臨牀所進行的各項檢查都是診斷所需的重要環節,但是活體組織檢查是診斷子宮頸癌最可靠的依據。進行活體組織檢查時應該注意以下幾個問題:
(1)早期宮頸癌應在陰道鏡下可疑或異常上皮和血管部位定位取材,以提高活檢的檢出率。
(2)無陰道鏡檢查條件時做碘試驗(席勒試驗),將碘液塗於宮頸表面,正常細胞含糖原而呈黑色,異常細胞不含糖原而不着色,爲活檢取材處。
(3)腫瘤合併感染時,應從新鮮的瘤組織或病變的邊緣處取材,以防所取爲壞死或炎性組織而掩蓋深處的腫瘤實質。
(4)即使臨牀體徵、局部病變很像癌瘤,也要做活體組織檢查。有些良性病變如慢性宮頸炎、宮頸結核、宮頸血管瘤等外觀很像腫瘤,僅憑肉眼觀察是不能做出診斷的,必須由活體組織檢查來證實。必要時刮取頸管內組織一併送病理檢查。
(5)如果宮頸腫瘤明顯存在,但經多次活檢甚至陰道鏡下多點取材仍爲陰性結果,則要在深部取材或切取活檢幫助明確診斷,以免漏診。
(6)宮頸錐形切除術:防癌塗片檢查或陰道脫落細胞學檢查多次發現癌細胞,但在陰道鏡下定位活體組織檢查爲陰性結果,以及宮頸多點活體組織檢查爲原位癌,但臨牀不能排除浸潤癌者,可行宮頸錐切術。此種方法既可達到診斷目的又將病竈一併切除,被認爲是一舉兩得的方法。目前較多地用於宮頸上皮內瘤變的診斷和治療。
15.3 膀胱鏡、直腸鏡、腎圖、腎盂造影、胸片、骨盆像等
近年來電子計算機斷層掃描(CT)及磁共振成像(MRI)越來越多地用於臨牀診斷和鑑別診斷(不作爲臨牀分期依據)。CT掃描可以協助臨牀瞭解盆腔及腹主動脈旁淋巴結的情況,而MRI檢查可以協助臨牀辨認宮頸癌與正常宮頸的差異。有學者認爲臨牀MRI檢查顯示宮頸全層組織及子宮下段受侵的患者中,94%有宮旁浸潤,尤其是大體積的宮頸癌患者,可直接選擇單純放射治療,以避免誤診爲早期癌而進行不恰當的處理。上述輔助檢查有助於確定病變的範圍、選擇恰當的治療方法,對提高治療率、判斷預後是很有必要的。
16 宮頸浸潤癌的診斷
由於特殊的解剖部位、易於暴露、易於檢查的特點及長期臨牀經驗和較好的治療效果,宮頸浸潤癌的診斷並不困難,主要依據患者的主訴即臨牀症狀、臨牀體徵、病史詢問、全身檢查、盆腔檢查及輔助檢查等。
16.1 詢問病史
每1份病例都要詳細記錄主訴、現病史、既往史、婚產史、個人嗜好、生活習慣及腫瘤家族史,供臨牀分析病例,總結經驗,積累資料。
16.2 體格檢查
(1)全身檢查:觀察患者的全身一般情況,有無消瘦、貧血、惡病質,周身淺表淋巴結有無腫大,尤其是鎖骨上及腹股溝等部位的淋巴結要仔細檢查。上、下腹部是否觸及包塊、有無腹水徵等,都可以幫助判斷和了解病情發展的程度,如有可疑應做進一步檢查。
(2)盆腔檢查:宮頸浸潤癌的正確診斷除做雙合診檢查外,一定要做盆腔三合診檢查。尤其在進行臨牀分期時主要依靠三合診檢查,檢查步驟如下並將檢查結果繪圖記錄。
①外陰檢查:先觀察,然後觸診檢查大陰脣、小陰脣、尿道口及陰道口周圍有無癌瘤浸潤或贅生物等存在。
②窺陰器檢查:以普通生理鹽水爲潤滑劑,將窺陰器輕輕放入陰道,操作要輕巧,由外向內慢慢打開暴露癌竈,轉動窺器瞭解整個陰道的情況,注意勿碰傷瘤體導致出血而影響檢查。觀察陰道穹隆的深淺、有無彈性、腫瘤浸潤範圍和生長方式。重點觀察宮頸外形是否存在,癌瘤的部位、大小、生長方式和類型、周圍浸潤情況、擴散的範圍、是否有感染竈存在等。
③雙合診及三合診檢查:雙合診檢查是婦科檢查的常規步驟。一隻手置於小腹部,另一隻手以食指和中指自陰道口向陰道內檢查陰道壁穹隆四周、宮頸表面及宮口周圍,瞭解癌瘤的部位、大小、質地、浸潤範圍、深度、厚度及接觸性出血的情況。依靠雙手的內外配合進一步檢查子宮體,注意宮體的位置、大小、質地、活動度等,最後檢查雙側附件及宮旁組織有無增厚、結節、腫塊大小、質地、有無觸痛等。宮頸癌的正確診斷和臨牀分期高度依賴盆腔三合診檢查。此時將食指留在陰道內,中指伸入肛門內行三合診檢查,先查子宮及雙附件,然後檢查盆腔後半部及盆壁情況,瞭解陰道後壁、宮頸管的粗細和硬度、兩側宮頸旁、組織及宮骶韌帶的彈性、有無增厚、結節,以及兩側盆壁、兩側陰道旁、盆腔有無腫大的淋巴結和直腸有無癌浸潤等。
17 鑑別診斷
宮頸浸潤癌應與宮頸感染性疾病鑑別。組織病理學過去的概念:診斷浸潤癌的標準是看基底膜是否有破壞,以後有的學者發現無論是特殊染色或電鏡觀察,均證實基底膜的完整與否並不是鑑別浸潤的可靠指標,因爲增殖的基底細胞和炎細胞均可破壞基底膜。目前認爲間質反應是鑑別浸潤癌的一個重要指標。
18 宮頸浸潤癌的治療
對病員一旦明確診斷爲宮頸浸潤癌,應首先考慮制訂最佳的治療方案。治療方案的制訂,與患者的年齡、一般情況、病竈的範圍、有無合併症存在及其性質有關。因此治療前必須對患者進行全身檢查,並結合各臟器及系統功能檢查結果以及臨牀分期綜合考慮後製訂治療方案。
宮頸浸潤癌的治療主要是手術及放射治療。近年來由於抗癌化學藥物的迅猛發展,過去認爲對宮頸癌無效的化療現已成爲輔助治療的常用方法,尤其在晚期或復發患者。在手術或放療前先用化療,化療後待癌竈萎縮或部分萎縮後再行手術或放療,或者手術或放療後再加用化療,提高療效。
18.1 手術治療
18.1.1 (1)宮頸癌手術的發展史
Wertheim(1898)進行了第1例經腹子宮廣泛切除術及部分盆腔淋巴結清掃術,他於1911年報道到了500例子宮廣泛切除術及選擇性盆腔淋巴結清掃術,手術死亡率爲10%。因爲腹部子宮廣泛切除手術的死亡率高,1902年Schauta開展了經陰道子宮廣泛切除術,手術死亡率低,5年治癒率達41%。其後數十年中,Schauta手術經過改良而進一步發展。Wertheim手術經過改良後,由其學生Werner以及其他著名歐洲手術學專家如Latzko、Schiffmanm等提出了重要的改變,即擴大了手術範圍,日本的Okabayashi(1921)提出更廣的子宮廣泛切除術,即切除更多宮旁組織的手術。在20世紀早期,雖然子宮廣泛切除術的死亡率仍高,但很多專家仍熱衷於研究子宮廣泛切除術的改進。1898年居里夫人發現了鐳,1907年Kleim用放射線治療宮頸癌。20世紀前半葉很重視宮頸癌的放療,由於放療後死亡率低、存活率高,於是各種方式的鐳療發展了,包括Paris、Stockholm、Manchester等方式加上盆腔外照射,其5年治癒率達40%。雖然放療的發展很快,手術治療的研究並未中斷,1930年Meigs改良了Wertheim手術,增加了更廣的盆腔淋巴結清掃術,治癒率增加了30%。以後又有很多專家如Parsons、Ufelder、Green、Brunschwig、Barber、Morton、Pratt、Symmonds、Rutledge、Marlex、Nelson、Averette、Shingleton等各自進行了改進,以減少泌尿道及其他併發症,並保持了廣泛的切除宮旁組織以及完全的盆腔淋巴結清掃術,甚至有清掃腹主動脈旁淋巴結者。
隨着經驗的累積和相關技術的進步,子宮廣泛手術做了無數次的技術修改。修改後的技術各家略有不同,結果卻很難比較。Piver、Rutledge、Smith等人便將子宮根除手術分成5級,並在美國德州安森醫院(MD Anderson Hospital)開始執行。
①第1級:子宮頸兩旁的組織並沒有真正的分開,只是將兩側的輸尿管往外拉,在輸尿管的內側沿子宮將子宮頸旁組織切下來,而且不包括骨盆腔淋巴摘除。真正來說,只是一個擴大的全子宮切除手術而已。這一級的手術,適合O期子宮頸癌以及Ⅰa1。偶爾,也會被用於Ⅰa2以及頸管型宮頸癌放療術後的手術治療。
②第2級:手術切除範圍包括主韌帶(cardinal ligament)、子宮骶韌帶(uterosacral ligament)的一半以及上1/3的陰道和整個子宮。輸尿管則被往外推開,仍未分離子宮膀胱韌帶(vesicouterine ligament)。子宮動脈(uterine artery)也在輸尿管隧道(ureteral tunnel)前,在輸尿管內側結紮。盆腔淋巴同時摘除,可算是子宮根除術。適合Ⅰa2以及放療後僅有子宮頸部分殘留或復發的病人。
③第3級:除切除子宮外還包括主韌帶、子宮骶骨韌帶、子宮旁以及陰道旁組織和陰道上1/4。子宮動脈則在髂內動脈出源處結紮。輸尿管從子宮膀胱韌帶分離出來後,再切除陰道旁組織,但子宮膀胱韌帶並不切斷,以便提供多一些輸尿管末端的血管供應,減少輸尿管瘻管的發生。盆腔淋巴摘除是例行的步驟,適合Ⅰb~Ⅱa病人,已是最常用的手術。
④第4級:比第3級的手術範圍更要廣些。包括輸尿管周圍組織(periureteral tissue)、膀胱上動脈結紮以及陰道上半部3/4切除。輸尿管在這個時候完全與子宮膀胱韌帶分開,以增加子宮兩旁更廣泛的切除。爲達此目的,必要時一併切除髂內動脈。適合骨盆中央復發癌(centralrecurrence)並需保留膀胱的病人。
⑤第5級:比第4級的手術還要大,包括切除末端輸尿管和部分膀胱,適合骨盆中央復發癌並已侵犯到末端輸尿管和部分膀胱的病人。因此,需要行輸尿管再植入膀胱的手術(reinplantation of the ureter)。
仔細看起來,每一級的切除範圍都有不同。其實,關鍵還是在於輸尿管周圍子宮膀胱韌帶的剝離程度和與它相關子宮頸和陰道旁組織的切除範圍。第3級以上尤其是第4級和第5級子宮根除的技術訓練愈來愈有深度,愈來愈需要團隊的默契。
現今,子宮廣泛手術一般都包括切除子宮兩旁的子宮旁組織、子宮骶韌帶、子宮膀胱韌帶(uterovesical ligament)的一部分、陰道上1/4~1/3或離開陰道病竈1~2cm以上,以及整個子宮的切除,同時還包括兩側最少四類骨盆腔淋巴的摘除:髂內外、閉孔和輸尿管淋巴。很顯然,手術本身很複雜,切除範圍因爲前接膀胱、後鄰直腸、兩側是輸尿管,都很容易受損,產生合併症,大小動靜脈血管尤其多,更容易出血。一旦出血,增加了操作時間,容易產生手術後脹氣,甚至腸梗阻。因此,需要很懂得骨盆解剖的婦科醫師、經常做子宮廣泛手術的醫師才能進行這個手術,更需要好的團隊,包括好的助手、好的刷手護士、好的麻醉師的配合。故此,目前都在癌症醫學中心,至少是設備很好的醫院才能夠做。
我國從20世紀50年代在上海、北京、江西等地首先開展了宮頸癌的子宮廣泛切除術,以後天津、山東、廣東、四川等地陸續開展。手術方式以Werthem手術爲基礎,以後又吸取Meigs等手術方式的優點而進行改良。子宮廣泛切除術及盆腔淋巴結清掃術在我國已廣泛開展,經陰道子宮廣泛切除術也在上海、安徽等地開展了少數病例。
18.1.2 (2)手術適應證
②患者的全身情況與其他手術一樣,應根據其全身情況能否耐受手術,特別要注意患者有無嚴重的內、外科合併症。如合併嚴重內、外科疾病不宜手術者,則應改用其他方法治療。
③患者年齡超過70歲者不是禁忌證,但需根據患者全身具體情況能否耐受手術而決定。
⑤手術也適用於合併妊娠的患者,以往曾認爲妊娠者不宜做子宮廣泛切除術,但通過實踐國內外學者都認爲妊娠不是禁忌證,在妊娠早期、中期的患者,行子宮廣泛切除術並不會增加手術的併發症。
⑥宮頸殘端癌、陰道狹窄的宮頸癌患者及不宜用放療的宮頸癌患者。
18.1.3 (3)手術的類型
18.1.3.1 ①經腹切除子宮的類型
宮頸癌的手術類型根據國內外文獻報道大約可分爲3大類,實際上其主要的區別在於主韌帶、宮骶韌帶及陰道上段切除的範圍以及這些手術是經腹還是經陰道進行。切除子宮手術的類型如下:
A.擴大的筋膜外全子宮切除術:是指接近宮頸分離側面但不包括宮頸間質,在宮頸附着處切斷宮骶韌帶,切除的陰道壁爲1cm左右。一般良性婦科病所行的全子宮切除術是在外側分離,進入宮頸間質恰好在主韌帶附着的內側切斷,一些表面的宮頸間質並未切除,而擴大的筋膜外全子宮切除術時是在靠近宮頸處切斷宮骶韌帶,在宮頸附着處切斷陰道壁。筋膜外全子宮切除術適用於宮頸癌原位癌或Ⅰa1期。
B.改良的子宮廣泛切除術或子宮次廣泛切除術:本手術是在子宮頸及盆壁之間子宮頸外側2~3cm的距離處分離及切除主韌帶。在輸尿管內側及在附着處的前方遊離輸尿管,但外側仍附着於主韌帶,這樣保存了輸尿管的血供,大大減少了輸尿管瘻的可能性。宮骶韌帶在其中部分離,保存了膀胱的神經支配,手術後不需要長期留置導尿管。本手術適用於宮頸癌Ⅰa2期肉眼未見明顯病竈或病竈極小的浸潤癌。
C.早期宮頸癌手術治療新技術:廣泛性宮頸切除術加腹腔鏡盆腔淋巴清掃術:宮頸癌的發病越來越趨向於年輕化,另外,越來越多的夫婦選擇晚婚及晚育,迫使婦科腫瘤醫生在醫治宮頸癌的同時,不得不考慮患者提出保留生育功能的要求,發展保留生育功能的新手術方法。
Dargent等於1994年首次報道了對侷限於宮頸的小病竈癌而希望保留生育功能的患者,行陰式廣泛性宮頸旁組織切除術、宮頸切除術及腹腔鏡下盆腔淋巴清掃術。
至今已有150多例陰式和腹式廣泛性宮頸切除術病例的報道,並有許多人術後成功獲得妊娠。但因該術式較新,缺乏長期隨訪資料,在廣泛開展該術式前,還需對其手術過程作進一步評估,並在開展此項手術的腫瘤治療中心作前瞻性研究。
手術病人的選擇:宮頸癌FIGOⅠ期、從早期微小浸潤到侷限於宮頸的較大病竈、無明顯宮旁及宮體擴散及低危淋巴轉移者。爲了適當正確地選擇病例,必須詳細瞭解宮頸癌的自然生長及擴散特點,主要包括:腫瘤首先向兩側,沿主韌帶間質擴散;在早期宮頸癌,腫瘤垂直向直腸陰道間隙和膀胱宮頸間隙擴散較少見;擴散可以是連續性或間斷性的;淋巴血管間隙受累及腫瘤的體積較大,則預後較差;宮頸腺癌的生存率比鱗癌低,而且鏡下微小浸潤腺癌的概念不像鱗癌那樣被接受。
Burghardt和Holzer於1977年曾提出,對於宮頸微小病竈,無必要切除宮體及附件。Burghardt等報道395例宮頸癌,149例爲Ⅰb期,其中16%有宮旁浸潤,但無一例垂直擴散到宮體。垂直擴散僅見於晚期宮頸癌。對根治性宮頸切除術後標本行組織病理學研究顯示,腫瘤的轉移與體積有直接關係。
綜上所述,陰式廣泛性宮頸切除術的手術指徵爲:早期宮頸浸潤癌;強烈要求保留生育功能;病竈侷限於宮頸,無明顯宮旁或宮體擴散;由切除宮頸的標本和(或)由宮頸外觀判斷的小體積病竈;無明顯淋巴轉移。
術前評估:對有根治性宮頸切除術適應證的病人,術前須向其詳細解釋手術過程,包括:術中有轉爲廣泛性子宮切除術的可能,此手術爲一種新術式,生存率可能低於其他傳統方法,術後並不能保證生育。在病人完全明白及同意以上解釋後,需進行下列詳細的術前評估。
病理學再複檢:爲確保正確地選擇病人,需請有經驗的病理學家再看片,明確腫瘤浸潤的深度、寬度、細胞類型、分化程度、是否有淋巴血管間隙侵犯等。
麻醉下三合診檢查:由2~3位有婦科腫瘤經驗的醫生,在麻醉下作分期。必須排除有無膀胱、直腸及宮旁浸潤,如經陰道手術需瞭解陰道是否夠寬大,以方便手術野的暴露。檢查宮頸管的長度,以便將來手術時幫助評估切除宮頸的長度。
CT和(或)MRI:CT及MRI可幫助進一步提供關於腫瘤體積及擴散的資料,優點爲:評估宮頸管的長度;確定宮頸內口與病竈浸潤深度的距離;進一步排除有無宮旁浸潤;排除淋巴轉移。
手術程序:經陰道手術,首先行腹腔鏡下淋巴清掃術或腹膜外淋巴清掃術。腹腔鏡下淋巴清掃術能更清楚地瞭解盆、腹腔內的情況。早期微小病竈宮頸癌,淋巴轉移率僅佔5%。Dargent等於2000年首次提出了用腹腔鏡辨別前哨淋巴結。主張術中用5ml亞甲藍注射於宮頸癌病竈外圍,然後即在腹腔鏡下打開後腹膜,根據淋巴管走向辨別並取出被亞甲藍染色的前哨淋巴結,立即行冰凍切片病檢。前哨淋巴結爲陰性時,行盆腔淋巴清掃術及根治性宮頸切除術。如爲陽性,則改爲廣泛性陰道全子宮切除術或行開腹手術或改爲放療。
淋巴清掃術結束後,病人在膀胱截石位下,用0.25%丁哌卡因(bupivacaine)加1∶20萬腎上腺素液注射於陰道黏膜下,以減少出血及幫助分離。陰道過緊時,可採用Schuchardt會陰切口。在距離宮頸病竈至少2cm的陰道穹隆部位黏膜處用皮鉗鉗夾,環形切開,作一袖口。銳性分離陰道黏膜,分離前面的膀胱陰道間隙直至膀胱子宮腹膜反折爲止,分離後面的直腸陰道間隙,直至後穹隆腹膜爲止,充分暴露兩側膀胱宮頸間隙,此時手指可在此間隙內觸摸到雙側輸尿管。鈍性遊離輸尿管膝部,鉗夾子宮動脈陰道下支及宮頸支。此時Dargent術式爲打開後穹隆腹膜,充分暴露子宮骶韌帶及主韌帶。Shepherd等改良此步驟爲向中間宮體方向推移後穹隆腹膜,直至充分暴露子宮骶韌帶及主韌帶。在距宮頸2cm處,分離、鉗夾並縫扎子宮骶韌帶及主韌帶。需注意避免損傷輸尿管及子宮動脈。使用Hegar擴宮捧,擴張宮頸至6mm,並將擴宮捧留置於宮頸管,以便作指引。打開膀胱子宮腹膜反折,分辨子宮峽部。Dargent在距子宮峽部下1cm處,用電刀切除宮頸。Shaephaerd等則主張在子宮峽部水平切除宮頸。在切下的宮頸標本邊緣處取材做冰凍切片,以確保邊緣無腫瘤浸潤,同時也可確定是否有內膜腺體組織,以判斷是否切到峽部。使用改良Shirodkhar方法縫合子宮峽部。用1號尼龍線圍繞Hegars擴宮器縫扎子宮峽部後,拔出擴宮器,用Sturmdorf宮頸包埋縫合法,行陰道黏膜上皮與子宮峽部重建術。
經腹手術原則和標準的經腹子宮廣泛手術一致,切斷圓韌帶後打開闊韌帶作盆腔淋巴清掃,分離輸尿管至子宮動脈處,可以保留子宮動脈。如手術中出血較明顯也可切斷結紮子宮動脈,再同樣作至子宮直腸窩、直腸側窩和膀胱側窩,分別切除宮骶韌帶及主韌帶,打開輸尿管隧道。充分遊離膀胱後於子宮頸內口處切斷宮頸,再於病竈下2cm處切斷陰道,將子宮下段斷端作Mersilene環扎縫合後再與陰道殘端吻合。
由於經腹子宮廣泛手術多數婦科腫瘤醫師均較熟悉,手術操作較容易,且能保證切除足夠的宮旁組織,術後1年內妊娠分娩率爲37%。
主要由以下3方面來評估此術式:與標準的根治性手術比較,其生存率如何?此術式能否保存生育功能?與標準術式比較是否有其他術後併發症?
關於以上3個方面的問題,僅有少量文章以回顧性分析報道。病例較少,術後隨訪期較短,因此對此術式的遠期療效及安全性還有保留。Roy及Plante報道了100例行此術式的病例,其中僅有5例復發,5例中有4例病理顯示有淋巴血管間隙浸潤。因此提出術前宮頸病理切片顯示有淋巴血管間隙浸潤的病例,不適宜選擇行此術式。這幾篇文章均報道了成功妊娠的病例。妊娠併發症包括中期妊娠流產、過期流產、感染性流產、早產、胎盤早剝及羊膜炎等,發病率有所增加。也有許多流產後再次成功妊娠的病例報道。較困難的問題是如何處理妊娠併發症。Dargent提出,宮頸縫合對保留宮頸功能是重要的。儘可能保留縫線,因縫線埋藏於陰道黏膜上皮下,拆除較困難。對於中期妊娠流產,需通過開腹子宮切開術排除宮內妊娠產物,早期妊娠流產則可通過陰道排除。Jelsema建議爲降低妊娠期感染,在妊娠中期行陰道關閉縫合術,或給予預防性抗生素。該術式較傳統的根治性手術住院天數少,短期術後發病率低,但出院後仍有盆腔痛、性交痛、不規則點狀出血、縫合問題、宮頸狹窄等,需長期隨訪。
D.子宮廣泛切除術:是指全子宮切除,將主韌帶在盆壁及肛提肌處切除,宮骶韌帶在靠近其下外側附着處切除,也有專家提出保留1cm的主韌帶及宮骶韌帶,以利排尿功能的迅速恢復。在切除主韌帶時,免不了將輸尿管從其通路進入主韌帶到達輸尿管陰道交叉點的附着物分離出來,這樣會使某些輸尿管節段因爲危及血管而不能存活,結果子宮廣泛切除術後可能導致難以恢復的輸尿管瘻(約佔2%)。陰道必須切除上段的1/3~1/2,宮旁組織應根據病竈範圍切除4cm以上,必要時可達盆壁,並且需同時做盆腔淋巴結清掃術。本手術適用於Ⅰb~Ⅱa期宮頸癌患者。

18.1.3.2 ②盆腔淋巴結清掃術
盆腔淋巴結清掃術是指將盆腔各組淋巴結整塊清除,清除的淋巴結有髂總、髂外、髂內及閉孔淋巴結。盆腔淋巴結清掃術有兩種手術方法:
A.切開腹壁進入腹腔:剪開盆腔腹膜暴露腹膜後區域,然後採用逆行切除方法,即從宮頸外圍開始打開骨盆漏斗韌帶,從上向下依次暴露髂總、髂內、髂外血管和輸尿管等,並剝離其周圍脂肪及淋巴組織,自外周向內整塊切除以上各組淋巴結。
B.腹膜外盆腔淋巴結清掃術:同樣切開腹壁,暴露腹膜,但不切開腹膜,而是將腹直肌筋膜與腹膜分開,然後將腹膜用手掌輕輕向中央推開,在膀胱側方間隙顯露出腹膜外盆腔,找到該側圓韌帶腹膜外部分,鉗夾、切斷、貫穿縫扎,暴露髂血管,用手指將腹膜向內側分離,與經腹腔內盆腔淋巴結清掃手術同樣操作,清除各組淋巴結。腹膜外盆腔淋巴結清掃手術的優點是手術時未切開腹膜,干擾腹腔內臟器較少、時間較短,手術後恢復快,缺點是手術野的暴露不如腹膜內行手術方便。
很多年來,專家們對宮頸癌手術時是否需要作盆腔淋巴結清掃術存在爭議:
a.不贊成作盆腔淋巴結清掃術的理由:贊成作陰道子宮廣泛切除術者認爲不需作盆腔淋巴結清掃術,認爲單作經陰道子宮根治術的患者很少有術後併發症,特別沒有瘻形成。術後患者的死亡率低,治癒率與經腹子宮廣泛切除術及盆腔淋巴結清掃術者相同,認爲盆腔淋巴結清掃術也是不完全的手術,要切除所有盆腔淋巴結在技術上是不可能的,特別是下臀淋巴結位於坐骨棘部位。在盆腔淋巴結癌轉移病例中,也有很多病例腹主脈旁淋巴結已有癌轉移,而高位腹主動脈旁淋巴結是不可能完全清除的。有的專家認爲80%~90%的患者不需清掃盆腔淋巴結。
b.贊成宮頸癌手術時需要清掃淋巴結的理由:盆腔淋巴結清掃術有助於進行足夠的圍繞宮頸癌的中心性解剖,這是手術最重要的部分,尤其清除髂血管、閉孔窩及必要時骶前部分等周圍組織。盆腔淋巴結清掃術有助於估計預後,並且可以確定患者術後是否需要加用放療。手術時如發現盆腔淋巴結有轉移,就應進一步作腹主動脈旁淋巴結清掃。雖然盆腔淋巴結未發現有癌轉移,而腹主動脈旁淋巴結卻已有轉移者也有發現,但並不常見。宮頸癌作子宮廣泛切除術者,必須清掃盆腔淋巴結,但不需作常規腹主動脈旁淋巴結清掃,因爲它起不到治療作用。Podczaski等曾報道7/52例(13.4%)Ⅰa及Ⅱb期患者腹主動脈旁淋巴結( ),52例中28例爲局部癌竈巨大,直徑>5cm,這些病例單純手術治療並不是首選,專家們估計約1%的患者作根治術時需作腹主動脈旁淋巴結清掃。如果手術時已發現盆腔淋巴結( ),則必須仔細捫摸腹主動脈旁淋巴結,如捫及大而實質的淋巴結疑有轉移者,即應作腹主動脈旁淋巴結清掃術。如果作子宮廣泛切除術時不作盆腔淋巴結清掃,根據文獻報道有15%~20%的病例盆腔淋巴結爲陽性,這些患者作盆腔淋巴結清掃手術後選擇性加放療,其效果較不作盆腔淋巴結清掃而僅於術後加用放療爲好。文獻報道宮頸癌患者作子宮廣泛切除術及盆腔淋巴結清掃術,明顯降低了治療後的死亡率和複發率。盆腔淋巴結有轉移及(或)腹主動脈旁淋巴結( )者,作淋巴結清掃術後再加放療,其5年生存率明顯提高。
綜上所述,並通過我國很多專家的實踐經驗,認爲宮頸浸潤癌患者作子宮廣泛切除術時,應以同時作盆腔淋巴結清掃術爲宜。
18.1.3.3 ③經陰道子宮廣泛切除術
從陰道內行子宮廣泛切除術,是治療早期子宮頸癌的理想方法。若合併經腹腔或腹膜外淋巴結清掃或放射治療、化學治療等綜合處理,則可治療較晚期的子宮頸癌。
A.肥胖患者的腹壁厚,若經腹做子宮廣泛切除術,主要是在骨盆腔深部操作,而深骨盆部呈漏斗形,經腹部手術時距手術者較遠,手術難度較大。若在陰道內手術時,則深部骨盆距離較近,切除子宮旁組織和陰道旁組織等容易掌握,必要時還可行全陰道切除術,這在經腹部行子宮廣泛切除術是比較困難的。
B.患者合併心臟病、腎臟病、高血壓和重度肺結核等嚴重內科疾病者,耐受力較差。腹部手術創傷面大、手術時間長、出血多;而陰道手術創傷面小、出血少、手術時間短。
D.體弱消瘦的患者抵抗力差,也要求手術創面小、時間短、出血少。
E.對放療或化療敏感性差的如腺癌、腺鱗癌等,最好行手術治療。
F.害怕行腹部手術者,容易接受經陰道的手術。
總之,陰道內子宮廣泛切除術的特點是手術既安全、又徹底,是腫瘤根治手術的主要目的。另外手術後腹部脹氣少、痛苦少,一般在術後第2天即能下牀。手術後患者恢復快,住院時間短。
a.手術時患者取截石位,首先要作Schuchardt會陰切口,即在會陰口作左和(或)右會陰側切口,使陰道口擴大。
b.陰道袖口的形成:距離宮頸癌組織3cm以上環切陰道黏膜,分離至陰道前、後壁能包裹全部宮頸包括癌竈,然後將陰道前、後壁閉合形成袖口。
c.切斷宮骶韌帶,剪開兩側膀胱側窩,遊離輸尿管下段進入膀胱部,先捫及輸尿管,也可放置輸尿管導管以便於捫及輸尿管,然後遊離。
e.鈍性分離直腸側窩,分次鉗夾宮骶韌帶中層和深層,切斷、縫扎之。
f.沿輸尿管膝部向上鈍性分離輸尿管隧道3~4cm,鉗夾、切斷、縫扎宮旁組織。切除宮旁組織的範圍根據病竈的範圍決定。
i.閉合前、後穹隆部腹膜,縫合Schuchardt會陰切口。
手術存活率:不同的醫學中心報告的差異很多,手術5年存活率,在第1期是69%~90%,與放療的60%~93%幾乎一樣。但考慮到個別因素,不同醫院有不盡相同的病人和危險因素,因此也可能有差別,更重要的是醫師的偏愛、病人的信賴、治療的合併症以及生活的品質,這些纔是真正選擇治療方法的依據。
Zander報道Ⅰb~Ⅱ的病人1092位中50.6%的病人做了手術(Meigs type),手術病人的5年存活率在 Ⅰb是84.5%,Ⅱ是71.1%,但其中大多數是Ⅱa的病人。
Currie的552位做手術病人的5年存活率則是:Ⅰ是86.3%(189人);Ⅱa是75%(103人);Ⅱb是58.9%(78人);以及其他,34.1%(41人)。
Tinga的病人5年存活率,Ⅰb~Ⅱa是72%~88%(46人),其中腺癌病人與鱗狀上皮癌病人比較,預後較差(P<0.01);Ⅱb~Ⅳ分別是40%和30%(18人),腺癌和鱗狀上皮癌沒有分別。
此外,手術後的病人、盆腔淋巴有侵犯的病人,Meigs的報告,5年存活率爲42%;其他像Kastner、Mitra等的報道,盆腔淋巴沒有侵犯的病人,5年存活率高達90%以上。上海張惜陰等(1992)1320例,Ⅰa期100%:安徽張基本等(1990)195例,Ⅰa期97.4%,Ⅰb期84.2%。
針對手術後追蹤5年以上(1963~1995)的病人分析結果,早期子宮頸癌存活率在Ⅰb是86.3%~98.3%(1629/1785),其中85%以上都是Ⅰb1病人。而且愈是在後階段手術的病人,預後愈好;Ⅱa是78.9%(582/738);Ⅱb是68.2%(112/164)。在Ⅱb這一類病人,腺癌和鱗狀上皮癌的預後雖有差別,鱗狀癌好些,但兩者沒有統計學上的意義。此外,針對Ⅱb的病人,剔除輔助性治療後,一共有105位癌症病人接受了手術治療,204位做放療。5年存活率,手術和放療病人分別是68%和52%(P=0.0006)。Ⅲa的病人特別少,只有13位,複發率是38.46%(5/13),存活率是30.8%(4/13);Ⅲb~Ⅳa的存活率爲31.9%(15/47)。
Orlandi報道了接受手術治療的264例病人,Ⅰb~Ⅲa患者的5年存活率是65%~76%。這個差異,主要是受了淋巴轉移和年齡的影響。年齡35歲以下的比35歲以上的病人差,有淋巴轉移的病人存活率最差(46%∶24%)。
18.1.4 (4)腹腔鏡子宮廣泛手術
腹腔鏡自從1980年電視影像傳真(video monitor)問世後,腹腔內能看到的都呈現在熒幕上,原本的單一操作頓時轉變,手術助手因此能夠充分地配合。由於傷口小、出血少、住院時間短,病人接受度高,很自然便快速成長起來,已經是不能缺少的手術工具,並由原來以診斷爲主演變成爲診斷和治療兼具的手術。目前,大多數良性手術近80%也都以腹腔鏡爲主。由於腹腔鏡協助經陰道切除子宮(laparoscopic assisted vaginal hysterectomy,LAVH)技術成熟,開始時也用在CIS的病人。同時,又用在放療前晚期子宮頸癌以及不明分期病人的手術分期(laparoscopic staging),以減少分期的錯誤。可惜不但未見改善,還進而增加了原本不該有的放療合併症,可能是手術後產生骨盆腔粘連的結果。
此後,Spirtos、Hatch、Dargent及Chen等人,又利用腹腔鏡做Piver3級及3級子宮廣泛術,稱腹腔鏡子宮廣泛術(laparoscopic radical hysterectomy)。因爲是由陰道將子宮切除,因此又稱陰道式腹腔鏡子宮廣泛術(laparoscopic assisted vaginal radicai hysterectomy)。雖然是經腹腔鏡,子宮還是由陰道切除的,因此經陰道只是一個步驟,反而腹腔鏡子宮廣泛術(laparoscopic radical hysterectomy)的名稱用得比較普遍。
腹腔鏡進行此手術優點很多。例如,腹部沒有一個大且長的刀疤,住院時間短。美國婦癌醫學會(SGO)收集各家並分析78位早期子宮頸癌,Ⅰb1子宮頸病竈≤2cm,行Piver3級子宮廣泛術。平均手術時間是205min,手術出血是250ml,住院天數是2.9天。至於缺點是在子宮兩側切除範圍有其限制。將輸尿管儘量往外側拉,所切除的子宮頸旁組織有限,更不要說陰道旁組織切除了。若要撥開子宮膀胱韌帶,必須先將覆蓋在輸尿管上面的陰道動脈分開,容易造成輸尿管損傷,可是這點卻與複發率的多少關系密切。陰道長短的切除不是一個重點,切除部分陰道與複發率關係不大。此外,一不小心出血也會增加。爲了克服這個問題,必須配合陰道子宮廣泛術(Shauta radical hysterectomy),即技術上的缺點需經由陰道做輸尿管剝離,才能推開子宮膀胱韌帶,做較廣泛的兩側切除,否則這個腹腔鏡手術只能做極早期的子宮頸癌治療。此外,經陰道做子宮廣泛手術合併症高,已經很少人提,近乎絕跡。還有,由陰道行子宮廣泛術後仍需打開腹腔,施行淋巴摘除,因此,還不如直接由腹部施行更簡單。此外,經由腹腔鏡也有在肚臍下方套針(trocar)部位發生癌症種植的報道。這個缺點再次說明用腹腔鏡從事子宮頸癌的手術,不論是手術分期、淋巴摘除以至於子宮廣泛手術的病人,都應該長期追蹤。
臺北榮民總醫院選擇了子宮頸癌Ⅰb1的159位病人,由兩組(袁九重,劉偉民)經常做腹部子宮廣泛手術同時也經常做腹腔鏡手術的醫師,來執行腹腔鏡子宮廣泛手術和傳統的腹部子宮廣泛術(abdominal radical hysterectomy,open method),其中21位病人經由腹腔鏡做子宮廣泛手術。因爲子宮頸的病竈很小,除了摘除主動脈淋巴和骨盆腔淋巴之外,還切除子宮與靠近子宮和陰道的部分子宮旁和陰道旁組織,類似Piver2級的子宮廣泛手術。在淋巴摘除數目上,腹腔鏡組是19.4,傳統組是18.0。手術時出血兩組分別是332.5ml和500ml,手術時間分別是6h和2h,住院時間分別是4.5天和8天。複發率在這兩組沒有分別,是3.8%。
利用腹腔鏡做子宮廣泛手術無法剝離輸尿管,更不要說分開子宮膀胱韌帶,因此無法達到現行的技術要求。更重要的是,經由腹腔鏡所觸摸到的子宮頸附近組織,沒有手部的觸感,無法判斷病竈的範圍,因此無法計劃治療。此外,手術的時間也太長,只能適合0期癌症和顯微侵犯的全子宮切除。因深層的顯微侵犯和Ⅰb1而需要做子宮廣泛手術和骨盆腔淋巴摘除,行Piver2級,最多到達3級,也可以考慮。若要解決這個技術上的問題,必須聯合諳熟陰道子宮廣泛術的醫師,在腹腔鏡的協助下才能真正做到Piver3級,甚至更廣泛一點的子宮頸兩側組織切除。這點非常重要,尤其在Ⅰb2~Ⅱb的病人,廣泛的兩側切除確實可以降低手術後的複發率。
18.1.5 (5)手術併發症
子宮廣泛切除術的手術範圍廣、創傷多,故手術時易發生併發症。常見的併發症有:
18.1.5.1 ①手術損傷臟器
子宮位於盆腔中央,前有膀胱,後有直腸,其周圍有許多盆腔大血管,所以無論哪一種根治手術,均可能損傷子宮周圍臟器,最常見的是損傷腸曲或膀胱。若手術操作仔細、技術熟練、解剖熟悉,一般都可以避免,除非誤選晚期病例,癌竈已浸潤膀胱或腸曲,在推移或剝離時易發生損傷。一旦發生損傷,可根據損傷的部位、範圍等而行修補術。若損傷部位已有癌竈浸潤,則應根據病情考慮作膀胱部分切除、縫合或切除部分腸段再吻合等修補手術。其次是損傷輸尿管,發生的原因可以是誤扎、誤夾或誤切,一旦發生損傷,應根據損傷的部位、大小而採用不同的修復手術,並在修復後需放置輸尿管導管作爲支架,以利於癒合。
神經損傷並不常見,最重要的是損傷股、閉孔、腓、骶、腹股溝及女陰神經等。手術中小心仔細,注意神經的解剖,小心輕放、自動拉鉤,注意患者的體位,可以避免損傷神經。絕大多數神經損傷不致發生永久性傷殘。但如手術切斷或部分切斷閉孔神經,則應立刻縫合修補,手術後也可恢復正常。
18.1.5.2 ②術時出血
子宮廣泛切除術時的出血可分爲兩方面,一是在清掃淋巴結時,由於在盆腔大血管周圍操作,稍一不慎即可直接損傷動脈或靜脈;二是在分離主韌帶或遊離輸尿管隧道時,導致盆底靜脈叢出血,此時出血點難以辨認。子宮廣泛切除術時,儘管醫生技術熟練、經驗豐富,但分離隧道、盆腔側壁、骶骨前時,隨時都可以發生出血。手術一旦發生出血,若系直接損傷大血管如髂動脈或髂靜脈,則可在看清出血點後縫扎或結紮止血。若系損傷盆底靜脈叢、不易迅速夾住出血點以止血時,則應暴露手術野、充足麻醉和保持患者全身情況穩定,最簡單和最有效的方法是壓迫止血,可用手指或紗布或紗布墊壓迫止血,至少壓迫30min或局部注射止血劑,然後縫扎止血。即使如此,有的嚴重出血還需在盆腔內留置紗布條或紗布墊,緊壓出血部位,術後3~5天分幾次逐漸抽出紗布條。此外還可用高位血管暫時阻斷法,如腹主動脈暫時阻斷法控制局部出血量,尋找出血點,準確鉗夾、縫扎或結紮止血。腹膜外髂內動脈結紮是可以用來減少廣泛全子宮切除術時術中出血的方法,也可用於估計病竈較晚、盆腔有炎症、易出血病例的預防或減少術中出血,均有一定效果。當盆腔靜脈叢出血時,要確定靜脈撕裂的位置較困難。此時可用紗布墊較長時間地壓迫出血部位直至出血停止,同時先解剖盆腔其他部位繼續進行手術。如損傷盆腔大靜脈壁小分支,小靜脈的斷端已回縮,只有用細針無創縫合才能止血。盆腔深靜脈出血與動脈出血不同,結紮髂內動脈效果欠佳,因爲從下肢及下腔靜脈有大量側支靜脈進入盆腔,此時若結紮雙側髂內動脈前分支,以阻斷進入盆腔的主要動脈血供而減少靜脈出血,可能有效。當損傷髂外或髂總靜脈壁時,必須在損傷部位的上方和下方放置血管夾,並用縫合血管的無損傷線修復損傷部位。
18.1.6 (6)術後併發症
18.1.6.1 ①術後出血
術後出血較少見,因爲手術後盆腔所有的血供都已硬化,再次出血的機會較少。除非在手術完成時出血尚未妥善控制,此時可用紗布墊填塞在盆腔滲血處,另一端放在開放的陰道內,填塞在盆腔24~48h後取出,以免發生上行性感染。有時術後出血多見於手術時出血點漏扎或止血不善,若出血發生在陰道殘端,血液往往經陰道排出,如在陰道斷端見出血點,則可經陰道鉗夾出血點,結紮或縫扎止血。若出血點位置較高或位於盆腔或腹腔內,則應立刻剖腹探查,尋找出血點,結紮或縫扎之。如在手術後數天才發生出血,則多由於繼發感染所引起,應先控制感染,根據出血的多寡決定是否需經陰道或剖腹止血,若行剖腹止血則需放置引流,手術後積極控制感染。
18.1.6.2 ②泌尿道併發症
A.膀胱併發症:瘻管形成:如果患者手術前未接受過放療,因膀胱缺血,形成膀胱陰道瘻者並不常見。爲預防膀胱陰道瘻的形成,可將膀胱反折腹膜縫於切除的陰道殘端前壁邊緣,以保護膀胱及輸尿管末端不致因繼發感染而導致瘻管形成。這個方法將有效地降低膀胱陰道瘻及輸尿管陰道瘻的發生。
神經性膀胱功能障礙:子宮廣泛術時遊離輸尿管,會將膀胱及輸尿管上段的神經部分去除,或將進、出膀胱及尿道的副交感及交感神經隨宮旁組織主韌帶及盆腔淋巴結一併切除,所以患者可有不同程度的膀胱功能障礙,其發生率可高達50%。組織分離愈多,影響膀胱功能的程度愈大。
Mundy及Sasaki提出主韌帶的後部神經部分含有主要的供應膀胱及尿道的副交感和交感神經,如將其切除則可導致手術後膀胱功能障礙。若僅將主韌帶的前部(血管部分)切除而保留後部,則可以減少術後膀胱功能障礙。Asmussen等建議手術時保留膀胱及尿道的神經供應,並不影響必要的廣泛分離以及切除中心病竈周圍的組織,因此使很多患者不致喪失尿道及膀胱功能。但Asmussen等的建議很多婦科醫師不能接受,因爲在同一個主韌帶上也有引流宮頸的淋巴管,要做到完全中心性分離,這些組織都必須切除,因此他們認爲有些神經性膀胱功能障礙是不可能避免的,尤其在較晚期的患者,需要切除足夠的中心性病竈並要完全地清掃淋巴結是很重要的。
研究證明病變開始時患者膀胱張力過強、膀胱容量減少,靜止壓增加,殘餘尿量增加。患者開始主訴排尿困難,隨後對膀胱充盈的感覺降低。應用敏感的尿動力測定儀可以測出各種不同的異常包括阻塞性排空型、即時及遲發的順應性喪失、感覺喪失及真性張力性尿失禁等。有些患者在排尿時,膀胱收縮功能完全喪失。手術後加以放療的患者,較單純手術者多見神經性膀胱功能障礙。
處理手術後膀胱的方法雖有不同,但爭議也很多。適當的處理是在術後前數週要避免膀胱過度膨脹,一般可持續留置導尿管7~10天,經尿道或恥骨上放置。手術範圍較小留置導尿管的時間短些,手術範圍很廣的留置時間長些,以後間歇鉗夾及放鬆導尿管即膀胱體操數天,手術後第10天最好作1次靜脈腎盂造影,如果僅有輕度輸尿管擴張,則可以去導尿管,試令患者自然排尿,並告之患者不要讓膀胱過度膨脹。如果膀胱過度膨脹可能使逼尿肌伸展及喪失代償功能,導致膀胱弛緩,將延長膀胱功能障礙,剩餘尿增多易致膀胱感染。故應令患者定時排尿,在必要時學會排尿後自己導尿測剩餘尿。當膀胱感覺恢復、剩餘尿<50ml時,即可不再導尿,但必須注意有無膀胱不完全排空。如果患者不能和不願刻苦鍛鍊,最好再較長期(數週)地放置導尿管。如果再發生膀胱過度膨脹,則必須再延長放置導尿管的時間,有時需放置數週,以期避免膀胱功能永久受損。膀胱功能障礙時常會合並尿路感染,應該定期檢查尿液及尿培養,並給適當的抗生素,同時應鼓勵患者每天排尿量超過2000ml,以預防感染。
在有些病例,排尿功能的恢復需要數月,尿動力測定可有少許或持續存在的慢性膀胱功能障礙的證據,Fraser提出20%的患者在手術後會有膀胱感覺的變化,持續存在達5~15年。也有少數病例其膀胱不能完全恢復正常。然而大多數病例在手術後小心護理膀胱,使其復原需要1年的時間。
B.輸尿管併發症:輸尿管損傷是最嚴重的併發症,遊離輸尿管時易損傷其管壁或影響其局部血運,加之術後繼發感染、排尿不暢等,可使輸尿管局部損傷處或因血供障礙發生壞死、脫落,而形成輸尿管陰道瘻、膀胱陰道瘻、腹膜外滲尿等。以往文獻報道,手術後泌尿道瘻的發生率高達10%。爲了預防泌尿道瘻的發生,手術操作有了不斷改進。Mattingly將子宮膀胱腹膜反折縫於陰道斷端前壁,延長留置保留導尿管的時間爲4~6周,使膀胱及輸尿管末端得到充分休息,術後給予抗生素預防感染。Novak將輸尿管的遊離段置於盆腔腹膜面,並以側腸繫膜覆蓋之。Lash用大網膜覆蓋輸尿管上的可疑損傷部位。上述改進的技術措施可能降低輸尿管瘻的發生率,但最重要的問題是手術細緻,儘量避免了損傷、手術後預防感染、避免排尿不暢等。近年來我國子宮廣泛切除術後泌尿道瘻的發生率已日趨下降,達1%以下。
在正常未經放療的輸尿管,其瘻管及永久性狹窄的發生率可在1%以下。如果由有經驗的醫師進行手術,技術精湛地預防圍輸尿管鞘膜的損傷及輸尿管肌層的損傷,並在手術後持續吸引腹腔後間隙的液體,則可以減少輸尿管瘻的發生。
子宮廣泛切除術後引起暫時性輸尿管功能改變幾乎是不可避免的,利用靜止的熒光靜脈腎盂電影照相術(cinefluoroscopic intravenots pyelogram technique)檢測,發現87%的患者在手術後第1周有輸尿管擴張,手術後6周輸尿管擴張逐漸恢復,靜脈腎盂造影恢復正常。在手術第1周可見輸尿管末端的蠕動有所改變,表現爲僵硬的管道,一個月後輸尿管蠕動恢復正常。這些變化可以解釋子宮廣泛切除術後泌尿道感染會增加。如果患者加用放療,再加上嚴重感染或淋巴囊腫的形成,有可能導致永久性輸尿管梗阻。
18.1.6.3 ③盆腔淋巴囊腫
盆腔淋巴結清掃術後腹膜後留有無效腔,迴流的淋巴液滯留在腹膜後形成囊腫,即稱盆腔淋巴囊腫。在完全徹底的淋巴結清掃術後後腹膜間隙內有液體積聚,這些液體的組成成分與Ⅲ度燒傷表面的滲出液相同,內含血液、淋巴液及組織液,其中含有高濃度的蛋白。在子宮廣泛切除術後,需在後腹膜間隙放置引流管抽吸液體,目的是清除積聚的大量液體。手術後放置的引流管應用滅菌生理鹽水沖洗,以保持通暢。吸出的液體量各人不同,可能每天數十毫升,持續1周後逐漸減少,有時吸出的液體量可達數百毫升。
較長一段時間吸引後腹膜間隙的液體,可能是降低輸尿管陰道瘻發生率的合理措施。這樣使已遊離的下段輸尿管不經常浸泡在液體內,可能會較快癒合。但是,利用引流來減少淋巴囊腫的形成僅佔5%以下,應該手術中行淋巴結清掃時,仔細結紮髂總淋巴近端和深腹股溝淋巴遠端的淋巴管和閉孔(髂內、外血管分叉處)近端、遠端的淋巴管,可以很好地預防術後淋巴囊腫的發生。
有時在子宮廣泛切除術及盆腔淋巴結清掃數月後,淋巴囊腫的症狀、體徵才明顯出現。淋巴囊腫可能小而無症狀。當淋巴囊腫較大時,患者主訴下腹不適位於囊腫的同側,放射至同側背部、臀部和(或)腿部,同側下肢可能有些水腫。靜脈腎盂造影時可能看到輸尿管梗阻的證據。
小的無症狀淋巴囊腫不致引起輸尿管梗阻,可以隨訪觀察。大的有症狀淋巴囊腫可能導致輸尿管梗阻,應經陰道或腹部用針進行穿刺。有條件者可在B超引導下局麻下進行穿刺抽液,抽出的液體應做細胞學檢查。一般不需切開引流。
18.1.6.4 ④感染
隨着抗生素的迅速發展,在廣泛切除手術前或術時及術後給以足夠的廣譜抗生素,作爲預防及治療用,手術後患者發生嚴重感染或嚴重盆腔結締組織炎者已明顯減少,再加上手術部位的足夠引流,故根治術後感染一般都能迅速控制。子宮廣泛切除術後應用廣譜抗生素預防和治療感染手術後盆腔結締組織炎的發生率已明顯降低,約在5%以下。如果使用預防性抗生素後仍發生繼發感染,應作陰道頂及腹腔吸引管內液體等的培養,如發現有病原菌,則應根據藥物敏感試驗選用抗生素。
18.1.6.5 ⑤靜脈血栓及肺栓塞
行子宮廣泛切除術的患者可能發生下肢靜脈血栓,其發生的原因有:
B.靜脈壁受損。
C.靜脈血淤積。
同時行盆腔淋巴結清掃術的患者,特別是在鬆動血管並摘除粘連的淋巴結和組織時,根治手術的生物學效應之一是在癒合過程中發現局部組織有壞死,於是組織促凝血酶原激酶釋入血循環,組織促凝血酶原激酶可以加速血凝機制,有助於靜脈血栓的形成。靜脈壁內膜釋放的促凝血酶原激酶是形成纖維蛋白極好的病竈,特別是某些部位的靜脈血流改變以致停滯。這種情況常見於下肢靜脈瓣後面,形成靜止的靜脈血栓。在時間過長的手術時下肢長期固定,手術中靜脈血淤積容易形成血栓。現在已有足夠的證據證實患者發生手術後下肢靜脈血栓,約有50%以上的病例在手術過程中有上述併發症。減少血栓形成併發症的方法是給預防性低劑量肝素,但是圍術期使用肝素有增加手術中出血的趨向,並發生手術後出血,所以有些學者認爲不應圍手術時給肝素治療,而是在手術後回病室後提早下牀活動,定時、間斷壓迫患者的下肢,有良好效果。
近來應用125I標記掃描檢測纖維蛋白原,發現3%~5%的患者下肢隱性靜脈血栓可能發生肺栓塞。這類併發症雖很少見,但血栓栓塞的兇險結果在這種高危病例必須認真估價。
18.2 放射治療
18.2.1 (1)適應證和禁忌證
適應證比較廣泛,各期宮頸浸潤癌均可放療,在某些情況下的原位癌和早期浸潤癌,如高齡及不適宜手術者亦可放療。以下情況被認爲放療禁忌:
①骨髓抑制:周圍血白細胞總數<3×109/L,血小板<70×109/L。
③急性或亞急性盆腔炎時,不應行腔內放療。
18.2.2 (2)治療前、中及後的常規處理
①開始治療之前,應進行詳細的病史詢問,仔細地全身檢查,盆腔檢查應繪圖表示,化驗檢查應包括肝腎功能、外周血象、大小便常規、膀胱鏡、腎圖及腎盂造影、陰道分泌物培養、心電圖等,有的患者尚需作B超、CT或MRI檢查,放療前必須有病理證實。
②治療中的處理:應每天或隔天行陰道沖洗,陰道有致病菌感染者應予抗生素治療,有合併症者應在療程中同時處理。療程中及結束前應有盆腔檢查及全身檢查記錄。
③治療後的處理:療程結束後,每天應自行陰道沖洗,清潔局部,防止陰道粘連及狹窄。放療後應定期隨診,首次隨診應於療程結束後1個月內,以後視情況可3個月1次,第2年可3~6個月隨診1次,3年後可半年1次,5年後可1年1次。
18.2.3 (3)宮頸癌放療中的個別對待原則
宮頸癌原發竈及宮旁浸潤情況不同,如局部有菜花、結節、潰瘍空洞,宮旁有不同程度的雙側浸潤或一側浸潤,盆腔可合併炎症及腫塊,病理類型及放療敏感度亦有差異,個體情況如陰道彈性、子宮大小及位置亦可不同,故應在放療中個別對待。
18.2.3.1 ①原位癌
一般行子宮切除。對於年紀較輕欲再生產者可考慮子宮頸圓錐切除,激光或冷凍治療。對於因身體狀況不宜或不願手術者,用單一的體腔內放射治療即可。
18.2.3.2 ②Ⅰa期
通常手術以子宮切除或修正式子宮根除手術切除(modified- radical hysterectomy)。若以體腔內放射治療,可分1或2次置放,於A點(子宮頸管中央往上2cm,再往外2cm)相當於側面陰道穹隆上面2cm,代表子宮頸處的子宮旁組織(cervical parametrium)達56~70Gy劑量。因骨盆腔淋巴轉移率低,通常不必給予骨盆腔照射,但Ⅰa2建議給予骨盆腔照射。
18.2.3.3 ③Ⅰb期及Ⅱa期
這兩期治療上的選擇一直有爭議,亦常因病人的身體狀況及病竈特性而有差別。腫瘤控制率及存活率,在傳統治療大部分的報告,不論是腺癌或扁平上皮細胞癌療效亦類似。較巨大的子宮頸腫瘤(bulky or barrel-shaped),其骨盆腔中間位置的復發,骨盆腔、腹主動脈旁淋巴結轉移及遠處器官的擴散比率較高。因體腔內放射治療劑量還不足以涵蓋全部腫瘤,故需施以較高劑量的體外照射,使其能儘量縮小到更適合體內放療高劑量能涵蓋的程度。此外,行腹膜外(extrafacial)子宮切除或建議合併兩者、組織插种放射治療,亦都可考慮以增加高劑量涵蓋的腫瘤體積。
Keys報道,對於巨大病竈≥4cm的183位Ⅰb病人並用含cisplatin的放射治療;另一組186位單以放療(兩組皆含體腔內放療,劑量與方法一樣),兩組亦都接受子宮切除。研究顯示,無痛存活期及整體存活期在接受同步放療、化療者皆顯著較高,雖然血液與腸胃系統方面第3,4級的副作用增加,但病人的耐受性仍佳,治療天數並未延長。
18.2.3.4 ④Ⅱb、Ⅲ及Ⅳa期
以往病人以單獨放療爲主,體外骨盆腔照射與體腔內放射治療依不同期別、不同醫院或醫師的經驗、觀點,此兩種療法的劑量搭配、視照野安排、病竈位置、大小略有差異。其原則乃是令腫瘤達到較高的劑量,而正常組織不超過耐受量,以達最理想的局部控制率及最低的併發症。當陰道下1/3有病竈延伸時,治療技術上較具挑戰性。Ⅱb病竈快速延伸至骨盆腔壁或已是Ⅲb病竈,追加組織插種應是一種可提高療效的方法。國內早年在放射源以手操作的時代,因輻射暴露的顧慮,此類治療鮮少發展。近10餘年遙控後荷式近距治療機漸普遍,但因爲是高劑量率,其不同生物效應可能增加併發症,亦令醫師有所顧慮,故經由會陰以模型板(templateimplant)插種,有待各院更進一步的發展,讓這類病人的局部治療率再進一步提升。新近綜合化療和放療,對晚期以及復發病人也有不錯的報道。
Kao等的433位Ⅱb的放療結果,病人的10年追蹤分析,骨盆腔復發或有遠端轉移的病人爲26%;但病人的無病期(disease-free-interval)可達72%。
Kapp等的62位Ⅱb的放療結果,5年無病期、盆腔控制率以及無遠端轉移的病人,分別是61%、65%和78%。3位病人有較嚴重的合併症:2位腎水腫,1位膀胱-陰道瘻管。
Whitney等人報告368位Ⅱb、Ⅲ及Ⅳa期腹主動脈旁淋巴結陰性子宮頸癌病人的隨機性分組比較,研究顯示177位接受加cisplatin及氟尿嘧啶(5-Fu)的同步放射化學治療,無病存活期及整體存活期於接受含cisplatin及氟尿嘧啶(5-Fu)的同步放射治療這一組在統計學上呈有意義的增加,此研究顯示對局部巨大子宮頸癌,合併cisplatin及氟尿嘧啶(5-Fu) 同步放射化學治療優於hydroxyurea。
Morris等人報告403位Ⅱb~Ⅳa(含少部分病竈超過5cm的Ⅰb、Ⅱa病人)隨機分組研究,兩組各有193位病人可分析比較。一組於骨盆腔及腹主動脈旁淋巴結皆照射45Gy,另一組僅骨盆腔照射45Gy,但第1~5天及第22~26天同步各給予5天的cisplatin及氟尿嘧啶(5-Fu)滴注。接受同步放療化學治療這一組,5年存活期爲67%。僅接受放療這一組爲40%,且其遠端轉移及局部復發亦顯著較高。這也顯示同步放射化學治療可增加骨盆腔病竈的控制,因而可減少局部復發,及後續因局部復發再轉移至腹主動脈旁淋巴結及遠端轉移的比例。腹主動脈旁淋巴結照射除增加副作用外,也不如同步化療提升放療對骨盆腔的效益。
Rose等人報告,Ⅱb、Ⅲ、Ⅳa等無腹主動脈旁淋巴腫大的病人526位。放射治療分別隨機分三組同步並用:
A.每週使用順鉑(cisplatin)。
B.順鉑(cisplatin)+氟尿嘧啶(5-Fu)+羥基脲(hydroxyurea)共兩週期。
C.單加用羥基脲(hydroxyurea)每週2次。
研究顯示同步使用含順鉑(cisplatin)放化療的兩組病人,其26個月無病存活期分別爲67%及64%,較並用羥基脲(hydroxyurea)組的47%顯著爲高。且此兩組的毒性較小,此研究亦顯示以往認爲尚具有潛力的羥基脲(hydroxyurea),可不需再考慮放療與此藥並用於子宮頸癌的治療研究。
Kim報告10位局部腫瘤巨大的Ⅱa、Ⅲb期病人同步並用以順鉑(cisplatin)爲主軸的放化療,骨盆腔照射45Gy,另9位單以放射治療。兩組皆以電腦斷層攝影,評估其骨盆腔照射前及體腔內放療前子宮頸病竈大小的變化。前者腫瘤外觀消失,達55%,後者達38%。此報告亦顯示,合併以順鉑(cisplatin)爲主軸的同步放化療可達到較佳的腫瘤消退率,提供後續體腔內放射治療較佳的劑量分佈,因而可以反映出較佳的局部控制率及存活期。
Lin報告42位Ⅱb~Ⅳa期病人,21位同步合併PEB化療共2~3週期,另21位則以PEBF化療5~6週期。41位(97.6%)達到腫瘤完全消退(中值追蹤期爲30個月),兩年存活期及無病竈存活期分別爲97.6%及92.9%。雖然合併症亦較高,但尚在合理可接受的毒性副作用範圍內,但顯示同步放化療可達較佳的局部控制,可能因而提升存活期。
目前的研究顯示,只有同步並用放化療才能提升存活期。輔助性化療(adjuvant therapy)則無此效果。資料亦尚未能斷言哪一種或哪幾種藥物及處理方案與放療並用爲治療子宮頸癌最適當的治療方法。目前,以順鉑(cisplatin)爲主軸的化療,尤其是以每週注射,應是放射治療與化學治療並用的主要考慮。
18.2.3.5 ⑤Ⅳb期
目前對Ⅳb期患者尚無標準化療,局部病竈以緩解性治療爲主,但依不同病人亦可考慮局部根治性治療。這類病人適宜進入臨牀研究方案,放療可用於中間病竈及遠端轉移。
Fletcher的報道綜合Ⅰ~Ⅳ期(1972),雖然年代久了點,但仍是經常被引用的數據。報道中2000位子宮頸癌在美國德州安德森醫院(MD Anderson Hospital)接受放療後,5年的存活率:Ⅰ是91.5%;Ⅱa,83.5%;Ⅱb,66.5%;Ⅲa,45.0%;Ⅲb,36.0%;Ⅳ,14.0%。
中國醫學科學院腫瘤醫院(1978)有8056例的報導,5年存活率,在Ⅰ是93.4%;Ⅱ,82.7%;Ⅲ,63.6%;Ⅳ26.6%。
18.2.3.6 ⑥其他
A.0期及Ⅰa期單純腔內放療即可。
B.宮頸巨大外生型腫瘤可先予消除劑量(可採用陰道或組織間放療消除),消除量一般穹隆部10~20Gy。
C.陰道浸潤多、陰道狹窄、宮旁浸潤嚴重者可考慮增加全盆照射劑量,相應減少腔內劑量。
H.合併卵巢腫瘤、炎性包塊、有手術指徵者應行手術予以切除,但術前應先予以部分腔內治療,以免因手術延誤宮頸癌的治療。
I.合併早、中期妊娠者應及時終止妊娠。<12周妊娠可於放療過程中自然流產,>12周則考慮剖宮取胎。
臺北榮民總醫院的治療與結果:臺北榮總癌病中心登記資料自1970年鍵入電腦檔案,至1995年底可分析的各期別子宮頸癌病例共有5134例。因部分病人資料久遠及通訊地址變化,不易再追蹤,故以下存活狀況仍依癌症登記的統計資料爲準。此外,有部分病人可能因其死亡並非由於子宮頸癌,也未列入(表6)。


原位癌方面,共有1501位接受手術,五年存活期是98%。其中有2位手術後追加放療,則爲100%。另13位只接受放療爲90%,國內與國外的報告相當。
Ⅰa期以上的病人,手術治療310位,五年存活期94%;放療30位,手術加放療41位。其五年存活期分別爲82%及61%,預後較手術差,可能與病人的年齡及內科狀況有關。
Ⅰb期病人,手術治療883位,放療77位。五年存活期分別爲90%及73%,手術似較佳。但另113位接受手術加放療、81位手術加化療,分別爲64%及65%。顯示此2組雖接受手術,但因病人仍具有其他影響的參數,例如骨盆腔淋巴結轉移、手術切緣不足、血管或淋巴管已有癌細胞浸潤,導致局部復發及遠端轉移增加,故術後輔助放療、化療5年整體的存活率仍較單以手術爲低,可能與病人的結構有關。77位單以放療的五年存活期爲73%,較文獻報告爲低,亦可能與病人的年齡、內科狀況有關,但比上述手術加放(化)療要好,似乎病人的結構亦是一個影響療效的因素。
Ⅱa期病人,手術治療432位,其五年存活率爲85%。放療149位,五年存活率爲62%。手術合併放療的126位病人,爲54%。似乎同爲Ⅱa期病人,其不同疾病的相關參數對手術及存活結果亦有很大差別。
國內早期(Ⅰa、Ⅰb、Ⅱa)含原位癌的5年存活期,手術及放射治療成果與國外的報告相當,但5年存活期放射治療的成果略差,可能與病人的年齡及內科狀況有關。本院癌症資料室的統計顯示,早期病例接受手術的比例較高於國外及國內其他醫院的報告。
Ⅱb的治療因臨牀骨盆腔觸診對輕微子宮頸旁組織有時不易診斷,經手術診斷爲Ⅱb期的119位病人,其五年存活率爲69%。另106位因評估有其他影響局部控制及存活因素、接受輔助性術後放療及53位術後化療的病人,其五年存活率分別爲53%及33%,顯示極輕度Ⅱb病人子宮根除仍可達不錯的治療結果。單以放療的251位病人,3年存活率爲56%,5年存活率爲45%,除需分析其各類治療參數影響療效外,病人組成構造與接受手術組織的差異,亦可能是療效較差的因素之一。
Ⅲa期病竈已延伸至陰道下段,手術組病人的總數雖不多,但13位僅以手術的患者,5年存活率爲61%,另16位追加輔助性術後放療的5年存活率爲53%。71位僅以放療的患者3年存活率爲42%,五年存活率爲26%。除病竈較大、病人身體狀況外,國內外放療設備因受限於早年放射源活性長度及置放器的設計,對於處延伸至陰道下段的病竈,較不易給予足夠的近距放射治療劑量,亦可能是存活率未能突破的原因。
Ⅲb期的治療以放射治療爲主,臨牀上Ⅲb與Ⅳa很難區別,手術後5年存活率是31.9%(15/47)。126位接受放療及31位放療加化療的患者,3年及5年存活率在50%及40%左右。現在三維適形放射治療的應用及與化療配合逐漸普遍,預計未來的療效應會再進步。
Ⅳa期的3,5年存活率單以放療的47位病人爲26%及16%。放療加化療的10位病人分別爲40%及30%。手術的17位病人分別爲45%及26%。手術加放療的15位病人分別爲33%及25%。
Ⅳb期病人單以放療或化療加手術,皆無5年存活率,3年存活率分別爲21%及25%。
綜觀國內自1970年至1995年的治療經驗,單以癌症登記的統計資料顯示早期的病竈,在未細分各類病竈大小、病理因素及病人年齡、內科狀況,放療5年存活率略低於手術。同期別相同影響參數的比較,宜再做進一步分析。對於局部病竈較大的Ⅰb、Ⅱb、Ⅲb及具各類局部控制及易轉移因素的病竈,宜合併化療。相信在診斷與治療的設備、軟硬件皆有長足進步的時代,子宮頸癌放射治療必可再進一步提升治療效益。
18.2.4 (4)治療方案
由於國內目前對宮頸癌的腔內放療均採用後裝放療,多爲高劑量率,部分爲中劑量率。
18.2.4.1 ①高劑量率腔內後裝治療+全盆照射+盆腔四野照射
先作全盆照射,全盆照射完成後開始腔內後裝放療,並可與盆腔四野照射同時進行(後裝當天不行體外照射)。
A.全盆照射:每週5次,每次Dm 2~2.5Gy,宮旁總劑量25~30Gy。
B.腔內後裝:每週1次,宮腔與陰道治療可同時或分別進行,每次A點劑量5~7Gy,總劑量36~42Gy。
C.盆腔四野照射:每週4次,每次Dm 2~2.5Gy,宮旁總劑量15~20Gy。
本方案若增加全盆照射劑量,則應相應減少腔內照射劑量,若體外照射均以全盆照射方式進行,則體外照射完成2周後再進行腔內放療;若以盆腔四野照射與腔內後裝放療配合進行,則體外給予宮旁劑量45Gy,腔內給予A點劑量45~50Gy。
18.2.4.2 ②中劑量率腔內後裝放療+全盆照射+盆腔四野垂直照射
先予全盆照射,全盆照射完成後再行腔內後裝治療。
A.全盆照射:每週5次,每次Dm 2~2.5Gy,宮旁總劑量25~30Gy。
B.腔內後裝:每週1次,每次A點劑量6~7Gy,宮腔與陰道治療可同時或分別進行,A點總劑量42~49Gy。
C.盆腔四野照射:每週4次,每次Dm 2~2.5Gy,宮旁總劑量15~20Gy。
若體外照射以盆腔四野照射與腔內後裝配合治療,則體外給予宮旁45Gy,腔內A點劑量45~50Gy。
18.2.5 (5)宮頸癌放療中的幾個具體問題
18.2.5.1 ①單純子宮切除後診斷爲子宮頸癌的放射治療
病人因其他婦科疾病或因手術前的相關檢查不足,未診斷出子宮頸癌而僅做了單純子宮切除手術,而陰道旁、子宮頸旁軟組織及部分陰道未切除,故此手術範圍不足。若病竈爲Ⅰb或Ⅱa期,手術後骨盆腔照射;殘餘陰道上端體腔內近距放療,很有必要。
若病竈僅爲深層顯微性侵犯(microscopic invasion),則可僅予50Gy,5~6周骨盆腔分次照射。若病竈爲肉眼可見,骨盆腔照射需要更高的劑量。當可能殘餘的陰道頂端有顯微性病竈,陰道腔內放射治療特別針對陰道上段黏膜及黏膜下表淺的範圍,使用高劑量率的近距治療機,通常給予黏膜表面下0.5cm處每次5~7Gy,共3~4次,病人僅需門診處理(或傳統低劑量率治療殘餘陰道上段黏膜,60Gy),簡單、方便、迅速。
放射治療與化學療法並用,尤其同步使用2種療法有加成作用。化療藥物可增加放射線敏感度,對於Ⅱb至Ⅳa期病人提升局部控制率與存活期,已奠定其作用。目前每週並用藥物如順鉑(cisplatin)的化學放射同步療法,已漸成爲局部廣泛性或晚期子宮頸癌常用的治療模式。
18.2.5.2 ②子宮廣泛術後的手術後放療
對於具較高複發率預後因子的病人,如骨盆腔淋巴結爲陽性、組織切像爲陽性或非常靠近癌細胞、深度間質侵犯(stromal invasion)、原發病竈大,或是血管/淋巴管有癌細胞侵入,皆較易產生復發。骨盆腔照射50Gy或合併體腔內放療以增加對殘餘陰道的照射,爲目前常用的治療方法,可顯著提高局部控制率,且對適當的選擇性病人羣,可提升存活期。
並用以順鉑(cisplatin)爲主軸,有無並用氟尿嘧啶(5-Fu)的同步放化療,比單以骨盆放射治療可以改善具高危險因子Ⅰa2、Ⅰb、Ⅱa期子宮廣泛手術患者的無病存活期及整體存活期。Peters等人報告,127位具高危險因子的Ⅰa2、Ⅰb、Ⅱa病人,並用以順鉑(cisplatin)爲主軸的同步放射化學治療與116位單以放射治療,四年無病存活期分別爲81%及63%(P=0.003),整體存活期分別爲81%及71%。Ⅲ及Ⅳ級的血液學及腸胃方面的副作用,在同步放射化學療法這一組也較高。
若已見有腹主動脈旁淋巴結轉移或骨盆腔較高位淋巴結也受侵犯,則與腹主動脈旁淋巴結一併照射40~50Gy,可減少局部複發率。對於腹主動脈旁淋巴結有顯微轉移的Ⅰb、Ⅱa、Ⅱb患者,此照射似可延長存活期,但亦增加了併發症,尤其是已有多次腹腔手術或經腹膜淋巴取樣者,更需慎重評估。
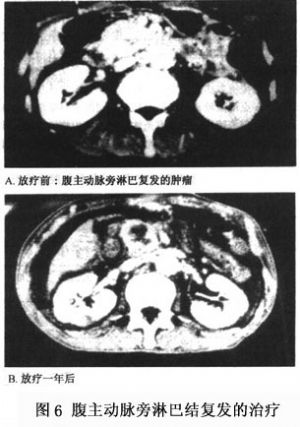
18.2.5.3 ③腹主動脈旁淋巴結復發的放療
在手術或放射治療後,骨盆腔淋巴結轉移已獲控制,因爲腹主動脈旁淋巴結轉移(paraaortic nodes recurrence)大都直接侵蝕到脊椎體尤其是腰椎,造成疼痛,或因上腹部壓迫造成阻塞性黃疸的病人,遠端轉移及未來全身性轉移的比例會增加。但因子宮頸癌即使是晚期仍有相當長的存活期,適當的局部放射治療可減輕病人的症狀,有助於生活品質的提升(圖6)。
18.2.5.4 ④再次放射治療
復發或在放射治療範圍內,再診斷有新原發病竈的處理非常困難。位於骨盆腔中間部位且病竈小,手術加放療效可達到治療目的,但併發症高。再次放療(reirradiation)雖於治療期間的耐受性較手術治療爲佳,但嚴重的晚期後遺症仍需考慮。插種治療對位於中央部位的較小復發病竈爲一可行的放療方式。目前已普遍發展的三維適形放射治療,對於較小較深的復發病竈亦將會有助益。
18.2.5.5 ⑤其他
A.消除量:對一些外生型或大宮頸型腫瘤一般先給予消除量,使宮頸腫瘤縮小,宮頸恢復至正常大小,一般消除量爲穹隆部10~20Gy,分2次給予,但腫瘤消除需要時間,一般上述消除劑量不計算到A點劑量之內,但消除劑量大時尚需考慮A點劑量及膀胱、直腸受量的影響。
B.陰道劑量:在傳統的腔內治療中,宮腔與陰道給予A點劑量比約爲2∶1,在中、高劑量率的後裝治療中,若按此比率,則膀胱、直腸併發症較高,降低陰道A點給予劑量是減少併發症的關鍵,在具體實施過程中以個別單位條件及經驗加以考慮。在中國醫學科學院腫瘤醫院的S-系列標準程序中,陰道是按照消除量考慮,按宮腔深度選擇應採用的梨型劑量分佈的標準程序,並需調整宮體部受量。
C.宮腔、陰道腔內放療分別進行:有的單位採用此方式治療,主要原因是減少單次治療時直腸、膀胱受量及保證宮腔、陰道放射源較合理的位置。標準放射源的位置爲陰道源與宮腔源垂直,宮腔源位於子宮中軸,包括宮腔源的冠狀面通過陰道源的中點。在宮腔及陰道同時進行時此位置難以保證,定位誤差亦大。
D.不同劑量率的生物效應:按等效應轉換系數的概念進行劑量調整時應考慮此爲參考值,而且只有治療方法完全相似僅劑量率不同時,參照系數纔有意義。當前後裝治療均與傳統方法有所變異,且隨着經驗的累計及方法的改變,A點劑量較初期有所增加,中國醫學科學院腫瘤醫院的一項在該院臨牀劑量率條件下對腺癌生物效應的實驗研究(劑量率在20~60cGy/min)表明,生物效應無明顯差異。
E.體外與腔內放療配合方式:按體外與腔內給予A點劑量的大小,可分爲以體外爲主、腔內爲輔及以腔內爲主、體外爲輔。前者A點劑量2/3來自體外,後者A點劑量2/3來自腔內,目前多系體外和腔內給予A點劑量相近似的方法。
F.腫瘤未控的判斷:這是一個很重要又很困難的問題,臨牀經驗顯得特別重要。應結合治療前病變、治療中腫瘤反應情況、治療結束前檢查及A點劑量及治療方法予以分析,當完成治療計劃時有下述情況應予以重視,即:宮頸萎縮不滿意,陰道及宮頸邊緣部仍有結節、不平;宮頸放療反應不好,宮旁情況未改善;疼痛及陰道排液惡臭及腎梗阻出現或進展。此時,若患者的臨牀情況允許(如直腸、膀胱無症狀,大、小便常規檢查未見特殊),則可以增加一定劑量。
在以往傳統的治療中,腔內與體外配合有先體外後腔內、先腔內後體外及二者同時進行之分。當前宮頸癌的放療中,已無明顯界限加以區別了。
18.2.6 (6)療效
宮頸癌的治療效果取決於病情的早晚和選擇恰當的治療手段。綜合國內外文獻報道,早期宮頸癌手術治療五年存活率爲Ⅰa期98%~100%,Ⅰb期80%~90%,Ⅱa期70%左右。平均五年存活率爲87%~92%,與放射治療的效果基本一致,兩者的五年存活率相當。
婦癌國際年報19期(1985)對比了1976~1978年8804例各期宮頸癌傳統放療和後裝治療的效果。不論總的或各期5年存活率後裝治療均超過傳統治療,總的5年生存率爲54.9%、46.3%,Ⅰ期爲70.9%、68.5%;Ⅱ期爲58.7%、53.5%;Ⅲ期爲41.O%、29.3%;Ⅳ期爲17.1%、9.1%。
表7爲國際年報20期及21期收集的1979~1981年宮頸癌的傳統腔內放療及高、低劑量率腔內後裝放療結果的比較,從1979~1986年治療結果看,各種後裝方法的長期生存率均達到傳統水平,並且治療效果逐漸趨向穩定。
表8顯示國內不同作者報道的5年生存率。
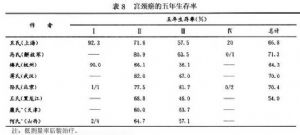
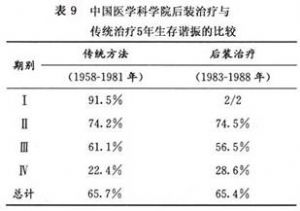
中國醫學科學院腫瘤醫院1983~1984年底第1批後裝治療的5年生存率與1958~1981年傳統方法治療五年生存率的比較,兩者無明顯的統計學差異(表9)。說明腔內後裝治療可以取代傳統的腔內放療,而不降低生存率。
18.2.7 (7)合併症
18.2.7.1 ①治療期間
骨盆腔體外照射時,病人可能有倦怠、胃口減低、噁心、腹瀉、裏急後重(tenesmus)等現象,若上腹亦照射時此症狀較明顯,此類症狀均可以經症狀治療或支持療法改善。
18.2.7.2 ②治療後
放射線腸炎(radiation enteritis)輕重程度不等的症狀,與小腸被照射超過45Gy的體積有關。小腸對脂肪、蛋白質、碳水化合物吸收不好,尤其子宮切除的患者掉落於原子宮部位的小腸體積更多。骨盆腔照射時小腸非治療的目標物,故任何設施或技術能減少小腸被照射的體積,即可減少此副作用。目前以上腹位置鑿空的腹板(belly board)或墊子令病人俯臥治療時,因腹壓及重量關係必要時並脹膀胱,骨盆腔內的小腸流向並下墜於鑿空的上腹部處可達此目的。
18.2.7.3 ③放射線直腸炎
在合併近距治療的合併症中,位於子宮頸靠腹面的直腸較常見。其嚴重度與病人的病竈期別、治療的解剖構造相對於射源置放器的關係位置、置放的技術有關。較輕者爲暫時性。治療可予以類固醇(hydrocorisone)局部灌注,較嚴重者灌注時間較長,症狀可能時好時壞。可考慮作人工肛門(colostomy),令受傷的腸道慢慢恢復,若評估病竈無復發徵象,也可以高壓氧治療,以促進受損組織的恢復。
18.2.7.4 ④放射線膀胱炎
因產生的時間不易預測且發生的頻率不高,故治療後較少見。除傳統副作用較高、較不適用的福爾馬林灌注外,以高壓氧治療爲現在最常使用且有效的方法。
18.2.7.5 ⑤性生活的變化
由於罹患子宮頸癌極可能與性行爲有關,因此許多病人常有不正確的觀念,認爲治療後再恢復性生活會增加復發的機會,甚至會傳染伴侶。其實,子宮頸癌治療後,復發與否和再恢復性生活無關。
總之,宮頸癌的治療方法較爲成熟,不論手術治療或放射治療均達到了較好的治療效果,然而仍有近一半的治療失敗率。如果能進一步總結治療經驗,普及、推廣規範的診治原則,提高治療水平及綜合治療方法,隨着經驗的積累,宮頸浸潤癌的治療效果將有進一步的提高。
18.3 化學治療
過去人們認爲宮頸癌屬於對化學藥物治療相對抗拒的腫瘤,對化學藥物治療宮頸癌基本持否定態度。
在婦科腫瘤治療方面,化療一直只有新輔助性療法和緩解性療法的作用,不像手術有預防、診斷、分期、治療和緩解的作用,放療也有決定性治療(definitive therapy)、輔助性治療和緩解性治療的特性。
在談到子宮頸癌化療的作用時,應該考慮實際臨牀觀察的事實與理論上的限制。臨牀上觀察到,尤其是曾經接受過放療後的骨盆腔復發,對於化學治療反應有限。雖然有少數病例完全緩解一段相當長的時間。一般而言,緩解中位期爲3~7個月。整體來講,很難顯示有意義地增加存活率。對於治療失敗的病例更難以處理,令人印象深刻。因此臨牀醫師都知道,化療只對於少數子宮頸癌病人有益。
至少有3個理由限制了化療用在治療子宮頸癌上:①因爲子宮頸抹片的推廣,大部分早期包括癌前期病變都可以診斷出來,這些都可以用手術或放療治癒,而且治癒的機率很高,很少的病例需要用到全身性抗癌化學療法;②對於曾經接受過放療而發生骨盆腔復發的病患,因爲局部血液循環不佳,加上放療後殘存的癌細胞,往往對化療藥物尤其是alkylating類有抗藥性。此外,放療後大部分造血功能的骨髓細胞因都在骨盆骨的骨髓,造成造血功能受損,相對地影響到化療藥物的劑量,也無法使用理想的治癌劑量;③晚期或複發性子宮頸癌往往會有輸尿管阻塞情形,甚至導致腎衰竭,會影響需經腎臟代謝藥物的選擇。
1976年以來,雖然有上述限制,學者們還是開始嘗試,化療首先用於遠處轉移或複發性子宮頸癌,成功機會雖然很少,但仍有些藥物對這些病人有所反應,建立了遠處轉移或複發性子宮頸癌緩解性化學療法(palliative chemotherapy)。因此引發化療可以和放射治療混合治療的想法。1999年,經過嚴謹的臨牀試驗,更建立了局部晚期子宮頸癌化療放療同步療法(concurrent chemoradiation)的地位。至於局部晚期尤其有巨大腫瘤時,先用新輔助性化療(neoadjuvant chemotherapy),再予手術;實施廣泛性手術後,因存有危險因子而需要輔助性化療(adjuvant chemotherapy)的發展,不論國內和國外都有臨牀試驗在進行中,期望未來幾年內能夠確定這兩種化學治療的作用地位。
因此,化療在治療子宮頸癌的應用上,可分爲下列四種綜合性治療方式:①緩解性化學療法(palliative chemotherapy);②化療放療同步療法(concurrent chemoradiation);③新輔助性化療法(neoadjuvant chemotherapy);④輔助性化療法(adjuvant chemotherapy)。
18.3.1 (1)緩解性化學療法(姑息性化療)
以化療來處理已經擴散、有遠處轉移和複發性子宮頸癌,並沒有很大的改善空間。主要原因爲大部分復發性病人都已經接受過放療,而復發腫瘤附近組織都已纖維化,沒有完整的血管,因此即使實施化學治療,腫瘤組織和血液中都很難達到殺死癌細胞的濃度。其次是大部分子宮頸癌爲鱗狀上皮癌,此種組織形態特性對於大部分化學藥物的反應較不理想。加上這些病人常有輸尿管阻塞、骨髓造血的保留功能受損,也會影響化療的劑量,減少其效果。
近年來由於晚期病例增多,某些經不規範治療帶來的未控、復發、轉移等復雜病例困擾臨牀,使人們對晚期宮頸癌及高危病人的輔助化療進行了廣泛的臨牀探索,作爲手術或放射的輔助治療手段用於原發腫瘤大於4cm直徑的Ⅰb2期病人或非鱗癌(如宮頸腺癌、腺鱗癌、透明細胞癌及小細胞癌)等預後較差的病例的綜合治療。有人主張在術前或放療前先用化療,使腫瘤的體積縮小後再手術或放療,可以提高手術切除率,減少復發及提高生存率,並取得了一定的經驗。雖然宮頸癌的化療主要是用於晚期病例及復發和廣泛轉移病人的治療,但近年來化療在宮頸癌治療中的應用已日趨廣泛。儘管到目前爲止尚無統一、規範的藥物和化療方案,但從治療的情況來看有些藥物和方案是有效的。
目前宮頸癌的化療主要用於以下幾種情況:宮頸癌晚期、全身廣泛轉移的病例;局部巨大腫瘤的術前化療;中、晚期宮頸癌配合放療增敏。
18.3.1.1 ①單一用藥
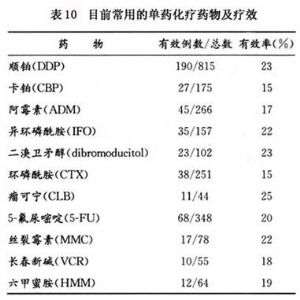
常用的有效藥物有:順鉑、博來黴素、絲裂黴素等。常用於聯合用藥組成不同的化療方案,見表10。
子宮頸癌大部分是鱗狀上皮癌,少部分是腺癌。曾經有超過60種化學藥物嘗試用來治療子宮頸鱗狀上皮癌,其中21種藥物的反應率超過15%。Park指出這兩種細胞對化學藥物治療的反應不同,應該要分開來考慮(表11)。

其中7種藥物順鉑(cisplatin),異環磷酰胺(ifosfamide),二溴衛矛醇(dibromodulcitol),紫杉醇(paclitaxel),長春瑞濱(vinorelbine),託泊替康(topotecan)和依立替康(iriotecan),因反應率較有意義,值得臨牀應用,因此而做簡要的分析。
A.cisplation是目前治療子宮頸癌最廣泛使用的單一試劑,在GOG(Gynecologic Oncology Group)大規模試驗中對於扁平上皮性子宮頸癌客觀性的反應高達23%,較高劑量似乎較有利,24h點滴較沒噁心嘔吐的現象。
B.異環磷酰胺(ifosfamide)的化學結構類似cyelophosphamide,歐洲的經驗高達29%。但GOG的結果較低,只有14%。
C.二溴衛矛醇(dibromodulcitol,mitolactol)是一種鹵化糖類,作用機制很像alkylating類藥物。GOG與墨西哥的研究均顯示較高的反應率,達29%。不幸的是,使用此藥有引起白血病的報告,而使混合順鉑(cisplatin)加二溴衛矛醇(dibromodulcitol)的試驗無疾而終。
D.placlitaxel(taxol),紫杉醇是由西方杉樹皮提煉出來的自然藥物,統稱taxanes。有統一的作用機制,使細胞內微細小管發生不可逆性去聚集化。2級臨牀試驗反應率有17%。此資料可建議紫杉醇(paclitaxel)加上順鉑(cisplatin),值得更進一步的臨牀試驗。
E.長春瑞濱(vinorelbine)是半合成的vinblastine衍生物,與其他vinca alkaloid藥物可能沒有交叉抗藥性的好處。對於晚期或複發性子宮頸癌2級臨牀試驗有18%的反應率,對於新輔助性化學療法2級臨牀試驗有高達45%的反應率。顯示對子宮頸癌的治療可以取代長春瑞濱(vincristine)或長春瑞濱(vinblastine)組合的混合式化學療法。
F. 託泊替康(topotecan)是camptothecin的衍生物,阻止topoisomeraseⅡ的作用而影響到DNA的功能和合成。2級臨牀試驗發現對子宮頸鱗狀上皮癌有效,緩解反應有19%。目前順鉑(cisplatin)加託泊替康(topotecan)對單獨eisplatin 3級臨牀試驗正在進行中。
G.依立替康(irinotecan,CPT-11)也是camptothecin的衍生物,作用在topoisomerase Ⅰ。主要有3篇文獻報告。1992年ASC0年會時,Takeuchi報告2級臨牀試驗緩解率達24%。1997年,Verschraegen對曾放療過的病人做2級臨牀試驗,也有21%的緩解反應率。1998年,GOG、Look的報告,2級臨牀試驗緩解反應率達13%。綜合上述3篇的統計,緩解反應率約20%與topotecan的結果一樣。
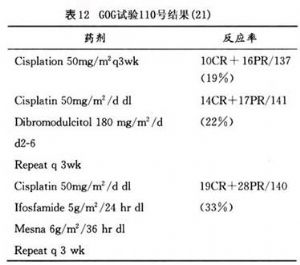
單一化學藥物的使用,往往僅有部分緩解以及有效期較短的缺點。如果希望改進存活率,應該使用聯合化學療法(combined chemotherapy)。1997年GOG試驗110號(表12)證實聯合化學療法優於單一化療法,尤其是含有順鉑(cisplatin)在內的聯合化學療法。至於要加上哪幾種其他藥物,還需要進一步的臨牀試驗。已完成報告的聯合化學治療的結果(表13)可供參考。

非鱗狀上皮性癌主要是子宮頸腺癌,目前發現有5種藥物有中度反應:順鉑(cisplatin),piperazinedine,異環磷酰胺(ifosfamide),gallium nitrate和氟尿嘧啶(5-Fu)(需加leucovorin)。
當前順鉑(DDP)被認爲是治療宮頸癌比較有效的藥物,在臨牀上較廣泛使用。據報道仍限於復發和晚期病例,在復發的病例中最初反應率爲50%(11/22),說明單藥順鉑對宮頸癌有一定的療效。環磷酰胺、多柔比星(阿黴素)、卡鉑等也是治療宮頸癌有效的藥物。最近又有新藥二溴甜醇正在進行臨牀試用,有待總結分析、觀察療效。
18.3.1.2 ②聯合用藥
聯合化療是腫瘤藥物治療的主要部分,很多有效的聯合化療方案大多數是在經驗的基礎上形成的。聯合用藥時應注意以下原則:使用不同作用機制的藥物;聯合的藥物不應有相似的毒性;每一種藥物的劑量應該儘可能和常用的有效劑量相近;單一無效的藥物不要聯合。以下介紹目前較常用的幾組治療宮頸癌的聯合化療方案。
A.BIP方案:
博萊黴素(BLM):15mg溶於葡萄糖鹽水1000ml中靜滴,第1天。
異環磷酰胺(IFO):1g/m2溶於林格液500ml靜滴,第1~5天。
美司鈉(mesna):200mg/m2靜注,第0、4、8h(保護尿路)。
每3周重複1次。
因在試管中發現異環磷酰胺和順鉑有協同作用,Boxton(1989)和Kumar(1991)等分別報告用BIP方案治療晚期復發宮頸癌分別達到總客觀反應率69%(34/49,其中CR10例)和66%(14/21,其中CR4例),說明這組方案是目前治療宮頸鱗癌有效的聯合方案。
B.BOMP方案:
博萊黴素(BLM):30mg靜滴,第1~4天,只用第1、2個療程。
長春新鹼(VCR):0.5mg/m2靜脈衝擊療法,第1,4天。
順鉑(DDP):50mg/m2靜脈(先水化),第1,22天。
每6周重複1次。
Alberts等報告14例,總反應率爲6/14(43%),其中4例達到CR,特別指出的是有1例左盆壁大腫塊完全消退。宮頸浸潤癌放療後盆腔纖維化,供血較差,一旦盆腔復發,很少對化療有效。這一組藥物對復發癌有效,令人鼓舞。
C.PVB方案:
順鉑(DDP):50mg/㎡靜注,第1天(先水化)。
博萊黴素(BLM):20mg/m2靜滴,第1~3天。
每3周重複1次,共3個週期。
1993年,Sardi等對Ib>4cm直徑腫瘤的病人用這組方案作爲輔助化療,取得了較好的效果。
博萊黴素(BLM):5mg靜滴,第1~7天。
因此,對於這類病人,在使用化療之前,首先要回顧病理標本的組織形態,是鱗狀上皮癌或腺癌,並排除可以實施內臟摘除術的可能性。如果爲單一轉移性,可考慮放療。減輕疼痛也是使用化療的適應證。骨盤腔復發引起的疼痛確實相當難解決,需要會診疼痛治療科醫師處理。治療前要評估病人的身體狀況、血液及腎功能,治療時更要注意噁心、嘔吐及其他副作用和生活品質。要了解化療只是暫時緩解性,同時減輕疼痛,延長生命,能夠完全緩解的情形很少,只見於單獨發生肺部轉移的病例。
1981年,GOG首先對34位複發性子宮頸癌病人,在評估無法接受手術和放射治療後,單獨每3周使用順鉑(cisplatin )50mg/m2,靜脈點滴,整個反應率(完全和不完全緩解)達38%。1985年,GOG的Bonomi對子宮頸鱗狀上皮癌的緩解率僅有22%,與順鉑(cisplatin)單獨使用相當。其後GOG又做大規模的臨牀試驗,1989年的報告,其緩解反應率下降僅17%~18%。緩解中位期4個月,存活中位期6個半月。
1993年,Vermorken回顧子宮頸癌的化學治療,並沒有明顯證據指出任何混合性化學治療比單獨使用順鉑(cisplatin)好,其中包括順鉑(cisplatin)加氟尿嘧啶(5-Fu),雖然它們對身體其他部位鱗狀上皮癌的治療效果不錯。
順鉑(cisplatin)是目前最有效的化療藥物,建議的療程和劑量是每3周50~100mg/m2。有些文獻認爲,高於50mg/m2的劑量並沒有好處。一般有效緩解期只有4~6個月,並不令人滿意。1996年,Daly使用每週順鉑(cisplatin) 50mg/m2,共4周,短期高劑量強度整個緩解反應率高達47%,但存活中位期只有32周,而18個月的存活率只有13%。
1997年,GOG試驗110號,是針對單獨使用順鉑(cisplatin)、順鉑(cisplatin)加二溴衛矛醇(dibromodulcitol)及順鉑(cisplatin)加異環磷酰胺(ifosfamide) 3組的隨意取樣臨牀試驗,雖然混合式化療的毒性較大,但其結果認爲順鉑(cisplatin)加上異環磷酰胺(ifosfamide)對於復發或遠處轉移的子宮頸癌緩解反應率較高,病竈無進展的存活期最長,是目前對於遠處轉移或複發性子宮頸鱗狀上皮癌標準的化學治療模式。
目前GOG已經完成兩個臨牀149號和169號3級臨牀試驗,正等待追蹤及分析結果。其中149號是順鉑(cisplatin)加異環磷酰胺(ifosfamide)對順鉑(cisplatin)加異環磷酰胺(ifosfamide)再加博來黴素(bleomycin)。169號順鉑(cisplatin)單獨對順鉑(cisplatin)加紫杉醇(paclitaxel)。另外,加入托泊替康 (topotecan)混合式化學療法也已完成2級臨牀試驗階段(表14)。

18.3.2 (2)化療放療同步療法
化療放療同步療法,是目前對子宮頸癌研究最廣泛的一種綜合性療法。在以往,對於局部性晚期子宮頸癌(Ⅱb~Ⅳa),放療(遠距加近距照射)是標準的治療方式,但是往往因爲腫瘤體積的大小、淋巴轉移與否,影響了治療效果。加以放療後會使腸道、膀胱以及陰道產生很多急性及晚期後遺症,因此有人嘗試同時加上化學治療。理由是化療藥物不僅可以充當加強放射治療的敏感劑,本身化療藥物也有殺死癌細胞的功能。因此有不同的策略來應付Ⅱb~Ⅳa的子宮頸癌,包括:
①放療細分多次照射法(hyperfraction或稱超分割法)。
②利用放射治療加強敏感劑。
③化療放療同步療法。
④新輔助化學治療,加上隨後的放射治療。
放療敏感劑中以羥基脲(hydroxyurea)研究最多。1979年,GOG利用羥基脲(hydroxyurea)作放療敏感劑對安慰劑進行比較,各加上標準的骨盤放射治療方法,治療Ⅲb和Ⅳa病人。發現腫瘤完全緩解、無進展期間和存活率,在使用羥基脲(hydroxyurea)組都比較好。1993年,GOG的Stehman發表另一放療敏感劑misonidazole與羥基脲(hydroxyurea)進行比較,羥基脲(hydroxyurea)的無進展期間和存活率還是比較佳。最近重新回顧1979年GOG的報告,發現有統計上的瑕疵,後來又比較化療放療同步療法有更好的結果。目前已經不建議使用羥基脲(hydroxyurea)來做放療敏感劑的治療方法了。
1984年,Thomas利用mitomycin C和氟尿嘧啶(5-Fu)與放療同步。1988年,Monyak利用順鉑(cisplatin)與放療同步。雖然他們的臨牀試驗沒有隨機取樣的設計,但是他們證實了同步療法是可行的,其緩解反應率和存活率令人印象深刻。
化療放療同步治療比新輔助性化學治療加上放射治療有幾個優點,包括不會延遲子宮頸癌的主要治療方式(放射治療),也不會延長治療的時間,而且兩種療法的互相作用可以阻止癌細胞的修補,讓癌細胞同步化,並進入細胞分裂期,減少了缺氧細胞的比例。其中順鉑(cisplatin)加氟尿嘧啶(5-Fu)的化學藥物組合最吸引人,因爲除化療本身的效果外,它們同時也可以當作放療的敏感劑,如頭、頸部鱗狀上皮癌的治療方式。
1998年,Thomas發表FIGO期別(Ⅰb2/Ⅱa至Ⅳa)使用氟尿嘧啶(5-Fu)與傳統放療同步和一天多次放射治療的臨牀試驗,並無骨盆腫瘤與存活統計上的意義。
臺北榮總癌症中心和婦產部登記資料1970~1996年子宮頸癌共有5134例,其中有64位接受同步療法。在婦產部,有23位晚期子宮頸鱗狀上皮癌病人(8位Ⅱb,11位Ⅲb,4位Ⅳa)接受同步療法。9位病人使用順鉑(cisplatin)加氟尿嘧啶(5-Fu),14位使用PEB(順鉑-依託泊苷-博來黴素)混合式化學藥物,2年總存活率達66.1%,總緩解反應率達95.7%,1年骨盆腔控制率爲71.6%,但是遲發性併發症也高達65.2%。在癌症中心,共有41位病人接受同步療法,其中Ⅲb病人有31位,Ⅳa病人有10位。這兩期病人在接受順鉑(cisplatin)及放療後,3年及5年存活率分別是50%和40%、40%和30%(44)。
1999年,GOG和SWOG (Southwest oncology Group)以及RTOG(Radiation Therapy Oncology(Group)一共發表了5篇同步療法的文章,奠定了這種療法的地位(表15),是沒有主動脈旁淋巴轉移的局部晚期子宮頸癌(Ⅰb2/Ⅱa bulky到Ⅳa)治療的最佳選擇。尤其GOG試驗120號,指出每週使用順鉑(cisplatin )40mg/m2共6周及同步放射治療,其2年無複發率高達70%,雖然比混合式化學藥物組67%在統計上無意義,但其血液、腸胃道毒性減少是有意義的。因此最值得考慮的藥物是每週順鉑(cisplatin )的化學放射同步療法,代替以往習慣使用順鉑(cisplatin )和氟尿嘧啶(5-Fu)的方法,而成爲目前局部性晚期子宮頸癌的最佳治療模式之一。

1978年Miyamoto等報告用此方案治療15例,其中12例(80%)CR,2例PR,總的反應率達93%。後來發現不能重複得到高反應率,這組方案似乎對遠處轉移患者療效較好。曾用此方案治療1例宮頸癌肺轉移患者,用藥5週期後病竈全部消失,說明此方案有效。
近年來由於腫瘤化學治療的進展,許多學者研究綜合治療以提高治療效果。我國自20世紀60年代開始應用動脈插管化療治療中、晚期宮頸癌,有的配合放療,有的配合手術治療,已取得了一些成功的經驗。過去常用單一藥物治療如氮芥、塞替派等,近年來則多選用包括順鉑及平陽黴素在內的聯合化療。動脈插管常用的爲腹壁下動脈、髂內動脈、子宮動脈、閉孔動脈等。一般將導管插至髂內動脈起點下1~2cm或髂總動脈交叉處,後者在灌注化療藥時需暫時阻斷雙下肢血流。這種治療方法既可以使盆腔腫瘤直接接受較高劑量的藥物濃度,還能夠降低化療引起的全身副反應,根據腫瘤的反應情況給1~2個療程。中山醫科大學腫瘤醫院對75例Ⅲb期宮頸癌給以髂內動脈插管化療與放療結合,藥物爲氮芥,總劑量35~40mg,1療程後進行常規腔內放療,結果Ⅲ期患者的10年生存率達62.7%,遠較對照組高(44.3%)。江西省婦產醫院採用腹壁下動脈插管化療,治療Ⅲ期宮頸癌32例,化療1~2個療程後進行放療,藥物爲順鉑(DDP)及平陽黴素(PYM),每次(天)兩種藥物均爲20mg,前5天兩藥同時應用,後5天單用DDP,共10天。
化學治療效果的評定,可分爲病人的主觀感覺及醫師的客觀檢查兩方面。以客觀檢查及生命延長來評定是最可靠的方法。一個適當的評定,必須是曾經在1個月之內接受兩個以上療程的化學治療,而且在次一個月詳細追蹤檢查後的結果。
A.完全緩解(complete remission或response):所有可測量大小的腫瘤病竈全部消失,無症狀,並且維持1個月以上。
B.部分緩解(partial remission或response):所有可測量大小的腫瘤全部小於50%以上,沒有新的腫瘤發生,並且維持1個月以上。
C.改善(improvement):至少有一個腫瘤的病竈縮小25%以上,沒有新的腫瘤發生,並維持1個月以上。
D.穩定(stable disease):腫瘤大小改變不超過25%以上,沒有新的腫瘤發生,並維持1個月以上。
E.惡化(progression):所有可測量大小的腫瘤全部增加在50%以上,或有新的腫瘤出現。
另外有一個臨牀常用的反應率(response rate)是指化學治療後,腫瘤的體積減小到50%以下,並且在其他部位沒有新的腫瘤出現,佔全部治療人數的百分率而言。
18.3.3 (3)新輔助化學療法
對於局部性較嚴重或較巨大的子宮頸癌,新輔助性化學療法一直是很吸引人的。這種新的治療方式理論上會有較好的治療效果,不像復發或遠處轉移的病人接受緩解性化學療法那樣。從開始化學藥物就作用於局部巨大的病竈,沒有前面提到限制化學治療效果的理由。因此對於沒有接受放射治療的病患,若先接受化學治療作爲新輔助性療法,如頭、頸部及食道鱗狀上皮癌的觀察,新輔助性化學治療反應良好,可以使期別降低,更容易手術切除。若體積太大,放射治療沒有把握,應先使用化學治療來萎縮腫瘤組織,再加上放射治療來達到控制。
1987年至1991年,有很多無隨機取樣的2級臨牀試驗有關子宮頸癌新輔助性化學療法的文章發表,因爲各篇文章病例不多且期別混亂,無法對新輔助性化學療法有所結論,但是提供了幾個有意義的觀察,也就是使用含有順鉑(cisplatin)等化學藥物,對於子宮頸癌新輔助性化學療法是可行的。通常是順鉑(cisplatin)-長春新鹼(vincristine)-blefeomycin(POB)三者的組合,每3周1療程,經過3個療程後,腫瘤體積會神奇地減小,不像放射治療後復發的病竈反應那樣差。
1993年,Sardi對子宮頸癌Ⅰb2隨意取樣治療,使用新輔助性化療。控制組(75人)先實施根除性手術,再加上輔助性放射治療。實驗組(76人)先使用POB(每10天1次,3療程)新輔助性化學治療,再加上根除性手術以及術後放射治療,發現存活率及無進展期間在實驗組均有明顯改善,其骨盆腔複發率控制組24.3%,實驗組7.6%,因爲這份報告有化療、手術及放療,其結果反而無法看出新輔助性化學治療的作用。
1991年,Souhami使用新輔助性化學療法加上根除性手術,對單獨放射治療在Ⅰb~Ⅱa治療有意義上的區別,但是1999年,Chang以同樣的期別、同樣的方法卻沒有區別。
有些臨牀醫師如DiSaia建議,在實施新輔助性化學療法後,對於反應良好者實施根除性手術,而對反應不良者實施放射治療。因此還需要更進一步研究這種新輔助性化學療法,對於子宮頸癌局部巨大病竈是否有較好的存活率,或只是證實先有好的反應,但實際並未改善存活率。
目前並無標準的新輔助性化學療法。GOG對於Ⅰb、體積<4cm正進行順鉑順順鉑(cisplatin)新輔助性化學療法加上根除性手術對單獨根除性手術的臨牀試驗。臺北榮總婦產部也正在對Ⅰb2(>3cm)進行每週順鉑(cisplatin )40mg/m2,3療程後第3天實施根除性手術對單獨根除性手術的3級臨牀試驗。我們的經驗,經過化學治療後腫瘤的體積有完全消失的病例。
Tewari曾建議懷孕20~30周合併侵犯性子宮頸癌而母親不願意犧牲胎兒時,亦可考慮新輔助性化學療法,避免疾病的進展,而容許胎兒的成熟。
18.3.4 (4)輔助性化學療法
通常所謂輔助性化學療法,是指子宮頸癌在接受根除性手術(Ⅰa和Ⅱb)或放射治療(較晚期)後,發現有高度轉移的危險因子存在,如已有主動脈旁淋巴,或骨盆腔淋巴多處轉移,或腫瘤體積太大,或癌細胞已經侵入淋巴管及血管,或腫瘤細胞分化不良,希望接着再加上抗癌化學藥物來輔助殺死可能局部尚未撲滅的癌細胞,或已經進入循環系統中但爲數不多的癌細胞,以加強整體治療效果,預防未來發生局部復發或遠處轉移。這種輔助性化學療法的臨牀應用很早就開始,文獻資料也很多,有正面效果的報告,也有統計上無意義的結果,目前仍無法確定其治療地位。
現在我們已經知道化學放射同步療法對較晚期的子宮頸癌(Ⅱb~Ⅳa)已經建立了治療標準模式,所以放射治療後再輔助性化學療法已經不合時代,剩下可以討論的就是根除性手術後是否加以輔助性化學療法了。1992年,Ng等人的報告,對於淋巴轉移高危險預後因子根除手術後的病人,輔助性化學療法(POB)確實可以減少複發率(34%∶65%,P<0.01)。1995年,Ng再報告,淋巴轉移數目與是否用輔助化學療法(POB)對複發率會有所影響:在淋巴轉移數目1~2個時用輔助性化學療法,複發率在統計上有意義(19.3%∶42.0%,P<0.025),但在淋巴數目≥3個時,統計上就無意義了(46%∶66%,P=0.30)。臺北榮總婦產部也曾加入由TattersaU主持的一項亞太地區大型國際臨牀試驗,在期別Ⅰb~Ⅱa根除手術後,證實有淋巴轉移,隨機取樣輔助性化學療法加上放射性治療對單獨使用放射治療,其預後統計是沒有意義的。綜合國內外對於期別(Ⅰb~Ⅱa)實施根除性手術,是否需要輔助性療法,Yuan的建議除淋巴轉移的高危險因素外,有子宮旁組織侵犯、深部基質侵犯、淋巴血管間侵犯及分化不良細胞,可視爲中度危險羣,而無上述危險因素者爲低危險羣。
有學者認爲在腔內放療尚未開展的地區,可採用有效的輔助化療爲根治術創造條件。對32例Ⅱ期宮頸癌及2例復發癌,先進行腹壁下動脈插管化療,其後有24例進行了根治性手術,化療的有效率爲88.2%(30/32)。對Ⅱb期宮頸癌患者術前動脈插管化療進行了10年觀察,5年生存率爲73.7%,10年爲62.5%,而同期單純手術組的5年和10年生存率分別爲38.9%和21.4%。
1992年Itoh報告6例Ⅲb期宮頸癌用髂內動脈給藥絲裂黴素(MMC )10mg/m2、長春新鹼(VCR)1mg/m2及順鉑(DDP)50mg/m2,每3周1次,共用2~3週期,6例病人全部達到PR,其中5例在治療後給予根治性子宮切除。
1992年Kigana等報告21例復發的宮頸癌採用雙側髂內動脈化療,順鉑(DDP) 50mg/m2和博萊黴素(BLM)30mg/m2,總的有效率達71.4%。這種治療方法改善了復發宮頸癌病人的預後。
綜上所述,目前宮頸癌的化療已不僅僅是一種對晚期及復發癌的姑息治療手段,已成爲綜合治療的方法之一,發揮着積極的作用。
子宮頸癌化學治療的發展不像手術及放射治療已超過百年曆史,雖然已經確立了治療上的地位,未來反而沒有太多的發展餘地。化學治療的發展雖然只有20年的臨牀經驗,而且有不確定的治療作用,但是這幾年來經過婦科腫瘤專家的努力,在某些子宮頸癌期別或轉移性復發上都建立了它的治療地位和未來發展的空間,期望化學治療在新藥的發展、化學療程、劑量及順序的設計,混合式化學療法、綜合式治療策略或配合免疫療法與基因治療治療子宮頸癌,增加治療的成果。
18.4 綜合治療
近40年來腫瘤的治療已進入綜合治療的時代,宮頸癌的治療也不例外。所謂綜合治療是指:根據病人的機體狀況、腫瘤的病理類型、播散及浸潤的範圍(臨牀分期)和發展趨向,有計劃、合理地應用現有的治療手段,儘可能地提高治癒率,改善病人的生存質量。由於腫癌各學科的發展、治療技術的長足進步及對腫瘤認識的加深,腫瘤綜合治療已取得了較好的療效。
在臨牀上並不是所有的宮頸癌病例都需要綜合治療,如早期宮頸浸潤癌播散轉移的可能性較小,選擇單一的手術或放射治療就可以達到治癒,沒有必要再加其他的治療方法。對中、晚期病例以往多采用放射治療(腔內放療加體外照射),儘管5年生存率平均在60%~70%,仍有近1/3的病例治療失敗,或復發或未控,需要臨牀尋找多種手段積極治療、提高療效。
現代腫瘤治療仍以手術、放療、化療爲基本手段,而這3種治療手段各有其優、缺點和侷限性。手術治療主要適用於早期局竈性腫瘤;放射治療的適應證廣泛,但也主要用於侷限性腫瘤或局部轉移病例;而化療主要用於病變廣泛不能手術切除或不宜放射治療者。合理地使用各種治療手段和相互配合、取長補短,這是現代腫瘤治療的方向。科學技術不斷髮展,綜合治療已不僅限於以上3種手段的結合,微波熱療、生物治療、激素治療、中醫中藥的使用,使綜合治療的手段可以多樣化。
宮頸癌的治療高度強調個別對待的原則,儘管早期宮頸癌的手術治療取得了很大成績並被普遍採用,但由於就診者中、晚期病例較多,因此絕大多數宮頸癌患者仍需接受放射治療。目前臨牀上晚期病例明顯增多,組織學類型趨向複雜,需要臨牀採取多種手段綜合治療而提高療效。
18.4.1.1 ①綜合治療的理由
除前面提到的部分原因外,綜合國內外學者的臨牀經驗,對宮頸癌進行綜合治療的理由是:
A.有人對用不同放療技術治療後進行手術切除標本檢查發現,宮頸殘存癌的發生率高達30%~50%。
B.盆腔淋巴結轉移率較高,同時有主動脈旁淋巴結轉移,也高達8%~10%。
C.局部腫瘤巨大是不良的預後因素,因爲原發竈體積大,容易侵入肌層。單純放療有時難以控制病情。
18.4.1.2 ②綜合治療的目的
A.縮小腫瘤的體積和範圍,使不能手術切除的病例得以進行手術切除。
C.消除亞臨牀病竈,提高生存率。
A.患者的全身情況、血象、肝、腎功能包括機體免疫狀況,應該能夠耐受治療。
B.要充分衡量每一種治療手段可能給病人帶來的得失,治療中要注意克服不利因素。
C.如果治療手段選擇得當,即使是晚期病例,通過精心、恰當的治療也可以控制病情發展,縮小腫瘤體積,減輕臨牀症狀,改善患者的一般狀況。
D.綜合治療的幾種方式:宮頸浸潤癌目前在臨牀上常用的綜合治療方式可以分爲以下幾種:
a.放射與手術的聯合治療:適用於早期宮頸癌(Ⅰa~Ⅱa)病例。Stallworthy長期從事宮頸癌綜合治療的研究,認爲生存率與腫瘤播散有着直接關係,強調治療應包括全部危險區在內,並在30多年前就提出建議,對Ⅰ~Ⅱ期宮頸癌在全程放療後6~8周行根治性子宮切除,作爲首次治療。20世紀70年代他用這種方法治療139例Ⅰ期宮頸癌無淋巴結轉移者,5年生存率爲82%,31例淋巴結轉移陽性者5年生存率爲62%。
許多學者認爲儘管Ⅰb期宮頸癌不論採用手術或放療5年生存率都比較高,但受某些不良因素的影響可使生存率降低。要想提高治療效果,必須採用綜合治療,克服或減少不良預後因素的影響。
術前放療:
主要用於:局部腫瘤巨大的Ⅰb期宮頸癌;Ⅱa期宮頸癌累及陰道較多;病理在Ⅲ級以上;桶狀形宮頸癌;黏液腺癌、腺鱗癌等。
術前照射多采用腔內後裝治療,放療劑量爲全量照射的1/2~1/3(A點劑量20Gy左右)。術前放療的優點是:縮小腫瘤體積,改善局部情況,糾正全身狀況;降低癌細胞的活性,減少術中播散的機會,有利於腫瘤的完整切除;提高手術切除率,達到綜合治療的目的。
腔內治療後施行手術的時間,要根據放療的方法和照射的劑量決定,一般在2~8周之間。如果術前放療爲低劑量照射,則可在2周左右手術。如果術前放療劑量較高,與手術間隔的時間也要延長。
關於手術方式,大多數學者主張行廣泛性子宮切除及盆腔淋巴結清掃,適用於Ⅱa期以前的病例。
術後放療:綜合多數學者的意見和臨牀經驗,對根治性子宮切除術後病理證實有淋巴結轉移或殘存癌者,應給予補充體外照射或腔內後裝治療,繼續消除殘存病竈,控制病情發展,提高治療效果。
體外放射治療以全盆照射爲基本方式,所設的照射野應將陰道殘端、兩側宮旁、盆腔淋巴區及術後病理提示的殘存病竈等一併包括在內。治療時間根據患者術後的恢復情況在2~4周內進行。照射劑量在40~45Gy(全盆),針對殘存病竈縮野可加量5~10Gy。如果有腹主動脈旁淋巴結轉移可行擴大野照射,對陰道斷端有殘存癌者要給予腔內後裝治療,治療劑量要將術前腔內治療所給的劑量一併考慮。
b.放射與化學藥物聯合治療:curtin等學者報道,宮頸癌早期(Ⅰa~Ⅱa)的治療方法是廣泛子宮切除+雙側盆腔淋巴結清掃術,5年生存率可高達70%~90%。而術後復發的病例,5年生存率不足5%。宮頸癌術後復發的高危因素是:宮頸深部肌層浸潤;腫瘤體積大於4cm;有宮旁浸潤;盆腔淋巴結轉移;病理形態爲非鱗癌腫瘤。對於復發的高危病例,術後給予化療+盆腔放療可以改善患者的生存率,兩者的配合比單純外照射療效好。
宮頸癌晚期(Ⅱb~Ⅲb),由於腫瘤體積大、浸潤的範圍廣及有淋巴轉移等,往往是造成常規放射治療失敗或預後差的直接原因。
近年來,對全身化療配合放療治療晚期宮頸癌的報道逐漸增多,一些報道證明同時放、化療比順序化、放療明顯提高了晚期病人的CR率和存活期。Park(1993)等對95例Ⅰ~Ⅱ期局部腫瘤直徑大於4cm的宮頸癌採用3種治療方式進行比較:單純放療;順序化療、放療;同時化療、放療,結果以30個月存活時間做比較,單純放療組爲79.5%,順序放、化療組爲89.5%,而同時放、化療組爲100%。因此,認爲綜合治療優於單純放療。在綜合治療中,同時化、放療比順序化、放療效果要好,並且可使病人總的治療時間縮短,費用減少。從目前情況來看,同時放、化療是晚期宮頸癌的治療趨勢。
宮頸癌同時放、化療的化療方案是:長春新鹼(VCR) 1mg靜注衝入;順鉑(PDD) 0.6~0.8mg/kg靜注;每週1次,連用6周。與放療同步進行。應用此方案治療中、晚期宮頸癌(Ⅱb~Ⅲb)及盆腔復發病例,從近期臨牀療效觀察來看,是安全有效的治療方法,在消除局部巨大腫瘤、控制腫瘤蔓延及晚期復發、轉移病例的治療方面起到了作用,而且尚未發現嚴重的骨髓抑制和其他毒性反應。少數病例出現輕度白細胞下降(WBC 3×109/L左右),或有輕度胃腸道反應,經對症處理均可好轉。關於腫瘤的長期控制,是否提高五年生存率或病人可否長期存活,有待隨診和總結。
Thomas及Dembo(1993)報道了一組放療同時用氟尿嘧啶靜脈滴注治療複發性宮頸癌,長期生存率達45%。而Kigawa等人的研究報告了局部晚期宮頸癌先期動脈灌注化療後放療與單純放療比較,不能改善病人的預後,僅在術前給予動脈灌注化療,對藥物有反應的病例可以提高手術切除率。如何選用抗癌藥物、劑量及療程,以及如何與其他治療方法互相配合以取得較好的遠期療效,有待今後深入研究、繼續積累經驗。
c.放療與熱療的綜合治療:放射治療宮頸癌至今爲絕大多數患者所接受,並取得了很大的成績,但對放療不敏感的腫瘤如高分化鱗癌、腺癌、黏液腺癌等則難以奏效。熱療是最近10年來興起的一種腫瘤治療方法,在這方面許多學者做了大量的臨牀研究工作。有學者認爲高溫和放療相仿,能直接殺傷癌細胞,對其作用機制有如下看法:高溫能抑制癌細胞的脫氧核糖核核糖核酸(DNA)及核糖核酸(RNA)的合成,從而影響細胞分裂。高溫使細胞膜受損,細胞質破壞引起溶酶體增加,線粒體和高爾基體損傷,導致細胞核染色體破壞。加溫使癌細胞殺滅是由於其酸性環境、氧和營養供應不足引起的。單純加溫熱療的效果不如熱療與放療的綜合治療,其原理爲:
高溫有助於殺傷對放射線抗拒的乏氧細胞:早在20世紀50年代Gray提出放療以後局部腫瘤復發是由於乏氧細胞的存在。由於腫瘤不同程度地存在感染及壞死,其中的乏氧細胞對放射線是抗拒的。如果給腫瘤加溫,腫瘤的含氧量可以上升,電離輻射的殺傷也隨之增加。有關的實驗研究證實乏氧細胞對高溫同樣敏感,二者並用有協同作用。
熱療與放療配合有增敏作用:因爲熱輻射主要作用於S期腫瘤細胞,恰好彌補了射線對S期細胞輻射不足的缺點,二者合用可互相補償。
加溫可以阻礙放射損傷的修復:有關實驗證明,高溫能抑制電離輻射的DNA修復。
基於上述理論,自1994年以來有研究對中、晚期宮頸癌、復發、轉移、未控等晚期病例進行了放療加熱療的臨牀觀察。具體做法是:病人在接受腔內放射治療後數十分鐘內給予加熱治療,選擇功率40W、加熱溫度43℃、加溫時間40min,熱輻射器儘量接觸瘤(牀)給予治療。目前近期臨牀觀察顯示熱療在放療中起到了協同作用,尤其是復發、未控病例採用放療加熱療加化療的綜合手段治療,使許多晚期腫瘤病例瘤竈縮小,局部情況改善,減輕了病人的症狀。
關於放療前加溫還是放療後加溫的問題,國外學者認爲放療後加熱更好,理由是:腫瘤接受射線輻射後部分細胞殺傷、部分細胞修復,放療後立即給予加溫熱療可以繼續阻斷腫瘤細胞的修復,達到抑制作用。放、熱療的時間間隔越短越好,如果能在放療同時加熱則療效更好。關於放、熱療的療效及是否提高治癒率,有待進一步分析、總結得出結論。
19 預後
19.1 預後
子宮頸癌的診治研究已近百年,療效顯著,總的來講預後較好。早期病例手術或放療均可達到較好的治療效果。手術治療Ⅰ期5年生存率達90%以上,Ⅱ期70%以上。由於臨牀以中、晚期病例較集中,多采用放射治療且療效較滿意。綜合各國文獻報道,放射治療總的5年生存率55%~65%,其中Ⅰ期70%~90%,Ⅱ期60%~80%,Ⅲ期40%~55%,Ⅳ期10%~20%。
不同單位的治療結果不同,有時差別較大,達10%~20%。分析原因有對療前分期解釋的差別、設備條件、技術方法與診療經驗,以及對病例的選擇如早期病例、一般狀況好者均被選擇手術治療,有合併症者及晚期病例則進行放療,生存率自然有所差別。FIGO於1985、1988及1991年分別對130多個單位的96023例各期宮頸癌進行綜合分析,總的5年生存率爲55.0%~53.5%,5年內死於宮頸癌者爲34.7%~35.9%,說明宮頸癌的治療效果遠未達理想。Jacobsen(1991)謂20餘年來子宮頸癌的治療效果近於停滯,看來不無道理。
19.2 影響預後的因素
影響宮頸癌預後的因素很多,如發病年齡、全身狀況、心理狀態、腫瘤體積的大小、病理類型、生長方式、浸潤深度、有無轉移以及患者接受治療的手段是否規範,如手術適應證的選擇和範圍、放療方法和劑量、化療藥物和配伍、綜合治療的情況及精心的護理、對症支持治療、精神上的安撫,都是影響預後的因素。但是臨牀分期、腫瘤分級、淋巴結轉移被認爲是影響預後的重要因素。
19.2.1 (1)全身狀況
一個宮頸癌患者如果具備良好的身體素質,營養充足、無貧血徵、免疫功能正常,保持良好的心理狀態,能以積極的態度配合治療並具備戰勝疾病的信心,這些都是取得較好療效的有利條件,反之則給治療增加了困難,並在很大程度上影響治療效果。
19.2.2 (2)臨牀分期
宮頸癌的預後取決於病變的早晚,即與臨牀分期有着直接關係。不論採取哪種治療方法,臨牀期別越早治療效果越好。國際年報第21期報道32052例宮頸癌的治療情況:Ⅰ期宮頸癌的5年存活率爲81.6%,Ⅱ期61.3%,Ⅲ期36.7%,Ⅳ期12.1%;顯示了隨着宮頸癌臨牀分期的升高,5年存活率遞減。中國醫學科學院腫瘤醫院有學者分析了7200例宮頸浸潤癌放療後10年存活率和治療失敗率:Ⅰ期宮頸癌的10年存活率爲90.37%,死亡率1.3%;Ⅱ期是73.34%,死亡率13.4%;Ⅲ期爲52.13%,死亡率30.5%;Ⅳ期爲14.0%,死亡率35.6%;說明宮頸癌放療後的存活率隨臨牀期別升高而下降,死亡率隨期別升高而上升。
19.2.3 (3)組織形態和病理分級
組織形態和病理分級對宮頸癌的預後亦起着至關重要的作用。對臨牀分期相同的病例採取相同的治療方法,由於組織病理形態不同或者相同的病理類型而分化程度不同,治療效果和預後也不盡相同。從組織病理學的角度判斷預後,人們一直認爲腺癌的放療效果不如鱗癌。特別是腺癌多爲內生型生長,容易浸潤宮頸間質,侵犯血管淋巴間隙,較早出現轉移。Pettersson(1991)對9123例Ⅰb期宮頸浸潤癌的不同病理形態採用不同的治療方法進行5年生存率的比較,宮頸鱗癌:單純放療爲68%,單純手術98.1%,手術+放療76.9%,放療+手術82.5%。宮頸腺癌:單純放療58.6%,單純手術89.0%,手術+放療69.8%,放療+手術79.9%。顯示了宮頸腺癌的治療效果與鱗癌的區別。Eifel等(1995)對1960~1989年間治療的1538例宮頸鱗癌及229例宮頸腺癌資料進行分析,二者的5年生存率分別爲81%及72%(P<0.01),在宮頸腫瘤≥4cm組中,腺癌患者的預測危險值是鱗癌患者的1.9倍。多因素分析組織學分類,是宮頸癌獨立的預後因素。臨牀上所見腺癌病例,其治療反應無論敏感程度、治療效果和預後與鱗癌仍有差別。Zamder(1981)分析566例宮頸鱗癌手術切除標本病理分級與5年存活率的關係(取材部位分腫瘤表面和腫瘤中心),腫瘤表面Ⅰ級96%,Ⅱ級84.0%,Ⅲ級72.3%;腫瘤深處(中心)Ⅰ級85.6%,Ⅱ級79.8%、Ⅲ級71.6%。顯示了病理分級愈高,5年存活率愈低,隨病理分級的增高,復發和死亡率呈上升趨勢。
19.2.4 (4)腫瘤體積
宮頸局部腫瘤體積的大小也是重要的預後因素。Werner-Wasik等(1995)報道宮頸局部腫瘤>5cm和<5cm者相比,其5年生存率及無瘤生存率分別爲53∶83及44∶78,癌竈大者明顯下降。腫瘤體積增大淋巴結轉移機率增加,腫瘤體積越大生存率越低,複發率增高。Burghardt曾對150例患者的腫瘤體積包括間質浸潤深度、宮頸及宮頸旁浸潤等進行了臨牀實驗測量:當腫瘤體積<1000mm3時,宮頸旁、宮旁皆無浸潤;當腫瘤體積>1000mm3時,有與無宮頸旁浸潤的淋巴結陽性率各爲47.8%與15.7%,宮頸旁浸潤的有與無者淋巴結陽性率各爲83.3%與18.7%。Burghardt認爲這是由於宮頸旁的許多血管分支及寬廣融合的淋巴網,使其受侵機會可能較高於宮頸間質。如果間質浸潤,則癌栓形成並且轉移。無浸潤者的5年生存率爲88%,有間質浸潤者的5年存活率爲55%。Bloss(1992)指出當腫瘤直徑爲4.0~4.9cm時,5年生存率爲80%,5.0~5.9cm時爲62%,當腫瘤體積增大至6cm以上時,生存率下降至30%左右。腫瘤體積增大容易侵入深層間質,放療難以控制,放療後殘存腫瘤可高達40%~55%,因而極易復發。
19.2.5 (5)淋巴系統轉移
與其他部位的癌瘤一樣,宮頸癌在發展過程中不斷生長、蔓延並發生轉移。癌細胞侵入淋巴血管間質,癌栓隨即通過淋巴管侵入區域性淋巴結,進一步轉移至遠處淋巴結。有無盆腔內或遠處淋巴結轉移是影響治療效果的重要因素之一。目前宮頸癌的有效治療手段無論手術或放療均爲區域性治療,一旦有遠處淋巴結轉移則難以達到根治目的,是治療效果差、存活率低、復發和死亡的直接原因。Angel等(1992)報道宮頸癌Ⅰ期89例,無淋巴結轉移者的5年存活率爲93%,有淋巴結轉移者爲15%,有顯著的療效差異。臨牀分期與淋巴結轉移也有直接關係,Burghardt等(1993)、Zander等(1981)、Van Nagell等(1992)、Podczaski等(1989)不同作者報道手術後標本經病理檢查所證實的盆腔淋巴和腹主動脈旁淋巴結轉移的情況,顯示無論盆腔淋巴結還是腹主動脈旁淋巴結轉移均隨臨牀分期的增高而上升,腹主動脈淋巴結陽性者多伴有盆腔淋巴結轉移(表16)。
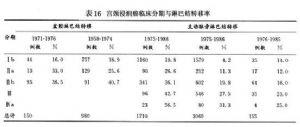
Van Nagell(1992)綜合了15篇文獻3019例Ⅰb~Ⅳa期宮頸癌主動脈旁淋巴結轉移與臨牀分期的關係(表17),顯示分期越高主動脈旁淋巴結轉移率也越高,同時主動脈旁淋巴結陽性時鎖骨上淋巴結轉移的發生率爲13%,並且多伴有盆腔淋巴結轉移。腹主動脈旁淋巴結轉移一般治療前不易發現,其部位又在照射野範圍之外,故常被遺漏。因此,有條件的中、晚期宮頸癌病例應常規做CT或MRI檢查。治療前預測淋巴結有無轉移有助於選擇合理的治療方案,進行有計劃的治療或綜合治療。1991年FIG0婦癌治療年報分析了6390例Ⅰb及Ⅱa期宮頸癌有無區域淋巴結轉移與預後的關係,5438例Ⅰb期中有淋巴結轉移的949例5年生存率爲59.O%,而無淋巴結轉移的4489例5年生存率爲89.5%。Ⅱa期952例中有淋巴結轉移的269例5年生存率爲48.9%,無淋巴結轉移的683例5年生存率則爲84.6%。1979年美國婦科腫瘤年會專題討論了淋巴結轉移與預後的關係,淋巴結轉移<3個者5年生存率爲67.2%,>3個者急劇下降至39.4%,因此多數學者認爲宮頸癌最重要的預後因素之一是較多部位的淋巴結轉移。

19.2.6 (6)治療方法
治療方法對預後的影響是個更爲複雜的問題。治療經驗、設備條件、對病例的選擇以及對分期的不同理解都可造成對分析結果的影響,最好對同一治療單位的不同治療方法進行對比,較爲客觀。
宮頸癌的手術指徵均認爲應是Ⅱa期以前的病例,手術切除不徹底是失敗的主要原因,主要表現爲以下幾種情況:①手術操作不規範;②術者技術不熟練;③手術標本切緣不淨;④淋巴結陽性的病例術中未能切除每個轉移的淋巴結等,均可影響手術治療的效果。如果有條件可以補救放射治療,但對術後是否追加放療意見不一致。Zander等(1981)對宮頸癌術後放療持懷疑態度,但是Ⅰ期和Ⅱ期單純手術患者與術後放療者相比,Ⅰ期546例中二者5年存活率相比各爲79.4%及89%。所以多數人主張,對術後有淋巴結轉移的病例應進行放射治療。
還有的人對宮頸癌淋巴結轉移提出兩種治療意見:第一,放射治療可能優於手術治療,因爲它不會丟掉隱匿在盆腔內的轉移淋巴結;第二,對有淋巴結轉移的病人進行淋巴結清掃加盆腔放療的綜合治療,可以改善生存率。
影響放療效果的因素:一般情況下腫瘤局部情況以外生型、血運好、無感染者照射敏感、效果好,容易治癒。如果全身狀況較差、繼發貧血、瘤牀合併感染則降低放射敏感性,同樣影響治療效果。組織病理學相同宮頸癌的放射敏感性可以不同。一般說來,分化程度越低放射敏感性越高,但在臨牀上發現放射越敏感的腫瘤越容易轉移,雖然原發或局部瘤竈得到控制,卻常常因爲遠處出現轉移竈而使治療失敗。所以放射敏感性的高低與放射治療的效果並不一致。再者,如果癌瘤浸潤的情況超過照射野的範圍,也是放療失敗的因素之一。放療設備、照射技術、技術人員的水平和恰當的治療劑量等,都是影響放療效果的因素。
19.2.7 (7)其他有關因素
①年齡因素:患者的發病年齡對預後的影響,研究結果不太一致。FIG0在一項多因素分析中對4539例宮頸鱗癌Ⅱ期的年齡因素進行分析,其總的5年生存率爲58.8%。年齡在20~39歲及70歲以上者,1206例的5年生存率爲50.3%,而40~69歲者(3333例)則爲61.9%,有一定差異。對後一組再分爲兩個年齡組進行分析時,40~49歲者(852例)5年生存率爲57.6%,而50~69歲者(2481例)則爲63.4%,二組相差不多。
②宮頸癌合併妊娠:綜合國內學者報道,合併妊娠患者佔宮頸癌的0.7%~9.5%。總的來講,合併妊娠的宮頸癌患者預後不好,淋巴轉移快而廣泛,產後則預後更差,妊娠晚期宮頸癌的預後又差於妊娠早期。中國醫學科學院腫瘤醫院對458例各期宮頸癌合併妊娠,與同期治療的10641例各期一般宮頸浸潤癌的5年存活率進行臨牀比較:宮頸癌合併妊娠Ⅰ期5年存活率爲80.O%;Ⅱ期是69.0%;Ⅲ期在37.3%;Ⅳ期8.3%;平均5年生存率爲47.6%。無合併妊娠患者5年生存率爲:Ⅰ期94.1%;Ⅱ期82.1%;Ⅲ期63.3%;Ⅳ期25.3%;平均5年生存率爲69.4%,有顯著差異。Jones等(1995)綜合多家醫院資料報道,在1984~1992年收治的1172例宮頸癌中合併妊娠者161例,妊娠和非妊娠組生存率相似,但隨妊娠早、中、晚期的變化,生存率逐漸下降。因此提倡妊娠早期開展防癌檢查,有利於早期發現、早期診斷、早期治療。
③宮頸殘端癌:系次全子宮切除術2年以後發生在宮頸的原發癌。無宮體的宮頸癌,無論手術治療還是放射治療都有一定的難度,因此高度強調個別對待原則。
20 宮頸浸潤癌的預防
早期診斷、積極治療、做好隨診。
宮頸浸潤癌治療後嚴密的定期隨診,對了解病情的變化、給予進一步處理及判斷預後非常重要。
20.1 隨診時間
一般情況下結束治療1個月後返院複查。如尚需補充放射治療,間隔時間不宜太長。補充治療多在2~4周內給予。若病情穩定,半年之內每2~3個月檢查1次;一年之內3~6個月檢查1次;2年之內半年檢查1次;以後至少1年檢查1次。當病情變化時,則應靈活掌握隨診時間。
20.2 隨診內容
①全身檢查:有無淺表淋巴結腫大、腹部情況、下肢是否水腫等。②術後隨診:主要觀察患者一般狀況恢復的情況、傷口是否完全癒合以及有無淋巴囊腫形成等。
臺北榮總醫院在手術後8周第1次複診,除非懷疑有持續癌症的存在,否則只做骨盆腔和腹部傷口檢查。必要時還開一些軟化大便的藥,但若有更年期症狀,則建議病人開始用單純的雌激素補充治療(estrogen replacement therapy)。隨後是每2個月複診1次,共2次,加起來是半年。每次都做拍片和骨盆腔檢查。這期間每月換1次尿管,也同時檢驗小便並測餘尿,只要病人能自解,且小便檢查沒有白細胞等發炎現象,餘尿即使比平常的100ml多一些,也可將尿管拿走。根據經驗,多半病人都是在手術後3個月內才能夠拿掉尿管。極少數的病人還會更長一些,也有6個月者。
手術6個月之後,便改爲每3個月複診1次,一共2次,便是1年。檢查包括拍片和骨盆腔檢查。1年後改爲每半年檢查1次,共2次。手術2年後除了拍片和骨盆腔檢查外,建議行腹部CT檢查。若有發現而骨盆腔檢查卻沒有發現時,更可考慮做正電子發射斷層攝影(FDG-PET),腫瘤小於1cm可能會有假陰性結果,腫瘤大於1cm尤其是局部淋巴結轉移,診斷的正確性可高達90%(表18)。

放療後隨診即通過盆腔檢查瞭解有無陰道粘連、宮頸原形是否恢復、宮體大小等。初次及結束治療後前2次隨診應常規消毒下探宮腔,瞭解宮腔有無積液或積膿存在,如有則給予擴宮引流、全身抗炎和對症處理。必要時三合診檢查宮旁、盆腔等部位有無異常。其他檢查包括大小便常規、血象、肺部透視,必要時作胸片、盆腹腔B超及陰道脫落細胞學檢查和陰道鏡檢。SCC可以跟蹤瞭解治療後的病情變化等。
20.3 (3)康復指導
康復治療包括心理治療和軀體治療,要幫助患者建立信心,以積極樂觀的態度正確對待疾病,進行適當的體育鍛煉、營養以及必要的自我護理(如:保護傷口、保持衛生及放療後陰道沖洗等)。對治療後的性生活恢復給予正確指導,並取得家屬的理解和配合。根據西安交通大學醫學院對該院經放療後生存10年以上的316例患者的情況進行調查,結果180例(57%)患者恢復了原來的勞動力,119例(37.7%)患者的勞動力部分恢復,說明儘管根治性放療可引起婦女機體某些器質性及功能性改變,但大部分患者(94%)可以完全或部分恢復勞動力。爲了提高生活質量,對治療後喪失卵巢功能、提早進入更年期的患者要解除顧慮,給予對證治療,必要時在醫生指導及觀察下進行激素替代治療。