3 註解
抗體是機體在抗原物質刺激下,由B細胞分化成的漿細胞所產生的、可與相應抗原發生特異性結合反應的免疫球蛋白。
抗體分子(antibody,Ab)是由漿細胞合成和分泌的,而每一種漿細胞克隆可以產生一種特異的抗體分子,所以血清中的抗體是多種抗體分子的混合物,它們的化學結構是不均一的,而且含量很少,不易純化,是抗體分子結構分析的困難。
4 抗體的發現
在免疫學發展的早期人們應用細菌或其外毒素給動物注射,經一定時期後用體外實驗證明在其血清中存在一種能特異中和外毒素毒性的組分稱之爲抗毒素,或能使細菌發生特異性凝集的組分稱之爲凝集素。其後將血清中這種具有特異性反應的組分稱爲抗體(antibody,Ab),而將能刺激機體產生抗體的物質稱之爲抗原(antigen,Ag)。由此建立了抗原與抗體的概念。
1890年德國學者Behuing和日本學者北里用白喉桿菌外毒的組分稱爲抗毒素,這是在血清中發現的第一種抗體。這種含有抗體的血清稱之爲免疫血清。
5 抗體的理化性質
1.抗體是球蛋白 早在40年代初期Tiselius和Kabat就證實了抗體活性與血清丙種球蛋白組分相關。他們用肺炎球菌多糖免疫家兔,可獲得高效價免疫血清。然後加入相應抗原吸收以除去抗體,將去除抗體的血清進行電泳圖譜分析,發現丙種球蛋白(γ-G)組分明顯減少,從而證明了抗體活性是存在於丙種球蛋白內。
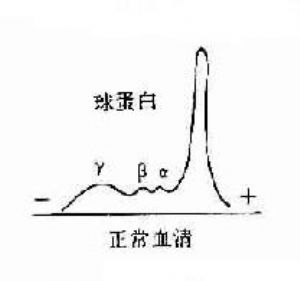

其後,經對不同免疫血清的電泳分析,超速離心分析和分子量測定等方法,發現大部分抗體活性存在於γ球蛋白內,但有小部分抗體活性可存在於β球蛋白內。它們的離心常數分別爲7S和平共處9S,分子量分別爲16萬和萬。因此它們分別被命名爲7Sγ球蛋白分子(16萬)19S,β2巨球蛋白分子(β2M,90萬)和β2A球蛋白分子,所以從早期對抗體性質的研究證明抗體不是由均質性球蛋白組成,而是由異性球蛋白組成。
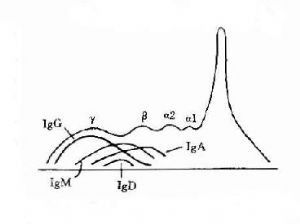
2.免疫球蛋白爲了準確描述抗體蛋白的性質,在60年代初提出將具有抗體活性的球蛋白稱爲免疫球蛋分子(immunoglobulin,lg)。γ球蛋白則必稱爲IgG,β2M稱爲IgM,而β2A稱爲IgA。其後又相繼發現二類Ig分子,分別稱爲IgE和IgD。故在血清中現已發現有五類免疫球蛋白分子,它們的結構與功能是各不相同的。
6 抗體的生物學活性
1.抗體與抗原的特異性結合刺激抗體產生的物質稱爲抗原,抗體分子與其相應的抗原發生結合稱爲特異性結合。例如,白喉抗毒素只能中和白喉桿菌外毒素,而不能中各破傷風外毒素,反之亦然。
2.抗體與補體的結合在一定條件下,抗體分子可以與存在於血清中的補體分子相結合,並使之活化,產生多種生物學效應,稱之爲抗體的補體結合現象,揭示了抗體分子與補體分子間的相互作用。
3.抗體的調理作用抗體的第三種功能是可增強吞噬細胞的吞噬作用。在體外的實驗中,如將免疫血清中加入中性粒細胞的懸液中,可增強對相應細胞的吞噬作用,稱這種現象爲抗體的調理作用。自此揭示了抗體分子與免疫細胞間的相互作用。爲了說明抗體分子這些生物學功能,必須進一步瞭解抗體分子的結構與功能的關係。
7 抗體的製備
爲了研究抗體的理化性質、分子結構與功能,以及應用抗體於臨牀疾病的診斷、治療及預防都需要人工製備抗體。目前,根據製備的原理和方法可分爲多克隆抗體、單克隆抗體及基因工程抗體三類。
7.1 多克隆抗體
大多數抗原是由大分子蛋白質組成,但只是抗原上有限部位的特殊分子結構能與其相應抗體結合,稱此部位爲抗原決定簇(antigenic determinant)或表位(epitope)。
一種天然抗原性物質(如細菌或其分泌的外毒素以及各種組織成分等)往往具有多種不同的抗原決定簇,而每一決定簇都可刺激機體一種抗體形成細胞產生一種特異性抗體。
在機體淋巴組織內可存在千百種抗體形成細胞(即B細胞),每種抗體形成細胞只識別其相應的抗原決定簇,當受抗原刺激後可增殖分化爲一種細胞羣,這種由單一細胞增殖形成的細胞羣體可稱之爲細胞克隆(clone)。同一克隆的細胞可合成和分泌在理化性質、分子結構、遺傳標記以及生物學特性等方面都是完全相同的均一性抗體,亦可稱之爲單克隆抗體。
在早期傳統的抗體製備方法是將一種天然抗原經各種途徑免疫動物,由於抗原性物質具有多種抗原決定簇,故可刺激產生多種抗體形成細胞克隆,合成和分泌抗各種決定簇抗體分泌到血清或體液中,故在其血清中實際上是含多種抗體的混合物,稱這種用體內免疫法所獲得的免疫血清爲多克隆抗體,也是第一代抗體。由於這種抗體是不均一的,無論是對抗體分子結構與功能的研究或是臨牀應用都受到很大限制,因此如何能獲得均一性抗體成爲關注的問題。
7.2 單克隆抗體
體內免疫法很難獲得單克隆抗體(monoclonal antibody,McAb)。如能將所需要的抗體形成細胞選出並能在體外進行培養即可獲得已知特異的單克隆抗體。1975年德國學者Kohler和英國學者Milstein將小鼠骨髓瘤細胞和經綿羊紅細胞(sheep rue blood cell),SRBC)免疫的小鼠脾細胞在體外進行兩種細胞融合,結果發現部分形成的雜交細胞既能繼續在體外培養條件下生長繁殖又能分泌抗SRBC抗體,稱這種雜交細胞系爲雜交瘤(hybridoma)。這種雜交瘤細胞既具有骨髓瘤細胞能大量無限生長繁殖的特性,又具有抗體形成細胞合成和分泌抗體的能力。它們是由識別一種抗原決定簇的細胞克隆所產生的均一性抗體,故稱之爲單克隆抗體。應用雜交瘤技術可獲得幾乎所有抗原的單克隆抗體,只要這種抗原能引起小鼠的抗體應答。
單克隆抗體由於純度高、特異性強、可以提高各種血清學方法檢測抗原的敏感性及特異性,但單克隆抗體多爲雙價抗體,與抗原結合不易交聯爲大分子集團,故不易出現沉澱反應。單克隆抗體的應用大促進了對各種傳染病和惡性腫瘤診斷的準確性。
單克隆抗體亦可與核素、各種毒素(如白喉外毒素或篦麻毒素)或藥物通過化學偶聯或基因重組製備成導向藥物(targetting drug)用於腫瘤的治療,是一種新型免疫治療方法,有可能提高對腫瘤的療效。
單克隆抗體亦可用於對各種免疫細胞及其它組織細胞表面分子的檢測,這對免疫細胞的分離、鑑定及分類及研究各種膜表面分子的結構與功能都具有重要意義。
7.3 基因工程抗體
自1975年單克隆抗體雜交瘤技術問世以來,單克隆體在醫學中被廣泛地應用於痢疾的診斷及治療。但目前絕大數單克隆抗體是鼠源的,臨牀重複給藥時體內產生抗鼠抗體,使臨牀療效減弱或消失。因此,臨牀應用理想的單克隆抗體應是人源的,但人-人雜交瘤技術目前尚未突破,即使研製成功,也還存在人-人雜交瘤體外傳代不穩定,抗體親合力低及產量不高等問題。目前較好的解決辦未能是研製基因工程抗體,(genetically engineering antibody)以代替鼠源單克隆抗體用於臨牀。
基因工程抗體興起於80年代早期。這一技術是將對Ig基因結構與功能的瞭解與DNA重組技術相結合,根據研究者的意圖在基因水平對Ig分子進行切割、拼接或修飾,甚至是人工全合後導入受體細胞表達,產生新型抗體,也稱爲第三代抗體。
基因工程抗體包括嵌合抗體、重構抗體、單鏈抗體、單區抗體及抗體庫等。其中以嵌合抗體研究的較多,也較成熟。單鏈抗體及單區抗體雖具有結構簡單、分子小等優點但其臨牀應用的前景尚待證實。