2 英文參考
protein[WS/T 476—2015 營養名詞術語]
3 概述
蛋白質(protein)是以氨基酸爲基本單位,通過肽鍵連接起來的一類含氮大分子有機化合物[1]。蛋白質是人體必需的營養素[2]。
蛋白質是一種複雜的有機化合物,有些情況下可以用“朊”字來指代蛋白質[3]。蛋白質是由氨基酸分子呈線性排列所形成,相鄰氨基酸殘基的羧基和氨基通過形成肽鍵連接在一起。蛋白質的氨基酸序列是由對應基因所編碼。除了遺傳密碼所編碼的20種“標準”氨基酸,在蛋白質中,某些氨基酸殘基還可以被翻譯後修飾而發生化學結構的變化,從而對蛋白質進行激活或調控。多個蛋白質可以一起,往往是通過結合在一起形成穩定的蛋白質複合物,發揮某一特定功能。
蛋白質是動物、植物和微生物等生物細胞的主要成分,是一類高分子含氮的有機化合物的總稱。蛋白質是活細胞的組成成分,也是作爲維持細胞生活的活性物質(如酶等),與生命現象密切相關的物質,它在體內不斷地進行代謝循環,而在外觀上似乎保持着恆定狀態。蛋白質是由各種L-α-氨基酸類(H2N-CHR-COOH,R=H即甘氨酸)彼此返復以肽鍵(……CO-NH……)結合而形成的多肽鏈(H2N-CHR1-CO-NH-CHR2-CO-NHR3-CO……)。由於蛋白質種類的不同,其所含氨基酸的種類、數量及其結合順序都不相同,其分子的大小是多種多樣的。從鯡魚和鮭的精子蛋白的魚精蛋白分子量爲4千左右直到病毒類那種具有複雜的四級結構的分子量至數億。對水解後僅生成氨基酸的天然蛋白質稱爲單純蛋白質。對水解後除產生氨基酸外,還有其他有機物質的稱爲結合蛋白質。前者根據溶解度與其來源而分別稱爲清蛋白、球蛋白、醇溶谷蛋白、谷蛋白、硬蛋白、組蛋白、魚精蛋白。後者依其所含有的非氨基酸有機物而分別稱爲核蛋白質、糖蛋白、核糖蛋白、磷脂蛋白、色素蛋白等。此外雖然不是天然蛋白質,但多少進行變化而產生的一族衍生蛋白質則有:白明膠、腖、等。除硬蛋白質外,蛋白質溶於水或稀鹽溶液而形成膠體溶液,蛋白質溶液可通過加入醇、丙酮等有機溶劑、硫酸銨等中性鹽和三氯醋酸、硫柳酸、生物鹼試劑、重金屬鹽等而使蛋白質沉澱,因此可用來對蛋白質的檢出、去除和提純。爲了檢出蛋白質和蛋白質中含有的氨基酸,可用雙縮脲反應、米倫(Millon′s)反應、黃色蛋白反應、阿達姆凱威斯(adam-kiewiez)反應、李伯曼(Libermann)反應、毛利斯(Molis-ch)反應等各種顯色反應。爲了正確分析組成蛋白質的氨基酸的種類和數量,通常可以將樣品加入過量的6N鹽酸於閉式管中,在110℃下處理約24-72小時,然後將水解產物放入以離子交換柱爲主體的氨基酸自動分析儀中進行測定。蛋白質中氨基酸的組成和分子內氨基酸的排列順序,對每種生物和器官都各顯有其特徵。也就是說蛋白質具有種屬和器官的特異性。天然蛋白質是不穩定的物質,因各種物理的(加熱、攪拌、薄膜化、紫外線及X線照射等)或化學的(尿素、有機溶劑酸、醇及數種鹽類處理等)原因而引起變性。通常,一般的天然蛋白質一旦注入與其不同的動物組織內,便會成爲所謂的抗原,在注射過的動物血清中會形成免疫球蛋白,它能和注射蛋白之間引起特異性的抗原抗體反應。因此可利用這種性質用微量(樣品)就能判斷出兩種蛋白質的同一性。
與其他生物大分子(如多糖和核酸)一樣,蛋白質是生物體中的必要組成成分,參與了細胞生命活動的每一個進程。酶是最常見的一類蛋白質,它們催化生物化學反應,尤其對於生物體的代謝至關重要。除了酶之外,還有許多結構性或機械性蛋白質,如肌肉中的肌動蛋白和肌球蛋白,以及細胞骨架中的微管蛋白(參與形成細胞內的支撐網絡以維持細胞外形)。另外一些蛋白質則參與細胞信號傳導、免疫反應、細胞黏附和細胞週期調控等。同時,蛋白質也是人們日常飲食中必需的營養物質,這是因爲動物自身無法合成所有必需氨基酸;通過消化所攝入的蛋白質食物(將蛋白質降解爲氨基酸),人體就可以將吸收的氨基酸用於自身的蛋白質合成。
蛋白質這一概念最早是由瑞典化學家永斯·貝採利烏斯於1838年提出,但當時人們對於蛋白質在機體中的核心作用並不瞭解。1926年,詹姆斯·B·薩姆納揭示尿素酶是蛋白質,首次證明了酶是蛋白質。
第一個被測序的蛋白質是胰島素,由弗雷德裏克·桑格完成,他也因此獲得1958年度的諾貝爾化學獎。首先被解析的蛋白質結構包括血紅蛋白和肌紅蛋白的結構,所用方法爲X射線晶體學;
該工作由馬克斯·佩魯茨和約翰·肯德魯於1958年分別完成,他們也因此獲得1962年度的諾貝爾化學獎。
4 歷史
在18世紀,安東尼奧·弗朗索瓦(Antoine Fourcroy)和其他一些研究者發現蛋白質是一類獨特的生物分子,他們發現用酸處理一些分子能夠使其凝結或絮凝。當時他們注意到的例子有來自蛋清、血液、血清白蛋白、纖維素和小麥麪筋裏的蛋白質。荷蘭化學家Gerhardus Johannes Mulder對一般的蛋白質進行元素分析發現幾乎所有的蛋白質都有相同的實驗公式。用“蛋白質”這一名詞來描述這類分子是由Mulder的合作者永斯·貝採利烏斯於1838年提出。Mulder隨後鑑定出蛋白質的降解產物,並發現其中含有爲氨基酸的亮氨酸,並且得到它(非常接近正確值)的分子量爲131Da。
對於早期的生物化學家來說,研究蛋白質的困難在於難以純化大量的蛋白質以用於研究。因此,早期的研究工作集中於能夠容易地純化的蛋白質,如血液、蛋清、各種毒素中的蛋白質以及消化性和代謝酶(獲取自屠宰場)。1950年代後期,Armour Hot Dog Co.公司純化了一公斤純的牛胰腺中的核糖核酸酶A,並免費提供給全世界科學家使用。目前,科學家可以從生物公司購買越來越多的各類純蛋白質。
着名化學家萊納斯·鮑林成功地預測了基於氫鍵的規則蛋白質二級結構,而這一構想最早是由威廉·阿斯特伯裏於1933年提出。隨後,Walter Kauzman在總結自己對變性的研究成果和之前Kaj Linderstrom-Lang的研究工作的基礎上,提出了蛋白質折迭是由疏水相互作用所介導的。1949年,弗雷德裏克·桑格首次正確地測定了胰島素的氨基酸序列,並驗證了蛋白質是由氨基酸所形成的線性(不具有分叉或其他形式)多聚體。原子分辨率的蛋白質結構首先在1960年代通過X射線晶體學獲得解析;到了1980年代,NMR也被應用於蛋白質結構的解析;近年來,冷凍電子顯微學被廣泛用於對於超大分子複合體的結構進行解析。截至到2008年2月,蛋白質數據庫中已存有接近50,000個原子分辨率的蛋白質及其相關複合物的三維結構的座標。[4]
5 蛋白質的生物化學性質

蛋白質並不完全是剛性分子。許多蛋白質在執行生物學功能時可以在多個相關結構中相互轉換。在進行功能型結構重排時,這些相關的三級或四級結構通常被定義爲不同“構象”,而這些結構之間的轉換就被稱爲“構象變換”。例如,酶的構象變換常常是由底物結合到活性位點所導致。在溶液中,所有的蛋白質都會發生結構上的動態變化,主要表現爲熱振動和與其他分子之間碰撞所導致的運動。

不同大小的蛋白質的分子表面。從左到右依次爲:抗體(IgG)、血紅蛋白、胰島素、腺苷酸激酶和谷胺酰氨合成酶。
蛋白質可以由三級結構的不同大致分爲三個主要類別:球蛋白、纖維蛋白和膜蛋白。幾乎所有的球蛋白都是水溶性的,許多酶都是球蛋白;纖維蛋白多爲結構蛋白;膜蛋白常常作爲受體或分子通道,是細胞與外界聯繫的重要介質。
要了解特定蛋白質的功能,獲得其三級結構或四級結構可以提供重要的結構信息。目前用於蛋白質的原子分辨率結構測定的方法主要是X射線晶體學和NMR光譜學。冷凍電子顯微學也可以提供超大蛋白質複合物(如病毒、核糖體等)的低分辨率結構信息。[5]而電子晶體學在一些情況下也可以提供較高分辨率的結構信息,特別是對於膜蛋白的二維晶體。[6]解析的結構(包括原子座標和結構解析的相關信息)通常存放到蛋白質數據庫(PDB),供全世界研究者免費下載。結構預測也可以爲未知結構(實驗結構)的蛋白質提供結構信息。
6 蛋白質的分類
蛋白質是生命的存在形式,是維持生命的物質基礎。人體的一切細胞組織都是由蛋白質組成的,蛋白質占人體重的15%。
根據所含的氨基酸種類齊全與否,營養學把蛋白質分爲三大類:完全蛋白質、半完全蛋白質、不完全蛋白質。
(1)完全蛋白質
完全蛋白質含有種類齊全的必需氨基酸,數量充足,比例也較適當,可以滿足人體的需要。屬於完全蛋白質的有酪蛋白、乳白蛋白、卵白蛋白、卵黃磷蛋白、白蛋白、肌蛋白、大豆蛋白、麥谷蛋白、谷蛋白等。完全蛋白質營養價值高,是高質量的蛋白質。
(2)半完全蛋白質
半完全蛋白質含有各種必需的氨基酸,在種類上是齊全的,但是含量多寡不齊,比例不當,不能完全滿足人體的需要。如小麥、大麥中的麥膠蛋白。
(3)不完全蛋白質
不完全蛋白質所含必需氨基酸種類不全,不能滿足人體的需要,如玉米膠蛋白、動物結締組織、膠質蛋白、豆球蛋白等。
蛋白質又可分爲單純蛋白質和結合蛋白質。單純蛋白質由氨基酸及其衍生物組成,如血清白蛋白、胰島素等,成分相對比較簡單;結合蛋白質是由單純蛋白質和某些非蛋白質化合物基團所組成。
根據蛋白質在人體內的作用,又可以分爲6類:結構蛋白、收縮蛋白、抗體蛋白、血液蛋白、激素蛋白、酶蛋白。
蛋白質可以由三級結構的不同大致分爲三個主要類別:球蛋白、纖維蛋白和膜蛋白。幾乎所有的球蛋白都是水溶性的,許多酶都是球蛋白;纖維蛋白多爲結構蛋白;膜蛋白常常作爲受體或分子通道,是細胞與外界聯繫的重要介質。
7 蛋白質的功能
蛋白質是細胞中的主要功能分子。[8]除了特定類別的RNA,大多數的其他生物分子都需要蛋白質來調控。蛋白質也是細胞中含量最爲豐富的分子之一;例如,蛋白質佔大腸桿菌細胞乾重的一半,而其他大分子如DNA和RNA則只分別佔3%和20%。[16]在一個特定細胞或細胞類型中表達的所有蛋白被稱爲對應細胞的蛋白質組。
蛋白質能夠在細胞中發揮多種多樣的功能,涵蓋了細胞生命活動的各個方面:發揮催化作用的酶;參與生物體內的新陳代謝的調劑作用,如胰島素;一些蛋白質具有運輸代謝物質的作用,如離子泵和血紅蛋白;發揮儲存作用,如植物種子中的大量蛋白質,就是用來萌發時的儲備;許多結構蛋白被用於細胞骨架等的形成,如肌球蛋白;還有免疫、細胞分化、細胞凋亡等過程中都有大量蛋白質參與。
蛋白質功能發揮的關鍵在於能夠特異性地並且以不同的親和力與其他各類分子,包括蛋白質分子結合。蛋白質結合其他分子的區域被稱爲結合位點,而結合位點常常是從蛋白質分子表面下陷的一個“口袋”;而結合能力與蛋白質的三級結構密切相關,因爲結構決定了結合位點的形狀和化學性質(即結合位點周圍的氨基酸殘基的側鏈的化學性質)。蛋白質結合的緊密性和特異性可以非常高;例如,核糖核酸酶抑制蛋白可以與人的血管促生蛋白angiogenin以亞飛摩爾(sub-femtomolar,即<10-15M)量級的解離常數進行結合,[17]但卻完全不結合(解離常數>1 M)angiogenin在兩棲動物中的同源蛋白抗腫瘤核糖核酸酶(onconase)。非常微小的化學結構變化,如在結合位點的某一殘基側鏈上添加一個甲基基團,有時就可以幾乎完全破壞結合;例如,氨酰tRNA合成酶可以分辨側鏈結構非常類似的纈氨酸和異亮氨酸,而這兩種氨基酸的差別就在於異亮氨酸的側鏈多出一個甲基。相同的蛋白質分子結合在一起就可形成同源寡聚體或多聚體,有些多聚體可以形成纖維;而這些形成纖維的蛋白質往往是結構蛋白,它們在單體狀態下是球蛋白,通過自結合來形成剛性的纖維。蛋白-蛋白相互作用可以調控酶的活性和細胞週期中的各種進程,並可以使大型的蛋白質複合物得以形成,這樣可以將參與同一生物學功能的分子結合到一起,從而提高其工作效率;而結合所誘導的蛋白構象變化對於複雜的信號傳導網絡的構建也是必不可少的。還有一些蛋白質(如膜蛋白)可以結合或者插入到細胞膜中。
7.1 催化作用
細胞中,酶是最被廣泛瞭解和研究最多的蛋白質,它的特點是催化細胞中的各類化學反應。酶的催化反應具有高度的專一性和極高的催化效率。酶在大多數與代謝和異化作用以及DNA的複製、修復和RNA合成等相關的反應中發揮作用。在翻譯後修飾作用中,一些酶(如激酶和磷酸酶)可以在其底物蛋白質上增加或去除特定化學基團(如磷酸基團)。目前已知的酶催化的反應有約4000種。[18]酶可以極大地加速其所催化的反應;例如,與沒有酶催化的情況相比,乳清酸核苷-5'-單磷酸脫羧酶(orotate decarboxylase)的加速作用最高可達1017倍(形象地說,在沒有酶的情況下完成反應需要七千八百萬年,而存在酶的情況下反應只需18毫秒)。[19]
結合於酶上,並在酶的作用下發生反應的分子被稱爲底物。雖然酶分子通常含有數百個氨基酸殘基,但參與與底物結合的殘基只佔其中的一小部分,而直接參與底物催化反應的殘基則更少(平均爲3-4個殘基)。[20]這部分參與底物結合和催化的區域被稱爲活性位點。有一些酶需要結合一些小分子(輔酶或輔因子)才能夠有效發揮催化作用。酶的活性還可以被酶抑制劑所抑制,或被酶激活劑所提高。
7.2 信號傳導和配基運輸
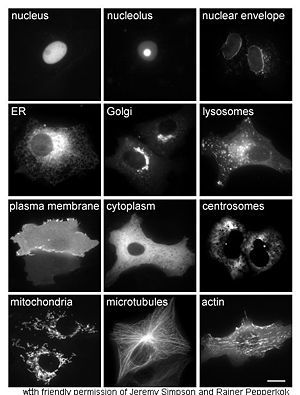
帶有綠色熒光蛋白標籤的蛋白質在不同的細胞區室和細胞結構中的分佈圖。熒光以白色來顯示。左邊從上到下依次爲,細胞核、內質網、質膜和線粒體;中間從上到下依次爲,核小體、高爾基體、細胞質和微管;右邊從上到下依次爲,核膜、溶酶體、中心體和微絲。
in vivo的蛋白質研究常常專注於蛋白質在細胞中的合成和定位。雖然已經知道許多細胞內蛋白質是在細胞質中合成,而膜結合蛋白質或分泌性蛋白質是在內質網中合成,但蛋白質定位到特定細胞器或細胞結構的特異性是如何達到的,目前還不清楚。一些有助於獲得特定蛋白質在細胞中定位的方法得到了發展,特別是用基因工程將目的蛋白質上連接上“報告者”(如綠色熒光蛋白),將這樣的融合蛋白在細胞中表達後,就可以通過顯微鏡觀察熒光來了解融合蛋白在細胞中的分佈。
另一種常用的同樣是基因工程的方法爲定點突變。利用這一方法,研究者可以改變蛋白質序列,從而改變其結構、細胞內定位以及調控機制;而這些改變可以在in vivo的情況下通過連接綠色熒光蛋白,或者在in vitro的情況下通過酶動力學的方法以及結合實驗進行觀察。
7.3 營養作用
構成蛋白質的基本單位是氨基酸,許多氨基酸按不同的方式連結,就成爲品種繁多的蛋白質[8]。
大多數微生物和植物能夠合成所有20種標準氨基酸;動物則由於缺乏某些氨基酸合成途徑中特定氨基酸合成反應所需的關鍵酶,如從天冬氨酸生成賴氨酸、甲硫氨酸和蘇氨酸的合成反應第一步中發揮催化作用的天冬氨酸激酶,而只能合成部分氨基酸。因此,動物必須從食物中獲取這些自身無法合成的氨基酸。一個生物體所無法合成而需從食物中獲取的氨基酸被稱爲必需氨基酸。如果環境中存在所需氨基酸,微生物能夠直接攝取這些氨基酸,而下調其自身的合成水平,從而節省了原來需要用於合成反應的能量。
動物所攝取的氨基酸來源於食物中所含的蛋白質。攝入的蛋白質通過消化作用而被降解,這一過程通常包括蛋白質在消化系統的酸性環境下發生變性,變性後的蛋白質被蛋白酶水解成氨基酸或小段的肽。隨後這些降解片斷就可以被吸收。部分吸收後的氨基酸被用於蛋白質的合成,其餘的則通過糖異生作用被轉化爲葡萄糖或進入三羧酸循環進行代謝。蛋白質的營養作用在飢餓環境下顯得特別重要,此時機體可以利用自身的蛋白質,特別是肌肉中的蛋白質,來產生能量以維持生命活動。蛋白質/氨基酸也是食物中重要的氮源.
人體所需蛋白質在許多食物中都含量豐富,如動物肌肉、乳製品、蛋、豆類、榖類和蕈類等。人體中蛋白質缺乏可以導致全身浮腫、皮膚乾燥病變、頭髮稀疏脫色、肌肉重量減輕、免疫力下降等。
食物蛋白質中含有21種氨基酸,分爲必須氨基酸和非必需氨基酸兩大類。必需氨基酸人體內不能自行合成,或合成數量難以滿足需要,必需由食物蛋白質供給,對成人來說,必需氨基酸有8種,對兒童來說,必需氨基酸有10種,這就是異亮氨酸、亮氨酸、賴氨散、蛋氨酸、苯丙氨酸、色氨酸、蘇氨酸,纈氨酸(兒童還包括組氨酸和精氨酸)。非必需氨基酸人體內可自行合成,可滿足身體需要,包括甘氨酸、脯氨酸、丙氨酸、羥脯氨酸、穀氨酸、門冬氨酸、組氨酸、精氨酸、酪氨酸、羥穀氨酸、胱氨酸、絲氨酸、半脫氨酸。[8]
8 人體蛋白質的生理功能
蛋白質是生命的存在形式,是維持生命的物質基礎。人體的一切細胞組織都是由蛋白質組成的,蛋白質占人體重的15%。蛋白質的主要生理功能是[8]:
8.1 構成和修補人體組織
蛋白質是構成和修補人體組織的“建築材料”,人體內的神經、肌肉、內臟、血液、骨骼甚至指甲、毛髮,都含有蛋白質,身體的生長發育、衰老組織的更新、損傷組織的修補都需要蛋白質的供應。
8.2 構成酶和激素
人體內發生的化學變化有成千上萬種,形成了人體的新陳代謝,而這些化學變化大多需要酶的催化。酶廣泛參加入體的各種生命活動,如肌肉收縮、血液循環、呼吸、消化、神經傳導、感覺、思維、生育等,如果沒有酶的參加,生命活動就無法正常進行,而酶的主要成分正是蛋白質。
激素是人體內分泌腺分泌的物質,直接進入血液分佈到全身,對肌體的代謝、生長、發育、繁殖起重要的調節作用,如甲狀腺素、腎上腺素、胰島素等。激素也是由蛋白質構成。
8.3 構成抗體
抗體是一種蛋白質,其功能是“抵抗”細菌和病毒等外來蛋白質的入侵,保護人體不受侵害,如用於治癌的干擾素。
8.4 調節滲透壓
正常人血液與組織液之間存在着水分的交換,靠血漿和組織液中的電解質和膠體蛋白來保持平衡。當組織液與血漿中的電解質濃度相等時,兩者間的水分分佈就取決於血漿中血蛋白的濃度。長期缺乏蛋白質的人,其血漿蛋白含量便會降低,血液內的水分就滲入周圍組織,造成營養不良性水腫。
8.5 供給熱能
9 人體蛋白質的生理價值
蛋白質的生理價值是評定食物蛋白營養價值的常用方法,其數值是蛋白質在體內保留量與吸收量的百分比,即[8]:
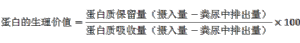
糞便中排出的蛋白質,爲攝入而不被吸收的部分:尿中排出的蛋白質,爲吸收而未被利用部分。一般以測量糞、尿中含氮量來換算。[8]
蛋白質的生理價值越高,說明在體內的利用率越高,但實際上沒有達到100的。常見食物中,雞蛋的生理價值最高,達到94,牛奶爲85,豬肉74,牛肉76,羊肉69,魚肉83,大豆64,大米77,小麥67,玉米60,花生59。[8]
蛋白質生理價值的高低,取決於其所含氨基酸的組成。食物中所含氮基酸的成分和比例越接近於人體需要,其生理價值就越高,反之,就越低。爲了提高蛋白質的生理價值,可以把兩種或兩種以上蛋白質混合食用,使其中所含氨基酸互爲補充,儘量接近人體需要的種類和比例。如大豆和玉米混合食用、動植物蛋白混合食用,這樣可以取長補短,提高生理價值。一般來說,搭配的種類越多越好。[8]
10 蛋白質組學與生物信息學
在一定時間內一個細胞或一類細胞中存在的所有蛋白質被稱爲蛋白質組,研究如此大規模的數據的領域就被稱爲蛋白質組學,與基因組學的命名方式相似。蛋白質組學中關鍵的實驗技術包括用於檢測細胞中大量種類蛋白質相對水平的蛋白質微陣列技術,和用於系統性研究蛋白-蛋白相互作用的雙雜交篩選技術。此外,還有探究所有組分之間的可能的生物學相互作用的相互作用組學,以及系統性地解析蛋白質結構,並揭示其中的可能的折迭類型的結構基因組學。
目前各類數據庫中含有許多種類的生物體的大量的基因組和蛋白質組數據,包括人類基因組的數據;要對這些數據進行分析已獲得有用的信息,就需要用到近來來發展起來的新興學科──生物信息學。生物信息學的發展使得現在研究者可以通過序列比對有效地鑑定相關生物體的同源蛋白質。利用序列信息推導工具(sequence profiling tool)可以對更特異地對序列進行分析,如限制酶圖譜、針對核酸序列的開放閱讀框架分析以及二級結構預測。利用特定軟件,如ClustalW,可以從序列信息中可以構造出系統樹並進行進化分析。生物信息學的研究領域包括集合、註釋和分析基因組和蛋白質組數據,這就需要應用計算技術於生物學問題,如基因識別和支序分類。
11 蛋白質的結構預測與模擬
作爲結構基因組研究的互補,蛋白質結構預測的目標是發展出有效的能夠提供未知結構(未通過實驗方法得到)蛋白質的可信的結構模型。目前最爲成功的結構預測方法是同源建模;這一方法是利用序列相似的蛋白質(已知結構)的結構作爲“模板”。而結構基因組的目標正是通過解析大量蛋白質的結構來爲同源建模提供足夠的模板以獲得剩餘的未解析的同源蛋白結構。從序列相似性較差的模板計算出精確的結構模型對於同源建模法還是一個挑戰,問題在於序列比對準確性的影響,如果能夠獲得“完美”的比對結果,則能夠獲得精確的結構模型。[28]許多結構預測方法已經被用於在蛋白質工程領域,在這些方法的幫助下,研究者們設計出一些新型的蛋白質折迭類型。更爲複雜的結構計算是預測蛋白質分子之間的相互作用,需要應用分子對接法和蛋白-蛋白相互作用預測。
利用分子動力學的方法可以模擬蛋白質的折迭和結合過程。通過分佈式計算,如Folding@Home計劃,爲分子動力學模擬注入了活力。小的α螺旋蛋白結構域,如villin的頭部和HIV輔助蛋白已經成功地在計算機中(in silico)被模擬。將分子動力學和量子力學相結合的方法已經被用於探索視網膜色素分子的電子態
12 外部鏈結
13 參考資料
- ^ [1] 中華人民共和國國家衛生和計劃生育委員會.WS/T 476—2015 營養名詞術語[Z].2015-12-29.
- ^ [2] 高崇新等編著.養生保健湯茶譜[M].北京:中國林業出版社,2004:284.
- ^ [3] ."在線新華字典查詢──朊".
- ^ [4] ."PDB Current Holdings Breakdown".
- ^ [5] Branden C, Tooze J.(1999)."Introduction to Protein Structure 2nd ed".Garland Publishing: New York, NY
- ^ [6] Gonen T, Cheng Y, Sliz P, Hiroaki Y, Fujiyoshi Y, Harrison SC, Walz T.(2005)."Lipid-protein interactions in double-layered two-dimensional AQP0 crystals".Nature 438(7068):633-8
- ^ [7] 高崇新等編著.養生保健湯茶譜[M].北京:中國林業出版社,2004:285.
- ^ [8] Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipurksy SL, Darnell J.(2004)."Molecular Cell Biology 5th ed".WH Freeman and Company: New York, NY