3 概述
垂體腺瘤是一組從垂體前葉和後葉及顱咽管上皮殘餘細胞發生的腫瘤,是常見的良性顱內內分泌腫瘤,約佔顱內腫瘤的10%。可發生於任何年齡,多見於40-50歲。可分爲功能性(分泌性)垂體瘤(包括催乳素瘤、生長激素瘤、ACTH瘤、Nelson綜合徵(ACTH-MSH瘤)、促甲狀腺激素瘤、混合型腺瘤)和無功能性(非分泌性)垂體瘤(即“嫌色細胞瘤”,佔20-35%)。
Marie於1886年首先描述肢端肥大症,1887年Minkowski論及肢端肥大症由垂體腺排列異常引起,1900年Benda認識到伴肢端肥大症的嗜酸性腺瘤並證明腫瘤是來自腺垂體細胞的真性腫瘤。1901年Frankel等研究肢端肥大症後提出該症有垂體嫌色細胞的增生以及垂體功能的亢進,而1908年Marburg認識到無分泌垂體腺瘤有垂體功能低下的臨牀表現。1909年Cushing進一步闡明和解釋了分泌性嗜酸性腺瘤引起垂體功能亢進(肢端肥大症)及無功能腺瘤(嫌色細胞瘤)導致垂體功能低下之間的臨牀關係,並於1912年明確提出垂體高分泌與低分泌的相反症羣,描述了它們的組織病理學基礎。以後的幾十年間,Cushing及其同道們主要研究垂體腺瘤的病理、臨牀特徵以及內分泌異常,使垂體腺瘤的總體知識進一步擴大和豐富。直至20世紀下半葉,垂體腺瘤的突出問題擺到了設計有效的治療方法上,而20世紀60年代主要放在進一步完善治療的安全性和有效性上。
3.壓迫蝶鞍區結構,如視交叉、視神經、海綿竇、腦底動脈、下丘腦、第三腦室,甚至累及額葉、顳葉、腦幹等,導致相應功能的嚴重障礙。
近20年來,垂體腺瘤的臨牀和研究工作有了飛速的發展,但仍有不少難題有待繼續總結研究。
6 別名
hypophyseal adenoma;腦下垂體腺瘤
9 流行病學
垂體腺瘤可發生於任何年齡,但以成人多見,約70%的病人始發年齡在30~50歲,只有3%~7%的病人始發年齡在20歲以下。一般來說,起病年齡越小,腫瘤的侵襲性(invasiveness)越大,預後也就越差。垂體腺瘤的發病率與性別有一定關係,國外資料顯示,成年女性的年發病率約爲70/100萬;成年男性的年發病率約爲28/100萬,男女之比約爲1∶2。絕大多數垂體腺瘤無臨牀症狀,爲隱性垂體腺瘤;只有2%~2.5%的垂體腺瘤有臨牀症狀,爲顯性垂體腺瘤,佔顱內腫瘤的8%~15%。近20年來,垂體腺瘤的臨牀病例增加甚多,其原因是內分泌診斷技術的發展、神經放射檢查設備的進步、電鏡的應用等。
10 病因
目前認爲垂體腺瘤來源於腺垂體細胞,如單激素細胞腺瘤如生長激素、泌乳素細胞腺瘤等來源於分泌相應激素的腺細胞,而對一些多激素來源的腺瘤還有爭議。過去一直認爲一種細胞只能分泌一種相應的激素,20世紀70年代Zimmemrman用PAP法研究5例正常人垂體組織證實,在同一種細胞內具有能與生長激素和泌乳素兩種激素抗體結合的顆粒,說明兩種激素可以同時在同一垂體細胞內產生。Midyley認爲促卵泡素和黃體生成素可可由同一種細胞分泌。Horvath報告了9例垂體泌乳素、生長激素細胞腺瘤。Kovacs也指出在非腫瘤情況下這種雙激素分泌細胞同樣散在於腺垂體中,只是數量較少而已。上述研究結果說明,垂體內一種細胞不是隻能分泌一種相應的激素。這類多激素細胞腺瘤,稱之爲“異源性垂體腺瘤”。其發生機制一般認爲與瘤細胞的基因表達有關,可能牽涉到基因的不穩定性和優勢選擇,也可能是細胞表型的變化,而沒有基因潛能的變化。
近年來認爲嫌色細胞腺瘤來源於分化程度較低或未分化的細胞,這種細胞可以向其他分泌激素的細胞轉化,臨牀上可伴有相應激素分泌增多的症狀,電鏡下可見分泌顆粒。Leuis認爲這類非功能垂體腺瘤雖有分泌顆粒,但瘤細胞分化較低,未能形成有生物效應的激素。Kovacs認爲這種瘤細胞能夠合成少量的激素或產生無活性的激素前體;或爲目前尚未能檢測的激素。Betzdorf測定瘤細胞組織培養液內生長激素的濃度,發現一些嫌色性細胞瘤與嗜酸性細胞瘤同樣是升高的,這就可解釋一些嫌色細胞腺瘤爲什麼伴有肢端肥大症。
11 發病機制
垂體腺瘤的發病機制研究可歸爲兩大學說:一爲垂體內在異常學說,另一爲下丘腦調節機制失常學說。採用分子生物學方法研究後,使長期以來一直有爭議的垂體學說和下丘腦學說趨向於統一。目前認爲垂體腺瘤的發展可分爲兩個階段——起始階段和促進階段,即垂體細胞先發生突變,然後在內外因素的促進下突變的細胞增生,發展爲垂體腺瘤。
11.1 垂體內在異常
11.1.1 (1)基因突變
垂體細胞的基因突變在垂體腺瘤發生中的作用近年受到高度重視,目前,已肯定的主要爲一些與細胞信號轉導有關的基因的點突變,這些基因包括G蛋白Gs的α亞單位(Gsα)基因、ras原癌基因、蛋白激酶C的α亞型(PKCα)基因等。
Gsα是最先明確與垂體腺瘤有關的基因。這方面的研究始於20世紀80年代中期,當時有人發現約1/3的GH腺瘤腺苷酸環化酶(adenosine cyclase,AC)活性及cAMP水平升高且不受GHRH和霍亂毒素(可通過刺激Gs而激活AC)的調節。稍後的研究證實:GH瘤細胞內AC的激活乃Gsα的突變所致。Gsα有2個突變熱點,其一使201位精氨酸變成半胱氨酸或組氨酸;另一使227位谷氨醯胺變成精氨酸或亮氨酸。此2位點對於Gsα的GTP酶活性極爲重要,突變使得Gsα的GTP酶活性下降,導致Gs信號系統持續地處於激活狀態,於是cAMP產生增加。在垂體細胞,cAMP不僅與激素的合成和釋放有關,而且參與細胞的增生。有人發現,霍亂毒素轉基因小鼠的垂體出現增生,說明Gs信號系統的激活確實可引起垂體細胞的增殖。目前已知,約40%的GH瘤和約10%的無功能垂體腺瘤與Gsα的突變有關。Gsα基因現已被視爲原癌基因,稱爲gsp。Gi也是一種G蛋白,其功能與Gs相反。Gi的突變亦與垂體腺瘤有關。有人在32例ACTH瘤中發現2例,22例無功能垂體腺瘤中發現3例有Giα亞單位的突變。Giα也已被視爲原癌基因,稱爲gip。其他G蛋白與垂體腺瘤的關係尚不清楚。
ras原癌基因的產物P21ras在細胞的信號轉導中具有重要的作用。現已發現,ras原癌基因的激活是許多人類腫瘤的重要原因。Ras基因的突變在人類垂體腺瘤中也具有一定的意義,有人研究了11例無功能垂體腺瘤、6例GH瘤和2例PRL瘤,只在1例PRL瘤中發現有ras的突變,這提示ras基因的突變在人類垂體腺瘤中較爲罕見。其後的一些研究也得到相似的結論。目前認爲,儘管ras原癌基因的突變在人類非內分泌腫瘤中具有重要的地位,但不是人類內分泌腫瘤的常見病因。
PKC是一類在細胞信號轉導中發揮重要作用的蛋白激酶。Alvaro等發現,垂體腺瘤組織的PKC表達水平較正常垂體組織高;侵襲性垂體腺瘤PKC的表達更高。他們還發現一些侵襲性垂體腺瘤的PKCα有突變,使其294位天冬氨酸變成甘氨酸,這一突變位點正好位於PKCα分子的V3區,此區含有Ca2結合位點,上述突變導致PKCα過度激活。PKC可調節細胞外多種蛋白酶、膠原酶的活性,PKC活性的升高可促進腫瘤向正常組織的浸潤。故目前認爲,PKCα的突變與垂體腺瘤的侵襲性有關。
研究顯示,垂體瘤組織的PTTG表達顯著增加,提示PTTG在垂體瘤的形成和發展過程中具有一定的作用。目前,對PTTG的作用機制尚不清楚,但有關的研究已提供了一些信息。人PTTG蛋白含有SH3入塢基序(motif),提示它與細胞的信號傳導有關。人PTTG蛋白還可誘導成纖維細胞生長因子(FGF)的表達,而FGF可促進細胞的生長和血管生成。因此,PTTG蛋白可能通過影響細胞信號轉導和促進FGF的表達而發揮致瘤作用。
有些研究顯示,一些垂體腺瘤瘤細胞cmyc、c-fos的表達增加,提示這些原癌基因可能也參與垂體腺瘤的發生發展。垂體腺瘤細胞可產生許多生物活性物質,包括下丘腦促垂體釋放激素(TRH、CRH、GHRH)、生長因子等,這些生物活性物質在垂體腺瘤的發生發展中可能也起一定的作用。
11.1.2 (2)激素受體的異常
下丘腦激素或因子可作用於垂體細胞表面的受體而發揮效應,這些受體的數目和(或)親和力的改變、表達異常、受體-G蛋白-效應器偶聯異常在垂體腺瘤的發生中具有重要的作用。
①多巴胺受體:多巴胺受體有DL、D2、D3、D4、D55種亞型,它們均爲G蛋白偶聯受體。垂體細胞表達的爲D2亞型,它有D2A和D2B 2種異形體,這2種異形體是由於mRNA剪接的不同而形成的。D2B較D2A略短,其信號轉導的能力較D2A爲低。
②生長抑素(SS)受體:SS受體(SSTR)有5種亞型:SSTR1、SSTR2、SSTR3、SSTR4和SSTR5,它們與SS-14和SS-28都能高親和力地結合。SS類似物奧曲肽(octeotide)與SSTR2和SSTR5的親和力較高,與SSTR3的親和力中等,與SSTR1和SSTR4的親和力則較低。SS及其類似物抑制GH釋放的作用主要由SSTR2介導:SSTR2激活後可抑制AC的活性,使K通道開放,細胞超極化,於是細胞膜上的電壓依從性Ca2通道關閉,引起[Ca2]i下降,從而抑制GH的釋放。SS及其類似物抑制GH細胞增生的作用主要由磷酸酪氨酸磷酸酶的激活來實現,由SSTR2和SSTR5共同介導。
GH瘤細胞表達多種SSTR亞型,其中比較重要的爲SSTR2和SSTR5,此2亞型激活後可使[Ca2]i和cAMP水平降低,故既能抑制GH的釋放又能阻止GH細胞的增生。體外結合實驗表明:SS結合位點的數目與腫瘤對SS類似物的反應性相關,結合位點越多則SS類似物的治療效果越好。gsp突變性GH瘤的SS結合位點一般較多,此種腫瘤對奧曲肽的反應較好。
用核酸雜交技術在PRL瘤、ACTH瘤、TSH瘤及無功能垂體腺瘤中也檢測到各種亞型SSTR的mRNA,說明這些腫瘤細胞中也有SSTR的表達。這些受體激活後也可引起[Ca2]i和cAMP水平的下降,提示它們也具有功能。但是,有些腫瘤細胞上的SSTR興奮後卻使[Ca2]i升高,這可能因SSTR-G蛋白-效應器偶聯異常所致。
③TRH受體:TRH受體也屬於GPCR,它與Gq偶聯,興奮後可激活磷脂酶Cβ(PLCβ),使[Ca2]i升高。大多數PRL瘤細胞存在高親和力TRH受體,但這些腫瘤對TRH無反應,原因未明,推測可能與受體後缺陷有關。TSH瘤罕見,是否含有TRH受體尚不清楚。有些學者基於大多數TSH瘤對TRH無反應這一事實,認爲TSH瘤不表達TRH受體或雖表達但表達產物無功能。與PRL瘤和TSH瘤相反,不少GH瘤(40%~50%)、無功能垂體腺瘤(30%~50%)、ACTH瘤(20%~30%)、促性腺激素瘤(70%~80%)對TRH有反應,說明這些腫瘤表達TRH受體,這一點雖無治療意義但卻有一定的診斷價值。
④GnRH受體:GnRH受體也屬於GPCR,受體興奮後可激活磷脂酶Cβ,使[Ca2]i升高,產生一系列效應。絕大多數促性腺激素瘤表達GnRH受體,對GnRH有反應。有些促性腺激素瘤對GnRH無反應,原因可能是這些腫瘤的GnRH受體後信號轉導系統有缺陷。促性腺激素瘤細胞的GnRH受體同正常的GnRH受體有明顯的不同:後者在受到持續性GnRH刺激時表現出失敏現象,即不再對GnRH有反應;前者無失敏現象,即對GnRH的持續刺激仍有反應。由於促性腺激素瘤的GnRH受體不存在失敏現象,故長效GnRH類似物對這些腫瘤效果不佳。
有15%~20%的GH瘤和ACTH瘤也表達GnRH受體,這些患者在給予GnRH後血GH或ACTH水平明顯升高,說明這些受體是有功能的。大多數無功能垂體腺瘤患者在接受GnRH後血促性腺激素和(或)其亞單位水平升高,說明無功能垂體腺瘤也存在GnRH受體。
⑤GHRH受體:大多數GH瘤表達有GHRH受體,這些腫瘤對GHRH有反應。核酸雜交研究顯示,GH瘤對GHRH的反應性與GHRH受體mRNA水平之間無相關關係。其他垂體腺瘤如PRL瘤、ACTH瘤及無功能垂體腺瘤也含有GHRH受體,但表達水平低,這些腫瘤對GHRH的反應也差。GHRH受體無失敏現象。
⑥CRH受體:CRH受體也屬GPCR,受體活化後可激活AC。ACTH瘤表達有CRH受體,這是它們對CRH有反應的基礎。ACTH瘤的CRH受體既不受皮質醇的調節,也不受CRH的調節。非ACTH瘤罕有CRH受體的表達。
11.2 調節機制的失常
很早就有人提出,激素調節機制的失常是引起垂體腺瘤的重要原因,支持這一學說的證據有:下丘腦GHRH瘤和CRH瘤可分別引起垂體GH瘤和ACTH瘤;異位GHRH也能引起GH瘤,惟作用較下丘腦GHRH瘤爲弱(原因可能是後者產生的GHRH直接進入垂體門脈系統,故垂體局部GHRH濃度較高)。近年的動物實驗證明:GHRH轉基因小鼠極易發生GH瘤。這些均說明下丘腦促垂體釋放激素在垂體腺瘤的發生中具有重要作用。那麼,下丘腦抑垂體激素(因子)的缺乏是否也能引起垂體腺瘤呢?這方面尚缺少有說服力的證據。一些研究顯示,PRL瘤的病人下丘腦多巴胺水平並無下降,提示下丘腦抑制因子的缺乏在垂體腺瘤的發病中可能不起重要的作用。
外周靶腺激素水平的下降可減弱其對垂體的抑制作用,從而促進相應的垂體細胞的增生,如Cushing病患者切除雙側腎上腺後可使原已存在的ACTH微腺瘤轉變成大腺瘤(Nelson綜合徵)。有研究指出,原發性性腺功能減退者垂體腺瘤的發病率並不高於普通人羣;原發性甲狀腺功能減退者雖有TSH細胞的增生但罕有TSH瘤,這些提示外周靶腺激素的缺乏不是垂體腺瘤發生的始動因素。
近年,一些學者運用分子生物學技術對垂體腺瘤細胞的克隆性作了研究,這使得人們對垂體腺瘤的發生機制有了新的認識。根據下丘腦調節失常學說,垂體腺瘤應爲多克隆起源;根據垂體起源學說,垂體腺瘤應爲單克隆起源。Alexander等的研究表明,幾乎所有垂體腺瘤都是單克隆起源的,這一結果有力地支持了垂體起源學說。然而,這並不意味着下丘腦調節機制失常在垂體腺瘤的發生中不起作用。事實上,垂體腺瘤的發生可能是多階段的(multistage),其始因爲垂體細胞的內在異常(如基因突變),在此基礎上如下丘腦調節機制發生紊亂則進一步刺激垂體細胞的增殖,最後形成腫瘤。下丘腦調節機制失常可能爲形成垂體腺瘤的促進因素。但是,長期過量的下丘腦促垂體釋放激素的刺激可誘使相應的垂體細胞發生突變,這可解釋何以下丘腦促垂體激素瘤能引起相應的垂體腺瘤。
隨機屍檢和用高分辨率MRI所作的人羣普查結果表明,微小的無症狀垂體腺瘤是相當常見的(約10%),但臨牀顯性垂體腺瘤的患病率則很低(1/500~1/1000),這說明垂體內在異常作爲垂體腺瘤發生的始發事件是相當常見的,但必須同時合併存在其他的促進垂體細胞增生的因素方可進一步形成顯性垂體腺瘤。影響垂體細胞增生的因素可能也不限於下丘腦激素或因子,垂體局部的自分泌/旁分泌因子及某些性腺肽類也起着重要的作用,它們可能也參與垂體腺瘤的發生發展。
有一些研究認爲垂體腺瘤與病毒感染有關。有報道稱,接種鼠多瘤病毒的小鼠易發生垂體腺瘤;多瘤中間T抗原(polyomamiddle T antigen)轉基因小鼠也易患垂體腺瘤。但這些研究未能爲人類的流行病學資料所證實,說明病毒感染與人類垂體腺瘤的關係不大。
術中看到的正常垂體爲橘紅色,質韌,而腺瘤常爲紫紅色且質軟,有的呈爛泥狀,當有變性時,瘤組織可呈灰白色;有的伴瘤組織壞死、出血或囊性變。在光鏡下結合屍檢材料,垂體腺瘤外有邊界,但無包膜。大的腺瘤部分可以垂體的硬膜爲包膜。瘤組織不同於腺垂體組織。一般說,瘤細胞形態較一致,但呈圓形、立方形或多角型的瘤細胞的大小差異很大:小的與淋巴細胞相似,僅在覈外有少量胞質,這些多是未分化的幹細胞;大的胞質較多,其中可充滿一些顆粒或呈泡沫狀,瘤細胞的大小較一致,亦常見大核和雙核,偶爾環狀核即核凹入,把一部分胞質包入核內,很少看到核分裂。近些年來,由於內分泌激素測定的進步和電子顯微鏡下觀察超微結構以及染色方法的改進、特異性免疫組織化學染色在病理上的廣泛應用,現在一個比較好的把形態(組織化學和電鏡)和功能(臨牀表現)相結合的垂體腺瘤的新分類已經形成。這個新分類是:
①泌乳素細胞腺瘤(PRL腺瘤):PRL腺瘤佔垂體腺瘤的40%~60%,臨牀表現女性爲閉經-溢乳(Forbes-Albright綜合徵),男性爲陽痿,性功能減退等。血漿中PRL水平升高。瘤細胞多爲嫌色性,呈乳突狀排列,瘤內可有小鈣化竈。少數瘤細胞爲嗜酸性。在電鏡下,分泌顆粒多少不等。大多數瘤細胞內分泌顆粒較少,體積較小,在120~300nm;體積較大的,最大長徑達1200nm,形狀不規則,可爲圓形、卵圓形、短桿狀、淚滴狀。電子密度大而均勻,在覈旁Golgi體附近與粗麪內質網一起形成泌乳素小體。少數分泌顆粒可在胞膜外,如分泌顆粒錯位胞溢。用免疫組織化學染色呈PRL陽性。較長期溴隱亭治療後可導致腫瘤鈣化,內分泌澱粉樣變沉着,血管周圍和間質纖維化,可影響手術療效。泌乳素細胞增生引起高泌乳素血癥,極罕見於外科標本中,偶在腫瘤周圍可見到。
②生長激素細胞腺瘤:佔分泌性腺瘤的20%~30%,臨牀主要表現爲肢端肥大症或巨人症,血漿中GH水平升高,並引起全身代謝紊亂。在HE染色中,瘤細胞可呈強或弱嗜酸性,橘黃G染色(+),PAS(-)。在電鏡下,根據細胞分泌顆粒的多少分爲:A.濃密顆粒型:顆粒直徑大多爲200~350nm,顆粒多而密集、圓形、密度大而均勻。其他細胞器很少。B.稀疏顆粒型:顆粒直徑大多在100~250nm,顆粒少而散在,胞核形態變異較大,在覈凹入部有圓形纖維小體,含有數目不等、長短不一的微纖維,核旁常見中心粒。用免疫組化染色,細胞質內GH陽性,其染色深淺與細胞內GH分泌顆粒的多少成正比。濃密型和稀疏型分泌顆粒在臨牀和生化上無區別,但在年輕人稀疏型腫瘤可能生長較快、較大,切除較困難,也容易復發。
③促腎上腺皮質激素細胞腺瘤:佔垂體腺瘤的5%~15%,臨牀表現爲皮質醇增多增多症(Cushing綜合徵),可引起全身脂肪、蛋白質代謝和電解質紊亂。當切除腎上腺皮質後可出現Nelson綜合徵,多數腺瘤較大,並有侵蝕現象。微腺瘤瘤體埋在腺垂體中後部;或由於ACTH細胞增生(結節性,瀰漫性,多數爲混合性)。瘤細胞可爲嗜鹼性或嫌色性。PAS(+),橘黃(-),紅素(-)。瘤細胞常呈篩網狀排列。在電鏡下,細胞內分泌顆粒多少不等,直徑150~450nm,電子密度極不均勻,深淺不等,或有中心空泡,核旁有成束的平行排列的微纖維積聚,可伴Crooke透明變性細胞。免疫組織化學染色細胞呈ACTH陽性。
④促甲狀腺素細胞腺瘤:此瘤罕見,不足1%。血漿中TSH升高。臨牀表現爲甲亢或甲低。瘤細胞較小,PAS(+)。在電鏡下瘤細胞顆粒小而圓、直徑爲50~150nm,密度不均勻。胞質中散在平行排列的微小管。用免疫細胞化學染色呈TSH陽性。
⑤促性腺激素腺瘤:很罕見。血中性激素升高,臨牀上可有性功能失調,如陽痿、性慾減退等表現。很少單獨存在,常與其他激素細胞如PRL細胞並存。分泌顆粒圓而小,直徑150~250nm。用免疫細胞化學染色示LH和FSH陽性。
⑥多分泌功能細胞腺瘤:在臨牀上腺瘤內含有2種或2種以上的分泌激素細胞。有多種內分泌功能失調症狀的混合徵候。最常見的是GH+PRL,此外還有GH+ACTH,PRL+ACTH,PRL+LH或FSH,GH+ACTH+TSH。這些細胞可用免疫細胞化學染色法顯示出。
⑦無內分泌功能細胞腺瘤:佔垂體腺瘤的20%~35%。這種腫瘤臨牀上無明顯內分泌失調症狀。當瘤體較大時,可出現視交叉壓迫和顱內壓增高症狀或伴垂體功能低下的症狀。本瘤可包括大嗜酸性細胞腺瘤和未分化細胞瘤,Kovacs等又稱裸細胞腺瘤。胞質較豐富,染色較淡,無特殊染色顆粒。瘤細胞圍繞血管及間質,呈乳突狀排列,有的可見腺樣分化,或彌散生長,胞核圓,染色質豐富。瘤內血管或血竇較豐富,易發生出血。若用免疫細胞化學方法,腫瘤內可含GH、PRL或GnH細胞,分泌顆粒小而稀疏,直徑爲50~200nm,無細胞排粒作用,所測激素多爲糖蛋白類激素爲α-亞單位。部分亞單位激素因無生物活性而無臨牀症狀。
12 垂體腺瘤的臨牀表現
垂體腺瘤瘤細胞的倍增時間爲100~700天,故腫瘤生長緩慢,這種生物學特徵決定了垂體腺瘤一般起病潛隱,早期可無症狀。有的腫瘤甚至自始至終沒有症狀,死後屍檢始被發現。垂體腺瘤主要有顱內神經功能障礙及內分泌功能障礙兩方面表現:
12.1 神經功能障礙
垂體腺瘤引起的神經症狀直接與腫瘤大小及其生長方向有關。一般無分泌功能腺瘤在確診時往往腫瘤體積已較大,多向鞍上及鞍外生長,臨牀神經症狀多較明顯。分泌性腺瘤因早期產生內分泌亢進症狀,確診時大多體積較小,腫瘤多位於蝶鞍內或輕微向鞍上生長,臨牀不產生或僅有輕微的神經症狀。
12.1.1 (1)頭痛
約2/3無分泌性垂體腺瘤病人可有頭痛,但不太嚴重。早期頭痛是由於腫瘤向上生長時,牽拉由三叉神經第1支支配的鞍膈所引起。頭痛位於雙顳部、前額、鼻根部或眼球後部,呈間歇性發作。腫瘤穿破鞍膈後頭痛可減輕或消失。晚期頭痛可能由於腫瘤增大影響顱底硬膜、動脈環、大血管、大靜脈竇等痛覺敏感組織所引起。如涉及由三叉神經或後組腦神經供應的硬腦膜,則頭痛位於前頭部或後枕部。腫瘤向第三腦室生長,阻塞室間孔引起顱內壓增高,可引起瀰漫性頭痛。有時腫瘤內出血或腫瘤的囊腫破裂可引起急性劇烈頭痛。GH腺瘤引起的頭痛明顯而頑固,大多爲全頭痛,原因除腫瘤向上生長牽拉鞍膈外,主要是因爲整個顱骨及硬膜增生,牽拉刺激感覺神經所致。
12.1.2 (2)視神經受壓症狀
垂體腺瘤向上方生長可將鞍膈頂高或突破鞍膈向上壓迫視神經交叉而產生視力、視野改變等。
①視野改變:視交叉與垂體的位置變異較大,故視野變化頗不一致。由於視網膜纖維及黃斑纖維在視交叉中的排列又有一定位置,因此產生視野缺損亦有一定順序。腫瘤由鞍內向上生長可壓迫視交叉的下方及後方,將視交叉推向前上方,甚至將視交叉豎起,此時首先受壓迫的是位於交叉下方的視網膜內下象限的纖維,引起顳側上象限視野缺損。腫瘤繼續生長可累及視交叉中層的視網膜內上象限纖維,因而產生顳側下象限視野缺損。此時即爲雙顳側偏盲。有時因視網膜內上象限的纖維有一部分混雜在不交叉的纖維中,位於視交叉側面,故在顳側偏盲中可保留小片視野,稱“顳側小島”。壓迫及外側的視網膜外上象限的纖維(不交叉),可產生鼻側下象限的視野缺損。位於視交叉的最外側的視網膜外下象限的纖維最不易受到壓迫,所以鼻側上象限的視野常得以保留直至最後受壓後才喪失。
如腫瘤位於視交叉的後方,它可先累及位於視交叉後部的黃斑纖維,而出現中心視野暗點,稱暗點型視野缺損。其發展順序亦與周邊視野相同,並逐漸與周邊視野缺損相融合。早期病例如周邊視野影響較輕時,應同時檢查中心視野暗點,纔不致誤診。如腫瘤向一側生長,壓迫視束,則臨牀可出現同向性偏盲,這種情況少見。少數視交叉前置者,腫瘤向鞍後上方生長,臨牀可無視野障礙。
必須注意,視野改變首先是有色視野缺損,其中紅色視野缺損出現最早,故對早期病例,應用小試標或有色視標檢查最易發現問題,從而得出早期診斷。一般情況下,視野改變與腫瘤大小是相平行的。但如果腫瘤發展很慢,即使腫瘤很大,由於視神經可以避讓,可不出現視野變化;如腫瘤生長很快,常首先出現暗點。
②視力改變:視力的減退與視野缺損並不平行,兩側也不對稱,常到晚期纔出現,並可發展到失明。這主要是視神經原發性萎縮的結果。
③視盤改變:由於視神經受壓及血循環障礙,大多數病人有視盤原發性萎縮,且多爲雙側同時開始,但程度不等。少數可一側先開始。萎縮多先由鼻側開始。少數病例因有阻塞性腦積水、顱內壓增高、視網膜靜脈迴流發生障礙,可出現視盤水腫。但如已發生視盤原發性萎縮者,即使再有顱高壓,也不致產生視盤水腫。因爲此時視神經周圍的蛛網膜鞘已被閉合,阻止了視盤水腫的出現。少數病例腫瘤偏於一側,可產生患側視神經原發萎縮,對側視盤水腫(Foster-Kennedy綜合徵)。
12.1.3 (3)鄰近症狀
①向外側發展:壓迫或侵入海綿竇,可產生第Ⅲ、Ⅳ、Ⅵ對腦神經及三叉神經第1支的障礙,其中以動眼神經最常受累,引起一側眼瞼下垂、眼球運動障礙。腫瘤沿頸內動脈周圍生長,可漸使該動脈管腔變狹或閉塞,而產生偏癱、失語等。腫瘤長入三叉神經半月節囊中,可產生繼發性三叉神經痛。長到顱中窩可影響顳葉,而有鉤回發作,出現幻嗅、幻味、輕偏癱、失語等症狀。
②向前方發展:可壓迫額葉而產生精神症狀,如神志淡漠、欣快、智力銳減、健忘、大小便不能自理、癲癇、單側或雙側嗅覺障礙等。
③向後方發展:可長入腳間窩,壓迫大腦腳及動眼神經,引起一側動眼神經麻痹,對側輕偏癱即 Weber 綜合徵等表現。甚至可向後壓迫導水管而引起阻塞性腦積水。
④向上方生長:影響第三腦室,可產生下丘腦症狀,如多飲、多尿、嗜睡和精神症狀,如近事遺忘、虛構、幻覺、定向力差、遲鈍,以及視盤水腫、昏迷等。
⑤向下方生長:可破壞鞍底長入蝶竇、鼻咽部,產生反覆少量鼻出血、鼻塞及腦脊液鼻漏等。
⑥向外上生長:可長入內囊、基底節等處,產生偏癱、感覺障礙等。
12.2 內分泌功能紊亂
各型分泌性腺瘤可分泌過多的激素,早期即可產生不同的內分泌亢進症狀。無分泌功能腺瘤可壓迫及破壞腺垂體細胞,造成促激素減少及相應靶細胞功能減退,臨牀產生內分泌功能減退症狀。少數內分泌性腺瘤病例在病程晚期亦可產生垂體功能減退。
12.2.1 (1)PRL腺瘤
多見於女性年輕者(20~30歲),男性病例約佔15%。因PRL增高抑制下丘腦促性激素釋放激素的分泌,使雌激素降低,LH、FSH分泌正常或降低。亦有認爲高PRL血癥影響正常雌激素的負反饋作用及黃體酮的合成。臨牀典型表現爲閉經-溢乳-不孕三聯徵(稱Forbes-Albright綜合徵),亦有少數不完全具備以上三聯徵者。PRL增高至60μg/L時可出現月經紊亂,如月經過少、延期,或有月經但不排卵、黃體酮不足、黃體期不顯著等。隨着PRL進一步增高,可出現閉經。閉經病例多同時伴有溢乳,但大多數擠壓乳房時方流出少量乳汁;也有部分病人不伴有溢乳。其他尚可有性慾減退、流產、肥胖、面部陣發潮紅等。在青春期患病者,可有發育期延遲、原發閉經。因雌激素可促進PRL細胞增生,故臨牀可見妊娠後發生PRL瘤。口服避孕藥(特別是低雌激素活性者)與PRL瘤的發生無關。
男性高PRL血癥者可致血睾酮生成及代謝障礙、血睾酮降低。精子生成障礙、數量減少、活力降低、形態異常。臨牀有陽痿、性功能減退、不育、睾丸縮小,少數可有毛髮稀少、肥胖、乳房發育及溢乳(約佔20%)等。
女性病人多能早期確診,有2/3病例爲鞍內微腺瘤(腫瘤直徑<10mm),神經症狀少見。男性病人往往未注意早期性慾減退症狀,因此在確診時大多腫瘤較大並向鞍上生長,產生頭痛及視路症狀等。高PRL血癥的原因甚多,必須在確診本症前排除其他原因。
12.2.2 (2)GH腺瘤
GH的促進生長作用主要是通過肝臟產生的作用於含有GH受體的各種細胞來實現的。GH腺瘤發生在青春期骨骺閉合以前表現爲“巨人症”,發生在成人則表現爲“肢端肥大症”。此症最早由Marie(1886)描述,病程發展緩慢,常達6~9年方纔確診。
①巨人症:病人(多在15歲以前)早期身高異常,甚至可達2 米以上,且生長極爲迅速,體重遠超過同齡者。外生殖器發育似成人,但無性慾,毛髮增多,氣力極大。成年後約有40%的病人可出現肢端肥大改變。晚期可有全身無力、智力減退、毛髮脫落、皮膚乾燥皺縮、嗜睡、頭痛、尿崩等症狀。病人多早年夭折,平均壽命20餘歲。
②肢端肥大症:病人的手足、頭顱、胸廓及肢體進行性增大,手、足掌肥厚,手指增粗,遠端呈球形,前額隆起,眶嵴、顴骨及下頜明顯突出,形成所謂“頜突畸形”。牙縫增寬,下頜牙前突較遠,口脣變厚,鼻樑寬而扁平,耳廓變大,帽子、鞋襪、手套經常更換大號。皮膚粗糙,色素沉着,毛髮增多,頭皮鬆垂,多油脂,多汗。女性病人外貌似男性。有的病人因脊柱過度生長而後凸,鎖骨、胸骨過度增長而前凸,亦可因胸腔增大而呈桶狀胸。由於舌、咽、軟齶、懸雍垂均肥大,說話時聲音嘶啞,睡眠時易打鼾。呼吸道管壁肥厚可致管腔狹窄,肺功能受影響。心臟肥大,少數可發展到心力衰竭。血管壁增厚,血壓增高,有時可發生卒中。其他如胃腸、肝脾、甲狀腺、胸腺等均可肥大。因組織增生可引起多處疼痛,除頭痛外病人早期常可因全身疼痛而誤診爲“風溼性關節炎”。因腕橫韌帶增厚可壓迫正中神經產生腕管綜合徵。脊柱增生使椎間孔狹小而壓迫脊神經根,引起背痛或感覺異常。因骨骼、關節、軟骨增生可引起肢體痛、關節痛、活動受限等。因椎管增生性狹窄,可產生脊髓壓迫症。少數女性有月經紊亂、閉經(伴溢乳者可能爲GH-PRL混合性腺瘤)。男性早期性慾亢進,晚期則減退,以致無慾、陽痿,有時生殖器萎縮。兩性均可不育。約20%病人可有黏液性水腫或甲狀腺功能亢進症狀,如多汗、汗臭及突眼性甲狀腺腫。約35%病人併發糖尿病。病人在早期因多食而體重增加,晚期體重減輕,尚有多尿、多飲、外陰瘙癢、足部壞疽、糖尿病性視網膜炎,甚至可發生糖尿病昏昏迷。血糖可能升高,半數病人尿糖陽性,糖耐量減低。血脂升高,血磷增高,少數血鈣、血鹼性磷酸酶亦可增高。病人早期多精力充沛、易激動;晚期則疲憊無力、注意力不集中、對外界缺乏興趣、記憶力差。GH腺瘤如不治療,常因代謝併發症,糖尿病,繼發感染,心、腦血管及呼吸道疾患而死亡。
GH腺瘤所引起的肢端肥大症應與異位生長激素釋放因子綜合徵鑑別,後者可異位分泌GHRF,使GH細胞增生,分泌過多GH。該情況罕見於:A.下丘腦神經節細胞瘤,可合併肢端肥大症。多見於40~60歲,除肢端肥大改變外,尚有頭痛、視力視野障礙、糖尿病、閉經、溢乳、性腺及腎上腺皮質功能低下等症狀。B.肺、胸腺、胰、胃腸等異位腫瘤,亦可有肢端肥大改變及相應臨牀症狀。測定血GH、生長介素-C及免疫反應性生長激素釋放因子(IR-GRF)均有增高,GH不被葡萄糖所抑制。全身CT或MRI有時可查出異位腫瘤。
有少數GH腺瘤患者,其腫瘤大小、GH值高低及臨牀表現不盡相符,如腫瘤較大或GH顯著升高其臨牀表現卻輕微,或血GH值升高不顯著者反而症狀明顯等。其原因有以下幾種推測:A.與病程長短有關,約20%病例GH值<5~10μg/L,但臨牀症狀明顯,反之亦有,可能GH雖顯著增高,但持續時間不長,其症狀不如GH輕度升高而持續久者明顯。B.GH具有免疫活性(大GH)及生物活性(小GH)兩種,GH腺瘤大多分泌具有高度生物活性的GH,少數分泌具有免疫活性的GH,臨牀症狀以有生物活性的GH較明顯。C.因GH在體內促進生長作用需通過肝臟細胞的生長介素來實現,雌激素可降低血漿中生長介素的活性及濃度,從而降低GH的全身效應,當GH瘤患者雌激素減低(如更年期患者或腫瘤影響垂體促性腺激素的釋放等所致雌激素減低),則臨牀症狀顯著。D.GH瘤內發生卒中,引起退變壞死或囊性變者,可使症狀自行緩解,即使腫瘤體積較大,其GH值可升高不著,症狀亦可保持較長時間的穩定。
12.2.3 (3)ACTH腺瘤(庫欣病)
多見於青壯年,女性爲主。大多瘤體較小,不產生神經症狀,甚至不易被放射檢查發現。本症特點爲瘤細胞分泌過量的ACTH及有關多肽,導致腎上腺皮質增生,產生高皮質醇血癥。後者可造成體內多種物質代謝紊亂,呈典型的庫欣綜合徵表現。這由庫欣於1932年首先描述12例皮質醇過多症候羣的病人而得名,並提出垂體嗜鹼性細胞腺瘤可能是其病因。該病臨牀症狀分述如下:
①脂肪代謝紊亂,可產生典型的“向心性肥胖”,病人頭、面、頸及軀幹處脂肪增多,臉呈圓形(稱滿月臉),脊椎向後突,頸背交界處有肥厚的脂肪層,形成“水牛背”樣,但四肢相對瘦小。晚期有動脈粥樣硬化改變。
②蛋白質代謝紊亂,可導致全身皮膚、骨骼、肌肉等處蛋白質消耗過度,皮膚、真皮處成膠原纖維斷裂,皮下血管得以暴露而出現“紫紋”(見於下肢、股、臀及上臂等處)及面部多血癥。由於脊柱及顱骨骨質疏鬆,故約有50%病人有腰背痠痛、維生素D缺乏缺乏病、軟骨病及病理性壓縮性骨折。兒童病人則可影響骨骼生長。因血管脆性增加而易產生皮膚瘀斑,傷口不易癒合,容易感染等。
③糖代謝紊亂,可引起類固醇性糖尿病(20%~25%),表現爲多飲、多尿,空腹血糖增高,糖耐量降低,一般多屬輕型且爲可逆性。
④電解質代謝紊亂,見於少數病人,晚期可出現血鉀及血氯降低,血鈉增高,引起低鉀、低氯性鹼中毒。
⑤性腺功能障礙,高皮質醇血癥可抑制垂體促性腺激素分泌。女性病人血睾酮明顯升高,70%~80%產生閉經、不孕及不同程度的男性化,如乳房萎縮、毛髮增多、痤瘡、喉結增大及聲低沉等。男性病人則血睾酮降低而引起性慾減退、陽痿、睾丸萎縮等。兒童病人則生長發育障礙。
⑥高血壓,約85%病例有高血壓,長期血壓增高可併發左心室肥大、心力衰竭、心律失常、腦卒中及腎功能衰竭。
⑦精神症狀,約2/3病人有精神症狀,輕者失眠、情緒不穩定、易受刺激、記憶力減退;重者精神變態。
⑧抗病力減退,皮質醇增多可降低抗體免疫功能,使溶酶體膜保持穩定,不利於消滅抗原,致使抗感染功能明顯減退,如皮膚易患真菌感染,細菌感染不易控制,且往往經久不愈。
納爾遜(Nelson)綜合徵由納爾遜等於1958年提出。患庫欣綜合徵作雙側腎上腺切除後,有10%~30%病人術後1~16年可發現垂體腫瘤。腫瘤發生原因大多認爲原先的皮質醇增多增多症即爲ACTH微腺瘤引起,但因腫瘤甚小,檢查未能發現,或未作進一步檢查而被忽略。雙側腎上腺切除後,由於缺少皮質醇對下丘腦中CRH的負反饋作用,導致CRH得以長期刺激垂體而引起腺瘤,或使原有的ACTH微腺瘤迅速長大,分泌大量的ACTH及MSH而產生全身皮膚、黏膜處明顯色素沉着,臨牀稱爲納爾遜綜合徵。有研究者認爲本綜合徵易發生於年輕(30歲以下)女性,在切除腎上腺後妊娠者更易發生。本症有10%~25%腫瘤呈侵蝕性,易長入鞍底硬膜、骨質及海綿竇等處,產生腦神經麻痹,且可向腦其他部位及顱外轉移。少數病人可有PRL增高及溢乳,可能爲下丘腦功能紊亂或垂體腺瘤壓迫下丘腦,致使PIF抑制作用減弱而引起PRL分泌增加。
引起高皮質醇血癥的原因中,有60%~80%爲ACTH及其有關多肽腺瘤,15%~25%爲腎上腺腫瘤(包括腎上腺皮質腺瘤及癌腫),5%~15%爲異位ACTH腺瘤(多見於肺癌,其他有胸腺、胃、腎、胰、甲狀腺、卵巢等處腫瘤)。臨牀有少數單純性肥胖病患者亦可有類似皮質醇增多的症狀,如高血壓、月經紊亂或閉經、紫紋、痤瘡、多毛等。
12.2.4 (4)促性腺激素腺瘤(GnH腺瘤或FSH、LH腺瘤)
該病起病緩慢,因缺少特異性症狀,故早期診斷困難。主要表現爲性功能降低,多見於中年以上男性。男女病人早期多無性慾改變現象,病程晚期大多有頭痛、視力及視野障礙,常誤診爲無功能垂體腺瘤(嫌色細胞瘤)。本症可分爲以下3型:
①FSH腺瘤:血漿FSFSH及α-亞基濃度明顯升高。病程早期,LH及睾酮濃度均正常,男性第二性徵正常,大多性慾及性功能亦正常,少數可性慾減退、勃起功能差。晚期病例LH及睾酮水平相繼下降,雖FSH增高可維持曲精管中支持細胞的正常數量,但睾酮濃度降低可導致精子發育及成熟發生障礙,可致陽痿、睾丸縮小及不育等。女性有月經紊亂或閉經。
②LH腺瘤:血清LH及睾酮濃度明顯升高,FSH水平下降,睾丸及第二性徵正常,性功能正常,睾丸活檢有間質細胞明顯增生,精母細胞成熟受阻,精子缺如,無生育能力。FSH下降原因可能爲腫瘤損傷垂體影響分泌FSH功能,或因睾酮及雌二醇(E2)升高及反饋抑制垂體分泌FSH所致。
③FSH/LH腺瘤:血清FSH、LH及睾酮升高。病程早期常無性功能障礙,腫瘤增大破壞垂體產生繼發性腎上腺皮質功能減退等症狀,此時血漿睾睾酮濃度仍正常或增高,但可出現陽痿等性功能減退症狀。
12.2.5 (5)TSH腺瘤
單純TSH分泌腺瘤甚爲罕見,多呈侵襲性。臨牀症狀有甲狀腺腫大並可捫及震顫,聞及雜音,有時出現突眼及其他甲亢症狀,如性情急躁、易激動、雙手顫抖、多汗、心動過速、胃納亢進及消瘦等。TSH腺瘤尚可繼發於原發性甲狀腺功能減退,可能是長期甲狀腺功能減退引起TSH細胞代償性肥大,部分致腺瘤樣變,最後形成腫瘤。TSH腺瘤可向鞍上生長,產生視力及視野改變。
12.2.6 (6)混合性垂體腺瘤
隨各種腫瘤所分泌不同的多種過多激素而產生相應不同的內分泌亢進症狀。
12.2.7 (7)嗜酸幹細胞腺瘤
PRL可中度增高,GH可正常或增高,臨牀有高PRL血癥的症狀,如月經紊亂、閉經、溢乳、不孕等,肢端肥大常不明顯,少數有輕微肢端肥大。男性有性慾減退,腫瘤常向鞍上生長,有頭痛、視覺障礙症狀。
12.2.8 (8)泌乳生長素細胞腺瘤
GH增高,有肢端肥大症狀,PRL可輕度增高。部分病人有溢乳、閉經等症狀。此型腫瘤生長緩慢。
12.2.9 (9)無分泌功能腺瘤
無分泌功能腺瘤又稱嫌色細胞瘤,多見於30~50歲,男性略多於女性。據統計在以往所謂嫌色性腺瘤中,約40%爲PRL腺瘤,約35%爲FSH及LH腺瘤,約10%爲單純α-亞單位分泌腺瘤。尚有發現嫌色細胞瘤有TSH、FSH(LH)、PRL、GH激素。在電鏡下可觀察到分泌顆粒,細胞培養測定亦可證實分泌激素。
腫瘤不產生內分泌亢進症狀的原因已見前述。因此可知實際上僅有少數爲真正的無分泌顆粒及無分泌激素能力的無分泌功能腺瘤,如瘤樣細胞瘤。此型腫瘤生長較緩慢,且不產生內分泌亢進症狀。因此確診時往往腫瘤已較大,壓迫及侵犯垂體已較嚴重,造成垂體促激素的減少,產生垂體功能減退症狀。一般認爲促性腺激素最先受影響,次爲促甲狀腺激素,最後影響促腎上腺皮質激素。臨牀可同時出現相應周圍靶腺體的萎縮,產生一個或多個靶腺的不同程度功能低下症狀:①促性腺激素不足,男性表現性慾減退、陽痿、外生殖器縮小、睾丸及前列腺萎縮,精子量少或缺如,第二性徵不著,皮膚細膩,陰毛呈女性分佈。女性表現月經紊亂或閉經,乳房、子宮及其附件萎縮,性慾減退,陰毛及腋毛稀少,肥胖等。兒童則發育障礙、身材矮小、智力減退。②促甲狀腺激素不足,表現畏寒、少汗、疲勞乏力、精神萎靡、食慾減退、嗜睡等。③促腎上腺皮質激素不足,可引起氫化可的松分泌減少而易產生低血糖、低鈉血癥,病人虛弱無力、厭食、噁心、抗病力差、易感染、體重減輕、血壓偏低、心音弱而心率快等。④生長激素減少,兒童有骨骼發育障礙、體格矮小,形成侏儒症。少數腫瘤壓迫後葉或下丘腦產生尿崩症。
因腎上腺皮質激素及甲狀腺激素缺乏,可引起各種代謝紊亂,機體應激能力減弱,易產生垂體危象,臨牀有以下幾種:①糖代謝障礙,在空腹、飢餓、胃腸道疾病、食物吸收不良或用胰島素時均可產生低血糖反應,出冷汗、煩躁、精神失常,有時可有強直樣發作,出現病理反射及低血糖症狀。②鹽代謝障礙,可產生血鈉過低,病人倦怠嗜睡、食慾不振,重者休克、昏迷甚至死亡。用大量甲狀腺素後使機體代謝率增加,可加重腎上腺皮質功能減退。③液體平衡失調,病人對水負荷的利尿反應減退,如飲水過多,作水試驗或應用尿崩靈可誘發水中毒,病人嗜睡、噁心嘔吐、精神錯亂、抽搐,甚至昏迷。④應激功能減退,機體抵抗力差、易感染,高熱時易陷於意識不清、昏迷。⑤體溫調節障礙,體溫低,皮膚冷,面色蒼白,脈搏細弱,逐漸昏迷。⑥低血壓,直立性低血壓可引起腦缺氧而昏倒。
13 垂體腺瘤的併發症
13.1 手術治療的併發症
13.1.1 (1)鞍內併發症
包括頸內動脈損傷(佔0.4%~1.4%),可引起假性動脈瘤、頸內動脈-海綿竇瘻,術後大血管痙攣、閉塞,及腦神經損傷(佔0.4%~1.9%),尤以展神經損傷爲多見。
13.1.2 (2)鞍上操作所致併發症
包括下丘腦、垂體柄、垂體損傷;視神經、視交叉及周圍血管的損傷導致視力減退或失明(佔0.4%~2.4%),後者也可由殘餘腫瘤出血、腫脹、鞍內填塞物過多等原因引起;鞍膈及蛛網膜損傷破裂發生腦脊液漏(佔1.5%~4.2%,甚高達9%~15%),可引起氣顱、腦膜炎(佔0%~2%);其他尚有蛛網膜下腔出血、雙額硬膜外血腫、癲癇等。
13.1.3 (3)經蝶入路及蝶竇內併發症
可有鼻中隔穿孔(3.3%~7.6%),上脣及牙齒麻木,鼻畸形,上頜骨、眶骨、篩骨等骨折,蝶竇炎(1%~4%)或膿腫,以及在蝶鞍前下壁兩側的蝶竇腔內損傷頸內動脈襻(動脈表面覆蓋骨缺損,僅有黏膜者約佔4%)和在蝶竇腔的上側方(有視神經孔的下中壁骨缺損者)損傷視神經。
13.1.4 (4)內分泌症狀
有10%~60%的患者可發生尿崩症,大多爲短暫性,持續性者佔0.5%~15%。術後垂體功能不足的發生爲1%~10%,多爲大腺瘤,且術前已有垂體功能低下者。
13.2 放療後的併發症
13.2.1 (1)放射性壞死
一般發生的高峯期在放療後1~3年,若放射劑量≤45Gy,其發生率僅0.4%。部位可涉及雙側額葉下內方、顳葉前內側鉤回、下丘腦及視交叉、第三腦室前壁等。臨牀表現爲視力、視野症狀加重,丘腦下部症狀及頭痛、噁心等。常可誤爲腫瘤復發。治療以支持療法爲主,給予大量維生素、能量合劑及替代性激素治療。
13.2.2 (2)新生物形成
最常見爲膠質瘤、腦膜瘤、纖維肉瘤,其發生的危險性是正常人羣的9~16倍,常在數年甚至10年以後發生。
13.2.3 (3)垂體功能低下
經8~10年隨訪,其發生率在13%~30%,甚至更高,表現爲性腺、甲狀腺和腎上腺軸的功能減退,需激素替代治療。
13.2.4 (4)其他併發症
14 實驗室檢查
垂體腺瘤的常規實驗室檢查多無異常。對垂體腺瘤來說,重要的是各種內分泌功能檢查。由於病變及病程的不同,垂體腺瘤的內分泌功能檢查可有不同結果。
14.1 生長激素(GH)
由垂體GH細胞分泌,受下丘腦調節,疑診GH腺瘤時,應測GH基礎值和葡萄糖抑制試驗。禁食12h後,休息情況下的GH正常值2~4μg/L,易受情緒、低血糖、睡眠、體力活動和應激狀態等影響,約90%的GH腺瘤病人GH基礎值高於10μg/L。GH水平在5~10μg/L可以是GH腺瘤,但個別情況也見於正常人,因此,應做葡萄糖抑制試驗。正常人口服葡萄糖100g後2h,GH低於正常值,3~4h後回升。GH腺瘤病人不受此影響,呈不能抑制現象。血漿胰島胰島素樣生長因子1(IGF-1)濃度測定可反映24h GH的分泌情況和CH腺瘤的活動性。GH的TRH興奮試驗,胰島素低血低血糖興奮試驗,如GH不升高則表示GH儲備能力不足。還有生長介素,主要在GH刺激下的肝臟產生,可促進GH對周圍組織的調節,測定生長介素,對GH腺瘤的診斷和治療後隨診有幫助,但術後並不像GH水平立即降低,而是緩慢降低。
14.2 ACTH檢查
內分泌學檢查對庫欣綜合徵及其病因的診斷和鑑別診斷的意義尤爲重要。因ACTH垂體腺垂體腺瘤中絕大多數爲微腺瘤(約80%),其中直徑<5mm的微腺瘤佔60%~70%。對此,增強CT、蝶鞍區薄層斷層的微腺瘤發現率僅30%,用1.5T的MRI增強薄層斷層條件下微腺瘤的發現率爲50%~60%,故CT或MRI陰性,並不能排除垂體微腺瘤的存在。
垂體ACTH細胞分泌ACTH,有下丘腦-垂體-腎上腺軸調節。對疑診ACTH腺瘤病人可測定血漿ACTACTH(正常人上午8~10時平均值爲22pg/ml,晚10~11時爲9.6pg/ml),ACTH很不穩定,進入血漿中很快分解,含量甚微;測血漿皮質皮質皮質醇(正常值爲20~30μg);測尿遊離皮質醇(UFC,正常值爲20~80μg/24h),>100µg有診斷意義。檢查需分兩步:第一步要查清是否爲庫欣綜合徵,第二步要明確是否爲垂體源性即庫欣病(垂體ACTH腺瘤和垂體ACTH細胞增生)。大多數病人血漿ACTACTH中度增高或正常,血漿皮質皮質皮質醇升高,且晝夜節律消失,24h尿遊離皮質醇(UFC/24h)升高,小劑量地塞米松抑制試驗不能抑制,大劑量地塞米松能抑制(皮質醇比對照值降低50%以上),對明確診斷有特殊意義。如血漿ACTACTH不高,而皮質醇明顯增高,節律消失,大、小劑量地塞米松均不能抑制,則符合腎上腺源性(腎上腺腺瘤或腎上腺癌)。如血漿ACTACTH明顯增加,節律消失,大、小劑量地塞米松均不能抑制者,多支持異位源性庫欣綜合徵(如肺癌、支氣管類癌等)。在採用17-OHCS爲指標的診斷符合率爲80%左右,北京協和醫院採用UFC/24h爲指標,符合率可達92.5%。對診斷困難者,可行ACTH刺激試驗,胰島素低血低血糖誘發試驗。如有條件可行選擇性靜脈導管,採集雙側巖下竇、頸內靜脈、下腔靜脈血測定ACTH,以及美替拉酮試驗和CRH試驗,這些對診斷和鑑別診斷有重要意義。
14.3 甲狀腺刺激素
垂體TSH細胞分泌TSH,血漿TSTSH正常值爲5~10μU/ml,TSH增高可見於垂體TSH腺瘤、下丘腦性甲亢、原發性甲低、甲狀腺炎和甲狀腺腫瘤等病例。TSH減低可見於垂體腫瘤、炎症或膿腫、手術和創傷後,有時需作甲狀腺刺激素釋放因子(TRHRH)興奮試驗,以瞭解垂體儲備功能。應用TSH 5~10單位肌內注射後測定甲狀腺素或甲狀腺吸碘率可增高,提示腺垂體功能減退。
14.4 促性腺激素
腺垂體FSH和LH細胞分泌FSH和LH,FSH正常值爲120μg/L,LH爲40μg/L。垂體FSH/LH腺瘤時,FSH/LH水平增高。垂體功能低下時,FSH和LH低,需同時測定睾酮和雌激素及其他激素協助診斷,還可作陰道黏膜塗片或精子數目幫助診斷。
14.5 黑色素刺激素
正常人血漿,MSH水平爲20~110pg/ml,MSH增高可見於垂體功能減低病人,增生型皮質醇增多增多症。腎上腺皮質腺瘤所致皮質醇增多增多症中MSH減低。
14.6 靶腺細胞分泌功能
如果垂體腺瘤長期壓迫垂體組織,或垂體卒中,手術創傷,致垂體功能不足,甲狀腺、腎上腺、性腺等靶腺等可發生功能低減。甲狀腺蛋白結合碘、甲狀腺素、17酮、17羥、尿遊離皮質醇均低下,睾酮、雌激素低下,精子數目減少;陰道塗片,雌激素低於正常。
15 輔助檢查
15.1 垂體微腺瘤的CT和MRI表現
15.1.1 (1)直接徵象
垂體內低密度(信號)區是診斷垂體微腺瘤的可靠徵象(圖1)。低密度(信號)區在3mm以上或超過垂體體積的1/3即可診斷爲垂體微腺瘤。低密度(信號)區的顯示與垂體及腫瘤的造影劑充盈方式有關。造影劑快速增強掃描時,由於垂體的血供極其豐富,且無血-腦脊液屏障,注入造影劑後可立即增強,其增強的程度與海綿竇及頸內動脈相接近。而腫瘤組織的血供不及垂體豐富,增強不及垂體迅速,腫瘤密度(信號)增加緩慢,因而在注入造影劑的一瞬間,腫瘤與鄰近垂體組織或海綿竇相比呈低密度(信號)。隨着時間的推移,循環血中的造影劑濃度逐漸降低,垂體與海綿竇的密度(信號)均逐漸下降,腫瘤組織逐漸呈等密度(信號)。因此,快速增強掃描可使低密度(信號)區的顯示最佳,而延長注射造影劑至掃描完成的時間則會造成漏診。少數微腺瘤表現爲或高密度(信號)區,表現爲等密度(信號)區的微腺瘤只能依據佔位徵象進行診斷。

15.1.2 (2)佔位徵象
①垂體增高和(或)上緣膨隆:垂體高度超過8mm即提示可能存在微腺瘤。但正常垂體高度也可能>8mm。另外,垂體高度正常也不能否定微腺瘤的存在,因此不能單純用垂體高度作爲微腺瘤是否存在的惟一標準,必須結合其他CT表現。垂體增高且上緣膨隆,則高度提示微腺瘤的存在,若垂體上緣的隆起不對稱,則更支持微腺瘤的診斷。有人報道,垂體增高且上緣隆起不對稱,91%有腫瘤存在。垂體上緣呈普遍性隆起只有部分病例中線區有腫瘤存在。因爲正常垂體上緣也可膨隆,故觀察垂體上緣形態也需結合其他徵象。
②垂體柄移位:腫瘤的佔位效應可將垂體柄推向對側,但在少數情況下,垂體柄也可向腫瘤同側移位。另外,動態增強掃描可見垂體柄周圍毛細血管叢,微腺瘤的佔位效應也可導致此毛細血管叢的移位。垂體柄偏離中線2mm以上,常常提示微腺瘤的存在。同樣,在分析垂體柄的變化時也需結合其他CT徵象,因爲微腺瘤病人垂體柄可以不移位,而正常人的垂體柄又可略偏離中線。
③神經垂體消失:冠狀CT掃描在通過垂體後緣的層面上,在鞍背前方常可見到略低密度的卵圓形後葉;而MRI檢查可更清晰地顯示神經垂體。微腺瘤的佔位效應常導致後葉受壓縮小而不能顯示,或被擠向一側。但若腫瘤發生於前葉前部,體積又較小,其佔位效應不重,則仍可見到後葉。故神經垂體消失常常提示有微腺瘤,而後葉顯示良好也不能完全排除微腺瘤。
④鞍底骨質的變化:微腺瘤可導致鞍底骨質的吸收或破壞,使鞍底兩側厚度不一,CT表現爲鞍底一側變薄或破壞。但正常人鞍底厚度有較大變異,只有骨質改變伴有相應部位的其他異常表現時,纔可認爲異常。
總之,垂體是否異常或是否存在微腺瘤,應從垂體高度、上緣形態、內部密度(信號)、異常密度(信號)區的存在及其大小、密度(信號)及邊界、垂體柄的移位、神經垂體及鞍底骨質的變化等幾方面進行仔細觀察,垂體柄移位、後葉消失及鞍底骨質的變化,可提示有微腺瘤存在。
15.2 垂體大腺瘤的CT和MRI表現
CT和MRI檢查是診斷垂體腺瘤最主要的影像學方法,不僅可以做出定性診斷,而且還可以瞭解腫瘤的大小、形態、質地以及與周圍結構之間的關係(圖2),爲治療方法的選擇提供和依據。

非增強掃描可見蝶鞍擴大,鞍底和鞍背骨質吸收變薄、傾斜;腫瘤位於腦外,由鞍內向鞍上生長,佔據鞍上池、第三腦室前部甚至達室間孔水平,但極少因此出現梗阻性腦積水;腫瘤可呈實體性或囊實性,無鈣化,邊界清楚,呈類圓形或啞鈴型;兩側海綿竇受腫瘤推移擠壓外移,少數腫瘤侵襲海綿竇,包繞頸內動脈甚至使該側海綿竇明顯外移;有時腫瘤可明顯向額葉或顳葉發展,或者突入蝶竇。增強掃描可見實體性腫瘤呈均一中度強化,囊性腫瘤呈周邊強化,中小體積腫瘤在腫瘤周邊可見殘存垂體。
15.3 普通X線檢查
頭顱正側位片可顯示蝶鞍形態,但不能顯示垂體,因此如果垂體腺瘤僅在鞍內生長而未影響蝶鞍形態,則頭顱正側位片可無異常。如腫瘤侵及蝶鞍則可在頭顱正側位片上形成一系列表現,如蝶鞍擴大;鞍壁脫鈣、變薄;前、後牀突變細甚至缺如;鞍底變闊、下陷;如腫瘤偏於一側則可使另一側鞍底下陷明顯,側位片上呈現出雙鞍底。
分層攝影、氣腦造影、腦室造影和血管造影對垂體腺瘤的診斷也有一定意義,但由於這些檢查多較複雜且有一定的危險性,加之CT和MRI的普及,現已很少使用。
15.4 PET檢查
PET作爲一種功能顯像技術,自20世紀80年代應用於臨牀以來已取得很大的成功。PET可提供有關腫瘤生化特徵、代謝特性、受體分佈及酶學特點等方面的信息,在腫瘤的診斷、治療等方面均有重要的意義。
PRL瘤及某些無功能腺瘤常有代謝增強,因此,用11C標記的左旋蛋氨酸和18F標記的氟脫氧葡萄葡萄糖(18F-fluorodeoxyglucose,18F-FDG)可使其顯像。用多巴胺受體激動藥治療後,瘤細胞的代謝降低,其攝取11C-左旋蛋氨酸和18F-FDG的能力也下降。11C標記的多巴胺D2受體拮抗藥甲基螺哌隆(methylspiperone)和雷氯必利(raclopride)可使PRL瘤顯像,且可預測多巴胺受體激動藥的療效。一般來說,11C標記的甲基螺哌隆和雷氯必利顯像者對多巴胺受體激動藥的反應良好。
16 診斷
垂體腺瘤的診斷主要依據不同類型腺瘤的臨牀表現,視功能障礙及其他腦神經和腦損害,以及內分泌檢查和放射學檢查,典型的病例不難做出垂體腺瘤的分類診斷。但對早期的微腺瘤,臨牀症狀不明顯,神經症狀輕微,內分泌學檢查不典型,又無影像學發現的病例則診斷不易,即使單有臨牀表現或神經症狀或內分泌學或影像學改變或四種均有改變的,亦不一定是垂體腺瘤。所以,既要全面瞭解病情作多方面的檢查,獲得資料,綜合分析,做出診斷和鑑別診斷,確定是否有腫瘤,是不是垂體腺瘤,還要對腫瘤部位、性質、大小、發展方向和累及垂體周圍重要結構的影響程度等進行仔細研究,以便選擇治療方案,制定治療措施,包括手術入路的選擇。
17 鑑別診斷
垂體腺瘤需與其他鞍區病變如淋巴細胞性垂體炎、肉芽腫性垂體炎、垂體膿腫、顱咽管瘤、Rathke裂囊腫、空泡蝶鞍等相鑑別。臨牀表現、內分泌檢查是鞍區病變鑑別的基礎,影像學檢查對鞍區病變的鑑別亦很重要(圖3)。多數情況下通過臨牀表現、內分泌檢查和影像學檢查鞍區病變可得鑑別,但有時需通過手術標本的病理檢查、免疫細胞化學檢查及電鏡觀察始能確診。
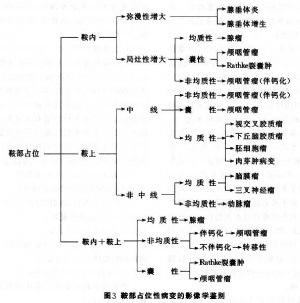
17.1 顱咽管瘤
多見於兒童及青少年,腫瘤常發生於鞍上,可向第三腦室、鞍旁、鞍後等處發展。臨牀表現爲下丘腦、垂體功能損害症狀如尿崩、發育遲緩等,視野改變多不規則,常有顱壓增高。蝶鞍改變爲鞍背縮短、鞍底平坦,70%可見鈣化斑。CT爲鞍上囊性低密度區,囊壁呈蛋殼樣鈣化,實體腫瘤爲高密度區,可有強化。MRI示鞍區囊性佔位的信號,鞍內底部往往可見正常垂體。成人顱咽管瘤常見於鞍內,多爲實質性,有時鑑別較難,需手術後才能確診。
17.2 腦膜瘤
常有頭痛、視力視野改變,但內分泌症狀多不明顯。蝶鞍一般正常大小,但鞍結節附近可見骨質增生。CT爲均勻高密度病竈,增強明顯。MRI掃描T1W呈等信號,T2W呈高信號,增強後有時可見腦膜“尾徵”。鞍內亦可見正常垂體。
17.3 異位松果體瘤
多見於兒童及青春期者,尿崩常爲首發症狀,有的可出現性早熟、發育停滯及視路受損症狀。蝶鞍多正常,CT爲類圓形高密度竈,其內見有鈣化點,有明顯均勻增強;MRI掃描示垂體柄處實體性腫塊。
17.4 視神經和下丘腦膠質瘤
前者多發生於兒童,爲患側失明及突眼,平片可見患側視神經孔擴大,蝶鞍正常。後者有下丘腦受損症狀和視野變化,MRI掃描可確定腫瘤範圍。
17.5 脊索瘤
常位於顱底斜坡,可向鞍區侵犯,出現頭痛、多發性腦神經麻痹及視力視野改變,內分泌症狀不明顯。X線平片及CT均可顯示斜坡區骨質破損和鈣化,腫瘤密度不均勻。
17.6 皮樣及上皮樣囊腫
可有視力減退及視野改變,但雙顳偏盲少見,其他腦神經損害症狀輕微,垂體功能常無影響。X線偶見顱底骨質吸收,CT爲低密度或混合密度病竈。
17.7 動脈瘤
可有視力視野及蝶鞍改變,但病史中常有蛛網膜下腔出血史。症狀多突然發生,有頭痛、動眼神經麻痹等。腦血管造影可明確診斷。
17.8 視交叉蛛網膜炎或囊腫
起病緩慢,視野變化不典型,蝶鞍無典型改變。無垂體功能減退症狀。CT及MRI掃描可予鑑別。
17.9 Rathke囊腫
發生於垂體中間部,較少見。可引起垂體功能減退、蝶鞍擴大、視交叉受壓等症狀。與鞍內型顱咽管瘤和無分泌功能垂體腺瘤較難鑑別,需手術方能確診。
17.10 空蝶鞍綜合徵
可有視路壓迫症和輕度垂體功能低下,蝶鞍常球型擴大,腦池造影CT掃描發現造影劑進入蝶鞍的蛛網膜下腔。
17.11 垂體膿腫
18 垂體腺瘤的治療
18.1 治療選擇
垂體腺瘤的治療方法有手術治療、放射治療及藥物治療。由於垂體腫瘤的大小不同,各種類型垂體腺瘤對以上治療方法的效果不同,以及病人年齡及一般情況的不同,故每一病人的治療方案均需考慮各種因素的影響問題。一般來說,手術治療適用各種類型的較大垂體腺瘤、微腺瘤中的ACTH型、GH型以及藥物治療不能耐受或治療不敏感的PRL瘤;藥物治療適用於PRL微腺瘤、TSH微腺瘤以及部分分泌性大腺瘤術後的病人;放射治療適用於術後腫瘤殘留的病人,或不願意手術的ACTH或GH微腺瘤病人。而高齡患者、身體情況差者可選擇藥物治療或放射治療。
垂體ACTH瘤80%以上爲微腺瘤,因藥物治療效果差,故經蝶入路手術是其最佳的選擇。過去由於早期診斷困難,病人表現爲庫欣綜合徵、雙側腎上腺增生,常誤行腎上腺切除術。隨之垂體失去靶腺的反饋調節,微腺瘤迅速增大,10%~30%病人出現納爾遜綜合徵。目前由於認識上的改變,對80%~90%庫欣病已從腎上腺手術轉向垂體腫瘤的切除,並取得遠較過去滿意的效果。國內外治療該腫瘤的手術治癒率在60%~85%,兒童患者的治癒率更高。而腫瘤複發率僅2%~11%,對腫瘤復發者可再次經蝶手術。
與庫欣病一樣,經蝶入路手術也是肢端肥大症(GH瘤)的首選治療方法。術後數小時,患者GH水平可明顯下降,出院前軟組織增大可漸消失。GH瘤的手術治癒率在58%~82%,術後複發率在5%~12%。對腫瘤未切盡或激素水平未恢復正常者,可行放療或藥物治療。
PRL瘤,尤其是大腺瘤也是手術的適應對象,術後視力可改善,大部分病人激素水平恢復正常。然而腫瘤術後的複發率較高,長期隨訪複發率爲6%~40%。由於多巴胺促效劑溴隱亭對該瘤有明顯治療作用,又因高PRL血癥病人經長期隨訪後,大多數小腺瘤不長成大腺瘤,且激素水平無變化,甚至恢復正常。故近來對PRL微小腺瘤的治療選擇趨向於保守或選用藥物治療。
TSH腺瘤罕見,選擇治療需慎重。當腫瘤較小或是繼發於原發性甲狀腺功能減退症的通常不需要手術處理,應用藥物甲狀腺素替代治療多能奏效。但對腫瘤較大向鞍上生長壓迫視路者,可考慮手術切除。必須對原發和繼發的TSH瘤及非腫瘤形式者(後者可受到TRH的進一步刺激)提高認識,作出鑑別,否則可產生不良後果,如在原發性甲狀腺功能減退病人作不必要的垂體手術,在中樞性甲狀腺功能亢進病人中作不恰當的甲狀腺切除。
一般說來,促性腺素瘤同無分泌功能腺瘤一樣,大多爲大腺瘤。根據腫瘤大小、形狀、生長方向可選擇經蝶或經顱入路手術。術後視路改善者近70%,但腫瘤複發率較高。
18.2 手術治療
手術切除腫瘤是目前治療垂體腺瘤的主要手段。手術的目的是解除腫瘤對視路和其他組織的壓迫,恢復激素水平,保護正常垂體功能。許多腫瘤通過經顱或經蝶入路手術能被有效治療。但手術也受到包括腫瘤特徵如腫瘤大小、形狀、生長方向、組織類型、鞍外擴展程度和病人的特徵如年齡、健康狀況、視路和內分泌損害程度以及蝶鞍、蝶竇的解剖等情況的影響。在決定手術入路時,腫瘤的體積和蝶鞍擴展程度不如腫瘤的形狀和生長方向來得那麼重要。在當今顯微外科技術較爲普及的情況下,對待可以安全經蝶或經顱入路手術的病人,一般傾向於經蝶入路手術。因爲經蝶入路更快更直接地達到垂體腺,清晰地區分腫瘤組織和垂體腺,腫瘤切除的徹底性較高,而病人的手術風險及術中損傷視路等結構的可能性小,病人的術後反應輕、恢復快。
18.2.1 (1)經顱手術
垂體腺瘤常規經顱手術有經額下、額顳(翼點)和顳下入路,每一種入路在特殊情況下有各自優缺點。垂體腺瘤額下入路手術可觀察視神經、視交叉、頸內動脈、鞍上池、垂體柄和蝶鞍,術中可在直視下切除腫瘤,對視神經、視交叉減壓較徹底,適用於較大垂體腺瘤向鞍上發展有視力視野障礙者,但前置型視交叉可阻礙這一入路接近腫瘤,故對臨牀(視野檢查有雙顳偏盲性暗點)和MRI估計有視交叉前置者應優先採用額顳(翼點)入路。該入路提供了在視神經及視束與頸內動脈之間操作的空間,也可在視交叉前、下及後方探查,且路徑短、視角大,充分利用了腦的自然解剖間隙,故適用於垂體腺瘤向視交叉後上方、向鞍旁或海綿竇發展者。缺點是手術者對遠側視神經和鞍內容物的視域受到影響。顳下入路適用於腫瘤明顯向視交叉後擴展的罕見情況或向鞍旁發展者,雖然這一入路可對視交叉進行減壓,但它對鞍內腫瘤的切除困難。
近10年來,隨着顱底外科的突破性進展,垂體腺瘤的新手術入路和改良的手術入路得到開發和應用,包括擴大的額下硬膜外入路、經眶額蝶聯合入路和經硬膜外海綿竇入路。擴大的額下硬膜外入路能清楚顯露顱底的中線區域,如篩竇、蝶竇以至斜坡,故適用於切除長向前顱底、蝶竇、篩竇、鞍區及斜坡的巨大垂體腺瘤。但有些腫瘤長向鞍上區、後牀突區及鞍旁海綿竇,成爲該手術入路的“盲區”。爲解決這一難點,可採用術中聯合額下或顳下硬膜內入路一起操作,以增加腫瘤切除的徹底性。該入路暴露範圍較經蝶入路廣,手術風險較常規經顱入路小,手術需特別注意的是嚴格修復顱底硬膜,以防術後腦脊液漏和顱內感染。經眶額蝶聯合入路是經額和經蝶聯合入路的改良,手術野暴露好,容易達到腫瘤全切除目的,但手術創傷大,同樣可能有腦脊液漏和顱內感染。經硬膜外海綿竇入路適用對象爲侵入鞍旁和(或)鞍上的垂體腺瘤,尤其是常規額下入路或經蝶入路手術復發者。主要手術方法爲:①遊離中顱底硬腦膜夾層,打開海綿竇外側壁。②經海綿竇內側三角、上三角、外側三角等間隙切除腫瘤及視神經兩旁切除侵入蝶竇和篩竇的腫瘤。③腫瘤長向鞍上者,可剪開硬腦膜,打開側裂,抬起額葉,將隆起的鞍膈連同其下的腫瘤推入蝶鞍內,經硬膜外切除。
經顱手術指徵有:①腫瘤向鞍上生長呈啞鈴狀;②腫瘤長入第三腦室,伴有腦積水及顱內壓增高者;③腫瘤向鞍外生長至顱前、中或後窩者;④有鼻或鼻竇炎症及蝶竇氣化不能良且無微型電鑽設備,不適合經蝶竇手術者;⑤腫瘤出血伴顱內血腫或蛛網膜下腔出血者。
術後視力及視野恢復率爲78%,其中視力改善爲83%,視野改善爲67%,其療效與以下因素有關:①術前視覺影響程度,即術前視力影響愈嚴重,術後恢復可能愈小。②視神經受壓時間長短,一般視力障礙在1年以內者,術後恢復大多良好,視覺障礙在2年以上者恢復較差。③視神經萎縮程度,已有明顯視神經萎縮者,往往不能完全恢復。
18.2.2 (2)經蝶手術
經蝶竇入路切除垂體腺瘤爲Schloffer(1907)首先在人體手術成功,後經改進,成爲目前最爲廣泛應用的垂體腺瘤手術方法,它包括經口-鼻-蝶竇、經鼻-蝶竇、經篩-蝶竇、經上頜竇-蝶竇入路等術式。其優點是手術安全度高,採用顯微手術技術,對微腺瘤可作選擇性全切除,保留正常垂體組織,恢復內分泌功能。近年來,隨着經蝶手術經驗的不斷積累和手術技巧的提高,注意到垂體腺瘤鞍上擴展部分常爲非浸潤性生長,包膜完整,且絕大多數垂體腺瘤組織質地脆軟,有些腫瘤伴有出血、壞死、囊液等改變,容易被吸除或刮除,故國內不少醫療單位對有視神經及視交叉受壓的大或巨腺瘤亦樂於採用經蝶入路手術,並能達到腫瘤儘可能多地切除,視路減壓滿意及保存垂體功能的目的,取得了較好的療效(佔83%)。國外也有學者對垂體大腺瘤採用經蝶入路、鞍底開放,有意待腫瘤墜落至鞍內後作二期手術的,有效率亦可達83%。
經蝶入路手術指徵一般包括:①垂體微腺瘤;②垂體腺瘤向鞍上擴展,但不呈啞鈴形,未向鞍旁侵襲,影像學提示腫瘤質地鬆軟者;③垂體腺瘤向蝶竇內生長者;④垂體腺瘤伴有腦脊液鼻漏者;⑤垂體腺瘤卒中不伴有顱內血腫或蛛網膜下腔出血者;⑥視交叉前置型垂體腺瘤;⑦患者年老體弱,不能耐受開顱手術者。禁忌證包括:①巨型或大型垂體腺瘤向側方、額底生長,或腫瘤呈啞鈴形者;②垂體腺瘤向鞍上擴展,影像學提示腫瘤質地堅硬者;③蝶竇氣化不良者;④鼻腔及鼻旁竇有炎症者。
分泌性垂體腺瘤經蝶竇入路手術切除腫瘤的療效與腫瘤體積大小、有無周邊浸潤、術前激素水平高低、腫瘤能否全切、正常垂體保留程度以及首次或再次手術等因素有關。其中徹底切除腫瘤最爲重要。一般如腫瘤爲微腺瘤,無周邊侵犯,激素水平輕至中度升高,腫瘤全切除,保留正常垂體及第一次手術者療效較好。而影響腫瘤全切的因素有:①腫瘤發展階段及大小,在腫瘤的初期,微腺瘤位於前葉內呈小結節形時爲作選擇性全切除的最佳時機。若腫瘤向鞍上、鞍旁、蝶竇內生長,體積較大者則不易完全切除。②腫瘤質地,95%的垂體腫瘤質地軟,易於吸除,能達到全切程度。約5%腫瘤質硬,難以全切。術前長期服用溴隱亭者,有部分病例的腫瘤可纖維化,質硬不易全切。③腫瘤侵蝕硬膜,腫瘤體積愈大,愈易侵蝕硬膜,以分泌性腺瘤較多見,故不易全切。從以上因素中,可見早期診斷是爭取作選擇性全切除的先決條件。
18.3 藥物治療
藥物治療的目的是試圖減少分泌性腫瘤過高的激素水平,改善臨牀症狀及縮小腫瘤體積。雖然當今尚無一種藥物能治癒該類垂體腺瘤,但有些藥物在臨牀實踐中確實取得了較好的療效。對無分泌性腺瘤,主要是針對垂體功能低下的症狀選用腎上腺皮質激素、甲狀腺激素及性腺激素予以替代治療。
18.3.1 (1)PRL腺瘤
治療PRL瘤的藥物效果最爲突出,其中主要有溴隱亭、喹高利特(Norprolac)及培高利特。
①溴隱亭:該藥是一種部分合成的麥角生物鹼溴化物,爲多巴胺促效劑,可興奮下丘腦,阻止PRL釋放,或刺激多巴胺受體有效抑制PRL分泌,並能部分抑制GH濃度。對女性患者,服藥後2周溢乳可改善,服藥約2個月後月經可恢復,並且90%停經前婦女可恢復排卵及受孕。在男性病人,服藥後數週性功能恢復,3個月後血睾酮濃度增加,1年內恢復正常,精子數亦可恢復。而對大腺瘤者,常可降低PRL水平,並且可使60%的腫瘤縮小,使病人頭痛減輕、視野改善。但溴隱亭的缺點爲停藥後腫瘤又復增大,PRL再度升高,症狀復發。另外,該藥每天需服2~3次,有噁心、嘔吐、乏力、直立性低血壓等不良反應。還可導致服藥後腫瘤發生纖維化,造成手術成功率(44%)較未服藥者的(81%)顯著降低。溴隱亭適用於:A.PRL微腺瘤者;B.PRL大腺瘤病人不願手術或不適於手術者;C.手術和(或)放療後無效者;D.大型PRL瘤向鞍外生長,可先服藥3個月,如腫瘤明顯縮小,則爲手術創造條件;E.妊娠期腫瘤長大者;F.GH瘤和混合性腫瘤(GH-PRL,TSH-PRL),但僅部分病人有效。
②喹高利特:商品名“諾果亭”,是一種新型非麥角類長效多巴胺D2受體選擇性激動藥,對PRL的抑制作用是溴隱亭的35倍,消化道不良反應少。藥物半衰期爲11~12h,故多數患者每天僅需服藥1次。
③培高利特:系國產麥角衍生物,亦是多巴胺激動藥,能作用於PRL細胞膜內多巴胺受體抑制PRL合成與分泌。國內協作組臨牀治療高PRL血癥90例,療效觀察有效率爲98.9%,其中PRL降至正常88例(97.8%),溢乳消失94.6%,月經恢復84.8%,妊娠21.1%,腫瘤縮小及消失47%,療效略遜於溴隱亭治療的對照組。但不良反應(同溴隱亭)僅有22.2%,低於溴隱亭治療組的35.6%,且症狀輕微,不需停藥,2~4周內自然消失。治療採用口服25~50μg/d,每2周調整1次,極量爲150μg/d。
18.3.2 (2)GH腺瘤
①奧曲肽:是生長抑素的衍生物,能較特異地抑制GH,且較生長抑素有更強的生物活性(抑制GH的活性比生長抑素高102倍)。該藥皮下注射後血漿半衰期爲120min,使GH濃度明顯下降,故可用於治療GH腺瘤。經觀察,該藥治療後可使2/3以上的肢端肥大症患者的GH水平降至正常,20%~50%的患者腫瘤縮小,同時對TSH分泌腺瘤和促性腺素瘤亦有治療作用。該藥不良反應較小,包括局部注射疼痛、腹部痙攣性痛、膽石症和暫時性脂肪性腹瀉及對GH瘤者的糖代謝呈雙重影響。但由於此藥需每天2~3次皮下注射,病人常難以長期堅持。
②BIM23014(BIM-LA):是一種新長效型(緩慢釋放) 生長抑素類似物,可避免重複注射或持續給藥的不便,每2周注射1次。
③溴隱亭:對肢端肥大者亦有治療作用,有報道治療後GH水平降低者佔2/3,但降至正常者僅20%,且治療劑量較高PRL血癥者明顯爲大,每天用量常達15~50mg。
④其他藥物:賽庚啶可直接抑制GH分泌,有一定療效。雌二醇作用於周圍靶組織對GH起拮抗作用,使症狀減輕。另有醋酸甲地孕甲地孕甲地孕酮(甲地孕酮)、氯丙嗪、左旋多巴等。
18.3.3 (3)ACTH腺瘤
許多藥物已被用於治療庫欣病,包括5-羥色胺拮抗藥賽庚啶、利他賽寧、多巴胺激動藥溴隱亭和腎上腺功能抑制劑或毒性劑如酮康唑、米託坦(密妥坦)、美替拉酮(甲吡酮)、氨魯米特(氨基導眠能)等。
①賽庚啶:可抑制血清素刺激CRH釋放,使ACTH水平降低。每天劑量24mg,分3~4次給予,療程3~6個月,緩解率可達40%~60%,對納爾遜綜合徵也有效,但停藥後症狀復發。適用於重病人的術前準備及術後皮質醇仍增高者。
②利他賽寧:新型長效5-羥色胺拮抗藥,每天10~15mg,連服1個月左右,效果較好且無明顯不良反應,但停藥後症狀往往復發。
③酮康唑:作爲臨牀應用的抗真菌藥,能通過抑制腎上腺細胞色素P-450所依賴的線粒體酶而阻滯類固醇合成,並能減弱皮質醇對ACTH的反應。每天劑量400~800mg,分3次服用,療程數週到半年,較嚴重的不良反應是肝臟損害。
18.4 放射治療
在垂體腺瘤的治療中,放射治療或可作爲手術治療或藥物治療的輔助療法,也可作爲一種確定的治療方法。它可分爲外放療和內放療兩種。外放療常用有超高壓照射的60Co和直線加速器,重粒子放療(α粒子、質子、中子等)以及γ-刀、X-刀等。內放療有放射性核素(198Au、90Y等),與藥物治療的情況相同,放療的有效性因垂體腺瘤的不同類型而有所不同。
18.4.1 (1)超高壓照射(60Co、直線加速器)
穿透性能較強,對皮膚、顱骨及正常組織影響較小。目前國內應用最多,已取代常規X線治療。常用總劑量爲45~55Gy,每週5次,每次180~200Gy。
①無分泌功能腺瘤:多爲大腺瘤,早期單純手術後的複發率爲55%~67%,晚期腫瘤全切除後的複發率在12%~21%,復發多發生在術後4~8年。國外有報道即使腫瘤肉眼全切除,仍可有鏡下殘留的病變,如88%和94%的鞍內或向鞍上擴展的大腺瘤有硬膜的侵犯。故爲防止腫瘤復發,提高手術治療的效果,一般主張術後放療。但近來也有研究者認爲腫瘤全切除者,可臨牀密切觀察,定期隨訪影像學,一旦腫瘤復發才予放療,以免放療引起的併發症。無分泌腺瘤對放射線治療中度敏感,療效較有分泌功能腺瘤爲好。放療後可使大部分腫瘤組織被破壞、體積縮小,所剩瘤組織增殖力明顯減退,復發延緩。
放療適應證:A.手術未全切除者。B.術後腫瘤復發且腫瘤不大者。C.診斷肯定而臨牀症狀不顯著者。D.年老體弱,或有重要器官疾病等不能耐受手術者。
放療效果:國外報道單純放療腫瘤控制率爲71%,手術後放療病人的控制率可達75%。也有許多報道手術加放療10年的局部控制率可達85%~94%。腫瘤復發後放療,10年的控制率爲78%;首次手術後放療10年控制率可達91%。放療後約半數病人的視力、視野障礙可望有些恢復,但亦有在放療過程中或治療以後發生腫瘤出血或囊變而使症狀反而加重。
②分泌性垂體腺瘤:放射治療分泌性腺瘤的療效,以內分泌亢進症狀較輕及激素升高水平較低者爲好。
A.PRL瘤經放療後部分病例血清PRL濃度可以降低,腫瘤縮小,但PRL多不能降至正常水平,部分無效。相對於手術或溴隱亭治療的效果,放療效果不滿意。
B.GH瘤對放療比較敏感,30%~70%的病人放療後GH水平可低於5μg/L,60%~80%的病人GH水平可低於10μg/L,治療的最大效應在3~5年。
C.ACTH瘤的放療效果在20%~50%。兒童患者療效較好,可達80%,有效時間短於GH瘤患者的。對納爾遜綜合徵,無論用於預防或治療,均能減少發生率或控制疾病。
由於開展經蝶顯微手術後治療效果有了明顯提高,現多主張治療分泌性腺瘤(TSH及PRL微腺瘤除外)應首選手術治療,對手術未能全切除腫瘤病例,術後輔以放射治療,可以減少腫瘤複發率。對肉眼全切除腫瘤病例,術後是否常規放療,有研究認爲腫瘤與正常組織之間無明顯界限,瘤細胞常侵入正常垂體組織中,主張術後應放療,但目前多認爲手術後達到治癒標準者不需作放療,可定期隨訪。對術中有腦脊液漏者應延期放療,以待修補處充分機化。
18.4.2 (2)重粒子放療
國外應用迴旋加速器開展的重粒子治療有α粒子束、質子束、負π介子、快中子等。利用Bragg峯效應,在確切的靶區內(垂體腺)可獲高能量釋放,但在鄰近組織內能量釋放甚小,故可用較大劑量治療,而不良反應或併發症並不增加。國外用質子束治療431例肢端肥大症病人,在以後的4年中有80%病人獲得控制(GH<10μg/L),重粒子放療258例GH瘤患者,5年內90%病人GH<10μg/L。對ACTH瘤,治療124例病人,65%完全控制,20%改善,僅15%失敗。
18.4.3 (3)γ-刀(X-刀)治療
國內已引進並開展該項技術。它是應用立體定向外科三維定位方法,將高能射線準確匯聚於顱內靶竈上,一次性或分次毀損靶竈組織,而周圍正常組織因射線劑量銳減可免受損害。對垂體腺瘤的治療始於20世紀70年代,其目的是控制腫瘤生長和激素的過度分泌。由於視器鄰近垂體(瘤)組織,所耐受的射線劑量較腫瘤所需的劑量爲小,故該治療的先決條件是視器相對遠離腫瘤邊緣,僅適應於無分泌功能腺瘤術後有部分殘留者和高分泌功能微小腺瘤不願手術及藥物治療無效或不能耐受者。γ刀的療效在無功能腺瘤局部控制率爲89%左右,ACTH瘤的治癒緩解率爲70%~85%,GH瘤爲67%~75%,PRL瘤爲50%~60%。其主要併發症爲視路損害和垂體功能低下。
19 預後
20世紀初經顱垂體腺瘤手術死亡率在10%以上。隨着科技的發展,診療技術的進步和手術經驗的積累,現經顱手術死亡率已下降至4%~5%,有的報道在1.2%~16%。北京協和醫院經顱手術死亡率爲4.7%,近20多年來開展現代經蝶顯微外科技術,手術死亡率又下降至0.4%~2%。據Laws治療505例中7例死亡,死亡率爲1.38%(死於腦膜炎、腦脊液漏、下丘腦損傷、頸內動脈損傷和腦底動脈環閉塞各1例,顱內血腫2例)。Zerves統計國際大宗材料2606例微腺瘤死亡率爲0.27%,2677例大腺瘤的死亡率爲0.86%。北京協和醫院經蝶手術892例,死亡4例,死亡率爲0.44%,均爲大腺瘤(1例死於復發瘤第2次手術中異常血管損傷,經止血後突然心室纖顫;死於腦血管病出血和下丘腦出血各1例;1例術後12天死於心血管意外)。微腺瘤死亡率爲0%,ACTH腺瘤256例和PRL腺瘤184例均無死亡。死亡原因除與手術直接有關的併發症外,尚與術後誤吸窒息、肺栓塞、心血管意外等有關。
嚴格掌握手術適應證,提高手術技巧,嚴密觀察病情變化,積極防治併發症,是降低死亡率的關鍵。
高分泌性垂體腺瘤的治療效果各家報道不一。據Hardy等資料,PRL腺瘤Ⅰ級根治率達90%,Ⅱ級爲58%、Ⅲ級43%、Ⅳ級0%。術後月經恢復率分別爲71.5%、53.8%、42.8%、0%,術後妊娠率分別爲56.5%、21.4%、0%、0%。若以術前PRL在100μg/L、200μg/L、500μg/L以下或>500μg/L統計,治癒率分別爲88%、83%、77%及14%。國內天津醫大平均隨訪4.6年,PRL瘤治癒率爲79.8%。北京協和醫院採用腫瘤加瘤周垂體組織切除微腺瘤治癒緩解率爲86%,大腺瘤爲60%。上海華山醫院早期(至1987年初)PRL瘤的治癒緩解率爲70%,月經恢復率爲53%。
GH瘤國外Ⅰ~Ⅱ級治癒率爲81.5%,Ⅲ~Ⅳ級者爲67.8%。Ross報道長期隨訪6.3年,治癒率(GH<5μg/L)爲75.3%,緩解率(GH<10μg/L)爲87.9%。國內天津醫大腫瘤控制率爲81.8%。術前GH<40μg/L,術後控制率爲94%;術前GH>40μg/L,術後控制率爲68%。北京協和醫院微腺瘤治癒緩解率爲80.5%,大腺瘤爲69.1%。術前GH<100μg/L的,術後≤10μg/L爲81.8%;術前GH>100μg/L的,術後≤10μg/L爲28.8%。上海華山醫院早期GH瘤的治癒緩解率爲86%。
ACTH腺瘤國外治愈率爲74%~85%,其中庫欣病病理證實有腺瘤者治癒率爲87%~91%,未證實有腺瘤者爲60%。國內協和醫院中遠期平均隨訪3年,病理證實有腺瘤或前葉細胞增生或無異常組的治癒率分別爲63.1%、72.7%及48.1%,微腺瘤組腫瘤加瘤周腺垂體大部分切除的治癒率可達80%。上海瑞金醫院Ⅰ級腫瘤根治率爲85%,Ⅱ~Ⅲ級爲60%。上海華山醫院庫欣病的治癒率爲86%,納爾遜綜合徵無1例治癒。兒童ACTH瘤的治癒率國外爲80%~100%,國內爲91%。
分泌性腺瘤術後長期隨訪的複發率:PRL瘤平均復發爲17%,個別報道達40%;GH瘤爲5%~12%,ACTH瘤2%~10.5%,個別爲20.6%。國內資料PRL瘤複發率爲5.26%(北京協和醫大),GH瘤爲3.6%(天津醫大),ACTH瘤爲11.4%(北京協和醫大)。腫瘤復發原因大多與腫瘤切除不徹底而有殘留組織,或爲高增殖垂體腺瘤,或腫瘤向周邊組織侵犯(侵襲性垂體腺瘤)有關。少數可因多發性微腺瘤或垂體細胞增生。