2 基本信息
《胃癌診療指南(2022年版)》由國家衛生健康委辦公廳於2022年4月3日《國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知》(國衛辦醫函〔2022〕104號)印發,要求各省、自治區、直轄市及新疆生產建設兵團衛生健康委組織做好實施工作。
3 發佈通知
國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知
國衛辦醫函〔2022〕104號
各省、自治區、直轄市及新疆生產建設兵團衛生健康委:
爲進一步提高腫瘤和血液病診療規範化水平,保障醫療質量安全,維護患者健康權益,我委委託有關單位制修訂了腫瘤和血液病相關病種診療指南。現印發給你們(見附件,可在國家衛生健康委網站醫政醫管欄目下載),請各地衛生健康行政部門組織做好實施工作。
附件:
2.膀胱癌診療指南(2022年版)
5.胰腺癌診治指南(2022年版)
6.腎癌診療指南(2022年版)
7.乳腺癌診療指南(2022年版)
8.子宮內膜癌診療指南(2022年版)
12.甲狀腺癌診療指南(2022版)
13.腦膠質瘤診療指南(2022年版)
16.瀰漫性大B細胞淋巴瘤診療指南(2022年版)
17.骨髓增生異常綜合徵伴原始細胞增多(MDS-EB)診療指南(2022年版)
18.慢性髓性白血病診療指南(2022年版)
19.血友病A診療指南(2022年版)
20.慢性淋巴細胞白血病-小淋巴細胞淋巴瘤診療指南(2022年版)
國家衛生健康委辦公廳
2022年4月3日
4 診療指南全文
4.1 一、概述
胃癌是指原發於胃的上皮源性惡性腫瘤。根據2020年中國最新數據,胃癌發病率和死亡率在各種惡性腫瘤中均位居第三。全球每年新發胃癌病例約120 萬,中國約佔其中的40%。我國早期胃癌佔比很低,僅約20%,大多數發現時已是進展期,總體 5 年生存率不足50%。近年來隨着胃鏡檢查的普及,早期胃癌比例逐年增高。胃癌治療的總體策略是以外科爲主的綜合治療,爲進一步規範我國胃癌診療行爲,提高醫療機構胃癌診療水平,改善胃癌患者預後,保障醫療質量和醫療安全,特制定本指南。本指南所稱的胃癌是指胃腺癌(以下簡稱胃癌),包括胃食管結合部癌。
4.2 二、診斷
應當結合患者的臨牀表現、內鏡及組織病理學、影像學檢查等進行胃癌的診斷和鑑別診斷。
4.2.1 (一)臨牀表現。
早期胃癌患者常無特異的症狀,隨着病情的進展可出現類似胃炎、潰瘍病的症狀,主要有:
①上腹飽脹不適或隱痛,以飯後爲重;
②胃部疼痛,如疼痛持續加重且向腰背放射,則提示可能存在胰腺和腹腔神經叢受侵。胃癌一旦穿孔,可出現劇烈腹痛的胃穿孔症狀。
③噁心、嘔吐,常爲腫瘤引起梗阻或胃功能紊亂所致。賁門部癌可出現進行性加重的吞嚥困難及反流症狀,胃竇部癌引起幽門梗阻時可嘔吐宿食。
④出血和黑便,腫瘤侵犯血管,可引起消化道出血。小量出血時僅有大便隱血陽性,當出血量較大時可表現爲嘔血及黑便。
⑤其他症狀如腹瀉(患者因胃酸缺乏、胃排空加快)、轉移竈的症狀等。
4.2.2 (二)體徵。
一般胃癌尤其是早期胃癌,常無明顯的體徵,進展期乃至晚期胃癌患者可出現下列體徵:①上腹部深壓痛,有時伴有輕度肌抵抗感,常是體檢可獲得的唯一體徵;②上腹部腫塊,位於幽門竇或胃體的進展期胃癌,有時可捫及上腹部腫塊 ; 女 性 患 者 於 下 腹 部 捫及可推動的腫塊,應考慮Krukenberg 瘤的可能;③胃腸梗阻的表現:幽門梗阻時可有胃型及震水音,小腸或系膜轉移使腸腔狹窄可導致部分或完全性腸梗阻;④腹水徵,有腹膜轉移時可出現血性腹水;⑤鎖骨上淋巴結腫大;⑥直腸前窩腫物;⑦臍部腫塊等。其中,鎖骨上窩淋巴結腫大、腹水徵、下腹部盆腔包塊、臍部腫物、直腸前窩種植結節、腸梗阻表現均爲提示胃癌晚期的重要體徵。因此,仔細檢查這些體徵,不但具有重要的診斷價值,同時也爲診治策略的制訂提供了充分的臨牀依據。
4.2.3 (三)影像檢查。
4.2.3.1 1.X 線氣鋇雙重對比造影
定位診斷優於常規 CT 或 MRI,對臨牀醫師手術方式及胃切除範圍的選擇有指導意義。
4.2.3.2 2.超聲檢查
超聲檢查(ultrasonography,US)因簡便易行、靈活直觀、無創無輻射等特點,可作爲胃癌患者的常規影像學檢查。充盈胃腔之後常規超聲可顯示病變部位胃壁層次結構,判斷浸潤深度,是對胃癌 T 分期的有益補充;彩色多普勒血流成像可以觀察病竈內血供;超聲雙重造影可在觀察病竈形態特徵的基礎上觀察病竈及周圍組織的微循環灌注特點;此外超聲檢查可發現腹盆腔重要器官及淋巴結有無轉移,頸部、鎖骨上淋巴結有無轉移;超聲引導下肝臟、淋巴結穿刺活檢有助於腫瘤的診斷及分期。
4.2.3.3 3.CT
CT 檢查應爲首選臨牀分期手段,我國多層螺旋CT廣泛普及,特別推薦胸腹盆腔聯合大範圍掃描。在無CT增強對比劑禁忌情況下均採用增強掃描,常規採用1mm 左右層厚連續掃描,並推薦使用多平面重建圖像,有助於判斷腫瘤部位、腫瘤與周圍臟器(如肝臟、胰腺、膈肌、結腸等)或血管關係及區分腫瘤與局部淋巴結,提高分期信心和準確率。爲更好地顯示病變,推薦口服陰性對比劑(一般掃描前口服500~800ml 水)使胃腔充分充盈、胃壁擴張,常規採用仰臥位掃描,對於腫瘤位於胃體下部和胃竇部,可以依檢查目的和患者配合情況採用特殊體位(如俯臥位、側臥位等),建議採用多期增強掃描。CT 對進展期胃癌的敏感性約爲65%-90%,早期胃癌約爲 50%:T 分期準確率爲70%-90%,N分期爲40%-70%。因而不推薦使用 CT 作爲胃癌初診的首選診斷方法,但在胃癌分期診斷中推薦爲首選影像方法。
4.2.3.4 4.MRI
推薦對 CT 對比劑過敏者或其他影像學檢查懷疑轉移者使用。MRI 有助於判斷腹膜轉移狀態,可酌情使用。增強MRI是胃癌肝轉移的首選或重要補充檢查,特別是注射肝特異性對比劑更有助於診斷和確定轉移病竈數目、部位。腹部MRI檢查對了解胃癌的遠處轉移情況與增強CT 的準確度基本一致,對胃癌 N 分期的準確度及診斷淋巴結侵犯的敏感性較CT在不斷提高,MRI 多 b 值彌散加權成像對胃癌N/T 分級有價值。MRI 具有良好的軟組織對比,隨着磁共振掃描技術的進步,對於進展期食管胃結合部癌,CT 平掃不能明確診斷,或腫瘤導致內鏡超聲檢查(endoscopic ultrasonography,EUS)無法完成時,推薦依據所在中心實力酌情嘗試MRI。
4.2.3.5 5.正電子發射計算機體層成像
正電子發射計算機體層成像(positron emissiontomography-computed tomography,PET-CT)可輔助胃癌分期,但不做常規推薦。如 CT 懷疑有遠處轉移可應用PET-CT評估患者全身情況,另外,研究顯示PET-CT 對於放化療或靶向治療的療效評價也有一定價值,但亦不做常規推薦。在部分胃癌組織學類型中,腫瘤和正常組織的代謝之間的呈負相關聯繫,如黏液腺癌,印戒細胞癌,低分化腺癌通常是18F-FDG 低攝取的,故此類患者應慎重應用。
4.2.3.6 6.單光子發射計算機體層攝影
骨掃描在探測胃癌骨轉移病變方面應用最廣、經驗豐富、性價比高,且具有較高的靈敏度,但在脊柱及侷限於骨髓內的病竈有一定的假陰性率,可與MRI 結合提高探測能力。對高度懷疑骨轉移的患者可行骨掃描檢查。
4.2.3.7 7.腫瘤標誌物
廣泛應用於臨牀診斷,而且腫瘤標誌物的聯合檢測爲我們提供了動態觀察腫瘤發生發展及臨牀療效評價和患者的預後,從而提高了檢出率和鑑別診斷準確度。建議常規推薦CA72-4、癌胚抗原(carcinoembryonic antigen,CEA)和CA19-9 , 可 在 部 分 患 者 中進一步檢測甲胎蛋白(alpha-fetoprotein,AFP)和CA125,CA125 對於腹膜轉移,AFP 對於特殊病理類型的胃癌,均具有一定的診斷和預後價值。CA242 和腫瘤特異性生長因子、胃蛋白酶原(pepsinogen,PG)Ⅰ和 PGⅡ的敏感性、特異性尚有待公認。目前腫瘤標誌物檢測常用自動化學發光免疫分析儀及其配套試劑。
4.2.3.8 8.胃鏡檢查
4.2.3.8.1 (1)篩查:
1)篩查對象:胃癌在一般人羣中發病率較低(33/10萬),內鏡檢查用於胃癌普查需要消耗大量的人力、物力資源,且患者接受度低。因此,只有針對胃癌高危人羣進行篩查,纔是可能行之有效的方法。我國建議以40 歲以上或有胃癌家族史者需進行胃癌篩查。符合下列第1 條和第2~6條中任一條者均應列爲胃癌高危人羣,建議作爲篩查對象:
①年齡40 歲以上,男女不限;
②胃癌高發地區人羣;
③幽門螺桿菌感染者;
④既往患有慢性萎縮性胃炎、胃潰瘍、胃息肉、手術後殘胃、肥厚性胃炎、惡性貧血等胃癌前疾病;
⑥存在胃癌其他高危因素(高鹽、醃製飲食、吸菸、重度飲酒等)。
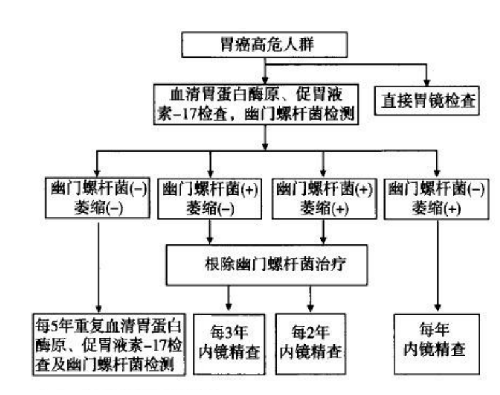
2)篩查方法:見圖 1。
血清 PG 檢測:我國胃癌篩查採用PGⅠ濃度≤70μg/L且 PGⅠ/PGⅡ≤3.0 作爲胃癌高位人羣標準。根據血清PG檢測和幽門螺桿菌抗體檢測結果對胃癌患病風險進行分層,並決定進一步檢查策略。
胃泌素 17(gastrin-17,G-17):血清G-17 濃度檢測可以診斷胃竇(G-17 水平降低)或僅侷限於胃體(G-17水平升高)的萎縮性胃炎。
上消化道鋇餐:X 線鋇餐檢查可能發現胃部病變,但敏感性及特異性不高,已被內鏡檢查取代,不推薦使用X線消化道鋇餐進行胃癌篩查。
內鏡篩查:內鏡及內鏡下活檢是目前診斷胃癌的金標準,近年來無痛胃鏡發展迅速,並已應用於胃癌高危人羣的內鏡篩查,極大程度上提高了胃鏡檢查的患者接受度。
4.2.3.8.2 (2)內鏡檢查技術
1)普通白光內鏡:普通白光內鏡是內鏡檢查技術的基礎,對於病變或疑似病變區域首先進行白光內鏡觀察,記錄病變區域自然狀態情況,而後再進行其他內鏡檢查技術。
2)化學染色內鏡:化學染色內鏡是在常規內鏡檢查的基礎上,將色素染料噴灑至需觀察的黏膜表面,使病竈與正常黏膜對比更加明顯。物理染色(靛胭脂、亞甲藍):指染料與病變間爲物理覆蓋關係,由於病變表面微結構與周圍正常黏膜不同,染料覆蓋後產生對光線的不同反射,從而突出病變區域與周圍正常組織間的界限。化學染色(醋酸、腎上腺素):指染料與病變區域間發生化學反應,從而改變病變區域顏色,突出病變邊界。
3)電子染色內鏡:電子染色內鏡可通過特殊光清晰觀察黏膜淺表微血管形態,常見電子染色內鏡包括窄帶成像技術、智能電子分光技術及智能電子染色內鏡。
4)放大內鏡:放大內鏡可將胃黏膜放大並觀察胃黏膜腺體表面小凹結構和黏膜微血管網形態特徵的細微變化,可用於鑑別胃黏膜病變的良惡性,判斷惡性病變的邊界和範圍。
5)EUS:EUS 是將超聲技術與內鏡技術相結合的一項內鏡診療技術。用於評估胃癌侵犯範圍及淋巴結情況。
6)其他內鏡檢查技術:激光共聚焦顯微內鏡:可顯示最高可放大 1000 倍的顯微結構,達到光學活檢的目的。熒光內鏡:以熒光爲基礎的內鏡成像系統,能發現和鑑別普通內鏡難以發現的癌前病變及一些隱匿的惡性病變。但上述方法對設備要求高,目前在臨牀常規推廣應用仍較少。
4.2.3.8.3 (3)胃鏡檢查操作指南:
胃鏡檢查是確診胃癌的必須檢查手段,可確定腫瘤位置,獲得組織標本以行病理檢查。內鏡檢查前必須充分準備,建議應用去泡劑和去黏液劑等。經口插鏡後,內鏡直視下從食管上端開始循腔進鏡,依次觀察食管、賁門、胃體、胃竇、幽門、十二指腸球部及十二指腸降部。退鏡時依次從十二指腸、胃竇、胃角、胃體、胃底賁門、食管退出。依次全面觀察、應用旋轉鏡身、屈曲鏡端及倒轉鏡身等方法觀察上消化道全部,尤其是胃壁的大彎、小彎、前壁及後壁,觀察黏膜色澤、光滑度、黏液、蠕動及內腔的形狀等。如發現病變則需確定病變的具體部位及範圍,並詳細在記錄表上記錄。檢查過程中,如有黏液和氣泡應用清水或去泡劑和去黏液劑及時沖洗,再繼續觀察。保證內鏡留圖數量和質量:爲保證完全觀察整個胃腔,如果發現病竈,另需額外留圖。同時,需保證每張圖片的清晰度。國內專家較爲推薦的是至少 40 張圖片。必要可酌情選用色素內鏡/電子染色內鏡或放大內鏡等圖像增強技術。
4.2.3.8.4 (4)早期胃癌的內鏡下分型:
見圖2。
1)早期胃癌的內鏡下分型依照2002 年巴黎分型標準及2005 年巴黎分型標準更新。淺表性胃癌(Type 0)分爲隆起型病變(0-Ⅰ)、平坦型病變(0-Ⅱ)和凹陷型病變(0-Ⅲ)。0-Ⅰ型又分爲有蒂型(0-Ⅰp)和無蒂型(0-Ⅰs)。0-Ⅱ型根據病竈輕微隆起、平坦、輕微凹陷分爲0-Ⅱa、0-Ⅱb和0-Ⅱc 3 個亞型。
2)0-Ⅰ型與 0-Ⅱa 型的界限爲隆起高度達到2.5mm(活檢鉗閉合厚度),0-Ⅲ型與 0-Ⅱc 型的界限爲凹陷深度達到1.2 mm(活檢鉗張開單個鉗厚度)。同時具有輕微隆起及輕微凹陷的病竈根據隆起/凹陷比例分爲0-Ⅱc+Ⅱa 及0-Ⅱa+Ⅱc 型。凹陷及輕微凹陷結合的病竈則根據凹陷/輕微凹陷比例分爲 0-Ⅲ+Ⅱc 和 0-Ⅱc+Ⅲ型。
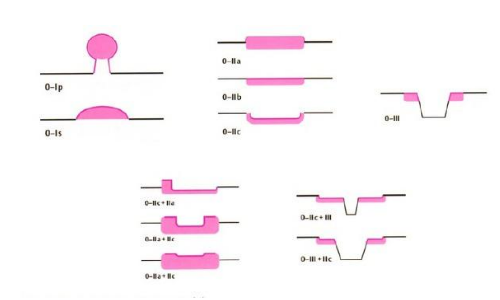
圖 2 胃癌的鏡下分型示意圖
3)早期胃癌精查及隨訪流程見圖3。
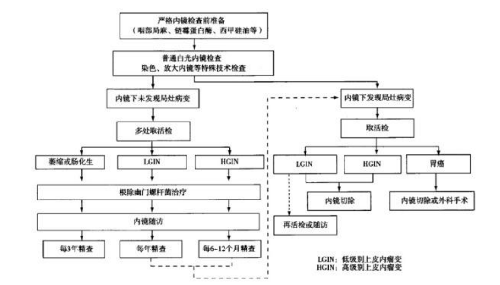
圖 3 胃癌精查和隨訪流程
4.2.3.8.5 (5)活檢病理檢查:
1)如內鏡觀察和染色等特殊內鏡技術觀察後未發現可疑病竈,可不取活檢。
2)活檢部位:爲提高活檢陽性率,不同類型病變取活檢時應注意選取活檢部位。
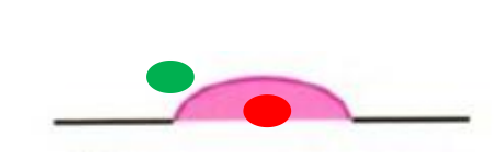
③潰瘍型病變:應於潰瘍堤內側活檢,不應活檢潰瘍底或潰瘍堤外側。
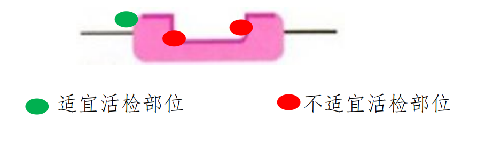
3)懷疑早期腫瘤性病變:直徑2cm 以下病變取1~2塊活檢,直徑每增加 1cm 可增加1 塊;傾向進展期癌的胃黏膜,避開壞死的區域,取材 6~8 塊。
①標本前期處置:活檢標本離體後,立即將標本展平,使黏膜的基底層面貼附在濾紙上。
②標本固定:置於充足(大於10 倍標本體積)的10%中性緩衝福爾馬林溶液(含 4%甲醛)中。包埋前固定時間須大於 6 小時,小於 48 小時。
③石蠟包埋:去除濾紙,將組織垂直定向包埋。包埋時,燒燙的鑷子不能直接接觸標本,先在蠟面減熱後再夾取組織,防止灼傷組織。
④蘇木精-伊紅(hematoxylin and eosin,HE)染色製片標準:修整蠟塊,要求連續切6~8 個組織面,撈取在同一張載玻片上。常規 HE 染色,封片。
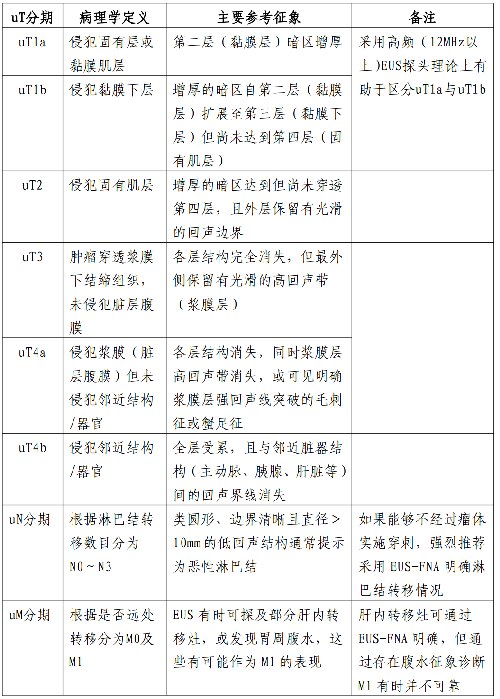
4.2.3.9 9.EUS
EUS 被認爲胃腸道腫瘤局部分期的最精確方法,在胃癌T 分期(特別是早期癌)和 N 分期不亞於或超過CT,常用以區分黏膜層和黏膜下層病竈,動態觀察腫瘤與鄰近臟器的關係,並可通過 EUS 引導下穿刺活檢淋巴結,明顯提高局部T、N 分期準確率,但 EUS 爲操作者依賴性檢查,因此,推薦在醫療水平較高的醫院或中心。對擬施行內鏡下黏膜切除(Endoscopic mucosal resection,EMR)、內鏡下黏膜下剝離術(Endoscopic submucosal dissection,ESD)等內鏡治療者必須進行此項檢查。EUS 能發現直徑5mm 以上淋巴結。淋巴結回聲類型、邊界及大小作爲主要的判斷標準,認爲轉移性淋巴結多爲圓形、類圓形低迴聲結構,其回聲常與腫瘤組織相似或更低,邊界清晰,內部回聲均勻,直徑>1cm;而非特異性炎性腫大淋巴結常呈橢圓形或三角形高回聲改變,邊界模糊,內部回聲均勻。超聲胃鏡檢查操作指南:規範的操作過程及全面、無遺漏的掃查是準確分期的基礎,以胃腫瘤分期爲目標的EUS應該至少包括自幽門回撤至食管胃結合部的全面掃查過程,爲準確評估第一站淋巴結,推薦自十二指腸球部回撤。在回撤過程中進行分期評估,並且留存腫瘤典型圖像及重要解剖標誌處圖像,如能做到動態的多媒體資料留存,可提高分期的準確率並提供回溯可能。掃查過程中應當注意胃腔的充盈及合適的探頭頻率選擇和適當的探頭放置,合適的焦距下圖像更加清晰,並避免壓迫病變導致錯誤分期。
4.2.4 (四)胃癌的診斷標準及內容。
4.2.4.1 1.定性診斷
採用胃鏡檢查進行病變部位活檢及病理檢查等方法明確病變是否爲癌、腫瘤的分化程度以及特殊分子表達情況等與胃癌自身性質和生物行爲學特點密切相關的屬性與特徵。除常規組織學類型,還應該明確Laurén 分型及HER2表達狀態。
4.2.4.2 2.分期診斷
胃癌的分期診斷主要目的是在制訂治療方案之前充分了解疾病的嚴重程度及特點,以便爲選擇合理的治療模式提供充分的依據。胃癌的嚴重程度可集中體現在局部浸潤深度、淋巴結轉移程度以及遠處轉移存在與否3 個方面,在臨牀工作中應選擇合適的輔助檢查方法以期獲得更爲準確的分期診斷信息。
4.2.4.3 3.臨牀表現
臨牀表現不能作爲診斷胃癌的主要依據,但是在制訂診治策略時,應充分考慮是否存在合併症及伴隨疾病會對整體治療措施產生影響。
4.2.5 (五)鑑別診斷。
4.2.5.1 1.胃良性潰瘍
與胃癌相比較,胃良性潰瘍一般病程較長,曾有典型潰瘍疼痛反覆發作史,抗酸劑治療有效,多不伴有食慾減退。除非合併出血、幽門梗阻等嚴重的合併症,多無明顯體徵,不會出現近期明顯消瘦、貧血、腹部腫塊甚至左鎖骨上窩淋巴結腫大等。更爲重要的是 X 線鋇餐和胃鏡檢查,良性潰瘍直徑常小於 2.5cm,圓形或橢圓形龕影,邊緣整齊,蠕動波可通過病竈;胃鏡下可見黏膜基底平坦,有白色或黃白苔覆蓋,周圍黏膜水腫、充血,黏膜皺襞向潰瘍集中。而癌性潰瘍與此有很大的不同,詳細特徵參見胃癌診斷部分。
4.2.5.2 2.胃淋巴瘤
佔胃惡性腫瘤的 2%-7%。95%以上的胃原發惡性淋巴瘤爲非霍奇金淋巴瘤,常廣泛浸潤胃壁,形成一大片淺潰瘍。以上腹部不適、胃腸道出血及腹部腫塊爲主要臨牀表現。
4.2.5.3 3.胃腸道間質瘤
間葉源性腫瘤,約佔胃腫瘤的3%,腫瘤膨脹性生長,可向黏膜下或漿膜下浸潤形成球形或分葉狀的腫塊。瘤體小症狀不明顯,可有上腹不適或類似潰瘍病的消化道症狀,瘤體較大時可捫及腹部腫塊,常有上消化道出血的表現。
4.2.5.4 4.胃神經內分泌腫瘤
神經內分泌腫瘤(neuroendocrine neoplasm,NEN)是一組起源於肽能神經元和神經內分泌細胞的具有異質性的腫瘤,所有神經內分泌腫瘤均具有惡性潛能。這類腫瘤的特點是能儲存和分泌不同的肽和神經胺。雖然胃腸胰NEN是一種少見的疾病,佔胃腸惡性腫瘤不足2%的比例,但目前在美國 NEN 是發病率僅次於結直腸癌的胃腸道惡性腫瘤。其診斷仍以組織學活檢病理爲金標準,然常規的HE 染色已不足以充分診斷 NEN,目前免疫組織化學染色方法中突觸素蛋白和嗜鉻粒蛋白 A 染色爲診斷 NEN 的必檢項目,並需根據核分裂象和 Ki-67 百分比對 NEN 進行分級。
4.2.5.5 5.胃良性腫瘤
約佔全部胃腫瘤的 2%左右,按組織來源可分爲上皮細胞瘤和間葉組織瘤,前者常見爲胃腺瘤,後者以平滑肌瘤、脂肪瘤、神經鞘瘤等較爲常見。一般體積較小,發展較慢。胃竇和胃體爲多發部位。多無明顯臨牀表現,X 線鋇餐爲圓形或橢圓形的充盈缺損,而非龕影;胃鏡下則表現爲黏膜下腫塊。
4.3 三、胃癌的病理與分期
4.3.1 (一)術語和定義。
4.3.1.1 1.胃癌
4.3.1.2 2.上皮內瘤變/異型增生
胃癌的癌前病變,上皮內瘤變和異型增生2 個名詞可通用。涉及胃上皮內瘤變/異型增生的診斷有3 種。
(1)無上皮內瘤變(異型增生):胃黏膜炎症、化生及反應性增生等良性病變。
(2)不確定上皮內瘤變(異型增生):不是最終診斷名詞,而是在難以確定胃黏膜組織和細胞形態改變的性質時使用的一種實用主義的描述。往往用於小活檢標本,特別是炎症背景明顯的小活檢標本,難以區分位於黏膜頸部區增生帶的胃小凹上皮增生及腸上皮化生區域化生上皮增生等病變的性質(如反應性或增生性病變)時。對此類病例,可以通過深切、重新取材等方法來明確診斷。
(3)上皮內瘤變(異型增生):以出現不同程度的細胞和結構異型性爲特徵的胃黏膜上皮增生,性質上是腫瘤性增生,但無明確的浸潤性生長的證據。病變累及小凹全長,包括表面上皮,這是診斷的重要依據。根據組織結構和細胞學特徵,胃上皮內瘤變(異型增生)可以分爲腺瘤型(腸型)和小凹或幽門型(胃型)兩種類型。大體檢查,胃黏膜上皮內瘤變(異型增生)可以呈息肉樣、扁平型或輕度凹陷狀生長。根據病變程度,將胃黏膜上皮內瘤變(異型增生)分爲低級別和高級別 2 級。
1)低級別上皮內瘤變:黏膜結構改變輕微;腺上皮細胞出現輕-中度異型,細胞核變長,但仍有極性,位於腺上皮基底部;可見核分裂。對息肉樣病變,也可使用低級別腺瘤。
2)高級別上皮內瘤變:黏膜腺體結構異型性明顯;細胞由柱狀變爲立方形,細胞核大、核漿比增高、核仁明顯;核分裂象增多,可見病理性核分裂。特別重要的是細胞核延伸至腺體腔側面、細胞極性喪失。對息肉樣病變,也可使用高級別腺瘤。
4.3.1.3 3.早期胃癌
4.3.1.4 4.進展期胃癌
癌組織侵達固有肌層或更深者,無論是否有淋巴結轉移。5.食管胃交界部腺癌
食管胃交界部腺癌是橫跨食管胃交界部的腺癌。解剖學上食管胃交界部是指管狀食管變爲囊狀胃的部位,即食管末端和胃的起始,相當於腹膜返折水平或希氏角或食管括約肌下緣,與組織學上的鱗柱交界不一定一致。
4.3.2 (二)標本類型及固定。
4.3.2.1 1.標本類型
日常工作中常見的標本類型包括:內鏡活檢標本,EMR/ESD,姑息性/根治切除術標本(近端胃切除標本、遠端胃切除標本和全胃切除標本)。
4.3.2.2 2.標本固定
(1)應及時、充分固定,採用10%中性緩衝福爾馬林固定液(含 4%甲醛),應立即固定(手術切除標本也儘可能半小時內),固定液應超過標本體積的10 倍以上,固定時間6~72 小時,固定溫度爲正常室溫。
(2)內鏡活檢標本:標本離體後,應由內鏡醫師或助手用小撥針將活檢鉗上的組織立即取下,並應在手指上用小撥針將其展平,取小塊濾紙,將展平的黏膜平貼在濾紙上,立即放入固定液中固定。
(3)EMR/ESD 標本:應由內鏡醫師展平標本,黏膜面向上,使用不生鏽的細鋼針固定於軟木板(或泡沫板)上,避免過度牽拉導致標本變形,亦不應使標本皺褶,標記口側及肛側方向,立即完全浸入固定液中。
(4)根治切除標本:通常是沿胃大彎側打開胃壁,如腫瘤位於胃大彎,則避開腫瘤沿大彎側打開胃壁,黏膜面向上,使用大頭針固定於軟木板(或泡沫板)上,板上應墊紗布,釘好後黏膜面向下,儘快(離體30 分鐘內)完全浸入固定液中。
4.3.3 (三)取材及大體描述指南。
取材時,應覈對基本信息,如姓名、送檢科室、牀位號、住院號、標本類型、數量等。
4.3.3.1 1.活檢標本
(2)取材:送檢黏膜全部取材,應將黏膜包於濾紙中以免丟失,取材時應滴加伊紅,利於包埋和切片時技術員辨認。大小相差懸殊的要分開放入不同脫水盒,防止小塊活檢組織漏切或過切。包埋時需注意一定要將展平的黏膜立埋(即黏膜垂直於包埋盒底麪包埋)。一個蠟塊中組織片數不宜超過 3 片、平行方向立埋。蠟塊邊緣不含組織的白邊儘量用小刀去除,建議每張玻片含6-8 個連續組織片,便於連續觀察。
4.3.3.2 2.EMR/ESD 標本
(1)大體檢查及記錄:測量並記錄標本大小(最大徑×最小徑×厚度),食管胃交界部標本要分別測量食管和胃的長度和寬度。記錄黏膜表面的顏色,是否有肉眼可見的明顯病變,病變的輪廓是否規則,有無明顯隆起或凹陷,有無糜爛或潰瘍等,記錄病變的大小(最大徑×最小徑×厚度)、大體分型(見附錄)以及病變距各切緣的距離(至少記錄病變與黏膜側切緣最近距離)。複雜標本建議臨牀病理溝通或由手術醫師提供標本延展及重建的示意圖。
(2)取材:EMR/ESD 標本應全部取材。垂直於最近側切緣取材。黏膜側切緣與基底切緣可用墨汁或碳素墨水標記(有條件的可於口側和肛側塗不同顏色以便於辨別),以便在鏡下觀察時能夠對切緣做出定位,並評價腫瘤切緣情況。食管胃交界部標本宜沿口側-肛側的方向取材,以更好的顯示腫瘤與食管胃交界的關係。每間隔2~3mm 平行切開,全部取材。如果標本太大,可以進行改刀,將1 條分爲多條,分別標記 a、b 等。按同一方向立埋(包埋第一塊和最後一塊的刀切面,如果第一塊和最後一塊鏡下有病變,再翻轉180°包埋,以確保最終切片觀察黏膜四周切緣情況),並記錄組織塊對應的包埋順序/部位。記錄組織塊對應的部位(建議附照片或示意圖並做好標記)。建議將多塊切除的標本分別編號和取材,不需考慮側切緣的情況,其他同單塊切除標本。
4.3.3.3 3.根治術標本
(1)大體檢查及記錄:應根據幽門及賁門的特徵來正確定位。測量胃大彎、小彎長度,胃網膜的體積;檢查黏膜面,應描述腫瘤的部位、大小(新輔助治療後標本,測量瘤牀的大小;內鏡下黏膜切除術後標本,描述潰瘍/黏膜缺損區/瘢痕的大小以及有無腫瘤的殘餘)、數目、大體分型(見附錄)、外觀描寫、浸潤深度、浸潤範圍、腫瘤與兩側切緣及環周切緣的距離。應觀察除腫瘤以外的胃壁黏膜是否有充血、出血、潰瘍、穿孔等其他改變;觀察漿膜面有無充血、出血、滲出、穿孔、腫瘤浸潤等;腫瘤周圍胃壁有無增厚及彈性情況;如有另送的脾臟、十二指腸等,依次描述。近端胃癌建議報與食管胃交界部的關係:累及/未累及食管胃交界部(腫瘤與食管胃交界部的關係:腫瘤完全位於食管,未累及食管胃交界部;腫瘤中心位於遠端食管,累及食管胃交界部;腫瘤中心位於食管胃交界部;腫瘤中心位於近端胃,累及食管胃交界部)。累及食管胃交界部者,記錄腫瘤中心距食管胃交界部的距離(單位:cm)(用於Siewert分型,見附錄)。遠端胃癌建議報與十二指腸的關係。
(2)取材:可自腫瘤中心從口側切緣至肛側切緣取一條組織分塊包埋(包括腫瘤、腫瘤旁黏膜及兩端切緣),並記錄組織塊對應的方位(宜附照片或示意圖並做好標記)。推薦縱向取兩端切緣與腫瘤的關係,對腫瘤距兩端切緣較遠者,也可橫向取兩端切緣。單獨送檢的閉合器切緣應剔除閉合器後全部取材觀察。對腫瘤侵犯最深處及可疑環周切緣受累處應重點取材。對早期癌或新輔助治療後病變不明顯的根治術標本,建議將可疑病變區和瘤牀全部取材。對周圍黏膜糜爛、粗糙、充血、出血、潰瘍、穿孔等改變的區域或周圍食管/胃壁內結節及食管胃交界部組織應分別取材。若附其他鄰近器官應觀察取材。應按外科醫師已分組的淋巴結取材。如外科醫師未送檢分組淋巴結,應按淋巴結引流區域對胃周淋巴結進行分組。應描述淋巴結的數目及大小,有無融合,有無與周圍組織粘連,如有粘連,注意需附帶淋巴結周圍的結締組織。所有檢出淋巴結均應取材。未經新輔治療的根治術標本應至少檢出 16 枚淋巴結,最好30 枚淋巴結以上。推薦取材組織大小不大於 2.0cm×1.5cm×0.3cm。
4.3.4 (四)病理診斷分型、分級和分期方案。
4.3.4.1 1.組織學分型(見附錄):
推薦同時使用WHO(消化系統腫瘤)和 Laurén 分型(腸型、瀰漫型、混合型,未分型)。
4.3.4.2 2.組織學分級
依據腺體的分化程度分爲高分化、中分化和低分化(高級別、低級別)。
4.3.4.3 3.胃癌分期
推薦美國癌症聯合會(American Joint CommitteeonCancer,AJCC)和國際抗癌聯盟(Union for InternationalCancer Control,UICC)聯合制定的分期。4.新輔助治療後根治術標本的病理學評估新輔助治療後病理學改變的基本特徵包括腫瘤細胞退變、消退,大片壞死、纖維組織增生、間質炎症細胞浸潤、鈣鹽沉積等。可能出現大的無細胞黏液湖,不能將其認爲是腫瘤殘餘。胃癌的療效分級系統宜採用美國病理學家學會/美國國家綜合癌症網絡(The National ComprehensiveCancer Network,NCCN)指南的標準(見附錄)。
4.3.5 (五)病理報告內容及指南。
胃癌的病理報告應包括與患者治療和預後相關的所有內容,如標本類型、腫瘤部位、大體分型、大小及數目、組織學類型、亞型及分級、浸潤深度、脈管和神經侵犯、周圍黏膜情況、淋巴結情況、環周及兩端切緣情況等。推薦報告最後註明 pTNM 分期。
1.大體描寫:包括標本類型、腫瘤部位、大體分型、大小(腫瘤大小應量出三維的尺寸)及數目。
2.主體腫瘤:組織學類型及分級、Laurén 分型(腸型、瀰漫型、混合型或不確定型)、浸潤深度(包括黏膜固有層、黏膜肌層、黏膜下層、淺肌層、深肌層、漿膜下層、漿膜層及周圍組織或器官。對於黏膜下層浸潤癌,如爲內鏡下切除標本,應測量黏膜下層浸潤深度,建議區分SM1(黏膜下層侵犯深度<500μm)和 SM2(黏膜下層侵犯深度>500μm);如爲根治切除術標本,建議區分SM1(黏膜下層上1/3)、SM2(黏膜下層中 1/3)和 SM3(黏膜下層下1/3)、切緣(內鏡下切除標本包括側切緣和基底切緣,根治切除標本包括口側、肛側切緣及環周切緣;切緣的情況要說明,包括浸潤癌或上皮內瘤變/異型增生;建議註明距切緣的距離)、淋巴管/血管浸潤(尤其是對於內鏡下切除標本,如果懷疑有淋巴管/血管浸潤,建議做免疫組化CD31/CD34、D2-40確定是否有淋巴管/血管浸潤;EVG 染色判斷有無靜脈侵犯)、神經侵犯。胃的潰瘍病竈或潰瘍瘢痕可影響EMR/ESD 手術及對預後的判斷,是病理報告中的一項重要內容。
3.癌旁:上皮內瘤變/異型增生及程度,有無胃炎及類型。
4.淋巴結轉移情況:轉移淋巴結數/淋巴結總數。宜報轉移癌侵及淋巴結被膜外的數目。
5.治療反應(新輔助治療的病例)。
6.應報告合併的其他病變。
7.胃腺癌和食管胃交界部腺癌應做HER2 免疫組化檢測及錯配修復蛋白(MLH1、PMS2、MSH2、MSH6)免疫組化檢測和/或 MSI 檢測。在有條件的單位開展PD-L1 檢測。
8.備註報告內容包括重要的相關病史(如相關腫瘤史和新輔助治療史)。
9.pTNM 分期。
4.3.6 (六)內鏡下切除病理報告中的幾個問題。
4.3.6.1 1.腫瘤侵犯深度:
腫瘤侵犯深度的判斷是以垂直切緣陰性爲前提的,黏膜下層的浸潤深度還是判斷病變是否完整切除的重要指標之一,侵犯黏膜下層越深則淋巴結轉移的可能性越高。胃以500μm爲界,不超過爲SM1,超過爲SM2。黏膜下層浸潤深度的測量方法,根據腫瘤組織內黏膜肌層的破壞程度不同而不同。若腫瘤組織內尚可見殘存的黏膜肌層,則以殘存的黏膜肌層下緣爲基準,測量至腫瘤浸潤前鋒的距離。若腫瘤組織內沒有任何黏膜肌層,則以腫瘤最表面爲基準,測量至腫瘤浸潤前鋒的距離。
4.3.6.2 2.切緣情況:
組織標本的電灼性改變是ESD標本切緣的標誌。切緣陰性是在切除組織的各個水平或垂直電灼緣均未見到腫瘤細胞。切緣陰性,但癌竈距切緣較近,應記錄癌竈與切緣最近的距離;水平切緣陽性,應記錄陽性切緣的塊數;
垂直切緣陽性,應記錄腫瘤細胞所在的部位(固有層或黏膜下層)。電灼緣的變化對組織結構、細胞及其核的形態的觀察會有影響,必要時可做免疫組織化學染色幫助判斷切緣是否有癌竈殘留。
4.3.6.3 3.脈管侵犯情況:
ESD 標本有無淋巴管、血管(靜脈)的侵犯是評判是否需要外科治療的重要因素之一。腫瘤侵犯越深,越應注意有無侵犯脈管的狀況。黏膜下浸潤的腫瘤組織如做特殊染色或免疫組織化學染色(如CD31/CD34、D2-40),常能顯示在HE染色中易被忽略的脈管侵犯。
4.3.6.4 4.有無潰瘍和黏膜其他病變:
胃的潰瘍或潰瘍瘢痕可影響ESD手術,以及對預後的判斷,是病理報告中的一項重要內容。而周圍黏膜的非腫瘤性病變,包括炎症、萎縮、化生等改變及其嚴重程度也應有所記錄。
4.3.6.5 5.pT1低分化癌、脈管侵犯、切緣陽性
應當再行外科手術擴大切除範圍。其他情況,內鏡下切除充分即可,但術後需定期隨訪。
4.3.6.6 6.預後不良的組織學特徵
4.3.6.7 7.陽性切緣
4.4 四、胃癌的治療
4.4.1 (一)治療原則。
應當採取綜合治療的原則,即根據腫瘤病理學類型及臨牀分期,結合患者一般狀況和器官功能狀態,採取多學科綜合治療(multidisciplinary team,MDT)模式(包括胃腸外科、消化內科、腫瘤內科、內鏡中心、放療科、介入科、影像科、康復科、營養科、分子生物學家、生物信息學家等),有計劃、合理地應用手術、化療、放療和生物靶向等治療手段,達到根治或最大幅度地控制腫瘤,延長患者生存期,改善生活質量的目的。
1.早期胃癌且無淋巴結轉移證據,可根據腫瘤侵犯深度,考慮內鏡下治療或手術治療,術後無需輔助放療或化療。
2.局部進展期胃癌或伴有淋巴結轉移的早期胃癌,應當採取以手術爲主的綜合治療。根據腫瘤侵犯深度及是否伴有淋巴結轉移,可考慮直接行根治性手術或術前先行新輔助化療,再考慮根治性手術。成功實施根治性手術的局部進展期胃癌,需根據術後病理分期決定輔助治療方案(輔助化療,必要時考慮輔助化放療)。
3.復發/轉移性胃癌應當採取以藥物治療爲主的綜合治療手段,在恰當的時機給予姑息性手術、放療、介入治療、射頻治療等局部治療,同時也應當積極給予鎮痛、支架置入、營養支持等最佳支持治療。
4.4.2 (二)早期胃癌內鏡治療。
早期胃癌的治療方法包括內鏡下切除和外科手術。與傳統外科手術相比,內鏡下切除具有創傷小、併發症少、恢復快、費用低等優點,且療效相當,5 年生存率均可超過90%。因此,國際多項指南和本共識均推薦內鏡下切除爲早期胃癌的首選治療方式。早期胃癌內鏡下切除術主要包括EMR和ESD。
4.4.2.1 1.內鏡治療有關定義及術語
(1)整塊切除:病竈在內鏡下被整塊切除並獲得單塊標本。
(2)水平/垂直切緣陽性:內鏡下切除的標本固定後每隔 2 mm 垂直切片,若標本側切緣有腫瘤細胞浸潤爲水平切緣陽性,若基底切緣有腫瘤細胞浸潤則稱爲垂直切緣陽性。
(3)完全切除:整塊切除標本水平和垂直切緣均爲陰性稱爲完全切除。
(5)非治癒性切除:存在下列情況之一者:
①非完全切除,包括非整塊切除和/或切緣陽性;
②存在引起淋巴結轉移風險的相關危險因素,如黏膜下侵及深度超過500μm、脈管浸潤、腫瘤分化程度較差等。
(6)局部復發:指術後 6 個月以上原切除部位及周圍1cm 內發現腫瘤病竈。
(7)殘留:指術後 6 個月內原切除部位及周圍1cm內病理髮現腫瘤病竈。
(8)同時性復發:指胃癌內鏡治療後12 個月內發現新的病竈:即內鏡治療時已存在但被遺漏的、術後12個月內經內鏡發現的繼發性病竈。
(9)異時性復發:指治療後超過12 個月發現新的病竈。大部分病竈出現在胃內原發病竈的鄰近部位,且病理組織類型相同。
4.4.2.2 2.內鏡治療術前評估:
需根據以下內容判定是否行ESD或 EMR。
(1)組織學類型:組織病理學類型通常由活檢標本的組織病理學檢查來確定,雖已有報道指出,組織病理學類型可一定程度通過內鏡預測,但尚缺乏充足證據。
(2)大小:採用常規內鏡檢測方法測量病變大小容易出錯,難以準確判斷術前病竈大小,因此,一般以切除後組織的測量及病理學檢查作爲最終檢查結果。
(3)是否存在潰瘍注意觀察病變是否存在潰瘍,如存在,需檢查是屬於活動性潰瘍還是潰瘍瘢痕。潰瘍組織病理定義爲至少 UL-Ⅱ深度的黏膜缺損(比黏膜肌層更深)。術前胃鏡中,活動性潰瘍一般表現爲病變表面覆蓋白色滲出物,不包括淺表糜爛。此外,潰瘍處在癒合或瘢痕階段時,黏膜皺襞或褶皺會向一箇中心聚合。
(4)浸潤深度目前常規使用內鏡檢查來判斷早期胃癌的侵犯深度,並推薦使用放大內鏡輔助判斷。當前述方法難以判斷浸潤深度時,EUS 可以作爲輔助診斷措施,效果明顯。
4.4.2.3 3.內鏡治療技術
(1)EMR:EMR 指內鏡下將黏膜病竈整塊或分塊切除、用於胃腸道表淺腫瘤診斷和治療的方法。目前尚缺乏足夠的EMR 治療早期胃癌的前瞻性研究,不推薦使用EMR 治療早期胃癌。
(2)ESD:目前推薦 ESD 作爲早期胃癌內鏡下治療的標準手術方式。
1)定義:ESD 是在 EMR 基礎上發展起來的新技術,根據不同部位、大小、浸潤深度的病變,選擇使用的特殊電切刀,如 IT 刀、Dual 刀、Hook 刀等,內鏡下逐漸分離黏膜層與固有肌層之間的組織,最後將病變黏膜及黏膜下層完整剝離的方法。
2)操作步驟:操作大致分爲5 步:
①病竈周圍標記;
②黏膜下注射,使病竈明顯抬起;
③環形切開黏膜;
④黏膜下剝離,使黏膜與固有肌層完全分離開,一次完整切除病竈;
(3)其他治療技術:內鏡下其他治療方法包括激光療法、氬氣刀和微波治療等,它們只能去除腫瘤,但不能獲得完整病理標本,也不能肯定腫瘤是否完整切除。因此,多用於胃癌前病變的治療,治療後需要密切隨訪,不建議作爲早期胃癌的首選治療方式。
4.4.2.4 4.早期胃癌內鏡治療適應證(表1)
表 1 早期胃癌內鏡治療絕對和相對適應證浸潤深度 分化 未分化cT1a(M)

* 僅適用於 ESD
早期胃癌內鏡治療的絕對適應證:肉眼可見黏膜內(cT1a)分化癌,必須無潰瘍(瘢痕)發生,即UL(–)。當侵犯深度、病變直徑、分化程度和合並潰瘍UL(+)其中一項超出上述標準,淋巴結轉移風險極低時,也可以考慮進行內鏡治療。對於 EMR/ESD 治療後局部黏膜病竈復發患者,可行擴大適應證進行處理。
4.4.2.5 5.早期胃癌內鏡治療禁忌證
國內目前較爲公認的內鏡切除禁忌證爲:
(2)癌症侵犯固有肌層;
另外,ESD 的相對手術禁忌證還包括抬舉徵陰性,即指在病竈基底部的黏膜下層注射鹽水後局部不能形成隆起,提示病竈基底部的黏膜下層與肌層之間已有粘連;此時行 ESD 治療,發生穿孔的危險性較高,但是隨着ESD操作技術的熟練,即使抬舉徵陰性也可以安全地進行ESD。
4.4.2.6 6.圍手術期處理
(1)術前準備:術前評估患者全身狀況,排除麻醉及內鏡治療禁忌證。取得患者及家屬知情同意後,簽署術前知情同意書。
(2)術後處理:術後第 1 天禁食;密切觀察生命體徵,無異常術後第 2 天進流質或軟食。術後1 周是否複查內鏡尚存爭議。
(3)術後用藥:潰瘍治療:內鏡下切除早期胃癌後潰瘍,可使用質子泵抑制劑(proton pump inhibitor,PPI)或 H2受體拮抗劑(H2 receptor antagonist,H2RA)進行治療。抗菌藥物使用:對於術前評估切除範圍大、操作時間長和可能引起消化道穿孔者,可以考慮預防性使用抗菌藥物。
4.4.2.7 7.術後併發症及處理
ESD 術後常見併發症主要包括出血、穿孔、狹窄、腹痛、感染等。
(1)出血:術中出血推薦直接電凝止血,遲發性出血可用止血夾或電止血鉗止血。
(2)穿孔:術中穿孔多數病例可通過金屬夾閉裂口進行修補。當穿孔較大時,常難以進行內鏡治療而需要緊急手術。
(3)狹窄:胃腔狹窄或變形發生率較低,主要見於賁門、幽門或胃竇部面積較大的ESD 術後。內鏡柱狀氣囊擴張是一種有效的治療方式。
4.4.2.8 8.預後評估及隨訪
在內鏡切除後的治癒性評價方面,現行內鏡的治癒性切除和 R0 切除容易混淆。R0 切除意味着陰性切緣,但內鏡下的陰性切緣並不能意味着治癒性切除。爲統一預後評估標準,本指南推薦採用 eCura 評價系統(表2)。隨訪方法見表3。
表 2 eCura 評價系統分期 潰瘍/深度 分化型 未分化型pT1a(M)
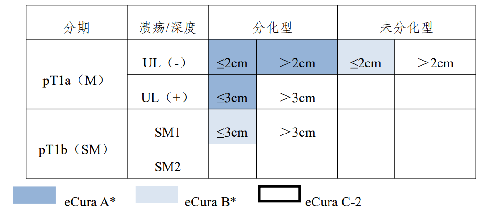
*需滿足 en bloc 整塊切除,HM0,VM0,ly(-),v(-)
表 3 不同 eCura 評價結果的隨訪方法eCura A 每 6~12 個月進行內鏡隨訪

eCura C1:在分化型癌中,滿足eCura A 或B 的其他條件,但未實現 en bloc 切除或HM0 的局部未能完整切除的病例,即 eCura C1。可以採用局部治療,例如再次行ESD、內鏡下消融等,同樣也可以考慮到ESD 的熱效應,採取積極隨訪的辦法。
eCura C2:病理提示淋巴結轉移風險高。雖然存在較高的淋巴結轉移風險,但是根據病例具體情況,在充分告知淋巴結轉移風險後,可以選擇 ESD 的方式給予治療。值得關注的是 eCura C 患者在選擇是否追加手術及手術時機的掌控方面尚存在爭論,主要集中在以下3 個方面。
(1)80%以上的 eCura C 患者並未出現局部復發或淋巴結轉移。
(2)對於脈管浸潤、神經侵犯、淋巴結侵犯及水平/垂直切緣等用於評價的危險因素在病變復發中起到的作用及影響尚需進一步細化。
(3)ESD 術後立即追加手術的eCura C 患者與ESD術後發生局部復發再行手術的患者,在預後方面並無顯著差異。
綜上所述,eCura C 患者是否需要立即追加手術尚需更詳細的臨牀研究數據支持。
4.4.3 (三)手術治療。
4.4.3.1 1.手術治療原則
手術切除是胃癌的主要治療手段,也是目前治癒胃癌的唯一方法。胃癌手術分爲根治性手術與非根治性手術。根治性手術應當完整切除原發病竈,並且徹底清掃區域淋巴結,主要包括標準手術、改良手術和擴大手術;非根治性手術主要包括姑息手術和減瘤手術。
4.4.3.1.1 (1)根治性手術:
①標準手術是以根治爲目的,要求必須切除 2/3 以上的胃,並且進行D2 淋巴結清掃。
②改良手術主要針對分期較早的腫瘤,要求切除部分胃或全胃,同時進行 D1 或 D1+淋巴結清掃。
③擴大手術包括聯合臟器切除或(和)D2 以上淋巴結清掃的擴大手術。
4.4.3.1.2 (2)非根治性手術:
①姑息手術主要針對出現腫瘤併發症的患者(出血、梗阻等),主要的手術方式包括胃姑息性切除、胃空腸吻合短路手術和空腸營養管置入術等。②減瘤手術主要針對存在不可切除的肝轉移或者腹膜轉移等非治癒因素,也沒有出現腫瘤併發症所進行的胃切除,目前不推薦開展。
4.4.3.2 2.治療流程
根據 cTNM 分期,以外科爲主的治療流程見圖4,術後治療流程見圖 5。
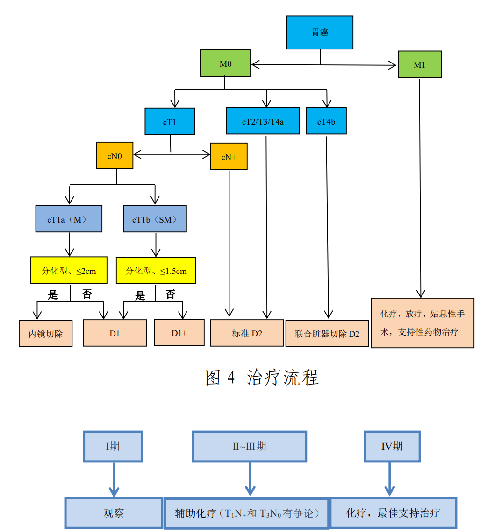
圖 5 術後治療(根據術後pTNM 分期)
4.4.3.3 3.安全切緣的要求
(1)對於 T1 腫瘤,應爭取2 cm 的切緣,當腫瘤邊界不清時,應進行內鏡定位。
(2)對於 T2 以上的腫瘤,BorrmannⅠ型和Ⅱ型建議至少 3cm 近端切緣,BorrmannⅢ型和Ⅳ型建議至少5cm近端切緣。
(4)對於食管侵犯的腫瘤,建議切緣3-5cm 或冰凍切片檢查爭取 R0 切除。
4.4.3.4 4.胃切除範圍的選擇
對於不同部位的胃癌,胃切除範圍是不同的。位於胃下部癌進行遠側胃切除術或者全胃切除術,位於胃體部癌進行全胃切除術,位於胃食管結合部癌進行近側胃切除術或者全胃切除術。
根據臨牀分期:
(1)cT2-4 或 cN(+)的胃癌,通常選擇標準胃部分切除或者全胃切除術。
(2)cT1N0M0 胃癌,根據腫瘤位置,除了可以選擇上述手術方式以外,還可以選擇近端胃切除、保留幽門的胃切除術、胃局部切除等。
(3)聯合臟器切除的問題,如果腫瘤直接侵犯周圍器官,可行根治性聯合臟器切除。對於腫瘤位於胃大彎側,存在 No.4sb 淋巴結轉移時,考慮行聯合脾切除的全胃切除手術。其他情況下,除了腫瘤直接侵犯,不推薦行預防性脾切除術。
4.4.3.5 5.淋巴結清掃
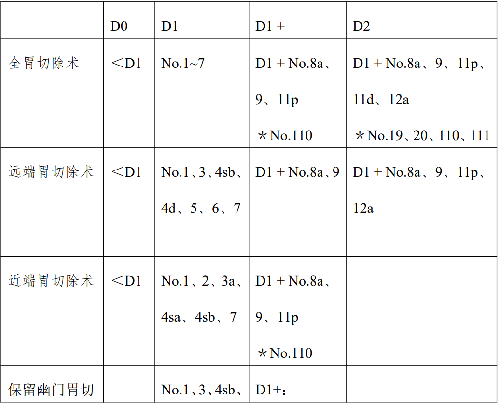
根據目前的循證醫學證據和國內外指南,淋巴結清掃範圍要依據胃切除範圍來確定(表3)。D1 切除包括切除胃大、小網膜及其包含在賁門左右、胃大、小彎以及胃右動脈旁的幽門上、幽門下淋巴結以及胃左動脈旁淋巴結。對於 cT1aN0 和cT1bN0、分化型、直徑<1.5cm的胃癌行 D1 清掃;對於上述以外的cT1N0 胃癌行D1+清掃。D2 切除是在 D1 的基礎上,再清掃腹腔幹、肝總動脈、脾動脈和肝十二指腸韌帶的淋巴結(胃周淋巴結分組見附錄)。至少清掃 16 枚以上的淋巴結才能保證準確的分期和預後判斷。對於 cT2-4 或者 cN(+)的腫瘤應進行D2清掃。當淋巴結清掃的程度不完全符合相應D 標準時,可以如實記錄爲:D1(+ No.8a)、D2(-No 10)等。
表 3 淋巴結清掃範圍

擴大的淋巴結清掃:對於以下情況,應該考慮D2以上範圍的擴大淋巴結清掃。
①浸潤胃大彎的進展期胃上部癌推薦行 D2+No.10 清掃。
②胃下部癌同時存在No.6 組淋巴結轉移時推薦行 D2+No.14v 淋巴結清掃。
③胃下部癌發生十二指腸浸潤推薦行 D2+No.13 淋巴結清掃。
脾門淋巴結清掃的必要性以及如何清掃存在較大爭議。不同文獻報道脾門淋巴結轉移率差異較大。T1、T2 期胃癌患者不需行脾門淋巴結清掃。因此建議以下情形行脾門淋巴結清掃:原發腫瘤>6cm,位於大彎側,且術前分期爲T3或T4的中上部胃癌。
4.4.3.6 6.胃食管結合部癌
目前對於胃食管結合部癌,胃切除術範圍與淋巴結清掃範圍尚未形成共識。根據目前的循證醫學證據,有以下推薦
(1)腫瘤中心位於胃食管結合部上下2cm 以內、長徑<4cm 食管胃結合部癌可以選擇近端胃切除(+下部食管切除)或者全胃切除術(+下部食管切除)。cT1 腫瘤推薦清掃淋巴結範圍 No.1、2、3、7、9、19、20。cT2-4 腫瘤推薦清掃淋巴結範圍 No.1、2、3、7、8a、9、11p、11d、19、20。腫瘤中心位於食管胃結合部以上的追加清掃下縱隔淋巴結。
(2)腫瘤侵犯食管<3 cm 時,推薦經腹經膈肌手術;侵犯食管長度>3 cm 且可能是治癒手術時,應考慮開胸手術。
4.4.3.7 7.腹腔鏡手術
指徵:胃癌侵潤深度在 T2 以內者,或進行腹腔鏡探查分期。目前有越來越多的臨牀研究結果證實了進展期胃癌實施腹腔鏡的安全性和遠期療效,但各中心應根據自己團隊的經驗謹慎選擇其指徵,進一步開展隨機對照研究進行探索。
4.4.3.8 8.消化道重建
不同的胃切除方式,有不同的消化道重建方式。重建推薦使用各種吻合器,以增加吻合的安全性和減少併發症。根據目前的循證醫學證據,針對不同的胃切除方式,做出如下推薦。
(1)全胃切除術後重建方式:Roux-en-Y 吻合、空腸間置法。
(2)遠端胃切除術後重建方式:BillrothⅠ式、BillrothⅡ式聯合 Braun 吻合、Roux-en-Y 吻合、空腸間置法。
4.4.3.9 9.其他
(1)脾切除:原發 T2-T4 腫瘤直接侵入脾臟或位於胃上部大彎。不推薦淋巴結清掃爲目的的脾切除。
(2)對於 T1 / T2 腫瘤,可以保留距胃網膜血管弓超過 3cm 的大網膜。
(3)原發或轉移病竈直接侵入鄰近器官的腫瘤,可以進行所涉及器官的聯合切除,以期獲得R0 切除。
4.4.3.10 10.圍手術期藥物管理
4.4.3.10.1 (1)抗菌藥物:
預防性使用:胃癌手術的切口屬Ⅱ類切口,可能污染的細菌爲革蘭陰性桿菌,鏈球菌屬,口咽部厭氧菌(如消化鏈球菌),推薦選擇的抗菌藥物種類爲第一、二代頭孢菌素,或頭黴素類;對β-內酰胺類抗菌藥物過敏者,可用克林素黴+氨基糖苷類,或氨基糖苷類+甲硝唑。給藥途徑爲靜脈滴注;應在皮膚、黏膜切開前 0.5~1 小時內或麻醉開始時給藥,在輸注完畢後開始手術,保證手術部位暴露時局部組織中抗菌藥物已達到足以殺滅手術過程中沾染細菌的藥物濃度。抗菌藥物的有效覆蓋時間應包括整個手術過程。如手術時間超過 3 小時或超過所用藥物半衰期的2 倍以上,或成人出血量超過 1500ml,術中應追加1 次。Ⅱ類切口手術的預防用藥爲 24 小時,必要時可延長至48 小時。過度延長用藥時間並不能進一步提高預防效果,且預防用藥時間超過48小時,耐藥菌感染機會增加。
治療使用:根據病原菌、感染部位、感染嚴重程度和患者的生理、病理情況及抗菌藥物藥效學和藥動學證據制訂抗菌治療方案,包括抗菌藥物的選用品種、劑量、給藥頻次、給藥途徑、療程及聯合用藥等。一般療程宜用至體溫正常、症狀消退後 72~96 小時。
4.4.3.10.2 (2)營養支持治療:
推薦使用患者參與的主觀全面評定(patient-generated subjective global assessment,PG-SGA)聯合營養風險篩查(nutritional risk screening,NRS)2002 進行營養風險篩查與評估。NRS2002≥3 分或 PG-SGA 評分在2~8 分的患者,應術前給予營養支持;NRS2002≥3 分PG-SGA 評分≥9 分的擇期手術患者給予 10~14 天的營養支持後手術仍可獲益。開腹大手術患者,無論其營養狀況如何,均推薦手術前使用免疫營養 5~7 天,並持續到手術後 7 天或患者經口攝食>60%需要量時爲止。免疫增強型腸內營養應同時包含ω-3 多不飽和脂肪酸、精氨酸和核苷酸三類底物。單獨添加上述3 類營養物中的任 1 種或 2 種,其作用需要進一步研究。首選口服腸內營養支持。
中度營養不良計劃實施大手術患者或重度營養不良患者建議在手術前接受營養治療1~2 周,即使手術延遲也是值得的。預期術後 7 天以上仍然無法通過正常飲食滿足營養需求的患者,以及經口進食不能滿足60%需要量1 周以上的患者,應給予術後營養治療。術後患者推薦首選腸內營養;鼓勵患者儘早恢復經口進食,對於能經口進食的患者推薦口服營養支持;對不能早期進行口服營養支持的患者,應用管飼餵養,胃癌患者推薦使用鼻空腸管行腸內營養。
補充性腸外營養給予時機:NRS2002≤3 分或NUTRIC評分≤5 分的低營養風險患者,如果腸內營養未能達到60%目標能量及蛋白質需要量超過 7 天時,才啓動腸外營養支持治療;NRS2002≥5 分或 NUTRIC 評分≥6 分的高營養風險患者,如果腸內營養在 48~72 小時內無法達到60%目標能量及蛋白質需要量時,推薦早期實施腸外營養。當腸內營養的供給量達到目標需要量 60%時,停止腸外營養。
4.4.3.10.3 (3)疼痛的處理:
不推薦在術前給予患者阿片類藥物或非選擇性非甾體抗炎藥,因爲不能獲益。手術後疼痛是機體受到手術刺激(組織損傷)後的一種反應。有效的術後疼痛治療,可減輕患者痛苦,也有利於康復。推薦採用多模式鎮痛方案,非甾體抗炎藥被美國和歐洲多個國家的指南推薦爲術後鎮痛基礎用藥。多模式鎮痛還包括口服對乙酰氨基酚、切口局部浸潤注射羅哌卡因或聯合中胸段硬膜外鎮痛等。由於阿片類藥物不良反應較大,包括影響胃腸功能恢復、呼吸抑制、頭暈、噁心、嘔吐等,應儘量避免或減少阿片類鎮痛藥物的應用。
4.4.3.10.4 (4)術後噁心嘔吐的處理:
全部住院患者術後噁心嘔吐(postoperative nausea and vomiting,PONV)的發生率 20%~30%,主要發生在術後24~48 小時內,少數可持續達 3~5 天。相關危險因素:女性、術後使用阿片類鎮痛藥、非吸菸、有 PONV 史或暈動病史。PONV 的預防:確定患者發生PONV 的風險,無PONV危險因素的患者,不需預防用藥。對低、中危患者可選表4中1或 2 種預防。對於高危患者可用2~3 種藥物預防。不同作用機制的藥物聯合防治優於單一藥物。5-羥色胺3 受體抑制劑、地塞米松和氟哌利多或氟哌啶醇是預防PONV最有效且副作用小的藥物。臨牀防治PONV 的效果判定金標準是達到 24 小時有效和完全無噁心嘔吐。
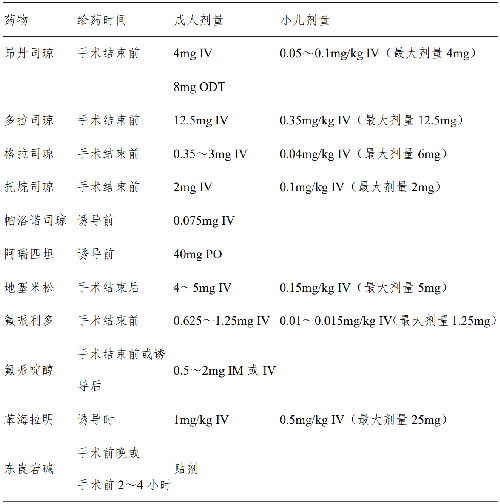
注:IV,靜脈注射;ODT,口腔崩解片;PO,口服;IM,肌內注射。PONV 的治療:對於患者離開麻醉恢復發生持續的噁心嘔吐時,應首先牀旁檢查排除藥物刺激或機械性因素後,進行鎮吐治理。
若患者無預防性用藥,第一次出現PONV,應開始小劑量5-羥色胺 3 受體抑制劑治療,通常爲預防劑量的1/4。也可給予地塞米松 2~4mg,氟哌利多0.625mg 或異丙嗪6.25~12.5mg。若患者在麻醉後恢復室內發生PONV 時,可考慮靜注丙泊酚 20mg。
如已預防性用藥,則治療時應換用其他類型藥物。如果在三聯療法預防後患者仍發生PONV,則6 小時內不能重複使用,應換爲其他藥物;若 6 小時發生,可考慮重複給予5-羥色胺 3 受體抑制劑和氟哌利多或氟哌啶醇,劑量同前。不推薦重複應用地塞米松。
4.4.3.10.5 (5)圍手術期液體管理:
圍手術期液體平衡能夠改善胃切除手術患者預後,既應避免因低血容量導致的組織灌注不足和器官功能損害,也應注意容量負荷過多所致的組織水腫和心臟負荷增加。術中以目標導向爲基礎的治療策略,可以維持患者合適的循環容量和組織氧供。
4.4.3.10.6 (6)應激性潰瘍的預防:
應激性潰瘍是指機體在各類嚴重創傷、危重症或嚴重心理疾病等應激狀態下,發生的急性胃腸道黏膜糜爛、潰瘍病變,嚴重者可併發消化道出血、
甚至穿孔,可使原有疾病程度加重及惡化,增加病死率。對於重症患者 PPI 優於 H2RA,推薦標準劑量PPI 靜脈滴注,每12 小時 1 次,至少連續 3 天,當患者病情穩定可耐受腸內營養或已進食、臨牀症狀開始好轉或轉入普通病房後可改爲口服用藥或逐漸停藥;對於非重症患者,PPI 與H2RA 療效相當,由於臨牀出現嚴重出血的發生率較低,研究表明該類患者使用藥物預防出血效果不明顯,因此對於非重症患者術後應激性潰瘍的預防,無法做出一致推薦。
4.4.3.10.7 (7)圍手術期氣道管理:
圍手術期氣道管理,可以有效減少併發症、縮短住院時間、降低再入院率及死亡風險、改善患者預後,減少醫療費用。圍手術期氣道管理常用治療藥物包括抗菌藥物、糖皮質激素、支氣管舒張劑(β2受體激動劑和抗膽鹼藥物)和黏液溶解劑。對於術後呼吸道感染的患者可使用抗菌藥物治療具體可依據《抗菌藥物臨牀應用指導原則(2015 年版)》;糖皮質激素、支氣管舒張劑多聯合使用,經霧化吸入,每天 2~3 次,療程7~14 天;圍手術期常用黏液溶解劑爲鹽酸氨溴索,可減少手術時機械損傷造成的肺表面活性物質下降、減少肺不張等肺部併發症的發生。對於呼吸功能較差或合併慢性阻塞性肺疾病等慢性肺部基礎疾病的患者,建議術前預防性應用直至術後。需要注意的是,鹽酸氨溴索爲靜脈製劑,不建議霧化吸入使用。
4.4.3.10.8 (8)其他:
伴有基礎疾病的患者圍手術期其他相關用藥管理及調整,可參考 UpToDate 圍手術期用藥管理專題。
4.4.4 (四)化療。
分爲姑息化療、輔助化療和新輔助化療和轉化治療,應當嚴格掌握臨牀適應證,排除禁忌證,並在腫瘤內科醫師的指導下施行。化療應當充分考慮患者的疾病分期、年齡、體力狀況、治療風險、生活質量及患者意願等,避免治療過度或治療不足。及時評估化療療效,密切監測及防治不良反應,並酌情調整藥物和/或劑量。按照RECIST 療效評價標準(見附錄)評價療效。不良反應評價標準參照NCI-CTC 標準。
4.4.4.1 1.姑息化療
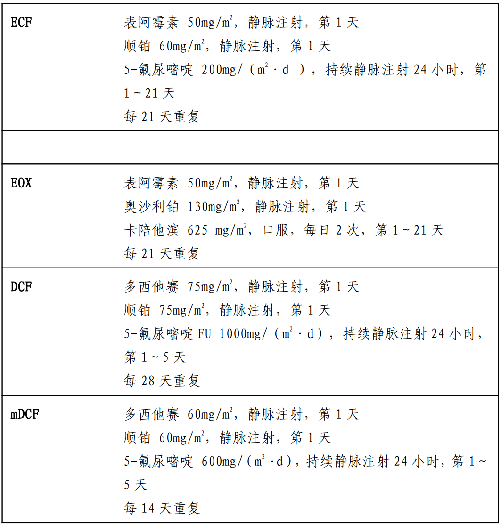
目的爲緩解腫瘤導致的臨牀症狀,改善生活質量及延長生存期。適用於全身狀況良好、主要臟器功能基本正常的無法切除、術後復發轉移或姑息性切除術後的患者。禁忌用於嚴重器官功能障礙,不可控制的合併疾病及預計生存期不足3 個月者。常用的系統化療藥物包括:5-氟尿嘧啶、卡培他濱、替吉奧、順鉑、奧沙利鉑、紫杉醇、多西他賽、白蛋白紫杉醇、伊立替康、表阿黴素等,靶向治療藥物包括:曲妥珠單抗、阿帕替尼。化療方案包括2 藥聯合或3 藥聯合方案,2 藥方案包括:5-氟尿嘧啶/亞葉酸鈣+順鉑(5-FU/LV+FP)、卡培他濱+順鉑(XP)、替吉奧+順鉑(SP)、5-氟尿嘧啶+奧沙利鉑(FOLFOX)、卡培他濱+奧沙利鉑(XELOX)、替吉奧+奧沙利鉑(SOX)、卡培他濱+紫杉醇、卡培他濱+多西他賽、5-氟尿嘧啶/亞葉酸鈣+伊立替康(FOLFIRI)等。3藥方案適用於體力狀況好的晚期胃癌患者,常用者包括:表阿黴素+順鉑+5-氟尿嘧啶(ECF)及其衍生方案(EOX、ECX、EOF),多西他賽+順鉑+5-氟尿嘧啶(DCF)及其改良方案(FLOT、DOX、DOS)等。白蛋白結合型紫杉醇作爲二線治療與普通紫杉醇療效相當,且很少發生過敏反應,目前也爲可選擇的化療藥物。對體力狀態差、高齡患者,考慮採用口服氟尿嘧啶類藥物或紫杉類藥物的單藥化療。對HER2 表達呈陽性(免疫組化染色呈+++,或免疫組化染色呈++且FISH 檢測呈陽性)的晚期胃癌患者,可考慮在化療的基礎上,聯合使用分子靶向治療藥物曲妥珠單抗。既往2 個化療方案失敗的晚期胃癌患者,身體狀況良好情況下,可考慮單藥阿帕替尼治療。姑息化療注意事項如下:
(1)胃癌是異質性較強的惡性腫瘤,治療困難,積極鼓勵患者儘量參加臨牀研究。
(2)對於復發轉移性胃癌患者,3 藥方案適用於腫瘤負荷較大且體力狀況較好者。而單藥化療適用於高齡、體力狀況差或臟器功能輕度不全患者。
(3)對於經系統化療疾病控制後的患者,仍需定期複查,根據回顧性及觀察性研究,標準化療後序貫單藥維持治療較標準化療可改善生活質量,減輕不良反應,一般可在標準化療進行 4~6 個週期後進行。
(4)腹膜轉移是晚期胃癌患者的特殊轉移模式,常因伴隨癌性腹水、癌性腸梗阻影響患者進食及生活質量。治療需根據腹脹等進行腹水引流及腹腔灌注化療,改善一般狀況,擇期聯合全身化療。
4.4.4.2 2.輔助化療
輔助化療適用於 D2 根治術後病理分期爲Ⅱ期及Ⅲ期者。Ⅰa 期不推薦輔助化療,對於Ⅰb 期胃癌是否需要進行術後輔助化療,目前並無充分的循證醫學證據,但淋巴結陽性患者(pTIN1M0)可考慮輔助化療,對於pT2N0M0 的患者,年輕(<40 歲)、組織學爲低分化、有神經束或血管、淋巴管浸潤因素者進行輔助化療,多采用單藥,有可能減少復發。聯合化療在 6 個月內完成,單藥化療不宜超過1 年。輔助化療方案推薦氟尿嘧啶類藥物聯合鉑類的2 藥聯合方案。對體力狀況差、高齡、不耐受 2 藥聯合方案者,考慮採用口服氟尿嘧啶類藥物的單藥化療。
輔助化療注意事項如下:
(1)輔助化療始於患者術後體力狀況基本恢復正常時,一般在術後 4 周開始。特別注意患者術後進食需恢復,圍手術期併發症需緩解。
(2)其他氟尿嘧啶類藥物聯合鉑類的2 藥聯合方案也可考慮在輔助化療應用。最新研究提示在Ⅲ期胃癌術後使用多西他賽聯合替吉奧膠囊較單藥替吉奧膠囊預後改善,多西他賽聯合替吉奧有可能成爲輔助化療的另一個選擇。
(3)觀察性研究提示Ⅱ期患者接受單藥與聯合化療生存受益相仿,但Ⅲ期患者從聯合治療中獲益更明顯。同時需結合患者身體狀況、年齡、基礎疾病、病理類型綜合考慮,選擇單藥口服或聯合化療。
(4)輔助化療期間需規範合理的進行劑量調整,密切觀察患者營養及體力狀況,務必保持體重,維持機體免疫功能。聯合化療不能耐受時可減量或調整爲單藥,在維持整體狀況時儘量保證治療週期。
4.4.4.3 3.新輔助化療
對無遠處轉移的局部進展期胃癌(T3/4、N+),推薦新輔助化療,應當採用鉑類與氟尿嘧啶類聯合的2 藥方案,或在 2 藥方案基礎上聯合紫杉類組成3 藥聯合的化療方案,不宜單藥應用。新輔助化療的時限一般不超過3 個月,應當及時評估療效,並注意判斷不良反應,避免增加手術併發症。術後輔助治療應當根據術前分期及新輔助化療療效,有效者延續原方案或根據患者耐受性酌情調整治療方案,無效者則更換方案或加用靶向藥物如阿帕替尼等。新輔助化療注意事項如下:
(1)3 藥方案是否適應於全部新輔助化療人羣,特別是東方人羣,尚存爭議。小樣本前瞻性隨機對照研究未顯示3藥方案較 2 藥方案療效更優,生存獲益更加明顯。我國進行了多項 2 藥方案的前瞻性臨牀研究,初步顯示了良好的療效和圍手術期安全性。建議根據臨牀實踐情況,在多學科合作的基礎上,與患者及家屬充分溝通。
(2)對於達到病理學完全緩解的患者,考慮爲治療有效患者,結合術前分期,原則上建議繼續術前化療方案。
(3)新輔助化療療效欠佳患者,應由MDT 團隊綜合評估手術的價值與風險,放療的時機和意義,術後藥物治療的選擇等,與患者及家屬詳細溝通。
4.4.4.4 4.轉化治療
對於初始不可切除但不伴有遠處轉移的局部進展期胃癌患者,可考慮化療,或同步放化療,爭取腫瘤縮小後轉化爲可切除。單純化療參考新輔助化療方案;同步放化療參見放療章節。
注意事項如下:
(1)不可切除的腫瘤學原因是本節探討人羣,包括原發腫瘤外侵嚴重,或區域淋巴結轉移固定、融合成團,與周圍正常組織無法分離或已包繞大血管;因患者身體狀況基礎疾病等不能切除者,轉化治療不適用,可參考姑息化療及放療。
(2)腫瘤的可切除性評估,需以腫瘤外科爲主,藉助影像學、內鏡等多種手段,必要時進行PET-CT 和/或腹腔鏡探查,精準進行臨牀分期,制訂總體治療策略。
(3)不同於新輔助化療,轉化治療的循證醫學證據更多來源於晚期胃癌的治療經驗,只有腫瘤退縮後纔可能實現R0 切除,故更強調高效縮瘤,在患者能耐受的情況下,可相對積極考慮 3 藥化療方案。
(4)初步研究提示同步放化療較單純放療或單純化療
可能實現更大的腫瘤退縮,但目前其適應人羣、引入時機等均需進一步探索,建議在臨牀研究中開展;在臨牀實踐中,建議由多學科團隊進行評估,確定最佳治療模式。
(5)初始診斷時不伴有其他非治癒因素而僅有單一遠處轉移,且技術上可切除的胃癌,是一類特殊人羣,例如僅伴有肝轉移、卵巢轉移、16 組淋巴結轉移、腹膜脫落細胞學陽性或侷限性腹膜轉移。在隊列研究中顯示通過轉化治療使腫瘤縮小後,部分患者實現 R0 切除術,但目前僅推薦在臨牀研究中積極考慮。在臨牀實踐中,必須由多學科團隊全面評估,綜合考慮患者的年齡、基礎疾病、身體狀況、依從性、社會支持度、轉移部位、病理類型、轉化治療的療效和不良反應以及手術之外的其他選擇等,謹慎判斷手術的獲益和風險。
(6)胃癌根治術後局部復發,應首先評估再切除的可能性;如爲根治術後發生的單一遠處轉移,除上述(5)涉及之外,尚需考慮首次手術分期、輔助治療方案、無病生存時間、復發風險因素等綜合判定。
(7)經過轉化治療後,推薦由多學科團隊再次評估根治手術的可行性及可能性,需與患者及家屬充分溝通治療風險及獲益。餘圍手術期的療效評估、安全性管理等同新輔助化療。
4.4.5 (五)放療。
放療是惡性腫瘤的重要治療手段之一。根據臨牀隨訪研究數據和屍檢數據,提示胃癌術後局部區域復發和遠處轉移風險很高,放療通過對原發腫瘤位置及淋巴引流區的照射可以降低局部區域復發風險。在多學科診療的指導下,通過放療與手術、化療、分子靶向治療等多種治療手段結合,可制定出合理的治療方案使患者獲益。目前美國NCCN 指南或歐洲 ESMO 指南均在特定情況下推薦對局部晚期胃癌在手術前或手術後實施放化療的治療模式。隨着D2 手術的開展和廣泛推廣,術後放療的適應症以及放療範圍都成爲學者探討的熱點。對於局部晚期胃癌的術前放療,特別是針對胃食管結合部癌,多項研究顯示術前同步放化療可以顯著降低腫瘤負荷,爲提高腫瘤治癒率提供幫助。
4.4.5.1 1.放療指證
(1)一般情況好,KPS≥70 分或ECOG 0~2 分。
(2)術前放療:對於可手術切除或潛在可切除的局部晚期胃癌,術前同步放化療可獲得較高的R0 手術切除率、使腫瘤顯著降期,從而改善長期預後。對於不可手術切除的局部晚期胃癌,術前同步放化療可顯著縮小腫瘤,使部分腫瘤轉化爲可切除病變,提高 R0 手術切除率而改善預後。在患者耐受性良好的前提下,可嘗試術前同步放化療聯合化療模式。
(3)術後放療:①手術切緣陽性者建議術後放療;②R0 切除且淋巴結清掃<D2 範圍者:術後病理T3~4和/或淋巴結轉移者建議術後同步放化療;③R0 切除且D2 淋巴結清掃範圍者:可考慮術後病理淋巴結轉移者行術後同步放化療。
(4)拒絕接受手術治療或因內科疾病原因不能耐受手術治療的胃癌患者。
(5)晚期胃癌的減症放療:遠處轉移的胃癌患者,根據情況照射原發竈或轉移竈,可達到緩解梗阻、壓迫、出血或疼痛的目的,提高患者生存質量。僅照射原發竈及引起症狀的轉移病竈,照射劑量根據病變大小、位置及耐受程度判定。
4.4.5.2 2.放療技術
調強放療技術包括容積旋轉調強放療技術及螺旋斷層調強放療等,比三維適形放療擁有更好的劑量分佈適形性和均勻性,結合靶中靶或靶區內同步加量放療劑量模式,可在不增加正常組織受照劑量的前提下,提高胃腫瘤照射劑量。
4.4.5.2.1 (1)放療靶區:
對於未手術切除的病變,常規分割劑量放療範圍包括原發腫瘤和轉移淋巴結,以及對高危區域淋巴結進行預防照射(表 5)。
表 5 高危選擇性照射淋巴引流區
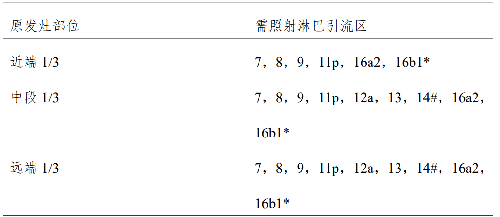
*:如 7~12 區淋巴結轉移或者 N2/3 病變,則須包括至16b1。
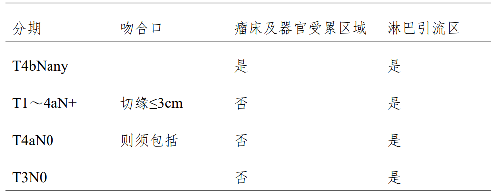
術後治療的放療範圍包括選擇性照射瘤牀及吻合口,以及對高危淋巴結區域進行預防照射。吻合口及瘤牀的照射指徵爲:切緣距離腫瘤<3cm 推薦包括相應吻合口,T4b者特別是胃後壁病變推薦術後放療包括瘤牀(表6)。
表 6 術後靶區選擇性照射範圍
4.4.5.2.2 (2)放療劑量:
三維適形放療和調強放療應用體積劑
量定義方式,常規照射應用等中心點劑量定義模式。同步放化療中常規放療總量爲 45~50Gy,單次劑量爲1.8~2.0Gy;根治性放療劑量推薦同步或序貫加量56~60Gy。
1)術後放療劑量:推薦臨牀靶區DT 45~50.4 Gy,每次1.8 Gy,共 25~28 次;有腫瘤和/或殘留者,大野照射後局部縮野加量照射 DT 5~10 Gy。
2)術前放療劑量:推薦 DT 41.4~45 Gy,每次1.8Gy,共 23~25 次。
3)根治性放療劑量:推薦DT 54~60 Gy,每次2Gy,共 27~30 次。
4)轉移、腦轉移放療劑量:30Gy/10f 或40Gy/20f或者立體定向放療。
4.4.5.2.3 (3)照射技術:
根據醫院具有的放療設備選擇不同的放療技術,如常規放療、三維適形放療、調強放療、圖像引導放療等。建議使用三維適形放療或調強放療等先進技術,更好地保護周圍正常組織如肝、脊髓、腎臟和腸道,降低正常組織毒副作用,提高放療耐受性。
1)模擬定位:推薦 CT 模擬定位。如無CT 模擬定位,必須行常規模擬定位。體位固定,仰臥位。定位前3小時避免多食,口服對比劑或靜脈應用造影有助於CT 定位和靶區勾畫。
2)建議 3 野及以上的多野照射。
3)如果調強放療,必須進行計劃驗證。
4)局部加量可採用術中放療或外照射技術。
5)放射性粒子植入治療不推薦常規應用。
4.4.5.2.4 (4)同步化療:
同步化療方案單藥首選替吉奧或者卡培他濱。有條件的醫院可開展聯合靜脈化療的臨牀研究。替吉奧劑量(以替加氟計):①體表面積<1.25m2,每次40mg;②體表面積 1.25~1.5m2,每次50mg;③體表面積≥1.5m2,每次 60mg。
卡培他濱劑量:800mg/m2,放療日口服,每日2次。正常組織限量:肺,V20<25%;心臟,V30<30%;脊髓,Dmax ≤45Gy;腎臟,V20<25%;小腸,V45<195ml;肝臟,V30<30%,Dmean<25Gy。
4.4.6 (六)靶向治療。
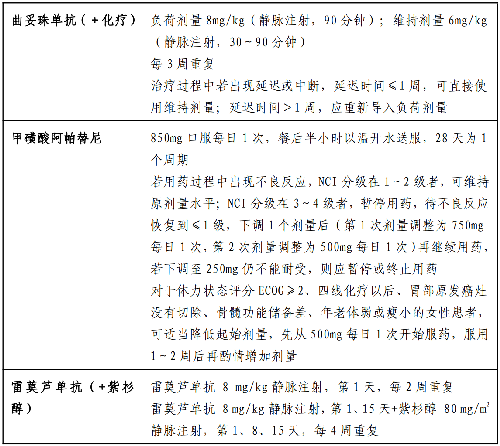
4.4.6.1 1.曲妥珠單抗
(1)適應證:對 HER2 過表達(免疫組化染色呈+++,或免疫組化染色呈++且 FISH 檢測呈陽性)的晚期胃或胃食管結合部腺癌患者,推薦在化療的基礎上,聯合使用分子靶向治療藥物曲妥珠單抗。適應人羣爲既往未接受過針對轉移性疾病的一線治療患者,或既往未接受過抗HER2 治療的二線及以上治療患者。
(2)禁忌證:既往有充血性心力衰竭病史、高危未控制心律失常、需要藥物治療的心絞痛、有臨牀意義瓣膜疾病、心電圖顯示透壁心肌梗死和控制不佳的高血壓。
(3)治療前評估及治療中監測:曲妥珠單抗不良反應主要包括心肌毒性、輸液反應、血液學毒性和肺毒性等。因此在應用前需全面評估病史、體力狀況、基線腫瘤狀態、HER2狀態以及心功能等。在首次輸注時需嚴密監測輸液反應,並在治療期間密切監測左室射血分數(left ventricularejection fraction,LVEF)。LVEF 相對治療前絕對降低≥16%或者 LVEF 低於當地醫療機構的該參數正常值範圍且相對治療前絕對降低 ≥10%時,應停止曲妥珠單抗治療。
(4)注意事項:
1)根據 ToGA 研究結果,對於HER2 陽性胃癌,推薦在5-氟尿嘧啶/卡培他濱聯合順鉑基礎上聯合曲妥珠單抗。除此之外,多項Ⅱ期臨牀研究評估了曲妥珠單抗聯合其他化療方案,也有較好的療效和安全性,如紫杉醇、卡培他濱聯合奧沙利鉑、替吉奧聯合奧沙利鉑、替吉奧聯合順鉑等。但不建議與蒽環類藥物聯合應用。
2)一線化療進展後的 HER2 陽性晚期胃癌患者,如一線已應用過曲妥珠單抗,跨線應用的高級別循證依據尚缺乏,有條件的情況下建議再次活檢,儘管國內多中心前瞻性觀察性研究初步結果顯示二線繼續應用曲妥珠單抗聯合化療可延長中位無進展生存時間,但暫不建議在臨牀實踐中考慮。
3)其他以 HER2 爲靶點的藥物有抗HER2 單克隆抗體帕妥珠單抗、小分子酪氨酸激酶抑制劑拉帕替尼、藥物偶聯抗HER2 單克隆抗體 TDM-1 等,目前這些藥物的臨牀研究均未獲得陽性結果,均不推薦在臨牀中應用。
4.4.6.2 2.阿帕替尼
(1)適應證:甲磺酸阿帕替尼是我國自主研發新藥,是高度選擇 VEGFR-2 抑制劑,其適應證是晚期胃或胃食管結合部腺癌患者的三線及以上治療,且患者接受阿帕替尼治療時一般狀況良好。
(2)禁忌證:同姑息化療,但需特別注意患者出血傾向、心腦血管系統基礎病和腎臟功能。
(3)治療前評估及治療中監測:阿帕替尼的不良反應包括血壓升高、蛋白尿、手足綜合徵、出血、心臟毒性和肝髒毒性等。治療過程中需嚴密監測出血風險、心電圖和心臟功能、肝臟功能等。
(4)注意事項:
1)目前不推薦在臨牀研究以外中,阿帕替尼聯合或單藥應用於一線及二線治療。
2)前瞻性研究發現,早期出現的高血壓、蛋白尿或手足綜合徵者疾病控制率、無復發生存及總生存有延長,因此積極關注不良反應十分重要,全程管理,合理調整劑量,謹慎小心嘗試再次應用。
3)重視患者教育,對於體力狀態評分ECOG≥2、四線化療以後、胃部原發竈未切除、骨髓功能儲備差、年老體弱或瘦小的女性患者,爲了確保患者的安全性和提高依從性,可先從低劑量如 500mg 每日 1 次開始口服。
4.4.7 (七)免疫治療。
隨着免疫檢查點抑制劑的廣泛應用,晚期胃癌一線化療聯合 PD-1 單抗(Checkmate 649 研究),以及三線單藥PD-1單抗治療已獲得隨機Ⅲ期臨牀研究的陽性結果(Attraction2 研究),而且在二線治療、圍手術期治療領域也開展了多項免疫檢查點抑制劑相關研究。目前建議患者積極參加臨牀研究。
4.4.8 (八)介入治療。
胃癌介入治療主要包括針對胃癌、胃癌肝轉移、胃癌相關出血以及胃出口梗阻的微創介入治療。
4.4.8.1 1.胃癌的介入治療
經導管動脈栓塞(Transcatheter arterialembolization,TAE)、經導管動脈栓塞化療(Transcatheterarterial chemoembolization,TACE)或經導管動脈灌注(transcatheter arterial infusion,TAI)化療可應用於進展期胃癌和不可根治胃癌的姑息治療或輔助治療,其療效尚不確切,需大樣本、前瞻性研究進一步證實。
4.4.8.2 2.胃癌肝轉移的介入治療
介入治療可作爲胃癌肝轉移瘤除外科手術切除之外的局部微創治療方案。主要包括消融治療、TAE、TACE及TAI化療等。
4.4.8.3 3.胃癌相關出血的介入治療
介入治療(如 TAE)對於胃癌相關出血(包括胃癌破裂出血、胃癌轉移竈出血及胃癌術後出血等)具有獨特的優勢,
通過選擇性或超選擇性動脈造影明確出血位置,並選用合適的栓塞材料進行封堵,可迅速、高效地完成止血,同時緩解出血相關症狀。
4.4.8.4 4.胃出口梗阻的介入治療
晚期胃癌患者可出現胃出口惡性梗阻相關症狀,通過X線引導下支架植入等方式,達到緩解梗阻相關症狀、改善患者生活質量的目的。
4.4.9 (九)中醫藥治療。
中醫藥治療有助於改善手術後併發症,減輕放、化療的不良反應,提高患者的生活質量,可以作爲胃癌治療重要的輔助手段。對於高齡、體質差、病情嚴重而無法耐受西醫治療的患者,中醫藥治療可以作爲輔助的治療手段。除了採用傳統的辨證論治的診療方法服用中草藥之外,亦可以採用益氣扶正、清熱解毒、活血化瘀、軟堅散結類中成藥進行治療。
對於早期發現的癌前病變(如慢性萎縮性胃炎、胃腺瘤型息肉、殘胃炎、胃潰瘍等)可選擇中醫藥治療,且需要加以飲食結構、生活方式的調整,可能延緩腫瘤的發生。
4.4.10 (十)支持治療。
胃癌支持/姑息治療目的在於緩解症狀、減輕痛苦、改善生活質量、處理治療相關不良反應、提高抗腫瘤治療的依從性。所有胃癌患者都應全程接受支持/姑息治療的症狀篩查、評估和治療。既包括出血、梗阻、疼痛、噁心/嘔吐等常見軀體症狀,也應包括睡眠障礙、焦慮抑鬱等心理問題。同時,應對癌症生存者加強相關的康復指導與隨訪。
4.4.10.1 1.胃癌患者支持/姑息治療的基本原則
醫療機構應將胃癌支持/姑息治療整合到腫瘤治療的全過程中,所有胃癌患者都應在他們治療早期加入支持/姑息治療、在適當的時間或根據臨牀指徵篩查支持/姑息治療的需求。支持/姑息的專家和跨學科的多學科協作治療組,包括腫瘤科醫師、支持/姑息治療醫師、護士、營養師、社會工作者、藥劑師、精神衛生專業人員等方面的專業人員,給予患者及家屬實時的相關治療。
4.4.10.2 2.胃癌患者支持/姑息治療的管理
4.4.10.2.1 (1)出血:
胃癌患者出血包括急性、慢性出血。急性出血是胃癌患者常見的症狀,可能是腫瘤直接出血或治療引起的出血。
1)急性出血應對生命體徵及循環狀況監測,及早進行液體復甦(血容量補充、血管活性藥物等),給予抑酸等止血措施。出現急性嚴重出血(嘔血或黑便)的患者應立刻進行內鏡檢查評估。
3)普遍可用的治療選擇包括注射療法、機械療法(例如內鏡夾)、消融療法(例如氬等離子凝固)或這些方法的組合。
5)外照射放療可以有效地控制多個小血管的急性和慢性消化道出血。
6)胃癌引起的慢性失血可應用PPI、止血藥物、體外放療等。對於存在貧血的患者可根據病情,酌情給予促紅細胞生成類藥物、鐵劑、葉酸、維生素B12等藥物。
4.4.10.2.2 (2)梗阻:
對於合併惡性胃梗阻的患者,支持/姑息治療的主要目的是減少噁心/嘔吐,並且在可能的情況下允許恢復口服進食。
1)內鏡:放置腸內支架緩解出口梗阻或放置食管支架緩解食管胃結合部/胃賁門梗阻。
2)手術:可選擇胃空腸吻合術,對於一些選擇性患者行胃切除術。
3)某些患者可選擇體外放療及化療。
4)當梗阻不可逆時,可通過行胃造口術以減輕梗阻的症狀(不適合進行內鏡腔內擴張或擴張無效者)。如果腫瘤位置許可,經皮、內鏡、手術或介入放射學放置胃造瘻管行胃腸減壓。對於伴中部或遠端胃梗阻、不能進食的患者,如果腫瘤位置許可,可放置空腸營養管。
5)如果存在腹水,應先引流腹水再放置胃造瘻管以減少感染相關併發症的風險。
4.4.10.2.3 (3)疼痛
1)患者的主訴是疼痛評估的金標準,鎮痛治療前必須評估患者的疼痛強度。疼痛評估首選數字疼痛分級法,評估內容包括疼痛的病因、特點、性質、加重或緩解因素、疼痛對患者日常生活的影響、鎮痛治療的療效和副作用等,評估時還要明確患者是否存在腫瘤急症所致的疼痛,以便立即進行相應治療。
2)WHO 三階梯鎮痛原則仍是臨牀鎮痛治療應遵循的最基本原則,阿片類藥物是癌痛治療的基石,必要時加用糖皮質激素、抗驚厥藥等輔助藥物,並關注鎮痛藥物的不良反應。
3)80%以上的癌痛可通過藥物治療得以緩解,少數患者需非藥物鎮痛手段,包括外科手術、放療鎮痛、微創介入治療等,應動態評估鎮痛效果,積極開展學科間的協作。
4.4.10.2.4 (4)噁心/嘔吐:
1)化療所致的噁心/嘔吐的藥物選擇應基於治療方案的催吐風險、既往的鎮吐經驗及患者自身因素,進行充分的動態評估以進行合理管理。
2)噁心/嘔吐可能與消化道梗阻有關,因此應進行內鏡或透視檢查評估以確定是否存在梗阻。
3)綜合考慮其他潛在致吐因素:如前庭功能障礙、腦轉移、電解質不平衡、輔助藥物治療(包括阿片類)、胃肌輕癱:腫瘤本身、化療誘導或由其他原因引起(如糖尿病)、惡性腹水、心理生理學(包括焦慮、預期性噁心/嘔吐)。
4)生活方式管理可能有助於減輕噁心/嘔吐,如少喫多餐,選擇健康食品,控制食量,忌冷忌熱。飲食會診也可能有用。
4.4.10.2.5 (5)營養:
首先需要正確評定每個腫瘤患者的營養狀況,篩選出具備營養治療適應證的患者,及時給予治療;爲了客觀評價營養治療的療效,需要在治療過程中不斷進行再評價,以便及時調整治療方案。
2)現階段應用最廣泛的惡性腫瘤營養風險篩查工具爲NRS2002 及 PG-SGA。
3)NRS<3 分者雖然沒有營養風險,但應在其住院期間每週篩查 1 次。NRS≥3 分者具有營養風險,需要根據患者的臨牀情況,制訂基於個體化的營養計劃,給予營養干預。
4)PG-SGA 評分0~1分時不需要干預措施,治療期間保持常規隨診及評價。PG-SGA 評分2~3分由營養師、護師或醫師進行患者或患者家庭教育,並可根據患者存在的症狀和實驗室檢查的結果進行藥物干預。PG-SGA 評分4~8分由營養師進行干預,並可根據症狀的嚴重程度,與醫師和護師聯合進行營養干預。PG-SGA 評分9分急需進行症狀改善和/或同時進行營養干預。
5)詢問病史、體格檢查及部分實驗室檢查有助於瞭解惡性腫瘤患者營養不良發生的原因及嚴重程度,以對患者進行綜合營養評定。
6)營養風險篩查及綜合營養評定應與抗腫瘤治療的影像學療效評價同時進行,以全面評估抗腫瘤治療的受益。
4.4.10.2.6 (6)心理痛苦:
1)心理痛苦是心理(即認知、行爲、情感)、社會、精神和/或軀體上的多重因素決定的不愉快的體驗,可能會影響患者應對腫瘤、軀體症狀以及治療的能力。心理痛苦包括瞭如抑鬱、焦慮、恐慌、社會隔絕以及存在性危機。
2)心理痛苦應在疾病的各個階段及所有環境下及時識別、監測記錄和處理。
3)應根據臨牀實踐指南進行心理痛苦的評估和管理。組建跨學科的多學科協作治療組對患者及家屬的心理痛苦進行管理和治療。
4.4.10.2.7 (7)厭食/惡液質:
1)評估體重下降的原因及嚴重程度,建議及早治療可逆的厭食原因(口腔感染、心理原因、疼痛、便祕、噁心/嘔吐等),評估影響進食的藥物等。
2)考慮制訂適當的運動計劃,積極給予營養支持(腸內或腸外營養)。
4.4.10.2.8 (8)其他症狀:
1)便祕:出現便祕時,需評估便祕原因及嚴重程度,排出梗阻、糞便堵塞、治療其他引起的便祕。排除其他原因後,可給予緩瀉劑、胃腸動力藥物、灌腸等治療。積極給予預防治療,如多喝水、適當運動,預防性用藥等。
2)睡眠/覺醒障礙:評估睡眠/覺醒障礙的類型及嚴重程度,患者對死亡/疾病的恐懼和焦慮,以及治療相關影響因素。提供睡眠衛生教育;提供認知行爲療法治療。對於難治性的睡眠/覺醒障礙應在專業人員的指導下給予藥物治療。
4.4.10.3 3.胃癌生存者健康行爲的輔導
(1)終生保持一個健康的體重,特別是在胃癌術後,應定期監測體重,鼓勵少食多餐,必要時轉診至營養師或營養部門進行個體化輔導,關注並積極評估處理引起體重減輕的醫療和/或心理社會的因素。
(2)重視植物來源的健康飲食,根據治療後遺症(例如:傾倒綜合徵、腸功能障礙)按需調整。
(3)採取健康的的生活方式,適當參與體力活動。目標:儘量每日進行至少 30 分鐘的中等強度的活動。
(4)限制飲酒。
(5)建議戒菸。
4.4.11 (十一)隨訪。
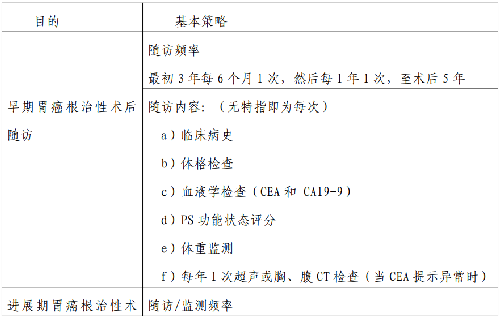
隨訪/監測的主要目的是發現尚可接受潛在根治爲目的治療的轉移復發,更早發現腫瘤復發或第二原發胃癌,並及時干預處理,以提高患者的總生存,改善生活質量。目前尚無高級別循證醫學證據來支持何種隨訪/監測策略是最佳的。隨訪應按照患者個體化和腫瘤分期的原則,如果患者身體狀況不允許接受一旦復發而需要的抗癌治療,則不主張對患者進行常規腫瘤隨訪/監測。
胃癌術後的胃鏡隨訪主要目的是在胃鏡下發現新生腫瘤或原發腫瘤復發,很少發生胃的吻合口局部復發,胃鏡下可觀察吻合口情況並取胃的局部組織活檢以判斷腫瘤復發情況。胃鏡檢查的策略:推薦術後1 年內進行胃鏡檢查,每次胃鏡檢查行病理活檢若發現有高級別不典型增生或者胃癌復發證據,則需在 1 年內複查。建議患者每年進行1次胃鏡檢查。對全胃切除術後,發生大細胞性貧血者,應當補充維生素 B12和葉酸。
PET-CT、MRI 檢查僅推薦用於臨牀懷疑復發,合併常規影像學檢查爲陰性時,比如:持續CEA 升高,腹部CT檢查或超聲爲陰性。目前不推薦將PET-CT 檢查列爲常規隨訪/監測手段。隨訪的具體方法及頻率詳見表7。
表 7 胃癌治療後隨訪要求及指南目的

4.5 附錄
附錄一: AJCC/UICC胃癌TNM分期(第8版)
附錄三:胃癌的大體分型
附錄十:胃食管結合部示意圖
附錄十二:胃癌CT分期徵象及報告參考
附錄十六:胃癌放射及化學治療療效判定基本標準
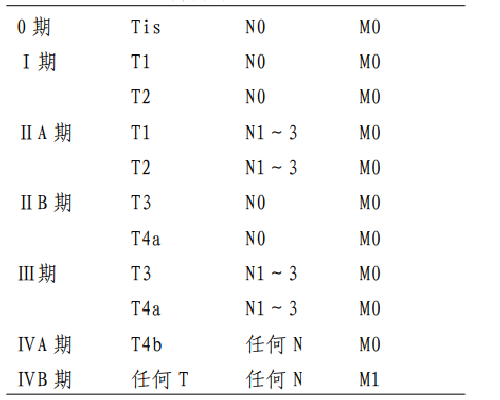
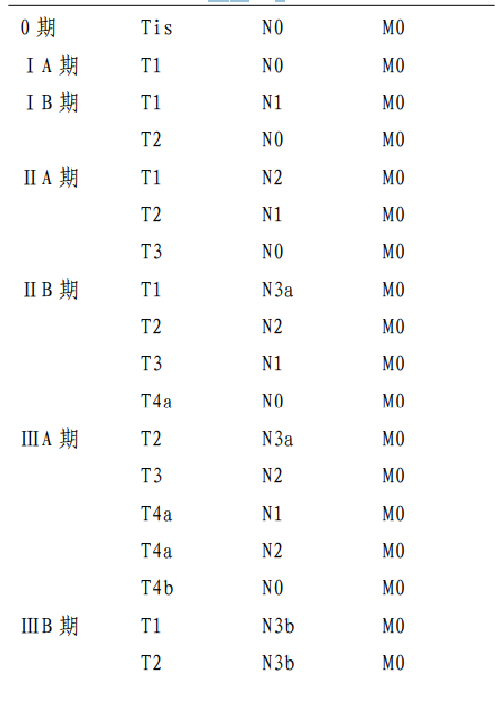
4.5.1 附錄一:AJCC/UICC胃癌TNM分期(第八版)
原發腫瘤(T)
T0 無原發腫瘤的證據
Tis 原位癌:上皮內腫瘤,未侵及固有層,高度不典型增生T1 腫瘤侵犯固有層,黏膜肌層或黏膜下層
T1a 腫瘤侵犯固有層或黏膜肌層
T1b 腫瘤侵犯黏膜下層
T2 腫瘤侵犯固有肌層*
T3 腫瘤穿透漿膜下結締組織,而尚未侵犯髒層腹膜或鄰近結構**,***
區域淋巴結(N)
遠處轉移(M)
M0 無遠處轉移
M1 有遠處轉移
組織學分級(G)
Gx 分級無法評估
G1 高分化
G2 中分化
G3 低分化,未分化
*腫瘤可以穿透固有肌層達胃結腸韌帶或肝胃韌帶或大小網膜,但沒有穿透覆蓋這些結構的髒層腹膜。在這種情況下,原發腫瘤的分期爲T3。如果穿透覆蓋胃韌帶或網膜的髒層腹膜,則應當被分爲 T4 期。
**胃的鄰近結構包括脾、橫結腸、肝臟、膈肌、胰腺、腹壁、腎上腺、腎臟、小腸以及後腹膜。
***經胃壁內擴展至十二指腸或食管的腫瘤不考慮爲侵犯鄰近結構,而是應用任何這些部位的最大浸潤深度進行分期。
臨牀分期(cTNM)
病理分期(pTNM)

新輔助治療後分期(ypTNM)

註釋
1.要達到準確分期,區域淋巴結的數目應該≥16 個,最好≥30 個。
2.若腫瘤累及食管胃交界部,腫瘤中心在食管胃交界部食管側者或在胃側2cm之內者(Siewert 分型Ⅰ型和Ⅱ型),按食管癌分期;腫瘤中心在近端胃2cm之外(Siewert 分型Ⅲ型)按胃癌分期。腫瘤中心雖在近端胃2cm 之內但未累及食管胃交界部者,按胃癌分期。
3.胃的神經內分泌瘤(NET)分期參照胃神經內分泌瘤的TNM 分期。
4.本分期不適用於非上皮性腫瘤,如淋巴瘤、肉瘤、胃腸道間質瘤等。
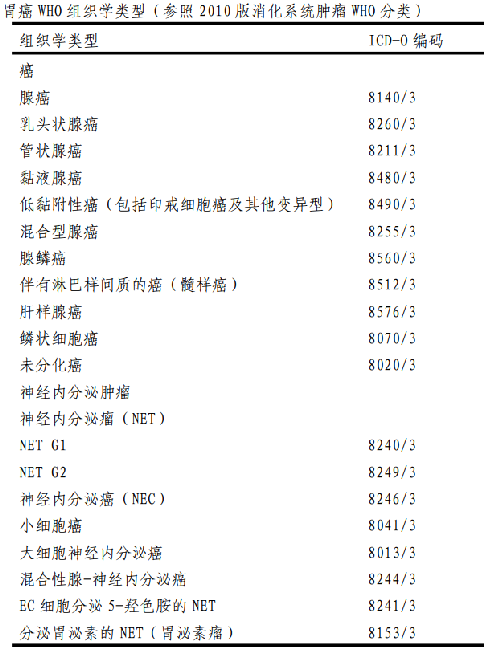
4.6 附錄二:胃癌組織學類型和分級
胃癌 WHO 組織學類型(參照 2010 版消化系統腫瘤WHO 分類)
4.7 附錄三:胃癌的大體分型
早期胃癌推薦巴黎分型
隆起型(0-Ⅰ):又可分爲有蒂隆起型(0-Ⅰp)和無蒂隆起型(0-Ⅰs);
表淺型(0-Ⅱ):又可分爲表淺隆起型(0-Ⅱa)、表淺平坦型(0-Ⅱb)和表淺凹陷型(0-Ⅱc)。同時具有表淺隆起和表淺凹陷的病竈根據表淺隆起/表淺凹陷的比例分爲表淺凹陷+表淺隆起型(0-Ⅱc+Ⅱa 型)和表淺隆起+表淺凹陷型(0-Ⅱa+Ⅱc 型)。
凹陷(潰瘍)型(0-Ⅲ):凹陷和表淺凹陷結合的病竈根據凹陷/表淺凹陷的比例分爲表淺凹陷+凹陷型(0-Ⅱc+Ⅲ型)和凹陷+表淺凹陷型(0-Ⅲ+Ⅱc 型)。
進展期胃癌常用 Borrmann 分型:Ⅰ型( 結節隆起型)、Ⅱ型(侷限潰瘍型)、Ⅲ型( 浸潤潰瘍型)、Ⅳ型( 瀰漫浸潤型)
4.8 附錄四:胃癌病理學報告標準模板
描述記錄
(全胃、胃大部或殘胃)切除標本:大彎長 cm,小彎長cm,附幽門環/十二指腸/食管下段,長 cm ; 於(食管胃結合部/胃底/胃體/胃竇; 小彎/大彎側)見 型(早期和進展期)腫物(包括外觀描寫):距上切緣 cm,距下切緣 cm,大小---×---×---cm,切面性狀;浸潤深度至 ; 累及/未累及幽門環/食管胃結合部。(若爲食管胃結合部癌,需描述腫瘤中心距食管胃交界線 cm)。腫物旁或腫物周圍食管黏膜/肌壁內檢查所見(糜爛/粗糙/顆粒狀/凹陷/斑塊//必要的陰性所見)。大彎找到淋巴結(數/多/十餘/數十餘)枚,直徑 至cm;小彎找到淋巴結 (數/多/十餘/數十餘)枚,直徑 至 cm。大網膜,大小---×---×---cm,有無腫瘤和淋巴結。
胃癌病理診斷報告內容
1.腫瘤
(1)組織分型
(2)組織分級
(3)浸潤深度
2.切緣
(1)近端
(2)遠端
3.其他病理所見
(1)慢性胃炎
(2)腸化
(3)不典型增生
(4)萎縮
(5)腺瘤
(6)息肉
(8)其他
77
(1)總數
(2)受累的數目
5.遠處轉移
7.特殊的輔助檢查結果(組織化學染色、免疫組化染色等)有困難的病理提交上級醫院會診(提供原始病理報告及組織塊部位等信息,以覈對送檢切片的正確減少誤差,提供充分的病變切片或蠟塊,以及術中所見等)。
4.9 附錄五:胃癌影像學報告指南
原則:圍繞胃癌 cTNM 分期,報告臨牀診治相關的全面信息,發揮MDT 在影像圖像判讀的價值。
原發竈
部位(食管胃交界區、胃底、胃體、胃竇、幽門管、大彎、小彎、前壁、後壁),形態(腫塊、侷限潰瘍、浸潤潰瘍、瀰漫增厚),厚度,密度(黏液腺癌等特異徵象),強化特徵,侵犯深度,黏膜及漿膜面情況,近/遠端累及邊界位置,與正常胃壁交界情況,與鄰近臟器關係。
報告有明確轉移徵象的淋巴結的數目(或參照 N 分期的數目範圍),最大淋巴結長短徑,形態、邊界、強化。
遠處轉移
轉移竈位置、分佈、形態、大小、密度及強化特徵,腹膜形態及腹水情況。存在爭議時提交 MDT 聯合討論確定。
4.10 附錄六:胃癌影像診斷流程
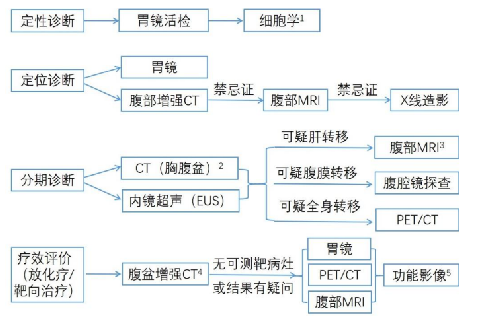
1.胃鏡反覆活檢無法確定病理診斷時,腹腔積液/胸腔積液細胞學檢測或轉移竈的病理學檢測可作爲定性診斷輔助依據。
2.腹盆 CT 應增強掃描,胸部 CT 常規平掃即可,若懷疑縱隔淋巴結轉移者應補充增強。
3.作爲 CT 懷疑肝轉移時進一步檢查的手段,推薦有條件者採用肝細胞特異性對比劑,可提高肝轉移診斷的敏感性。
4.根據 RECIST 1.1 標準,肝肺或腹膜轉移結節長徑>1cm 或淋巴結短徑>1.5cm作爲靶病竈。原發竈厚度可作爲評效參考,但不做靶病竈考量。
5.小樣本研究顯示,影像學功能成像參數如磁共振擴散成像ADC 值、雙能CT碘濃度值等可輔助胃癌療效評價。
4.11 附錄七:胃癌淋巴結分組標準
第 3 組 (No. 3) 小彎淋巴結
第 4sa 組 (No. 4sa) 大彎淋巴結左組(沿胃短動脈)第 4sb 組 (No. 4sb) 大彎淋巴結左組(沿胃網膜左動脈)第 4d 組 (No. 4d) 大彎淋巴結右組(沿胃網膜右動脈)第 5 組 (No. 5) 幽門上淋巴結
第 8a 組 (No. 8a) 肝總動脈前上部淋巴結第 8b 組 (No.8b) 肝總動脈後部淋巴結
第 9 組 (No. 9) 腹腔動脈周圍淋巴結第 10 組 (No. 10) 脾門淋巴結
第 11p 組 (No. 11p) 脾動脈近端淋巴結第 11d 組 (No. 11d) 脾動脈遠端淋巴結第 12a 組 (No. 12a) 肝十二指腸韌帶淋巴結(沿肝動脈)第 12b 組 (No. 12b) 肝十二指腸韌帶淋巴結(沿膽管)第 12p 組 (No. 12p) 肝十二指腸韌帶淋巴結(沿門靜脈)第 13 組 (No. 13) 胰頭後淋巴結
第 14v 組 (No. 14v) 沿腸繫膜上靜脈淋巴結第 14a 組 (No. 14a) 沿腸繫膜上動脈淋巴結第 15 組 (No. 15) 結腸中動脈周圍淋巴結第 16a1 組 (No. 16a1) 腹主動脈周圍淋巴結a1
第 16a2 組 (No. 16a2) 腹主動脈周圍淋巴結a2
第 16b1 組 (No. 16b1) 腹主動脈周圍淋巴結b1
第 16b2 組 (No. 16b2) 腹主動脈周圍淋巴結b2
第 17 組 (No. 17) 胰頭前淋巴結
第 18 組 (No. 18) 胰下淋巴結
第 19 組 (No. 19) 膈下淋巴結
第 110 組 (No. 110) 胸部下食管旁淋巴結第 111 組 (No. 111) 膈上淋巴結
第 112 組 (No. 112) 後縱隔淋巴結
4.12 附錄八:不同部位胃癌的各組淋巴結分站標準
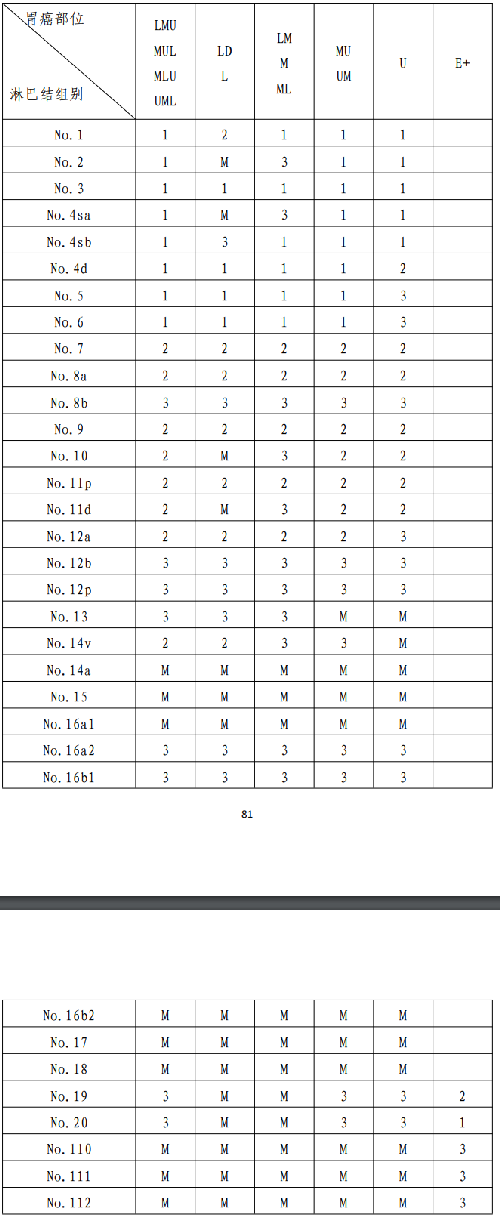
4.13 附錄九:胃腫瘤的解剖部位編碼

4.14 附錄十:胃食管結合部示意圖
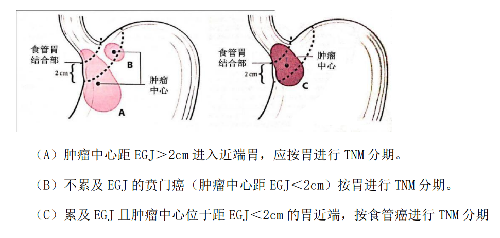
(A)腫瘤中心距 EGJ>2cm 進入近端胃,應按胃進行 TNM 分期。
(B)不累及 EGJ 的賁門癌(腫瘤中心距 EGJ<2cm)按胃進行TNM 分期。
(C)累及 EGJ 且腫瘤中心位於距 EGJ<2cm 的胃近端,按食管癌進行TNM 分期
4.15 附錄十一:Siewert 分型
Siewert 分型:是 Siewert 等學者基於食管胃交界部的解剖學特點提出的分型,也稱 Munich 分型。他們認爲,遠端食管腺癌和賁門腺癌應屬同一種疾病,即食管胃交界部腺癌。食管胃交界部腺癌是指腫瘤中心位於解剖學上食管胃交界部(解剖學上的食管胃交界部是指管狀食管變爲囊狀胃的部位,即食管末端和胃的起始,相當於希氏角或腹膜返折水平或食管括約肌下緣,與組織學上的鱗柱交界不一定一致)上、下各 5cm 這段範圍內的腺癌。可分爲3 型:
Ⅰ型:相當於遠端食管腺癌,腫瘤中心位於食管胃交界部上1~5cm 處。
Ⅱ型:相當於賁門腺癌,腫瘤中心位於食管胃交界部上1cm 至下2cm 處。
Ⅲ型:相當於賁門下腺癌,腫瘤中心位於食管胃交界部下2~5cm 處。
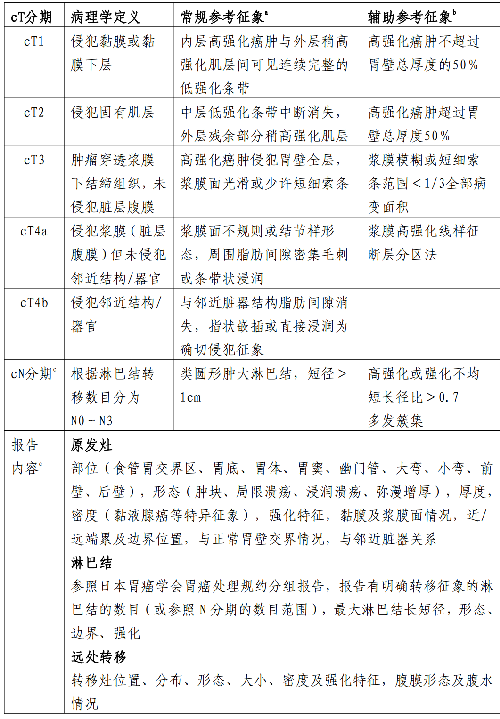
4.16 附錄十二:胃癌CT分期徵象及報告參考
1.胃癌CT分期徵象及報告參考
4.17 附錄十三:胃癌超聲內鏡(EUS)分期徵象
4.18 附錄十四:胃癌常用系統治療方案

3 藥聯合方案
單藥方案

4.19 附錄十五:胃癌常用靶向治療藥物
4.20 附錄十六、:胃癌放射及化學治療療效判定基本標準
4.20.1 一、實體瘤療效評價標準
完全緩解,腫瘤完全消失超過 1 個月。
部分緩解,腫瘤最大直徑及最大垂直直徑的乘積縮小達50%,其他病變無增大,持續超過 1 個月。
病變穩定,病變兩徑乘積縮小不超過 50%,增大不超過25%,持續超過1個月。
病變進展,病變兩徑乘積增大超過 25%。
4.20.2 二、RECIST1.1 療效評價標準
4.20.2.1 (一)靶病竈的評價
1.完全緩解:所有靶病竈消失,全部病理淋巴結(包括靶結節和非靶結節)短直徑必須減少至<10mm。
2.部分緩解:靶病竈直徑之和比基線水平減少至少30%。
3.病變進展:以所有測量的靶病竈直徑之和的最小值爲參照,直徑和相對增加至少 20%(如果基線測量值最小就以基線值爲參照);除此之外,必須滿足直徑和的絕對值增加至少 5 mm(出現 1 個或多個新病竈也視爲疾病進展)。
4.病變穩定:靶病竈減小的程度沒達到部分緩解,增加的程度也沒達到病變進展水平,介於兩者之間,可以直徑之和的最小值作爲參考。
4.20.2.2 (二)非靶病竈的評價
1.完全緩解:所有非靶病竈消失和腫瘤標誌物恢復正常。2.未完全緩解/穩定:存在 1 個或多個非靶病竈和/或腫瘤標誌物持續高於正常值。
3.病變進展。出現一個或多個新病竈和/或已有的非靶病竈明確進展。
4.20.2.3 (三)最佳總療效的評價
最佳總療效的評價是指從治療開始到疾病進展或復發之間所測量到的最小值。患者最好療效的分類通常由病竈測量和確認組成。
4.21 附錄十七:腫瘤術前輔助治療療效評估(腫瘤退縮分級TRG)腫瘤退縮分級(TRG) 光鏡下所見

備註
a. TGR 評分僅限於原發腫瘤病竈
5 附件 胃癌診療指南(2022 年版)編寫審定專家組(按姓氏筆畫排序)組長:季加孚
成員:王仁本、石素勝、劉雲鵬、劉宏俊、李鵬、沈琳、武愛文、周志偉、周愛萍、房學東、趙東兵、胡道予、徐泉、章真、梁軍、梁寒