1 拼音
gǔ suǐ zēng shēng yì cháng zōng hé zhēng bàn yuán shǐ xì bāo zēng duō ( M D S - E B ) zhěn liáo zhǐ nán ( 2 0 2 2 nián bǎn )
2 基本信息
《骨髓增生異常綜合徵伴原始細胞增多(MDS-EB)診療指南(2022年版)》由國家衛生健康委辦公廳於2022年4月3日《國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知》(國衛辦醫函〔2022〕104號)印發,要求各省、自治區、直轄市及新疆生產建設兵團衛生健康委組織做好實施工作。
3 發佈通知
國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知
國衛辦醫函〔2022〕104號
各省、自治區、直轄市及新疆生產建設兵團衛生健康委:
爲進一步提高腫瘤和血液病診療規範化水平,保障醫療質量安全,維護患者健康權益,我委委託有關單位制修訂了腫瘤和血液病相關病種診療指南。現印發給你們(見附件,可在國家衛生健康委網站醫政醫管欄目下載),請各地衛生健康行政部門組織做好實施工作。
附件:
2.膀胱癌診療指南(2022年版)
5.胰腺癌診治指南(2022年版)
6.腎癌診療指南(2022年版)
7.乳腺癌診療指南(2022年版)
8.子宮內膜癌診療指南(2022年版)
12.甲狀腺癌診療指南(2022版)
13.腦膠質瘤診療指南(2022年版)
16.瀰漫性大B細胞淋巴瘤診療指南(2022年版)
17.骨髓增生異常綜合徵伴原始細胞增多(MDS-EB)診療指南(2022年版)
18.慢性髓性白血病診療指南(2022年版)
19.血友病A診療指南(2022年版)
20.慢性淋巴細胞白血病-小淋巴細胞淋巴瘤診療指南(2022年版)
國家衛生健康委辦公廳
2022年4月3日
4 診療指南全文
骨髓增生異常綜合徵伴原始細胞增多(MDS-EB)診療指南(2022年版)
4.1 一、概述
骨髓增生異常綜合徵(myelodysplastic syndromes,MDS)是一組起源於造血幹細胞的異質性髓系克隆性疾病,其特點是髓系細胞發育異常,表現爲無效造血、難治性血細胞減少,高風險向急性髓系白血病(acute myelogenousleukemia,AML)轉化。
MDS 的診斷與分型標準自1982 年由FAB 協作組首次確立以來,在過去近 40 年裏幾經補充修改,日趨完善。其中MDS伴原始細胞增多(myelodysplastic syndromes withexcessblasts,MDS-EB)亞型是指骨髓中原始細胞達5%~19%,較其他亞型向 AML 轉化的風險進一步提高。
4.2 二、診斷技術和應用
4.2.1 (一)發病情況。
MDS 全球發病率約爲(2~12)/10 萬,中國發病率爲(0.23~1.51)/10 萬。MDS 發病率隨年齡增長而增加,80%發病年齡大於 60 歲。男性多於女性,德國資料≥70歲人羣中 MDS 發病率,男性 33.9/10 萬,女性18/10 萬;瑞典資料中 MDS 男性與女性之比爲 1.8∶1。
4.2.2 (二)臨牀表現。
MDS-EB 的臨牀表現無特異性,以全血細胞減少爲主,常有明顯貧血、出血及感染表現,可伴有脾腫大,常在短期內進展爲急性白血病,轉化率高達40%,部分患者雖未進展爲急性白血病,但常因感染及出血而死亡。
4.2.3 (三)實驗室檢查。
MDS 診斷依賴於多種實驗室檢測技術的綜合使用,其中骨髓穿刺塗片細胞形態學和細胞遺傳學檢測技術是MDS診斷的核心。
4.2.3.1 1.必需的檢測項目。
4.2.3.1.1 (1)骨髓穿刺塗片:
MDS 患者外周血和骨髓塗片的形態學異常分爲 2 類:原始細胞比例增高和細胞發育異常。原始細胞可分爲 2 型:1 型(EB-1)爲無嗜天青顆粒的原始細胞;2 型(EB-1)爲有嗜天青顆粒但未出現核旁空暈區的原始細胞,出現核旁空暈區者則判斷爲早幼粒細胞。典型的MDS患者,發育異常細胞佔相應系別細胞的比例≥10%。擬診MDS患者均應進行骨髓鐵染色計數環狀鐵粒幼紅細胞,其定義爲幼紅細胞胞質內藍色顆粒在 5 顆以上且圍繞核周1/3以上者。
4.2.3.1.2 (2)骨髓活檢病理:
所有懷疑爲MDS 的患者均應行骨髓活檢,通常在髂後上棘進行,長度不少於1.5 cm。骨髓活檢細胞學分析有助於排除其他可能導致血細胞減少的因素或疾病,並提供骨髓細胞增生程度、巨核細胞數量、原始細胞羣體、骨髓纖維化程度及腫瘤骨髓轉移等重要信息。懷疑爲 MDS 的患者應行 Gomori 銀染色和原位免疫組化,常用的檢測標誌包括 CD34、MPO、GPA、CD61、CD42、CD68、CD20和 CD3。
4.2.3.1.3 (3)染色體核型分析:
所有懷疑MDS 的患者均應進行染色體核型檢測,通常需分析≥20 個骨髓細胞的中期分裂象,並按照《人類細胞遺傳學國際命名體制(ISCN)2013》進行核型描述。40%~60%的 MDS 患者具有非隨機的染色體異常,其中以+8、-7/del(7q)、del(20q)、-5/del(5q)和-Y最爲多見。MDS 患者常見的染色體異常中,部分具有診斷價值:①不平衡染色體異常:-7/del(7q);del(5q);(i17q)/t(17p);-13/del(13q);del(11q);del(12p)/t(12p);del(9q);idic(X)(q13)。②平衡染色體異常:(t11;16)(q23.3;p13.3);(t3;21)(q26.2;q22.1);(t1;3)(p36.3;q21.2);(t2;11)(p21;q23.3);inv(3)(q21.3;q26.2)/t(3;3)(q21.3;q26.2);(t6;9)(p23;q34.1)。而+8、del(20q)和-Y 亦可見於再生障礙性貧血及其他血細胞減少疾病。形態學未達到標準(1系或多系細胞發育異常比例<10%)、但同時伴有持續性血細胞減少的患者,如檢出具有 MDS 診斷價值的細胞遺傳學異常,應診斷爲 MDS 未分類型(MDS-U)。
4.2.3.2 2.推薦的檢測項目。
4.2.3.2.1 (1)熒光原位雜交技術:
應用針對MDS 常見異常的組套 探 針 進 行 熒 光 原 位 雜 交(fluorescence insituhybridization,FISH)檢測,可提高部分MDS 患者細胞遺傳學異常檢出率。因此,對疑似MDS 者,骨髓幹抽、無中期分裂象、分裂象質量差或可分析中期分裂象<20 個時,應進行 FISH 檢測,通常探針應包括:5q31、CEP7、7q31、CEP8、20q、CEPY 和 TP53。
4.2.3.2.2 (2)骨髓流式細胞術檢查:
目前尚無MDS 特異性的抗原標誌或標誌組合。對於缺乏確定診斷意義的細胞形態學或細胞遺傳學表現的患者,不能單獨依據流式細胞術檢測結果確定 MDS 診斷。但流式細胞術對於MDS 的預後分層有應用價值。
4.2.3.2.3 (3)基因突變檢測:
新一代基因測序技術可以在絕大多數 MDS 患者中檢出至少 1 個基因突變。MDS 常見基因突變包括 TET2、RUNX1、ASXL1、DNMT3A、EZH2、SF3B1 等。部分基因的突變狀態對 MDS 的鑑別診斷和危險度分層中有一定的價值,推薦作爲選做檢測項目,包括:TP53、TET2、DNMT3A、IDH1/2、EZH2、ASXL1、SRSF2、RUNX1、U2AF1、SETBP1等。
4.2.4 (四)診斷標準。
原始細胞增多是 MDS-EB 主要的診斷標準:
1.MDS-EB-1:骨髓 5%~9%或外周血2%~4%,無Auer小體。
2.MDS-EB-2:骨髓 10%~19%或外周血5%~19%或有Auer小體。
4.2.5 (五)預後分層。
MDS 患者常用危險度分層系統包括國際預後評分系統(international prognostic score system,IPSS)、WHO分型預後積分系統 (WHO adapted prognostic scoringsystem,WPSS)和修訂的國際預後積分系統(revisedinternational prognostic scoring system,IPSS-R)。此外,安德森癌症中心(MD Anderson Cancer Center,MDACC分層系統除了常用主要參數外,還引入了年齡、體能狀態等參數。
1.IPSS:IPSS 危險度的分級1997 制定,根據以下3個因素確定:骨髓原始細胞比例、血細胞減少的程度和骨髓細胞遺傳學特徵。骨髓原始細胞5%~10%(EB-1)積分0.5分,骨髓原始細胞 11%~20%(EB-2)積分1.5 分。
2.WPSS:2007 年制定,紅細胞輸注依賴及鐵過載不僅導致器官損害,也可直接損害造血系統功能,從而可能影響MDS 患者的自然病程。2011 年修訂的WPSS 預後評分系統將評分依據中的紅細胞輸注依賴改爲血紅蛋白水平。WPSS作爲一個時間連續性的評價系統,可在患者病程中的任何時點對預後進行評估。骨髓原始細胞5%~10%(EB-1)積分2分,骨髓原始細胞 11%~20%(EB-2)積分3 分。
3.IPSS-R:IPSS-R 積分系統被認爲是MDS 預後評估的金標準,是 MDS 預後國際工作組在2012 年對IPSS預後評分系統修訂的最新版本,其對預後的評估效力明顯優於IPSS、WPSS。2%<骨髓原始細胞<5%積分1 分,骨髓原始細胞 5%~10%(EB1)積分 2 分,骨髓原始細胞>10%(EB-2)積分 3 分。然而,IPSS-R 也有其侷限性。其預後評估是否適用於接受化療或靶向藥物治療的患者依然未知;再者,其他具有獨立預後意義的因素未包含其中,比如紅細胞的輸注依賴、基因突變,特別是基因突變可能有助於更精準的預後評估。
4.3 三、治療
MDS 治療宜根據 MDS 患者的預後分組,同時結合患者年齡、體能狀況、合併疾病、治療依從性等進行綜合分析,選擇治療方案。MDS可按預後積分系統分爲2組:較低危組[IPSS低危組、中危-1 組,IPSS-R 極低危組、低危組和中危組(≤3.5 分),WPSS 極低危組、低危組和中危組]和較高危組[IPSS中危-2 組、高危組,IPSS-R 中危組(>3.5 分)、高危組和極高危組,WPSS 高危組和極高危組]。MDS-EB 階段患者如伴隨血細胞計數減少,基本都在較高危組,其治療目標是延緩疾病進展、延長生存期和治癒。
4.3.1 (一)支持治療。
支持治療最主要目標爲提升患者生活質量。對於MDS-EB患者主要包括成分輸血:一般在血紅蛋白<60 g/L 或伴有明顯貧血症狀時可給予紅細胞輸注。患者爲老年、機體代償能力受限、需氧量增加時,建議血紅蛋白≤80g/L 時給予紅細胞輸注。血小板計數<10×109/L 或有活動性出血時,應給予血小板輸注。
4.3.2 (二)去甲基化藥物。
常用的去甲基化藥物包括5-阿扎胞苷(azacitidine,AZA)和 5-氮雜-2’-脫氧胞苷酸(decitabine,地西他濱)。去甲基化藥物應用於較高危組MDS 患者,與支持治療組相比,去甲基化藥物治療組可降低患者向AML 進展的風險、改善生存。
4.3.2.1 1.AZA:
推薦用法爲每日 75 mg/m2×7 日,皮下注射,28日爲 1 個療程。接受 AZA 治療的MDS 患者,首次獲得治療反應的中位時間爲 3 個療程,約90%治療有效的患者在6個療程內獲得治療反應。因此,推薦MDS 患者接受AZA 治療6個療程後評價治療反應,有效患者可持續使用。
4.3.2.2 2.地西他濱:
推薦方案爲每日20 mg/m2×5 日,每4周爲 1 個療程。推薦 MDS 患者接受地西他濱治療4~6個療程後評價治療反應,有效患者可持續使用。
4.3.3 (三)化療。
較高危組尤其是原始細胞比例增高的MDS-EB 患者預後較差,化療是選擇非造血幹細胞移植(hematopoieticstemcell transplantation,HSCT)患者的治療方式之一。可採取 AML 標準 3+7 誘導方案或預激方案。預激方案在國內廣泛應用於較高危 MDS 患者,爲小劑量阿糖胞苷(10 mg/m2,每12 小時 1 次,皮下注射,14 日)基礎上加用粒細胞集落刺激因子,並聯合阿克拉黴素或高三尖杉酯鹼或去甲氧柔紅黴素。預激方案治療較高危 MDS 患者的完全緩解率可達40%~60%,且老年或身體機能較差的患者對預激方案的耐受性優於常規 AML 化療方案。預激方案也可與去甲基化藥物聯合。
4.3.4 (四)創新藥物。
BCL-2 抑制劑[(Venetoclax(VEN)]、免疫檢查點抑制劑(程序性死亡蛋白-1 抑制劑抑制劑等)、口服組蛋白脫乙酰酶抑制劑及 CD47 單抗等聯合去甲基化藥物在高危MDS治療獲得初步可觀結果,未來有可能改善MDS-EB 患者的總體預後。
4.3.5 (五)異基因造血幹細胞移植。
異基因造血幹細胞移植(allogeneic hematopoieticstem cell transplantation,allo-HSCT)是目前唯一能根治 MDS 的方法,造血幹細胞來源包括同胞全相合供者、非血緣供者和單倍型相合血緣供者。allo-HSCT 的適應證爲:①年齡<65 歲、較高危組 MDS 患者;②年齡<65 歲、伴有嚴重血細胞減少、經其他治療無效或伴有不良預後遺傳學異常(如-7、3q26 重排、TP53 基因突變、複雜核型、單體核型)的較低危組患者。擬行 allo-HSCT 的MDS-EB 患者,在等待移植的過程中可應用化療或去甲基化藥物或二者聯合橋接allo-HSCT,但不應耽誤移植的進行。
4.4 四、療效和隨訪
是基於 MDS 國際工作組(International WorkingGroup,IWG)2000 年提出、2006 年修訂的國際統一療效標準。MDS的治療反應包括以下 4 種類型。
4.4.1 (一) 改變疾病的自然病程。
4.4.1.1 1.完全緩解:
骨髓:原始細胞≤5%且所有細胞系成熟正常。外周血:原始細胞爲 0,血紅蛋白≥110 g/L,中性粒細胞≥1.0×109/L,血小板≥100×109/L。
4.4.1.2 2.部分緩解:
外周血絕對值必須持續至少2 個月,其他條件均達到完全緩解標準(凡治療前有異常者),但骨髓原始細胞僅較治療前減少≥50%,但仍>5%,不考慮骨髓細胞增生程度和形態學。
4.4.1.3 3.骨髓 CR:
骨髓:原始細胞≤5%且較治療前減少≥50%;外周血:如果達到血液學改善,應同時註明。
4.4.1.4 4.疾病穩定:
未達到部分緩解的最低標準但至少8周以上無疾病進展證據。
4.4.1.5 5.失敗:
治療期間死亡或病情進展,表現爲血細胞減少加重、骨髓原始細胞增高或較治療前發展爲更進展的FAB亞型。
4.4.1.6 6.進展:
原始細胞<5%者:原始細胞增加≥50%達到5%;原始細胞 5%~10%者:原始細胞增加≥50%達到10%;原始細胞 10%~20%者:原始細胞增加≥50%達到20%;外周血:中性粒細胞或血小板較最佳緩解/療效時下降≥50%;血紅蛋白下降≥20 g/L;依賴輸血。
4.4.2 (二)細胞遺傳學反應。
1.完全反應:染色體異常消失且無新發異常。2.部分反應:染色體異常細胞比例減少≥50%。
4.4.3 (三)血液學改善。
1.紅系反應(治療前血紅蛋白<110 g/L):血紅蛋白升高≥15 g/L;紅細胞輸注減少,與治療前比較,每8周輸注量至少減少 4 U;僅治療前血紅蛋白≤90g/L 且需紅細胞輸注者才納入紅細胞輸注療效評估。
2.血小板反應(治療前血小板<100×109/L):治療前血小板>20×109/L 者,淨增值≥30×109/L 或從<20×109/L 增高至>20×109/L 且至少增高100%。
3.中性粒細胞反應(治療前中性粒細胞<1.0×109/L):增高 100%以上和絕對值增高>0.5×109/L。
4.血液學改善後進展或復發:至少有下列1 項:中性粒細胞或血小板較最佳療效時下降≥50%,血紅蛋白下降≥15g/L,依賴輸血。
4.4.4 (四)改善生存質量。
使用各種問卷或 WHO 體能積分。
4.5 附錄1:MDS-EB 患者的診斷治療流程
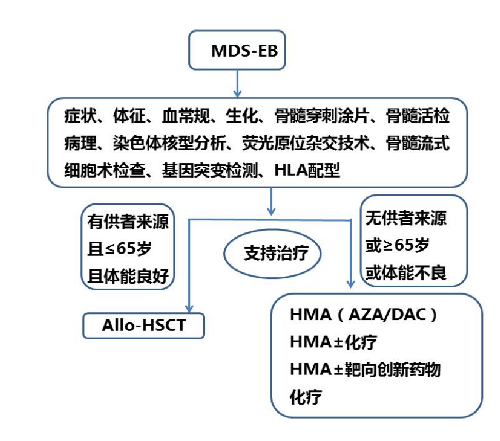
4.6 附錄2:骨髓增生異常綜合徵伴原始細胞增多(MDS-EB)診療指南(2022版)編寫審定專家組
(按姓氏筆畫排序)
組長:黃曉軍
成員:王婧、付海霞、許蘭平、江倩、江浩、張曉輝、楊申淼、張圓圓、賈晉松、黃曉軍、路瑾