2 基本信息
《食管癌診療指南(2022年版)》由國家衛生健康委辦公廳於2022年4月3日《國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知》(國衛辦醫函〔2022〕104號)印發,要求各省、自治區、直轄市及新疆生產建設兵團衛生健康委組織做好實施工作。
3 發佈通知
國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知
國衛辦醫函〔2022〕104號
各省、自治區、直轄市及新疆生產建設兵團衛生健康委:
爲進一步提高腫瘤和血液病診療規範化水平,保障醫療質量安全,維護患者健康權益,我委委託有關單位制修訂了腫瘤和血液病相關病種診療指南。現印發給你們(見附件,可在國家衛生健康委網站醫政醫管欄目下載),請各地衛生健康行政部門組織做好實施工作。
附件:
2.膀胱癌診療指南(2022年版)
5.胰腺癌診治指南(2022年版)
6.腎癌診療指南(2022年版)
7.乳腺癌診療指南(2022年版)
8.子宮內膜癌診療指南(2022年版)
12.甲狀腺癌診療指南(2022版)
13.腦膠質瘤診療指南(2022年版)
16.瀰漫性大B細胞淋巴瘤診療指南(2022年版)
17.骨髓增生異常綜合徵伴原始細胞增多(MDS-EB)診療指南(2022年版)
18.慢性髓性白血病診療指南(2022年版)
19.血友病A診療指南(2022年版)
20.慢性淋巴細胞白血病-小淋巴細胞淋巴瘤診療指南(2022年版)
國家衛生健康委辦公廳
2022年4月3日
4 診療指南全文
4.1 一、概述
食管癌已是全球範圍內常見的惡性腫瘤之一,據2020年全球癌症統計,食管癌的新發病人數達 60.4 萬,死亡人數達54.4萬。中國是食管癌高發地區,雖然中國食管癌的發病率及死亡率均呈下降趨勢,但依舊是威脅我國居民健康的主要惡性腫瘤。根據2015年中國惡性腫瘤流行情況估計,我國食管癌新發病例24.6 萬,我國食管癌粗發病率 17.8/10 萬,城市粗發病率爲12.6/10 萬,農村粗發病率爲24.6/10 萬;食管癌死亡病例 18.8 萬,我國食管癌粗死亡率爲13.7/10萬,城市粗死亡率 10.0/10 萬,農村粗死亡率18.4/10 萬,發病率及死亡率分別列全部惡性腫瘤的第 6 位和第4 位。食管癌的發病有明顯的地域差異,高發區主要集中在太行山脈附近區域(河南、河北、山西、山東泰安、山東濟寧、山東菏澤),以及安徽、江蘇蘇北、四川南充、四川鹽亭、廣東汕頭、福建閩南等地區。我國食管癌流行學典型特徵爲男性發病率高於女性,農村人口發病率高於城市人口。然而,自2000 年開始,無論城市抑或農村,無論男性抑或女性,食管癌發病率均呈現下降趨勢,其中女性發病率下降趨勢尤其明顯。我國食管癌主要的組織學類型爲鱗狀細胞癌爲主,已知其發病與飲食生活習慣密切相關,包括燙食、熱茶、飲酒、吸菸等,此外還包括食品黴變、炭烤或煙燻製備方式、飲用水、土壤成分或環境微生物菌羣等因素。通過提倡健康生活方式,改變不良飲食習慣,有助於預防食管癌發生;針對高危人羣開展早期篩查,有助於提高早期食管癌檢出率;各級醫療機構貫徹食管癌早診早治策略,有助於改善患者長期生存及生活質量;通過規範化診療及多學科綜合治療模式進一步提升局部進展期與晚期食管癌患者預後。只有上述多層面醫療措施充分得到執行,才能從根本上減輕我國民衆食管癌疾病負擔,因此制定並執行食管癌診療指南是必要的,需要各專業醫務工作者予以高度重視。
4.2 二、食管癌診斷指南
4.2.1 (一)症狀體徵。
4.2.1.1 1.臨牀症狀
典型臨牀表現爲進行性吞嚥困難,進食後梗噎感、異物感、燒灼感、停滯感或飽脹感等,伴或不伴有胸骨後疼痛、反酸、胃灼熱、噯氣,起初爲進普通飲食困難,隨後逐漸惡化爲僅可進半流質飲食或流質飲食,可伴或不伴有進食後隨即出現食糜或黏液反流、咳黃膿痰、發熱、胸悶、喘憋、嘔吐、嘔血、黑便、胸背部疼痛、聲音嘶啞或飲水嗆咳等。由於進食困難導致營養攝入不足風險升高,累積數月後可能消瘦、乏力、倦怠、體力減弱等。2.相關體徵
早期食管癌通常無明顯特異性體徵;中晚期階段可能出現頸部或鎖骨上區淋巴結腫大,提示淋巴結轉移可能;黃疸、觸診肝腫大或肝區壓痛等,提示肝轉移可能;胸廓呼吸運動受限,呼吸淺快,肋間隙豐滿,氣管向健側移位,患側語音震顫減弱或消失等,提示惡性胸水可能;腹壁緊張度增加、腹式呼吸運動減弱、叩診移動性濁音等,提示惡性腹水、腹膜轉移可能;近期體重明顯減輕、皮褶厚度變薄、舟狀腹等,提示營養不良或惡液質。
4.2.2 (二)輔助檢查。
4.2.2.1 1. 影像學檢查
4.2.2.1.1 (1)CT:
推薦胸段食管癌 CT 掃描常規包含頸、胸、腹部區域;食管胃交界部癌 CT 掃描根據病情可納入盆腔區域(臨牀判斷必要時)。推薦使用靜脈滴注以及口服對比增強,CT 平掃/增強掃描及多角度重建影像,用於判斷食管癌位置、腫瘤浸潤深度、腫瘤與周圍結構及器官的相對關係、區域淋巴結轉移以及周圍血管侵犯。如果患者有靜脈對比劑的禁忌證,則推薦包含相應區域的CT平掃,或者補充頸部或腹部超聲檢查。
4.2.2.1.2 (2)上消化道造影:
用於評估食管原發腫瘤情況。其對於食管癌的位置和長度判斷較直觀,但是不能評估原發竈侵犯深度或區域淋巴結轉移情況。檢查操作指南應至少3 個攝片體位:正位、左前斜位及右前斜位,上界包括下嚥,下界達胃幽門以遠。
4.2.2.1.3 (3)MRI:
對於 CT 無法判別食管癌原發竈與周圍氣管及支氣管膜部、主動脈外膜臨界關係時,MRI 可提供有價值的補充信息。此外,還對診斷肝臟、顱腦、骨骼等遠隔轉移竈具有臨牀價值,是否推薦取決於主診醫生判斷。體內有金屬植入物或幽閉恐懼綜合徵患者慎用或禁用。
4.2.2.1.4 (4)正電子發射計算機體層成像(positron emissiontomography-computed tomography,PET-CT):
用於輔助診斷、治療前/後分期、療效評估,輔助重要臨牀決策。掃描範圍推薦全身掃描(至少包括顱底至 大腿根部 )。合併糖尿 病患者檢查前血糖水平需控制在11.1mmol/L 以下,以避免影響顯像質量。新輔助治療後再分期建議同一中心同一儀器重複檢查,氟-18- 氟代脫氧葡萄糖(18Ffluorodeoxyglucose,18F-FDG)劑量差異應在20%放射性活度以內,並且注射示蹤劑後靜息時間差異在15 分鐘以內。已知懷孕婦女應權衡檢查對臨牀決策與胎兒發育風險的利弊;哺乳期婦女注射18F-FDG後需暫停母乳餵養 12 小時以上。幽閉恐懼症爲相對禁忌證。目前對於最大標準攝取值在診斷與評效環節的閾值尚缺乏共識,因此應結合主診醫師經驗進行解讀,在設備條件允許的醫療機構可推薦。
4.2.2.1.5 (5)超聲檢查:
指常規體表超聲檢查,主要應用於食管癌患者雙側頸區、鎖骨上區淋巴結評估(N 分期)及肝臟轉移竈評估(M分期)診斷。超聲引導下可穿刺活檢獲得病理學診斷證據。上述頸部及腹/盆腔超聲分期檢查與診斷醫師經驗相關,專業資質雄厚的醫療機構可選擇。此外,還可用於晚期食管癌患者胸腹腔積液診斷及定位。
4.2.2.2 2. 內鏡學檢查
4.2.2.2.1 (1)食管普通光鏡:
食管癌臨牀診斷的必要檢查項目之一,兼顧食管癌原發病竈大體分型與活檢病理學確診。內鏡下分型詳見食管癌分類章節內容。存在食管不全或完全梗阻患者,食管內鏡可能無法獲得腫瘤遠端累及信息,可結合上消化道造影或胸部CT/MRI/PET-CT 影像進行判斷。
4.2.2.2.2 (2)食管色素內鏡:
常用染劑包括碘液、甲苯胺藍等,可單一染色,也可聯合使用。通過噴灑色素對比正常黏膜顯示上皮不典型增生或多原發早癌區域,提高 T 分期準確性。
4.2.2.2.3 (3)特殊內鏡技術:
利用窄帶成像技術結合放大內鏡觀察食管上皮乳頭內毛細血管袢(intrapapillary capillary loops,IPCL)與黏膜微細結構有助於更好地區分病變與正常黏膜及評估病變浸潤深度;放大內鏡通過直接觀察食管黏膜表面形態,根據IPCL 的分型可進一步鑑別病變良惡性及食管病變可能的浸潤深度,可指導靶向活檢及判斷是否符合治療適應證;激光共聚焦顯微內鏡(confocal laser endomicroscopy,CLE)可將組織放大至 1000 倍,從微觀角度顯示細胞及亞細胞結構,在無需活檢的情況下即可從組織學層面區分病變與非病變區域,實現“光學活檢”的效果;上述特殊內鏡技術若醫療設備條件准許可考慮選擇。
4.2.2.2.4 (4)食管超聲內鏡(endoscopic ultrasonography,EUS):
內鏡下超聲技術有助於顯示食管癌原發病竈侵及層次,對於T分期診斷比較重要。此外,EUS 還可評估食管及腹腔幹周圍淋巴結,EUS引導下細針穿刺活檢(endoscopic ultrasonography guided fine-needle aspiration,EUS-FNA)獲得病理學確認 N 分期。影像學檢查提示管腔狹窄導致EUS 無法通過者,或者存在可疑穿孔患者禁忌。EUS同樣受內鏡診斷醫生經驗影響,專業資質雄厚的醫療機構可選擇。
4.2.2.3 3. 其他檢查
(1)目前缺乏食管癌特異性血液腫瘤標誌物,諸如循環腫瘤細胞、循環腫瘤 DNA/RNA、表觀遺傳學標記物(DNA甲基化、非編碼 RNA、組蛋白修飾等)、外泌體等尚處於實驗室或臨牀前研究階段,除非臨牀研究範疇內,不推薦常規臨牀診療。
(2)影像學檢查疑似食管胸上/中段癌侵犯氣管/支氣管膜部者,建議具備設備條件的醫療機構進一步行支氣管鏡/超聲支氣管鏡檢查。
(3)具備設備條件的醫療機構可對影像學檢查懷疑的氣管/支氣管周圍腫大淋巴結行超聲支氣管鏡下穿刺活檢明確病理學診斷。
(4)縱隔鏡/胸/腹腔鏡下淋巴結切取活檢術等全身麻醉下有創性檢查可在經多學科討論後對高選擇性患者開展以輔助診療決策。
4.2.3 (三)臨牀診斷。
病理學診斷(金標準)需要食管內鏡下活檢確診。存在內鏡檢查禁忌或者多次嘗試活檢均未能明確病理診斷者可綜合上消化道造影、(頸)胸(腹)部增強 CT、全身PET-CT 或EUS 或超聲支氣管鏡(endobronchial ultrasound,EBUS)引導下穿刺活檢輔助診斷。影像學檢查可疑轉移性淋巴結或遠隔臟器應根據醫療條件及操作風險因素經綜合評估後,由主診醫生酌情選擇合理的活檢方式。臨牀分期診斷應包括(頸)胸/腹(盆)部增強CT,依據醫療條件可選擇超聲檢查、EUS、PET-CT 及MRI 等影像學評估方法。新輔助治療後再分期診斷仍以治療前初始臨牀分期方法爲基礎,綜合醫療條件及操作風險,針對可疑轉移性區域淋巴結或遠隔臟器可進行有創性活檢病理學再確認。
4.2.4 (四)食管癌高危健康人羣的篩查。
年齡≥40 歲,來自食管腫瘤高發地區,或有食管腫瘤家族史、食管癌高危因素(吸菸、重度飲酒、頭頸部或呼吸道鱗癌、喜食高溫及醃製食物、口腔衛生狀況不良等)爲高危人羣,推薦行內鏡下食管黏膜碘染色法篩查。若內鏡下未見病竈,即定期複查內鏡隨訪。若發現淺表型病竈,取活檢評估病理情況。若病理爲低級別上皮內瘤變/異型增生,每 3 年隨訪 1 次;若病理爲高級別上皮內瘤變/異型增生、黏膜內癌,並且未發現脈管侵犯,可考慮行內鏡下治療。如果內鏡表現較活檢病理結果更重,建議行精細食管內鏡檢查(包括放大內鏡、窄光譜成像、染色等)以評估病變情況、決定診治計劃。年齡≥40 歲,具有食管癌高危因素(賁門失弛緩症、腐蝕性狹窄、胼胝症、肥胖)的高危人羣,推薦每1~3 年進行1 次內鏡下食管黏膜碘染色評估。
對於已知或食管內鏡下新發現的具有巴雷特食管高危危險因素的患者,推薦食管內鏡下每隔 2cm 行4 點位活檢(至少8 塊活檢組織)。若存在洛杉磯分級診斷爲 B、C、D 級別的食管炎,需先規律服用質子泵抑制劑,治療 8~12 周後再行內鏡下診斷;若沒有巴雷特食管,則可以終止內鏡篩查;若病理診斷爲巴雷特食管不伴有異型增生,每隔 3~5 年再次行內鏡檢查及病理活檢;若病理診斷爲巴雷特食管伴低級別上皮內瘤變/異型增生,則需行食管內鏡下治療或每年行內鏡檢查並每隔 1cm 行 4 點位活檢;若病理診斷爲巴雷特食管合併高級別上皮內瘤變,則需行食管內鏡下治療或外科手術治療。
4.2.5 (五)食管癌的分類和分期。
4.2.5.1 1. 食管癌的臨牀分段
4.2.5.1.1 (1)頸段食管:
上自下嚥,下達胸廓入口即胸骨上切跡水平。周圍毗鄰氣管、頸血管鞘和脊椎。內鏡下通常距門齒15~20cm。
4.2.5.1.2 (2)胸上段食管:
上起胸廓入口,下至奇靜脈弓下緣(即肺門水平之上)。其前面被氣管、主動脈弓的3 個分支及頭臂靜脈包圍,後面毗鄰脊椎。內鏡下通常距門齒20~25cm。
4.2.5.1.3 (3)胸中段食管:
上起奇靜脈弓下緣,下至下肺靜脈下緣(即肺門水平之間)。其前方夾在兩肺門之間,左側與胸降主動脈爲鄰,後方毗鄰脊椎,右側遊離直接與胸膜相貼。內鏡下通常距門齒25~30cm。
4.2.5.1.4 (4)胸下段食管
上起自下肺靜脈下緣,下至食管胃結合部(即肺門水平之下)。內鏡下通常距門齒30~40cm。臨牀上需綜合多種影像學與內鏡學檢查結果,以病變中心位置所處食管分段進行診斷。
4.2.5.2 2. 食管胃交界部定義
食管胃交界部即食管末端和胃的起始,相當於賁門切跡或腹膜返折水平或食管括約肌下緣,與組織學上的鱗柱交界不一定一致,解剖範圍包括胸下段食管、食管胃交界線及胃近端5cm範圍。臨牀診療常根據 Siewert 分型,根據病變中心位於食管胃交界線(又稱鱗柱交界線、Z 線或 EGJ 線)上下各 5cm 範圍內分爲:
Siewert Ⅰ型:腫瘤中心位於食管胃交界線以上1~5cm範圍內。
Siewert Ⅱ型:腫瘤中心位於食管胃交界線以上1cm至以下2cm範圍內。
Siewert Ⅲ型:腫瘤中心位於食管胃交界線以下2~5cm範圍內。
若腫瘤累及食管胃交界部,腫瘤中心在食管胃交界部食管側者或在胃側 2cm 之內者(Siewert Ⅰ型和Ⅱ型),遵照食管癌分期原則;腫瘤中心在近端胃 2cm 之外(SiewertⅢ型)或腫瘤中心雖在近端胃2cm 之內但未累及食管胃交界部者,遵循胃癌分期原則。
4.2.5.3 3. 淺表型食管癌及癌前病變內鏡下分型
我國內鏡學分型:隱伏型(充血型)、糜爛型、斑塊型和乳頭型。國際內鏡學分型(2005 年巴黎分型):隆起型病變(0-Ⅰ)、平坦型病變(0-Ⅱ)和凹陷型病變(0-Ⅲ)。0-Ⅰ型又分爲有蒂型(0-Ⅰp)和無蒂型(0-Ⅰs)。黏膜內癌通常表現爲0-Ⅱb 型、0-Ⅱa型及0-Ⅱc型,病竈表面光滑或呈規則的小顆粒狀;而黏膜下癌通常爲0-Ⅰ型及0-Ⅲ型,病竈表面呈不規則粗顆粒狀或凹凸不平小結節狀。詳見附錄A。
病理學病變層次分類:病變僅侷限於上皮內,未突破基底膜者,爲 M1 型(高級別上皮內瘤變/重度異型增生;Tis);淺表型食管癌分爲黏膜內癌和黏膜下癌:黏膜內癌分爲M2 型與M3型;M2型指病變突破基底膜,侵及黏膜層;M3 型指病變侵及黏膜肌層。黏膜下癌根據其侵犯深度可分爲 SM1 型、SM2 型、SM3,SM1型指病變侵犯黏膜下層上 1/3;SM2 型指病變侵犯黏膜下層中1/3;SM3型指病變侵犯黏膜下層下 1/3。對於內鏡下切除的食管鱗癌標本,以200μm作爲區分病變侵犯黏膜下淺層與深層的臨界值。
4.2.5.4 4. 進展期食管癌大體分型
髓質型:病變以食管壁增厚爲特點,邊緣坡狀隆起。
4.2.5.5 5. 食管癌病理組織學類型
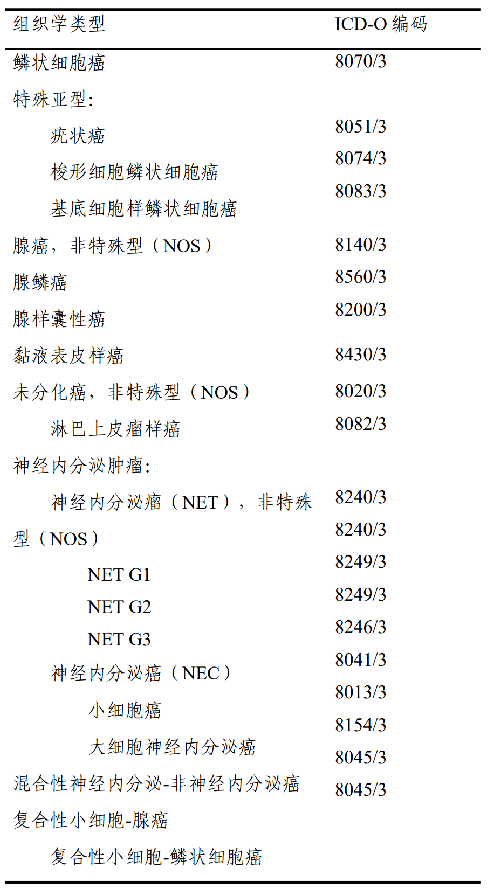
參照 2019 版 WHO 消化系統腫瘤分類,常見病理組織學類型包括鱗癌、腺癌、神經內分泌腫瘤等類型,詳見附錄B。
4.2.5.6 6. 食管癌國際分期原則
參照國際國際抗癌聯盟(Union for International Cancer Control,UICC)/美國癌症聯合會(American Joint Committee onCancer,AJCC)第 8 版 TNM 分期體系,將食管原發腫瘤(T)、區域淋巴結(N)、遠隔臟器轉移(M)及病理分化程度(G)分別定義如下:
4.2.5.6.1 • 原發腫瘤(T)
Tx 原發腫瘤不可評價
T0 沒有原發腫瘤的證據Tis 高級別上皮內瘤變/異型增生T1a 腫瘤侵犯黏膜固有層或黏膜肌層T1b 腫瘤侵犯黏膜下層
T2 腫瘤侵犯固有肌層
T4a 腫瘤侵犯臨近臟器(可切除),如胸膜、心包、奇靜脈、膈肌或腹膜
T4b 腫瘤侵犯臨近重要臟器(不可切除),例如主動脈、椎體或氣管
4.2.5.6.2 • 區域淋巴結(N)
Nx 區域淋巴結不可評價
N1 1~2 個區域淋巴結轉移N2 3~6 個區域淋巴結轉移N3 ≥7 個區域淋巴結轉移
4.2.5.6.3 • 遠處轉移(M)
M0 無遠處轉移
M1 有遠處轉移
4.2.5.6.4 • 病理分化程度
Gx 分化程度不可評估
G1 高分化
G2 中分化
G3 低分化
根據不同臨牀情況,分爲臨牀分期(cTNM)、病理分期(pTNM)與誘導治療後病理分期(ypTNM)3 種類型,具體內容見附錄 C。
上述分期原則適用於食管癌,包括鱗狀細胞癌、腺癌、腺鱗癌、未分化癌、神經內分泌癌、伴神經內分泌特徵的腺癌等,但不適用於食管的神經內分泌瘤及非上皮性腫瘤,如淋巴瘤、肉瘤、胃腸道間質瘤和黑色素瘤等。
4.2.5.7 7. 國際 UICC/AJCC 第 8 版食管癌TNM分期的區域淋巴結分站
1R 右側頸部氣管旁:右側鎖骨上區氣管周圍至右肺尖部區域1L 左側頸部氣管旁:左側鎖骨上區氣管周圍至左肺尖部區域
2R 右側上段氣管旁:頭臂動脈下緣與氣管交匯處至右肺尖部區域
2L 左側上段氣管旁:主動脈弓上緣至左肺尖部區域4R 右側下段氣管旁:頭臂動脈下緣與氣管交匯處至奇靜脈上緣區域
4L 左側下段氣管旁:主動脈弓上緣至隆突水平區域7 隆突下:氣管隆突下區域
8U 胸上段食管旁:肺尖部至氣管分叉區域8M 胸中段食管旁:氣管分叉至下肺靜脈下緣區域9R 右側下肺韌帶:右側下肺韌帶內9L 左側下肺韌帶:左側下肺韌帶內15 膈肌:膈肌頂至膈肌腳區域16 賁門旁:緊鄰食管胃交界部區域17 胃左動脈:沿胃左動脈走行區域18 肝總動脈:緊鄰肝總動脈近端區域19 脾動脈:緊鄰脾動脈近端區域20 腹腔:腹腔動脈根部區域
4.2.5.8 8. 日本食道學會(Japan Esophagus Society,JES)第11版食管癌分期的淋巴結分站
JES 關於食管癌的分期系統主要針對食管鱗癌外科手術方案及放療靶區規劃均具有指導意義,因此也對我國廣大食管鱗癌患者具有參考價值。
JES 區域淋巴結分站:
頸部淋巴結:頸淺淋巴結(100),頸部食管旁淋巴結(101),頸深淋巴結(102),上部的頸深淋巴結(102up),中部的頸深淋巴結(102mid),咽後淋巴結(103),鎖骨上淋巴結(104)
胸部淋巴結:胸上段食管旁淋巴結(105),胸段氣管旁淋巴結( 106 ) , 喉 返 神 經 淋 巴 結 (106rec ),左喉返神經淋巴結(106recL ),右喉返神經淋巴結(106recR ),氣管前淋巴結(106pre),氣管支氣管淋巴結(106tb),左側氣管支氣管淋巴結(106tbL),右側氣管支氣管淋巴結(106tbR),隆突下淋巴結(107),胸中段食管旁淋巴結(108),主支氣管淋巴結(肺門淋巴結,109),胸下段食管旁淋巴結(110),膈上淋巴結(111),後縱隔淋巴結(112),胸主動脈前方淋巴結(112aoA),胸主動脈後方淋巴結(112aoP),下肺韌帶淋巴結(112pul),動脈韌帶淋巴結(113),前縱隔淋巴結(114)。
腹部淋巴結:賁門右淋巴結(1),賁門左淋巴結(2),胃小彎淋巴結(3),沿胃左動脈分支的胃小彎側淋巴結(3a),胃右動脈第二分支遠端的胃小彎淋巴結(3b),左側胃大彎沿胃短動脈淋巴結(4sa),左側胃大彎沿胃網膜左動脈淋巴結(4sb),右側胃大彎沿胃網膜右動脈第二分支至遠端淋巴結(4d),幽門上淋巴結(5),幽門下淋巴結(6),胃左動脈淋巴結(7),肝總動脈前上淋巴結(8a),肝總動脈後淋巴結(8p),腹腔幹淋巴結(9),脾門淋巴結(10),脾動脈近端淋巴結(11p),脾動脈遠端淋巴結(11d),肝十二指腸韌帶內沿肝固有動脈淋巴結(12a),肝十二指腸韌帶內沿膽總管淋巴結(12b),肝十二指腸韌帶內沿門靜脈淋巴結(12p),胰頭後淋巴結(13),腸繫膜上靜脈淋巴結(14v),結腸中動脈淋巴結(15),腹主動脈裂孔淋巴結(16a1),腹腔幹上緣至左腎靜脈下緣之間腹主動周圍脈淋巴結(16a2),左腎靜脈下緣至腸繫膜下動脈上緣之間腹主動脈周圍淋巴結(16b1),腸繫膜下動脈上緣至腹主動脈分叉之間腹主動脈周圍淋巴結(16b2),胰頭前淋巴結(17),胰腺下緣淋巴結(18),膈下淋巴結(19),膈肌食管裂孔淋巴結(20)。
4.2.6 (六)食管癌患者的營養評估。
食管癌診療初始階段即需重視患者營養評估,也是基線期綜合評估的重要組成部分。營養評估包括營養風險篩查與營養評定兩部分。
4.2.6.1 1. 營養風險篩查
營養風險篩查是應用營養風險篩查工具判斷患者是否具有可能影響臨牀結局的營養相關風險的過程。目前臨牀常用營養風險篩查2002(Nutritional Risk Screening 2002,NRS2002)工具等。患者入院後24 小時內應由受過培訓的醫師、營養師、藥師及護師等應用NRS2002 進行營養風險篩查。有營養風險者,需針對性制定營養診斷與干預計劃;無營養風險患者,應於7 日後再次行營養風險篩查。擇期手術者,營養風險篩查時間應提前至術前10 日以上。NRS2002工具包括營養狀態受損評分、疾病嚴重程度評分及年齡評分三部分,詳見附錄 D。當總評分≥3 分時,即具有“營養風險”,需要制定營養診斷與干預計劃。
4.2.6.2 2. 營養評定
營養評定是對有營養風險者進一步瞭解其營養狀況的過程。包括兩部分:基本營養評定和營養不良評定。(1)基本營養評定:基本營養評定是有營養風險者均需接受的營養管理項目。評定內容包括:營養相關病史、膳食調查、體格檢查(身高、體質量等)、實驗室檢查(肝腎功能、血糖、血脂、電解質、酸鹼平衡等)。上述指標是住院患者常規採集內容,也是制定營養干預計劃、開具營養處方及實施監測的必要內容。(2)營養不良評定:營養不良評定涉及營養不良的診斷與分級。推薦根據全球(營養)領導人發起的營養不良診斷標準共識進行營養不良評定。對於營養風險篩查陽性者,如在表現型指標與病因型指標中,至少各自具有 1 項陽性者(附錄E),即可診斷爲營養不良。此外,也可考慮選擇主觀全面評定(Subjective Global Assessment,SGA)、患者參與的 SGA 等評定量表。
4.3 二、食管癌治療指南
4.3.1 (一)外科治療。
外科治療是食管癌的主要根治性手段之一。在2000年以前我國食管癌外科治療的主要入路以左胸入路爲主,由於左胸主動脈弓遮擋和弓上三角狹小導致上縱隔淋巴結清掃不完全,因此,食管癌左胸入路治療後下頸和上縱隔淋巴結複發率高達30%~40%,嚴重影響長期生存。導致我國以左胸入路外科治療食管癌術後5 年生存率近30年來一直徘徊在 30%~40%。隨着近年我國食管癌規範化治療的進步和食管癌胸、腹腔鏡微創手術的推廣應用,右胸入路逐漸增多。右胸入路由於沒有主動脈弓的遮擋,淋巴結清掃較爲徹底。大部分醫院頸部淋巴結清掃爲選擇性。相比較左胸入路,經右胸入路行完全胸、腹二野或頸、胸、腹三野淋巴結清掃能降低術後頸部和胸部淋巴結轉移複發率,可明顯提高 5 年生存率。此外,局部進展期食管癌的單純外科治療模式已經被以手術爲主的多學科綜合治療模式替代,後者包括術前新輔助與術後輔助治療,涉及化療、放化療與免疫治療等。本章節僅聚焦外科治療相關指南內容。
4.3.1.1 1. 手術治療原則
(1)外科可切除性需由食管外科經驗豐富的胸外科醫師評估後判定,包括手術入路及淋巴結清掃策略,以達到包括原發腫瘤及區域淋巴結在內的根治性切除目標。
(2)外科治療方案應在將食管癌疾病情況(包括食管癌累及部位與臨牀分期)、患者合併症、手術者習慣等因素綜合考慮的前提下謹慎制定。
(3)手術入路選擇:對胸段食管癌推薦經右胸入路手術。對上縱隔無淋巴結轉移的食管胸中下段癌,也可選擇經左胸入路等手術。
(4)可選擇的手術方式:可選擇傳統開放式或腔鏡輔助或機器人輔助下的 McKeown 食管癌切除術(經右胸遊離食管+經上腹遊離胃+頸部吻合術),Ivor Lewis 食管癌切除術(經上腹遊離胃+經右胸遊離食管+胸內吻合術),Sweet 食管癌切除術(經左胸遊離食管+經膈肌遊離胃+胸內或頸部吻合術),左胸腹聯合切口+頸部或胸部吻合,聯合胸、腹二野或頸、胸、腹三野淋巴結清掃術。對於不耐受經胸手術的 cT1~2N0 期食管癌患者,可選擇經膈肌裂孔食管內翻拔脫術等多種術式。對於食管胃交界部癌,依據Siewert 分型進行術式選擇:Siewert Ⅰ型參照食管外科術式;Siewert Ⅲ型參照胃外科術式;Siewert Ⅱ型外科治療爭議較大,目前更多是根據胸外科與胃腸外科醫生的手術習慣及不同熟練程度共同決定。
(5)可採用的淋巴結清掃方式:若頸部區域無可疑轉移淋巴結,則對於食管胸中下段癌建議行胸、腹完全二野淋巴結清掃(常規胸腹二野+上縱隔區域淋巴結,特別是雙側喉返神經鏈周圍的區域淋巴結);若頸部區域有可疑轉移淋巴結,或者食管胸上段癌,則推薦頸、胸、腹三野淋巴結清掃術(雙側下頸區+ 雙側鎖骨上區+上述完全二野淋巴結)。
(6)可選用的代食管器官及上消化道重建路徑:最常用的代食管器官可選擇胃、結腸及空腸;是否需要帶蒂血管行顯微外科吻合應酌情考慮。上消化道重建路徑可選擇原食管牀、胸骨後或胸骨前。
(7)食管外科手術數量及相關專業團隊規模是影響食管癌圍術期併發症率及死亡率的重要因素之一,故推薦在經驗豐富的食管癌診療大中心或接受規範化培訓合格的醫師治療組實施食管癌切除術。
4.3.1.2 2. 外科術後隨訪指南
術後 2 年內 3 個月複查 1 次,2~5 年每半年複查1 次,5年以後每年複查 1 次。複查項目包括頸/胸/腹部CT 或頸部及腹部超聲及各項實驗室檢查。上消化道造影、全身PET-CT、骨掃描、顱腦MRI等影像學檢查與上消化道內鏡檢查可根據患者術後病情變化作爲選擇性檢查項目。隨訪期間發現可疑復發或轉移病竈,可酌情行病理學活檢明確診斷。
4.3.2 (二)放射治療。
放射治療是食管癌綜合治療的重要組成部分,涉及術前新輔助、術後輔助、根治性及姑息性治療多個方面。對於 cTis~2 N1~3 M0 或 cT3~4a Nany M0 期食管癌擬行手術者,推薦術前新輔助放化療以提高根治性切除率、病理完全緩解率、局部腫瘤控制率,進而改善術後長期生存;非計劃手術或拒絕手術治療者,推薦行根治性同步放化療;術後經病理學評估爲非根治性切除(R1或 R2),或者雖爲 R0 切除,但爲(y)pT4 Nany M0 期者,可根據患者恢復情況考慮行術後輔助同步放化療。淺表型食管癌經內鏡下食管黏膜切除術,病理學評估爲T1b期或T1a 期合併脈管癌栓、神經受累、低分化或未分化癌或非R0切除者,首選食管切除術,經外科評估不適合手術或拒絕手術者,可考慮行輔助放療或同步放化療;經外科評估不可切除的cT4bNanyM0期食管癌患者,或拒絕手術治療者,推薦行根治性同步放化療。術後局部復發、晚期食管癌合併食管梗阻、廣泛性淋巴結轉移、合併遠隔臟器轉移(肺、骨、腦等)經全身系統性藥物治療後評估疾病穩定或退縮者,可考慮姑息性放射治療。
4.3.2.1 1. 放療方案制定指南
4.3.2.1.1 (1)放射治療技術:
建議採用三維適形放療或調強放療技術,優選後者。已有多個放射物理方面的研究表明,相較於早年的常規二維放療技術,三維適形或調強放療在靶區劑量分佈和正常組織器官保護等方面均表現優異,特別是對於心臟和肺的保護,可降低放療相關不良反應。
4.3.2.1.2 (2)CT 模擬定位:
採取仰臥位,雙臂伸直置於體側或者雙手交叉抱肘置於額前。頸段及上段患者建議頭頸肩罩固定,中下段及食管胃交界癌體膜固定。行靜脈造影增強掃描,層厚0.5cm。有對比劑過敏史者可不行增強掃描。
食管下段及食管胃交界癌,或者需要照射胃左、腹腔淋巴結的患者,爲了減少胃部充盈大小造成的照射體積差異,CT模擬定位前空腹 3~4 小時,CT 掃描前及每次放療前15 分鐘,患者需服用200~300ml 半流質飲食(如稠粥、酸奶等,每次定量)。術後殘胃位於縱隔的患者,不要充盈胃,以胃內無內容物時定位爲佳,放療時亦如此。
4.3.2.1.3 (3)靶區定義:
1)術前新輔助同步放化療或根治性同步放化療:目前尚無食管癌放療靶區規範,建議根據根治性放療靶區設計原則勾畫新輔助放療靶區。勾畫靶區時需考慮後續食管切除術計劃吻合口位置,應儘量避免吻合口位於射野內。
大體腫瘤靶區(Gross Tumor Volume,GTV)及淋巴結靶區(Gross Tumor Volume — Lymph Node,GTVnd):結合各項治療前臨牀評估可見的食管癌原發腫瘤爲GTV,確診轉移或不能除外轉移的淋巴結爲 GTVnd。
臨牀靶區(Clinical Target Volume,CTV):
①頸段/胸上段食管癌:GTV 上下外擴 3cm,GTVnd 三維外擴0.5~1cm。一般需包括中頸、1(下頸、雙側鎖骨上)、2、4、7 淋巴結引流區。頸段可不包括 7 區。相離較遠的靶區可考慮累及野照射,如上段食管癌伴腹腔淋巴結轉移。
②胸中段食管癌:GTV 上下外擴3cm,GTVnd三維外擴0.5~1cm。一般需包括 1、2、4、7、部分8 淋巴結引流區。因中段食管癌腹腔淋巴結轉移概率亦比較高,部分患者可能需要照射15、16、17 甚至是 20 區。
③胸下段食管癌/SiewertⅠ/SiewertⅡ型食管胃交界癌:GTV 上下外擴 3cm,GTVnd 三維外擴0.5~1cm,一般需包括7、8、15、16、17、20 淋巴結引流區,部分患者可能需要包括18、19區的近端。相離較遠的靶區可考慮累及野照射,如下段食管癌伴1區淋巴結轉移。
計劃靶區(Planning Target Volume,PTV):根據實際擺位誤差決定,一般在 CTV 的基礎上三維外擴0.5cm形成,頭頸肩網罩固定的頸段或胸上段食管癌可外擴 0.3cm。
PGTV(採用序貫或同步加量時):GTV+GTVnd 三維外擴0.5cm。2)術後輔助放療/同步放化療:需包括吻合口情況:原發於頸段或上段食管癌,或切緣距腫瘤≤3cm。
GTV 及 GTVnd:R1 或 R2 切除後,GTV 包括殘留的原發腫瘤、切緣陽性的吻合口,GTVnd 包括殘留的淋巴結。
CTV:①頸段/胸上段食管癌:包括GTV+GTVnd(如有),吻合口、1、2、4、7 淋巴結引流區。頸段可不包括7 區。T4b需包括瘤牀。②胸中段食管癌:包括 GTV+GTVnd(如有),1、2、4、7、部分8淋巴結引流區。根據病理結果酌情包括15、16、17、20淋巴結引流區。T4b 需包括瘤牀。③胸下段食管癌/SiewertⅠ/SiewertⅡ型食管胃交界癌:包括 GTV+GTVnd(如有),1、2、4、7、8、15、16、17、20 淋巴結引流區。T4b 需包括瘤牀。
PTV:根據實際擺位誤差決定,一般在CTV的基礎上外擴0.5cm形成,頭頸肩網罩固定的頸段或上段食管癌可外擴0.3cm。
PGTV(有腫瘤或淋巴結殘存需序貫或同步加量時):GTV+GTVnd 外擴 0.5cm。
4.3.2.2 2. 處方劑量指南
4.3.2.2.1 (1)術前新輔助放療/同步放化療:
95%PTV40~50Gy/1.8~2.0Gy,每日 1 次,每週 5 次。有條件的單位也可採用同步加量技術。
4.3.2.2.2 (2)術後輔助放療/同步放化療:
R0 術後:95%PTV 50~54Gy/1.8~2.0Gy,每日1 次,每週5次。R1/2 術 後 : 95%PTV 50Gy/1.8~2.0Gy ,序貫95%PGTV10Gy/1.8~2.0Gy,每日 1 次,每週5 次。有條件的單位也可採用同步加量技術。
4.3.2.2.3 (3)根治性放療/同步放化療:
①95%PTV60Gy/1.8~2.0Gy,每日 1 次,每週 5 次。
② 95%PTV 50Gy/1.8~2.0Gy,序貫95%PGTV10Gy/1.8~2.0Gy,每日 1 次,每週5 次。有條件的單位也可採用同步加量技術。
注:根治性同步放化療中放療劑量可酌情降至50~54Gy,目前國內單位多數採用 60Gy。
4.3.2.3 3. 正常組織劑量
對於術後或術前放療的患者,建議先按足量處方劑量(如95%PTV 60Gy)進行正常組織評估,再按實際處方劑量執行,同時確定正常組織的實際受量。
(1)雙肺:平均劑量<14Gy~16Gy,V20≤28%,V30≤20%;同步放化療者 V20≤25%;已行免疫藥物治療的患者肺受量儘量低。
(2)心臟:V30<40%,V40<30%
(4)胃:V40<40%,Dmax<55~60Gy
(5)小腸:V40<40%,Dmax<55Gy
(6)雙腎:V20<30%
(7)肝:V30<30%
4.3.2.4 4. 同步化療方案
4.3.2.4.1 (1)紫杉醇+鉑類:
紫杉醇 45~60mg/m2,靜脈滴注,第1 天。順鉑 20~25mg/m2,靜脈滴注,第1 天[或卡鉑濃度-時間曲線下面積(area under the concentration-time curve,AUC)=2,靜脈滴注,第1 天)。
每週重複
4.3.2.4.2 (2)順鉑+氟尿嘧啶或卡培他濱或替吉奧:
由於卡培他濱或替吉奧療效與氟尿嘧啶相似或更優,副作用較輕,並且口服方便,可代替氟尿嘧啶。
卡培他濱 800mg/m2,靜脈滴注,每日2 次,第1~5天;或替吉奧 40~60mg/m2,口服,每日 2 次,第1~5 天。每週重複
4.3.2.4.3 (3)紫杉醇+氟尿嘧啶或卡培他濱或替吉奧:
紫杉醇 45~60mg/m2,靜脈滴注,第1 天。卡培他濱 625~825mg/m2,靜脈滴注,每日2 次,第1~5天;或替吉奧 40~60mg/m2,口服,每日 2 次,第1~5 天。每週重複
4.3.2.4.4 (4)奧沙利鉑+氟尿嘧啶或卡培他濱或替吉奧(推薦腺癌):
奧沙利鉑 85mg/m2,靜脈滴注,第1、15、29 天。卡培他濱 625mg/m2,靜脈滴注,每日2 次,第1~5天;或替吉奧 40~60mg/m2,口服,每日 2 次,第1~5 天。每週重複療效評估詳見附錄 F。
4.3.2.5 5. 放療後評估及隨訪指南
(1)術前新輔助放療後評估:推薦於術前新輔助放療結束1個月後評估療效,複查項目包括增強CT(包含頸部、胸部及腹部區域)及血常規、生化等實驗室檢查。上消化道造影、全身PET-CT、骨掃描、顱腦 MRI 可根據病情選擇;爲準確臨牀再分期需要,酌情可考慮行食管內鏡重複活檢、纖維支氣管鏡檢及EBUS 引導下經支氣管鏡針吸活檢術(endobronchial ultrasoundguidedtransbronchial needleaspiration,EBUS-TBNA)或 EUS-FNA 區域腫大淋巴結再次活檢等有創性檢查。建議在放療結束後 4~8 周實施食管癌根治術。
(2)術後輔助放療後隨訪:推薦於術後輔助放療結束後3個月開始隨訪,推薦頻次爲初始 2 年內3 個月複查1 次,2~5年每半年複查 1 次,5 年以後每年複查 1 次。包括增強CT(包含頸部、胸部及腹部區域)及血常規、生化等實驗室檢查。上消化道造影、全身PET-CT、骨掃描、顱腦 MRI 可根據病情選擇;隨訪期間若發現吻合口、區域淋巴結或遠隔臟器可疑轉移竈,酌情可考慮行上消化道內鏡檢查、纖維支氣管鏡檢及 EBUS-TBNA 或EUS-FNA區域腫大淋巴結有創性檢查。
(3)根治性放化療後隨訪:推薦於根治性放化療結束後1~2個月開始,隨訪,推薦頻次爲初始 2 年內3 個月複查1 次,2~5年每半年複查 1 次,5 年以後每年複查 1 次。包括增強CT(包含頸部、胸部及腹部區域)及血常規、生化等實驗室檢查。上消化道造影、全身PET-CT、骨掃描、顱腦 MRI 可根據病情選擇;隨訪期間若發現吻合口、區域淋巴結或遠隔臟器可疑轉移竈,酌情可考慮行上消化道內鏡檢查、纖維支氣管鏡檢及 EBUS-TBNA 或EUS-FNA區域腫大淋巴結有創性檢查。
4.3.3 (三)系統性藥物治療。
早期食管癌的臨牀症狀不明顯,難於發現;大多數食管癌患者在確診時已爲局部晚期或存在遠處轉移。因此,以控制播散爲目的的系統性藥物治療在食管癌的治療中佔有重要的地位。近年來,隨着分子靶向治療、免疫治療新藥的出現和發展,藥物治療在食管癌綜合治療中的作用前景廣闊。
目前,藥物治療在食管癌中主要應用領域包括針對局部晚期患者的新輔助治療和輔助治療,以及針對晚期患者的化療、分子靶向治療和免疫治療。
4.3.3.1 1.新輔助治療:
新輔助化療有利於腫瘤降期、消滅全身微小轉移竈,並觀察腫瘤對該化療方案的反應程度,指導術後化療。對於食管鱗癌,可手術切除的局部晚期患者可考慮行新輔助化療,包括cTis~2 N1~3 M0 或 cT3~4a Nany M0 期頸、胸段食管癌。可手術切除的局部晚期食管下段及食管胃交界部腺癌推薦圍手術期化療或新輔助化療,包括 cTis~2 N1~3 M0 或 cT3~4aNany M0 期或可疑cT4b期食管胃交界部腺癌。
4.3.3.2 2.術後輔助治療:
食管鱗癌根治性術後是否常規進行輔助化療仍存在爭議,對於存在高危因素(T4a 及N1~3 期)的患者可考慮行輔助化療或放化療。食管下段及食管胃交界部腺癌術後輔助化療的證據來自於圍手術期化療的相關研究,對於術前行新輔助化療並完成根治性手術的患者,術後可沿用原方案行輔助化療。對於術前接受過新輔助放化療的食管癌和食管胃交界部癌(包括鱗癌和腺癌)患者,在根治術後如未達到病理完全緩解,接受納武利尤單抗治療 1 年可顯著延長無病生存。目前,國家藥品監督管理局尚未批准納武利尤單抗用於食管或食管胃交界部癌輔助治療的適應證,待獲批後可作爲推薦的治療策略。輔助治療一般在術後4周以後開始。
4.3.3.3 3.復發/轉移性食管癌的藥物治療:
對初診晚期轉移性食管癌患者,如能耐受,可行系統性藥物治療。轉移性食管癌經全身治療後出現疾病進展,可更換方案治療。對根治性治療後出現局部復發或遠處轉移的患者,如能耐受,可行系統性藥物治療。
4.3.3.3.1 (1)一線治療:
目前,免疫檢查點抑制劑聯合化療已經成爲晚期食管癌一線治療的標準。對於晚期食管癌和食管胃交界部癌(包括鱗癌和腺癌)的患者,一線治療可在順鉑+氟尿嘧啶化療方案的基礎上聯合帕博利珠單抗;對於晚期食管胃交界部腺癌患者,一線治療可在奧沙利鉑+氟尿嘧啶類藥物的基礎上聯合納武利尤單抗;對於晚期食管鱗癌患者,一線治療可在紫杉醇+順鉑化療的基礎上聯合卡瑞利珠單抗。對於不適合接受免疫檢查點抑制劑治療的患者,可考慮行單純化療。晚期食管鱗癌的常用化療方案包括順鉑聯合氟尿嘧啶、紫杉醇聯合鉑類藥物等。晚期食管胃交界部腺癌的常用化療方案爲順鉑或奧沙利鉑聯合氟尿嘧啶類藥物;對於體力狀況良好的患者,一線治療也可以考慮紫杉類藥物聯合鉑類以及氟尿嘧啶類藥物的三藥聯合方案。對於 HER-2 陽性的晚期食管胃交界部腺癌患者,一線治療可在順鉑+氟尿嘧啶類藥物的基礎上聯合曲妥珠單抗。
4.3.3.3.2 (2)二線及以後治療:
免疫檢查點抑制劑已成爲化療失敗的晚期食管癌患者的重要治療選擇。對於一線化療失敗的晚期食管鱗癌患者,可選擇卡瑞利珠單抗或替雷利珠單抗作爲二線治療藥物。目前,國家藥品監督管理局尚未批准替雷利珠單抗用於晚期食管或食管胃交界部癌二線治療的適應證,待獲批後可作爲推薦的治療策略。對於一線化療失敗的PD-L1CPS≥10 的食管鱗癌患者,二線治療可選擇帕博利珠單抗單藥;對於至少二線化療失敗的食管胃交界部腺癌患者,三線及以後的治療可以選擇納武利尤單抗。
晚期食管胃交界部腺癌患者二線治療的選擇包括紫杉醇單藥,或伊立替康單藥,或多西他賽單藥化療。晚期食管鱗癌的二線化療無標準方案,如不適合接受免疫檢查點抑制劑治療,臨牀實踐中可參考腺癌的方案進行化療。
在靶向治療方面,對於 HER-2 陽性的晚期食管胃交界部癌,三線及以後的治療可選擇維迪西妥單抗。抗血管生成的靶向藥物也可以作爲治療選擇:晚期食管胃交界部癌的三線及以後治療可選擇阿帕替尼;晚期食管鱗癌二線及以後治療可選擇安羅替尼或阿帕替尼。
4.3.3.4 4. 系統性藥物治療前相關檢查評估
4.3.3.4.1 (1)評估腫瘤情況:
通過病理和細胞學明確病理類型,通過病史、體格檢查、影像學檢查明確疾病的範圍、發展趨向,以確定治療目標。治療前應行影像學評估,視具體情況留作基線資料,方便治療後對比療效或長期隨訪。
4.3.3.4.2 (2)評估患者身體條件:
患者應當一般狀況良好,ECOGPS評分 0~1 分。詳見附錄 G。
治療開始前 1 周內行血常規、肝腎功能、心電圖等檢查。心、肝、腎和造血功能無明顯異常。血常規中性粒細胞絕對值≥1.5×109/L、血小板≥80×109/L、HGB≥80g/L 可考慮治療。
4.3.3.4.3 (3)評估合併疾病情況:
患者應無活動性消化道穿孔出血、胃腸梗阻、肺栓塞、休克等嚴重併發症。若合併非腫瘤性發熱,體溫應<38℃。
如患者合併心、肺或其他慢性內科疾病,可根據病情進行相關檢查,如:心肌酶譜、腦鈉肽、24 小時動態心電圖、超聲心動圖、肺功能檢查等。
4.3.3.5 5. 常用系統性藥物治療方案
4.3.3.5.1 (1)術前新輔助治療:
1)氟尿嘧啶+亞葉酸+奧沙利鉑+多西他賽(FLOT)(推薦腺癌):奧沙利鉑 85mg/m2靜脈滴注、第1天,多西他賽50mg/m2靜脈滴注、第 1 天,亞葉酸 200mg/m2 靜脈滴注、第1 天,5-氟尿嘧啶2600mg/m2 持續靜脈滴注 24 小時、第1天,每2 周重複,術前、術後各 4 個週期。
①方案一:5-氟尿嘧啶 800mg/m2持續靜脈滴注24 小時、第1~5天,順鉑 100mg/m2靜脈滴注、第 1 天,每4 周重複,術前2~3個週期,術後 3~4 個週期(推薦腺癌)。②方案二:5-氟尿嘧啶 1000mg/m2持續靜脈滴注24 小時、第1~4 天,順鉑 80mg/m2靜脈滴注、第1 天,每3 周重複,術前2個週期。③方案三:5-氟尿嘧啶 800mg/m2持續靜脈滴注24 小時、第1~5天,順鉑 80mg/m2 靜脈滴注、第 1 天,每3 周重複,術前2個週期(推薦鱗癌)。
3)紫杉醇+順鉑(TP)(推薦鱗癌):①方案一:紫杉醇 150mg/m2 靜脈滴注、第1 天,順鉑50mg/m2靜脈滴注、第 1 天,每 2 周重複。
②方案二:紫杉醇 135mg/m2 靜脈滴注、第1 天,順鉑70mg/m2靜脈滴注、第 1 天,每 3 周重複。4)多西他賽+順鉑+氟尿嘧啶(DCF)(推薦鱗癌):多西他賽70mg/m²靜脈滴注、第 1 天,順鉑70mg/m²靜脈滴注、第1天,5-氟尿嘧啶 750 mg/m²靜脈滴注、第 1~5 天,每3 周重複。
4.3.3.5.2 (2)術後輔助治療:
1)納武利尤單抗:納武利尤單抗240mg 靜脈滴注、第1天,每2 周重複,治療 16 周;然後,納武利尤單抗480mg 靜脈滴注、第1天,每 4 周重複。總治療時長不超過1 年。(注:目前,國家藥品監督管理局尚未批准納武利尤單抗用於食管或食管胃交界部癌輔助治療的適應證,待獲批後可作爲推薦的治療策略。)
2)紫杉醇+順鉑(TP)(推薦鱗癌):紫杉醇150mg/m2靜脈滴注、第 1 天,順鉑 50mg/m2靜脈滴注、第1 天,每2 周重複。
4.3.3.5.3 (3)晚期一線治療:
1)氟尿嘧啶+順鉑(PF):5-氟尿嘧啶750~1000mg/m2持續靜脈滴注 24 小時、第 1~4 天,順鉑 70~100mg/m2靜脈滴注4小時、第1天,每 3~4 周重複。
①方案一:紫杉醇 135~175 mg/m²靜脈滴注3 小時、第1天,順鉑 75 mg/m²靜脈滴注、第 1 天,每3 周重複。
②方案二:紫杉醇 90~150 mg/m² 靜脈滴注3 小時、第1天,順鉑50 mg/m²靜脈滴注、第 1 天,每 2 周重複。
③方案三:白蛋白結合型紫杉醇125 mg/m²靜脈滴注、第1、8天,順鉑 75 mg/m²靜脈滴注、第 1 天,每3 周重複。
3)奧沙利鉑+亞葉酸鈣+氟尿嘧啶(FLO)(推薦腺癌):奧沙利鉑 85 mg/m²靜脈滴注 2 小時、第1 天,亞葉酸鈣200mg/m²靜脈滴注 2 小時、第 1 天,之後用 5-氟尿嘧啶2600 mg/m²持續靜脈滴注24小時、第 1 天,每 2 周重複。
4)多西他賽+順鉑+氟尿嘧啶(改良的DCF 方案)(推薦腺癌):多西他賽 40 mg/m²靜脈滴注 1 小時、第1 天,順鉑40mg/m²靜脈滴注1~3 小時、第 3 天,5-氟尿嘧啶 2000 mg/m²持續靜脈滴注48小時、第1 天,每 2 周重複。
5)伊立替康+氟尿嘧啶/亞葉酸鈣(推薦腺癌):伊立替康180mg/m²靜脈滴注 30 分鐘、第 1 天,亞葉酸鈣400mg/m² 靜脈滴注、第1 天,5-氟尿嘧啶 400 mg/m² 靜脈推注、第1 天,5-氟尿嘧啶1200mg/m² 持續靜脈滴注 24 小時、第 1~2 天,每2 周重複。
6)帕博利珠單抗+氟尿嘧啶+順鉑:帕博利珠單抗200mg靜脈滴注、第 1 天,5-氟尿嘧啶 800mg/m2 靜脈滴注、第1~5天,順鉑80mg/m2靜脈滴注、第 1 天,每 3 周重複。
①方案一:納武利尤單抗 360 mg 靜脈滴注、第1 天,卡培他濱1000 mg/m2口服、每日 2 次、第 1~14 天,奧沙利鉑130mg/m2靜脈滴注、第 1 天,每 3 周重複。
②方案二:納武利尤單抗 240 mg 靜脈滴注、第1 天,奧沙利鉑85 mg/m2靜脈滴注、第 1 天,亞葉酸400mg/m2靜脈滴注、第1天,5-氟尿嘧啶 400mg/m2靜脈滴注、第1 天,5-氟尿嘧啶1200mg/m2持續靜脈滴注 24 小時、第 1~2 天,每2 周重複。
8)卡瑞利珠單抗+紫杉醇+順鉑(推薦鱗癌):卡瑞利珠單抗200mg 靜脈滴注、第 1 天,紫杉醇175mg/m2靜脈滴注、第1天,順鉑 75mg/m2靜脈滴注、第 1 天,每3 周重複。
4.3.3.5.4 (4)晚期二線及後線治療:
1)卡瑞利珠單抗單藥:卡瑞利珠單抗200mg 靜脈滴注、第1天,每 2 周重複。
2)帕博利珠單抗單藥:帕博利珠單抗200mg 靜脈滴注、第1天,每 3 周重複。
3)納武利尤單抗單藥:納武利尤單抗3mg/kg 靜脈滴注、第1天,每 2 周重複。(注:目前,國家藥品監督管理局僅批准納武利尤單抗用於晚期或複發性食管胃交界部腺癌及胃癌的三線治療,尚未批其用於晚期食管鱗癌二線及後線治療的適應證。)
4)替雷利珠單抗單藥:替雷利珠單抗200mg 靜脈滴注、第1天,每 3 周重複。(注:目前,國家藥品監督管理局尚未批准替雷利珠單抗用於晚期食管或食管胃交界部癌二線治療的適應證,待獲批後可作爲推薦的治療策略。)
5)紫杉類單藥:
①方案一:紫杉醇 175mg/m2靜脈滴注、第1 天,每3周重複。②方案二:白蛋白結合型紫杉醇100~150mg/m2靜脈滴注、第1、8 天,每 3 周重複。
③方案三:多西他賽 75~100mg/m2靜脈滴注、第1 天,每3周重複。
6)伊立替康單藥:伊立替康 150~180mg/m2靜脈滴注、第1天,每 2 周重複。
7)伊立替康聯合替吉奧:伊立替康160mg/m2靜脈滴注、第1天,替吉奧 40~60mg 口服、每日 2 次、第1~10 天,每2 周重複。
8)阿帕替尼(推薦腺癌):阿帕替尼250~500mg 口服,連續服用。
4.3.3.6 6. 治療相關不良反應的防治
治療期間應根據治療方案的不良反應特點,定期進行實驗室檢查,必要時應給予相應的對症支持治療。骨髓抑制、胃腸道反應、肝腎功能損害是化療相對常見的不良反應。免疫治療和靶向治療藥物的毒性譜與化療有所不同,治療過程中應予以關注。
(1)骨髓抑制:建議患者於化療後每週複查1~2 次血常規。根據具體化療方案及患者血常規變化的特點,複查時間間隔可酌情增減。若出現 3、4 度白細胞或中性粒細胞降低應停藥,對症給予粒細胞集落刺激因子、粒細胞巨噬細胞集落刺激因子治療,並視具體情況延遲或減量下一週期化療。當血小板<50×109/L 時應給予白介素11或重組人血小板生成素等藥物治療,酌情使用止血藥物。根據患者的血常規結果和化療方案的特點,也可預防性使用上述升白細胞及升血小板藥物。
(2)胃腸道反應:化療相關噁心嘔吐:可發生於化療後數小時或數天。可單獨或聯合應用 5-羥色胺3 受體拮抗劑類、糖皮質激素及神經激肽-1 受體拮抗劑等藥物。甲氧氯普胺與苯海拉明連用,可提高鎮吐作用且可控制錐體外系反應。應注意對症糾正嚴重嘔吐造成水電解質紊亂。
食慾下降:尤其是術後患者,手術改變造成消化系統異常,故化療時更要注意營養支持。可以口服營養製劑和增強食慾的藥物,如甲地孕酮等。或者放置胃或空腸營養管並通過營養管進行營養支持,必要時應靜脈營養支持。
腹瀉:應注意避免進食寒涼和粗纖維豐富的食物,及時服用止瀉藥。腹瀉超過每日 5 次或出現血性腹瀉應停止化療,並注意足量補液及糾正水電解質紊亂。
(3)肝腎功能損害:化療前應瞭解患者有無肝炎病史。建議每化療週期複查 1 次肝腎功能。一旦出現肝功能損害,應當全面評估肝功能,並予以保肝藥物治療。腎功能不全者禁用有腎毒性的藥物,在使用腎毒性藥物,如順鉑時,應注意足量水化,且需要注意藥物間的相互作用。
(4)神經系統毒性:應用奧沙利鉑等藥物前,須告知患者避免接觸寒冷物品,並給予營養神經藥物。嚴重神經毒性應停藥。
(5)過敏反應:使用糖皮質激素、H2受體拮抗劑、苯海拉明預處理可降低過敏反應發生的概率。使用易引起過敏的化療藥時,應在給藥後 2 小時內密切觀察患者的反應,一旦發生過敏,應立即停藥,並予以腎上腺素、糖皮質激素、吸氧、升壓藥等搶救。
(6)免疫相關不良反應:免疫檢查點抑制劑可能引發免疫相關不良反應。對於存在自身免疫性疾病病史的患者,在治療決策時需特別謹慎。對於接受免疫檢查點抑制劑單藥或聯合治療的患者,必須密切監測。建議所有接受此類藥物治療的患者在治療期間監測血常規、肝腎功能、心肌酶譜和甲狀腺功能;如患者出現疲勞等非特異性症狀,應考慮檢測促腎上腺皮質激素和皮質醇;如出現呼吸急促、咳痰、發熱、胸痛、咯血等症狀,應考慮進行胸部影像學檢查。如診斷免疫相關不良反應,可根據病情暫停或永久停用免疫檢查點抑制劑,並針對不良反應進行治療。免疫相關性肺炎、心肌炎等嚴重不良反應可能迅速致命,應特別警惕,必要時應快速、積極地使用糖皮質激素等免疫抑制治療。
(7)阿帕替尼的主要不良反應:阿帕替尼的常見不良反應包括蛋白尿、白細胞和中性粒細胞減少、高血壓、手足綜合徵、轉氨酶升高等。在接受阿帕替尼治療過程中,應監測血壓,並定期進行血常規、肝腎功能、尿常規檢查,必要時停藥並予以對症治療。
4.3.3.7 7. 系統性藥物治療後隨訪
(1)對於可手術切除、接受新輔助化療的患者,應及時評估療效。推薦每週期化療前進行病史詢問、體格檢查;2~3 個週期後複查影像學評效。如病史、體格檢查或影像學檢查結果提示疾病進展,應中止化療,並再次評估腫瘤的可切除性;對於可根治性切除的患者,應及時行手術治療。
(2)對於根治性術後接受輔助化療的患者,因無明確觀察指標,推薦在完成既定的化療後行影像學檢查。如病情穩定,並且無自覺症狀,在治療結束後的 2 年內,可每3~6 個月進行隨訪,內容包括病史詢問、體格檢查、複查影像學評估,並且根據臨牀需要複查血常規、血生化、食管內鏡等項目。自第 3 年起,可每6~12 個月進行隨訪,內容同上。自第 6 年起,可每年隨訪1 次,內容同上。
(3)對於轉移性食管癌接受姑息性治療的患者,因中位緩解期短,推薦在完成既定的化療後行影像學檢查。如病情穩定,並且無自覺症狀,可每 2 個月進行隨訪,內容包括病史詢問、體格檢查、複查影像學評估,並且根據臨牀需要複查血常規、血生化、食管內鏡等項目。
4.3.4 (四)內鏡治療。
4.3.4.1 1.早期食管癌內鏡下治療術前評估
對於無淋巴結轉移的早期食管癌推薦行內鏡下食管黏膜切除術。若經病理學評估食管癌浸潤深度爲SM2 或SM3 型,即使臨牀評估無區域淋巴結轉移,也推薦根治性食管外科切除術。因此,術前準確判斷腫瘤浸潤深度、累及範圍及區域淋巴結轉移情況是合理治療決策及預後預測的先決條件。推薦採用色素內鏡及電子染色內鏡評估病變累及範圍;超聲內鏡、鱗狀上皮 IPCL 分型、食管腫瘤內鏡下形態學分型等信息綜合判斷浸潤深度。鑑於目前尚缺乏食管內鏡學評估指南,並且容易受內鏡醫生操作經驗水平影響,故推薦依靠食管黏膜切除術後病理學評估進行臨牀決策。
4.3.4.2 2.早期食管癌內鏡下治療原則
與傳統食管外科手術相比,內鏡下食管黏膜切除術治療食管癌前病變或早期食管癌的手術創傷較小、圍術期併發症風險較低、術後加速康復、醫療經濟學效益較高,長期預後近似於根治性食管切除術。內鏡下食管黏膜切除術即可兼顧臨牀診斷與治療,又可從保留食管臟器角度改善患者生活質量,因此是具有優勢的。推薦部分cTis~1aN0M0 期食管癌患者選擇,包括食管黏膜重度異型增生、侵犯層次侷限於食管黏膜上皮層或黏膜固有層的食管癌(M1、M2);累及黏膜肌層(M3)或黏膜下淺層(SM1)但是不伴脈管瘤栓或神經侵犯,不伴食管周圍區域淋巴結腫大者。若病變累及超過3/4 環周管腔,經驗豐富內鏡醫生評估後認爲術後食管瘢痕狹窄風險較高者不推薦內鏡治療。
4.3.4.3 3. 內鏡下食管黏膜切除方式
主要包括內鏡下黏膜切除術(endoscopic mucosal resection,EMR)、多環套扎黏膜切除術(multi-band mucosectomy,MBM)及內鏡黏膜下剝離術(endoscopic submucosal dissection,ESD)。
(1)EMR:EMR 指內鏡下將食管黏膜病竈整塊或分塊切除,用於食管淺表型腫瘤的診斷與治療。方法包括食管黏膜下注射-抬舉-切除法的基礎上逐漸演變出透明帽法(EMR with a cap,EMRC)、套扎法(EMR with ligation,EMRL)、分片黏膜切除術(endoscopypiecemeal mucosal resection,EPMR)等技術。各種EMR技術的基本原理相同,多是先通過黏膜下注射將食管黏膜下層與固有肌層分離,然後利用不同的方法切除局部隆起的食管黏膜病竈。EMRC 是利用內鏡前端安置的透明帽對病變進行吸引,再行圈套切除,對操作技術要求不高,併發症少,但可切除的病變大小受透明帽的限制;EMRL 是先對病變進行套扎,阻斷血流並形成亞蒂後切除,視野清晰,出血較少;EPMR 用於傳統EMR 不能一次完整切除的較大病竈,將病竈分次部分切除,適用於>2cm的巨大平坦病變,但是分次切除的組織標本體外拼接困難,難以評估根治效果,易導致病變局部殘留或復發。
(2)MBM:MBM 是在食管曲張靜脈套扎器的基礎上改良而來的多塊黏膜切除技術,主要包括標記、圈套切除、處理創面等步驟。與 EMR 相比,MBM 不需要行黏膜下注射,可顯著縮短操作時間。同時,在保證相同治療效果的前提下MBM較EMR具有操作簡單、成本低、治療時間短、安全高效的優點,便於在基層推廣,應注意規範化操作,避免病變殘留。
(3)ESD:ESD 是對不同部位、大小、浸潤深度的病變,在進行黏膜下注射後使用特殊電刀逐漸分離黏膜層與固有肌層之間的組織,將病變黏膜及黏膜下層完整剝離的方法。操作大致分爲5步:
①病竈周圍標記;
②黏膜下注射,使病竈充分抬舉;
③部分或環周切開黏膜;
④黏膜下剝離,使黏膜與固有肌層完全分離開,一次完整切除病竈;
經典ESD技術改進後的隧道式黏膜剝離技術(標記-注射-遠端開口-近端切開-建立隧道-兩邊切開)也可用於累及範圍較大的食管黏膜病變。
4.3.4.4 4. 內鏡治療常見併發症及處理
雖然內鏡下切除屬於微創治療,但是受內鏡醫師經驗水平、設備器械精密度、食管黏膜疾病及患者全身合併症等諸多因素影響,可能術後併發食管黏膜出血、穿孔、狹窄、感染等風險。
4.3.4.4.1 (1)出血:
包括術中出血指術中需要止血治療(如電凝或止血夾止血)的局部創面出血;術後遲發性出血指操作術後30天內出現嘔血、黑便等徵象,血紅蛋白下降20g/L 以上。EMR出血風險與食管黏膜病變範圍呈正相關,病竈直徑超過2cm者術中及術後出血風險顯著升高,混合電流切除者易發生術中出血,凝固電流切除者易發生延遲性出血。ESD 出血可能與病變部位、大小及類型、剝離層次、病變的黏連程度、血管分佈、操作者的熟練程度等相關。
4.3.4.4.2 (2)穿孔:
ESD 術中穿孔風險較EMR 更高,通常可在術中發現。若患者 ESD 術後突發前胸及頸面部皮下氣腫,胸部平片或CT發現縱隔氣體或查體見穿孔徵象等,應考慮術後穿孔。ESD穿孔與操作者經驗、病變部位及大小、病變處有無潰瘍形成等相關。操作過程中使用 CO2 氣體及預防性夾閉肌層破損處可降低穿孔發生率,而創面處肌層暴露則會增加穿孔風險。消化道內積聚大量氣體,容易使小的肌層裂傷形成穿孔,因此,操作過程中應及時抽吸消化道內的氣體。嚴格掌握內鏡切除適應證、充分的黏膜下注射及選用合適的器械也有利於預防穿孔發生。
4.3.4.4.3 (3)食管狹窄:
指內鏡下食管黏膜切除術後需要內鏡下治療的食管管腔狹窄,常伴有不同程度的吞嚥困難,多見於術後1個月左右。食管黏膜病變範圍、浸潤深度、切除創面的環周比例與縱向長度是術後食管狹窄的常見危險因素。大於3/4 環周的食管黏膜病變經內鏡切除治療的術後狹窄發生率可達 88%~100%。
4.3.4.5 5. 內鏡下非黏膜切除治療
4.3.4.5.1 (1)射頻消融術:
利用電磁波生物物理中的熱效應發揮治療作用,使腫瘤組織脫水、乾燥和凝固壞死,從而達到治療目的。因其有效治療深度僅限於 1000μm 範圍,因此術後食管穿孔或狹窄風險較低,可用於治療不耐受外科切除或拒絕手術的多原發、單病竈範圍較大(累及全周管腔)的食管癌前病變或早期食管癌。
4.3.4.5.2 (2)光動力療法、氬離子凝固術、激光療法、熱探頭治療及冷凍療法:
這些內鏡下非切除技術既可單獨使用,也可與內鏡切除術聯合應用。光動力療法是利用特定激光激發選擇性聚集於腫瘤組織的光敏劑產生單態氧,通過物理、化學和免疫等複雜機制導致腫瘤壞死的療法,可用於處理大面積早期多竈病變,應注意光敏反應、術後穿孔狹窄等併發症風險。氬離子凝固術是一種非接觸性熱凝固方法,可有效處理食管癌前病變,然而應用於早期食管癌則需嚴格掌握適應證。非切除治療方法致腫瘤毀損,但是無法獲得組織標本進行病理學評估,也無法判別治療根治性狀態,因此術後仍需要嚴密隨診,長期預後尚待明確,目前存在食管黏膜切除或消融禁忌證的患者可考慮選擇。
4.3.4.6 6. 內鏡治療後隨訪指南
食管癌前病變及早期食管癌經內鏡下食管黏膜切除術後3個月、6 個月與 12 個月各需複查內鏡評估1 次,若無復發則以後每年複查內鏡 1 次。食管黏膜輕度異型增生患者推薦術後每3 年隨訪1次,中度異型增生患者推薦術後 1 年隨訪 1 次。內鏡隨訪時應結合染色和/或放大內鏡檢查,發現陽性或可疑病竈行選擇性活檢及病理診斷。食管黏膜病變經內鏡下黏膜切除術後應仔細檢查創面,必要時使用染色或窄光譜方法進行評估,發現病變殘留時應及時行再次食管內鏡治療,有利於降低複發率。局部殘留或復發的食管黏膜病變多可通過內鏡下治療清除,內鏡下治療失敗者可追加手術或放化療。此外,食管癌診療相關影像學評估方法亦不可忽視,應警惕異時多原發食管鱗癌或第二原發癌(如頭頸部鱗癌、胃癌等)。
4.3.5 (五)病理學評估指南。
4.3.5.1 1.標本類型及固定指南
4.3.5.1.1 (1)標本類型:
常見標本類型包括內鏡活檢標本、EMR/ESD和根治切除術標本。
4.3.5.1.2 (2)標本固定:
應及時、充分固定,採用10%中性緩衝福爾馬林固定液(含 4%甲醛),應立即固定(手術切除標本也儘可能半小時內),固定液應超過標本體積的10 倍以上,固定時間6~72小時。
內鏡活檢標本:標本離體後,應由內鏡醫師或助手用小撥針將活檢鉗上的組織立即取下,並應在手指上用小撥針將其展平,取小塊濾紙,將展平的黏膜平貼在濾紙上,立即放入固定液中固定。
EMR/ESD 標本:應由內鏡醫師展平標本,黏膜面向上,使用不生鏽的細鋼針固定於軟木板(或泡沫板)上,避免過度牽拉導致標本變形,亦不應使標本皺褶,標記口側及肛側方向,立即完全浸入固定液中。
根治切除術標本:沿腫瘤對側打開食管壁。黏膜面向上,使用大頭針固定於軟木板(或泡沫板)上,板上應墊紗布,釘好後黏膜面向下,儘快(離體 30 分鐘內)完全浸入固定液中。
4.3.5.2 2.取材及大體描述指南
4.3.5.2.1 (1)查對:
取材時,應覈對基本信息,如姓名、送檢科室、牀位號、住院號、標本類型等。
4.3.5.2.2 (2)活檢標本:
1)大體檢查及記錄:描述送檢組織的大小及數目。2)取材:送檢黏膜全部取材,應將黏膜包於濾紙中以免丟失,取材時應滴加伊紅,利於包埋和切片時技術員辨認。大小相差懸殊的要分開放入不同脫水盒,防止小塊活檢組織漏切或過切。包埋時需注意一定要將展平的黏膜立埋(即黏膜垂直於包埋盒底麪包埋)。一個蠟塊中組織片數不宜超過 3 片、平行方向立埋(由於食管癌前病變及早期癌多較平坦,而對食管癌前病變程度及早期癌的判斷要看異型細胞累及鱗狀上皮層次的比例、是否有黏膜固有層浸潤,對組織層次清晰度要求較高。只有做好上述展平和立埋這兩步驟,才能保證切片上活檢組織的層次分明,這對食管早期癌及癌前病變的準確診斷至關重要)。蠟塊邊緣不含組織的白邊儘量用小刀去除,建議每張玻片含6~8 個連續組織片,便於連續觀察。
4.3.5.3 3.EMR/ESD 標本
4.3.5.3.1 (1)大體檢查及記錄:
測量並記錄標本大小(最大徑×最小徑×厚度),食管胃交界部標本要分別測量食管和胃的長度和寬度。記錄黏膜表面的顏色,是否有肉眼可見的明顯病變,病變的輪廓是否規則,有無明顯隆起或凹陷,有無糜爛或潰瘍等,記錄病變的大小(最大徑×最小徑×厚度)、大體分型以及病變距各切緣的距離(至少記錄病變與黏膜側切緣最近距離)。多塊切除的標本宜由手術醫師根據內鏡下病變的輪廓/碘不染色輪廓(食管鱗狀上皮病變)在標本固定前進行重建。複雜標本建議臨牀病理溝通或由手術醫師提供標本延展及重建的示意圖。
4.3.5.3.2 (2)取材:
EMR/ESD 標本應全部取材。宜塗碘(從固定液中取出並至少衝水半小時以上再做碘染色)識別病變(碘不染色區)和最近側切緣。垂直於最近側切緣取材。黏膜側切緣與基底切緣可用墨汁或碳素墨水標記(有條件的可於口側和肛側塗不同顏色以便於辨別),以便在鏡下觀察時能夠對切緣做出定位,並評價腫瘤切緣情況。食管胃交界部標本宜沿口側-肛側的方向取材,以更好的顯示腫瘤與食管胃交界的關係。每間隔 2~3mm 平行切開,全部取材。如果標本太大,可以進行改刀,將一條分爲 n 條,分別標記a、b 等。按同一方向立埋(包埋第一塊和最後一塊的刀切面,如果第一塊和最後一塊鏡下有病變,再翻轉 180°包埋,以確保最終切片觀察黏膜四周切緣情況),並記錄組織塊對應的包埋順序/部位。記錄組織塊對應的部位(建議附照片或示意圖並做好標記)。建議將多塊切除的標本分別編號和取材,不需考慮側切緣的情況,其他同單塊切除標本。
4.3.5.4 4.根治切除術標本指南
4.3.5.4.1 (1)大體檢查及記錄:
取材時記錄切除食管長度,可見或未見食管胃交界部,如果有則記錄胃的長度。腫瘤部位(結合手術及內鏡檢查):頸段、胸上段食管、胸中段食管、胸下段食管、食管胃交界部。記錄腫瘤距口側切緣和肛側切緣及環周切緣的距離。腫瘤大體分型(包括外觀描寫)、大小、切面顏色、質地;浸潤深度;累及/未累及食管胃交界部(腫瘤與食管胃交界部的關係:腫瘤完全位於食管,未累及食管胃交界部;腫瘤中心位於遠端食管,累及食管胃交界部;腫瘤中心位於食管胃交界部;腫瘤中心位於近端胃,累及食管胃交界部)。累及食管胃交界部者,記錄腫瘤中心距食管胃交界部的距離:___cm (用於 Siewert 分型)。食管癌建議報與食管胃交界部的關係;食管胃交界部腺癌建議報 Siewert 分型。
4.3.5.4.2 (2)取材:
必要時塗碘(從固定液中取出並至少衝水半小時以上再做碘染色)識別病變(碘不染色區)。食管取材可自腫瘤中心從口側切緣至肛側切緣取一條組織分塊包埋(包括腫瘤、腫瘤旁黏膜及兩端切緣),並記錄組織塊對應的方位(宜附照片或示意圖並做好標記)。推薦縱向取兩端切緣與腫瘤的關係,對腫瘤距兩端切緣較遠者,也可橫向取兩端切緣。單獨送檢的閉合器切緣應剔除閉合器後全部取材觀察。對腫瘤侵犯最深處及可疑環周切緣受累處應重點取材。推薦使用墨汁或碳素墨水標記環周切緣。對早期食管癌或新輔助治療後病變不明顯的根治術標本,建議將可疑病變區和瘤牀全部取材。對周圍黏膜糜爛、粗糙或碘不染色等改變的區域或周圍食管/胃壁內結節及食管胃交界部組織應分別取材。送檢的分組淋巴結應全部包埋取材。若附縱隔胸膜、肺和膈肌等其他鄰近器官應觀察取材。推薦取材組織大小不大於 2.0cm×1.5cm×0.3cm。標準的二野或三野清掃且未經新輔助治療的根治術標本應檢出 15 枚以上淋巴結。
4.3.5.5 5.病理報告內容及指南
食管癌的病理報告應包括與患者治療和預後相關的所有內容,如標本類型、腫瘤部位、大體分型、大小及數目、組織學類型、亞型及分級、浸潤深度、脈管和神經侵犯、壁內轉移、周圍黏膜情況、淋巴結情況、環周及兩端切緣情況等。推薦報告最後註明(y)pTNM分期。
(1)大體描寫:包括標本類型、腫瘤部位、大體分型、大小(腫瘤大小應量出三維的尺寸)及數目。
(2)主體腫瘤:組織學類型、亞型及分級(見附錄B)、浸潤深度(包括黏膜固有層、黏膜肌層、黏膜下層、淺肌層、深肌層、纖維膜及周圍組織或器官。對於黏膜下層浸潤癌,如爲內鏡下切除標本,應測量黏膜下層浸潤深度(μm),建議區分SM1-黏膜下層侵犯深度<200μm 和 SM2-黏膜下層侵犯深度>200μm;如爲外科根治術標本,建議區分 SM1-黏膜下層上 1/3、SM2-黏膜下層中1/3 和SM3-黏膜下層下 1/3)、切緣(內鏡下切除標本包括側切緣和基底切緣;根治切除標本包括口側、肛側切緣及環周切緣)(切緣的情況要說明,包括:浸潤癌或上皮內瘤變/異型增生或巴雷特食管或巴雷特食管伴上皮內瘤變/異型增生;建議註明距切緣的距離;根治切除標本建議採用0、<0.1cm 及≥0.1cm 註明距環周切緣的距離)、淋巴管/血管浸潤(尤其是對於內鏡下切除標本,如果懷疑有淋巴管/血管浸潤,建議做免疫組化 CD31、D2-40 確定是否有淋巴管/血管浸潤;EVG染色判斷有無靜脈侵犯)、神經侵犯、壁內轉移。
(3)癌旁:上皮內瘤變/異型增生及程度、巴雷特食管,有無食管炎、胃炎及類型。
(4)淋巴結轉移情況:轉移淋巴結數/淋巴結總數。宜報轉移癌侵及淋巴結被膜外的數目。
(5)病理退縮反應(新輔助治療的病例),遵照美國病理學院(College of American Pathologists,CAP)標準,聯合殘存腫瘤細胞比例(可參考 Mandard、Becker、日本食管疾病學會食管腫瘤退縮分級標準),對新輔助治療後標本進行病理學評估(附錄H)。
(6)應報告合併的其他病變。
(7)對擬採用 PD-1 抑制劑治療的食管鱗狀細胞癌患者,推薦癌組織中評估 PD-L1 表達 CPS 評分。PD-L1(Dako22C3)檢測試劑盒已經獲批食管鱗狀細胞癌適應證,作爲帕博利珠單抗治療的伴隨診斷,以 CPS≥10 作爲陽性標準。食管胃交界腺癌應做HER2 免疫組化檢測及錯配修復蛋白(MLH1、PMS2、MSH2、MSH6)免疫組化檢測和/或 MSI 檢測。
(8)備註報告內容包括重要的相關病史(如相關腫瘤史和新輔助治療史)。
(9)(y)pTNM 分期。
4.3.6 (六)分期綜合治療模式。
以下采用的是 UICC/AJCC 分期(第8 版)。
1.0 期/癌前病變:低級別上皮內瘤變建議隨訪,亦可行內鏡下射頻消融治療。高級別上皮內瘤變建議行內鏡下切除(EMR/ESD/MBM等),亦可根據臨牀條件選擇內鏡下射頻消融、冷凍治療等方式,由於病變過長或累及 3/4 環周以上、ESD 術後可能導致頑固性狹窄者也可考慮外科治療。
2.Ⅰ期:T1a 期首選內鏡下黏膜切除或黏膜剝離術。如果由於病變過長或累及 3/4 環周以上、ESD 術後可能導致頑固性狹窄或有可疑淋巴結轉移,建議行外科手術治療。T1b 及以上Ⅰ期首選外科手術治療。如心肺功能差或拒絕手術者,可行內鏡下ESD加術後放化療。完全性切除的Ⅰ期食管癌,術後一般不行輔助治療。
3.Ⅱ期:食管鱗癌:cT2N0M0 期首選手術治療,cT2N1M0及cT3 N0 M0 期推薦新輔助治療聯合手術治療。食管腺癌:cT2N0M0期首選手術治療,cT1 N1 M0 期推薦新輔助治療聯合手術治療。如心肺功能差或拒絕手術者,可行根治性放化療。術前新輔助治療包括同期放化療與化療。
4.Ⅲ期:食管鱗癌或腺癌均推薦新輔助治療聯合手術治療。如心肺功能差或拒絕手術者,可行根治性放化療。對於不能手術的Ⅲ期患者,目前的標準治療是同步放化療。
5.ⅣA 期鱗癌或腺癌:T4a 期推薦新輔助治療聯合手術治療;如心肺功能差或拒絕手術者,也可行根治性放化療。T4b 期推薦根治性放化療,或單純化療(侵犯椎體、氣管、主動脈、心臟等重要臟器)。
6.ⅣB 期:主要以全身系統性治療與姑息治療爲主。一般狀況好者,推薦全身系統性藥物治療,必要時可聯合局部治療;一般狀況不能耐受上述治療者,以姑息和支持治療爲主要手段。治療目的爲延長生命,提高生活質量。姑息治療主要包括內鏡治療(包括食管擴張、食管支架等治療)、止痛對症治療及營養支持治療等。
4.3.7 (七)治療指引圖。
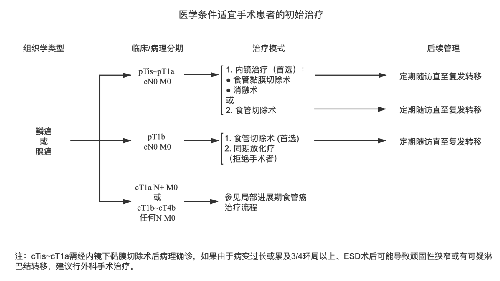


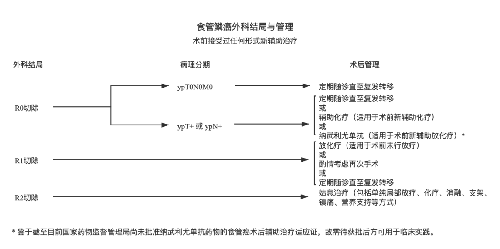
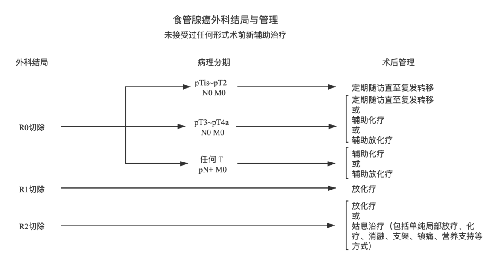
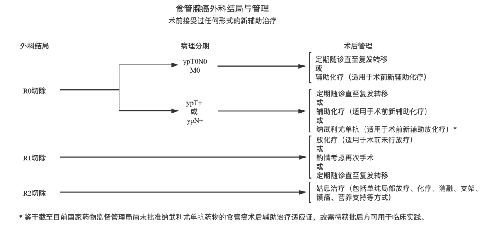
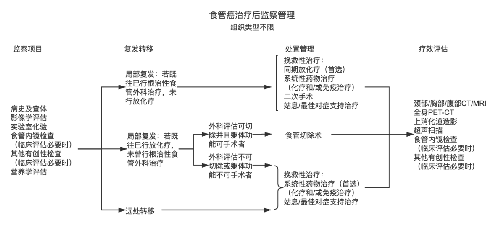
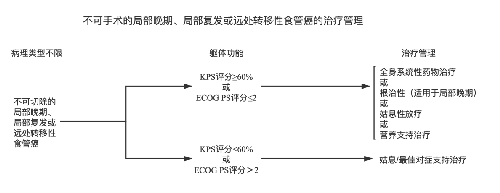
4.3.8 (八)營養支持。
對於有營養風險者,應及時制定營養支持計劃。營養支持是指經腸內或腸外途徑爲不能正常進食的患者提供適宜營養素的方法,包括營養補充、營養支持、營養治療三個部分,有口服營養補充、腸內營養及腸外營養三種方式。規範化的營養支持應包括營養支持的啓動時機、途徑選擇、營養支持目標、營養素選擇及監護計劃等要素。食管癌外科手術涉及上消化道重建、胃酸分泌功能減弱或喪失,對於術後營養支持治療有特殊要求。
4.3.8.1 1. 營養支持的指徵
(2)BMI<18.5kg/m2;
(3)NRS2002≥5 分;
(4)SGA 評定爲C 級。
4.3.8.2 2. 營養支持治療的要求及途徑
大多數有營養風險的食管癌患者通過強化膳食及口服營養補充進行營養支持即可。對 NRS2002 評分≥5 分或存在嚴重營養不良者,如經口途徑不能滿足目標量,可進行腸內營養-管飼、補充性腸外營養甚至全腸外營養,以改善患者治療前營養狀態及治療後機體對應激的適應能力。
在制定腫瘤患者營養支持計劃時,推薦採用間接測熱法對腫瘤患者的能量消耗進行個體化測量以指導能量供給,使能量攝入量儘可能接近機體能量消耗值,以保持能量平衡,避免攝入過量或不足。若無法直接測量實際能量消耗值以指導營養供給,可採用體重公式計算法估算能量目標需要量,按照 25~30kcal/(kg·d)提供。推薦蛋白質補給量應>1.2 g/(kg·d),患者腎功能正常前提下可提高至2.0g/(kg·d)。
目前沒有足夠的證據顯示何種手術方式在改善營養狀態及營養管理方面的優勢,手術方式的影響取決於術者的臨牀經驗。術後營養支持治療首選經胃腸道途徑,可管飼和/或經口方式。對於術中留置營養管路的患者,術後 24 小時內即可開始腸內營養。腸內營養輸注從低速開始,根據患者耐受情況適度遞增至每日目標量。發生術後吻合口瘻者,需根據吻合口瘻嚴重程度、患者一般狀態、營養需求綜合考慮,制訂個體化的營養支持方案。發生術後吻合口瘻,可考慮經任何途經的腸內管飼或聯合腸外營養。
4.3.8.3 3. 出院後家庭營養支持治療
食管癌患者出院後仍需要定期營養風險評估,持續存在嚴重營養不良者推薦營養支持。患者出院後營養支持首選膳食指導聯合口服營養製劑,對於術中留置營養管的患者,出院時可以保留營養管,以備家庭腸內營養之需。家庭營養支持治療需在經驗豐富的營養支持小組(包括醫師、營養師、藥師及護士及等)指導監護下完成並且持續改進。
4.3.9 (九)姑息治療。
姑息治療,也稱最佳對症支持治療,是指以改善症狀與生活質量爲導向的多維度綜合管理,尤其需要多學科協作共同制定治療方案。
4.3.9.1 1. 進食困難
進食困難症狀常源於上消化道不全梗阻,或者食管癌疾病本身導致的消化道動力障礙。目前國內尚缺乏標準化吞嚥症狀評估量表以指導臨牀。可考慮經鼻或胃/空腸造口置管進行暫時性管飼營養支持,若將來無根治性食管癌治療計劃,則經多學科討論後也可考慮行食管支架置入。
4.3.9.2 2. 完全梗阻
上消化道完全梗阻患者的姑息治療旨在維持患者每日營養攝入,基於創建上消化道旁路的胃/空腸造口置管作爲首選方法,經驗豐富的內鏡中心可考慮食管內鏡下球囊擴張,消融治療後帶膜支架置入,或聯合放化療。
4.3.9.3 3. 上消化道出血
一旦發生嘔血、黑便等上消化道出血症狀,則提示食管癌疾病已瀕臨終末期,原發性腫瘤破潰或繼發性食管-主動脈瘻發生。可根據醫療條件及患者病情,酌情考慮選擇內鏡、介入、外科治療等干預措施。嚴密監測血紅蛋白水平,止血及抑酸性藥物干預,預防重度貧血、失血性休克發生。
4.4 附錄 A 早期/表淺食管癌推薦巴黎分型(同早期/表淺食管癌日本大體分型,即 0 型):
1.隆起型(0-Ⅰ):又可分爲有蒂隆起型(0-Ⅰp)和無蒂隆起型(0-Ⅰs)。
2.淺表型(0-Ⅱ):又可分爲表淺隆起型(0-Ⅱa)、表淺平坦型(0-Ⅱb)和表淺凹陷型(0-Ⅱc),同時具有表淺隆起和表淺凹陷的病竈根據表淺隆起/表淺凹陷的比例分爲表淺凹陷+表淺隆起型(0-Ⅱc+Ⅱa 型)和表淺隆起+表淺凹陷型(0-Ⅱa+Ⅱc 型)。
3.凹陷(潰瘍)型(0-Ⅲ):凹陷和表淺凹陷結合的病竈根據凹陷/表淺凹陷的比例分爲表淺凹陷+凹陷型(0-Ⅱc+Ⅲ型)和凹陷+表淺凹陷型(0-Ⅲ+Ⅱc 型)。
4.5 附錄 B 食管癌 WHO 組織學類型(參照 2019 版消化系統腫瘤WHO分類)
4.6 附錄 C 食管癌 TNM 分期(2017 年第8 版UICC/AJCC)
食管癌分期中 T、N、M 的定義
4.6.1.1 原發腫瘤(T)
TX 原發腫瘤不能評價
T0 沒有原發腫瘤的證據
Tis 高級別上皮內瘤變/異型增生
T1 腫瘤侵及黏膜固有層、黏膜肌層或黏膜下層
T1a 腫瘤侵及黏膜固有層或黏膜肌層
T1b 腫瘤侵及黏膜下層
T2 腫瘤侵及固有肌層
4.6.1.2 區域淋巴結(N)
NX 區域淋巴結不能評價
4.6.1.3 遠處轉移(M)
M0 無遠處轉移
M1 有遠處轉移
4.6.2 臨牀分期(cTNM)預後分組:
| 臨牀分期 | c T N M |
| 鱗癌 | |
| 0 | TisN0 M0 |
| Ⅰ | T1 N0~1 M0 |
| Ⅱ | T2 N0~1 M0 T3 N0 M0 |
| Ⅲ | T3 N1 M0 T1~3 N2 M0 |
| ⅣA | T4 N0~2 M 任何 T N3 M00 |
| ⅣB | 任何 T 任何N M1 |
| 腺癌 | |
| 0 | TisN0 M0 |
| Ⅰ | T1 N0 M0 |
| ⅡA | T1 N1 M0 |
| ⅡB | T2 N0 M0 |
| Ⅲ | T2 N1 M0 T3~4a N0~1 M0 |
| ⅣA | T1~4a N2 M0 T4b N0~2 M0 任何 T N3 M0 |
| ⅣB | 任何 T 任何N M1 |
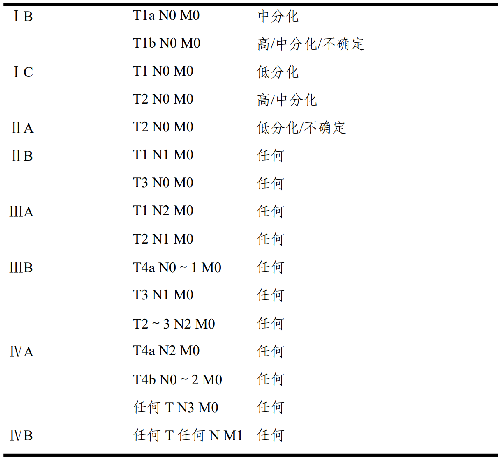
4.6.3 病理分期(pTNM)預後分組:
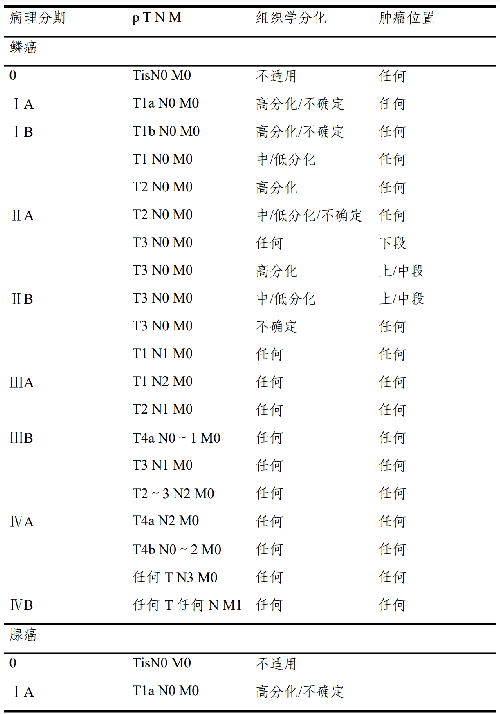
註釋:
1.要達到準確分期,區域淋巴結的數目應該≥15 個。
2.腫瘤部位按照腫瘤中心的位置分段(分上、中、下段,上段=頸段+胸上段,中段=胸中段;下段=胸下段+腹段)。
3.若腫瘤累及食管胃交界部,腫瘤中心在食管胃交界部食管側者或在胃側 2cm 之內者(Siewert I 型及 II 型),按食管癌分期;腫瘤中心在近端胃 2cm 之外(Siewert III 型)按胃癌分期。腫瘤中心雖在近端胃 2cm 之內但未累及食管胃交界部者,按胃癌分期。
4.基底細胞樣鱗狀細胞癌、梭形細胞鱗狀細胞癌、小細胞癌、大細胞神經內分泌癌及未分化癌按低分化鱗狀細胞癌分期。混合有鱗狀細胞癌成分的混合型癌(如腺鱗癌)或組織學類型不明確的按鱗狀細胞癌分期。
5.食管的神經內分泌瘤(NET)十分罕見,其分期參照胃腸道神經內分泌瘤的 TNM 分期。
6.本分期不適用於非上皮性腫瘤,如淋巴瘤、肉瘤、胃腸道間質瘤和黑色素瘤等。
7.目前國際上有兩大食管癌 TNM 分期系統。西方主導的UICC/AJCC分期認爲鎖骨上淋巴結轉移屬於 M1,腹腔幹淋巴結仍然屬於區域淋巴結。日本食道學會(JES)則認爲鎖骨上淋巴結仍然是胸段食管癌的區域淋巴結,而腹腔幹淋巴結不是胸上段食管癌的區域淋巴結。
新輔助治療後病理分期(ypTNM)預後分組:
| 新輔助治療後病理分期 | yp T N M |
| Ⅰ | T0~2 N0 M0 |
| Ⅱ | T3 N0 M0 |
| ⅢA | T0~2 N1 M0 |
| ⅢB | T4a N0 M T3 N1~2 M00 T0~3 N2 M0 |
| ⅣA | T4a N1~2,X M0 T4b N0~2 M0 任何 T N3 M0 |
| ⅣB | 任何 T 任何N M1 |
4.7 附錄 D 營養風險篩查 2002
4.7.1 A. 營養狀態受損評分(取最高分)
| 0 分 | 正常營養狀態 |
| 1 分(任一項) | 近3個月體質量下降>5 近1周內進食量減少 25%~50%% |
| 2 分(任一項) | 近2個月體質量下降>5% 近1周內進食量減少 50%~75% |
| 3 分(任一項) | 近1個月體質量下降>5% 近1周內進食量減少>75% 體質量指數<18.5kg/m2 伴有一般情況差 |
B. 疾病嚴重程度評分(營養需求的增加)(取最高分)
| 0 分 | 正常營養需求 |
| 1 分(任一項) | 一般惡性腫瘤、髖部骨折、長期血液透析、糖尿病、慢性疾病(如肝硬化、慢性阻塞性肺病) |
| 2 分(任一項) | 血液惡性腫瘤、重症肺炎、腹部大手術、腦卒中 |
| 3 分(任一項) | 重症頭部損傷、骨髓移植、重症患者APACHEⅡ評分>10 分的 ICU 患者 |
年齡評分
| 1 分 | 年齡≥70 歲 |
總分(A+B+C)
注:APACHE II 爲急性生理學與慢性狀況評分系統II。
4.8 附錄 E 全球(營養)領導人發起的營養不良診斷標準
4.8.1 A. 表現型指標
| 體質量下降 | 過去6個月>5% 或超過6個月>10% |
| 低體質量指數 | <70 歲:<20 kg/m2,<18.5 kg/m2(亞洲人) ≥70 歲:<22 kg/m2,<20 kg/m2(亞洲人) |
| 肌肉量減少 | 通過經驗證的測量方法得到肌肉減少結果 |
B. 病因學指標
4.9 附錄 F 放射治療及化學治療療效判定標準
4.9.1 1.WHO 實體瘤療效評價標準:
完全緩解,腫瘤完全消失超過 1 個月。
部分緩解,腫瘤最大直徑及最大垂直直徑的乘積縮小達50%,其他病變無增大,持續超過 1 個月。
病變穩定,病變兩徑乘積縮小不超過 50%,增大不超過25%,持續超過1個月。病變進展,病變兩徑乘積增大超過 25%。
4.9.2 2.RECIST 療效評價標準:
4.9.2.1 2.1 靶病竈的評價
完全緩解,所有靶病竈消失。
部分緩解,靶病竈最長徑之和與基線狀態比較,至少減少30%。病變進展,靶病竈最長徑之和與治療開始之後所記錄到的最小的靶病竈最長徑之和比較,增加 20%,或者出現一個或多個新病竈。病變穩定,介於部分緩解和疾病進展之間。
4.9.2.2 2.2 非靶病竈的評價
完全緩解,所有非靶病竈消失和腫瘤標誌物恢復正常。未完全緩解/穩定,存在 1 個或多個非靶病竈和/或腫瘤標誌物持續高於正常值。病變進展,出現 1 個或多個新病竈和/或已有的非靶病竈明確進展。
4.9.3 3.最佳總療效的評價
最佳總療效的評價是指從治療開始到疾病進展或復發之間所測量到的最小值。通常,患者最好療效的分類由病竈測量和確認組成。
4.10 附錄 G 患者狀況評分
4.10.1 1. Karnofsky 評分(KPS,百分法)
100 正常,無症狀和體徵,無疾病證據
70 生活可自理,但不能維持正常生活或工作
60 生活能大部分自理,但偶爾需要別人幫助,不能從事正常工作
40 生活不能自理,需要特別照顧和治療
30 生活嚴重不能自理,有住院指徵,尚不到病重
10 重危,臨近死亡
0 死亡
4.10.2 2. Zubrod-ECOG-WHO 評分(ZPS,5 分法)
0 正常活動
1 症輕狀,生活自理,能從事輕體力活動2 能耐受腫瘤的症狀,生活自理,但白天臥牀時間不超過50%3 腫瘤症狀嚴重,白天臥牀時間超過 50%,但還能起牀站立,部分生活自理
4 病重臥牀不起
5 死亡
4.11 附錄 H 新輔助治療後病理學評估:
註釋:
2)療效評估根據存活腫瘤細胞決定,經過新輔助治療後出現的無腫瘤細胞的角化物或黏液湖不能認爲是腫瘤殘留;淋巴結內出現無腫瘤細胞的角化物或黏液湖不能認爲是腫瘤轉移。
4.12 附錄 I 術語和定義(適用本指南)
4.12.1 (一)食管癌
從下嚥食管起始部到食管胃結合部之間食管上皮來源的癌。包括食管鱗癌與食管腺癌兩種主要類型及其他少見類型惡性腫瘤。
4.12.1.1 1.食管鱗狀細胞癌
4.12.1.2 2.食管腺癌
主要起源於食管下 1/3 的巴雷特黏膜的腺樣分化的惡性上皮細胞腫瘤,偶爾起源於上段食管的異位胃黏膜,或食管固有腺體。
4.12.2 (二)巴雷特食管
指食管下段的復層鱗狀上皮被單層柱狀上皮所代替。
4.12.3 (三)食管的癌前疾病和癌前病變
癌前疾病包括慢性食管炎、巴雷特食管炎、食管白斑症、食管憩室、賁門失弛緩症、食管管型、返流性食管炎和食管良性狹窄。癌前病變是指以食管黏膜鱗狀上皮內不同層次的異型鱗狀細胞爲特徵的癌前病變,根據病變累及層次,分爲低級別上皮內瘤變/異型增生(侷限於鱗狀上皮下 1/2),高級別上皮內瘤變/異型增生(累及食管鱗狀上皮超過下 1/2,既往稱原位癌)。
4.13 附錄 J 縮略語(適用本指南)
PET-CT:正電子發射計算機體層成像(PositronEmissionTomography-Computed Tomography,PET-CT)
IPCL:食管上皮乳頭內毛細血管袢(Intrapapillary CapillaryLoops)
CLE:激光共聚焦顯微內鏡(Confocal Laser Endomicroscopy)
EUS:超聲內鏡(Endoscopic Ultrasonography)
EBUS:超聲支氣管鏡(endobronchial ultrasound,EBUS)
UICC:國際抗癌聯盟(Union for International Cancer Control)
AJCC:美國癌症聯合會(American Joint Committee on Cancer)
JES:日本食道學會(Japan Esophageal Society)
NRS2002:營養風險篩查 2002(Nutritional Risk Screening 2002)
SGA:主觀全面評定(Subjective Global Assessment)
PG-SGA:患者參與的主觀全面評定(Patient GeneratedSubjectiveGlobal Assessment)
GTV:腫瘤靶區(Gross Tumor Volume)
GTVnd:淋巴結靶區(Gross Tumor Volume LymphNode)
CTV:臨牀靶區(Clinical Target Volume)
PTV:計劃靶區(Planning Target Volume)
AUC:濃度-時間曲線下面積(Area Under The Concentration-TimeCurve)
CAP:美國病理學院(College of American Pathologists)
CPS:聯合陽性評分(Combined Positivity Score)
EMR:內鏡下黏膜切除術(Endoscopic Mucosal Resection)
MBM:多環套扎黏膜切除術(multi-band mucosectomy)
ESD:內鏡下黏膜剝離術(Endoscopic Submucosal Dissection)
RFA:射頻消融術(Radiofrequency Ablation)
PDT:光動力療法(Photodynamic Therapy)
APC:氬離子凝固術(Argon Plasma Coagulation)
5 附件 食管癌診療指南(2022 年版)編寫審定專家組(按姓氏筆畫排序)
組長:王綠化
副組長:於金明、于振濤、李印
成員:王軍、王貴齊、王峯、王鎮、王鑫、劉俊峯、孫永琨、李志剛、李勇、陳克能、趙心明、柳碩巖、姜宏景、秦建軍、黃鏡、康曉徵、韓泳濤、惠周光、傅劍華、譚黎傑、薛麗燕