2 基本信息
《淋巴瘤診療指南(2022年版)》由國家衛生健康委辦公廳於2022年4月3日《國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知》(國衛辦醫函〔2022〕104號)印發,要求各省、自治區、直轄市及新疆生產建設兵團衛生健康委組織做好實施工作。
3 發佈通知
國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知
國衛辦醫函〔2022〕104號
各省、自治區、直轄市及新疆生產建設兵團衛生健康委:
爲進一步提高腫瘤和血液病診療規範化水平,保障醫療質量安全,維護患者健康權益,我委委託有關單位制修訂了腫瘤和血液病相關病種診療指南。現印發給你們(見附件,可在國家衛生健康委網站醫政醫管欄目下載),請各地衛生健康行政部門組織做好實施工作。
附件:
2.膀胱癌診療指南(2022年版)
5.胰腺癌診治指南(2022年版)
6.腎癌診療指南(2022年版)
7.乳腺癌診療指南(2022年版)
8.子宮內膜癌診療指南(2022年版)
12.甲狀腺癌診療指南(2022版)
13.腦膠質瘤診療指南(2022年版)
16.瀰漫性大B細胞淋巴瘤診療指南(2022年版)
17.骨髓增生異常綜合徵伴原始細胞增多(MDS-EB)診療指南(2022年版)
18.慢性髓性白血病診療指南(2022年版)
19.血友病A診療指南(2022年版)
20.慢性淋巴細胞白血病-小淋巴細胞淋巴瘤診療指南(2022年版)
國家衛生健康委辦公廳
2022年4月3日
4 診療指南全文
4.1 一、概述
淋巴瘤是中國最常見的惡性腫瘤之一。世界衛生組織GLOBOCAN 2020 顯 示 2020 年中國新發霍奇金淋巴瘤(Hodgkin lymphoma,HL)6829 例,其中男性4506例,女性 2323 例;死亡 2807 例,其中男性1865 例,女性942例。2020 年中國新發非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)92 834 例,其中男性 50 125 例,女性42 709例;死亡 54 351 例,其中男性 29 721 例,女性24 630 例;男性NHL 發病率和死亡率均居全部惡性腫瘤第10 位;女性NHL發病率和死亡率均未進入全部惡性腫瘤的前10 位。由於淋巴瘤病理類型複雜,治療原則各有不同,爲進一步提高淋巴瘤的診療能力和規範化實施,配合抗腫瘤藥品供應保障有關政策調整,保障醫療質量與安全,現對淋巴瘤診療指南進行修訂和更新。
4.2 二、淋巴瘤的診斷
應當結合患者的臨牀表現、體格檢查、實驗室檢查、影像學檢查和病理學檢查結果等進行診斷。
4.2.1 (一)臨牀表現。
淋巴瘤的症狀包括全身和局部症狀。全身症狀包括不明原因的發熱、盜汗、體重下降、皮膚瘙癢和乏力等。局部症狀取決於病變不同的原發和受侵部位,淋巴瘤可以原發於身體的任何器官和組織,通常分爲原發於淋巴結和淋巴結外兩大類。最常表現爲無痛性的進行性淋巴結腫大。
4.2.2 (二)體格檢查。
應特別注意不同區域的淋巴結是否腫大、肝脾的大小、伴隨體徵和一般狀況等。
4.2.3 (三)實驗室檢查。
應完成的實驗室檢查包括血常規、肝腎功能、乳酸脫氫酶(lactate dehydrogenase,LDH)、β2微球蛋白、紅細胞沉降率、乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒和人類免疫缺陷病毒檢測,必要時進行骨髓穿刺細胞學和/或活檢等。對於存在中樞神經系統受累風險的患者應進行腰椎穿刺,予以腦脊液生化、常規和細胞學等檢查。對 NK/T 細胞淋巴瘤,以及其他EB 病毒相關的淋巴瘤,如EB病毒陽性瀰漫大 B 細胞淋巴瘤、淋巴瘤樣肉芽腫等,應進行外周血 EB 病毒 DNA 滴度檢測。對原發胃的黏膜相關邊緣區B細胞淋巴瘤,應常規進行幽門螺桿菌(helicobacterpylori,Hp)檢查。
4.2.4 (四)影像學檢查。
常用的影像檢查方法:CT、MRI、正電子發射計算機體層 成 像 ( positron emission tomography-computedtomography,PET-CT)、超聲和內鏡等。
4.2.4.1 1.CT
目前仍作爲淋巴瘤分期、再分期、療效評價和隨診的最常用影像學檢查方法,對於無碘對比劑禁忌證的患者,應儘可能採用增強 CT。
4.2.4.2 2.MRI
對於中樞神經系統、骨髓和肌肉部位的病變應首選;對於肝、脾、腎臟、子宮等實質器官病變可以選擇或者首選MRI檢查,尤其對於不宜行增強 CT 掃描者,或者作爲CT發現可疑病變後的進一步檢查。
4.2.4.3 3.PET-CT
是大多數淋巴瘤分期與再分期、療效評價和預後預測的最佳檢查方法,但是在疾病緩解後的長期隨訪過程中,不建議採用 PET-CT 進行隨訪。
4.2.4.4 4.超聲
可用於淺表淋巴結和淺表器官(睾丸、甲狀腺及乳腺等)病變的診斷和隨診,但一般不用於淋巴瘤的分期診斷。對於淺表淋巴結和淺表器官(如睾丸、乳腺)病變的診斷和治療後隨診具有優勢,可以常規使用;對於腹部、盆腔淋巴結檢查可以選擇性使用;對於肝、脾、腎、子宮等腹盆腔實質性器官的評估,可以作爲 CT 和MRI 的補充,尤其是不能行增強 CT 檢查時。在淺表淋巴結切除活檢時,選取超聲檢測聲像圖異常的淋巴結,有助於提高活檢的準確性。超聲引導下穿刺活檢也應用於深部淋巴結、肝臟、縱隔等部位的病變診斷。
4.2.4.5 5.同位素骨掃描
淋巴瘤骨受侵患者的全身骨顯像缺乏特徵性改變,難以與骨轉移瘤、多發性骨髓瘤、骨結核、骨纖維異常增殖症、甲狀旁腺功能亢進、感染性疾病等鑑別,需要結合患者的病史、實驗室檢查和其他影像學檢查。常規骨掃描(99mTc-MDP)對初治HL 患者的臨牀價值有限,但骨掃描對原發骨淋巴瘤治療後隨訪觀察和預後評價需要結合 CT 檢查。
4.2.4.6 6.腔鏡檢查
4.2.5 (五)病理學檢查。
病理學檢查是淋巴瘤診斷的主要手段。對於淋巴結病竈,應儘可能切除完整淋巴結。如果淋巴結病竈位於淺表,應儘量選擇頸部、鎖骨上和腋窩淋巴結。粗針穿刺僅用於無法有效、安全地獲得切除或切取病變組織的患者。初次診斷時,應首選切除或切取病變組織;對於復發患者,如果確實無法獲得切除或切取的病變組織標本,可通過粗針穿刺獲取的病變組織進行診斷。
淋巴瘤的病理診斷需綜合應用形態學、免疫組織化學(immunohistochemistry,IHC)、流式細胞術及遺傳學和分子生物學技術等。同時臨牀特徵也非常重要。
4.2.5.1 1.形態學
在淋巴瘤病理診斷中非常重要,不同類型的淋巴瘤具有特徵性和診斷性的形態學特點。
4.2.5.2 2.IHC
用於鑑別淋巴瘤細胞的免疫表型,如B 或T/NK細胞、腫瘤細胞的分化及成熟程度等。通過組合相關的IHC標記物,進行不同病理亞型的鑑別診斷。
4.2.5.3 3.熒光原位雜交檢測技術
熒光原位雜交(fluorescence in situ hybridization,FISH)檢測技術可以發現特定的染色體斷裂、易位以及缺失或擴增等,對特定染色體異常相關淋巴瘤的輔助診斷有指導意義,如伯基特淋巴瘤相關的t(8;14)易位以及t(2;8)或 t(8;22)易位、濾泡性淋巴瘤相關的t(14;18)易位、黏膜相關淋巴組織結外邊緣區淋巴瘤相關的t(11;18)易位、套細胞淋巴瘤(mantle cell lymphoma,MCL)相關的t(11;14)易位以及雙打擊或三打擊高級別B 細胞淋巴瘤相關的MYC(8q24)、BCL2(18q21)和 BCL6(3q27)重排等。
4.2.5.4 4. 淋巴細胞抗原受體基因重排檢測技術
淋巴細胞受體基因單克隆性重排是淋巴瘤細胞的主要特徵,可用於協助鑑別淋巴細胞增殖的單克隆性與多克隆性,以及無法通過 IHC 診斷的淋巴瘤,是對形態學和IHC檢查的重要補充。
4.2.5.5 5.其他
包括二代測序、流式細胞技術等,是常規病理學診斷方法的有益補充。
4.3 三、淋巴瘤的分期
Ann-Arbor 分期( Cotswolds 會議修訂)是目前通用的描述HL和NHL的分期系統,更適用於HL和原發淋巴結的NHL,而對於某些原發淋巴結外的 NHL,如慢性淋巴細胞白血病、皮膚 T 細胞淋巴瘤和原發胃腸道、中樞神經系統淋巴瘤等,則難以適用,這些原發於特殊結外器官和部位的NHL,通常有其專屬的分期系統。另外,基於亞洲和中國的結外鼻型NK/T 細胞淋巴瘤患者數據,建立了結外鼻型NK/T 細胞淋巴瘤的分期系統,命名爲中國南方腫瘤臨牀研究協會(ChineseSouthwest Oncology Group,CSWOG)和亞洲淋巴瘤協作組(Asian Lymphoma Study Group,ALSG)分期系統,簡稱CA分期。見附件 2(附件 2.1 至附件2.5)。
4.4 四、淋巴瘤放射治療
放射治療是淋巴瘤綜合治療的重要組成部分,實施中如何選擇放射治療的線束、放射野和劑量,由具體病例的治療目的和診療條件決定。可採用光子、電子和質子等射線束以達到對靶區的合理涵蓋及正常組織的最大保護。先進的放療技術如適形調強放療、屏氣和呼吸門控、影像引導、以及質子治療,在確保腫瘤控制的前提下,可以顯著減少對正常組織的損失。
①根治性治療;
② 化療後的鞏固放療;
③化療不能耐受或抗拒、殘存病竈的解救治療;
④姑息放療。
放療設野分爲:全淋巴照射和次全淋巴照射。全淋巴照射通常包括斗篷野+鋤形野+盆腔野(在未行脾切除的病例中還需要進行脾照射),次全淋巴照射可以省略部分受照區域。受累野照射(involved-field radiotherapy,IFRT)僅照射化療前受累淋巴結的整個淋巴結區域,受累野範圍包括所有已知腫瘤的部位和鄰近區域;隨着影像診斷和適形放療技術的發展,IFRT 在 HL 和侵襲性淋巴瘤中,被更精準的受累淋巴結照射或受累部位照射(involved site radiotherapy,ISRT)所替代。
ISRT 靶區定義與勾畫:
ISRT 結內病變:ISRT 目前是化療敏感的HL 和NHL標準放射野設定方案。照射範圍需要以CT 模擬爲基礎,融合其他現代顯像手段如 PET-CT 和 MRI 決定。ISRT 的靶區主要包括初診時累及的淋巴結以及全部化療前或活檢手術前的所有可疑腫瘤累及區域,但應排除鄰近未受侵的正常組織,比如肺、骨、肌肉、腎臟等。化療前或活檢前大體腫瘤體積是勾畫臨牀靶區(clinical target volume,CTV)的基礎。考慮到亞臨牀病竈的不確定性,以及原始腫瘤影像可能欠缺的準確性,在設置 CTV 時,可以基於臨牀判斷適當擴充邊界。惰性淋巴瘤採用單純放療時,傾向採用更大的放射野。例如,濾泡性淋巴瘤的放射野應該較同樣受累時的瀰漫大B細胞淋巴瘤化療後的放射野更大。在胸部和腹部區域,應考慮器官運動確定內靶區,在此基礎上外擴形成計劃靶區。
ISRT 結外病變:結外病變的放射野設定原則與結內病變類似。但在某些結外器官原發病變中,CTV 需要包括整個器官,如胃、唾液腺、甲狀腺。在其他結外器官中,如眼、乳腺、肺、骨、皮膚等,可考慮部分器官照射。多數情況下,不需進行未受累淋巴結的預防照射。放療劑量:HL 化療達完全緩解(complete response,CR)後的照射劑量爲 20~30Gy,部分緩解(partial response,PR)後的照射劑量爲 36~40Gy。惰性淋巴瘤的根治性照射劑量爲 24~30Gy。瀰漫大 B 細胞淋巴瘤化療CR 後的照射劑量爲 30~36Gy;根據風險分層,對化療以及放療的反應等個體因素,PR 後的照射劑量可在 36~50Gy 選擇。結外鼻型NK/T細胞淋巴瘤的根治性照射劑量爲50~56Gy。
4.5 五、淋巴瘤綜合治療
多學科綜合治療是淋巴瘤的治療原則。作爲一組臨牀特點不盡相同、診斷標準與治療方式各異的惡性腫瘤,在診斷時,需明確淋巴瘤患者的病理類型和預後不良的分子病理特徵,通過相關影像診斷技術明確疾病分期,綜合臨牀表現和實驗室檢查結果,根據各自預後風險的評判標準判斷預後;選擇包括內科治療、放療及必要的手術治療等的綜合治療。六、淋巴瘤的中醫藥治療中醫把淋巴瘤歸屬於石疽、惡核、失榮、痰核的範疇,中醫治療淋巴瘤採用辨病與辨證相結合的方法,常見中醫證型多爲兩種或多種證候要素組成的複合證型,如痰熱蘊結型、氣鬱痰阻型、脾虛痰溼型、氣血兩虛型、肝腎陰虛型等,中醫治療以整體觀念和辨證施治爲原則,既要考慮全身陰陽平衡狀態,也要考慮減瘤祛邪,即以經方爲基礎的“平衡阻斷”抗腫瘤。化、放療的同時配合中醫藥治療可以減毒增效,減輕化、放療的消化道反應、骨髓抑制、周圍神經炎等不良反應,增加療效。對化、放療結束的患者,中醫藥可以通過調整患者身體的陰陽平衡狀態,從而改善體質,提高免疫功能,促進患者康復。
適應人羣:化療及放療期間、抗腫瘤治療後恢復期及晚期姑息治療患者。
4.6 七、常見淋巴瘤類型的臨牀特點、診斷與治療
4.6.1 (一)HL。
HL 是一種獨特的淋巴系統惡性疾病,男性多於女性,男女之比爲 1.3∶1~1.4∶1。發病年齡在歐美髮達國家呈較典型的雙峯分佈,分別在 15~39 歲和50 歲以後;而包括中國在內的東亞地區,發病年齡多在30~40 歲,呈單峯分佈。
4.6.1.1 1.臨牀表現
90%的 HL 以淋巴結腫大爲首發症狀,多起始於一組受累的淋巴結,以頸部和縱隔淋巴結最常見,隨着病情進展可逐漸擴散到其他淋巴結區域,晚期可累及脾、肝、骨髓等。患者初診時多無明顯全身症狀,20%~30%的患者可伴有B症狀,包括不明原因的發熱、盜汗和體重減輕,還可以有皮疹、皮膚瘙癢、乏力等症狀。
4.6.1.2 2.病理分類及診斷
根據 2017 年版 WHO 造血與淋巴組織腫瘤分類,HL分爲經典型(classical Hodgkin lymphoma,cHL)和結節性淋巴細胞爲主型(nodular lymphocyte predominant Hodgkinlymphoma,NLPHL)兩大類型,經典型可分爲4 種組織學亞型,即結節硬化型、富於淋巴細胞型、混合細胞型和淋巴細胞消減型;結節性淋巴細胞爲主型少見,約佔HL 的10%。HL 是起源於生髮中心的 B 淋巴細胞腫瘤,形態學特徵表現爲正常組織結構破壞,在炎症細胞背景中散在異型大細胞,如裏-施(Reed-Sternberg,R-S)細胞及變異型R-S細胞。典型 R-S 細胞爲雙核或多核巨細胞,核仁嗜酸性,大而明顯,細胞質豐富;若細胞表現爲對稱的雙核時則稱爲鏡影細胞。NLPHL 中 的 腫 瘤 細 胞 爲 淋 巴細胞爲主型(lymphocytepredominant,LP)細胞,過去稱爲淋巴細胞和組織細胞,細胞核大、摺疊,似爆米花樣,故又稱爲爆米花細胞,其核仁小、多個、嗜鹼性。LP 腫瘤細胞被程序性死亡蛋白1(programmed death-1,PD-1)陽性的T 細胞環繞。越來越多的證據提示完全呈瀰漫生長的NLPHL 和富於T 細胞/組織細胞的大 B 細胞淋巴瘤有重疊。診斷 HL 應常規檢測的 IHC 標記物包括CD45(LCA)、CD20、CD15、CD30、PAX5、CD3、MUM1、Ki-67 指數和EBER。cHL常表現爲 CD30(+)、CD15(+)或(-)、PAX5 弱(+)、MUM1(+)、CD45(-)、CD20(-)或弱(+)、CD3(-),部分病例EBER(+)。NLPHL 爲 CD20(+)、CD79a(+)、BCL6(+)、CD45(+)、CD3(-)、CD15(-)、CD30(-)、BOB1(+)、OCT2(+)、EBER(-)。在進行鑑別診斷時需增加相應的標記物,來鑑別如間變大細胞淋巴瘤或瀰漫大B 細胞淋巴瘤等。骨髓細胞學:骨髓有核細胞增生活躍或明顯活躍,部分病例嗜酸粒細胞增多。若腫瘤細胞骨髓浸潤,可找見本病特徵性的 R-S 細胞。骨髓穿刺塗片找到R-S 細胞陽性率較低,僅 3%左右;骨髓活檢可提高到9%~22%。3.治療原則
4.6.1.2.1 (1)NLPHL:
爲非 cHL,具有惰性病程和偶見的晚復發特點,與 cHL 在自然病程和治療效果方面有所不同。大多數患者爲早期,不伴有 B 症狀、縱隔或結外受侵及大腫塊。具有潛在的轉化爲大 B 細胞淋巴瘤的特點。早期患者預後很好,晚期、年齡≥45 歲、低血紅蛋白和B 症狀與預後不良相關。因爲腫瘤細胞表達 CD20 抗原,所以利妥昔單抗治療有效。① 初治患者的治療原則:早期、無大腫塊、無B症狀者以放療爲主;早期、有大腫塊或B 症狀者採用免疫化療聯合放療的綜合治療;晚期以免疫化療爲主。因具有惰性病程特徵,部分晚期患者可以選擇觀察隨診。ⅠA/侷限ⅡA期、無大腫塊:首選 ISRT;完整手術切除了孤立淋巴結病變的IA 期患者,可以選擇觀察。IA 伴大腫塊、ⅡA 病變廣泛或伴大腫塊、以及ⅠB/ⅡB 期:推薦化療+利妥昔單抗+ISRT。Ⅲ/Ⅳ 期:基於患者臨牀特徵的不同,可以選擇化療+利妥昔單抗±ISRT、利妥昔單抗單藥、對有症狀的局部病變進行姑息性放療或對無症狀者進行觀察隨診。②治療方案:一線治療方案可選擇:ABVD(阿黴素+博來黴素+長春花鹼+達卡巴嗪)+R(利妥昔單抗)、CHOP(環磷酰胺+阿黴素+長春新鹼+潑尼松)+R、CVP(環磷酰胺+長春新鹼+潑尼松)+R 或利妥昔單抗單藥。復發難治患者的二線治療方案可以選擇:R+DHAP(地塞米松,高劑量阿糖胞苷,順鉑),R+ICE(異環磷酰胺,卡鉑,依託泊苷),R+IGEV(異環磷酰胺,吉西他濱,長春瑞濱),R+苯達莫司汀;如之前未使用過 R-CHOP,R-ABVD,R-CVP 方案,也可選擇。
4.6.1.2.2 (2)cHL:
①初治患者的治療原則:早期患者以化放療綜合治療爲主,晚期患者以化療爲主。早期患者按照預後良好型、預後不良型、是否有大腫塊以及中期PET-CT 療效評價結果等因素,決定化療週期數、是否放療和放療劑量等。晚期患者可根據中期 PET-CT 療效評價結果,決定是否更改化療方案或降低化療強度。
Ⅰ/ⅡA 期、預後良好型、無大腫塊:總體推薦的治療策略是 ABVD 方案化療 3~4 週期±ISRT 20~30Gy。若選擇PET-CT 進行早期療效評價,2 週期化療後如PET-CT療效評價結果爲 Deauville 評分 1~3 分,推薦繼續ABVD 方案治療1~2 週期±ISRT 20~30Gy;如Deauville 評分4 分,繼續ABVD 方案化療 2 週期+受累野放療30Gy;如Deauville評分5 分,需進行活檢,活檢結果陰性者按照Deauville評分4分治療,陽性者依據復發難治cHL 患者的治療策略。PET-CTDeauville 五分量表見附件 3.1。Lugano 2014 淋巴瘤治療效果評價標準詳見附件 3.2。
Ⅰ/ⅡB 期、預後不良型或伴有大腫塊:總體推薦的治療策略是 ABVD 方案化療 4~6 週期±ISRT 30Gy。若選擇PET-CT進行早期療效評價,2 週期化療後如PET-CT 療效評價結果爲Deauville評分1~3分,推薦繼續ABVD方案治療2週期+ISRT30Gy 或更改爲 AVD(阿黴素,長春花鹼,氮烯咪胺)方案化療 4 週期,不進行放療;如 Deauville 評分4~5 分,推薦更改爲強化的 BEACOPP(博來黴素,依託泊苷,阿黴素,環磷酰胺,長春新鹼,甲基苄肼,潑尼松)方案化療2~4週期±ISRT 30Gy。
Ⅲ/Ⅳ期患者總體推薦的治療策略是ABVD 方案化療6週期。若選擇 PET-CT 進行早期療效評價,2 週期化療後如PET-CT 療效評價結果爲 Deauville 評分1~3 分,推薦更改爲 AVD 方案治療 4 週期;如 Deauville 評分4~5 分,推薦更改爲強化的 BEACOPP 方案化療3 週期,再次進行PET-CT療效評價,如 Deauville 評分依然爲4~5 分,需進行活檢,活檢陰性者繼續完成 BEACOPP 方案化療1 週期,活檢陽性者依據復發難治 cHL 患者的治療策略。
②一線治療方案:推薦的治療方案包括ABVD、增量的BEACOPP[年齡<60 歲、ABVD 早期PET-CT 評價未達CR、晚期HL 國際預後評分(international prognostic score,IPS)≥4 分]。
③復發難治患者的治療策略及解救治療方案:復發難治患者的整體治療策略是選擇合適的二線方案進行解救化療,化療緩解後,適合高劑量化療聯合自體造血幹細胞移植( high dose chemotherapy and autologous stemcelltransplantation,HDT/ASCT)的患者進行HDT/ASCT的鞏固性治療±放療;不適合移植的患者,可以根據解救化療的療效,選擇更換藥物治療方案、放療或觀察隨診。可選擇的二線及後線治療方案包括:DHAP,ESHAP(依託泊苷,甲潑尼龍,高劑量阿糖胞苷,順鉑),GVD(吉西他濱,長春瑞濱,脂質體阿黴素),ICE,IGEV,MINE(依託泊苷,異環磷酰胺,美司鈉,米託蒽醌)等。國家藥品監督管理局(National Medical ProductsAdministration,NMPA)於 2020 年5 月14 日批准維布妥昔單抗用於治療復發/難治性 CD30 陽性HL。NMPA 分別於2018年 12 月 27 日、2019 年 5 月 29 日和2019 年12 月27日批准信迪利單抗、卡瑞利珠單抗和替雷利珠單抗上市,用於治療二線系統化療後復發/難治性 cHL。
4.6.1.3 4.HL 預後因素(附件 4.1)
(1)初治早期 HL 的不良預後因素:不同研究組關於早期 HL 的不良預後因素略有不同。
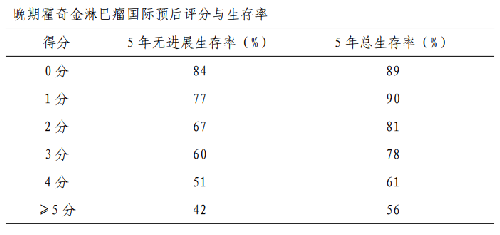
(2)晚期 HL 的不良預後因素:IPS:①白蛋白<40g/L;②血紅蛋白<105g/L;③男性;④年齡≥45 歲;⑤Ⅳ期病變;⑥白細胞≥15×109/L;⑦淋巴細胞佔白細胞比例<8%和/或計數<0.6×109/L。
(3)早期 PET-CT 評估結果:無論診斷時分期早晚,化療 2~3 週期後進行 PET-CT 評估,結果爲陰性的患者,預後明顯優於陽性患者。
4.6.2 (二)NHL。
4.6.2.1 1.瀰漫大 B 細胞淋巴瘤
瀰漫大 B 細胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是 NHL 中最常見的類型,在歐美地區佔成人NHL的30%~40%,中國佔 35%~50%。DLBCL 中位發病年齡爲50~70歲,男性略多於女性。
4.6.2.1.1 (1)臨牀表現:
DLBCL 臨牀表現多樣,因累及的組織、器官和腫瘤負荷等而不同。發病初期多表現爲無痛性淋巴結腫大,但 DLBCL 可以累及任何組織和器官,淋巴結外病變比例可達 40%~60%。臨牀病程呈侵襲性,表現爲迅速增大的腫物。約 1/3 的患者伴有 B 症狀,半數以上患者LDH 升高。
4.6.2.1.2 (2)病理診斷及分類:
DLBCL 的主要病理特徵是體積較大的異常淋巴樣細胞瀰漫性生長,破壞正常淋巴結結構。DLBCL 包括多種變異型、亞組和亞型(附件1)。診斷 DLBCL 的常規 IHC 標記物包括CD19、CD20、PAX5、CD3、CD5、CyclinD1、Ki-67;通常表現爲CD19(+)、CD20(+)、PAX5(+)、CD3(-)。DLBCL 診斷後,爲進一步探討腫瘤細胞起源(生髮中心或非生髮中心),可以選擇Hans模型(CD10、BCL6、MUM-1)或 Choi 模型(GCET1、FOXP1、CD10、BCL6、MUM-1),也可以增加 CD30、CD138、ALK 等進行鑑別診斷;建議所有 DLBCL 患者常規檢測EBER,以鑑別EB病毒陽性大 B 細胞淋巴瘤(非特指型)。建議所有DLBCL患者常規進行 IHC 檢測 C-MYC、BCL2,如果C-MYC 陽性率≥40%、BCL2陽性率≥50%,Ki-67 指數>80%陽性,尤其是生髮中心細胞型,應增加相應的 FISH 檢測,以鑑別伴有MYC、BCL2和/或BCL6 重排的高級別 B 細胞淋巴瘤,即“雙打擊”淋巴瘤或“三打擊”淋巴瘤,提示預後不良。如果沒有條件做FISH檢測,無法評價 MYC、BCL2、BCL6 基因易位的情況下,應通過IHC評價 MYC 蛋白(界值爲≥40%),BCL2(界值爲≥50%),稱爲“雙表達”淋巴瘤,提示預後不良。骨髓細胞學:當 DLBCL 骨髓浸潤時,可見到瘤細胞胞體較大,染色質粗糙,核仁多個但不明顯,胞質灰藍色、有少量空泡。
4.6.2.1.3 (3)治療原則:
DLBCL 的治療模式是以內科治療爲主的多學科綜合治療。治療策略應根據患者的年齡、一般狀態、國際預後指數(internation prognostic index,IPI)評分、臨牀分期、是否有大腫塊和變異亞型等因素而定,進行分層治療。對高腫瘤負荷患者,可以在正規化療開始前給予1 個小劑量的誘導治療,藥物包括潑尼松±長春新鹼,以避免腫瘤溶解綜合徵的發生。對HBV 攜帶或感染患者,應密切監測外周血 HBV-DNA 滴度,並選擇恩替卡韋等抗病毒治療。
①Ⅰ和Ⅱ期 DLBCL 的一線治療:Ⅰ/Ⅱ期、無大腫塊者,推薦選擇:R-CHOP方案3~4個週期+ISRT或R-CHOP方案6個週期±ISRT;對於 IPI=0 分的患者,可選擇R-CHOP方案4個週期或 R-CHOP 方案 4 個週期序貫利妥昔單抗單藥2個週期。Ⅰ/Ⅱ期有大腫塊者推薦 R-CHOP 方案6 個週期±ISRT。
②Ⅲ和Ⅳ期患者的一線治療:首先推薦參加臨牀試驗,或 R-CHOP 方案化療 6~8 個週期。可選擇在治療開始前、治療中或治療結束時進行 PET-CT 檢查,根據檢查結果繼續或調整原治療方案。爲了避免 PET-CT 假陽性,特別是治療中期 PET-CT 結果對療效判斷的影響,推薦在更改治療方案前,再次進行活檢。
③ 年 齡 超 過 80 歲 或 虛弱患者一線治療可以選擇R-miniCHOP 方案,R-CDOP(利妥昔單抗,環磷酰胺,脂質體阿黴素,長春新鹼,潑尼松),R-GemOx(利妥昔單抗,吉西他濱,奧沙利鉑)或 R-GCVP(利妥昔單抗,吉西他濱,環磷酰胺,長春新鹼,潑尼松)方案。左心室功能不全的患者可以選擇 R-CDOP 方案、劑量調整(dose adjusted,DA)的EPOCH-R 方案(依託泊苷,潑尼松,長春新鹼,環磷酰胺,阿黴素,利妥昔單抗)、R-CEOP 方案(利妥昔單抗,環磷酰胺,依託泊苷,長春新鹼,潑尼松)或R-GCVP 方案。
④同時發生中樞神經系統侵犯的患者,如果累及部位在腦實質,建議給予高劑量甲氨蝶呤(high dose methotrexate,HdMTX)(≥3g/m2,於 R-CHOP 21 天一週期方案的第15天給藥);
如果侵犯腦膜,推薦甲氨蝶呤/阿糖胞苷鞘內給藥。HdMTX(3~3.5g/m2)可與 R-CHOP 方案同週期給藥或作爲R-CHOP 方案聯合鞘內注射治療後的鞏固治療。
⑤一線鞏固治療(選擇性):60~80 歲的老年患者,可以考慮來那度胺進行維持治療。
⑥解救治療:對適合 HDT/ASCT 的患者,可採用的解救化療方案包括:ICE±R、DHAP(地塞米松,順鉑,阿糖胞苷)±R、ESHAP±R、GDP±R、DHAX(地塞米松,阿糖胞苷,奧沙利鉑)±R,GemOx(吉西他濱,奧沙利鉑)±R 和MINE±R。對不適合 HDT/ASCT 的患者,推薦的解救治療方案包括:GemOx±R、CEOP±R、DA-EPOCH±R、GDP±R、吉西他濱+長春瑞濱±R 和利妥昔單抗單藥等。姑息放療也是治療選擇。部分患者僅能接受最佳支持治療。合適的患者也可考慮異基因造血幹細胞移植治療。二線及以上解救治療失敗的患者,可選擇抗 CD19 嵌合抗原受體T 細胞(Chimeric AntigenReceptor T-Cell,CAR-T)治療。
4.6.2.1.4 (4)預後指標:
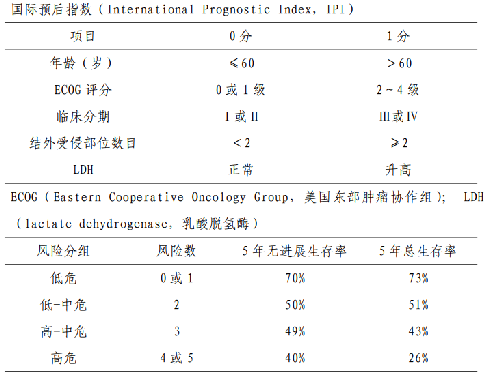
IPI 是目前國際上常用的DLBCL預後評分系統。此系統依據 5 個獨立的不良預後因素,即年齡>60歲、Ⅲ~Ⅳ期、結外累及部位數目>1、美國東部腫瘤協作組(Eastern Cooperative Oncology Group,ECOG)行爲狀態(performance status,PS)評分≥2、血清LDH水平>正常值上限,每一個不良預後因素爲1 分。0~1 分爲低危組;2 分爲低中危組; 3 分爲高中危組;4~5 分爲高危組。對於應用含利妥昔單抗方案治療的患者,可以採用修正的IPI 預後指數。對於年齡≤60 歲的患者,可以採用年齡調整的 IPI 預後指數(附件 4.2)。除臨牀因素外,近年來隨着分子遺傳學研究的進展,伴MYC、BCL2 和/或 BCL6 重排的“雙打擊”或“三打擊”淋巴瘤和 TP53 突變與 DLBCL 的預後不良相關。
4.6.2.1.5 (5)特殊原發部位及病理類型的DLBCL:
①原發中樞神經系統 DLBCL:爲DLBCL 的亞型之一,是指原發於顱內或眼內的 DLBCL,而不包括硬腦膜淋巴瘤、血管內大 B 細胞淋巴瘤、淋巴瘤繼發中樞神經系統受侵及免疫缺陷相關淋巴瘤。原發中樞神經系統DLBCL 不足NHL的1%,佔原發腦腫瘤的 2%~3%。中位發病年齡約爲60 歲,男性略多於女性。
臨牀表現:50%~80%的患者出現局竈性症狀,常伴有精神和反應水平的改變;由於顱內壓升高可引起噁心、嘔吐、頭痛等症狀。軟腦膜病變可導致頭痛和非對稱性顱神經功能異常。眼內淋巴瘤表現爲視力模糊、視野缺損等。診斷:影像學上表現爲中樞神經系統的結節或腫物。MRI是首選的檢查方法,可見病竈在T1 加權像呈低信號或等信號,T2 加權像呈高信號,常伴有水腫。病理學檢查爲確診本病所必需,可通過立體定向穿刺活檢或開顱活檢取得。在無法取得腫瘤組織活檢時,腦脊液細胞學檢查陽性也可接受,腦脊液流式細胞分析可作爲輔助性診斷手段。需與本病鑑別的疾病包括脫髓鞘疾病、亞急性梗死及感染所致的顱內佔位性病變、腦膠質瘤和轉移瘤。尤其應注意鑑別影像學表現與本病相似和激素治療有效的疾病,如多發性硬化症和神經系統結節病。
原發中樞神經系統 DLBCL 的血管周圍浸潤更爲明顯,腫瘤細胞形態多類似生髮中心母細胞或免疫母細胞,基本上起源於非生髮中心 B 細胞,Ki-67 陽性細胞比例常超過90%。IHC 標記物與 DLBCL 相同。
治療原則:以內科治療爲主的綜合治療。皮質激素類藥物可以迅速緩解症狀,但若未經化療或放療,腫瘤多在短期內復發。在腫瘤組織活檢前,不推薦使用皮質激素類藥物,但顱內高壓危及生命時除外。化療選用藥物的原則是能透過血腦屏障,首選 HdMTX,可聯合高劑量阿糖胞苷(highdosecytarabine,HdAra-C)、替莫唑胺、利妥昔單抗等提高療效。一線治療達到CR/CRu的患者可進行鞏固治療,包括HDT/ASCT、HdAra-C±依託泊苷或全腦放療。復發耐藥的患者可選擇HdMTX 或 HdAra-C、替莫唑胺、拓撲替康、培美曲塞、伊布替尼、來那度胺等單藥或聯合方案。解救治療有效患者可考慮 HDT/ASCT,對於原發性中樞神經系統淋巴瘤而言,自體造血幹細胞移植的預處理方案建議採用含噻替派的聯合方案。
化療後聯合全腦放療可延長患者的無進展生存時間(progression free survival,PFS)。但全腦放療的神經毒性對年齡>60 歲的患者更加明顯,因此建議年齡>60歲的患者在化療緩解後,可推遲放療。手術的作用僅限於活檢,完整切除腫瘤並無益處。
預後:本病惡性程度較高,支持治療的中位生存時間僅爲 2~3 個月,單純手術爲 3~5 個月,單純放療約爲12~16個月,經含 HdMTX 方案化療後爲25~84 個月。最重要的預後因素爲年齡和行爲狀態。
②原發睾丸 DLBCL:原發睾丸DLBCL 佔睾丸腫瘤的3%~9%,佔 NHL 的 1%~2%。DLBCL 是原發睾丸淋巴瘤最常見的病理類型,佔 80%~90%。本病是50 歲以上男性最常見的睾丸惡性腫瘤,中位發病年齡約 65 歲。臨牀表現:多表現爲睾丸無痛性腫物或腫脹,少數表現爲陰囊疼痛。診斷時雙側睾丸同時受累者約佔20%,多達35%的患者在病程中對側睾丸受侵。腹膜後淋巴結腫大者可表現爲腹痛和腹腔積液。B 症狀通常只見於晚期患者。本病易出現結外器官受累,包括中樞神經系統、皮膚、皮下組織、肺和胸膜等。超聲表現主要爲:睾丸體積增大,外形光整,睾丸內侷限性或瀰漫性低迴聲區,邊界可清楚或不清楚,彩超顯示有豐富血供,病竈內可有正常睾丸血管穿行。治療原則:原發睾丸 DLBCL 應接受包括手術、放療和免疫化療在內的綜合治療。患者應接受睾丸切除和高位精索結紮術,術後應行免疫化療。因對側睾丸和中樞神經系統受侵率高,推薦對側睾丸的預防性放療和含HdMTX 的中樞神經系統預防性治療。Ⅱ期患者可進行ISRT。預後: 本病的不良預後因素包括高齡、晚期、LDH升高、B 症狀、IPI 高和未經手術或放療等。
③原發縱隔大 B 細胞淋巴瘤:多見於年輕的成年人,中位發病年齡 35 歲左右,女性略多於男性。腫瘤細胞起源於胸腺 B 細胞,基因表達譜具有自身獨特性,與cHL 相似性更高。不同於大多數 DLBCL,多數表達CD23、CD30 和PD-L1。臨牀表現:臨牀症狀和體徵多與快速增大的縱隔腫物相關,可致上腔靜脈壓迫綜合徵,心包積液和胸腔積液等。初診時病變常較侷限,主要位於前上縱隔,可伴有鎖骨上、頸部和肺門淋巴結累及,復發後常伴有廣泛的結外器官或組織受侵。
治療原則:一線化療方案的選擇尚存爭議。可選擇的方案包括:DA-EPOCH-R、R-CHOP 或R-CHOP 續貫R-ICE等。化療後可行鞏固放療,對 PET-CT 評價陰性者可以考慮不放療。因化療後前縱隔常殘存腫物影,CT 檢查無法準確判斷殘存腫物的性質,推薦化療結束時採用PET-CT 進行評價。但PET-CT的假陽性率偏高,如考慮根據PET-CT 結果更改化療方案,推薦再次活檢。復發難治患者的治療可參照復發難治DLBCL的治療策略。
預後:預後優於非特指型的DLBCL,5 年PFS 可以達到80%~95%。不良預後因素參考DLBCL。④高級別 B 細胞淋巴瘤,伴有MYC 和BCL2 和/或BCL6基因易位(雙/三打擊淋巴瘤):定義是高級別B 細胞淋巴瘤,且通過 FISH 檢測出 MYC 和 BCL2 和/或BCL6 基因易位,含MYC易位和 BCL2 或 BCL6 易位者爲雙打擊,三個基因均易位者爲三打擊淋巴瘤。約佔 DLBCL 的2%~11%,多數爲生髮中心B細胞來源。
臨牀特點:具有高度侵襲性特徵,常見LDH 增高,骨髓受侵、中樞神經系統受侵和高IPI 評分等。治療原則:無推薦的標準治療方案,首先推薦參加臨牀試驗。R-CHOP 方案療效差,高強度方案有可能提高療效。推薦的治療方案包括:DA-EPOCH-R,R-HyperCVAD/HdMA(利妥昔單抗,環磷酰胺,長春新鹼,阿黴素,地塞米松與HdMTX和 HdAra-C 交替)和 R-CODOX-M/IVAC(利妥昔單抗,環磷酰胺,長春新鹼,阿黴素和甲氨蝶呤,異環磷酰胺,依託泊苷,阿糖胞苷)。對於侷限期患者,推薦給予鞏固放療。中樞神經系統受侵率高,推薦中樞神經系統預防性治療。預後:預後較差。一項隨訪時間較長,應用R-CHOP方案治療的回顧性研究中,5 年無進展生存率和總生存率分別爲 18%和 27%。另一項 meta 研究,比較了R-CHOP、R-HyperCVAD或 R-CODOX-M/IVAC 和 DA-EPOCH-R 方案作爲一線治療的療效,三組患者的中位 PFS 分別爲 12、19 和22 個月。與R-CHOP方案相比,DA-EPOCH-R 方案顯著延長了患者的PFS。
4.6.2.2 2.濾泡性淋巴瘤
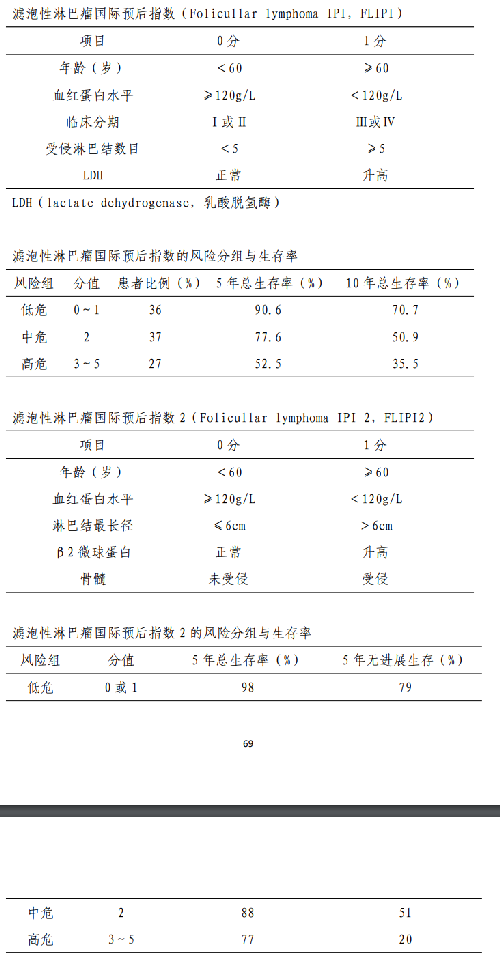
濾泡性淋巴瘤(follicular lymphoma,FL)是歐美地區最常見的惰性淋巴瘤,約佔NHL 的20%~30%,包括中國在內的亞洲地區發病率較低,不足NHL 的10%。中位發病年齡約 60 歲。
4.6.2.2.1 (1)臨牀表現:
主要表現爲多發淋巴結腫大,亦可累及骨髓、外周血、脾臟、咽淋巴環、胃腸道和軟組織等,原發結外者少見。晚期患者多見,約佔70%。
4.6.2.2.2 (2)病理診斷:
形態學上表現爲濾泡中心細胞和中心母細胞的增生,多爲濾泡樣結節狀生長。根據中心母細胞的數量,將 FL 分爲 3 級:每個高倍鏡視野0~5 箇中心母細胞爲 1 級、6~15 個爲 2 級、15 個以上爲3 級,FL 3 級可以進一步分爲 3a 級和 3b 級,其中3b 表現爲中心母細胞呈片狀分佈且缺乏中心細胞。診斷 FL 應常規檢測的IHC 標記物包括 CD19、CD20、PAX5、CD3、CD10、BCL2、BCL6、LMO2、CD21和 Ki-67,也包括鑑別診斷所需的標記物,如鑑別慢性淋巴細胞白血病/小淋巴細胞淋巴瘤(chronic lymphocyticleukemia/small lymphocytic lymphoma,CLL/SLL)和MCL的 CD23、CD5、cyclin D1。FL 常存在t(14;18)易位及所致的 Bcl2 蛋白過表達,但隨着級別升高有不同程度的丟失,爲確診帶來困難,必要時可以進行FISH BCL2 檢測。兒童型濾泡性淋巴瘤(paediatric-type follicularlymphoma,PTFL)是一種主要發生於兒童和年輕人,淋巴結起源的濾泡性淋巴瘤。PTFL 多見累及頭頸部的淋巴結,分期早。腫瘤細胞表型爲 CD10+/CD20+/CD79a+/PAX5+/BCL6+,多數 BCL2 陰性。此類型 FL 預後很好,多數患者可以通過單純手術切除獲得治癒,無需放療或化療。2017 年版 WHO 造血與淋巴組織腫瘤分類新提出“十二指腸型濾泡性淋巴瘤”,其預後很好,需要與其他胃腸道解剖部位的 FL 區分開;新提出的“伴IRF4 基因重排的大B細胞淋巴瘤”,常發生咽淋巴環和頸部淋巴結,兒童及年輕人多見 , 組 織 學 表 現 與 經 典 高級別FL 一致,IHC顯示IRF4+/CD10+/BCL6+,FISH 顯示有IRF4 重排,該類型預後相對較好。另外把之前原位濾泡性淋巴瘤改爲原位濾泡性腫瘤。骨髓細胞學:當瘤細胞累及骨髓時,有核細胞增生可明顯活躍,以 FL 細胞增多爲主,FL 細胞較正常淋巴細胞大,胞核圓形或不規則形,核染色質較細,核仁隱約可見,胞質豐富,呈淡藍色,部分 FL 細胞可見空泡變性。FL 的診斷主要依據病理組織學,當出現 FL 白血病時,骨髓或外周血可見一定數量的 FL 細胞。
4.6.2.2.3 (3)治療:
1~2 級 FL 屬於惰性淋巴瘤,根據不同分期,治療策略如下。3 級 FL 的治療等同於DLBCL。
①Ⅰ/Ⅱ期 FL:Ⅰ/Ⅱ期患者通過放療具有潛在治癒可能。Ⅰ期和病變範圍侷限、無大腫塊的Ⅱ期患者,以放療爲主。治療首選 ISRT,或 ISRT+CD20 單抗±化療;在無法放療的特殊情況下,可以選擇 CD20 單抗±化療。Ⅰ期伴有大腫塊或病變範圍廣泛的Ⅱ期患者,參考Ⅲ/Ⅳ期的治療策略,以內科治療爲主,推薦 CD20 單抗±化療±姑息性ISRT,沒有治療指徵者可選擇觀察隨診。
②Ⅲ/Ⅳ期 FL:Ⅲ/Ⅳ期 FL 被認爲是一種不可治癒的疾病。Ⅲ/Ⅳ期且低腫瘤負荷的 FL,診斷後即刻治療與先觀察隨診、待有治療指徵時再治療比較,患者OS 並無差異。無治療指徵患者觀察隨診期間,5 年內可每3~6個月進行 1 次查體或實驗室檢查,5 年後每年1 次;2 年內≥6個月進行 1 次 CT 檢查,2 年後≥1 年進行1 次CT 檢查。具有治療指徵的患者,需進行治療。治療指徵包括:可以參加合適的臨牀試驗、高腫瘤負荷、有症狀、威脅器官功能、繼發血細胞減少、大腫塊和病變持續進展等。FL 推薦的一線治療方案包括:R-B(利妥昔單抗,苯達莫司汀),R-CHOP 或 G-CHOP(奧妥珠單抗,環磷酰胺,阿黴素,長春新鹼,潑尼松),R-CVP(利妥昔單抗,環磷酰胺,長春新鹼,潑尼松)或 G-CVP(奧妥珠單抗,環磷酰胺,長春新鹼,潑尼松)以及 R-R(利妥昔單抗,來那度胺)等。部分低腫瘤負荷的患者,可以選擇利妥昔單抗單藥。老年和體弱患者,推薦單藥利妥昔單抗,或單藥烷化劑(如苯丁酸氮芥、環磷酰胺)± 利妥昔單抗等。初治、高腫瘤負荷的患者,在誘導化療達到 CR 或 PR 後,利妥昔單抗維持治療可以延長 PFS。
③復發難治 FL 的治療:復發FL 仍可首選觀察隨診,當出現治療指徵時再開始解救治療。對於進展較快的病變,應再次活檢,明確是否有組織學轉化,特別是伴有LDH增高、某部位腫瘤異常快速增大、新出現的結外受侵或全身症狀等。PET-CT 檢查標準攝取值明顯增高時,應高度懷疑組織學轉化。如果復發進展的時間距離末次應用利妥昔單抗6個月以上,還可以繼續選擇利妥昔單抗治療。根據一線治療方案,推薦選擇的二線方案包括:R-B,R-CHOP,R-CVP 或R-R等。一線應用 R-CHOP 或 R-CVP 方案治療開始在24 個月內出現疾病進展(progression of disease,POD)的患者,推薦來那度胺爲主的治療方案、參加臨牀試驗或HDT/ASCT作爲鞏固治療。二線誘導化療獲得緩解後,也可以選擇利妥昔單抗維持治療。二線及以上治療失敗的患者,可選擇抗CD19CAR-T治療。
約 15%的 FL 可發生向 DLBCL 的組織學轉化,年轉化率爲2%~3%。與組織學轉化相關的危險因素包括:分期晚、高濾泡 性 淋 巴 瘤 國 際 預 後 指數(follicular lymphomainternational prognostic index,FLIPI)、LDH 增高和B症狀等。積極治療與觀察隨診對轉化率無明顯影響。轉化的FL 通常預後不良,轉化時的分期、轉化前是否接受過化療或利妥昔單抗治療、是否轉化爲雙打擊或三打擊DLBCL等因素與預後相關。轉化型 FL 的治療參考DLBCL。④預後:FLIPI 有 FLIPI1 和FLIPI2 兩個評分系統,分別包含 5 個獨立的預後不良因素,均將患者分爲3 個風險組,FLIPI1 評分系統 0~1 分爲低危組,2 分爲中危組,≥3分爲高危組;FLIPI2 評分系統 0 分爲低危組,1~2 分爲中危組,3~5 分爲高危組(附件 4.3)。POD24 或一線免疫化療後的無事件生存時間≤12 個月均提示預後不良。一項研究結果顯示,一線應用 R-CHOP 方案治療後,POD24 和非POD24 患者的5年總生存率分別爲 50%和 90%。
4.6.2.3 3.邊緣區淋巴瘤
邊緣區淋巴瘤是起源於邊緣區的B 細胞淋巴瘤,屬於惰性淋巴瘤。按照起源部位的不同,分爲3 種亞型:即結外邊緣區淋巴瘤[也稱爲黏膜相關淋巴組織(mucosa-associatedlymphoid tissue,MALT)淋巴瘤]、淋巴結邊緣區淋巴瘤和脾邊緣區淋巴瘤。其中 MALT 淋巴瘤最常見。邊緣區淋巴瘤的病因與慢性感染或炎症所致的持續免疫刺激有關。如胃 MALT 淋巴瘤與Hp 的慢性感染有關,甲狀腺 MALT 淋巴瘤與橋本甲狀腺炎有關,腮腺MALT 淋巴瘤與乾燥綜合徵有關,丙型肝炎病毒感染與淋巴結邊緣區淋巴瘤和脾邊緣區淋巴瘤有關。
邊緣區淋巴瘤的病理診斷更多的是一種排除法,免疫標記物無特異性,需在除外其他類型的小B 細胞淋巴瘤後方可診斷,CD21 和 CD23 常顯示擴大的FDC 網。病理學形態上常表現爲小的淋巴細胞克隆性增生,引起邊緣區增寬,生髮中心萎縮,可見濾泡“植入”現象和淋巴上皮病變。
4.6.2.3.1 (1)MALT 淋巴瘤:
MALT 淋巴瘤最常見的原發部位是胃腸道,其中胃原發者佔約 80%~85%。約2/3 的患者爲侷限期,1/3 的患者爲廣泛期,骨髓受侵的比例約爲10%~15%。
①胃原發 MALT 淋巴瘤:臨牀特點:症狀包括消化不良、返酸、腹痛和體重減輕等,B 症狀不常見,胃出血比例約爲20%~30%、穿孔比例約爲 5%~10%。Ⅰ期和Ⅱ期患者佔80%~90%,90%的患者 Hp 陽性。胃鏡下可表現爲胃黏膜紅斑、糜爛和潰瘍等。
病理診斷:胃 MALT 淋巴瘤需要胃鏡活檢病理診斷,常規進行 Hp 染色。MALT 淋巴瘤的典型形態是小的淋巴細胞密集增生,多數情況下浸潤並破壞黏膜上皮,形成淋巴上皮病變。IHC 標記物包括 CD3、CD5、CD10、BCL-2、CD19、CD20、CD21、CD23、CD43、PAX5。在除外了FL、CLL/SLL 和MCL後,結合形態及 B 細胞表型方可診斷爲MALT 淋巴瘤。少數病例需要 PCR-Ig 檢測以獲得單克隆依據方可確診。爲了判定胃MALT 淋巴瘤是否具有 Hp 依賴性,可以通過FISH 或PCR法檢測 t(11;18)易位,t(11;18)易位者預示抗Hp 治療效果不佳。當體積大的轉化淋巴細胞呈實性或片狀增生時,應診斷爲 DLBCL 伴有 MALT 淋巴瘤。治療原則:Ⅰ/Ⅱ期:Hp 陽性,t(11;18)陰性或未知患者推薦首選抗 Hp 治療;Hp 陽性,t(11;18)陽性患者首選抗 Hp 治療聯合 ISRT;若存在放療禁忌,也可選擇抗Hp聯合利妥昔單抗治療。對於抗 Hp 治療無效或Hp 陰性患者,推薦首選 ISRT,不適合接受放療的患者,可選擇利妥昔單抗單藥治療。抗 Hp 治療後,首次胃鏡複查可在3 月後,如胃鏡提示病變緩解,以後可每 3~6 個月進行1 次胃鏡檢查。IIE、Ⅲ/Ⅳ期:無治療指徵者可選擇觀察隨診,有治療指徵的患者參考Ⅲ/Ⅳ期 FL 的治療原則,手術治療僅限於發生大出血和穿孔等特殊情況。
②非胃原發 MALT 淋巴瘤:臨牀特點:非胃原發MALT淋巴瘤呈現惰性進程,預後與胃原發MALT 淋巴瘤近似。常見的非胃原發 MALT 淋巴瘤發病部位包括唾液腺、肺、頭頸部、眼附屬器、皮膚、甲狀腺和乳腺等。治療原則:Ⅰ/Ⅱ期首選 ISRT 或手術。因治療可能產生嚴重併發症者也可觀察隨診或利妥昔單抗單藥治療。Ⅲ/Ⅳ期參考Ⅲ/Ⅳ期 FL 的治療策略。
4.6.2.3.2 (2)淋巴結邊緣區淋巴瘤:
臨牀特點:佔所有淋巴瘤的 1.5%~1.8%,中位發病年齡60 歲,男女比例相仿,晚期病變多見。主要累及淋巴結,偶可累及骨髓和外周血。大部分患者表現爲無痛性多發淋巴結腫大,需注意除外MALT淋巴瘤或脾邊緣區淋巴瘤合併淋巴結受累的患者。病理診斷:結構特點與脾邊緣區淋巴瘤相近,免疫表型無特異性,與其他邊緣區淋巴瘤亞型近似。治療原則:參考 FL 的治療原則。預後:5年總生存率爲60%~80%,預後判斷可參考FLIPI。
4.6.2.3.3 (3)脾邊緣區淋巴瘤:
臨牀特點:佔淋巴瘤的2%,中位發病年齡 50 歲,男女比例相當。常累及脾、脾門淋巴結,也常累及骨髓、外周血和肝髒。主要表現爲脾大,可伴有自身免疫性血小板減少、貧血,外周血中可見毛細胞。實驗室檢查須包括丙型肝炎病毒的檢測。病理診斷:組織結構與淋巴結邊緣區淋巴瘤相似,免疫表型無特異性。可依據骨髓或外周血中出現的異常小淋巴細胞,且同時伴有脾大的臨牀表現,在排除了FL、CLL/SLL、MCL 等之後方可診斷。
治療原則:對於無症狀、無進行性血細胞減少、無脾大的患者可先觀察隨診。對伴有脾腫大且丙型肝炎病毒陽性的患者,如無治療禁忌,可給予抗丙型肝炎病毒治療。對伴有脾腫大、丙型肝炎病毒陰性的患者,如無症狀也可先觀察隨診;對有症狀的患者,首選利妥昔單抗單藥治療,利妥昔單抗治療無效的患者,推薦脾切除。對於以上治療後進展的患者,可參考Ⅲ/Ⅳ期 FL 的治療策略。預後:參考 FL 的預後評價。
4.6.2.4 4.CLL/SLL
CLL/SLL 屬於惰性 B 細胞淋巴瘤,CLL 和SLL 是同一種疾病的不同表現,治療方法相同。兩者的主要區別在於CLL表現爲外周血中存在大量、異常的淋巴細胞;而SLL的腫瘤負荷主要位於淋巴結。國際慢性淋巴細胞白血病工作組對SLL 的定義爲:有淋巴結腫大和/或脾大、無因骨髓受侵導致的血細胞減少、外周血克隆性B 細胞數<5×109/L。SLL需由淋巴結活檢的組織病理學確診,而流式細胞學通常足以診斷 CLL,診斷困難時需淋巴結活檢及骨髓活檢。診斷CLL需達到以下標準: 外周血克隆性B 細胞計數≥5×109/L;克隆性 B 細胞表型需經流式細胞術確認;典型的免疫表型爲CD19(+)、CD5(+)、CD23(+)、CD200(+)、CD20(弱+)、CD79b(弱+)、FMC-7(-),CD10(-)、CyclinD1(-)。若外周血克隆性 B 細胞計數未達 5×109/L,但存在因骨髓受侵導致的血細胞減少,仍診斷 CLL。
CLL/SLL 在歐美國家約佔NHL 的7%~10%,是歐美國家最常見的成人白血病類型。亞洲及中國CLL/SLL 的發病率較低,約佔 NHL 的 1%~3%。中位發病年齡65 歲,男女比例1.5∶1~2∶1。
4.6.2.4.1 (1)臨牀表現:
病變通常累及外周血、骨髓、淋巴結和肝脾。臨牀表現多樣,大部分患者可無症狀,部分可出現乏力、自身免疫性貧血、感染、肝脾和淋巴結腫大。
4.6.2.4.2 (2)病理診斷:
典型的CLL/SLL 細胞爲單一性,瀰漫性浸潤,有假濾泡形成(增殖竈),細胞核染色質顆粒狀是其特點,可見增殖中心。IHC 表型:CD5(+)、CD23(+)、CD43(+)或(-)、CD10(-)、CD19(+)、CD20(弱+)、LEF1(+)。需要鑑別 MCL 時,可以增加其他標記物,如Cyclin D1、SOX11。增殖竈的出現易誤診爲反應性增生。前期都有單克隆B細胞增生症。
血常規:白細胞和淋巴細胞持續增高,分類時以分化較好的 CLL 細胞爲主,常>50%,可達80%~90%,其形態類似正常淋巴細胞,但細胞核形不規則、呈深切跡或核裂隙,核染色質呈不規則聚集、胞質量少、灰藍色多無顆粒。破碎細胞(籃狀細胞)多見;可見少量幼稚淋巴細胞增多,通常<2%。當外周血幼稚淋巴細胞>55%時,可診斷爲B-CLL/幼淋巴細胞白血病。晚期可見血小板減少。骨髓細胞學:骨髓有核細胞增生明顯活躍或極度活躍。淋巴系細胞高度增生,以異常的成熟小淋巴細胞爲主,佔40%以上,甚至高達 90%。細胞大小和形態基本與外周血一致,形態異常不明顯,核可有深切跡或裂隙,核染色質不規則聚集,核仁無或不明顯,有少量胞質,無顆粒。還可夾雜一些中到大的淋巴細胞。原始、幼稚淋巴細胞一般<5%。幼稚淋巴細胞數目增多與疾病進展相關。粒系、紅系及巨核系細胞三系明顯減少。當患者伴發溶血時,有核紅細胞可顯著增生。
4.6.2.4.3 (3)分期:
SLL 參考 Ann-Arbor 分期系統,CLL 參考Rai和 Binet 分期系統(見附件 2.2)。
4.6.2.4.4 (4)治療:
①SLL:Ⅰ期患者採用局部放療;Ⅱ~Ⅳ期患者,如無治療指徵可以觀察隨診,有治療指徵時參考CLL 的治療原則。
② CLL:Rai 0~Ⅱ期的低危和中危患者,如無治療指徵則可以觀察隨診;Rai 0~Ⅱ期、有治療指徵或RaiⅢ~Ⅳ期伴持續血細胞減少的患者,根據FISH 檢測的del(17p)和 / 或 TP53 突 變 情 況 、免疫球蛋白重鏈可變區(immunoglobulin heavy chain variable region,IGHV)突變狀態、患者一般狀態和合並疾病等因素,選擇相應的治療方案。應注意 CLL 的支持治療,如腫瘤溶解綜合徵、感染和自身免疫性血細胞減少的處理。
③ 治療指徵:適合參加臨牀試驗;出現明顯的疾病相關症狀,如嚴重乏力、盜汗、體重下降和非感染性發熱;威脅臟器功能;持續增大的大腫塊,如脾大超過左肋緣下6cm,淋巴結直徑>10cm;進行性貧血和進行性血小板減少;激素治療無效的 CLL 伴發自身免疫性疾病。
④ 一線治療方案的選擇:A.無 del(17p)/TP53 突變:伴有嚴重伴隨疾病的虛弱患者(無法耐受嘌呤類似物)或年齡≥65 歲和年齡<65歲但伴有嚴重伴隨疾病(肌酐清除率<70ml/mim)的患者首先推薦伊布替尼治療,其他推薦方案包括:苯達莫司汀+CD20單抗(不推薦用於虛弱患者),高劑量甲潑尼龍+利妥昔單抗,苯丁酸氮芥,利妥昔單抗。
年齡<65 歲,不伴有嚴重合並疾病的患者,推薦的方案包括:伊布替尼,苯達莫司汀+CD20 單抗,FCR(氟達拉濱,環磷酰胺,利妥昔單抗)(IGHV 突變的CLL 患者優選),FR(氟達拉濱,利妥昔單抗),高劑量甲潑尼龍+利妥昔單抗,伊布替尼+利妥昔單抗。
一線治療後的維持治療:對高危患者(外周血微小殘存腫瘤細胞≥10
-4並<10
-2)可以考慮來那度胺維持治療。
B.伴有 del(17p)/TP53 突變:首選推薦伊布替尼;其他推薦方案包括:高劑量甲潑尼龍+利妥昔單抗。⑤復發耐藥患者治療方案的選擇:A.無 del(17p)/TP53 突變:伴有嚴重伴隨疾病的虛弱患者或年齡≥65 歲和年齡<65 歲但伴有嚴重伴隨疾病(肌酐清除率<70ml/mim)的患者首先推薦布魯頓酪氨酸激酶抑制劑(伊布替尼、澤布替尼、奧布替尼),維奈克拉(venetoclax)+利妥昔單抗方案,其他推薦方案包括:苯達莫司汀+利妥昔單抗,劑量減低的FCR,高劑量甲潑尼龍+利妥昔單抗,來那度胺±利妥昔單抗,維奈克拉,劑量增加的利妥昔單抗,苯達莫司汀+利妥昔單抗+伊布替尼。年齡<65 歲,不伴有嚴重合並疾病的患者,首先推薦布魯頓酪氨酸激酶抑制劑(伊布替尼、澤布替尼、奧布替尼)治療,其他推薦方案包括:苯達莫司汀+利妥昔單抗,FCR,高劑量甲潑尼龍+利妥昔單抗,來那度胺±利妥昔單抗,維奈克拉,苯達莫司汀+利妥昔單抗+伊布替尼。二線治療後的維持治療:對於二線治療後獲得CR或PR的患者,可以考慮來那度胺維持治療。B.伴有 del(17p)/TP53 突變:二線以上治療方案首選推薦:布魯頓酪氨酸激酶抑制劑(伊布替尼、澤布替尼、奧布替尼),維奈克拉+利妥昔單抗,維奈克拉;其他推薦方案包括:高劑量甲潑尼龍+利妥昔單抗,來那度胺±利妥昔單抗。
4.6.2.4.5 (5)預後:
不良預後因素包括:IGHV 無突變,del(17p)/TP53 突變,del(11q),複雜核型(≥3 種染色體異常);流式細胞術檢測腫瘤細胞 CD38 陽性≥30%,ZAP-70 陽性≥20%,CD49d 陽性≥30%;β2 微球蛋白增高和分期晚等。
4.6.2.5 5.MCL
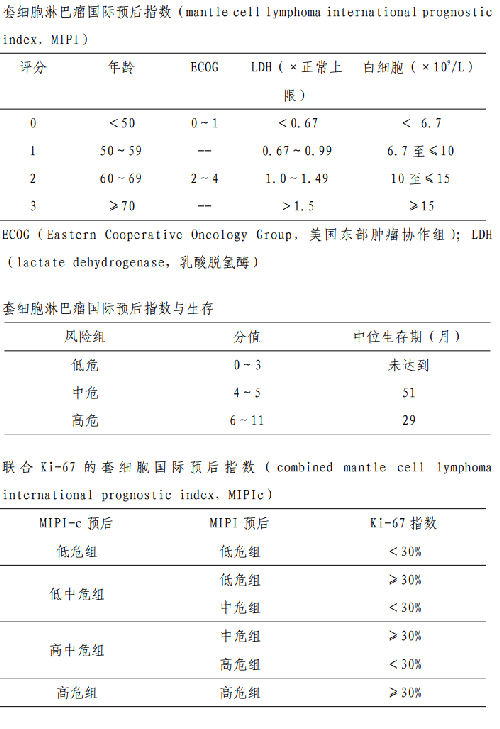
MCL 約佔 NHL 的 3%~10%,男女比例爲2∶1~3∶1,中位發病年齡 65 歲左右。自然病程可以表現爲侵襲性和惰性,但大部分具有侵襲性生長特點。對治療的反應類似惰性淋巴瘤,傳統化療不可治癒。既往多藥聯合化療的生存期約爲3~5 年,近年來隨着 HDT/ASCT、阿糖胞苷及靶向藥物的引入,生存期得到明顯延長。少部分惰性MCL,稱爲白血病樣非淋巴結性 MCL,分子遺傳學變異較少,無del(17p)/TP53突變,不表達或低表達 SOX11,其病程類似於惰性淋巴瘤,預後較好。
4.6.2.5.1 (1)臨牀特點:
最常累及淋巴結、骨髓、消化道、脾臟和咽淋巴環,診斷時 70%爲Ⅳ期。骨髓受侵率可達50%~100%,下消化道受侵率高,內鏡下常表現爲多發性息肉樣病變。
4.6.2.5.2 (2)病理診斷:
MCL 的腫瘤細胞爲形態一致的小至中~大的淋巴細胞,細胞核表面略不規則,生長方式多樣,包括套區性、結節性和瀰漫性。由於預後差,所以鑑別診斷非常重要,需要與 CLL/SLL、FL 和邊緣區淋巴瘤相鑑別。IHC標記物選擇包括 CD20、PAX5、CD3、Cyclin D1、CD10、CD23、MUM-1、CyclinD1、SOX11 和 CD138。典型的免疫表型爲CD19(+)、CD5(+)、CD23(-)、CD200(弱+)、CD20(+)、CD79b(+)、FMC-7(+)、CD10(-)、CyclinD1(+)。大多數患者有 CD5(+)、Cyclin D1(+)的表達,而在Cyclin D1(-)時,可以加做 FISH 檢測 CCND2 和CCND3 以及IHC 檢測SOX11綜合診斷。確診困難,需要尋找其他證據,FISH 檢測t(11;14)對診斷 MCL 的敏感性和特異性都很高。此外,2017 年版WHO造血與淋巴組織腫瘤分類將 MCL 分爲兩種類型:一種爲經典MCL,表現爲 SOX11 陽性,IGHV 無突變,臨牀侵襲性強,預後差,還可以出現更具侵襲性的變異型母細胞型和多型性型,常伴 TP53 突變;另一種爲白血病性結外MCL,常累及外周血、骨髓及脾,表現爲 SOX11 陰性,伴IGHV 突變,臨牀呈惰性,預後較好。
骨髓細胞學:腫瘤細胞累及骨髓時,骨髓塗片中可見數量不等的異常淋巴細胞增多,腫瘤細胞胞體大小不一,胞核多爲圓形或輕度不規則,多見一個大而畸形的核仁,染色質細緻彌散,胞質較豐富,呈淡藍色。
4.6.2.5.3 (3)治療:
對 MCL 患者應進行全面檢查,準確分期,以指導治療方案選擇。發生母細胞變或有中樞神經系統症狀者應進行腦脊液和腦 MRI 檢查,對於擬診爲Ⅰ期或Ⅱ期的患者,應進行內鏡檢查除外胃腸道侵犯。
① 治療策略:Ⅰ期或侷限Ⅱ期不伴有大腫塊者,推薦可採用單純 ISRT 或常規劑量強度的免疫化療±ISRT。
廣泛Ⅱ期不伴有大腫塊者,推薦常規劑量強度免疫化療。某些具有惰性臨牀特徵者,如白血病樣非淋巴結性MCL伴脾大、SOX11 陰性[IGHV 突變型],無TP53 突變或缺失以及腫瘤負荷低、Ki-67 增殖指數<10%等,可以觀察隨診。Ⅱ期伴有大腫塊和Ⅲ/Ⅳ期具有侵襲性臨牀特徵的患者,若適合 HDT/ASCT,推薦高劑量強度誘導化療後序貫HDT/ASCT;不適合 HDT/ASCT 的患者,推薦參加臨牀試驗或常規劑量強度的治療。屬於惰性特徵的患者,如無症狀或治療指徵,可以觀察隨診。有症狀或治療指徵者,需根據是否存在TP53突變,選擇相應的治療。
② 一線治療方案:高劑量強度方案:首選R-DHA(利妥昔單抗,地塞米松,阿糖胞苷)+鉑類(卡鉑、順鉑或奧沙利鉑),R-CHOP/R-DHAP 交替方案,NORDIC(強化劑量的R-CHOP[maxi-CHOP]與利妥昔單抗+高劑量阿糖胞苷交替)方案,HyperCVAD,利妥昔單抗,苯達莫司汀序貫利妥昔單抗和高劑量阿糖胞苷;其他推薦方案:苯達莫司汀+利妥昔單抗。
常規劑量強度方案:推薦苯達莫司汀+利妥昔單抗,VR-CAP(硼替佐米,利妥昔單抗,環磷酰胺,阿黴素和潑尼松),R-CHOP,來那度胺+利妥昔單抗;其他推薦方案:改良的 R-HyperCVAD 方案(用於<60 歲患者),RBAC500(利妥昔單抗,苯達莫司汀,阿糖胞苷)。鞏固治療:可以考慮 HDT/ASCT。
維持治療:利妥昔單抗。
③二線治療方案:可以選擇一線方案未應用的方案或藥物。推薦的首選方案包括:BTK 抑制劑(伊布替尼、澤布替尼、奧布替尼);來那度胺+利妥昔單抗;其他推薦方案包括:苯達莫司汀+利妥昔單抗,苯達莫司汀+利妥昔單抗+阿糖胞苷,硼替佐米±利妥昔單抗;R-DHAP,R-DHAX(地塞米松,阿糖胞苷,奧沙利鉑),R-GemOx,BTK 抑制劑+來那度胺+利妥昔單抗,BTK 抑制劑+維奈克拉,維奈克拉±利妥昔單抗等。二線治療後的鞏固治療:異基因造血幹細胞移植。
4.6.2.5.4 (4)預後:
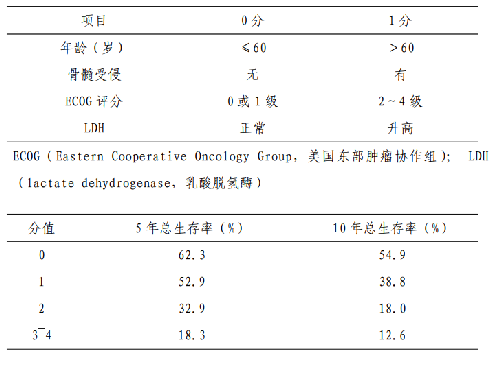
IPI 源於侵襲性淋巴瘤的生存數據,也可以作爲 MCL 的預後指標,但預後判斷效能較差。簡易套細胞淋巴瘤國際預後評分系統(international prognosticindexfor mantle cell lymphoma,MIPI)對MCL 的預後分層效果較好,被廣泛採用。其他不良預後因素還包括Ki-67、TP53突變和母細胞轉化等。其中 Ki-67>30%是獨立於MIPI的最重要的生物學預後指標,聯合Ki-67 的套細胞國際預後指數( combined mantle cell lymphoma internationalprognostic index,MIPIc)能夠更好地區分預後,也被推薦採用(見附件 4.4)。TP53 突變患者應用傳統方案和HDT/ASCT 等治療的療效欠佳,TP53 突變與Ki-67>30%和母細胞樣細胞形態相關。
4.6.2.6 6.伯基特淋巴瘤
伯基特淋巴瘤屬於高度侵襲性NHL。可分爲地方流行性、散發性和免疫缺陷相關性3個變異型。伯基特淋巴瘤約佔NHL的 3%~5%,約佔兒童 NHL 的 40%。
4.6.2.6.1 (1)臨牀特點:
流行性伯基特淋巴瘤主要發生於非洲赤道地區和巴西東北部,高峯發病年齡在4~7 歲,男女之比爲 2∶1,多累及頜骨,EB 病毒陽性率>95%。散發性伯基特淋巴瘤散佈於世界各地,主要發生在兒童和青年,男女之比爲 2∶1~3∶1,腹部受累多見,EB 病毒陽性率<30%。免疫缺陷相關型多發生於艾滋病患者,常累及淋巴結和骨髓。伯基特淋巴瘤是細胞倍增週期最短的腫瘤,生長迅速。伯基特淋巴瘤結外受侵常見,頭頸、腹部、骨髓和中樞神經系統等是其最常受累及的部位。
4.6.2.6.2 (2)病理診斷:
經典型伯基特淋巴瘤形態學表現爲較均一的中等大小腫瘤性 B 細胞瀰漫增生,核分裂象及凋亡很明顯,常見星空現象。腫瘤細胞起源於生髮中心,IHC免疫表型常表現爲 sIgM(+)、單一輕鏈(+)、CD19(+)、CD20(+)、CD22(+)、c-Myc(+)、CD10(+)、Bcl6(+)、Bcl2(-或弱+)、CD5(-)、CD23(-)、MUM-1(-)和TdT(-)。增殖指數非常高,Ki-67 近 100%。即使形態學、免疫表型都是典型的伯基特淋巴瘤,也要進行FISH MYC 檢測,其中t(8;14)佔約 80%,t(2;8)和t(8;22)佔15%;鑑別診斷包括形態學、免疫表型都是典型的伯基特淋巴瘤,但無MYC異常者,歸入高級別 B 細胞淋巴瘤,非特指型。EBER檢測對伯基特淋巴瘤是必須的,但我國更多的是散發性患者,EBER(-)多見。
骨髓細胞學:骨髓增生明顯活躍或極度活躍。典型的伯基特淋巴瘤細胞爲中到大的淋巴細胞,大小不一併易見成堆分佈;白血病細胞胞核較大,多爲圓形或不規則形,核染色質呈粗顆粒狀,有 l 個至多個大小不等的明顯核仁;胞質量多少不定,強嗜鹼性並含有大小不一、數量較多的脂質空泡呈穿鑿樣,細胞核上也可見空泡。塗片中退化細胞多見,粒系、紅系細胞增生受抑制。
4.6.2.6.3 (3)治療原則:
以化療爲主,但CHOP 方案療效不理想,高劑量強化治療及聯合利妥昔單抗可提高療效。應進行中樞神經系統預防性治療,並充分預防腫瘤溶解綜合徵的發生。伯基特淋巴瘤可選擇的化療方案包括:CODOX-M+利妥昔單抗、CODOX-M/IVAC 方案、DA-EPOCH-R 或R-HyperCVAD/HD-MA方案等。對於腫瘤負荷低的低危患者,3 週期治療達CR後,再進行一個週期的鞏固治療後即可結束治療。診斷時已存在腦實質受侵的患者,第一週期的治療應從包含可以透過血腦屏障藥物的方案開始。選擇 DA-EPOCH-R 方案時應聯合鞘內注射 MTX,該方案不適合存在腦實質受侵的患者。沒有明確可推薦的二線解救方案,可考慮選擇R-ICE、R-GDP、R-IVAC、高劑量阿糖胞苷+利妥昔單抗等方案,解救治療後達 CR 的患者可考慮 HDT/ASCT 或異基因造血幹細胞移植。
4.6.2.6.4 (4)預後:
年齡>40 歲、一般情況差、分期晚、LDH增高、骨髓和中樞神經系統受侵和人類免疫缺陷病毒陽性等預後不良。
4.6.2.7 7.淋巴母細胞淋巴瘤
淋巴母細胞淋巴瘤(lymphoblastic lymphoma,LBL)佔成人 NHL 的 3%~4%,佔兒童NHL 的40%左右。屬於高度侵襲性淋巴瘤。可以分爲 T 細胞來源(T-LBL)和B細胞來源(B-LBL),T-LBL 佔 LBL 的80%以上,B-LBL 約佔LBL的10%~15%。LBL 與急性淋巴細胞白血病(acute lymphocyteleukemia,ALL)是屬於不同臨牀表現及不同發展階段的同一種疾病,2017 年版 WHO 造血與淋巴組織腫瘤將骨髓中原始和幼稚淋巴細胞比率≥20%定義爲ALL。
4.6.2.7.1 (1)臨牀表現:
T-LBL 的典型臨牀表現爲前縱隔巨大腫塊所致的咳嗽、氣短,可伴有胸腔積液,骨髓及中樞神經系統受侵常見。B-LBL 往往表現爲淋巴結腫大,以皮膚或骨受侵常見。
4.6.2.7.2 (2)病理診斷:
在細胞形態上,LBL 主要表現爲中等大小的腫瘤細胞呈瀰漫性生長,細胞核圓形、不規則或扭曲,核仁不明顯,胞質少,染色質細,核分裂易見。LBL免疫表型以 TdT(+)爲特點,也可以增加CD99、CD34、CD10協助母細胞分化的判定。其中 B-LBL 的免疫表型爲sIg(-)、cIg(+)、CD10(+)、CD19(+)、CD20(-)或(+)、CD79(+)、PAX5(+);T-LBL 的免疫表型爲CD3ε(+)或(-)、CD2(+)、CD4(+)、CD8(+)、CD1a(+)或(-)和CD7(+)。CD7、CD43不能單獨作爲 T 淋巴細胞的標記物。細胞幼稚時,需要增加CD34、CD117、MPO、Lys 等檢測,以鑑別急性髓細胞白血病。由於 LBL 來源於不成熟階段的淋巴細胞,可出現腫瘤細胞同時表達 B 或 T 淋巴細胞的標記,甚至表達NK 或髓系細胞的分子標記,這種情況不少見,尤應注意。當病變發生在縱隔時,需要追加上皮相關標記物(如AE1/AE3 和CK19等)和T/B 細胞基因克隆性重排來鑑別胸腺瘤,以免誤診。B-LBL常伴發有一些特定基因異常,如BCR-ABL1、ETV6-RUNX1及KMT2A 重排等,在條件允許情況下,建議行相關分子遺傳學檢查。
骨髓細胞學:骨髓有核細胞增生多爲極度活躍或明顯活躍,以原始和幼稚淋巴細胞增生爲主,常伴有形態異常;原始淋巴細胞外形呈圓形、橢圓形或有尾狀突起;胞核多爲圓形,核大,核染色質粗細不均、排列不規則,核可見凹陷、摺疊、切跡及裂痕等。細胞胞質量少,核漿比高。粒系增生明顯受抑制,粒細胞顯著減少,甚至不見。紅系細胞增生也明顯受抑,幼紅細胞少見或不見。巨核系細胞多數顯著減少或不見,血小板少見。退化細胞明顯增多。核分裂象細胞易見。在 T 急性淋巴母細胞淋巴瘤中發現有嗜酸性粒細胞在淋巴瘤細胞周圍浸潤,需排除嗜酸性粒細胞增多和髓系增生伴有 FGFR1 基因的 8p11.2 細胞遺傳學異常。血常規:白細胞多數增高,少數可高達100×109/L。
4.6.2.7.3 (3)治療原則及治療方案:
無論是Ⅰ期還是Ⅳ期患者,均應按全身性疾病治療。LBL 患者應採用ALL 的治療方案,對於年輕成人患者,兒童 ALL 治療方案的療效優於成人方案。治療過程包括誘導治療,鞏固強化,維持治療等幾個階段。爲預防腫瘤溶解綜合徵,可先採用糖皮質激素+環磷酰胺預處理。根據不同的年齡階段,如兒童、年輕成人和成人,選擇 多 藥 聯 合 的 治 療 方 案 ,推薦的治療方案包括:Berlin-Farnkfurt-Münster 方案(環磷酰胺,長春新鹼,柔紅黴素,地塞米松,阿糖胞苷,甲氨蝶呤,培門冬酶和潑尼松),Hyper-CVAD/MA 等。如爲Ph+B-ALL,需聯合BCR-ABL酪氨酸酶抑制劑。所有患者均應進行中樞神經系統預防性治療,且儘早開始。誘導治療達到CR 的患者,需進一步檢測微小殘存病變(minimal residual disease,MRD),如果MRD陽性,推薦異基因造血幹細胞移植;MRD 陰性,推薦維持治療或對高危患者進行異基因造血幹細胞移植。
4.6.2.7.4 (4)預後:
兒童 LBL 預後明顯優於成人。其他不良預後因素包括白細胞高、中樞神經系統受累、達到CR的時間長、誘導化療結束後有殘存病變等。與預後不良相關的基因異常包括:亞二倍體(<44 條染色體)、t (9;22)(q34;q11.2):BCR-ABL1、BCR-ABL1 樣(Ph 樣)、KMT2A重排(t[4;11])、t(v;14q32)/IgH、t(17;19):TCF3-HLF融合、複雜核型(≥5 條染色體異常)、IKZF1 基因變異、21號染色體內擴增(intrachromosomal amplificationofchromosome 21,iAMP21)。t(12;21)(p13;q22):ETV6-RUNX1和多倍體(具有染色體 4、10 和17 三倍體的患者顯示有更好的預後)與預後良好相關。
4.6.2.8 8.外周 T 細胞淋巴瘤,非特指型
外周 T 細胞淋巴瘤(peripheral T-cell lymphoma,PTCL)是一組起源於胸腺後成熟 T 淋巴細胞的淋巴系統惡性腫瘤。外周 T 細胞淋巴瘤,非特指型(peripheral T-cell lymphoma,not otherwise specified,PTCL-NOS)在歐美國家佔所有NHL 的 7%~10%,亞洲國家發病率明顯高於歐美,佔所有NHL的 15%~22%。由於其在形態學、免疫學、遺傳學和臨牀表現上都無特異性,所以只有在排除其他獨立分型的T 細胞淋巴瘤後,方能做出 PTCL-NOS 的診斷。
4.6.2.8.1 (1)臨牀表現:
常見於中老年人,中位發病年齡55歲,PTCL-NOS 無明顯性別差異。多表現爲淺表淋巴結腫大,半數伴 B 症狀。結外常累及皮膚及皮下組織、肝脾、消化道、甲狀腺及骨髓等。診斷時多爲Ⅲ期或Ⅳ期。
4.6.2.8.2 (2)病理診斷:
PTCL-NOS 是成熟(外周)T 細胞發育階段的腫瘤。病理組織學爲豐富的高內皮小血管增生、上皮樣組織細胞增生及炎性細胞浸潤的混合性背景。瘤細胞形態多樣且變化大,可以由小、中等或大細胞組成,多數爲中到大細胞,胞質淡染,胞核多形性,不規則,染色質多或泡狀,核仁明顯,核分裂象多見;常見免疫表型爲CD3(+)、CD4(+)>CD8(+)、CD5(+)、CD45RO(+)、CD7(-)、CD8(-)。腫瘤細胞常表達 CD3ε和 CD2 等T 細胞相關抗原,而丟失一種或多種其他成熟 T 細胞抗原(CD5 或CD7),提示T細胞存在克隆性增殖;同時,PTCL-NOS 的TCR 基因常表現爲克隆性重排,當其與淋巴組織反應性改變鑑別困難時,可藉助TCR基因重排檢測方法來輔助診斷。診斷時還需要注意鑑別濾泡輔助 T 細胞來源的淋巴瘤,如血管免疫母細胞性T 細胞淋巴瘤、淋巴結外周 T 細胞淋巴瘤伴濾泡輔助T 細胞表型和淋巴結濾泡輔助 T 細胞淋巴瘤等。此外,在DLBCL 的細胞多形性明顯時,酷似 T 細胞特點,也需要進行鑑別,所以B細胞標記物(如 CD20 和 PAX5 等)不可缺少。在伴有多量漿細胞增生時,請注意漿細胞的克隆性。骨髓細胞學:骨髓有核細胞增生多明顯活躍,以淋巴細胞增生爲主,成人型 T 細胞性白血病細胞常>10%,可高達80%以上。粒系細胞、幼紅細胞及巨核細胞常減少。
4.6.2.8.3 (3)治療:
① 治療原則:PTCL-NOS 本身是一組異質性的疾病,其最佳治療方案和治療策略仍在探索中。Ⅰ~Ⅳ期患者首先推薦參加合適的臨牀試驗,或 4~6 個週期化療±ISRT。對於治療後達 CR 的患者,可以考慮參加合適的臨牀試驗、HDT/ASCT 或停藥觀察。復發難治的PTCL-NOS 患者,亦首先推薦參加臨牀試驗,或應用二線方案及姑息放療;二線治療達到 CR 的患者可以考慮 HDT/ASCT 或異基因造血幹細胞移植。② 一線治療方案:首選推薦:CHOP,CHOEP,DA-EPOCH;其他方案包括:CHOP 序貫 IVE(異環磷酰胺,依託泊苷,表阿黴素),hyperCVAD/MA。
③ 二線治療方案:優先參加臨牀試驗。首選推薦的治療方案包括:西達本胺,維布妥昔單抗(CD30 陽性者),DHAP,DHAX,ESHAP,GDP,GemOX,ICE 等。其他推薦方案包括:苯達莫司汀、吉西他濱、來那度胺或GVD(吉西他濱,長春瑞濱,脂質體阿黴素)。
4.6.2.8.4 (4)預後:
PTCL-NOS 總體預後差於侵襲性B 細胞淋巴瘤患者,5 年生存率約 30%。預後評分系統包括IPI和PTCL-NOS 預後指數(prognostic index for peripheralT-cell lymphoma,not otherwise specified,PIT),PIT包括年齡>60 歲、LDH 增高、ECOG PS 評分≥2 和骨髓受侵(附件 4.5)。
4.6.2.9 9.蕈樣肉芽腫和塞扎裏綜合徵
蕈樣肉芽腫和塞扎裏綜合徵(mycosisfungoides/sézary syndrome,MF/SS)是最常見的皮膚T細胞淋巴瘤(cutaneous T cell lymphoma,CTCL),佔NHL的 2%~3%。MF 佔 CTCL 的 60%,SS 僅佔5%。MF 是一種惰性病程的原發皮膚的成熟 T 細胞淋巴瘤,患者多表現爲間斷、穩定或緩慢發展的皮損。皮膚外組織,主要是淋巴結及外周血的累及,提示進入晚期。SS 是一種MF 的變異型,表現爲侵襲性紅皮病性白血病
4.6.2.9.1 (1)臨牀特點:
MF 臨牀表現爲多發性皮膚紅斑、斑塊和瘤樣結節。全身皮膚均可發生,常伴明顯瘙癢。病程呈反覆性進展,病變可侷限於皮膚數月、數年、甚至幾十年,在疾病晚期可發生淋巴結和內臟受侵。約10%的皮損表現爲廣泛性紅皮病。SS 表現爲廣泛性紅皮病伴外周血受侵(循環血中異常細胞佔淋巴細胞比例>5%),在皮損組織、淋巴結和外周血中可見到塞扎裏細胞。診斷SS 應符合以下條件:塞扎裏細胞絕對值≥1×109/L,CD4+/CD8+細胞的比值≥10,腫瘤細胞免疫表型爲 CD3(+),CD4(+),CD5(+),CD45RO(+),CD7(-),CD8(-)和存在T 細胞克隆性增殖的證據。
4.6.2.9.2 (2)病理診斷:
MF 的診斷比較困難,可能需要經過幾年的觀察、多次活檢才能確診。小的、多形核淋巴細胞聚集在表皮或表真皮交界處,向表皮浸潤,形成Pautrier微膿腫是其特點。SS 最主要的特徵與MF 類似。MF 免疫表型通常爲成熟輔助 T 細胞的表型,爲CD3ε(+)、CD4(+)、CD45RO(+)、CD8(-)。偶見 CD4(-)、CD8(+)的成熟T 細胞表型,存在 T 細胞克隆性增殖的證據。本病需要與濾泡輔助性T細胞來源的淋巴瘤鑑別。MF 非腫塊期的病理診斷困難,需要注意與非特異性皮炎鑑別,必須密切結合臨牀。
4.6.2.9.3 (3)分期:
4.6.2.9.4 (4)治療原則:
MF 和 SS 目前尚無根治性治療方法,主要依據分期選擇合適的治療。治療主要目的是控制皮損範圍,減輕症狀及降低進展風險。多數情況下治療不能獲得持久緩解。初期病變的治療,應選擇低毒性和低累積毒性的方法,達到可以持久或維持治療的目的。當需要化療時,建議首選單藥治療,因聯合治療亦不能明顯延長緩解時間。不同部位的病變,如皮膚、淋巴結或外周血對治療的反應性並不完全一致,療效與預後的關係亦不明確,臨牀症狀和體徵的變化可以作爲療效判斷的基礎。停止治療一段時間後,當再次出現病變進展時,恢復此前的治療方法或藥物,有可能繼續有效。預防和控制皮膚感染以及緩解瘙癢也是重要的治療環節。早期皮損不宜採用強烈的治療,以採用單一或綜合應用多種局部治療手段爲主;ⅡB 期、Ⅲ期、Ⅳ期和難治性病變可採用包括全身系統治療在內的綜合治療或參加合適的臨牀試驗。針對皮膚病變的治療方法包括:放療、光照療法,外用皮質類固醇、氮芥軟膏或維甲酸等。全身性藥物治療推薦選擇維布妥昔單抗、干擾素、甲氨蝶呤(≤50mg/周)、吉西他濱、脂質體阿黴素、維 A 酸等。
4.6.2.9.5 (5)預後:
MF 患者的預後較好,5 年生存率近90%,不良預後因素包括 T3/T4 期患者、伴有皮膚外病變和年齡≥65 歲。SS 患者預後通常不佳,中位生存期約2~4 年。
4.6.2.10 10.NK/T 細胞
淋巴瘤NK/T細胞淋巴瘤中最常見的類型是結外NK/T細胞淋巴瘤,鼻型。通常發生於上呼吸道,包括鼻腔、鼻咽、副鼻竇、扁桃體、下嚥和喉;也可以累及鼻外,皮膚、睾丸和胃腸道是最常見的鼻外受累部位。此型淋巴瘤在亞洲較歐美常見,是中國最常見的外周 T 細胞淋巴瘤類型,佔所有外周T細胞淋巴瘤的 40%~50%。
4.6.2.10.1 (1)臨牀特點:
年輕男性多見,B 症狀常見,腫瘤常侷限於鼻腔或侵犯鄰近組織。早期病變佔70%~90%。常見的症狀和體徵爲鼻塞或鼻出血以及頸部淋巴結腫大。
4.6.2.10.2 (2)病理診斷:
結外 NK/T 細胞淋巴瘤,鼻型病理學特徵爲瀰漫性淋巴瘤細胞浸潤,呈血管中心性、血管破壞性生長,導致組織缺血壞死及黏膜潰瘍。壞死很常見,是導致漏診的主要原因。診斷需要的 IHC 標記物包括CD3、CD56、CD2、CD4、CD5、CD7、CD8、CD45RO、CD20、PAX5、TIA-1、顆粒酶 B、Ki-67 及 EBER 等。典型的免疫表型爲CD2(+)、CD3(+)、CD56(+)、TIA-1(+)、顆粒酶B(+)和EBER(+)。EBER(-)時診斷要謹慎,如果CD56(+)、CD3(+)、細胞毒性 T 細胞標誌物均表達可以診斷,如果CD3(-)、CD56(-),則診斷 PTCL-NOS。60%~90%的結外NK/T 細胞淋巴瘤無TCR基因重排。本病需注意與未分化癌相鑑別,應增加CK、EMA等上皮標記物檢測。
骨髓細胞學:腫瘤細胞呈圓形或橢圓形、可見僞足樣突起;胞核多呈圓形,染色質細顆粒狀,核仁多個但不明顯;胞質量中等、深藍色,可見空泡。累及胸腔時,胸水中可見腫瘤細胞。
4.6.2.10.3 (3)治療:
① 治療原則:需區分原發於鼻腔或上呼吸道和原發於鼻外的患者。因對放療敏感,早期患者應採用化放療聯合治療策略。Ⅰ/Ⅱ期(原發鼻腔型):不適合化療的患者,推薦單純放療或參加合適的臨牀試驗;適合化療的患者,推薦參加合適的臨牀試驗或化放療聯合治療,化療週期數2~4個。Ⅳ期(原發鼻腔型)或Ⅰ~Ⅳ期(原發鼻腔外)推薦參加合適的臨牀試驗或門冬酰胺酶爲主的聯合方案化療±放療。
② 一線化療方案:P-GemOx(吉西他濱,培門冬酶,奧沙利鉑),DDGP(地塞米松,順鉑,吉西他濱,培門冬酶),SMILE(地塞米松,甲氨蝶呤,異環磷酰胺,培門冬酶,依託泊苷)。
同步化放療的推薦方案:DeVIC(地塞米松,依託泊苷,異環磷酰胺,卡鉑),VIPD(依託泊苷,異環磷酰胺,順鉑,地塞米松)。
③ 二線治療方案:DAHP,DHAX,ESHAP,GDP,GemOx,ICE,西達本胺等。
4.6.2.10.4 (4)預後因素:
目前國際上常用的預後模型爲NK/T細胞淋巴瘤預後評分系統(Prognostic Index of NaturalKiller Lymphoma,PINK)和聯合EB 病毒DNA 的NK/T細胞淋巴瘤預後評分系統(Prognostic Index of NaturalKillerLymphoma with Epstein-Barr Virus DNA,PINK-E)。PINK模型的不良預後因素包括年齡>60 歲、遠處淋巴結侵犯、III/IV 期、鼻外原發,如果納入血漿中是否可以檢測到EBV-DNA 則爲 PINK-E 模型。見附件4.6。
說明:本診療指南是基於臨牀研究證據和專家共識制定的。推薦的治療方案主要基於中國已批准具有治療適應證的藥物,同時介紹了國內外研究進展。在決定患者治療方案時,應該充分根據每位患者的疾病特點和臨牀表現,給予患者規範而個體化的治療。
5 附件
5.1 附件 1.世界衛生組織造血和淋巴組織腫瘤分類淋巴瘤部分(2017 年修訂版)
淋巴瘤類型
B 淋巴母細胞白血病/淋巴瘤伴 t(9;22)(q34.1;q11.2);BCR-ABL1
B 淋巴母細胞白血病/淋巴瘤伴 t(v;11q23.3);KMT2A 重排
B 淋巴母細胞白血病/淋巴瘤伴 t(12;21)(p13.2;q22.1);ETV6-RUNX1
B 淋巴母細胞白血病/淋巴瘤伴超二倍體B 淋巴母細胞白血病/淋巴瘤伴低二倍體
B 淋巴母細胞白血病/淋巴瘤伴 t(5;14)(q31.1;q32.3);IL3-IGH
B 淋巴母細胞白血病/淋巴瘤伴 t(1;19)(q23;p13.3);TCF3-PBX1
4. 脾邊緣區淋巴瘤
Waldentrom 巨球蛋白血癥
8. 意義未明的單克隆丙種球蛋白病,IgM 型
μ重鏈病
ɑ重鏈病
γ重鏈病
意義未明的單克隆丙種球蛋白病,非 IgM 型
骨的孤立性漿細胞瘤
骨外漿細胞瘤
輕鏈和重鏈沉積病
12. 濾泡性淋巴瘤
原位濾泡性腫瘤
生髮中心 B 細胞亞型a
活化 B 細胞亞型
21. EBV 陽性的瀰漫大 B 細胞淋巴瘤,非特指型22. EBV 陽性黏膜皮膚潰瘍
24. 淋巴瘤樣肉芽腫病,1/2 級
25. 淋巴瘤樣肉芽腫病,3 級
多中心性 Castleman 病
32. 伯基特淋巴瘤
33. 伴有 11q 異常的伯基特樣淋巴瘤a
伴有 MYC 和 BCL2 和/或 BCL6 重排
35. 介於瀰漫大 B 細胞淋巴瘤與典型霍奇金淋巴瘤間的不能分類型B 細胞淋巴瘤
2. T 細胞大顆粒淋巴細胞性白血病
5. 兒童 EBV 陽性 T 細胞和 NK 細胞淋巴增殖性疾病
T/NK 細胞型慢性活動性 EBV 感染,系統型種痘水皰病樣淋巴組織增殖性疾病
重度蚊蟲叮咬性過敏症
14. 蕈樣真菌病
15. 塞扎裏綜合徵
16. 原發皮膚 CD30 陽性的 T 細胞淋巴增殖性疾病淋巴瘤樣丘疹病
原發皮膚 CD8 陽性的侵襲性親表皮細胞毒性T 細胞淋巴瘤a
19. 血管免疫母細胞 T 細胞淋巴瘤和其他 T 濾泡輔助細胞來源的淋巴結淋巴瘤
伴濾泡輔助 T 細胞表型淋巴結的外周 T 細胞淋巴瘤20. 間變性大細胞淋巴瘤,ALK 陽性
霍奇金淋巴瘤
1. 經典霍奇金淋巴瘤
富於淋巴細胞型
混合細胞型
淋巴細胞消減型
注:IRF4(interferon regulatory factor 4,干擾素調節因子4);EBV(Epstein-Barr virus,EB 病毒);HHV8(human herpes virus 8,人類皰疹病毒 8 型); ALK(anaplastic lymphoma kinase,間變性淋巴瘤激酶);a斜體表示暫定名。
5.2 附件2. 淋巴瘤的分期系統
5.2.1 附件 2.1 Ann-Arbor (Cotswolds 修訂)分期系統。
Ⅰ期:侵及一個淋巴結區(Ⅰ),或侵及一個單一的淋巴結外器官或部位(ⅠE);
Ⅱ期:在橫膈的一側,侵及二個或更多的淋巴結區(Ⅱ)或外加侷限侵犯一個結外器官或部位(ⅡE);
Ⅲ期:受侵犯的淋巴結區在橫膈的兩側(Ⅲ)或外加侷限侵犯一個結外器官或部位(ⅢE)或脾(ⅢS)或 二者均有(ⅢES);
Ⅳ期:瀰漫性或播散性侵犯一個或更多的結外器官,同時伴有或不伴有淋巴結侵犯。
A 組:無全身症狀;
B 組:有全身症狀,包括不明原因發熱(>38℃,連續3 天及以上)、盜汗(連續 7 天及以上)或體重減輕(6 個月內下降 10%以上);
E:淋巴瘤累及淋巴結外器官。單一結外部位受侵,病變侵犯到與淋巴結/淋巴組織直接相連的器官/組織時,不記錄爲Ⅳ期,應在各期後記入“E”字母 (如病變浸潤至與左頸部淋巴結相連結的皮膚,記錄爲“IE”);
X:大瘤塊,腫瘤直徑>胸廓寬度的 1/3 或融合瘤塊最大徑>10cm。
5.2.2 附件 2.2 慢性淋巴細胞白血病的Rai 分期和Binet 分期系統
Rai 分期
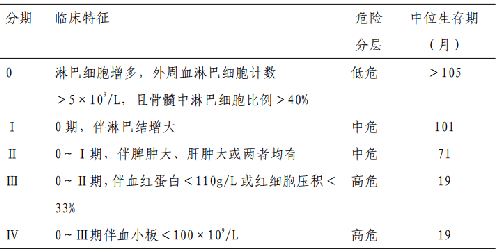
Binet 分期

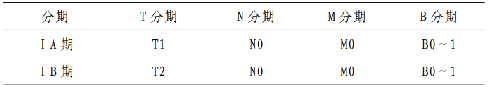
5.2.3 附件 2.3 蕈樣黴菌病和塞扎裏綜合徵TNMB 分期系統
分期 定義
皮膚(T)
T1 期 侷限性斑片、丘疹和/或斑塊,<10%體表面積T2 期 斑片、丘疹和/或斑塊,≥10%體表面積
T3 期 1 個或更多腫塊形成(直徑≥1 cm)
T4 期 融合性紅斑≥80%體表面積
淋巴結(N)
N1 期 異常淋巴結;組織病理爲 Dutch 1 級或 NCI LN 0~2 級N2 期 異常淋巴結;組織病理爲 Dutch 2 級或 NCI LN 3 級N3 期 異常淋巴結;組織病理爲 Dutch 3~4 級或NCI LN 4 級Nx 期 異常淋巴結;無組織學確認
內臟(M)
M1 期 內臟受累(須有病理學確診和註明受侵器官)Mx 期 內臟不正常;無組織學確診
血液(B)
B0 期 無明顯血液受累:異型細胞(塞扎裏細胞)佔外周血淋巴細胞比例≤5%
B1 期 低負荷血液受累:異型細胞(塞扎裏細胞)佔外周血淋巴細胞比例>5%,但未達到 B2 水平
B2 期 高負荷血液受累:異型細胞(塞扎裏細胞)≥1 000/ul 或CD4(+)/CD7(-)細胞比例≥40%或 CD4(+)/CD26(-)細胞比例≥30%
5.2.4 附件 2.4 Lugano 胃腸淋巴瘤分期系統
Ⅰ期:病變侷限於胃腸道
Ⅰ期:侵及黏膜、黏膜下層
Ⅰ期:侵及固有肌層、漿膜層
Ⅱ期:病變擴散至腹腔
Ⅱ期:累及局部淋巴結
Ⅱ期:累及遠隔淋巴結
5.2.5 附件 2.5 鼻型 NK/T 細胞淋巴瘤CA 分期系統
Ⅰ期:病竈侵犯鼻腔或鼻咽,不伴腫瘤局部侵犯(皮膚、骨、鼻旁竇)Ⅱ期:非鼻型病變或病竈侵犯鼻腔或鼻咽,伴有局部侵犯(皮膚、骨、鼻旁竇)
Ⅲ期:病竈伴有區域淋巴結侵犯
5.3 附件3 淋巴瘤療效判定標準
5.3.1 附件 3.1 Deauville 五分量表
評分(分) PET-CT 檢查結果
1 無攝取
2 病竈或者其他正常組織的攝取值≤縱隔
3 病竈或者其他正常組織的攝取值>縱隔但≤肝
5 病竈或者其他正常組織的攝取值明顯高於肝臟和/或新病竈X 新的攝取區域不太可能與淋巴瘤有關
5.3.2 附件 3.2 Lugano 2014 淋巴瘤治療效果評價標準



5PS(five-point scale,5 分法);5PS 評分爲 3 分時,在多數患者中通常預示標準治療下預後良好,尤其是中期評效時,但在涉及 PET 的降階梯臨牀試驗中,爲避免治療不足,3 分通常認爲預後不佳;可測定病竈的定義:1)淋巴結:需按區域劃分,最好納入縱隔和腹膜後區域;2)非淋巴結病竈:包括實體器官(如肝、脾、腎、肺等)、消化道、皮膚、可初診的病竈。PET-CT(positron emission tomography-computed tomography,正電子發射計算機體層成像); FDG(fluorodeoxyglucose,氟代脫氧葡萄糖)。
5.4 附件 4. 淋巴瘤的預後評分系統
5.4.1 附件 4.1 HL 預後評分

5.4.2 附件 4.2 瀰漫大 B 細胞淋巴瘤預後評分
國際預後指數(International Prognostic Index,IPI)
修正的國際預後指數(Revised IPI,R-IPI)

5.4.3 附件 4.3 濾泡性淋巴瘤預後評分
5.4.4 附件 4.4 套細胞淋巴瘤預後評分
5.4.5 附件 4.6 NK/T 細胞淋巴瘤預後評分系統

5.5 附件 5 淋巴瘤診療指南(2022年版)編寫審定專家組
(按姓氏筆畫排序)
組長:石遠凱
成員:馬軍、王華慶、盧曉陽、馮利、朱軍、朱明清、朱雄增、李曄雄、林桐榆、郭小毛、姜文奇、高子芬、秦燕、謝傳淼