2 附錄Ⅺ A 抗生素微生物檢定法
本法系在適宜條件下,根據量反應平行線原理設計,通過檢測抗生素對微生物的抑制作用,計算抗生素活性(效價)的方法。
抗生素微生物檢定包括兩種方法,即管碟法和濁度法。測定結果經計算所得的效價,如低於估計效價的90%或高於估計效價的110%時,應調整其估計效價,重新試驗。除另有規定外,本法的可信限率不得大於5%。
2.1 第一法 管碟法
本法系利用抗生素在瓊脂培養基內的擴散作用,比較標準品與供試品兩者對接種的試驗菌產生抑菌圈的大小,以測定供試品效價的一種方法。
2.1.1 菌懸液的製備
枯草芽孢桿菌(Bacillus subtilis)懸液 取枯草芽孢桿菌(CMCC(B) 63 501]的營養瓊脂斜面培養物,接種子盛有營養瓊脂培養基的培養瓶中,在35~37℃培養7日,用革蘭染色法塗片鏡檢,應有芽孢85%以上。用滅菌水將芽孢洗下,在65℃加熱30分鐘,備用。
短小芽孢桿菌(Bacillus pumilus)懸液 取短小芽孢桿菌(CMCC(B) 63 202]的營養瓊脂斜面培養物,照上述方法製備。
金黃色葡萄球菌(Staphylococcus aureus)懸液 取金黃色葡萄球菌(CMCC(B) 26 003]的營養瓊脂斜面培養物,接種於營養瓊脂斜面上,在35~37℃培養20~22小時。臨用時,用滅菌水或0.9%滅菌氯化鈉溶液將菌苔洗下,備用。
藤黃微球菌(Micrococcus luteus)懸液 取藤黃微球菌[CMCC(B) 28 001]的營養瓊脂斜面培養物,接種於盛有營養瓊脂培養基的培養瓶中,在26~27℃培養24小時,或採用適當方法製備的菌斜面,用培養基Ⅲ或0.9%滅菌氯化鈉溶液將菌苔洗下,備用。
大腸埃希菌(Escherichia coli)懸液 取大腸埃希菌[CM-CC(B) 44 103]的營養瓊脂斜面培養物,接種於營養瓊脂斜面上,在35~37℃培養20~22小時。臨用時,用滅菌水將菌苔洗下,備用。
啤酒酵母菌(Saccharomyces cerevisiae)懸液 取啤酒酵母菌[ATCC 9763]的V號培養基瓊脂斜面培養物,接種於Ⅳ號培養基瓊脂斜面上。在32~35℃培養24小時,用滅菌水將菌苔洗下置含有滅菌玻璃珠的試管中,振搖均勻,備用。肺炎克雷伯菌(Klebosiella Pneumoniae)懸液 取肺炎克雷伯菌[CMCC(B) 46 117]的營養瓊脂斜面培養物,接種於營養瓊脂斜面上,在35~37℃培養20~22小時。臨用時,用無菌水將菌苔洗下,備用。
支氣管炎博德特菌(Bordetella Bronchiseptica)懸液 取支氣管炎博德特菌[CMCC(B) 58 403]的營養瓊脂斜面培養物,接種於營養瓊脂斜面上,在32~35℃培養24小時。臨用時,用無菌水將菌苔洗下,備用。
2.1.2 標準品溶液的製備
標準品的使用和保存,應照標準品介紹的規定。臨用時照表1的規定進行稀釋。
2.1.3 供試品溶液的製備
精密稱(或量)取供試品適量,用各品種項下規定的溶劑溶解後,再按估計效價或標示量照表1的規定稀釋至與標準品相當的濃度。
抗生素類別 | 試驗菌 | 抗生紊濃度範圍 | |||||
編號 | 單位/ml | 溫度/℃ | 時間/小時 | ||||
枯草芽孢桿菌[CMCC(B) 63 501] | I | 7.8~8.0 | 7.8 | 0.6~1.6 | 35~37 | 14~16 | |
枯草芽孢桿菌[CMCC(B) 63 501] | I | 7.8~8.0 | 7.8 | 0.9~4.5 | 35~37 | 14~16 | |
枯草芽孢桿菌[CMCC(B) 63 501] | I | 7.8~8.0 | 7.8 | 0.9~4.5 | 35~37 | 14~16 | |
巴龍黴索 | 枯草芽孢桿菌[CMCC(B) 63 501] | I | 7.8~8.0 | 7.8 | 0.9~4.5 | 35~37 | 14~16 |
枯草芽孢桿菌[CMCC(B) 63 501] | I | 7.8~8.0 | 7.8 | 2.0~12.0 | 35~37 | 14~16 | |
捲曲黴索 | 枯草芽孢桿菌[CMCC(B) 63 501] | I | 7.8~8.0 | 7.8 | 10.0~40.0 | 35~37 | 14~16 |
枯草芽孢桿菌[CMCC(B) 63 501] | I | 6.5~6.6 | 6.O | 5.0~10.0 | 35~37 | 14~16 | |
續表
抗生素類別 | 試驗菌 | 抗生素濃度範圍 | |||||
編號 | 單位/ml | 溫度/℃ | 時間/小時 | ||||
枯草芽孢桿菌[CMCC(B) 63 501] | Ⅷ | 6.0 | 6.0 | 9.0~43.7 | 35~37 | 14~16 | |
短小芽孢桿菌[CMCC(B) 63 202] | Ⅰ | 7.8~ 8.0 | 7.8 | 2.0~12.0 | 35~37 | 14~16 | |
短小芽孢桿菌[CMCC(B) 63 202] | Ⅰ | 7.8~8.0 | 7.8 | 5.0~20.0 | 35~37 | 14~16 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅱ | 7.8~8.0 | 7.8③ | 4.0~25.0 | 35~37 | 14~16 | |
Ⅱ | 6.5~6.6 | 6.0 | 10.0~40.0 | 35~37 | 14~16 | ||
Ⅱ | 6.5~6.6 | 6.0 | 10.0~40.0 | 35~37 | 16~18 | ||
Ⅱ | 6.5~6.6 | 6.0 | 4.0~25.0 | 35~37 | 16~18 | ||
Ⅱ | 6.5~6.6 | 6.0 | 30.0~80.03 | 35~37 | 16~18 | ||
Ⅱ | 6.5~6.6 | 6.0 | 2.0~12.0 | 35~37 | 16~18 | ||
大腸埃希菌[CMCC(B) 44 103] | Ⅵ | 7.2~7.4 | 6.0 | 614~2344 | 35~37 | 16~18 | |
啤酒酵母菌(ATCC 9763) | Ⅳ | 6.0~6.2 | 10.5 | 0.5~2.0 | 35~37 | 24~36 | |
短小芽孢桿菌[CMCC(B) 63 202] | Ⅰ | 7.8~8.0 | 7.8 | 5~20 | 35~37 | 14~16 | |
短小芽孢桿菌[CMCC(B) 63 202] | Ⅰ | 7.8~8.0 | 7.8 | 5~20 | 35~37 | 14~16 | |
短小芽孢桿菌[CMCC(B) 63 202] | Ⅰ | 7.8~8.0 | 7.8 | 0.5~20 | 35~37 | 16~18 | |
Ⅱ | 7.8~8.0 | 7.8 | 5~20 | 35~37 | 18~24 | ||
枯草芽孢桿菌[CMCC(B) 63 501] | Ⅱ | 8.0~8.2 | 7.8 | 5~403 | 35~37 | 14~16 | |
枯草芽孢桿菌[CMCC(B) 63 501] | Ⅰ | 7.8~8.0 | 7.8 | 1~4 | 35~37 | 14~16 | |
枯草芽孢桿菌[CMCC(B) 63 501] | Ⅱ | 7.8~8.0 | 7.8 | 5~10 | 35~37 | 16~18 | |
短小芽孢桿菌[CMCC(B) 63 202] | Ⅰ | 7.8~ 8.0 | 7.8 | 2.0~8.0 | 35~37 | 14~16 | |
肺炎克雷伯菌[CMCC(B) 46 117] | Ⅱ | 7.8~8.0 | 7.0 | 50~200 | 35~37 | 16~18 | |
枯草芽孢桿菌[CMCC(B) 63 501] | Ⅱ④ | 8.0~8.2 | 7.8 | 20~40 | 35~37 | 16~18 | |
枯草芽孢桿菌[CMCC(B) 63 501] | 8.0~8.2 | 7.8 | 5~40 | 35~37 | 16~18 | ||
枯草芽孢桿菌[CMCC(B) 63 501] | Ⅰ | 7.8~ 8.0 | 7.8 | 0.5~2.0 | 35~37 | 14~16 | |
大腸埃希菌[CMCC(B) 44 103] | 6.5- 6.6 | 6.0 | 1000~4000 | 35~37 | 16~18 | ||
枯草芽孢桿菌[CMCC(B) 63 501] | Ⅱ | 7.8~8.0 | 7.8 | 7.5~30 | 35~37 | 14~16 | |
枯草芽孢桿菌[CMCC(B) 63 501] | Ⅱ | 7.8~ 8.0 | 7.8 | 20~80 | 36~37 | 14~16 | |
枯草芽孢桿菌[CMCC(B) 63 501] | Ⅱ | 6.5~6.6 | 6.0 | 20~40 | 36~37 | 14~16 | |
枯草芽孢桿菌[CMCC(B) 63 501] | Ⅷ | 6.0 | 6.0 | 2.5~12.5 | 35~37 | 14~16 | |
①兩性黴素B雙碟的製備,用菌層15ml代替兩層。
②乙酰螺旋黴素,抗Ⅱ檢定培養基製備時,調節pH值使滅菌後爲8.0~8.2。
③含3%氯化鈉。
④加0.3%葡萄糖。
理論計算值u/mg | ||
(C21H39N7O12)2·3H2SO4 | 798. 3 | |
C18H36N4O11·H2SO4 | 831.6 | |
C22H43N5O13·nH2SO4(n=1.8或2) | ||
C17H34N4O10·nH2SO4 (n<2) | ||
C16H16N2Na2O7S | 904.0 | |
C22H24N2O8·HCl | 1000 | |
C22H24N2O9·2H2O | 927 | |
(C19H37N5O7)2·5H2SO4 | 646.3 | |
C3H5CaO4P·H2O | 711.5 | |
C38H69NO13 | 1000 | |
C14H24N2O7·2HCl·5H2O | 670.9 | |
C20H41N5O7·5/2H2SO4 | 654.3 | |
C22H23ClN2O8·HCl | 1000 |
理論計算值u/mg | ||
C37H67NO13 | 1000 | |
C11H12Cl2N2O5 | 1000 | |
桿菌肽鋅 | ||
C65H73Cl2N9O24·HCl | 975. 2 | |
C47H73NO17 | 1000 | |
C23H45N5O14·nH2SO4 | ||
(C21H41N5O7)2·5H2SO4 | 660.1 | |
C38H72N2O12 | 1000 | |
C18H37N5O9 | 1000 | |
C41H76N2O15 | 1000 | |
C42H69NO15 | 1000 | |
C45H73NO16 | 937 | |
C72~89H68~99Cl2N8~9O28~33 | 1000 |
2.1.4 雙碟的製備
取直徑約90mm,高16~17mm的平底雙碟,分別注入加熱融化的培養基(表1)20ml,使在碟底內均勻攤布,放置水平臺面上使凝固,作爲底層。另取培養基適量加熱融化後,放冷至48~50℃(芽孢可至60℃),加入規定的試驗菌懸液適量(能得清晰的抑菌圈爲度。二劑量法標準品溶液的高濃度所致的抑菌圈直徑在18~22mm,三劑量法標準品溶液的中心濃度所致的抑菌圈直徑在15~18mm),搖勻,在每1雙碟中分別加入5ml,使在底層上均勻攤布,作爲菌層。放置在水平臺上冷卻後,在每1雙碟中以等距離均勻安置不鏽鋼小管(內徑爲6.0mm±0.1mm,高爲10.0mm±0.1mm,外徑爲7.8mm±0.1mm)4個(二劑量法)或6個(三劑量法),用陶瓦圓蓋覆蓋備用。
2.1.5 檢定法
二劑量法 取照上述方法製備的雙碟不得少於4個,在每1雙碟中對角的2個不鏽鋼小管中分別滴裝高濃度及低濃度的標準品溶液,其餘2個小管中分別滴裝相應的高低兩種濃度的供試品溶液;高、低濃度的劑距爲2:1或4:1。在規定條件下培養後,測量各個抑菌圈直徑(或面積),照生物檢定統計法(2010年版藥典二部附錄XIV)中的(2.2)法進行可靠性測驗及效價計算。三劑量法 取照上述方法製備的雙碟不得少於6個,在每1雙碟中間隔的3個不鏽鋼小管中分別滴裝高濃度(S3)、中濃度(S2)及低濃度(S1)的標準品溶液,其餘3個小管中分別滴裝相應的高、中、低三種濃度的供試品溶液;高、低濃度的劑距爲1:0.8。在規定條件下培養後,測量各個抑菌圈直徑(或面積),照生物檢定統計法(2010年版藥典二部附錄XIV)中的(3.3)法進行可靠性測驗及效價計算。
2.2 第二法 濁度法
本法系利用抗生素在液體培養基中對試驗菌生長的抑制作用,通過測定培養後細菌濁度值的大小,比較標準品與供試品對試驗菌生長抑制的程度,以測定供試品效價的一種方法。
2.2.1 菌懸液製備
金黃色葡萄球菌(Staphylococcus aureus)懸液 取金黃色葡萄球菌[CMCC(B) 26 003]的營養瓊脂斜面培養物,接種於營養瓊脂斜面上,在35~37℃培養20~22小時。臨用時,用滅菌水或0.9%滅菌氯化鈉溶液將菌苔洗下,備用。
大腸埃希菌(Escherichia coli)懸液 取大腸埃希菌[CMCC(B) 44 103]的營養瓊脂斜面培養物,接種於營養瓊脂斜面上,在35~37℃培養20~22小時。臨用時,用滅菌水將菌苔洗下,備用。
白色念珠菌(Candida albicans)懸液 取白色念珠菌[CMCC(F)98 001]的改良馬丁瓊脂斜面的新鮮培養物,接種於10ml培養基Ⅸ中,置35~37℃培養8小時,再用培養基Ⅸ稀釋至適宜濃度,備用。
2.2.2 標準品溶液的製備
標準品的使用和保存,應照標準品介紹的規定。臨用時照表3的規定進行稀釋。
2.2.3 供試品溶液的製備
精密稱(或量)取供試品適量,照各品種項下規定進行供試品溶液的配製。
抗生素類別 | 試驗菌 | 抗生素濃度範圍 | ||||
編號 | 單位/ml | 溫度/℃ | ||||
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~7.2 | 7.8 | 0.15~1.0 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~7.2 | 7.8 | 2.4~10.8 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~ 7.2 | 7.8 | 0.8~2.0 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~ 7.2 | 7.8 | 0.1~ 0.85 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~7.2 | 7.8 | 0.92~1.50 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~7.2 | 6.0 | 0.05~0.33 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~7.2 | 7.0 | 5.5~13.3 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~7.2 | 7.8 | 0.1~ 2.5 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~ 7.2 | 7.8 | 0.1~ 0.25 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~7.2 | 7.8 | 1.0~ 5.0 | 35~37 | |
大腸埃希菌[CMCC(B) 44 103] | Ⅲ | 7.0~7.2 | 7.0 | 12~42 | 35~37 | |
大腸埃希菌[CMCC(B) 44 103] | Ⅲ | 7.0~7.2 | 7.0 | 12.0~ 31.0 | 35~37 | |
大腸埃希菌[CMCC(B) 44 103] | Ⅲ | 7.0~7.2 | 7.0 | 12.0~ 31.0 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~ 7.2 | 7.8 | 5.0~16.0 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~ 7.2 | 7.8 | 0.3~1.1 | 35~37 | |
大腸埃希菌[CMCC(B) 44 103] | Ⅲ | 7.0~7.2 | 7.0 | 30~72 | 35~37 | |
金黃色葡萄球菌[CMOC(B) 26 003] | Ⅲ | 7.0~7.2 | 7.8 | 0.8~2.4 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~7.2 | 7.8 | 1.2~3.2 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~7.2 | 7.8 | 0.5~1.2 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~ 7.2 | 6.0 | 0.06~0.30 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~ 7.2 | 5.6 | 1.0~4.0 | 35~37 | |
金黃色葡萄球菌[CMCC(B) 26 003] | Ⅲ | 7.0~7.2 | 7.8 | 0.8~4.8 | 35~37 | |
2.2.4 含試驗菌液體培養基的製備
臨用前,取規定的試驗菌懸液適量(35~37℃培養3~4小時後測定的吸光度在0.3~0.7之間,且劑距爲2的相鄰劑量間的吸光度差值不小於0.1),加入到各規定的液體培養基中,混合,使在試驗條件下能得到滿意的劑量-反應關係和適宜的測定濁度。
已接種試驗菌的液體培養基應立即使用。
2.2.5 檢定法
2.2.5.1 標準曲線法
除另有規定外,取適宜的大小厚度均勻的已滅菌試管,在各品種項下規定的劑量-反應線性範圍內,以線性濃度範圍的中間值作爲中間濃度,標準品溶液選擇5個劑量,劑量間的比例應適宜(通常爲1:1.25或更小),供試品根據估計效價或標示量溶液選擇中間劑量,每一劑量不少於3個試管。在各試驗管內精密加入含試驗菌的液體培養基9.0ml,再分別精密加入各濃度的標準品或供試品溶液各1.0ml,立即混勻,按隨機區組分配將各管在規定條件下培養至適宜測量的濁度值(通常約爲4小時),在線測定或取出立即加入甲醛溶液(1→3)0.5ml以終止微生物生長,在530nm或580nm波長處測定各管的吸光度。同時另取2支試管各加入藥品稀釋劑1.0ml,再分別加入含試驗菌的液體培養基9.0ml,其中一支試管與上述各管同法操作作爲細菌生長情況的陽性對照,另一支試管立即加入甲醛溶液0.5ml,混勻,作爲吸光度測定的空白液。照標準曲線法進行可靠性檢驗和效價計算。
抗生素微生物檢定法標準曲線法的計算及統計學檢驗標準曲線法的計算及可靠性檢驗
1.標準曲線的計算
將標準品的各濃度1g值及相對應的吸光度列成表4。
組數 | 抗生素濃度lg值 | 吸光度 |
1 2 3 4 n | x1 x2 x3 x4 xn | y1 y2 y3 y4 yn |
平均值 | x | y |
按公式(1)和(2)分別計算標準曲線的直線迴歸係數(即斜率)b和截距a,從而得到相應標準曲線的直線迴歸方程(3):
迴歸係數:
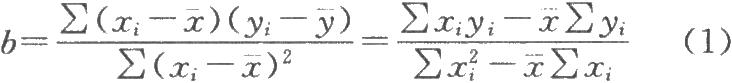
截距: a=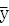 -b
-b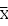 (2)
(2)
直線迴歸方程: Y=bX+a (3)
2.迴歸係數的顯著性測驗
判斷迴歸得到的方程是否成立,即X、Y是否存在着迴歸關係,可採用t檢驗。
假設H0:b=0,在假設H0成立的條件下,按公式(4)~(6)計算t值。
估計標準差:

迴歸係數標準誤:
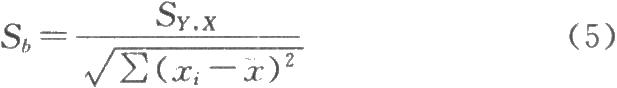

式中yi爲標準品的實際吸光度;
Y爲估計吸光度[由標準曲線的直線迴歸方程(3)計算得到];
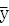 爲標準品實際吸光度的均值;
爲標準品實際吸光度的均值;
對於相應自由度(2n-4)給定的顯著性水平a(通常a=0.05),查表得ta/2(n-2),若|t|>ta/2(n-2),則拒絕H0,認爲迴歸效果顯著,即X、Y具有直線迴歸關係;若|t|≤ta/2(n-2),則接受H0,認爲迴歸效果不顯著,即X、Y不具有直線迴歸關係。
3.測定結果的計算及可信限率估計
3.1抗生素濃度lg值的計算 當迴歸係數具有顯著意義時,測得供試品吸光度的均值後,根據標準曲線的直線迴歸方程(3),按方程(7)計算抗生素的濃度lg值。
抗生素的濃度lg值:

3.2抗生素濃度(或數學轉換值)可信限的計算按公式(4)和(8)計算得到的抗生素濃度lg值在95%置信水平(a=0.05)的可信限。
X0的可信限:
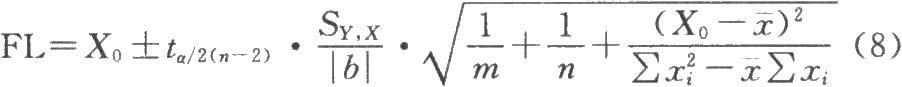
m爲供試品的平行測定數;
Y0爲抗生素供試品吸光度的均值。
3.3可信限率的計算 按公式(9)計算得到的抗生素濃度(或數學轉換值)的可信限率。
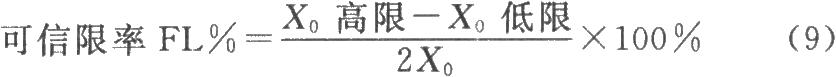
式中,X0應以濃度爲單位。
其可信限率除另有規定外,應不大於5%。
3.4供試品含量的計算 將計算得到的抗生素濃度(將lg值轉換爲濃度)再乘以供試品的稀釋度,即得供試品中抗生素的量。
2.2.5.2 二劑量法或三劑量法
除另有規定外,取大小一致的已滅菌的試管,在各品種項下規定的劑量反應線性範圍內,選擇適宜的高、(中、)低濃度,分別精密加入各濃度的標準品和供試品溶液各1.0ml,二劑量的劑距爲2:1或4:1,三劑量的劑距爲1: 0.8。同標準曲線法操作,每一濃度組不少於4個試管,按隨機區組分配將各試管在規定條件下培養。照生物檢定統計法(2010年版藥典二部附錄XIV)中的(2.2)法和(3.3)法進行可靠性測驗及效價計算。
2.3 培養基及其製備方法
2.3.1 培養基Ⅰ
腖5g、瓊脂15~20g、牛肉浸出粉3g、水1000ml、磷酸氫二鉀3g
除瓊脂外,混合上述成分,調節pH值使比最終的pH值略高0.2~0.4,加入瓊脂,加熱溶化後濾過,調節pH值使滅菌後爲7.8~8.0或6.5~6.6,在115℃滅菌30分鐘。
2.3.2 培養基Ⅱ
腖6g、葡萄糖1g、牛肉浸出粉1~5g、瓊脂15~20g、酵母浸出粉6g、水1000ml除瓊脂和葡萄糖外,混合上述成分,調節pH值使比最終的pH值略高0.2~0.4,加入瓊脂,加熱溶化後濾過,加葡萄糖溶解後,搖勻,調節pH值使滅菌後爲7.8~8.0或6.5~6.6,在115℃滅菌30分鐘。
2.3.3 培養基Ⅲ
腖5g、磷酸氫二鉀3.68g、牛肉浸出粉1.5g、磷酸二氫鉀1.32g、酵母浸出粉3g、葡萄糖1g、氯化鈉3.5g、水1000ml除葡萄糖外,混合上述成分,加熱溶化後濾過,加葡萄糖溶解後,搖勻,調節pH值使滅菌後爲7.0~7.2,在115℃滅菌30分鐘。
2.3.4 培養基Ⅳ
腖10g、葡萄糖10g、氯化鈉10g、瓊脂20~30g、枸櫞酸鈉10g、水1000ml除瓊脂和葡萄糖外,混合上述成允,調節pH值使比最終的pH值略高0.2~0.4,加入瓊脂,在109℃加熱15分鐘,於70℃以上保溫靜置1小時後濾過,加葡萄糖溶解後,搖勻,調節pH值使滅菌後爲6.0~6.2,在115℃滅菌30分鐘。
2.3.5 培養基V
腖10g、瓊脂15~20g[1]、麥芽糖40g、水1000ml除瓊脂和麥芽糖外,混合上述成分,調節pH值使比最終的pH值略高0.2~0.4,加入瓊脂,加熱溶化後濾過,加麥芽糖溶解後,搖勻,調節pH值使滅菌後爲6.0~6.2,在115℃滅菌30分鐘。
2.3.6 培養基Ⅵ
腖8g、酵母浸出粉5g、牛肉浸出粉3g、磷酸二氫鉀1g、氯化鈉45g、瓊脂15~20g、
除瓊脂和葡萄糖外,混合上述成分,調節pH值使比最終的pH值略高0.2~0.4,加入瓊脂,加熱溶化後濾過,加葡萄糖溶解後,搖勻,調節pH值使滅菌後爲7.2~7.4,在115℃滅菌30分鐘。
2.3.7 培養基Ⅶ
腖5g、枸櫞酸鈉10g、牛肉浸出粉3g、瓊脂15~20g、磷酸氫二鉀7g、水1000ml、磷酸二氫鉀3g
除瓊脂外,混合上述成分,調節pH值使比最終的pH值略高0.2~0.4,加入瓊脂,加熱溶化後濾過,調節pH值使滅菌後爲6.5~6.6,在115℃滅菌30分鐘。
2.3.8 培養基Ⅷ
酵母浸出粉1g、瓊脂15~20g硫酸銨1g、磷酸鹽緩衝液 (pH6.0)1000ml、
葡萄糖5g 混合上述成分,加熱溶化後濾過,調節pH值使滅菌後爲6.5~6.6,在115℃滅菌30分鐘。
2.3.9 培養基Ⅸ
蛋白腖7.5g、氯化鈉5.0g、酵母膏2.0g、葡萄糖10.0g、牛肉浸出粉1.0g、水1000ml除葡萄糖外,混合上述成分,加熱溶化後濾過,加葡萄糖溶解後,搖勻,調節pH值使滅菌後爲6.5,在115℃滅菌30分鐘。
2.3.10 營養肉湯培養基
腖10g、肉浸液①1000ml、氯化鈉5g
取腖和氯化鈉加入肉浸液內,微溫溶解後,調節pH值爲弱鹼性,煮沸,濾清,調節pH值使滅菌後爲7.2±0.2,在115℃滅菌30分鐘。
2.3.11 營養瓊脂培養基
腖10g、瓊脂15~20g、氯化鈉5g、肉浸液①1000ml
除瓊脂外,混合上述成分,調節pH值使比最終的pH值略高0.2~0.4,加入瓊脂,加熱溶化後濾過,調節pH值使滅菌後爲7.0~7.2,分裝,在115℃滅菌30分鐘,趁熱斜放使凝固成斜面。
注①肉浸液也可用牛肉浸出粉3g,加水1000ml,配成溶液代替。
2.3.12 改良馬丁培養基
腖5.0g、酵母浸出粉2.0g、硫酸鎂0.5g、瓊脂15~20g、磷酸氫二鉀1.0g、水1000ml、葡萄糖20.0g
除葡萄糖外,混合上述成分,微溫溶解,調節pH值約爲6.8,煮沸,加入葡萄糖溶解後,搖勻,濾清,調節pH值使滅菌後爲6.4±0.2,分裝,在115℃滅菌30分鐘,趁熱斜放使凝固成斜面。
2.3.13 多黏菌素B用培養基
蛋白腖6.0g、酵母浸膏3.0g、牛肉浸膏1.5g、瓊脂15~20g、胰消化酪素4.0g、水1000ml、葡萄糖1.0g
除瓊脂外,混合上述成分,調節pH值使比最終的pH值略高0.2~0.4,加入瓊脂,加熱溶化後濾過,調節pH值使滅菌後爲6.5~6.7,在115℃滅菌30分鐘。
培養基可以採用相同成分的乾燥培養基代替,臨用時,照使用說明配製和滅菌,備用。
2.3.14 滅菌緩衝液
磷酸鹽緩衝液(pH5.6) 取磷酸二氫鉀9.07g,加水使成1000ml,用1mol/L氫氧化鈉溶液調節pH值至5.6,濾過,在115℃滅菌30分鐘。
磷酸鹽緩衝液(pH6.0) 取磷酸氫二鉀2g與磷酸二氫鉀8g,加水使成1000ml,濾過,在115℃滅菌30分鐘。
磷酸鹽緩衝液(pH7.0) 取磷酸氫二鉀9.39g與磷酸二氫鉀3.5g,加水使成1000ml,濾過,在115℃滅菌30分鐘。
磷酸鹽緩衝液(pH7.8) 取磷酸氫二鉀5.59g與磷酸二氫鉀0.41g,加水使成1000ml,濾過,在115℃滅菌30分鐘。
磷酸鹽緩衝液(pH10.5) 取磷酸氫二鉀35g,加10mol/L氫氧化鈉溶液2ml,加水使成1000ml,濾過,在115℃滅菌30分鐘。
3 附錄Ⅺ B 青黴素酶及其活力測定法
3.1 培養基
腖15g、0.1%硫酸亞鐵(FeSO4·7H2O)溶液0.5ml、氯化鈉49 、枸櫞酸鈉5.889、20%硫酸鎂(MgSO4·7H2O)溶液1ml、磷酸氫二鉀4g、甘油50g、肉浸液1000ml
混合上述成分,調節pH值使滅菌後爲7.0~7.2,分裝於500ml錐形瓶內,每瓶80ml,在115℃滅菌30分鐘。
3.2 青黴素酶溶液的製備
取蠟樣芽孢桿菌(Bacillus cereus) (CMCC(B) 63 301]的斜面培養物,接種至上述一瓶培養基內,在25℃搖牀培養18小時後,取此培養物接種至其餘各瓶培養基內,每瓶接種10ml,同時每瓶加入無菌青黴素4500單位,在25℃搖牀培養24小時,再加無菌青黴素2萬單位,繼續培養24小時,再加無菌青黴素2萬單位,繼續培養24小時,離心沉澱菌體,調節pH值至約8.5,用濾柱濾過除菌,濾液用無菌操作調pH值至近中性後,分裝於適宜容器內,在10℃以下貯存,備用。
3.3 酶活力測定
青黴素溶液的製備 稱取青黴素鈉(鉀)適量,用磷酸鹽緩衝液(pH7.0)溶解成每1ml中含青黴素1萬單位的溶液。
青黴素酶稀釋液的製備 取青黴素酶溶液,按估計單位用磷酸鹽緩衝液(pH7.0)稀釋成每1ml中約含青黴素酶8000~12000單位的溶液,在37℃預熱。
3.4 測定法
精密量取青黴素溶液50ml,置100ml量瓶中,預熱至37℃後,精密加入已預熱的青黴素酶稀釋液25ml,迅速混勻,在37℃準確放置1小時,精密量取3ml,立即加至已精密量取的碘滴定液(0.005mol/L)[精密量取碘滴定液(0.05mol/L)10ml,置100ml量瓶中,用醋酸鈉緩衝液(pH4.5)稀釋至刻度]25ml中,在室溫暗處放置15分鐘,用硫代硫酸鈉滴定液(0.01mol/L)滴定,至近終點時,加澱粉指示液,繼續滴定至藍色消失。
3.5 空白試驗
取已預熱的青黴素溶液2ml,在37℃放置1小時,精密加入上述碘滴定液(0.005mol/L)25ml,然後精密加青黴素酶稀釋液1ml,在室溫暗處放置15分鐘,用硫代硫酸鈉滴定液(0.01mol/L)滴定。按下式計算:
E=(B-A)×M×F×D×100式中 E爲青黴素酶活力,單位/(ml·小時);B爲空白滴定所消耗的上述硫代硫酸鈉滴定液的容量,ml;
F爲在相同條件下,每1ml的上述碘滴定液(0.005mol/L)相當於青黴素的效價,單位;
3.6 【附註】
磷酸鹽緩衝液(pH7.0) 取磷酸氫二鉀7.36g與磷酸二氫鉀3.14g,加水使成1000ml。
醋酸鈉緩衝液(pH4.5) 取冰醋酸13.86ml,加水使成250ml;另取結晶醋酸鈉27.30g,加水使成200ml,兩液混合均勻。
4 附錄Ⅺ C 異常毒性檢查法
本法系給予小鼠一定劑量的供試品溶液,在規定時間內觀察小鼠出現的死亡情況,以判定供試品是否符合規定的一種方法。
供試用的小鼠應健康合格,體重17~20g,在試驗前及試驗的觀察期內,均應按正常飼養條件飼養。做過本試驗的小鼠不得重複使用。
4.1 供試品溶液的製備
除另有規定外,用氯化鈉注射液按各品種項下規定的濃度製成供試品溶液。
4.2 檢查法
除另有規定外,取上述小鼠5只,按各品種項下規定的給藥途徑,每隻小鼠分別給予供試品溶液0.5ml。給藥途徑分爲以下幾種。
4.3 靜脈注射
將供試品溶液注入小鼠尾靜脈,應在4~5秒內勻速注射完畢。規定緩慢注射的品種可延長至30秒。
4.4 腹腔注射
將供試品溶液注入小鼠腹腔。
4.5 皮下注射
將供試品溶液注入小鼠腹部或背部兩側皮下。口服給藥 將供試品溶液通過適宜的導管,灌入小鼠胃中。結果判斷 除另有規定外,全部小鼠在給藥後48小時內不得有死亡;如有死亡時,應另取體重18~19g的小鼠10只複試,全部小鼠在48小時內不得有死亡。
5 附錄Ⅺ D 熱原檢查法
本法系將一定劑量的供試品,靜脈注入家兔體內,在規定時間內,觀察家兔體溫升高的情況,以判定供試品中所含熱原的限度是否符合規定。
5.1 供試用家兔
供試用的家兔應健康合格,體重1.7kg以上,雌兔應無孕。預測體溫前7日即應用同一飼料飼養,在此期間內,體重應不減輕,精神、食慾、排泄等不得有異常現象。未曾用於熱原檢查的家兔;或供試品判定爲符合規定,但組內升溫達0.6℃的家兔;或3周內未曾使用的家兔,均應在檢查供試品前3~7日內預測體溫,進行挑選。挑選試驗的條件與檢查供試品時相同,僅不注射藥液,每隔30分鐘測量體溫1次,共測8次,8次體溫均在38.0~39.6℃的範圍內,且最高與最低體溫相差不超過0.4℃的家兔,方可供熱原檢查用。用於熱原檢查後的家兔,如供試品判定爲符合規定,至少應休息48小時方可再供熱原檢查用,其中升溫達0.6℃的家兔應休息2周以上。如供試品判定爲不符合規定,則組內全部家兔不再使用。
5.2 試驗前的準備
在做熱原檢查前1~2日,供試用家兔應儘可能處於同一溫度的環境中,實驗室和飼養室的溫度相差不得大於3℃,且應控制在17~25℃,在試驗全部過程中,實驗室溫度變化不得大於3℃,應防止動物騷動並避免噪聲干擾。家兔在試驗前至少1小時開始停止給食,並置於寬鬆適宜的裝置中,直至試驗完畢。測量家兔體溫應使用精密度爲±0.1℃的測溫裝置。測溫探頭或肛溫計插入肛門的深度和時間各兔應相同,深度一般約6cm,時間不得少於1.5分鐘,每隔30分鐘測量體溫1次,一般測量2次,兩次體溫之差不得超過0.2℃,以此兩次體溫的平均值作爲該兔的正常體溫。當日使用的家兔,正常體溫應在38.0~39.6℃的範圍內,且同組各兔間正常體溫之差不得超過1℃。
與供試品接觸的試驗用器皿應無菌、無熱原。去除熱原通常採用乾熱滅菌法(250℃加熱30分鐘),也可用其他適宜的方法。
5.3 檢查法
取適用的家兔3只,測定其正常體溫後15分鐘以內,自耳靜脈緩緩注入規定劑量並溫熱至約38℃的供試品溶液,然後每隔30分鐘按前法測量其體溫1次,共測6次,以6次體溫中最高的一次減去正常體溫,即爲該兔體溫的升高溫度(℃)。如3只家兔中有1只體溫升高0.6℃或高於0.6℃,或3只家兔體溫升高的總和達1.3℃或高於1.3℃,應另取5只家兔複試,檢查方法同上。
5.4 結果判斷
在初試的3只家兔中,體溫升高均低於0.6℃,並且3只家兔體溫升高總和低於1.3℃;或在複試的5只家兔中,體溫升高0.6℃或高於0.6℃的家兔不超過1只,並且初試、複試合併8只家兔的體溫升高總和爲3.5℃或低於3.5℃,均判定供試品的熱原檢查符合規定。
在初試的3只家兔中,體溫升高0.6℃或高於0.6℃的家兔超過1只;或在複試的5只家兔中,體溫升高0.6℃或高於0.6℃的家兔超過1只;或在初試、複試合併8只家兔的體溫升高總和超過3.5℃,均判定供試品的熱原檢查不符合規定。當家兔升溫爲負值時,均以0℃計。
6 附錄Ⅺ E 細菌內毒素檢查法
本法系利用鱟試劑來檢測或量化由革蘭陰性菌產生的細菌內毒素,以判斷供試品中細菌內毒素的限量是否符合規定的一種方法。
細菌內毒素檢查包括兩種方法,即凝膠法和光度測定法,後者包括濁度法和顯色基質法。供試品檢測時,可使用其中任何一種方法進行試驗。當測定結果有爭議時,除另有規定外,以凝膠法結果爲準。
細菌內毒素的量用內毒素單位(EU)表示,1EU與1個內毒素國際單位(IU)相當。
細菌內毒素國家標準品系自大腸埃希菌提取精製而成,用於標定、複覈、仲裁鱟試劑靈敏度和標定細菌內毒素工作標準品的效價。
細菌內毒素工作標準品系以細菌內毒素國家標準品爲基準標定其效價,用於試驗中的鱟試劑靈敏度複覈、干擾試驗及各種陽性對照。
細菌內毒素檢查用水系指內毒素含量小於0.015EU/ml(用於凝膠法)或0.005EU/ml(用於光度測定法)且對內毒素試驗無干擾作用的滅菌注射用水。
試驗所用的器皿需經處理,以去除可能存在的外源性內毒素。耐熱器皿常用乾熱滅菌法(250℃、30分鐘以上)去除,也可採用其他確證不干擾細菌內毒素檢查的適宜方法。若使用塑料器械,如微孔板和與微量加樣器配套的吸頭等,應選用標明無內毒素並且對試驗無干擾的器械。
6.1 供試品溶液的製備
某些供試品需進行復溶、稀釋或在水性溶液中浸提製成供試品溶液。一般要求供試品溶液的pH值在6.0~8.0的範圍內。對於過酸、過鹼或本身有緩衝能力的供試品,需調節被測溶液(或其稀釋液)的pH值,可使用酸、鹼溶液或適宜的緩衝液調節pH值。酸或鹼溶液須用細菌內毒素檢查用水在已去除內毒素的容器中配製。緩衝液必須經過驗證不含內毒素和干擾因子。
6.2 內毒素限值的確定
L=K/M
式中 L爲供試品的細菌內毒素限值,一般以EU/ml、EU/mg或EU/U(活性單位)表示;
K爲人每千克體重每小時最大可接受的內毒素劑量,以EU/(kg·h)表示,注射劑K=5EU/(kg·h),放射性藥品注射劑K=2.5EU/(kg·h),鞘內用注射劑K=0.2EU/(kg·h);
M爲人用每千克體重每小時的最大供試品劑量,以ml/(kg·h)、mg/(kg·h)或U/(kg·h)表示,人均體重按60kg計算,人體表面積按1.62m2計算。注射時間若不足1小時,按1小時計算。供試品每平方米體表面積劑量乘以0.027即可轉換爲每千克體重劑量(M)。
按人用劑量計算限值時,如遇特殊情況,可根據生產和臨牀用藥實際情況做必要調整,但需說明理由。
確定最大有效稀釋倍數( MVD) 最大有效稀釋倍數是指在試驗中供試品溶液被允許達到稀釋的最大倍數(1→MVD),在不超過此稀釋倍數的濃度下進行內毒素限值的檢測。用以下公式來確定MVD:
MVD=cL/λ
c爲供試品溶液的濃度,當L以EU/ml表示時,則c等於1.0ml/ml,當L以EU/mg或EU/U表示時,c的單位需爲mg/ml或U/ml。如供試品爲注射用無菌粉末或原料藥,則MVD取1,可計算供試品的最小有效稀釋濃度c=λ/L;
λ爲在凝膠法中鱟試劑的標示靈敏度(EU/ml),或是在光度測定法中所使用的標準曲線上最低的內毒素濃度。
6.2.1 方法1 凝膠法
凝膠法系通過鱟試劑與內毒素產生凝集反應的原理來檢測或半定量內毒素的方法。
6.2.1.1 鱟試劑靈敏度複覈試驗
在本檢查法規定的條件下,使鱟試劑產生凝集的內毒素的最低濃度即爲鱟試劑的標示靈敏度,用EU/ml表示。當使用新批號的鱟試劑或試驗條件發生了任何可能影響檢驗結果的改變時,應進行鱟試劑靈敏度複覈試驗。
根據鱟試劑靈敏度的標示值(λ),將細菌內毒素國家標準品或細菌內毒素工作標準品用細菌內毒素檢查用水溶解,在旋渦混合器上混勻15分鐘,然後製成2λ、λ、0.5λ和0.25λ四個濃度的內毒素標準溶液,每稀釋一步均應在旋渦混合器上混勻30秒鐘。取分裝有0.1ml鱟試劑溶液的10mm×75mm試管或復溶後的0.1ml/支規格的鱟試劑原安瓿18支,其中16管分別加入0.1ml不同濃度的內毒素標準溶液,每一個內毒素濃度平行做4管;另外2管加入0.1ml細菌內毒素檢查用水作爲陰性對照。將試管中溶液輕輕混勻後,封閉管口,垂直放入37℃±1℃的恆溫器中,保溫60分鐘±2分鐘。
將試管從恆溫器中輕輕取出,緩緩倒轉180°,若管內形成凝膠,並且凝膠不變形、不從管壁滑脫者爲陽性;未形成凝膠或形成的凝膠不堅實、變形並從管壁滑脫者爲陰性。保溫和拿取試管過程應避免受到振動造成假陰性結果。
當最大濃度2λ管均爲陽性,最低濃度0.25A管均爲陰性,陰性對照管爲陰性,試驗方爲有效。按下式計算反應終點濃度的幾何平均值,即爲鱟試劑靈敏度的測定值(λc)。
λc=antilg(∑X/4)
式中 X爲反應終點濃度的對數值(lg)。反應終點濃度是指系列遞減的內毒素濃度中最後一個呈陽性結果的濃度。
當λc在0.5λc~2λ(包括0.5λ和2λ)時,方可用於細菌內毒素檢查,並以標示靈敏度λ爲該批鱟試劑的靈敏度。
6.2.1.2 干擾試驗
按表1製備溶液A、B、C和D,使用的供試品溶液應爲未檢驗出內毒素且不超過最大有效稀釋倍數(MVD)的溶液,按鱟試劑靈敏度複覈試驗項下操作。
編號 | 稀釋用液 | 稀釋 倍數 | 所含內毒 素的濃度 | 平行管數 | |
A | 無/供試品溶液 | - | - | - | 2 |
B | 2λ/供試品溶液 | 供試品溶液 | 1 2 4 8 | 2λ 1λ 0.5λ 0.25λ | 4 4 4 4 |
c | 2λ/檢查用水 | 檢查用水 | 1 2 4 8 | 2λ 1λ 0.5λ 0.25λ | 4 4 4 4 |
D | 無/檢查用水 | - | - | - | 2 |
注:A爲供試品溶液;B爲干擾試驗系列;C爲鱟試劑標示靈敏度的對照系列;D爲陰性對照。
只有當溶液A和陰性對照溶液D的所有平行管都爲陰性,並且系列溶液C的結果在鱟試劑靈敏度複覈範圍內時,試驗方爲有效。按下式計算系列溶液C和B的反應終點濃度的幾何平均值(Es和Et)。
Es=antilg(∑Xs/4)
Et=antilg(∑Xt/4)
式中 Xs、Xt分別爲系列溶液C和溶液B的反應終點濃度的對數值(lg)。
當Es在0.5λ~2λ(包括0.5λ和2λ)及Et在0.5Es~2Es(包括0.5Es和2Es)時,認爲供試品在該濃度下無干擾作用。若供試品溶液在小於MVD的稀釋倍數下對試驗有干擾,應將供試品溶液進行不超過MVD的進一步稀釋,再重複干擾試驗。
可通過對供試品進行更大倍數的稀釋或通過其他適宜的方法(如過濾、中和、透析或加熱處理等)排除干擾。爲確保所選擇的處理方法能有效地排除干擾且不會使內毒素失去活性,要使用預先添加了標準內毒素再經過處理的供試品溶液進行干擾試驗。
當進行新藥的內毒素檢查試驗前,或無內毒素檢查項的品種建立內毒素檢查法時,須進行干擾試驗。
當鱟試劑、供試品的處方、生產工藝改變或試驗環境中發生了任何有可能影響試驗結果的變化時,須重新進行干擾試驗。
6.2.1.3 檢查法
6.2.1.3.1 (1)凝膠限度試驗
按表2製備溶液A、B、C和D。使用稀釋倍數爲MVD並且已經排除干擾的供試品溶液來製備溶液A和B。按鱟試劑靈敏度複覈試驗項下操作。
注:A爲供試品溶液;B爲供試品陽性對照;C爲陽性對照;D爲陰性對照。
結果判斷 保溫60分鐘±2分鐘後觀察結果。若陰性對照溶液D的平行管均爲陰性,供試品陽性對照溶液B的平行管均爲陽性,陽性對照溶液C的平行管均爲陽性,試驗有效。若溶液A的兩個平行管均爲陰性,判定供試品符合規定;若溶液A的兩個平行管均爲陽性,判定供試品不符合規定。若溶液A的兩個平行管中的一管爲陽性,另一管爲陰性,需進行復試。複試時,溶液A需做4支平行管,若所有平行管均爲陰性,判定供試品符合規定;否則判定供試品不符合規定。
6.2.1.3.2 (2)凝膠半定量試驗
本方法系通過確定反應終點濃度來量化供試品中內毒素的含量。按表3製備溶液A、B、C和D。按鱟試劑靈敏度複覈試驗項下操作。
結果判斷 若陰性對照溶液D的平行管均爲陰性,供試品陽性對照溶液B的平行管均爲陽性,系列溶液C的反應終點濃度的幾何平均值在0.5λ~2λ之間,試驗有效。
系列溶液A中每一系列平行管的終點稀釋倍數乘以λ,爲每個系列的反應終點濃度,所有平行管反應終點濃度的幾何平均值即爲供試品溶液的內毒素濃度[按公式CE=antilg(∑X/2)]。如果檢驗時採用的是供試品的稀釋液,則計算原始溶液內毒素濃度時要將結果乘以稀釋倍數。
如試驗中供試品溶液的所有平行管均爲陰性,應記爲內毒素濃度小於λ(如果檢驗的是稀釋過的供試品,則記爲小於λ乘以供試品進行半定量試驗的初始稀釋倍數)。如果供試品溶液的所有平行管均爲陽性,應記爲內毒素的濃度大於或等於最大的稀釋倍數乘以λ。
若內毒素濃度小於規定的限值,判定供試品符合規定。若內毒素濃度大於或等於規定的限值,判定供試品不符合規定。
編號 | 稀釋用液 | 稀釋 倍數 | 所含內毒 素的濃度 | 平行 管數 | |
A | 無/供試品溶液 | 檢查用水 | 1 2 4 8 | - - - - | 2 2 2 2 |
B | 2λ/供試品溶液 | 1 | 2λ | 2 | |
C | 2λ/檢查用水 | 檢查用水 | 1 2 4 8 | 2λ 1λ 0.5λ 0.25λ | 2 2 2 2 |
D | 無/檢查用水 | - | - | - | 2 |
注:A爲不超過MVD並且通過干擾試驗的供試品溶液。從通過干擾試驗的稀釋倍數開始用檢查用水稀釋至1倍、2倍、4倍和8倍,最後的稀釋倍數不得超過MVD。
C爲鱟試劑標示靈敏度的對照系列。
D爲陰性對照。
6.2.2 方法2 光度測定法
光度測定法分爲濁度法和顯色基質法。
濁度法系利用檢測鱟試劑與內毒素反應過程中的濁度變化而測定內毒素含量的方法。根據檢測原理,可分爲終點濁度法和動態濁度法。終點濁度法是依據反應混合物中的內毒素濃度和其在孵育終止時的濁度(吸光度或透光率)之間存在着量化關係來測定內毒素含量的方法。動態濁度法是檢測反應混合物的濁度到達某一預先設定的吸光度所需要的反應時間,或是檢測濁度增加速度的方法。
顯色基質法系利用檢測鱟試劑與內毒素反應過程中產生的凝固酶使特定底物釋放出呈色團的多少而測定內毒素含量的方法。根據檢測原理,分爲終點顯色法和動態顯色法。終點顯色法是依據反應混合物中內毒素濃度和其在孵育終止時釋放出的呈色團的量之間存在的量化關係來測定內毒素含量的方法。動態顯色法是檢測反應混合物的色度達到某一預先設定的吸光度所需要的反應時間,或檢測色度增長速度的方法。光度測定試驗需在特定的儀器中進行,溫度一般爲37℃±1℃。
供試品和鱟試劑的加樣量、供試品和鱟試劑的比例以及保溫時間等,參照所用儀器和試劑的有關說明進行。
爲保證濁度和顯色試驗的有效性,應預先進行標準曲線的可靠性試驗以及供試品的干擾試驗。
6.2.2.1 標準曲線的可靠性試驗
當使用新批號的鱟試劑或試驗條件有任何可能會影響檢驗結果的改變時,需進行標準曲線的可靠性試驗。
用標準內毒素製成溶液,製成至少3個濃度的稀釋液(相鄰濃度間稀釋倍數不得大於10),最低濃度不得低於所用鱟試劑的標示檢測限。每一稀釋步驟的混勻時間同凝膠法,每一濃度至少做3支平行管。同時要求做2支陰性對照。當陰性對照的反應時間大於標準曲線最低濃度的反應時間,將全部數據進行線性迴歸分析。
根據線性迴歸分析,標準曲線的相關係數(r)的絕對值應大於或等於0.980,試驗方爲有效。否則須重新試驗。
6.2.2.2 干擾試驗
選擇標準曲線中點或一個靠近中點的內毒素濃度(設爲λm),作爲供試品干擾試驗中添加的內毒素濃度。按表4製備溶液A、B、C和D。
注:A爲稀釋倍數不超過MVD的供試品溶液。
B爲加入了標準曲線中點或靠近中點的一個已知濃度內毒素的,且與溶液A有相同稀釋倍數的供試品溶液。
C爲如“標準曲線的可靠性試驗”項下描述的,用於製備標準曲線的標準內毒素溶液。
D爲陰性對照。
按所得線性迴歸方程分別計算出供試品溶液和含標準內毒素的供試品溶液的內毒素含量ct和cs,再按下式計算該試驗條件下的回收率(R)。
R=(cs-ct)/λm×100%
當內毒素的回收率在50%~200%之間,則認爲在此試驗條件下供試品溶液不存在干擾作用。
當內毒素的回收率不在指定的範圍內,須按“凝膠法干擾試驗”中的方法去除干擾因素,並重復干擾試驗來驗證處理的有效性。
當鱟試劑、供試品的來源、處方、生產工藝改變或試驗環境中發生了任何有可能影響試驗結果的變化時,須重新進行干擾試驗。
6.2.2.3 檢查法
使用系列溶液C生成的標準曲線來計算溶液A的每一個平行管的內毒素濃度。
試驗必須符合以下三個條件方爲有效:
(1)系列溶液C的結果要符合“標準曲線的可靠性試驗”中的要求;
(2)用溶液B中的內毒素濃度減去溶液A中的內毒素濃度後,計算出的內毒素的回收率要在50%~200%的範圍內;
6.2.2.4 結果判斷
若供試品溶液所有平行管的平均內毒素濃度乘以稀釋倍數後,小於規定的內毒素限值,判定供試品符合規定。若大於或等於規定的內毒素限值,判定供試品不符合規定。
7 附錄Ⅺ F 升壓物質檢查法
本法系比較垂體後葉標準品(S)與供試品(T)升高大鼠血壓的程度,以判定供試品中所含升壓物質的限度是否符合規定。
7.1 標準品溶液的製備
同縮官素生物測定法標準品溶液的製備法(2010年版藥典二部附錄Ⅻ F),按垂體後葉標準品升壓素單位計算,製成每1ml中含1單位的溶液,分裝於適宜的容器內,4~8℃貯存,經驗證保持活性符合要求的條件下,可在3個月內使用。標準品稀釋液的製備 臨用前,精密量取標準品溶液適量,用氯化鈉注射液製成每1ml中含0.1單位的溶液。
7.2 供試品溶液的製備
按品種項下規定的限值,且供試品溶液與標準品稀釋液的注入體積應相等的要求,製備適當濃度的供試品溶液。
7.3 檢查法
取健康合格、體重300g以上的成年雄性大鼠,用適宜的麻醉劑(如腹腔注射烏拉坦1g/kg)麻醉後,固定於保溫手術檯上,分離氣管,必要時插入插管,以使呼吸通暢。在一側頸靜脈或股靜脈插入靜脈插管,供注射藥液用,按體重每100g注入肝素溶液50~100單位,然後剝離另一側頸動脈,插入與測壓計相連的動脈插管,在插管與測壓計通路中充滿含適量肝素鈉的氯化鈉注射液。全部手術完畢後,將測壓計的讀數調節到與動物血壓相當的高度,開啓動脈夾,記錄血壓。緩緩注入適宜的交感神經阻斷藥(如甲磺酸酚妥拉明,按大鼠每100g體重注入0.1mg,隔5~10分鐘用相同劑量再注射一次),待血壓穩定後,即可進行藥液注射。各次注射速度應基本相同,並於注射後立即注入氯化鈉注射液0.5ml,相鄰兩次注射的間隔時間應基本相同(一般約爲5~10分鐘),每次注射應在前一次反應恢復穩定以後進行。
選定高低兩劑量的垂體後葉標準品稀釋液(ml),高低劑量之比約爲1:0.6,低劑量應能使大鼠血壓升高1.33~3.33kPa,將高低劑量輪流重複注入2~3次,如高劑量所致反應的平均值大於低劑量所致反應的平均值,可認爲該動物的靈敏度符合要求。
在上述高低劑量範圍內選定標準品稀釋液的劑量(dS),供試品溶液按品種項下規定的劑量(dT),照下列次序注射一組4個劑量:dS、dT、dT、dS,然後以第一與第三、第二與第四劑量所致的反應分別比較;如dT所致的反應值均不大於dS所致反應值的一半,則判定供試品的升壓物質檢查符合規定。否則應按上述次序繼續注射一組4個劑量,並按相同方法分別比較兩組內各對dS、dT所致的反應值;如dT所致的反應值均不大於dS所致的反應值,則判定供試品的升壓物質檢查符合規定,如dT所致的反應值均大於dS所致的反應值,則判定供試品的升壓物質檢查不符合規定;否則應另取動物複試。如複試的結果仍有dT所致的反應值大於dS所致的反應值,則判定供試品的升壓物質檢查不符合規定。
8 附錄Ⅺ G 降壓物質檢查法
本法系比較組胺對照品(S)與供試品(T)引起麻醉貓血壓下降的程度,以判定供試品中所含降壓物質的限度是否符合規定。
8.1 對照品溶液的製備
精密稱取磷酸組胺對照品適量,按組胺計算,加水溶解使成每1ml中含1.0mg的溶液,分裝於適宜的容器內,4~8℃貯存,經驗證保持活性符合要求的條件下,可在3個月內使用。
8.2 對照品稀釋液的製備
臨用前,精密量取組胺對照品溶液適量,用氯化鈉注射液製成每1ml中含組胺0.5μg的溶液。供試品溶液的製備 按品種項下規定的限值,且供試品溶液與標準品稀釋液的注入體積應相等的要求,製備適當濃度的供試品溶液。
8.3 檢查法
取健康合格、體重2kg以上的貓,雌者應無孕,用適宜的麻醉劑(如巴比妥類)麻醉後,固定於保溫手術檯上,分離氣管,必要時插入插管以使呼吸暢通,或可進行人工呼吸。在一側頸動脈插入連接測壓計的動脈插管,管內充滿適宜的抗凝劑溶液,以記錄血壓,也可用其他適當儀器記錄血壓。在一側股靜脈內插入靜脈插管,供注射藥液用。試驗中應注意保持動物體溫。全部手術完畢後,將測壓計調節到與動物血壓相當的高度(一般爲13.3~20.0kPa),開啓動脈夾,待血壓穩定後,方可進行藥液注射。各次注射速度應基本相同,每次注射後立即注入一定量的氯化鈉注射液,每次注射應在前一次反應恢復穩定以後進行,且相鄰兩次注射的間隔時間應儘量保持一致。
自靜脈依次注入上述對照品稀釋液,劑量按動物體重每1kg注射組胺0.05μg、0.1μg及0.15μg,重複2~3次,如0.1μg劑量所致的血壓下降值均不小於2.67kPa,同時相應各劑量所致反應的平均值有差別,可認爲該動物的靈敏度符合要求。取對照品稀釋液按動物體重每1kg注射組胺0.1μg的劑量(dS),供試品溶液按品種項下規定的劑量(dT),照下列次序注射一組4個劑量:dS、dT、dT、dS。然後以第一與第三、第二與第四劑量所致的反應分別比較;如dT所致的反應值均不大於dS所致反應值的一半,則判定供試品的降壓物質檢查符合規定。否則應按上述次序繼續注射一組4個劑量,並按相同方法分別比較兩組內各對dS、dT劑量所致的反應值;如dT所致的反應值均不大於dS所致的反應值,則判定供試品的降壓物質檢查符合規定;如dT所致的反應值均大於dS所致的反應值,則判定供試品的降壓物質檢查不符合規定;否則應另取動物複試。如複試的結果仍有dT所致的反應值大於dS所致的反應值,則判定供試品的降壓物質檢查不符合規定。
9 附錄Ⅺ H 無菌檢查法
無菌檢查法系用於檢查藥典要求無菌的藥品、醫療器具、原料、輔料及其他品種是否無菌的一種方法。若供試品符合無菌檢查法的規定,僅表明了供試品在該檢驗條件下未發現微生物污染。
無菌檢查應在環境潔淨度10000級下的局部潔淨度100級的單向流空氣區域內或隔離系統中進行,其全過程應嚴格遵守無菌操作,防止微生物污染,防止污染的措施不得影響供試品中微生物的檢出。單向流空氣區、工作臺面及環境應定期按《醫藥工業潔淨室(區)懸浮粒子、浮游菌和沉降菌的測試方法》的現行國家標準進行潔淨度驗證。隔離系統按相關的要求進行驗證,其內部環境的潔淨度須符合無菌檢查的要求。日常檢驗還需對試驗環境進行監控。
9.1 培養基培養基的製備及培養條件
培養基可按以下處方製備,也可使用按該處方生產的符合規定的脫水培養基。配製後應採用驗證合格的滅菌程序滅菌。製備好的培養基應保存在2~25℃、避光的環境,若保存於非密閉容器中,一般在3周內使用;若保存於密閉容器中,一般可在1年內使用。
酪腖(胰酶水解)15.0g、氯化鈉2.5g、葡萄糖5.0g、新配製的0.1%刃天、
L-胱氨酸0.5g、青溶液1.0ml、硫乙醇酸鈉0.5g(或硫乙醇酸)(0.3ml)、瓊脂0.75g、水1000ml、酵母浸出粉5.0g
除葡萄糖和刃天青溶液外,取上述成分混合,微溫溶解,調節pH爲弱鹼性,煮沸,濾清,加入葡萄糖和刃天青溶液,搖勻,調節pH值使滅菌後爲7.1±0.2。分裝至適宜的容器中,其裝量與容器高度的比例應符合培養結束後培養基氧化層(粉紅色)不超過培養基深度的1/2。滅菌。在供試品接種前,培養基氧化層的高度不得超過培養基深度的1/5,否則,須經100℃水浴加熱至粉紅色消失(不超過20分鐘),迅速冷卻,只限加熱一次,並防止被污染。
2.改良馬丁培養基
腖5.0g、磷酸氫二鉀1.0g、酵母浸出粉2.0g、硫酸鎂0.5g、葡萄糖20.0g、水1000ml 除葡萄糖外,取上述成分混合,微溫溶解,調節pH值約爲6.8,煮沸,加入葡萄糖溶解後,搖勻,濾清,調節pH值使滅菌後爲6.4±0.2,分裝,滅菌。
改良馬丁培養基置23~28℃培養。
3.選擇性培養基
按上述硫乙醇酸鹽流體培養基或改良馬丁培養基的處方及製法,在培養基滅菌或使用前加入適宜的中和劑、滅活劑或表面活性劑,其用量同方法驗證試驗。
4. 0.5%葡萄糖肉湯培養基(用於硫酸鏈黴素等抗生素的無菌檢查)腖10.0g、氯化鈉5.0g、葡萄糖5.0g、水1000ml、牛肉浸出粉3.0g
除葡萄糖外,取上述成分混合,微溫溶解,調節pH爲弱鹼性,煮沸,加入葡萄糖溶解後,搖勻,濾清,調節pH值使滅菌後爲7.2±0.2,分裝,滅菌。
腖10.0g、氯化鈉5.0g、牛肉浸出粉3.0g、水1000ml取上述成分混合,微溫溶解,調節pH爲弱鹼性,煮沸,濾清,調節pH值使滅菌後爲7.2±0.2,分裝,滅菌。
按上述營養肉湯培養基的處方及製法,加入14.0g瓊脂,調節pH值使滅菌後爲7.2±0.2,分裝,滅菌。
按改良馬丁培養基的處方及製法,加入14.0g瓊脂,調節pH值使滅菌後爲6.4±0.2,分裝,滅菌。
9.2 培養基的適用性檢查
無菌檢查用的硫乙醇酸鹽流體培養基及改良馬丁培養基等應符合培養基的無菌性檢查及靈敏度檢查的要求。本檢查可在供試品的無菌檢查前或與供試品的無菌檢查同時進行。
9.2.1 無菌性檢查
9.2.2 靈敏度檢查
9.2.2.1 菌種
培養基靈敏度檢查所用的菌株傳代次數不得超過5代(從菌種保藏中心獲得的冷凍乾燥菌種爲第0代),並採用適宜的菌種保藏技術,以保證試驗菌株的生物學特性。
金黃色葡萄球菌(Staphylococcus aureus)[CMCC(B) 26 003]
銅綠假單胞菌(Pseudmnonas aeruginosa)(CMCC(B) 10 104]
枯草芽孢桿菌(Bacillus subtilis)[CMCC(B) 63 501]
生孢梭菌(Clostridium sporogenes)[CMCC(B) 64 941]
白色念珠菌(Candida albicans)[CMCC(F) 98 001]
黑麴黴(Aspergillus niger)[CMCC(F) 98 003]
9.2.2.2 菌液製備
接種金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌的新鮮培養物至營養肉湯培養基中或營養瓊脂培養基上,接種生孢梭菌的新鮮培養物至硫乙醇酸鹽流體培養基中,30~35℃培養18~24小時;接種白色念珠菌的新鮮培養物至改良馬丁培養基中或改良馬丁瓊脂培養基上,23~28℃培養24~48小時,上述培養物用0.9%無菌氯化鈉溶液製成每1ml含菌數小於100cfu(菌落形成單位)的菌懸液。接種黑麴黴的新鮮培養物至改良馬丁瓊脂斜面培養基上,23~28℃培養5~7天,加入3~5ml含0.05%(ml/ml)聚山梨酯80的0.9%無菌氯化鈉溶液,將孢子洗脫。然後,採用適宜的方法吸出孢子懸液至無菌試管內,用含0.05% (ml/ml)聚山梨酯80的0.9%無菌氯化鈉溶液製成每1ml含孢子數小於100cfu的孢子懸液。
菌液製備後若在室溫下放置,應在2小時內使用;若保存在2~8℃,可在24小時內使用。黑麴黴孢子懸液可保存在2~8℃,在驗證過的貯存期內使用。
9.2.2.3 培養基接種
取每管裝量爲12ml的硫乙醇酸鹽流體培養基9支,分別接種小於100cfu的金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、生孢梭菌各2支,另1支不接種作爲空白對照,培養3天;取每管裝量爲9ml的改良馬丁培養基5支,分別接種小於100cfu的白色念珠菌、黑麴黴各2支,另1支不接種作爲空白對照,培養5天。逐日觀察結果。
9.2.2.4 結果判斷
空白對照管應無菌生長,若加菌的培養基管均生長良好,判該培養基的靈敏度檢查符合規定。
9.3 稀釋液、沖洗液及其製備方法
1. 0.1%蛋白腖水溶液取蛋白腖1.0g,加水1000ml,微溫溶解,濾清,調節pH值至7.1±0.2,分裝,滅菌。
2. pH7.0氯化鈉-蛋白腖緩衝液 取磷酸二氫鉀3.56g、磷酸氫二鈉7.23g、氯化鈉4.30g、蛋白腖1.0g,加水1000ml,微溫溶解,濾清,分裝,滅菌。
根據供試品的特性,可選用其他經驗證過的適宜的溶液作爲稀釋液、沖洗液。
如需要,可在上述稀釋液或沖洗液的滅菌前或滅菌後加入表面活性劑或中和劑等。
9.4 方法驗證試驗
當建立產品的無菌檢查法時,應進行方法的驗證,以證明所採用的方法適合於該產品的無菌檢查。若該產品的組分或原檢驗條件發生改變時,檢查方法應重新驗證。
驗證時,按“供試品的無菌檢查”的規定及下列要求進行操作。對每一試驗菌應逐一進行驗證。
9.4.1 菌種及菌液製備
除大腸埃希菌(Escherichia coli)[CMCC(B) 44 102]外,金黃色葡萄球菌、枯草芽孢桿菌、生孢梭菌、白色念珠菌、黑麴黴同培養基靈敏度檢查。大腸埃希菌的菌液製備同金黃色葡萄球菌。
9.4.2 薄膜過濾法
取每種培養基規定接種的供試品總量按薄膜過濾法過濾,沖洗,在最後一次的沖洗液中加入小於100cfu的試驗菌,過濾。取出濾膜接種至硫乙醇酸鹽流體培養基或改良馬丁培養基中,或將培養基加至濾筒內。另取一裝有同體積培養基的容器,加入等量試驗菌,作爲對照。置規定溫度培養3~5天。各試驗菌同法操作。
9.4.3 直接接種法
取符合直接接種法培養基用量要求的硫乙醇酸鹽流體培養基8管,分別接入小於100cfu的金黃色葡萄球菌、大腸埃希菌、枯草芽孢桿菌、生孢梭菌各2管;取符合直接接種法培養基用量要求的改良馬丁培養基4管,分別接入小於100cfu的白色念珠菌、黑麴黴各2管。其中1管接入每支培養基規定的供試品接種量,另1管作爲對照,置規定的溫度培養3~5天。
9.4.4 結果判斷
與對照管比較,如含供試品各容器中的試驗菌均生長良好,則說明供試品的該檢驗量在該檢驗條件下無抑菌作用或其抑菌作用可以忽略不計,照此檢查方法和檢查條件進行供試品的無菌檢查。如含供試品的任一容器中的試驗菌生長微弱、緩慢或不生長,則說明供試品的該檢驗量在該檢驗條件下有抑菌作用,應採用增加沖洗量、增加培養基的用量、使用中和劑或滅活劑、更換濾膜品種等方法,消除供試品的抑菌作用,並重新進行方法驗證試驗。
9.5 供試品的無菌檢查
9.5.1 檢驗數量
檢驗數量是指一次試驗所用供試品最小包裝容器的數量。除另有規定外,出廠產品按表1規定;上市產品監督檢驗按表2、表3規定。表1、表2、表3中最少檢驗數量不包括陽性對照試驗的供試品用量。一般情況下,供試品無菌檢查若採用薄膜過濾法,應增加1/2的最小檢驗數量作陽性對照用;若採用直接接種法,應增加供試品無菌檢查時每個培養基容器接種的樣品量作陽性對照用。
9.5.2 檢驗量
是指一次試驗所用的供試品總量(g或ml)。除另有規定外,每份培養基接種的供試品量按表2、表3規定。若每支(瓶)供試品的裝量按規定足夠接種兩份培養基,則應分別接種硫乙醇酸鹽流體培養基和改良馬丁培養基。採用薄膜過濾法時,檢驗量應不少於直接接種法的供試品總接種量,只要供試品特性允許,應將所有容器內的全部內容物過濾。
9.5.3 陽性對照
應根據供試品特性選擇陽性對照菌:無抑菌作用及抗革蘭陽性菌爲主的供試品,以金黃色葡萄球菌爲對照菌;抗革蘭陰性菌爲主的供試品以大腸埃希菌爲對照菌;抗厭氧菌的供試品,以生孢梭菌爲對照菌;抗真菌的供試品,以白色念珠菌爲對照菌。陽性對照試驗的菌液製備同方法驗證試驗,加菌量小於100cfu,供試品用量同供試品無菌檢查每份培養基接種的樣品量。陽性對照管培養48~72小時應生長良好。
9.5.4 陰性對照
供試品無菌檢查時,應取相應溶劑和稀釋液、沖洗液同法操作,作爲陰性對照。陰性對照不得有菌生長。無菌試驗過程中,若需使用表面活性劑、滅活劑、中和劑等試劑,應證明其有效性,且對微生物無毒性。
無菌檢查法包括薄膜過濾法和直接接種法。只要供試品、性狀允許,應採用薄膜過濾法。供試品無菌檢查所採用的檢查方法和檢驗條件應與驗證的方法相同。
操作時,用適宜的消毒液對供試品容器表面進行徹底消毒。如果容器內有一定的真空度,可用適宜的無菌器材(如帶有除菌過濾器的針頭),向容器內導入無菌空氣,再按無菌操作啓開容器取出內容物。
9.6 供試品處理及接種培養基
9.6.1 1.薄膜過濾法
薄膜過濾法應優先採用封閉式薄膜過濾器,也可使用一般薄膜過濾器。無菌檢查用的濾膜孔徑應不大於0.45μm,直徑約爲50mm。根據供試品及其溶劑的特性選擇濾膜材質。抗生素供試品應選擇低吸附的濾器及濾膜。濾器及濾膜使用前應採用適宜的方法滅菌。使用時,應保證濾膜在過濾前後的完整性。
水溶性供試液過濾前先將少量的沖洗液過濾以潤溼濾膜。油類供試品,其濾膜和過濾器在使用前應充分乾燥。爲發揮濾膜的最大過濾效率,應注意保持供試品溶液及沖洗液覆蓋整個濾膜表面。供試液經薄膜過濾後,若需要用沖洗液沖洗濾膜,每張濾膜每次沖洗量一般爲100ml,且總沖洗量不得超過1000ml,以避免濾膜上的微生物受損傷。
水溶液供試品 取規定量,直接過濾,或混合至含適量稀釋液的無菌容器內,混勻,立即過濾。如供試品具有抑菌作用或含防腐劑,須用沖洗液沖洗濾膜,沖洗次數一般不少於3次。所用的沖洗量、沖洗方法同方法驗證試驗。沖洗後,如用封閉式薄膜過濾器,分別將100ml硫乙醇酸鹽流體培養基及改良馬丁培養基加入相應的濾筒內。如採用一般薄膜過濾器,取出濾膜,將其分成3等份,分別置於含50ml硫乙醇酸鹽流體培養基及改良馬丁培養基的容器中,其中一份作陽性對照用。
可溶於水的固體制劑供試品 取規定量,加適宜的稀釋液溶解或按標籤說明覆溶,然後照水溶液供試品項下的方法操作。
β-內酰胺類抗生素供試品 取規定量,按水溶液或固體制劑供試品的處理方法處理,立即過濾,用適宜的沖洗液沖洗濾膜。再用含適量β-內酰胺酶的沖洗液清除殘留在濾筒、濾膜上的抗生素後接種培養基,必要時培養基中可加少量的β-內酰胺酶;或將濾膜直接接種至含適量β-內酰胺酶的培養基中。接種培養基照水溶液供試品項下的方法操作。
非水溶性製劑供試品 取規定量,直接過濾;或混合溶於含聚山梨酯80或其他適宜乳化劑的稀釋液中,充分混合,立即過濾。用含0.1%~1%聚山梨酯80的沖洗液沖洗濾膜至少3次。濾膜於含或不含聚山梨酯80的培養基中培養。接種培養基照水溶液供試品項下的方法操作。
可溶於十四烷酸異丙酯的膏劑和黏性油劑供試品 取規定量,混合至適量的無菌十四烷酸異丙酯①中,劇烈振搖,使供試品充分溶解,如果需要可適當加熱,但溫度不得超過44℃,趁熱迅速過濾。對仍然無法過濾的供試品,於含有適量的無菌十四烷酸異丙酯的供試液中加入不少於100ml的稀釋液,充分振搖萃取,靜置,取下層水相作爲供試液過濾。過濾後濾膜沖洗及接種培養基照非水溶性製劑供試品項下的方法操作。
注①無菌十四烷酸異丙酯的製備 採用薄膜過濾法過濾除菌。選用孔徑爲0.22μm的脂溶性濾膜,在140℃乾熱滅菌2小時。
無菌氣(噴)霧劑供試品 取規定量,將各容器置至少-20℃的冰室冷凍約1小時。以無菌操作迅速在容器上端鑽一小孔,釋放拋射劑後再無菌開啓容器,並將供試品轉移至無菌容器中,然後照水溶液或非水溶性製劑供試品項下的方法操作。裝有藥物的注射器供試品 取規定量,排出注射器中的內容物至無菌容器中,若需要可吸入稀釋液或用標籤所示的溶劑溶解,然後照水溶液或非水溶性製劑供試品項下的方法操作。同時應採用直接接種法進行包裝中所配帶的無菌針頭的無菌檢查。具有導管的醫療器具(輸血、輸液袋等)供試品 取規定量,每個最小包裝用50~100ml衝洗液分別沖洗內壁,收集沖洗液於無菌容器中,然後照水溶液供試品項下的方法操作。同時應採用直接接種法進行包裝中所配帶的針頭的無菌檢查。
9.6.2 2.直接接種法
直接接種法即取規定量的供試品分別接種至各含硫乙醇酸鹽流體培養基和改良馬丁培養基的容器中。除另有規定外,每個容器中培養基的用量應符合接種的供試品體積不得大於培養基體積的10%,同時,硫乙醇酸鹽流體培養基每管裝量不少於15ml,改良馬丁培養基每管裝量不少於10ml。若供試品具有抑菌作用,可加入適量的無菌中和劑或滅活劑,或加大每個容器的培養基用量。供試品檢查時,培養基的用量和高度同方法驗證試驗。
固體制劑供試品 取規定量,直接接種至各管培養基中,或加入適宜的溶劑溶解,或按標籤說明覆溶後,取規定量接種至各管培養基中。
非水溶性製劑供試品 取規定量,混合,加入適量的聚山梨酯80或其他適宜的乳化劑及稀釋劑使其乳化,接種至各管培養基中。或直接接種至含聚山梨酯80或其他適宜乳化劑的各管培養基中。
敷料供試品 取規定數量,以無菌操作拆開每個包裝,於不同部位剪取約100mg或1cm×3cm的供試品,接種於各管足以浸沒供試品的適量培養基中。
腸線、縫合線等供試品 腸線、縫合線及其他一次性使用的醫用材料按規定量取最小包裝,無菌拆開包裝,接種於各管足以浸沒供試品的適量培養基中。
滅菌醫用器具供試品 取規定量,必要時應將其拆散或切成小碎段,接種於各管足以浸沒供試品的適量培養基中。放射性藥品 取供試品1瓶(支),接種於裝量爲7.5ml
的硫乙醇酸鹽流體培養基和改良馬丁培養基中。每管接種量爲0.2ml。
9.7 培養及觀察
上述含培養基的容器按規定的溫度培養14天。培養期間應逐日觀察並記錄是否有菌生長。如在加入供試品後或在培養過程中,培養基出現渾濁,培養14天后,不能從外觀上判斷有無微生物生長,可取該培養液適量轉種至同種新鮮培養基中,細菌培養2天、真菌培養3天,觀察接種的同種新鮮培養基是否再出現渾濁;或取培養液塗片,染色,鏡檢,判斷是否有菌。結果判斷
陽性對照管應生長良好,陰性對照管不得有菌生長。否則,試驗無效。
若供試品管均澄清,或雖顯渾濁但經確證無菌生長,判供試品符合規定;若供試品管中任何一管顯渾濁並確證有菌生長,判供試品不符合規定,除非能充分證明試驗結果無效,即生長的微生物非供試品所含。當符合下列至少一個條件時,方可判試驗結果無效:
(1)無菌檢查試驗所用的設備及環境的微生物監控結果不符合無菌檢查法的要求;
(3)供試品管中生長的微生物經鑑定後,確證是因無菌試驗中所使用的物品和(或)無菌操作技術不當引起的。
試驗若經確認無效,應重試。重試時,重新取同量供試品,依法檢查,若無菌生長,判供試品符合規定;若有菌生長,判供試品不符合規定。
供試品 | 批產量N(個) | |
大體積注射劑(>100ml) | ≤100 100 >500 | 10%或4個(取較多者) 10個 2%或20個(取較少者) 2%或10個(取較少者) |
眼用及其他非注射產品 | ≤200 >200 | 5%或2個(取較多者) 10個 |
桶裝固體原料 抗生素原料藥(≥5g) | ≤4 4 >50 | 每個容器 20%或4個容器(取較多者) 2%或10個容器(取較多者) 6個容器 |
醫療器具 | ≤100 100 >500 | 10%或4件(取較多者) 10件 2%或20件(取較少者) |
注:若供試品每個容器中的裝量不夠接種兩種培養基,那麼表中的最少檢驗數量加倍。
供試品裝量V(ml) | 每支供試品接人每種培養基的最少量 | 供試品最少檢驗數量(瓶或支) |
≤1 1 5≤V<20 20≤V<50 50≤V<100 50≤V<100(靜脈給藥) 100≤V≤500 v>500 | 全量 半量 2ml 5ml 10ml 半量 半量 500ml | 10① 10 10 10 10 10 6 6① |
①若供試品每個容器內的裝量不夠接種兩種培養基,那麼表中的最少檢驗數量加倍。
供試品裝量M | 每支供試品接入每種培養基的最少量 | 供試品最少檢驗數量(瓶或支) |
M<50mg 50mg≤M<300mg 300mg≤M<5g M≥5g 縫合線、一次性醫用材料 帶導管的一次性醫療器具(如輸液袋) 其他醫療器具 | 全量 半量 150mg 500mg 取100mg或1cm×3cm 整個材料③ 整個器具③(切碎或拆散開) | 10① 10 10 10② 10 10① 10 |
①若供試品每個容器內的裝量不夠接種兩種培養基,那麼表中的最少檢驗數量加倍。
②抗生素粉針劑(≥5g)及抗生素原料藥(≥5g)的最少檢驗數量爲6瓶(或支),桶裝固體原料的最少檢驗數量爲4個包裝。
③如果醫用器械體積過大,培養基用量可在2000ml以上,將其完全浸沒。
10 附錄Ⅺ J 微生物限度檢查法
微生物限度檢查法系檢查非規定滅菌製劑及其原料、輔料受微生物污染程度的方法。檢查項目包括細菌數、黴菌數、酵母菌數及控制菌檢查。
微生物限度檢查應在環境潔淨度10000級下的局部潔淨度100級的單向流空氣區域內進行。檢驗全過程必須嚴格遵守無菌操作,防止再污染,防止污染的措施不得影響供試品中微生物的檢出。單向流空氣區域、工作臺面及環境應定期按《醫藥工業潔淨室(區)懸浮粒子、浮游菌和沉降菌的測試方法》的現行國家標準進行潔淨度驗證。
供試品檢查時,如果使用了表面活性劑、中和劑或滅活劑,應證明其有效性及對微生物無毒性。
除另有規定外,本檢查法中細菌及控制菌培養溫度爲30~35℃;黴菌、酵母菌培養溫度爲23~28℃。
檢驗結果以1g、1ml、10g、10ml或10cm2爲單位報告,特殊品種可以最小包裝單位報告。
10.1 檢驗量
檢驗量即一次試驗所用的供試品量(g、ml或cm2)。
除另有規定外,一般供試品的檢驗量爲10g或10ml;膜劑爲100cm2;貴重藥品、微量包裝藥品的檢驗量可以酌減。要求檢查沙門菌的供試品,其檢驗量應增加20g或20ml(其中10g或10ml用於陽性對照試驗)。
檢驗時,應從2個以上最小包裝單位中抽取供試品,膜劑還不得少於4片。
一般應隨機抽取不少於檢驗用量(兩個以上最小包裝單位)的3倍量供試品。
10.2 供試液的製備
根據供試品的理化特性與生物學特性,採取適宜的方法製備供試液。供試液製備若需加溫時,應均勻加熱,且溫度不應超過45℃。供試液從製備至加入檢驗用培養基,不得超過1小時。
10.2.1 1.液體供試品
取供試品10ml,加pH7.0無菌氯化鈉-蛋白腖緩衝液至100ml,混勻,作爲1: 10的供試液。油劑可加入適量的無菌聚山梨酯80使供試品分散均勻。水溶性液體制劑也可用混合的供試品原液作爲供試液。
10.2.2 2.固體、半固體或黏稠性供試品
取供試品10g,加pH7.0無菌氯化鈉-蛋白腖緩衝液至100ml,用勻漿儀或其他適宜的方法,混勻,作爲1: 10的供試液。必要時加適量的無菌聚山梨酯80,並置水浴中適當加溫使供試品分散均勻。
10.2.3 3.需用特殊方法製備供試液的供試品
10.2.3.1 (1)非水溶性供試品
方法1 取供試品5g(或5ml),加至含溶化的(溫度不超過45℃)5g司盤80、3g單硬脂酸甘油酯、10g聚山梨酯80無菌混合物的燒杯中,用無菌玻棒攪拌成團後,慢慢加入45℃的pH7.0無菌氯化鈉-蛋白腖緩衝液至100ml,邊加邊攪拌,使供試品充分乳化,作爲1: 20的供試液。
方法2 取供試品10g,加至含20ml無菌十四烷酸異丙酯(製法見附錄Ⅺ H 無菌檢查法中供試品的無菌檢查項下)和無菌玻璃珠的適宜容器中,必要時可增加十四烷酸異丙酯的用量,充分振搖,使供試品溶解。然後加入45℃的pH7.0無菌氯化鈉-蛋白腖緩衝液100ml,振搖5~10分鐘,萃取,靜置使油水明顯分層,取其水層作爲1: 10的供試液。
10.2.3.2 (2)膜劑供試品
取供試品100cm2,剪碎,加pH7.0無菌氯化鈉-蛋白腖緩衝液100ml(必要時可增加稀釋液),浸泡,振搖,作爲1: 10的供試液。
10.2.3.3 (3)腸溶及結腸溶製劑供試品
取供試品10g,加pH6.8無菌磷酸鹽緩衝液(用於腸溶製劑)或pH7.6無菌磷酸鹽緩衝液(用於結腸溶製劑)至100ml,置45℃水浴中,振搖,使溶解,作爲1: 10的供試液。
10.2.3.4 (4)氣霧劑、噴霧劑供試品
取規定量供試品,置冰凍室冷凍約1小時,取出,迅速消毒供試品開啓部位,用無菌鋼錐在該部位鑽一小孔,放至室溫,並輕輕轉動容器,使拋射劑緩緩全部釋出。用無菌注射器吸出全部藥液,加至適量的pH7.0無菌氯化鈉-蛋白腖緩衝液(若含非水溶性成分,加適量的無菌聚山梨酯80)中,混勻,取相當於10g或10ml的供試品,再稀釋成1: 10的供試液。
10.2.3.5 (5)貼劑供試品
取規定量供試品,去掉貼劑的保護層,放置在無菌玻璃或塑料片上,粘貼面朝上。用適宜的無菌多孔材料(如無菌紗布)覆蓋貼劑的粘貼面以避免貼劑粘貼在一起。然後將其置於適宜體積並含有表面活性劑(如聚山梨酯80或卵磷脂)的稀釋劑中,用力振盪至少30分鐘,製成供試液。貼劑也可採用其他適宜的方法製備成供試液。
10.2.3.6 (6)具抑菌活性的供試品
當供試品有抑菌活性時,採用下列方法進行處理,以消除供試液的抑菌活性,再依法檢查。常用的方法如下。
①培養基稀釋法 取規定量的供試液,至較大量的培養基中,使單位體積內的供試品含量減少,至不含抑菌作用。測定細菌、黴菌及酵母菌的菌數時,取同稀釋級的供試液2ml,每1ml供試液可等量分注多個平皿,傾注瓊脂培養基,混勻,凝固,培養,計數。每1ml供試液所注的平皿中生長的菌落數之和即爲1ml的菌落數,計算每1ml供試液的平均菌落數,按平皿法計數規則報告菌數;控制菌檢查時,可加大增菌培養基的用量。
②離心沉澱法 取一定量的供試液,500轉/分鐘離心3分鐘,取全部上清液混合。用於細菌檢查。
③薄膜過濾法 見細菌、黴菌及酵母菌計數項下的“薄膜過濾法”。
④中和法 凡含汞、砷或防腐劑等具有抑菌作用的供試品,可用適宜的中和劑或滅活劑消除其抑菌成分。中和劑或滅活劑可加在所用的稀釋液或培養基中。
10.3 細菌、黴菌及酵母菌計數
10.3.1 計數培養基的適用性檢查
細菌、黴菌及酵母菌計數用的培養基應進行培養基的適用性檢查,成品培養基、由脫水培養基或按處方配製的培養基均應檢查。
菌種 試驗用菌株的傳代次數不得超過5代(從菌種保藏中心獲得的冷凍乾燥菌種爲第0代),並採用適宜的菌種保藏技術進行保存,以保證試驗菌株的生物學特性。
大腸埃希菌(Escherichia coli)[CMCC(B) 44 102]
金黃色葡萄球菌(Staphylococcus aureus)[CMCC(B) 26 003]枯草芽孢桿菌(Bacillus subtitis)[CMCC(B) 63 501]
白色念珠菌(Candida albicans)[CMCC(F) 98 001]黑麴黴(Aspergillus niger)[CMCC(F) 98 003]
菌液製備 接種大腸埃希菌、金黃色葡萄球菌、枯草芽孢桿菌的新鮮培養物至營養肉湯培養基中或營養瓊脂培養基上,培養18~24小時;接種白色念珠菌的新鮮培養物至改良馬丁培養基中或改良馬丁瓊脂培養基上,培養24~48小時。上述培養物用0.9%無菌氯化鈉溶液製成每1ml含菌數爲50~100cfu的菌懸液。接種黑麴黴的新鮮培養物至改良馬丁瓊脂斜面培養基上,培養5~7天,加入3~5ml含0.05%(ml/ml)聚山梨酯80的0.9%無菌氯化鈉溶液,將孢子洗脫。然後,採用適宜的方法吸出孢子懸液至無菌試管內,用含0.05% (ml/ml)聚山梨酯80的0.9%無菌氯化鈉溶液製成每1ml含孢子數50~100cfu的孢子懸液。
菌液製備後若在室溫下放置,應在2小時內使用;若保存在2~8℃,可在24小時內使用。黑麴黴孢子懸液可保存在2~8℃,在驗證過的貯存期內使用。
適用性檢查 取大腸埃希菌、金黃色葡萄球菌、枯草芽孢桿菌各50~100cfu,分別注入無菌平皿中,立即傾注營養瓊脂培養基,每株試驗菌平行製備2個平皿,混勻,凝固,置30~35℃培養48小時,計數;取白色念珠茵、黑麴黴各50~100cfu,分別注入無菌平皿中,立即傾注玫瑰紅鈉瓊脂培養基,每株試驗菌平行製備2個平皿,混勻,凝固,置23~28℃培養72小時,計數;取白色念珠菌50~100cfu,注入無菌平皿中,立即傾注酵母浸出粉腖葡萄糖瓊脂培養基,平行製備2個平皿,混勻,凝固,置23~28℃培養72小時,計數。同時,用相應的對照培養基替代被檢培養基進行上述試驗。
結果判定 若被檢培養基上的菌落平均數不小於對照培養基上的菌落平均數的70%,且菌落形態大小與對照培養基上的菌落一致,判該培養基的適用性檢查符合規定。
10.3.2 計數方法的驗證
當建立產品的微生物限度檢查法時,應進行細菌、黴菌及酵母菌計數方法的驗證,以確認所採用的方法適合於該產品的細菌、黴菌及酵母菌數的測定。若產品的組分或原檢驗條件發生改變可能影響檢驗結果時,計數方法應重新驗證。
驗證時,按供試液的製備和細菌、黴菌及酵母菌計數所規定的方法及下列要求進行。對各試驗菌的回收率應逐一進行驗證。菌種及菌液製備 同計數培養基的適用性檢查。
10.3.2.1 驗證方法
驗證試驗至少應進行3次獨立的平行試驗,並分別計算各試驗菌每次試驗的回收率。
(1)試驗組 平皿法計數時,取試驗可能用的最低稀釋級供試液1ml和50~100cfu試驗菌,分別注入平皿中,立即傾注瓊脂培養基,每株試驗菌平行製備2個平皿,按平皿法測定其菌數。薄膜過濾法計數時,取規定量試驗可能用的最低稀釋級供試液,過濾,沖洗,在最後一次的沖洗液中加入50~100cfu試驗菌,過濾,按薄膜過濾法測定其菌數。
(2)菌液組 測定所加的試驗菌數。
(3)供試品對照組 取規定量供試液,按菌落計數方法測定供試品本底菌數。
(4)稀釋劑對照組 若供試液製備需要分散、乳化、中和、離心或薄膜過濾等特殊處理時,應增加稀釋劑對照組,以考察供試液製備過程中微生物受影響的程度。試驗時,可用相應的稀釋液替代供試品,加入試驗菌,使最終菌濃度爲每1ml供試液含50~100cfu,按試驗組的供試液製備方法和菌落計數方法測定其菌數。
10.3.2.2 結果判斷
在3次獨立的平行試驗中,稀釋劑對照組的菌數回收率(稀釋劑對照組的平均菌落數佔菌液組的平均菌落數的百分率)應均不低於70%。若試驗組的菌數回收率(試驗組的平均菌落數減去供試品對照組的平均菌落數的值佔菌液組的平均菌落數的百分率)均不低於70%,照該供試液製備方法和計數法測定供試品的細菌、黴菌及酵母菌數;若任一次試驗中試驗組的菌數回收率低於70%,應採用培養基稀釋法、離心沉澱法、薄膜過濾法、中和法(常見干擾物的中和劑或滅活方法見表1)等方法或聯合使用這些方法消除供試品的抑菌活性,並重新進行方法驗證。
若沒有適宜的方法消除供試品的抑菌活性,那麼驗證試驗中微生物回收的失敗可看成是因供試品的抗菌活性引起的,同時表明該供試品不能被試驗菌污染。但是,供試品也可能僅對試驗用菌株具有抑制作用,而對其他菌株沒有抑制作用。因此,根據供試品須符合的微生物限度標準和菌數報告規則,在不影響檢驗結果判斷的前提下,應採用能使微生物生長的更高稀釋級的供試液進行方法驗證試驗。若驗證試驗符合要求,應以該稀釋級供試液作爲最低稀釋級的供試液進行供試品檢驗。計數方法驗證時,採用上述方法若還存在一株或多株試驗菌的回收率達不到要求,那麼選擇回收率最接近要求的方法和試驗條件進行供試品的檢驗。
10.4 供試品檢查
計數方法包括平皿法和薄膜過濾法。檢查時,按已驗證的計數方法進行供試品的細菌、黴菌及酵母菌菌數的測定。按計數方法的驗證試驗確認的程序進行供試液製備。用稀釋液稀釋成1: 10、1:102、1:103等稀釋級的供試液。
10.4.1 1.平皿法
根據菌數報告規則取相應稀釋級的供試液1ml,置直徑90mm的無菌平皿中,注入15~20ml溫度不超過45℃的溶化的營養瓊脂培養基或玫瑰紅鈉瓊脂培養基或酵母浸出粉腖葡萄糖瓊脂培養基,混勻,凝固,倒置培養。每稀釋級每種培養基至少製備2個平板。
陰性對照試驗 取試驗用的稀釋液1ml,置無菌平皿中,注入培養基,凝固,倒置培養。每種計數用的培養基各製備2個平板,均不得有菌生長。
培養和計數 除另有規定外,細菌培養3天,黴菌、酵母菌培養5天,逐日觀察菌落生長情況,點計菌落數,必要時,可適當延長培養時間至7天進行菌落計數並報告。菌落蔓延生長成片的平板不宜計數。點計菌落數後,計算各稀釋級供試液的平均菌落數,按菌數報告規則報告菌數。若同稀釋級兩個平板的菌落平均數不小於15,則兩個平板的菌落數不能相差1倍或以上。一般營養瓊脂培養基用於細菌計數;玫瑰紅鈉瓊脂培養基用於黴菌及酵母菌計數;酵母浸出粉腖葡萄糖瓊脂培養基用於酵母菌計數。在特殊情況下,若營養瓊脂培養基上長有黴菌和酵母菌、玫瑰紅鈉瓊脂培養基上長有細菌,則應分別點計黴菌和酵母菌、細菌菌落數。然後將營養瓊脂培養基上的黴菌和酵母菌數或玫瑰紅鈉瓊脂培養基上的細菌數,與玫瑰紅鈉瓊脂培養基中的黴菌和酵母菌數或營養瓊脂培養基中的細菌數進行比較,以菌落數高的培養基中的菌數爲計數結果。含蜂蜜、王漿的液體制劑,用玫瑰紅鈉瓊脂培養基測定黴菌數,用酵母浸出粉腖葡萄糖瓊脂培養基測定酵母菌數,合併計數。菌數報告規則 細菌、酵母菌宜選取平均菌落數小於300cfu、黴菌宜選取平均菌落數小於100cfu的稀釋級,作爲菌數報告(取兩位有效數字)的依據。以最高的平均菌落數乘以稀釋倍數的值報告1g、1ml或10cm2供試品中所含的菌數。如各稀釋級的平板均無菌落生長,或僅最低稀釋級的平板有菌落生長,但平均菌落數小於1時,以<1乘以最低稀釋倍數的值報告菌數。
10.4.2 2.薄膜過濾法
採用薄膜過濾法,濾膜孔徑應不大於0.45μm,直徑一般爲50mm,若採用其他直徑的濾膜,沖洗量應進行相應的調整。選擇濾膜材質時應保證供試品及其溶劑不影響微生物的充分被截留。濾器及濾膜使用前應採用適宜的方法滅菌。使用時,應保證濾膜在過濾前後的完整性。水溶性供試液過濾前先將少量的沖洗液過濾以潤溼濾膜。油類供試品,其濾膜和濾器在使用前應充分乾燥。爲發揮濾膜的最大過濾效率,應注意保持供試品溶液及沖洗液覆蓋整個濾膜表面。供試液經薄膜過濾後,若需要用沖洗液沖洗濾膜,每張濾膜每次沖洗量爲100ml。總沖洗量不得超過1000ml,以避免濾膜上的微生物受損傷。
取相當於每張濾膜含1g、1ml或10cm2供試品的供試液,加至適量的稀釋劑中,混勻,過濾。若供試品每1g、1ml或10cm2所含的菌數較多時,可取適宜稀釋級的供試液1ml進行試驗。用pH7.0無菌氯化鈉-蛋白腖緩衝液或其他適宜的沖洗液沖洗濾膜,沖洗方法和沖洗量同“計數方法的驗證”。沖洗後取出濾膜,菌面朝上貼於營養瓊脂培養基或玫瑰紅鈉瓊脂培養基或酵母浸出粉腖葡萄糖瓊脂培養基平板上培養。每種培養基至少製備一張濾膜。
10.4.2.1 陰性對照試驗
取試驗用的稀釋液1ml,照上述薄膜過濾法操作,作爲陰性對照。陰性對照不得有菌生長。
10.4.2.2 培養和計數
培養條件和計數方法同平皿法,每片濾膜上的菌落數應不超過100cfu。
10.4.2.3 菌數報告規則
以相當於1g、1ml或10cm2供試品的菌落數報告菌數;若濾膜上無菌落生長,以<1報告菌數(每張濾膜過濾1g、1ml或10cm2供試品),或<1乘以稀釋倍數的值報告菌數。
10.5 控制菌檢查
控制菌檢查用的培養基應進行培養基的適用性檢查,成品培養基、由脫水培養基或按處方配製的培養基均應檢查。
10.5.1 菌種
大腸埃希菌(Escherichia coli)[CMCC(B) 44 102]
金黃色葡萄球菌(Staphylococcus aureus)[CMCC(B)26 003]
乙型副傷寒沙門菌(Salmonella paratyphi B)[CMCC(B) 50 094]
銅綠假單胞菌(Pseudomonas aeruginosa)[CMCC(B) 10 104]
生孢梭菌(Clostridium sporogenes)[CMCC(B) 64 941]
白色念珠菌(Candida albicans)[CMCC(F) 98 001]
10.5.2 菌液製備
接種大腸埃希菌、金黃色葡萄球菌、乙型副傷寒沙門菌、銅綠假單胞菌的新鮮培養物至營養肉湯培養基中或營養瓊脂培養基上,生孢梭菌的新鮮培養物至硫乙醇酸鹽流體培養基中,培養18~24小時;接種白色念珠菌的新鮮培養物至改良馬丁培養基中或改良馬丁瓊脂培養基上,培養24~48小時。用0.9%無菌氯化鈉溶液製成每1ml含菌數爲10~100 cfu的菌懸液。
菌懸液在室溫下放置應在2小時內使用,若保存在2~8℃可在24小時內使用。
10.5.3 適用性檢查
控制菌檢查用培養基的適用性檢查項目包括促生長能力、抑制能力及指示能力的檢查。各培養基的檢測項目及所用菌株見表2。
表2 控制菌檢查用培養基的促生長能力、抑制能力及指示能力檢查
特性 | 試驗菌株 | ||
大腸埃希菌 | 大腸埃希菌 | ||
金黃色葡萄球菌 | |||
4-甲基傘形酮葡糖苷酸培養基 | 大腸埃希菌 | ||
大腸埃希菌 | |||
大腸菌羣 | 大腸埃希菌 | ||
金黃色葡萄球菌 | |||
大腸埃希菌 | |||
大腸埃希菌 | |||
沙門菌 | 乙型副傷寒沙門菌 | ||
乙型副傷寒沙門菌 | |||
金黃色葡萄球菌 | |||
乙型副傷寒沙門菌 | |||
乙型副傷寒沙門菌 | |||
指示能力 | 乙型副傷寒沙門菌 | ||
金黃色葡萄球菌 | |||
大腸埃希菌 | |||
綠膿菌素測定用培養基 | |||
金黃色葡萄球菌 | 亞碲酸鹽肉湯培養基 | 金黃色葡萄球菌 | |
大腸埃希菌 | |||
金黃色葡萄球菌 | |||
大腸埃希菌 | |||
梭菌 | 梭菌增菌培養基 | 生孢梭菌 | |
生孢梭菌 | |||
白色念珠菌 | 白色念珠菌 | ||
白色念珠菌 | |||
念珠菌顯色培養基 | 白色念珠菌 | ||
大腸埃希菌 | |||
白色念珠菌 |
10.5.3.1 液體培養基促生長能力檢查
分別接種不大於100cfu的試驗菌(表2)於被檢培養基和對照培養基中,在相應控制菌檢查規定的培養溫度及最短培養時間下培養。與對照培養基管比較,被檢培養基管試驗菌應生長良好。
10.5.3.2 固體培養基促生長能力檢查
取試驗菌各0.1ml(含菌數50~100cfu)分別塗布於被檢培養基和對照培養基平板上,在相應控制菌檢查規定的培養溫度及最短培養時間下培養。被檢培養基與對照培養基上生長的菌落大小、形態特徵應一致。
10.5.3.3 培養基抑制能力檢查
接種不少於100cfu的試驗菌(表2)於被檢培養基中,在相應控制菌檢查規定的培養溫度及最長時間下培養,試驗菌應不得生長。
10.5.3.4 固體培養基指示能力檢查
取試驗菌各0.1ml(含菌數不大於100cfu)(表2)分別塗布於被檢培養基和對照培養基平板上,在相應控制菌檢查規定的培養溫度及時間下培養。被檢培養基上試驗菌生長的菌落大小、形態特徵、指示劑反應情況等應與對照培養基一致。
10.5.3.5 液體培養基指示能力檢查
分別接種不大於100cfu的試驗菌(表2)於被檢培養基和對照培養基中,在相應控制菌檢查規定的培養溫度及最短培養時間下培養。與對照培養基管比較,被檢培養基管試驗菌生長情況、指示劑反應等應與對照培養基一致。
10.6 控制菌檢查方法的驗證
當建立產品的微生物限度檢查法時,應進行控制菌檢查方法的驗證,以確認所採用的方法適合於該產品的控制菌檢查。若產品的組分或原檢驗條件發生改變可能影響檢驗結果時,檢查方法應重新驗證。
驗證時,依各品種項下微生物限度標準中規定檢查的控制菌選擇相應驗證的菌株,驗證大腸菌羣檢查法時,採用大腸埃希菌作爲驗證菌株。驗證試驗按供試液的製備和控制菌檢查法的規定及下列要求進行。
10.6.1 菌種及菌液製備
10.6.2 驗證方法
取規定量供試液及10~100cfu試驗菌加入增菌培養基中,依相應控制菌檢查法進行檢查。當採用薄膜過濾法時,取規定量供試液,過濾,沖洗,試驗菌應加在最後一次沖洗液中,過濾後,注入增菌培養基或取出濾膜接入增菌培養基中。
10.6.3 結果判斷
若上述試驗檢出試驗菌,按此供試液製備法和控制菌檢查法進行供試品的該控制菌檢查;若未檢出試驗菌,應採用培養基稀釋法、離心沉澱法、薄膜過濾法、中和法等方法或聯合使用這些方法消除供試品的抑菌活性,並重新進行方法驗證。
10.7 供試品檢查
10.7.1 陽性對照試驗
陽性對照試驗方法同供試品的控制菌檢查,對照菌的加菌量爲10~100cfu。陽性對照試驗應檢出相應的控制菌。
10.7.2 陰性對照試驗
取稀釋液10ml照相應控制菌檢查法檢查,作爲陰性對照。陰性對照應無菌生長。
(1)大腸埃希菌(Escherichia coli) 取供試液10ml(相當於供試品1g、1ml、10cm2),直接或處理後接種至適量(不少於100ml)的膽鹽乳糖培養基中,培養18~24小時,必要時可延長至48小時。
取上述培養物0.2ml,接種至含5ml MUG培養基的試管內,培養,於5小時、24小時在366nm紫外光下觀察,同時用未接種的MUG培養基作本底對照。若管內培養物呈現熒光,爲MUG陽性;不呈現熒光,爲MUG陰性。觀察後,沿培養管的管壁加入數滴靛基質試液,液麪呈玫瑰紅色,爲靛基質陽性;呈試劑本色,爲靛基質陰性。本底對照應爲MUG陰性和靛基質陰性。
如MUG陽性、靛基質陽性,判供試品檢出大腸埃希菌;如MUG陰性、靛基質陰性,判供試品未檢出大腸埃希菌;如MUG陽性、靛基質陰性,或MUG陰性、靛基質陽性,則應取膽鹽乳糖培養基的培養物劃線接種於曙紅亞甲藍瓊脂培養基或麥康凱瓊脂培養基的平板上,培養18~24小時。
若平板上無菌落生長或生長的菌落與表3所列的菌落形態特徵不符,判供試品未檢出大腸埃希菌。若平板上生長的菌落與表3所列的菌落形態特徵相符或疑似,應進行分離、純化、染色鏡檢和適宜的鑑定試驗,確認是否爲大腸埃希菌。
(2)大腸菌羣(Coliform) 取含適量(不少於10ml)的乳糖膽鹽發酵培養基管3支,分別加入1: 10的供試液1ml(含供試品0.1g或0.1ml)、1:100的供試液1ml(含供試品0.01g或0.01ml)、1:1000的供試液1ml(含供試品0.001g或0.001ml),另取1支乳糖膽鹽發酵培養基管加入稀釋液1ml作爲陰性對照管。培養18~24小時。
乳糖膽鹽發酵管若無菌生長或有菌生長但不產酸產氣,判該管未檢出大腸菌羣;若產酸產氣,應將發酵管中的培養物分別劃線接種於曙紅亞甲藍瓊脂培養基或麥康凱瓊脂培養基的平板上,培養18~24小時。
若平板上無菌落生長,或生長的菌落與表4所列的菌落形態特徵不符或爲非革蘭陰性無芽孢桿菌,判該管未檢出大腸菌羣;若平板上生長的菌落與表4所列的菌落形態特徵相符或疑似,且爲革蘭陰性無芽孢桿菌,應進行確證試驗。
確證試驗 從上述分離平板上挑選4~5個疑似菌落,分別接種於乳糖發酵管中,培養24~48小時。若產酸產氣,判該乳糖膽鹽發酵管檢出大腸菌羣,否則判未檢出大腸菌羣。根據大腸菌羣的檢出管數,按表5報告1g或1ml供試品中的大腸菌羣數。
表5 可能的大腸菌羣數
各供試品量的檢出結果 | 可能的大腸菌羣數N | ||
0.1g或0.1ml | 0.01g或0.01ml | 0.001g或0.001ml | (個/g或ml) |
+ + + - | + + - - | + - - - | >103 102 10 <10 |
(3)沙門菌(Salmonella) 取供試品10g或10ml,直接或處理後接種至適量(不少於200ml)的營養肉湯培養基中,用勻漿儀或其他適宜方法混勻,培養18~24小時。
取上述培養物1ml,接種於10ml四硫磺酸鈉亮綠培養基中,培養18~24小時後,分別劃線接種於膽鹽硫乳瓊脂(或沙門、志賀菌屬瓊脂)培養基和麥康凱瓊脂(或曙紅亞甲藍瓊脂)培養基的平板上,培養18~24小時(必要時延長至40~48小時)。若平板上無菌落生長或生長的菌落不同於表6所列的特徵,判供試品未檢出沙門菌。
若平板上生長的菌落與表6所列的菌落形態特徵相符或疑似,用接種針挑選2~3個菌落分別於三糖鐵瓊脂培養基高層斜面上進行斜面和高層穿刺接種,培養18~24小時,如斜面未見紅色、底層未見黃色;或斜面黃色、底層無黑色,判供試品未檢出沙門菌。否則,應取三糖鐵瓊脂培養基斜面的培養物進行適宜的鑑定試驗,確認是否爲沙門菌。
無色至淺橙色,半透明,菌落中心帶黑色或全部黑色或無黑色 | |
沙門、志賀菌屬瓊脂 | 無色至淡紅色,半透明或不透明,菌落中心有時帶黑褐色 |
無色至淺橙色,透明或半透明,光滑溼潤的圓形菌落 | |
麥康凱瓊脂 | 無色至淺橙色,透明或半透明,菌落中心有時爲暗色 |
(4)銅綠假單胞菌(Pseudomonas aeruginosa) 取供試液10ml(相當於供試品1g、1ml、10cm2),直接或處理後接種至適量(不少於100ml)的膽鹽乳糖培養基中,培養18~24小時。取上述培養物,劃線接種於溴化十六烷基三甲銨瓊脂培養基的平板上,培養18~24小時。
銅綠假單胞菌典型菌落呈扁平、無定形、周邊擴散、表面溼潤,灰白色,周圍時有藍綠色素擴散。如平板上無菌落生長或生長的菌落與上述菌落形態特徵不符,判供試品未檢出銅綠假單胞菌。如平板生長的菌落與上述菌落形態特徵相符或疑似,應挑選2~3個菌落,分別接種於營養瓊脂培養基斜面上,培養18~24小時。取斜面培養物進行革蘭染色、鏡檢及氧化酶試驗。
氧化酶試驗 取潔淨濾紙片置於平皿內,用無菌玻棒取斜面培養物塗於濾紙片上,滴加新配製的1%二鹽酸二甲基對苯二胺試液,在30秒內若培養物呈粉紅色並逐漸變爲紫紅色爲氧化酶試驗陽性,否則爲陰性。
若斜面培養物爲非革蘭陰性無芽孢桿菌或氧化酶試驗陰性,均判供試品未檢出銅綠假單胞菌。否則,應進行綠膿菌素試驗。
綠膿菌素( Pyocyanin)試驗 取斜面培養物接種於PDP瓊脂培養基斜面上,培養24小時,加三氯甲烷3~5ml至培養管中,攪碎培養基並充分振搖。靜置片刻,將三氯甲烷相移至另一試管中,加入1mol/L鹽酸試液約1ml,振搖後,靜置片刻,觀察。若鹽酸溶液呈粉紅色,爲綠膿菌素試驗陽性,否則爲陰性。同時用未接種的PDP瓊脂培養基斜面同法作陰性對照,陰性對照試驗應呈陰性。
若上述疑似菌爲革蘭陰性桿菌、氧化酶試驗陽性及綠膿菌素試驗陽性,判供試品檢出銅綠假單胞菌。若上述疑似菌爲革蘭陰性桿菌、氧化酶試驗陽性及綠膿菌素試驗陰性,應繼續進行適宜的鑑定試驗,確認是否爲銅綠假單胞菌。
(5)金黃色葡萄球菌(Staphylococcus aureus) 取供試液10ml(相當於供試品1g、1ml、10cm2),直接或處理後接種至適量(不少於100ml)的亞碲酸鈉(鉀)肉湯(或營養肉湯)培養基中,培養18~24小時,必要時可延長至48小時。取上述培養物,劃線接種於卵黃氯化鈉瓊脂培養基或甘露醇氯化鈉瓊脂培養基的平板上,培養24~72小時。若平板上無菌落生長或生長的菌落不同於表7所列特徵,判供試品未檢出金黃色葡萄球菌。
若平板上生長的菌落與表7所列的菌落特徵相符或疑似,應挑選2~3個菌落,分別接種於營養瓊脂培養基斜面上,培養18~24小時。取營養瓊脂培養基的培養物進行革蘭染色,並接種於營養肉湯培養基中,培養18~24小時,做血漿凝固酶試驗。
血漿凝固酶試驗 取滅菌小試管3支,各加入血漿和無菌水混合液(1:1)0.5ml,再分別加入可疑菌株的營養肉湯培養物(或由營養瓊脂培養基斜面培養物製備的濃菌懸液)0.5ml、金黃色葡萄球菌營養肉湯培養物(或由營養瓊脂培養基斜面培養物製備的濃菌懸液)0.5ml、營養肉湯或0.9%無菌氯化鈉溶液0.5ml,即爲試驗管、陽性對照管和陰性對照管。將3管同時培養,3小時後開始觀察直至24小時。陰性對照管的血漿應流動自如,陽性對照管血漿應凝固,若試驗管血漿凝固爲血漿凝固酶試驗陽性,否則爲陰性。如陽性對照管或陰性對照管不符合規定時,應另製備血漿,重新試驗。若上述疑似菌爲非革蘭陽性球菌、血漿凝固酶試驗陰性,判供試品未檢出金黃色葡萄球菌。
(6)梭菌(Clostridium) 取供試液10ml(相當於供試品1g、1ml、10cm2)2份,其中1份置80℃保溫10分鐘後迅速冷卻。上述2份供試液直接或處理後分別接種至100ml的梭菌增菌培養基中。置厭氧條件下培養48小時。取上述每一培養物0.2ml,分別塗抹接種於含慶大黴素的哥倫比亞瓊脂培養基平板上,置厭氧條件下培養48~72小時。若平板上無菌落生長,判供試品未檢出梭菌;若平板上有菌落生長,應挑選2~3個菌落分別進行革蘭染色和過氧化氫酶試驗。
過氧化氫酶試驗 取上述平板上的菌落,置潔淨玻片上,滴加3%過氧化氫試液,若菌落表面有氣泡產生,爲過氧化氫酶試驗陽性,否則爲陰性。
若上述可疑菌落爲革蘭陽性梭菌,有或無卵圓形或球形的芽孢,過氧化氫酶試驗陰性,判供試品檢出梭菌,否則判供試品未檢出梭菌。
(7)白色念珠菌(Candida albicans) 取供試液10ml(相當於供試品1g、1ml、10cm2)直接或處理後接種至適量(不少於100ml)的沙氏葡萄糖液體培養基中,培養48~72小時。取上述培養物劃線接種於沙氏葡萄糖瓊脂培養基平板上,培養24~48小時(必要時延長至72小時)。
白色念珠菌在沙氏葡萄糖瓊脂培養基上生長的菌落呈乳白色,偶見淡黃色,表面光滑有濃酵母氣味,培養時間稍久則菌落增大,顏色變深、質地變硬或有皺褶。若平板上無菌落生長或生長的菌落與上述菌落形態特徵不符,判供試品未檢出白色念珠菌。如平板上生長的菌落與上述菌落形態特徵相符或疑似,應挑選2~3個菌落分別接種至念珠菌顯色培養基平板上,培養24~48小時(必要時延長至72小時)。若平板上無綠色或翠綠色的菌落生長,判供試品未檢出白色念珠菌。若平板上生長的菌落爲綠色或翠綠色,挑取相符或疑似的菌落接種於1%聚山梨酯80-玉米瓊脂培養基上,培養24~48小時。取培養物進行染色、鏡檢及芽管試驗。
芽管試驗 挑取1%聚山梨酯80-玉米瓊脂培養基上的培養物,接種於加有一滴血清的載玻片上,益上蓋玻片,置溼
潤的平皿內,於35~37℃培養1~3小時,置顯微鏡下觀察孢子上有否長出短小芽管。
若上述疑似菌爲非革蘭陽性菌,顯微鏡下未見厚膜孢子、假菌絲、芽管,判供試品未檢出白色念珠菌。
10.7.3 結果判斷
供試品檢出控制菌或其他致病菌時,按一次檢出結果爲準,不再複試。
供試品的細菌數、黴菌和酵母菌數其中任何一項不符合該品種項下的規定,應從同一批樣品中隨機抽樣,獨立複試兩次,以3次結果的平均值報告菌數。
若供試品的細菌數、黴菌和酵母菌數及控制菌三項檢驗結果均符合該品種項下的規定,判供試品符合規定;若其中任何一項不符合該品種項下的規定,判供試品不符合規定。
10.7.4 稀釋液
1.pH7.0無菌氯化鈉-蛋白腖緩衝液 照無菌檢查法(2010年版藥典二部附錄Ⅺ H)製備。
2.pH6.8無菌磷酸鹽緩衝液、pH7.6無菌磷酸鹽緩衝液按緩衝液(2010年版藥典二部附錄XV D)配製後,過濾,分裝,滅菌。
如需要,可在上述稀釋液滅菌前或滅菌後加入表面活性劑或中和劑等。
3. 0.9%無菌氯化鈉溶液 取氯化鈉9.0g,加水溶解使成1000ml,過濾,分裝,滅菌。
10.8 培養基及其製備方法
培養基可按以下處方製備,也可使用按該處方生產的符合要求的脫水培養基。配製後,應採用驗證合格的滅菌程序滅菌。
1.營養瓊脂培養基、營養肉湯培養基、硫乙醇酸鹽流體培養基、改良馬丁培養基及改良馬丁瓊脂培養基
照無菌檢查法(2010年版藥典二部附錄Ⅺ H)製備。
腖5.0g、玫瑰紅鈉0.0133g葡萄糖10.0g、瓊脂14.0g磷酸二氫鉀1.0g、水1000ml、硫酸鎂0.5g
除葡萄糖、玫瑰紅鈉外,取上述成分,混合,微溫溶解,濾過,加入葡萄糖、玫瑰紅鈉,分裝,滅菌。
腖10.0g、瓊脂14.0g、酵母浸出粉5.0g、水1000ml、葡萄糖20.0g
除葡萄糖外,取上述成分,混合,微溫溶解,濾過,加入葡萄糖,分裝,滅菌。
腖20.0g、磷酸二氫鉀1.3g、乳糖5.0g、牛膽鹽2.0g(或去氧膽酸鈉)(0.5g)、氯化鈉5.0g磷酸氫二鉀4.0g、水1000ml
除乳糖、牛膽鹽或去氧膽酸鈉外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.4±0.2,煮沸,濾清,加入乳糖、牛膽鹽或去氧膽酸鈉,分裝,滅菌。
腖20.0g、0.04%溴甲酚紫指示液25ml、乳糖10.0g、水1000ml、牛膽鹽5.0g
除0.04%溴甲酚紫指示液外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.4±0.2,加入0.04%溴甲酚紫指示液,根據要求的用量分裝於含倒管的試管中。滅菌。所用倒管的規格應保證產氣結果的觀察。
營養瓊脂培養基100ml、曙紅鈉指示液2ml、20%乳糖溶液5ml、亞甲藍指示液1.3~1.6ml、取營養瓊脂培養基,加熱溶化後,冷至60℃,按無菌操作加入滅菌的其他3種溶液,搖勻,傾注平皿。
腖20.0g、1%中性紅指示液3ml、乳糖10.0g、瓊脂14.0g、牛膽鹽5.0g、水1000ml、氯化鈉5.0g
除乳糖、1%中性紅指示液、牛膽鹽及瓊脂外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.2±0.2,加入瓊脂,加熱溶化後,再加入其餘各成分,搖勻,分裝,滅菌,冷至約60℃,傾注平皿。
8. 4-甲基傘形酮葡糖苷酸(4-methylumbelliferyl-β-D-glucuronide,MUG)培養基
腖10.0g、磷酸二氫鉀(無水)0.9g、硫酸錳0.5mg、磷酸氫二鈉(無水)6.2g、硫酸鋅0.5mg、亞硫酸鈉40mg、硫酸鎂0.1g、去氧膽酸鈉1.0g、氯化鈉5.0g、MUG75mg、氯化鈣50mg、水1000ml除MUG外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.3±0.1,加入MUG,溶解,每管分裝5ml,滅菌。
腖20.0g、硫酸亞鐵0.2g、牛肉浸出粉5.0g、硫代硫酸鈉0.2g、乳糖10.0g、0.2%酚磺酞指示液12.5ml、蔗糖10.0g、瓊脂12.0g、葡萄糖1.0g、水1000ml、氯化鈉5.0g
除三種糖、0.2%酚磺酞指示液、瓊脂外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.3±0.1,加入瓊脂,加熱溶化後,再加入其餘各成分,搖勻,分裝,滅菌,製成高底層(2~3cm)短斜面。
腖5.0g、硫代硫酸鈉30.0g、牛膽鹽1.0g、水1000ml、碳酸鈣10.0g
臨用前,取上述培養基,每10ml加入碘試液0.2ml和亮綠試液0.1ml,混勻。
腖5.0g、硫代硫酸鈉8.5g、牛肉浸出粉5.0g、中性紅指示液2.5ml、乳糖10.0g、亮綠試液0.33ml、牛膽鹽8.5g、瓊脂16.0g、枸櫞酸鈉8.5g、水1000ml、枸櫞酸鐵銨1.0g
除乳糖、中性紅指示液、瓊脂外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.2±0.1,濾過,加入瓊脂,加熱溶化後,再加入其餘各成分,搖勻,滅菌,冷至60℃,傾注平皿。
腖20.0g、枸櫞酸鈉1.0g、牛肉浸出粉3.0g、枸櫞酸鐵銨1.0g、乳糖10.0g、中性紅指示液3ml、蔗糖10.0g、瓊脂16.0g、去氧膽酸鈉1.0g、水1000ml、硫代硫酸鈉2.3g
除糖、指示液及瓊脂外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.2±0.1,加入瓊脂,加熱溶化後,再加入其餘成分,搖勻,冷至60℃,傾注平皿。
腖10.0g、溴化十六烷基三甲銨0.3g、牛肉浸出粉3.0g、瓊脂14.0g、氯化鈉5.0g、水1000ml
除瓊脂外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.5±0.1,加入瓊脂,加熱溶化後,分裝,滅菌,冷至60℃,傾注平皿。
14.亞碲酸鹽肉湯培養基
臨用前,取滅菌的營養肉湯培養基,每100ml中加入新配製的1%亞碲酸鈉(鉀)試液0.2ml,混勻,即得。
腖6.0g、10%氯化鈉卵黃液100ml、牛肉浸出粉1.8g、瓊脂14.0g、氯化鈉30.0g、水650ml
除10%氯化鈉卵黃液外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.6±0.1,滅菌,待冷至約60℃,以無菌操作加入10%氯化鈉卵黃液,充分振搖,傾注平皿。
10%氯化鈉卵黃液的製備 取新鮮雞蛋1個,以無菌操作取出卵黃,放人10%無菌氯化鈉溶液100ml中,充分振搖,即得。
腖10.0g、酚磺酞指示液2.5ml、牛肉浸出粉1.0g、瓊脂14.0g、甘露醇10.0g、水1000ml、氯化鈉75.0g
除甘露醇、酚磺酞指示液及瓊脂外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.4±0.2,加入瓊脂,加熱溶化後,濾過,分裝,滅菌,冷至60℃,傾注平皿。
腖20.0g、乳糖10.0g、0.04%溴甲酚紫、水1000ml、指示液25ml
除0.04%溴甲酚紫指示液外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.2±0.2,加入指示液,分裝於含倒管的小試管中,每管3ml。滅菌。
18.綠膿菌素(Pyocyanin)測定用培養基(PDP瓊脂培養基)
腖20.0g、甘油10ml、氯化鎂(無水)1.4g、瓊脂14.0g、硫酸鉀(無水)10.0g、水1000ml
取腖、氯化鎂、硫酸鉀和水混合,微溫溶解,調節pH值使滅菌後爲7.3±0.1,加入甘油及瓊脂,加熱溶化,混勻,分裝於試管,滅菌,置成斜面。
19.梭菌增菌培養基
牛肉浸出粉10.0g、鹽酸半胱氨酸0.5g、腖10.0g、氯化鈉5.0g、酵母浸出粉3.0g、醋酸鈉3.0g、可溶性澱粉1.0g、瓊脂0.5g、葡萄糖5.0g、水1000ml
取上述成分,混合,加熱煮沸使溶解,調節pH值使滅菌後爲6.8±0.2,加熱溶化,濾過,分裝,滅菌。
酪蛋白胰酶消化物10.0g、肉胃酶消化物5.0g、心胰酶消化物3.0g、酵母浸出粉5.0g、玉米澱粉1.0g、氯化鈉5.0g、瓊脂15.0g、水1000ml
除瓊脂外,取上述成分,混合,微溫溶解,調節pH值使滅菌後爲7.3±0.2,加入瓊脂,加熱溶化,濾過,分裝,滅菌,冷至45~50℃,加入相當於20mg慶大黴素的無菌硫酸慶大黴素,混勻,傾注平皿。
腖10g、葡萄糖40g、水1000ml
除葡萄糖外,取上述成分,混合,微溫溶解,濾過。加入葡萄糖,溶解,分裝,滅菌。
除瓊脂和葡萄糖外,混合,微溫溶解,濾過。加入瓊脂和葡萄糖,溶解,分裝,滅菌。
23.(科瑪嘉)念珠菌顯色培養基①
腖1.2g、瓊脂15g、氫罌素0.5g、滅菌水1000ml、色素22.0g
除瓊脂外,取上述成分,混合,微溫溶解,調節pH值至6.3±0.2。濾過,加入瓊脂,加熱煮沸,不斷攪拌至瓊脂完全溶解,傾注平皿。
①本檢查法中白色念珠菌檢查所描述該菌在唸珠菌顯色培養基上的菌落特徵,是指該菌在法國科瑪嘉公司提供的科瑪嘉念珠菌顯色培養基上生長的菌落特徵。給出這一信息是爲了方便本方法的使用者,並不表示對該公司產品的認可。若其他等效產品具有相同的效果,那麼也可使用其他等效的產品。
黃色玉米粉40g、瓊脂10~15g、聚山梨酯80 10ml、水1000ml
取玉米粉、聚山梨酯80及蒸餾水500ml,混合,65℃加熱30分鐘,混勻,用紗布濾過,補足原水量。取瓊脂,水500ml,混合,加熱溶解。將以上兩種溶液混合,搖勻,分裝,滅菌。
微生物限度標準
非無菌藥品的微生物限度標準是基於藥品的給藥途徑及對患者健康潛在的危害而制訂的。藥品的生產、貯存、銷售過程中的檢驗,原料及輔料的檢驗,新藥標準制訂,進口藥品標準複覈,考察藥品質量及仲裁等,除另有規定外,其微生物限度均以本標準爲依據。
1.製劑通則、品種項下要求無菌的製劑及標示無菌的製劑 應符合無菌檢查法規定。 2.口服給藥製劑
細菌數每1g不得過1000cfu。每1ml不得過100cfu。
大腸埃希菌每1g或1ml不得檢出。3.局部給藥製劑
3.1 用於手術、燒傷及嚴重創傷的局部給藥製劑 應符合無菌檢查法規定。
3.2 耳、鼻及呼吸道吸入給藥製劑
細菌數每1g、1ml或10cm2不得過100cfu。
黴菌和酵母菌數 每1g、1ml或10cm2不得過10cfu。
金黃色葡萄球菌、銅綠假單胞菌 每1g、1ml或10cm2不得檢出。
大腸埃希菌 鼻及呼吸道給藥的製劑,每1g、1ml或10cm2不得檢出。
細菌數 每1g、1ml或10cm2不得過100cfu。
黴菌數和酵母菌數 每1g、1ml或10cm2應小於10cfu。金黃色葡萄球菌、銅綠假單胞菌、白色念珠菌 每1g、1ml或10cm2不得檢出。
3.4 贏腸給藥製劑
細菌數 每1g不得過1000cfu。每1ml不得過100cfu。黴菌和酵母菌數 每1g或1ml不得過100cfu。
3.5 其他局部給藥製劑
細菌數 每1g、1ml或10cm2不得過100cfu。
黴菌和酵母菌數 每1g、1ml或10cm2不得過100cfu。
金黃色葡萄球菌、銅綠假單胞菌 每1g、1ml或10cm2不得檢出。
4.含動物組織(包括提取物)的口服給藥製劑 每10g或10ml還不得檢出沙門菌。
5.有兼用途徑的製劑 應符合各給藥途徑的標準。
6.黴變、長蟎者 以不合格論。
11 附錄Ⅺ K 過敏反應檢查法
本法系將一定量的供試品溶液注入豚鼠體內,間隔一定時間後靜脈注射供試品溶液進行激發,觀察動物出現過敏反應的情況,以判定供試品是否引起動物全身過敏反應。
供試用的豚鼠應健康合格,體重250~350g,雌鼠應無孕。在試驗前和試驗過程中,均應按正常飼養條件飼養。做過本試驗的豚鼠不得重複使用。
11.1 供試品溶液的製備
11.2 檢查法
除另有規定外,取上述豚鼠6只,隔日每隻每次腹腔或適宜的途徑注射供試品溶液0.5ml,共3次,進行致敏。每日觀察每隻動物的行爲和體徵,首次致敏和激發前稱量並記錄每隻動物的體重。然後將其均分爲2組,每組3只,分別在首次注射後第14日和第21日,由靜脈注射供試品溶液1ml進行激發。觀察激發後30分鐘內動物有無過敏反應症狀。
11.3 結果判斷
靜脈注射供試品溶液30分鐘內,不得出現過敏反應。如在同一只動物上出現豎毛、發抖、乾嘔、連續噴嚏3聲、連續咳嗽3聲、紫癜和呼吸困難等現象中的2種或2種以上,或出現二便失禁、步態不穩或倒地、抽搐、休克、死亡現象之一者,判定供試品不符合規定。
12 附錄Ⅺ L 溶血與凝聚檢查法
本法系將一定量供試品與2%的家兔紅細胞混懸液混合,溫育一定時間後,觀察其對紅細胞狀態是否產生影響的一種方法。
12.1 2%紅細胞混懸液的製備
取健康家兔血液,放入含玻璃珠的錐形瓶中振搖10分鐘,或用玻璃棒攪動血液,以除去纖維蛋白原,使成脫纖血液。加入0.9%氯化鈉溶液約10倍量,搖勻,每分鐘1000~1500轉離心15分鐘,除去上清液,沉澱的紅細胞再用0.9%氯化鈉溶液按上述方法洗滌2~3次,至上清液不顯紅色爲止。將所得紅細胞用0.9%氯化鈉溶液製成2%的混懸液,供試驗用。
12.2 供試品溶液的製備
12.3 檢查法
取潔淨玻璃試管5只,編號,1、2號管爲供試品管,3號管爲陰性對照管,4號管爲陽性對照管,5號管爲供試品對照管。按下表所示依次加入2%紅細胞懸液、0.9%氯化鈉溶液、蒸餾水,混勻後,立即置37℃±0.5℃的恆溫箱中進行溫育。3小時後觀察溶血和凝聚反應。
如試管中的溶液呈澄明紅色,管底無細胞殘留或有少量紅細胞殘留,表明有溶血發生;如紅細胞全部下沉,上清液無色澄明,或上清液雖有色澄明,但1、2號管和5號管肉眼觀察無明顯差異,則表明無溶血發生。
若溶液中有棕紅色或紅棕色絮狀沉澱,輕輕倒轉3次仍不分散,表明可能有紅細胞凝聚發生,應進一步置顯微鏡下觀察,如可見紅細胞聚集爲凝聚。
12.4 結果判斷
當陰性對照管無溶血和凝聚發生,陽性對照管有溶血發生,若供試品管中的溶液在3小時內不發生溶血和凝聚,判定供試品符合規定;若供試品管的溶液在3小時內發生溶血和(或)凝聚,判定供試品不符合規定。
13 參考資料
- ^ [1] 國家藥典委員會.中華人民共和國藥典:2010年版:第一增補本[M].北京:中國醫藥科技出版社,2010.