2 英文參考
immunoglobulin,Ig
4 概述
具有抗體活性的血清蛋白稱爲免疫球蛋白,又稱爲抗體。是由機體的B淋巴細胞在抗原的刺激下分化、分裂而成的一組特殊球蛋白。人和動物的免疫血清中的免疫球蛋白極不均一,其組成、結構、大小、電荷、生物學活性等都有很大差異,約佔機體全部血清蛋白的20~25%。目前已在人、小鼠等血清中先後分純得到5類免疫球蛋白,1968年,世界衛生組織統一命名爲免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA)、免疫球蛋白D(IgD)、免疫球蛋白E(IgE)。
5 免疫球蛋白分子的基本結構
Porter等對血清IgG抗體的研究證明,Ig分子的基本結構是由四肽鏈組成的。即由二條相同的分子量較小的肽鏈稱爲輕鏈和二條相同的分子量較大的肽鏈稱爲重鏈組成的。輕鏈與重鏈是由二硫鍵連接形成一個四肽鏈分子稱爲Ig分子的單體,是構成免疫球蛋白分子的基本結構。Ig單體中四條肽鏈兩端遊離的氨基或羧基的方向是一致的,分別命名爲氨基端(N端)和羧基端(C端)。

5.1 輕鏈和重鏈
由於骨髓瘤蛋白(M蛋白)是均一性球蛋白分子,並證明本週蛋白(BJ)是Ig分子的L鏈,很容易從患者血液和尿液中分離純化這種蛋白,並可對來自不同患者的標本進行比較分析,從而爲Ig分子氨基酸序列分析提供了良好的材料。
1.輕鏈(lightchain,L) 輕鏈大約由214個氨基酸殘基組成,通常不含碳水化合物,分子量約爲24kD。每條輕鏈含有兩個由鏈內二硫鍵內二硫所組成的環肽。L鏈共有兩型:kappa(κ)與lambda(λ),同一個天然Ig分子上L鏈的型總是相同的。正常人血清中的κ:λ約爲2:1。
2.重鏈(heavychain,H鏈) 重鏈大小約爲輕鏈的2倍,含450~550個氨基酸殘基,分子量約爲55或75kD。每條H鏈含有4~5個鏈內二硫鍵所組成的環肽。不同的H鏈由於氨基酸組成的排列順序、二硫鍵的數目和們置、含的種類和數量不同,其抗原性也不相同,根據H鏈抗原性的差異可將其分爲5類:μ鏈、γ鏈、α鏈、δ鏈和ε鏈,不同H鏈與L鏈(κ或λ鏈)組成完整Ig的分子分別稱之爲IgM、IgG、IgA、IgD和IgE。γ、α和δ鏈上含有4個肽,μ和ε鏈含有5個環肽。
5.2 可變區和恆定區
通過對不同骨髓蛋白或本週蛋白H鏈或L鏈的氨基酸序列比較分析,發現其氨基端(N-末端)氨基酸序列變化很大,稱此區爲可變區(V),而羧基末端(C-末端)則相對穩定,變化很小,稱此區爲恆定區。
1.可變區(variableregion,V區) 位於L鏈靠近N端的1/2(約含108~111個氨基酸殘基)和H鏈靠近N端的1/5或1/4(約含118個氨基酸殘基)。每個V區中均有一個由鏈內二硫鍵連接形成的肽環,每個肽環約含67~75個氨基酸殘基。V區氨基酸的組成和排列隨抗體結合抗原的特異性不同有較大的變異。由於V區中氨基酸的種類爲排列順序千變萬化,故可形成許多種具有不同結合抗原特異性的抗體。
L鏈和H鏈的V區分別稱爲VL和VH。在VL和VH中某些局部區域的氨基酸組成和排列順序具有更高的變休程度,這些區域稱爲高變區(hypervariable region,HVR)。在V區中非HVR部位的氨基酸組面和排列相對比較保守,稱爲骨架區(fuamework rugion)。VL中的高變區有三個,通常分別位於第24~34、50~65、95~102位氨基酸。VL和VH的這三個HVR分別稱爲HVR1、HVR2和HVR3。經X線結晶衍射的研究分析證明,高變區確實爲抗體與抗原結合的位置,因而稱爲決定簇互補區(complementarity-determining regi-on,CDR)。VL和VH的HVR1、HVR2和HVR3又可分別稱爲CDR1、CDR2和CDR3,一般的CDR3具有更高的高變程度。高變區也是Ig分子獨特型決定簇(idiotypic determinants)主要存在的部位。在大多數情況下H鏈在與抗原結合中起更重要的作用。
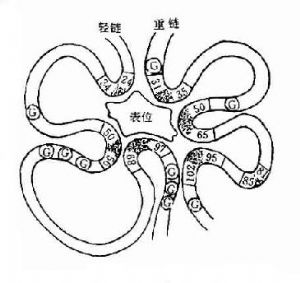
圖2-4 與表位結合高變區示意圖(G表示相對保守的甘氨酸)
2.恆定區(constantregion,C區) 位於L鏈靠近C端的1/2(約含105個氨基酸殘基)和H鏈靠近C端的3/4區域或4/5區域(約從119位氨基酸至C末端)。H鏈每個功能區約含110多個氨基酸殘基,含有一個由二鋶鍵連接的50~60個氨基酸殘基組成的肽環。這個區域氨基酸的組成和排列在同一種屬動物Ig同型L鏈和同一類H鏈中都比較恆定,如人抗白喉外毒素IgG與人抗破傷風外毒素的抗毒素IgG,它們的V區不相同,只能與相應的抗原發生特異性的結合,但其C區的結構是相同的,即具有相同的抗原性,應用馬抗人IgG第二體(或稱抗抗體)均能與這兩種抗不同外毒素的抗體(IgG)發生結合反應。這是製備第二抗體,應用熒光、酶、同位毒等標記抗體的重要基礎。
5.3 功能區
Ig分子的H鏈與L鏈可通過鏈內二硫鍵摺疊成若干球形功能區,每一功能區(domain)約由110個氨基酸組成。在功能區中氨基酸序列有高度同源性。
1.L鏈功能區 分爲L鏈可變區(VL)和L鏈恆定區(CL)兩功能區。
2.H鏈功能區 IgG、IgA和IgD的H鏈各有一個可變區(VH)和三個恆定區(CH1、CH2和CH3)共四個功能區。IgM和IgE的H鏈各有一個可變區(VH)和四個恆定區(CH1、CH2、CH3和CH4)共五個功能區。如要表示某一類免疫蛋白H鏈恆定區,可在C(表示恆定區)後加上相應重鏈名稱(希臘字母)和恆定區的位置(阿拉伯數字),例如IgG重鏈CH1、CH2和CH3可分別用Cγ1、Cγ2和Cγ3來表示。
IgL鏈和H鏈中V區或C區每個功能區各形成一個免疫球蛋白摺疊(immunoglobulin fold,Ig fold),每個Ig摺疊含有兩個大致平行、由二硫連接的β片層結構(betapleated sheets),每個β片層結構由3至5股反平行的多肽鏈組成。可變區中的高變區在Ig摺疊的一側形成高變區環(hypervariable loops),是與抗原結合的位置。
(1)VL和VH是與抗原結合的部位,其中HVR(CDR)是V區中與抗原決定簇(或表位)互補結合的部位。VH和VL通過非共價相互作用,組成一個FV區。單位Ig分子具有2個抗原結合位點(antigen-bindingsite),二聚體分泌型IgA具有4個抗原結合位點,五聚體IgM可有10個抗原結合位點。
(2)CL和CH上具有部分同種異型的遺傳標記。
(3)CH2:IgGCH具有補體Clq結合點,能活化補體的經典活化途徑。母體IgG藉助CH2部分可通過胎盤主動傳遞到胎體內。
(4)CH3:IgGCH3具有結合單核細胞、巨噬細胞、粒細胞、B細胞和NK細胞Fc段受體的功能。IgMCH3(或CH3因部分CH4)具有補體結合位點。IgE的Cε2和Cε3功能區與結合肥大細胞和嗜鹼性粒細胞FCεRI有關。
4.鉸鏈區(hingeregion)鉸鏈區不是一個獨立的功能區,但它與其客觀存在功能區有關。鉸鏈區位於CH1和CH2之間。不同H鏈鉸鏈區含氨基酸數目不等,α1、α2、γ1、γ2和γ4鏈的鉸鏈區較短,只有10多個氨基酸殘基;γ3和δ鏈的鉸鏈區較長,約含60多個氨基酸殘基,其中γ3鉸鏈區含有14個半胱氨酸殘基。鉸鏈區包括H鏈間二硫鍵,該區富含脯氨酸,不形成α-螺旋,易發生伸展及一定程度的轉動,當VL、VH與抗原結合時此氏發生扭曲,使抗體分子上兩個抗原結合點更好地與兩個抗原決定簇發生互補。由於CH2和CH3構型變化,顯示出活化補體、結合組織細胞等生物學活性。鉸鏈區對木瓜蛋白酶、胃蛋白酶敏感,當用這些蛋白酶水解免疫球蛋白分子時常此區發生裂解。IgM和IgE缺乏鉸鏈區。
5.4 J鏈和分泌成分
1.J鏈(joining chain) 存在於二聚體分泌型IgA和五聚體IgM中。J鏈分子量約爲15kD,由於124個氨基酸組成的酸性糖蛋白,含有8個半胱氨酸殘基,通過二硫鍵連接到μ鏈或α鏈的羧基端的半胱氨酸。J鏈可能在Ig二聚體、五聚體或多聚體的組成以及在體內轉運中的具有一定的作用。
2.分泌成分(secretorycomponent,SC) 又稱分泌片(secretory piece),是分泌型IgA上的一個輔助成分,分子量約爲75kD,糖蛋白,由上皮細胞合成,以共價形式結合到Ig分子,並一起被分泌到粘膜表面。SC的存在對於抵抗外分泌液中蛋白水解酶的降解具有重要作用。
5.5 單體、雙體和五聚體
1.單體 由一對L鏈和一對H鏈組成的基本結構,如IgG、IgD、IgE血清型IgA。
2.雙體 由J鏈連接的兩個單體,如分泌型IgA(secretory IgA,SIgA)二聚體(或多聚體)IgA結合抗原的親合力(avidity)要比單體IgA高。

圖2-5 分泌型IgA結構示意圖
3.五聚體 由J鏈和二硫鍵連接五個單體,如IgM。μ鏈Cys414(Cμ3)和Cys575(C端的尾部)對於IgM的多聚化極爲重要。在J鏈存在下,通過兩個鄰近單體IgMμ鏈Cys之間以及J鏈與鄰μ鏈Cys575之間形成二硫鍵組成五聚體。由粘膜下漿細胞所合成和分泌的IgM五聚體,與粘膜上皮細胞表面pIgR(poly-Ig receptor,pIgR)結合,穿過粘膜上皮細胞到粘膜表面成爲分泌型IgM(secretory IgM)。
5.6 酶解片段
1.本瓜蛋白酶的水解片段Porter等最早用木瓜蛋白酶(papain)水解兔IgG,從而區劃獲知了Ig四肽鏈的基本結構和功能。
(1)裂解部位:IgG鉸鏈區H鏈鏈間二硫鍵近N端側切斷。
(2)裂解片段:共裂解爲三個片段:①兩個Fab段(抗原結合段,fragmentof antigen binding),每個Fab段由一條完整的L鏈和一條約爲1/2的H鏈組成,Fab段分子量爲54kD。一個完整的Fab段可與抗原結合,表現爲單價,但不能形成凝集或沉澱反應。Fab中約1/2H鏈部分稱爲Fd段,約含225個氨基酸殘基,包括VH、CH1和部分鉸鏈區。②一個Fc段(可結晶段,fragmentcrystallizable),由連接H鏈二硫鍵和近羧基端兩條約1/2的H鏈所組成,分子量約50kD。Ig在異種間免疫所具有的抗原性主要存在於Fc段。
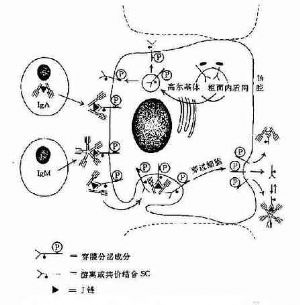
圖2-6 人分泌型IgA和分泌型IgM的局部產生示意圖

圖2-7 IgM結構示意圖
2.胃蛋白酶的水解片段Nisonoff等最早用胃蛋白酶(pepsin)裂解免疫球蛋白。
(1)裂解部位:鉸鏈區H鏈鏈間二硫鍵近C端切斷。
(2)裂解片段:
1)F(ab')2:包括一對完整的L鏈和由鏈間二硫鍵相連一對略大於Fab中Fd的H鏈,稱爲Fd',約含235個氨基酸殘基,包括VH、VH1和鉸鏈區。F(ab')2具有雙價抗體活性,與抗原結合可發生凝集和沉澱反應。雙價的F(ab')2與抗原結合的親合力要大於單價的Fab。由於應用F(ab')2時保持了結合相應抗原的生物學活性,又減少或避免了Fc段抗原性可能引起的副作用,因而在生物製品中有較大的實際應用價值。雖然F(ab')2與抗原結合特性方面同完整的Ig分子一樣,但由於缺乏Ig中部分,因此不具備固定補體以及與細胞膜表面Fc受體結合的功能。F(ab')2經還原等處理後,H鏈間的二硫可發生斷裂而形成兩個相同的Fab'片段。
2)Fc'可繼續被胃蛋白酶水解成更小的片段,失去其生物學活性。

圖2-8 Ig酶水解片段示意圖
6 免疫球蛋白分子的功能
Ig是體液免疫應答中發揮免疫功能最主要的免疫分子,免疫球蛋白所具有的功能是由其分子中不同功能區的特點所決定的。
6.1 特異性結合抗原
Ig最顯着的生物學特點是能夠特異性地與相應的抗原結合,如細菌、病毒、寄生蟲、某些藥物或侵入機體的其他異物。Ig的這種特異性結合抗原特性是由其V區(尤其是V區中的高變區)的空間構成所決定的。Ig的抗原結合點由L鏈和H鏈超變區組成,與相應抗原上的表位互補,藉助靜電力、氫鍵以及範德華力等次級鍵相結合,這種結合是可逆的,並受到pH、溫度和電解濃度的影響。在某些情況下,由於不同抗原分子上有相同的抗原決定簇,或有相似的抗原決定簇,一種抗體可與兩種以上的抗原發生反應,此稱爲交叉反應(cross reaction)。
抗體分子可有單體、雙體和五聚體,因此結合抗原決定簇的數目(結合價)也不相同。Fab段爲單價,不能產生凝集反應和沉澱反應。F(ab')2和單體Ig(如IgG、IgD、IgE)爲雙價。雙體分泌型IgA有4價。五聚體IgM理論上應爲10價,但實際上由於立體構型的空間位阻,一般只有5個結合點可結合抗原。
B細胞表面Ig(SmIg)是特異性識別抗原的受體,成熟B細胞主要表達SmIgM和SmIgD,同一B細胞克隆表達不同類SmIg其識別抗原的特異性是相同的。
6.2 活化補體
1.IgM、IgG1、IgG2和IgG3可通過經典途徑活化補體。當抗體與相應抗原結合後,IgG的CH2和IgM的CH3暴露出結合C lq的補體結合點,開始活化補體。由於Clq6個亞單位中一般需要2個C端的球與補體結合點結合後才能依次活化Clr和Cls,因此IgG活化補體需要一定的濃度,以保證兩個相鄰的IgG單體同時與1個Clq分子的兩個亞單位結合。當Clq一個C端球部結合IgG時親和力則很低,Kd爲10-4M,當Clq兩個或兩個以上球部結合兩個或多個IgG分時,親合力增高Kd爲10-8M。IgG與Clq結合點位於CH2功能區中最後一個β摺疊股318~322位氨基酸殘基(Glu-x-Lys-x-Lys)。IgM倍以上。人類天然的抗A和抗B血型抗體爲IgM,血型不符合引韋的輸血反應發生快而且嚴重。
2.凝聚的IgA、IgG4和IgE等可通過替代途徑活化補體。
6.3 結合Fc受體
不同細胞表面具有不同Ig的Fc受體,分別用FcγR、FcεR、FcαR等來表示。當Ig與相應抗原結合後,由於構型的改變,其Fc段可與具有相應受體的細胞結合。IgE抗體由於其Fc段結構特點,可在遊離情況下與有相應受體的細胞(如嗜鹼性粒細胞、肥大細胞)結合,稱爲親細胞抗體(cytophilic antibody)。抗體與Fc受體結合可發揮不同的生物學作用。
1.介導I型變態反應變應原刺激機體產生的IgE可與嗜鹼性粒細胞、肥大細胞表面IgE高親力受體細胞脫顆粒,釋放組胺,合成由細胞FcεRI結合。當相同的變應原再次進入機體時,可與已固定在細胞膜上的IgE結合,刺激細胞脫顆粒,釋放組受,合成由細胞脂質來源的介質如白三烯、前列腺素、血小板活化因子等,引起Ⅰ型變態反應。
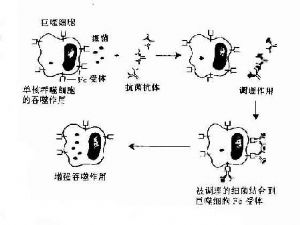
2.調理吞噬作用 調理作用(opsonization)是指抗體、補體C3b、C4b等調理素(opsonin)促進吞噬細菌等顆粒性抗原。由於補體對熱不穩定,因此又稱爲熱不穩定調理素(heat-labile opsonin)。抗體又稱熱穩定調理素(heat-stableopsonin)。補體與抗體同時發揮調理吞噬作用,稱爲聯合調理作用。中性粒細胞、單核細胞和巨噬細胞具有高親和力或低親和力的FcγRI(CD64)和FcγRⅡ(CD32),IgG尤其是人IgG1和IgG3亞類對於調理吞噬起主要作用。嗜酸性粒細胞具有親和力FcγRⅡ,IgE與相應抗原結合後可促進嗜酸性粒細胞的吞噬作用。抗體的調理機制一般認爲是:①抗體在抗原顆粒和吞噬細胞之間“搭橋”,從而加強了吞噬細胞的吞噬作用;②抗體與相應顆粒性抗原結合後,改變抗原表面電荷,降低吞噬細胞與抗原之間的靜電斥力;③抗體可中和某些細菌表面的抗吞噬物質如肺炎雙球菌的莢膜,使吞噬細胞易於吞噬;④吞噬細胞FcR結合抗原抗體複合物,吞噬細胞可被活化。
3.發揮抗體依賴的細胞介導的細胞毒作用 當IgG抗體與帶有相應抗原的靶細胞結合後,可與有FcγR的中性粒細胞、單核細胞、巨噬細胞、NK細胞等效應細胞結合,發揮抗體依賴的細胞介導的細胞毒作用(antibodydependentcell-mediated cytotoxicity,ADCC)。目前已知。NK細胞發揮ADCC效應主要是通過其膜表面低親和力FcγRⅢ(CD16)所介導的,IgG不僅起到連接靶細胞和效應細胞的作用,同時還刺激NK細胞合成和分泌腫瘤壞死因子和γ干擾素等細胞因子,並釋放顆粒,溶解靶細胞。嗜酸性粒細胞發揮ADCC作用是通過其FcεRⅡ和FcαR介導的,嗜酸性粒細胞可脫顆粒釋放鹼性蛋白等,在殺傷寄生蟲如蠕蟲中發揮重要作用。
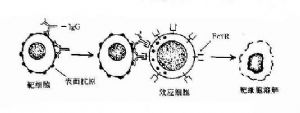
此外,人IgGFc段能非特異地與葡萄菌A蛋白(staphylococcus proteinA,SPA)結合,應用SPA可純化IgG等抗體,或代替第二抗體用於標記技術。
6.4 通過胎盤
在人類,IgG是唯一可通過胎盤從母體轉移給胎兒的Ig。IgG能選擇性地與胎盤母體一側的滋養層細胞結合,轉移到滋養層細胞的吞飲泡內,並主動外排到胎兒血循環中。IgG的這種功能與IgGFc片段結構有關,如切除Fc段後所剩餘的Fab並不能通過胎盤。IgG通過胎盤的作用是一種重要的自然被動免疫,對於新生兒抗感染有重要作用。
7 免疫球蛋白分子的抗原性
Ig本身具有抗原性,將Ig作爲免疫原免疫異種動物、同種異體或在自身體內可引起不同程度的免疫性。根據IgI不同抗原決定簇存在的不同部位以及在異種、同種異體或自體中產生免疫反應的差別,可把Ig的抗原性分爲同種型、同種異型和獨特型第三種不同抗原決定簇。
7.1 同種型
同種型(isotype)是指同一種屬內所有個體共有的Ig抗原特異性的標記,要異種體內可誘導產生相應的抗體,換句話說,同種型抗原特異性因種屬(specics)而異。同種型的抗原性位於CH和CLH ,同種型主要包括Ig的類、亞類,型和亞型。
1.免疫球蛋的類和亞類(classesand subclasses)
(1)類:決定Ig不同類的抗原性差異存在於H鏈的恆定區(CH)。根據CH抗原性的差異(即氨基酸組成、排列、構型、二硫鍵等不同)H鏈可分爲μ、γ、α、δ和ε五類,不同H鏈與L鏈組成完整Ig的分子別爲IgM、IgA、IgD和IgE。在基因水平上,不同類的H鏈恆定區的是由不同的恆定區基因片段所編碼。不同類Ig在理化性質及生物學功能上可有較大差異。
(2)亞類:同一類Ig中由於鉸鏈區氨基酸組成和二硫鍵數目的差異,可分爲不同的亞類,亞類間抗原性的差異要小於不同類之間的差異。目前已發現人的α重鏈有α1和α2兩個亞類,分別與L鏈組成IgA1和IgA2。γ重鏈有4個亞類,但命名爲IgG1、IgG2a、IgG2b和IgG3。IgM、IgD和IgG,目前尚未發現存在不同的亞類。Ig不同亞類也是由不同的恆定區基因片段編碼。
2.免疫球蛋白的型和亞型(typesand subtypes)
(1)型:決定Ig型的抗原性差異存在於L鏈的恆定區(CL),根據CL抗原性的差異(氨基酸的組成、排列和構型的不同)分爲κ和λ輕鏈之比約爲2:1;而在小鼠,97%輕鏈爲κ型,λ型只佔3%左右。
(2)亞型:根據λ輕鏈恆定區(C2)個別氨基酸的差異又可分λ1、λ2、λ3和λ4四個亞型。λ1和λ2在λ輕鏈190位氨基酸的分別爲亮氨酸和精氨酸,λ3和λ4在第154氨基酸分別爲某氨酸和絲氨酸。
7.2 同種異型
同種異型(allotype)是指同一種屬不同個體間的Ig分子抗原性的不同,在同種異體間免疫可誘導免疫反應。同種異型抗原性的差別往往只有一個或幾個氨基酸殘基的不同,可能是由於編碼Ig的結構基因發生點突變所致,並被穩定地遺傳下來,因此Ig同種異型可作爲一種遺傳標記(genetic markers),這種標記主要分佈在CH和CL上。
1.γ鏈上的同種異型 γ1、γ2γ3和λ4重鏈上均存在有同種異型標記,目前已發現:Glma、x、f、z;G2mn;G3mgl、g5、b0、b1、b3、b4、b5、c3、c5、s、t、u、v;G4m4a、4b。共20種左右。其中G表示λ鏈,1、2、3或4表示亞類λ1、λ2、λ3和λ4,m代表標記(marker)。
除Glmf和z位於IgG1分子的Cγ1區外,其餘的Gm均位於Fc部位。一條γ鏈可能同時具有一個以上的Gm標誌,如白種人常常在γ1H鏈Cγ1區有G1mz,Fc部位有G1ma。由於人第14號染色體編碼四種IgG亞類的C區基因Cγ1、Cγ2、Cγ3和Cγ4是密切連鎖的,因此IgGH鏈各亞類Gm標記可作爲間倍體(haplotype)遺傳給子代。
2.α鏈上的同種異型 α2H鏈已發現有A2m1和A2m2兩種。A2m1在411、428、458和467位氨酸上分別爲苯丙氨酸、天冬氨酸、亮氨酸、纈氨酸;A2m2則分別爲蘇氨酸、穀氨酸、異亮氨酸和丙氨酸。α1H鏈上尚未發現有同種異型存在。
3.ε鏈上的同種異型目前只發現Em1一種同種異型。
4.κ鏈上的同種異型舊稱爲Inv,現分爲Km1、2和3。Km1在153位和191位氨基酸上分別爲纈氨酸和亮氨酸,Km2分別爲丙氨酸和亮氨酸,Km3分別爲丙氨和纈氨酸。λ輕鏈上尚未發現有同種異型。
7.3 獨特型
獨特型(idiotype)爲每一種特異性IgV區上的抗原特異性。不同抗體形成細胞克隆所產生的IgV區具有與其客觀存在抗體V區不同的抗原性,這是由可變區中成其是超變區的氨基酸組成、排列和構型所決定的。所以,在單一個體內所存在的獨特型數量相當大,可達107以上。獨特型的抗原決定簇稱爲獨特位(idiotope),可在異種、同種異體以及自身體內誘產生相應在的抗體,稱爲抗獨特型抗體(antiidiotypicantibody,αI d),獨特型和抗獨型抗體可形成複雜的免疫調節中佔有得要地位。
| 分類 | 抗原性存在部位 | 舉例 | |
| 同種型 | 類 亞類 型 亞型 | CH CH CL CL(λ) | IgM、IgG、IgA、IgD、IgE IgG1-4,IgA1、2 κ、λ λ1、λ2、λ3、λ4 |
| 同種異型 | CH(λ1) (λ2) (λ3) (λ4) CH(α2) CH(ε) CL(κ) | G1ma(1)、x(2)、f(3)、z(17) G2mn(23) G3mb1(5)、c3(6)、b5(10)、b0、(11)b3(13)、b4(14)、s(15)、t(16)、g1(21)、c5(24)、u(26)、v(27)、g1(28) G4m4a(1)、4b(1) A2m1、2 Em1 Km1、2、3 | |
| 獨特型 | VHVL | 極多 | |
注:γ1~γ4同種異型的命名中,WHO1976年建議採用阿拉數字代號,但目前許多專業實驗室仍沿用小寫英文字母,在本表中將γ鏈同種異型阿拉伯數字代號列於相應英文字母代號後的括號中
8 免疫球蛋白分子的超家族
應用DNA序列分析和X晶體衍射分析等研究表明,許多細胞膜表面和機體某些蛋白質分子,其多肽鏈摺疊方式與Ig摺疊相似,在DNA水平和氨基酸序列上與IgV區或C區有較高的同源性,它們可能從同一原始祖先基因(primodial ancestral gene)經複製和突變衍生而來。編碼這些多肽鏈的基因稱爲免疫球蛋白基因超家族(immunoglobulin gene superfamily),這一基因超家族所編碼的產物稱爲免疫球蛋白超家族(immunogloblin superfamily,IGSF)。
8.1 免疫球蛋白超家族的組成
由於細胞表面標記、單克隆抗體以及基因工程研究的進展,近年來發現屬於IGSF的成員已達近百種,主要包括T細胞、B細胞抗原識別受體和信號傳導分子,MHC及相關分子,Ig受體,某些細胞因子受體,神經系統功能相關分子,以及部分白細胞分化抗原(CD)(表2-2)。
表2-2 免疫球蛋白超家族的組成(成員舉例)
| 主要功能 | 成員 |
| 抗原識別受體和信號傳導分子 | IgH鏈:μ、γ、δ、ε和α鏈 IgL鏈:κ和λ鏈 SmIg複合物成分:MG-1(Ig-α,CD79a)、B29(Ig-β,CD79b) TCR:α、β、γ和δ鏈 CD3:γ、δ和ε鏈 |
| MHC及其相關分子 | MHCⅠ類抗原:α鏈、β2M MHCⅡ類抗原:α、β鏈 β2M相關分子:CD1、Qa、TL |
| 免疫球蛋白受體 | PolyIgR(pIgR) IgG Fc段受體:FcγRⅠ(CD64)、FcγRⅡ、FcγRⅢ(CD16) Ige Fc段受體:FcεRIα鏈 IgE Fc段受體:FcαR |
| 細胞因子受體 | IL-1R(CDw121a),IL-6R(CD126),M-CSFR(CD115),G-CSFR、SCFR(CD117),PDGFR |
| 白細胞分化抗原 | CD2,LFA-3(CD58),ICAM-1(CD54),ICAM-2(CD102)、ICAM-3(CD50),CD4,CD8α、β鏈,CD28,B7/BB1(CD80),CD7,CD22,CD33,CD48,CEA(CD66e),Thy-1(CDw90),PECAM-1(CD31),VCAM-1(CD106) |
8.2 免疫球蛋白超家族的特點
1.IGSF的結構特點 IGSF的成員均含有1~7個Ig樣功能區,第個Ig樣功能區約含100(70~110)個氨基酸殘基,功能區的二級結構是由3~5個股反平行β摺疊股各自形成兩個平行β片層的平面(anti-paralle β-pleated sheet),每個反平行β摺疊股由5~10個氨基酸基組成,β片層內側的疏水性氨基酸起到穩定Ig摺疊的作用,大多數功能區內有一個二硫鍵,垂直連接兩個β片層,形成二硫鍵的兩個半胱氨酸間有55~75個氨基酸殘基,使之成爲一個球形結構,肽鏈的這種摺疊方式稱爲免疫球蛋摺疊(Ig fold)。
根據IGSF功能區中Ig摺疊方式、兩個半胱氨酸之間氨基酸殘基的數目以及與IgV區或C區同源性的程度,IGSF功能區可分爲V組、C1組和C2組。
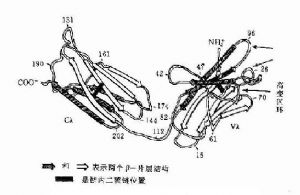
圖2-11 人Ig輕鏈(λ)多肽摺疊示意圖
(1)V組:V組功能區的兩個半胱氨酸之間含65~75個氨基酸殘基,有9個反平行β摺疊股,如IgH鏈和L鏈V區,TCRα、β、γ、δ鏈V區,CD4v區,CD8α、β鏈V區,Thy-1,pIgR和分泌成分(SC)N端四個功能區,CEAN端第一個功能區,PDGFR靠近胞膜的功能區等。
(2)C1組:又稱C組。C1組功能區二個半胱氨酸之間約含50~60個氨基酸殘基,有7個β摺疊股,如IgH鏈和L鏈C區(γ、δ和α鏈的CH1~CH3或μ和ε鏈的CH1~CH4),TCRα、β、γ、δ鏈C區,MHc Ⅰ類分子重鏈α3功能區,β2M,MHCⅡ類分子α2和β2功能區,CD1、Qa和TL靠近胞膜功能區等。
(3)C2組:又稱H組。C2組功能區的氨基酸排列的順序類似V組,但形成二硫鍵的兩個半胱氨酸之間所含氨基酸殘基數約爲50~60,有7個β摺疊股,這種結構介於V組和C1組之間,如CD3γ、δ和ε鏈,CD2和LFA-3(CD58),pIgR靠近胞膜功能區,FcγRⅠ、FcγRⅡ、FcγRⅢ、FcεRⅠα鏈、FcαR,ICAM-1,CEA第2至7個功能區,IL-6R、M-CSFR、G-CSFR、SCFR。PDGFR第1至4功能區,以及N-CAM、CD22、CD48分子等。
2.IGSF功能特點 IGSF的功能是以識別爲基礎,因此又稱爲識別球蛋白超家族(cognoglobulinsuperfamily)。IGSF很可能最起源於原始的具有粘功能的基因,通過複製和突變衍生形成了識別抗原、細胞因子受體、IgFc段受體、細胞間粘附分子以及病毒受體等不同的功能區。IGSF識別的基本方式有以下幾種。
(1)IGSF和IGSF相互識別:①同嗜性相互作用(heterophilicinteraction)如相同神經細胞粘附分子(N-CAM)之間的相互識別,血小板內皮細胞粘附分子-1(PECAM-1,CD31)的相互識別;②異嗜性相互作用( heterophilic interaction),如CD2與LFA-3,CD4與MHCⅡ類分子的單態部分(α2和β2),CD8與MHCⅠ類分子的單態部分(α3),poly IgR與多聚Ig,FcγRⅠ(CD64)、FcγRⅡ(CD32)、FcγRⅢ(CD16)與IgG Fc 段,FcγRⅠ與Ige Fc段,FcαR(CD89)與IgA Fc段,CD28與B7/BB1(CD80)等之間的相互識別。
(2)IGSF和結合素(integrin)相互識別:如ICAM-1(CD54)、ICAM-2(CD102)與LFA-1(CD11a/CD18),VCAM-1(CD106)與VLA-4(CD49d/CD29)之間的相互作用。
9 各類免疫球蛋白的生物學活性
不同Ig其合成部位、合成時間、血清含量、分佈、半衰期以及生物學活性有所差別。
9.1 IgG
IgG主要由脾、淋巴結中的漿細胞合成和分泌,以單體形式存在。在個體發育過程中機體合成IgG的年齡要晚於 IgM,在出生後第3個月開始合成,3~5歲接近成年人水平。IgG是血清中主要的抗體成分,約佔血清總Ig的75%。根據IgG分子中γ鏈抗原性差異,人IgG有4個亞類:IgG1、IgG2、IgG3和IgG4(小鼠4個亞類是IgG1、IgG2a、IgG2b和IgG3)。其中IgG3γ3鉸鏈區含有62個氨基酸殘基,具有4個重複γ1鉸鏈區(15個氨基酸殘基)的串連結構,重鏈間二硫鍵數量多,約10~15個,因此易被蛋白酶裂解,半衰期也較短。不同IgG亞類的生物學活性有所差異(表2-3)。IgG的半衰期相對較長,約爲20~30天。IgG可通過經典途徑活化補體,其固定補體的能力依次是IgG3>IgG1>IgG2,在小鼠爲IgG2b>IgG2a>IgG3,人的IgG4和小鼠的IgG1無固定補體的能力。IgG是唯一能通過胎盤的Ig,在自然被動免疫中起重要作用。此外IgG還具有調理吞噬、ADCC和結合SPA等作用。由於IgG上述特點,IgG在機體免疫防護中起着主要的作用,大多數抗菌、抗病毒、抗毒素抗體都屬於IgG類抗體。應用對麻疹、甲型肝炎等有免疫力的產婦或正常人丙種或胎盤球蛋白可進行人工被動免疫,能有郊地預防相應的傳染性疾病。不少自身抗體如抗甲狀腺球蛋白抗體、系統性紅斑狼瘡的LE因子(抗核抗體)以及引起Ⅲ型變態反應免疫複合物中的抗體大都也屬於IgG。
| 性質 | IgG1 | IgG2 | IgG3 | IgG4 |
| 重鏈及其分子量(kD) | γ1(52) | γ2(52) | γ3(58) | γ4(52) |
| 單體分子量(kD) | 146 | 146 | 170 | 146 |
| 鉸鏈區氨基酸數目 | 15 | 12 | 62 | 12 |
| 血漿中半衰期(天) | 21~23 | 21~23 | 7~8 | 21~23 |
| 血清濃度(mg/dl) | 800 | 400 | 80 | 40 |
| 固定補體 | ++ | + | +++ | - |
| 結合FcR:FcγRⅠ FcγRⅡ FcγRⅢ | +++ +++ ++ | - + - | +++ +++ ++ | + + - |
| 結合SPA | + | + | + | - |
| 通過胎盤 | ++ | + | ++ | ++ |
9.2 IgA
IgA主要由粘膜相關淋巴樣組織產生,其中大部分是由胃腸淋巴樣組織所合成,少部分由呼吸道、唾液腺和生殖道粘膜組織合成。哺乳期產婦腺組織含有大量IgA產生細胞,這些細胞主要來自胃腸。在人類,還有少量的IgA來自骨髓。人出生後4~6月開始合成IgA,4~12歲血清中含量達成人水平,血清型IgA總Ig的10%左右,半衰期約5~6天。IgA有IgA1和IgA2兩個亞類。IgA1主要存在於血清中,約佔血清中IgA的85%,α1鏈分子量爲56kD;IgA2主要存在於外分泌液中,少部分以血清型IgA存在,約佔血清中IgA的15%,α2鏈缺乏鉸鏈區,分子量爲52kD。血清中的IgA除單體形式外還有由J鏈共價相連的二聚體或三聚體等形式。分泌型IgA是由J連接的雙體和分泌成分所組成,主要存在於初乳、唾液、淚液、胃腸液、支氣管分泌等外分泌液中,是粘膜局部免疫的最重要因素,分泌型IgA通過與相應的病原微生物(如脊髓灰質炎病毒)結合,阻抑其吸附到易感細胞上,分泌型IgA還可中和毒素如霍亂弧菌毒素和大腸杆毒素等。新生兒易患呼吸道、胃腸道感染可能與IgA合成不足有關。慢性支氣管炎發作與分泌型IgA的減少也有一定關係。產婦可通過初乳將分泌型IgA傳遞給嬰兒,這也是一種重要的自然被動免疫。嗜酸性粒細胞、中性粒細胞和巨噬細胞表達FcαR,血清型單體IgA可介導調理吞噬和ADCC作用。此外,分泌型IgA具有免疫排除(immune exclusion)功能,即分泌型IgA結合飲食中大量的可溶性抗原以及腸道正常菌羣或病原微生物所釋放的熱原物質,防止它們進入血液。
9.3 IgM
血清中IgM是由5個單體通過一個J鏈和二硫鍵連接成五聚體,分子量最大,爲970kD,沉降係數爲19S,稱爲巨球蛋白(macroglobulin)。在分子結構上IgM無鉸鏈區,Cμ2可能替代了鉸鏈區的功能。在生物進化過程中IgM是最早出現的免疫球蛋白,如八目鰻可產生IgM。在個體發育過程中,無論是B細胞膜表面Ig(SmIg),還是合成分泌到血清中的Ig,IgM都是最早出現的Ig,在胚胎髮育晚期的胎兒即有能力產生IgM。在抗原刺激誘導體液免疫應答過程中,一般IgM也最先產生。IgM佔血清總Ig的5%~10%。由於IgM在免疫應答早期產生,並在補體參與下的溶血作用比IgG強500倍以上,而且活化補體後通過C3B、C4b等片段發揮調理作用,因此IgM在機體的早期免疫防護中佔有重要地位。天然的血型抗體(凝集素)爲IgM,血型不符的輸血,易發生嚴重的溶血反應。IgM不能過胎盤,臍血中如出現針對某種病原微生物的IgM,表示胚胎期有相應病原微生物如梅毒螺旋體、風疹或巨細胞毒等感染,稱爲胚胎感染或垂直感染。正常人血清中也含有產量單體IgM。
膜表面IgM是B細胞識別抗原受體中一種主要的SmIg。成熟B細胞有SmIgD,在正常人B細胞庫(Bcell repretorire)中SmIgM+B細胞約佔80%。在記憶B細胞中SmIgM逐漸消失,被SmIgG、SmIgA或SmIgE所替代。
9.4 IgD
IgD於1995年從人骨髓瘤蛋白中發現,分子量爲175kD,主要由扁桃體、脾等處漿細胞產生,人血清中IgD濃度爲3~40μg/ml,不到血清總Ig的1%,在個體發育中合成較晚。IgD鉸鏈區很長,且對蛋白酶水解敏感,因此IgD半衰期很短,僅2.8天。血清中IgD確切的免疫功能尚不清楚。在B細胞分化到成熟B細胞階段,除了表達SmIgD,抗原刺激後表現爲免疫耐受。成熟B細胞活化後或者活化後或者變成記憶B細胞時,SmIgD逐漸消失。
9.5 IgE
IgE是1966年發現的一類Ig,分子量爲188kD,血清中含量極低,僅佔血清總Ig的0.002%,在個體發育中合成較晚。ε鏈有4個CH(Cε1~Cε4),無鉸鏈區,含有較多的半胱氨酸和甲硫氨酸。對熱敏感,56℃、30分鐘可使IgE喪失生物學活性。IgE主要由鼻咽部、扁桃體、支氣管、胃腸等粘膜固有層的漿細胞產生,這些部位常是變應原入侵和I型變態反應發生的場所。IgE爲親細胞抗體,Cε2和Cε3功能區可與嗜鹼性粒細胞、肥大細胞膜上高親和力FcεRⅠ結合。變應原再次進入機體與已固定在嗜鹼性粒細胞、肥大細胞上IgE結合,可引起Ⅰ型變態反應。寄生蟲感染或過敏反應發作時,局部的外分泌液和血清中IgE水平都明顯升高。
| IgG | IgA | IgM | IgD | IgE | |
| 重鏈名稱 | γ | α | μ | δ | ε |
| 重鏈功能區數目 | 4 (Vγ、Cγ1、Cγ2、Cγ3) | 4 (Vα 、Cα1、 Cα2、Cα3) | 5 (Cμ、Cμ1、Cμ2、Cμ3、Cμ4) | 4 (Vδ、Cδ1、Cδ2、Cδ3) | 5 (Vε、Cε1、Cε2、Cε3、Cε4) |
| 主要存在形式 | 單體 | 單體、雙體 | 五聚體 | 單體 | 單體 |
| MW(Kd) | 146~170 | 160,400 | 970 | 175 | 188 |
| 平均含碳水化合物(%) | 4 | 10 | 12 | 18 | 12 |
| 成人血清濃度(mg/dl±SD) | 1150±300 | 210±50 | 150 | 0.3~4 | 0.002 |
| 佔血清總Ig% | 75 | 10 | 5~10 | <1 | <0.001 |
| 存在於外分泌液中 | - | +++ | + | - | - |
| 經典途徑活化補體 | ++(IgG> IgG>IgG2) | - | +++ | - | - |
| 替代途徑活化補體* | + | + | ? | + | + |
| 結合吞噬細胞 | ++(IgG3>IgG1) | + | - | - | +(嗜酸性粒細胞) |
| 結合肥大細胞和嗜鹼性粒細胞 | - | - | - | - | +++ |
| 結合SPA | + | ± | ± | - | - |
| 半衰期(天) | 20~23(IgG3)爲7~8 | 5.8 | 5.1 | 2.8 | 2.5 |
| 合成部位 | 脾、淋觀點結漿細胞 | 粘膜相關 淋巴樣組織 | 脾、淋巴結、漿細胞 | 扁桃體、脾漿細胞 | 粘膜固有層漿細胞 |
| 開始合成時間 | 生後3月 | 4~6月 | 胚胎後期 | 較晚 | 較晚 |
| 達成人水平時間 | 3~5歲 | 4~12歲 | 6月~1歲 | 較晚 | 較晚 |
| 通過胎盤 | + | - | - | - | - |
| 免疫作用 | 抗菌、抗病毒、抗毒素,自身抗體 | 粘膜局部免疫作用,抗菌、抗病毒,免疫排除功能 | 早期防禦作用,溶菌,溶血,SmIgM,天然血型抗體,類風溼因子 | SmIgM+ SmIgD+ 正應答 | 抗寄生蟲感染I型超敏反應 |
*聚合的Ig
10 免疫球蛋白基因的結構和抗體多樣性
Ig分子是由三個不連鎖的Igκ、Igλ和IgH基因所編碼。Igκ、Igλ和IgH基因定位於不同的染色體上(表2-5)。編碼一條Ig多肽鏈的基因是由在胚系中多個分隔的DNA片段(基因片段)經重排而形成的。1965年Dreyer和Bennet首先提出假說,認爲Ig的V區和C區是由分隔存在的基因所編碼,在淋巴細胞發育過程中這兩個基因發生易位而重排在一起。1976年日本學者利根川進應用DNA重組技術證實了這一假說。利根川進由此獲得1987年醫學和生理學諾貝爾獎。
10.1 Ig重鏈基因的結構和重排
(一)重鍵V區基因
H鏈V區是由V、D、J三種基因片段經重排後組成。
1.H鏈V區基因組成
(1)V基因片段:小鼠VH基因段約爲250~1000,人的VH基因片段約爲100。V基因片段編碼VH的信號序列和V區靠N端98個氨基酸殘基,包括CDR1和CDR2。
(2)D基因片段:D是指多樣性(diversity)。D基因片段僅存在於H鏈,不存在於L鏈。小鼠DH共有12個片段,人的DH片段的數目還不完全清楚,可能有10~20個左右。D片段編碼H鏈CDR3中大部分氨基酸殘基。
(3)J基因片段:J是連接(joining)的意思。JH連接V基因片段和C基因片段。小鼠JH有4個,人有9個JH片段,其中6個是有功能的。J基因片段編碼CDR3的其餘部分氨基酸殘基和第4個骨架區。
2.H鏈V區基因的移位 首先發生D與J基因片段的連接形成D-J,然後V基因片段與D-J基因片段連接。H鏈V區基因的易位和連接是通過七聚體-間隔序列-九聚體識別信號和重組酶而完成的。
(二)重鏈C區基因
1.C基因片段小鼠H鏈區基因片從5’端到3’排列的順序是Cμ-Cδ-Cγ3-Cγ1-Cγ2b-Cε-Cα2,人H鏈C區基因的順序爲Cμ-Cδ-Cγ3-Cγ1-Cε2(pseudo基因)- Cα2- Cγ2-Cγ- Cε- Cα2(圖2-13,14)。

圖2-13小鼠Ig基因結構
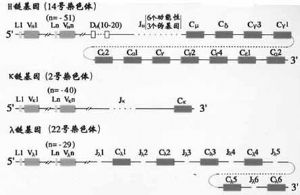
圖2-14 人Ig基因結構
2.Ig類別轉換(class switch) 是指一個B細胞克隆在分化過程中,V基因不變,而CH基因片段不同重排,比較CH基因片段重排後基因編碼的產物,其V區相同,而C區不同,即識別抗原的特異性相同,而Ig的類或亞類發生改變。Ig可能是通過缺失模式(deletion model)和RNA剪接(splicing)兩種機制來實現類別的轉換。
(三)膜表面Ig重鏈基因
膜表面Ig(Sm Ig)是B細胞識別抗原的受體。(Sm Ig)和分泌性Ig的H鏈結構相類似,所不同的是smIgH名字的羧基端多含一段穿膜的疏水性氨基酸殘基和胞漿區。因此SmIgH鏈的轉錄本(transcript)要比分泌性IgH鏈轉錄本多1~2個外顯子。編碼H鏈的羧基端部分,其氨基酸殘基的的數目視H鏈不同而有差異,如在小鼠或人SmIgμ鏈的這一部分長約41個氨基酸殘基,而小鼠SmIgε鏈此區域卻有72個氨基酸殘基。這個區域包括三個部分:①一個酸性間隔子,與H鏈最後一個CH功能區相同,位於胞膜外側;②含26個氨基酸殘基的疏水區,爲穿膜部分;③胞漿內部分,3~28個氨基酸殘基不等。
10.2 Ig輕鏈基因的結構和重排
在IgH鏈基因重排後,L鏈可變區基因片段隨之發生重排。在L鏈中,κ鏈基因先發生重排,如果κ基因重排無效,隨即發生λ基因的重排。L鏈匠CDR1、CDR2和大部分CDR3由Vκ或Vλ基因片段所編碼(Vκ編碼95個氨基酸殘基),Jκ或Jλ基因片段編碼CDR3的其餘部分和第四個骨架區(Jλ編碼從96位到108位氨基酸)。L鏈無D基因片段。
κ鏈基因是V基因片段(Vκ)、J基因片段(Jκ)和C基因片段(Cκ)重排後組成。小鼠Vκ基因片段約有250,Jκ有5個(其中4個功能),Cκ只有1個。人Vκ基因片段約有100個,Jκ有5個。Cκ也只有1個。Vκ與Cκ之間以隨機方式發生重排。
κ鏈基因也是由Vλ、Jλ和Tλ基因片段經重排後組成。小鼠Vλ基因片段有3個:Vλ1、VλX;4個Jλ和4個Cλ基因片段,分爲(Jλ2Cλ2,Jλ4Cλ和Jλ3Cλ3,Jλ1Cλ1)兩組。它們的基因重排比較複雜。人Vλ約有100個,至少有6個Cλ與各自的J基因片段相連,人λ鏈確切的重排情況還不清楚。
10.3 抗體多樣性的遺傳學基礎
機體對外界環境中種類衆多抗原刺激可產生相應的特異性抗體,推算出抗體的多樣性在107以上。抗體多樣性主要由基因控制。
1.胚系(germ line)中衆多的V、D、J基因片段 在胚繫上,尚未重排的Ig基因片段數量相當多,這是生物在長期進化中形成的。表2-6例舉了小鼠H鏈和L鏈重排的多樣性以及H鏈和κ鏈相互隨機配對所推算的多樣性數目。
表2-6 小鼠Ig多樣性(舉例)
*多樣性數目不包括VDJ連接多樣性、N區插入和體細胞突變所增加的多樣性數目
2.VDJ連接的多樣性在L鏈基因重排過程中V-J連接位點有一定的變異範圍,例如VL基因片段3'端5個核苷酸CCTCC和JL基因片段5'端4個核苷酸GTGG連接時,總共9個核苷酸中只有6個核苷酸編碼L鏈第95、96位氨基酸,因此可產生8種不同的連接方式。在H鏈基因重排過程中K-J以及V-D-J連接時都可有連接多樣性的存在。
3.體細胞突變(somaticmutation)體細胞在發育過程中可發生基因突變。以長期體外培養的B細胞前體爲例,每個細胞每個鹼基對的突變率約爲1~43×10-5,這種點突變主要發生在V基因。體細胞突變擴展了原有胚系衆多基因片段重排的多樣性。
4.N區的插入在IgH鏈基因片段重排過程中,有時可通過無模板指導的機制(nontempletdirected mechanism),在重組後D基因片段的兩側即VH-DH或DH-JH連接處額外插入稱爲N區的幾個核苷酸。N區不是由胚系基因所編碼。在N區插入前,先通過外切酶切除VH-DH或DH-JH連接處幾個鹼基對,然後通過末端脫氧核苷酸轉移酶(terminal deoxynucleotidyl transferase,TdT)連接上N區。由於額外插入了N區,可發生移碼突變(fuame shift mutation),使插入部位以及下游的密碼子發生改變,從而編碼不同的氨基酸,大大地增加了抗體的多樣性。
5.L鏈H鏈相互隨機配對 如表2-6所示,小鼠H鏈和κ鏈隨機配對後推算其多樣性可達4.8×107,如果再加上H鏈與λ鏈的隨機配對其多樣性應更多了。
12 藥品介紹
12.1 適應症
肝炎:在接觸前或在甲肝潛伏期中應用本品有保護作用。對接觸甲肝源二週內亦可用本品預防。 麻疹:易感者接觸傳染源在6日以內,特別是有接觸可能的1歲以下嬰兒應以本品預防。 免疫球蛋白缺乏病人應用本品可預防嚴重感染。 水痘:如無水痘一帶狀皰疹免疫球蛋白可以本品來改善水痘病毒的感染。
12.2 用量用法
肌肉注射: 1.甲肝接觸後預防:成人和兒童皆爲每公斤體重0.02ml,應於接觸後儘快給予。如接觸2周或症狀發生後無需再用。 2.擬去甲肝流行區,預計停留2個月以內者預防:成人和兒童皆爲每公斤體重0.02ml;長期停留者每5個月復注每公斤體重0.06ml,接觸後預防每公斤體重爲0.02ml。 3.接觸麻疹不到6日者預防量爲每公斤體重0.25ml。 4.免疫球蛋白缺乏的成人和兒童,預防量開始爲每公斤體重1.32ml,以後每3周~4周每公斤體重0.66ml。注射次數視病情收效而定。