1 概述
現代囊外白內障摘除聯合人工晶狀體植入術,以其操作簡單、安全、併發症少、無晶狀體眼可得到一期矯正等優點,迅速得到普及。20世紀80年代初,現代囊外白內障摘除技術被介紹到我國。此後,在眼科同道的共同努力下得到迅速普及和提高。至80年代中後期,國內顯微手術的開展已形成相當規模。
幾乎與此同時,一種全新概念的現代手術——超聲乳化白內障吸出術已經逐漸在臨牀普及。20世紀90年代,是超聲乳化白內障吸除技術發展最快的時期。發達國家幾乎95%以上白內障醫生可以熟練掌握這一技術。我國現代白內障手術技術發展儘管不太平衡,但經過不懈努力,總體水平已與發達國家基本持平。
國內許多學者對現代囊外白內障摘除技術進行不斷探索。其中最突出的特點是借鑑了在保持囊外手術基本特點基礎上,採用超聲乳化手術的小切口進行非超聲乳化白內障摘除術。這一手術不但要求術者有熟練的囊外白內障手術技術,還要求掌握諸如隧道切口、撕囊、水分離、劈核等超聲乳化手術技巧,使現代囊外白內障手術技術又向前推進了一大步。
超聲乳化白內障吸除技術集光、機、電等高科技於一體,是近10年來眼科臨牀發展最快的臨牀技術之一。開展超聲乳化手術初期由於嚴重的併發症如角膜失代償引起的大泡性角膜病變等,使許多眼科醫生望而生畏。如何減少或防止這一併發症的發生已引起臨牀的廣泛注意。研究結果表明,能量越高,超聲時間越長,引起角膜損傷越大。因此降低超聲能量和縮短乳化時間,是避免發生角膜併發症的最有效措施。因而推動由動力型超聲乳化向抽吸型超聲乳化的過渡。
隨着超聲乳化儀性能的不斷改進,高智能化的多功能超乳儀已避免了角膜及其他併發症。
在手術器械方面開發和創新了一大批專用性器械。專用於超聲乳化的制式手術刀具:包括隧道刀、側口刀、槍狀穿刺刀及擴口刀。每一種刀具均有固定的尺寸和形狀,以保證切口的規範化。鑽石刀是專用於製作透明角膜隧道切口而設計,其刀刃十分銳利,且肩寬及刃長恰好適應透明角膜隧道切口的要求。撕囊鑷則是專爲連續環形撕囊術而設計,可準確夾持前囊膜的任何部位。用於特殊手術技術的各種劈核器、切核器、旋核器等是最有代表的新型手術器械。這些手術器械設計巧妙,製作精良,在創新和完善新術式中起了重大作用。此外,專門用於各種類型的摺疊人工晶狀體植入的摺疊鑷、推注器、植入鑷等,也具有相當的專用性特點。
在人工晶狀體材料方面,除傳統的PMMA單片硬質晶狀體外,各種不同的軟性摺疊晶狀體材料在臨牀上得到越來越廣泛的應用。硅凝膠是最早在臨牀得到應用的軟性人工晶狀體材料之一,其後水凝膠、丙烯酸酯多聚物(Acrylic)等材料先後應用於臨牀。隨着科學技術水平的發展,白內障手術方法融進了更多的高科成分,使白內障手術成爲最具有挑戰性和先進性,並能代表當今眼科手術最新進展的手術方法之一。
在白內障手術麻醉方面,也有許多改良和創新。球后麻醉由於注射部位的特殊性,對操作要求比較高,稍有不慎容易產生嚴重併發症。爲提高麻醉安全性和操作方法更簡單的麻醉,除了倡導使用球周麻醉、筋膜囊下麻醉以外,表面麻醉作爲適合透明角膜切口的麻醉方法已受到廣泛重視。
正確掌握顯微手術基本操作技術,培養良好的手術素質,爲進一步學習掌握複雜手術操作是十分必要的。
本章內容正是基於這種考慮,重點介紹超聲乳化白內障吸除術及其相關技術,以期對現代的超聲乳化白內障手術技術有一個較全面瞭解。
2 應用解剖
2.1 角鞏膜緣解剖(Anatomy of Limlous)
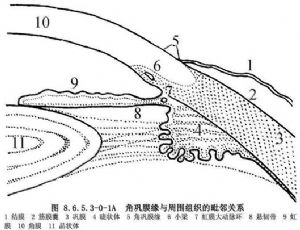
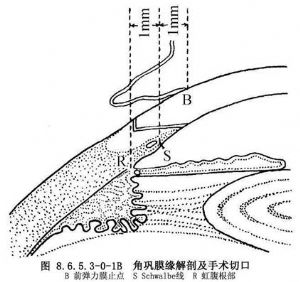
角鞏膜緣是角膜向鞏膜過渡的特殊組織區域,位於透明角膜和白色鞏膜之間,呈灰白色條帶狀外觀,寬約1.5~2.0mm。角鞏膜緣與周圍組織的毗鄰關係如圖8.6.5.3-0-1A。角鞏膜緣的毗鄰:前界相當於前彈力層止點(圖8.6.5.3-0-1B,B),即球結膜附着點的前面約0.75mm;後界則爲鞏膜突和虹膜根部(圖8.6.5.3-0-1B,R);中間以Schwalbe線(圖8.6.5.3-0-1B,S)爲界,將其分爲前、後兩部分。角鞏膜緣不僅是傳統和現代囊外白內障手術切口的進路,也是抗青光眼手術的必經之路。即使是超聲乳化手術中的鞏膜隧道切口,也與角鞏膜緣解剖特點密切相關。
2.2 晶狀體解剖(Anatomy of the Lens)
晶狀體囊膜作爲包繞晶狀體物質的最外層基底膜,對於維持晶狀體正常生理功能的重要性自不待言。然而,長期以來,囊膜對白內障手術本身和術後的意義,始終沒有引起足夠重視。直到現代顯微手術概念的建立,人們才發現晶狀體囊膜在現代白內障手術中已經發揮了越來越大的作用。因此,隨着囊外白內障摘除、超聲乳化手術以及人工晶狀體手術的不斷普及和提高,一個全新概念的手術方式—現代囊膜手術不斷形成和完善,成爲現代白內障手術的重要組成部分。
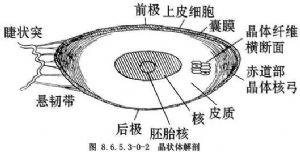
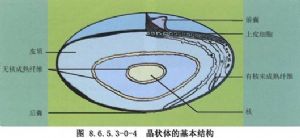
①晶狀體的位置和大小:晶狀體爲雙凸面體,嬰兒期晶狀體接近於球形,隨着年齡增長,前面漸趨扁平。成年人晶狀體直徑約爲9~10mm,平均厚度約爲4~5mm,晶狀體前後凸面交匯處即爲赤道部。藉助晶狀體懸韌帶使其懸掛於虹膜和玻璃體之間(圖8.6.5.3-0-2)。在年輕個體,晶狀體與玻璃體之間有一環形區相連,稱爲玻璃體囊膜韌帶(ligamentum hyaloidocapsul),這一環形區內的潛在腔隙稱爲Berger′s間隙。30歲以下個體,由於在這一區域內存在着晶狀體和玻璃體的緻密粘連,因此不宜作囊內白內障摘出。晶狀體的正常生理位置,構成了虹膜的可靠支持,如因各種原因致晶狀體脫位,虹膜將因失去支持而出現震顫。
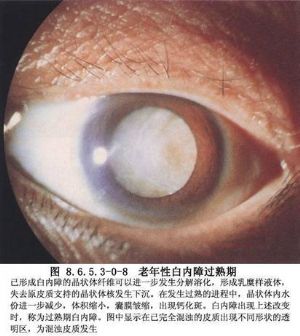
由於晶狀體纖維終生不斷形成,並被向核心部壓縮,因此晶狀體自出生後逐漸增大。這種增大趨勢到成年以後將變得越來越小,因此,成年人正常晶狀體的大小差異較小。但在病理情況下,晶狀體的厚度將發生明顯改變。比如老年性白內障膨脹期,晶狀體厚度可達7mm;而過熟期白內障,由於晶狀體核下沉使晶狀體顯著變薄,可僅爲2.5mm。
前房深度一般指晶狀體前極與角膜內表面間距離而言,正常平均爲3.5mm。當閉角型青光眼急性發作時,前房深度明顯變淺;而當因鈍傷致房角後退或房角劈裂時,因晶狀體虹膜隔後退而使前房加深。
②囊袋解剖:在現代白內障手術中,囊袋是實施許多手術步驟的重要場所,術後則是人工晶狀體永久性固定的位置。
據Ohmi和Apple等人對61只屍眼解剖材料測量發現,晶狀體直徑平均爲9.6±0.39mm;睫狀溝爲11.1±0.5mm;而睫狀突內徑約爲10.2mm(圖8.6.5.3-0-3)。
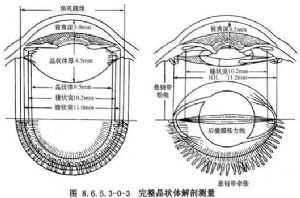
當去除晶狀體核及皮質後,囊袋呈虛脫狀態。此時,前後囊膜貼附在一起,而直徑卻略有擴大,從正常的9.5mm增加到10.5mm。應用Miyake技術活體觀察發現,植入12.0mm長的單片PMMA人工晶狀體後,囊袋將因牽張而成橢圓形,大約爲11.2×9.2mm。
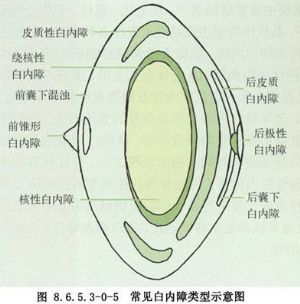
③懸韌帶具有相當好的彈性。一項尸解測量結果表明,分佈在前囊膜的懸韌帶可以被牽拉3.8mm的距離而不發生斷裂,同正常懸韌帶長度1.5~2.0mm比較幾乎伸張了2倍。不過抗牽張強度隨年齡而下降,大約每10年下降0.5mm。這在老年人羣中,如何防止術中懸韌帶離斷,是一個很重要的研究課題(圖8.6.5.3-0-4,8.6.5.3-0-5)。
3 術前檢查和麻醉
3.1 (1)白內障一般檢查(General Eamination for Cataract Surgery)
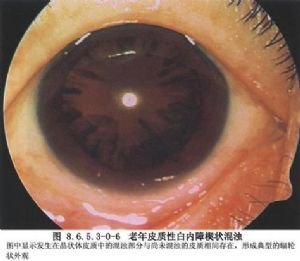
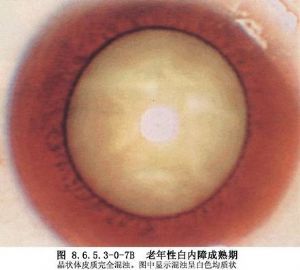
①裂隙燈顯微鏡檢查:檢查前充分散瞳及暗室條件是必須的。充分散瞳不僅全面瞭解晶狀體情況,同時也可查明是否有瞳孔部分或全部後粘連等(圖8.6.5.3-0-6~8.6.5.3-0-8)。

B.後照法:主要用於觀察前囊膜改變。可對前囊膜渾濁、隆起及凹陷作出判斷,即出現所謂魚皮樣粗糙面上的黑色斑。同時亦可根據囊膜表面反光色彩推測白內障發展程度。
C.直接焦點照明:即光學切面檢查法。可明確顯示晶狀體內光學不連續區。這些相互平行排列的光帶主要是由於不同層次相鄰組織界面折光指數不同形成的。從外到裏依次爲:a.囊膜;b.分離帶(即皮質纖維);c.成年核;d.嬰幼年核;e.胎兒核(含前、後Y字縫合);f.胚胎核。隨年齡增長,更多細微的不連續區附加在成年核外。這些不連續區代表晶狀體組織發育的不同階段,因此,不僅可以確定渾濁在晶狀體深部所佔據的部位,同時也是推測許多渾濁產生於生命中哪一時期的參照依據。
在前囊膜和分離囊之間存在一真正的光學空虛區,代表由上皮最新形成的纖維。這一空虛區如消失,往往是晶狀體代謝變化或白內障形成最早出現的徵象之一。
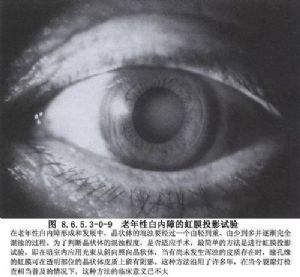
②虹膜新月影投照試驗:這是檢查白內障成熟程度最簡單易行的方法。從集中光源自側面照射於瞳孔區,如白內障已形成,則由於光反射面使瞳孔區呈白色反光。如果渾濁已擴展到前囊下(成熟期白內障),則白色反光區與瞳孔應相一致,視爲虹膜新月影投照度驗陰性;反之,如渾濁處於晶狀體某一定深度(未成熟白內障),則由於渾濁層次與瞳孔平面尚有一定厚度的透明皮質,因此,當自側方投照時,與光照方向同側瞳孔緣內形成的陰影,以典型的新月姿態,投映在晶狀體渾濁背景上。新月影程度與白內障成熟程度成反比。虹膜新月影投照試驗陽性代表進展期白內障,陰性代表成熟期白內障。對於晶狀體侷限性渾濁及周邊部渾濁,本方法將失去診斷價值(圖8.6.5.3-0-9)。
③眼內壓測定:術前瞭解眼內壓,判斷是否存在繼發於膨脹期白內障、晶狀體溶解、晶狀體半脫位、色素膜炎、進行性房角狹窄等的青光眼,進而決定採取何種術式,可提供重要參考。特別是人工晶狀體植入術前,更應對青光眼因素對手術可能產生的影響作出準確判斷(圖8.6.5.3-0-10)。
④房角檢查:對老年病人常規檢查前房角亦是有益的。慢性或亞急性閉角型青光眼,可望通過單純白內障摘出和周邊部虹膜切除得以解決。而開角型青光眼或外傷性房角後退,以及睫狀體脫離等存在時,應果斷作出是否需要做聯合手術(圖8.6.5.3-0-11)。

⑤瞳孔檢查:直接光反射遲鈍或消失,間接光反射正常,一般難望恢復正常中心視力。手術前要明瞭瞳孔散大能力。對於長期應用縮瞳劑或老年性瞳孔強直,瞳孔不能充分散大,術中應考慮做虹膜扇形全切或瞳孔括約肌切開。如發現瞳孔局部後粘連,在制定手術方案時要加以考慮。
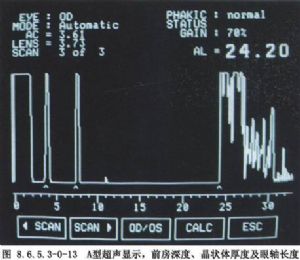
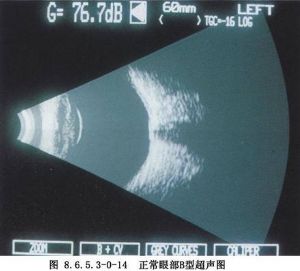
⑥A、B型超聲檢查:現代白內障摘出術抑或超聲乳化,術前例行B型超聲檢查是必要的。它爲了解眼內諸多病理情況提供了客觀診斷依據,如視網膜脫離、玻璃體出血、眼內腫瘤等。而人工晶狀體植入前,例行A超眼軸測量及角膜屈光度數的測量,其數據輸入超乳儀即可獲植入晶狀體的度數(圖8.6.5.3-0-12~8.6.5.3-0-14)。
3.2 (2)視功能評價(Evaluation of Visual Function):
①視力檢查:應分別檢查雙眼遠、近視力,以大致估計白內障所致視力損害的程度。對視力低下者,應例行光感、光定位、色覺檢查。在暗室內,遮蓋健眼,患眼前5m持一蠟燭光源,讓病人辨別出燭光是否存在,以確定是否有光感,而後,從不同的九個方向,測定其各方向的光定位能力(病人始終正視前方)。最後紅、綠玻片置於眼前,確定辨色能力是否正常。雙光源分辨試驗,即辨別眼前相距很近的二個光源的能力,對於判定視網膜功能亦有很重要意義。一旦瞭解視力結果無法用白內障程度解釋時,應做進一步特殊檢查。
②視野檢查:對於輕度或中等程度的白內障,做準確的視野檢查,必要時行Amsler屏檢查,以確定是否有中心暗點或視物變形,對於提示可能同時存在的青光眼或其他眼底病是極有意義的。周邊視野也可通過數指法大致確定。一般說來,除非視力極度低下(如近成熟白內障),應能在固視點周圍45°範圍內做準確數指。
③視覺電生理檢查:視網膜電流圖(electroretinogram,ERG)對於評價黃斑部視網膜功能有重要價值。緻密渾濁的晶狀體由於對光的吸收和散射作用而影響檢查效果。閃光ERG可用於低視力眼的檢查。視網膜脫離特別是視網膜遺傳性變性性疾病的ERG檢查具有肯定的臨牀意義。此外,外傷眼的ERG檢查對於判斷視網膜脫離和鐵質沉着徵的存在亦具臨牀意義。
研究表明,單純白內障患者F-ERG反應相當於弱光刺激正常眼,白內障僅是減弱了達到視網膜的刺激光強度。因此,非常緻密的琥珀色核性白內障可能因爲阻隔光線,導致標準光刺激下記錄不到F-ERG。
閃光VEP(Flash VEP,F-VEP)反映視路傳導和視皮質功能,當黃斑部病變和視神經損害時,其振幅均可降低。一些學者還認爲,F-VEP是屈光間質渾濁時檢查視功能的理想方法。即使術前因白內障影響視力低於0.1,其F-VEP預測術後視力的準確性亦高於80%。
值得注意的是F-ERG主要反映整個視網膜功能;而F-VEP則主要反映黃斑和視神經功能,二者有互補性。臨牀上,只有對兩種檢查結果結合起來一起分析,才能充分發揮電生理檢查的優勢,提高預測術後視力的準確性。
3.3 (3)眼局部評價與術式選擇(Choice of Procedures and Evaluation of Eye Condition)
對超聲乳化手術而言,晶狀體核越硬,需要破碎的超聲能量就越大,操作時間越長,發生相關手術併發症的可能性也愈大。對初學者來說,根據自己的技術水平,選擇適當核硬度的白內障,以最大限度保證手術的安全性,是由囊外白內障手術順利過渡到超聲乳化技術的重要保證。
白內障形成過程中,晶狀體核硬度不斷發生變化,同時伴隨顏色改變,而且二者存在一定的相關性。
年齡與核硬度也有密切關係,特別是初發白內障的年齡與核硬度關係更大。相同顏色的白內障如80歲病人的白內障核硬度顯然比60歲者要硬得多。
①晶狀體核硬度分級:晶狀體核硬度則主要是根據裂隙燈檢查結果,對其核顏色進行判斷而進行分級。
Ⅰ級(軟核):裂隙燈下爲透明或淡灰白色,一般爲皮質型或後囊下渾濁型白內障的特點;某些與代謝有關的白內障類型,其核硬度亦爲Ⅰ級。這種類型的白內障,因爲核質特別軟,比較容易被雕刻。因此,只需很小的能量即可將其吸除。
Ⅱ級(軟核):晶狀體核呈灰白或灰黃色。主要出現在後囊下渾濁型白內障中、晚期及年齡較輕的皮質型老年性白內障中。因核硬度稍大,對乳化頭及輔助器械均有阻抗,便於刻出一定形狀的溝槽。
Ⅲ級(中等硬度核):大多數老年性白內障的核硬度爲Ⅲ級,核呈黃色或淡棕黃色。這種白內障以核渾濁爲主,裂隙燈下光學切面可清晰勾勒出核界線,中心部顏色最深,漸漸向較淡的皮質過渡。這種核硬度的白內障是超聲乳化手術最佳適應證。
Ⅳ級(硬核):晶狀體核呈深黃色或淡琥珀色。多見於老年性白內障晚期或病史較長、視力極差的老年患者。這種白內障由於核較硬,往往需要較高的超聲能量,並需要較複雜的劈核手法相配合,因此不適合於初學者。
Ⅴ級(極硬核):臨牀上比較少見。晶狀體核呈深棕褐色或黑色,整個晶狀體呈現高密度團塊外觀。這類白內障,從操作難度或是從安全性考慮,不適於做超聲乳化手術。

②眼底紅光反射:眼底紅光反射是判斷晶狀體透明性的一個重要指標,同時可在一定程度上反映晶狀體密度。
軟核性白內障呈現明亮的紅光反射,並彌散至囊個晶狀體核;中等硬度核白內障,紅光反射亮度減弱,且可在瞳孔區彌散出淡棕褐色反光。硬核性白內障,由於核質緻密渾濁,眼底紅光反射很弱,有時僅在周邊部可見。至於Ⅴ級極硬核白內障,則瞳孔區除呈現深棕褐色反光外,無任何眼底紅光反射。
紅光反射強弱及均勻程度不僅可以反映晶狀體核密度,而且有助於判斷和確認撕囊的軌跡,也可以精確聚焦在晶狀體的任何層面,這對於保證術中操作的精確性是十分重要的。
③角膜狀態:角膜透明性不僅可反映角膜內皮功能及抗損傷儲備能力,同時也是可直接影響手術操作的關鍵因素之一。因此術前通過對角膜透明性檢查,對角膜功能狀態進行評價是必要的。對某些病例,例行角膜內皮檢查及角膜中央厚度測量,可以預估許多術後角膜併發症的發生。內皮細胞<1000/mm2時術後發生角膜內皮失代償危險性增加。
④虹膜狀態:虹膜組織結構正常,可保證對散瞳劑有正常反應。同時對輕度創傷、灌注壓以及超聲能量等有較好的耐受性。持續保持散瞳狀態,對於順利完成手術是重要的。虹膜營養不良時雖然可以充分散大,但不持久,特別是受到灌注液或手術器械刺激時,很容易縮小,以至影響手術進行。對術前散瞳效果不理想者,應作必要的心理準備及制定相應對策,必要時更換術式。
⑤前房深度:前房過淺往往是手術不順利的潛在因素。單就操作空間而言,由於距離角膜內皮過近,術中損傷角膜內皮的可能性也就越大。而且由於前房淺,插入乳化頭時也容易發生困難。尤其是術中虹膜特別容易自切口脫出者,很難使手術繼續進行。
相反,前房過深時術者很難使乳化針頭按正確角度操作,且因很難採用特殊劈核技術而使手術陷於僵局。此時,只有降低灌注瓶高度,以減少前房灌注壓。
⑥眼部其他情況:一般來說,眼部情況越複雜,或者說併發情況越多,越不利於手術操作。對初學者來說,選擇病例時還應注意下列情況。
A.重度屈光不正,特別是高度近視眼。這種病例,大多存在玻璃體液化及晶狀體小帶脆弱的情況,術中極易發生併發症。
B.葡萄膜炎,特別是反覆發作的前葡萄膜炎,並伴有廣泛後粘連者。在這種情況下,將增加很多非超聲乳化性手術步驟,使手術複雜化。術中瞳孔很難保持散大狀態並極易脫色素,均使術中術後併發症增多。
C.青光眼。不管是否曾經歷過濾過手術,都可能存在散瞳困難和淺前房問題。此外,術中眼壓難以控制,也是使手術失敗的潛在因素之一。
D.視網膜脫離。有視網膜脫離史的患者,很容易發生低眼壓,導致術中淺前房。有反覆多次手術史者,更應注意玻璃體液化及晶狀體小帶脆弱的情況。
E.眼外傷史。任何種類和程度的眼外傷,都有可能使晶狀體小帶斷裂,也可能併發其他更爲嚴重的眼組織損傷。如忽略這些情況的存在,將可能明顯影響手術的安全性。
F.眼球暴露程度。正常情況下,角膜頂點與上眶緣平齊。如不伴眼瞼解剖位置異常,則開瞼後,眼球暴露相當好。這不僅使整個手術操作更便捷,而且避免了眼瞼壓迫所致的眼壓增高的發生。如果眼球深陷,將使得手術器械無法按正規要求通過隧道切口,甚至使整個手術都無法進行。瞼裂過小,或由於眼瞼肥厚僵硬而使開瞼困難者,主要問題是限制手術野和眼瞼壓迫眼球。此時,最好做外眥部切開,並用縫線和鋼絲開瞼器雙重開瞼。
4 適應證
一般來說,凡適合作囊外白內障摘除術的病例,均可行超聲乳化吸除術。但在病例選擇上,應根據自身技術條件,確定相對選擇標準。
下面一些情況,應作選擇時參考:
1.瞳孔 術前散大瞳孔至少不小於6mm爲安全。初學者切不可選擇小瞳孔病例。
2.角膜 角膜完全透明是作好超聲乳化術的基本條件。角膜侷限性混濁、變性及有其他影響其透明性的病變,均不宜作本手術。
3.前房深度 術中必須保持前房有足夠深度,故頑固性淺前房者,在選擇病例時應作慎重考慮。
4.晶狀體核硬度 初學者應選擇核硬度適宜的病例,隨着熟練程度的不斷提高,可不斷擴大選擇範圍。
根據眼部檢查及晶狀體核硬度判斷結果,可確定理想的超聲乳化手術適應證。
③角膜內皮正常。
⑥前房深度正常。
⑦眼底紅光反射明亮均勻。
⑧前囊膜結構正常,有正常的緊張度。
?眼底正常。
白內障類型則以老年性白內障、併發性白內障及外傷白內障爲主,特別是以後囊下渾濁類型白內障最爲適合。年齡則以60±10歲爲適宜。超過70歲者,其核實際硬度比按顏色分級結果高一級。
5 禁忌證
1.有極硬度核(黑色核或部分深棕色核)白內障,脫位或半脫位的白內障不適合行超聲乳化吸除術。
對於初學者,應根據自身技術條件確定相對和絕對禁忌證範圍,並隨技術水平的提高不斷進行修正。
對於初學者的相對禁忌證:
②長期應用縮瞳劑的青光眼。
④各種原因所致的淺前房者。
⑤併發角膜內皮病變者。
絕對禁忌證:
①黑色極硬核白內障。
6 術前準備及麻醉
手術者的準備、病人的準備、術前全身常規檢查、術前眼部常規系統檢查、術前用藥、術前眼部處理見本書概述1.5、1.5.1、1.5.2、1.5.3及1.5.4。
①手術檯上的術前準備(Immediately Preoperative Preparations of the
operation):麻醉和軟化眼球的時機:麻醉和軟化眼球是在鋪無菌巾前進行,還是在其後進行,應根據手術種類、麻醉方式和病人的具體情況而定。
在白內障手術,爲縮短無菌操作時間和術前獲得良好的軟眼狀態,麻醉和軟化眼球一般在毒鋪巾之前進行。這樣做的優點是:①無孔巾遮擋,麻醉時更易識別進針的解剖標誌;②鋪單之前,病人一般處於較放鬆狀態,更容易配合操作;③可使用不同的壓迫器具軟化眼球;④充分利用前後手術的間隔時間,使銜接更爲緊密。
全身麻醉手術,局部輔助麻醉應在消毒鋪單後進行;如需軟化眼球,則可以手法按壓眼球。對青光眼手術、角膜移植手術等不需全麻的患者,局部麻醉亦應在無菌臺上進行;而像角膜穿孔傷一類的眼外傷患者,更應在一切無菌條件準備工作完成之後考慮球后麻醉,以免在臺下麻醉時,因壓迫眼球致眼內容物脫出等。
②病人體位(Position of Patients):
A.頭部水平。病人額部與頦部應在同一平面,以使眼球處於正常生理位置。由於顯微鏡的侷限性,術中不允許有較大的體位改變,眼位調整靠直肌或縫線牽引來完成。因此,如果頭位不正,將不利於術中眼位調整和操作。
B.平臥舒適。病人平臥,儘量使肢體舒展,手術牀應平坦有彈性,無凸起或凹陷。特別對於手術時間長的患者,術前應仔細檢查並清除鋪單下的異物,使牀單平整,以免因異物、皺褶對長時間壓迫,引起組織壞死。
C.特殊體位。某些手術如玻璃體切割術中的氣-液交換,要求病人採取特定體位。在有高級手術牀的條件下,這一體位可由電控開關變換牀的位置獲得;在一般手術牀上變換體位應由多人協助共同完成,嚴防墜牀。
D.頭架。必要時使用頭架,其高度應與患者額部大體持平。使用頭架既可固定病人頭部,又可作術者的臂託,使操作更加穩定。
(8)麻醉(Anesthesia):
①白內障手術常用的麻醉劑(Ordinary Anesthetics for Cataract Sargery):
A.表面麻醉劑:
a.丁卡因(dicaine):其麻醉效果較奴佛卡因強10倍,但毒性較之大20倍。優點是作用速度快,維持時間長,滴入結膜囊後1~3min發揮麻醉效果,可持續60min。
臨牀常用0.25%~1%濃度滴眼液。
b.諾維新(novesine):特點是作用快,不損害角膜上皮,一次點藥可維持麻醉效果30min。
a.普魯卡因(procaine):又名奴佛卡因(novocaine),爲最常用的局部麻醉劑。由於其穿透力較差,故臨牀上僅作浸潤或阻滯麻醉用。它可阻斷神經傳導,使痛覺、觸覺、溫覺等消失。毒性小,使用相對比較安全。
b.利多卡因(lidocaine):2%製劑常用來作球后麻醉和瞬目麻醉。用於眼球內麻醉劑,必須是不含防腐劑者。
c.布比卡因(bupivacaine):又名麻卡因(marcaine),屬長效酰胺麻醉藥物類,作用慢,但持續時間長。臨牀上常用濃度爲0.75%。
目前在眼科手術麻醉中,最常用2%利多卡因和0.75%布比卡因1∶1或3∶2混合製劑。取前者作用快、後者持續時間長的優點,效果非常滿意。
②白內障手術常用麻醉方法(Ordinary Anesthesia for Cataract Surgery):
anesthesia):自下瞼眶緣中、外1/3交界處皮膚進針。採取與眼球相切,沿矢狀面,緊貼眶底進針,一直到赤道部。然後改變進針方向,即使針頭略向上抬起,直指向球后視軸方向。按此方向繼續進針,進入球后肌錐內。
球后注射2~4ml 2%利多卡因和0.75%布比卡因混合液,10min後即可顯示麻醉效果。如果麻醉效果不滿意,20~30min後可重複注射。如果手術時間過長,手術期間可以2%利多卡因做追加麻醉。
球后注射完畢,應壓迫眼球至少半分鐘,以防止出血並促進藥液擴散。
B.球周麻醉(peribulbar anaesthesia):Davis和Mandel最早於1986年介紹球周麻醉的方法是,分別將麻醉劑注射到上方和下方肌錐外側,進針3.5cm,相當於眼球赤道,兩次共注射10ml麻醉劑。Bloomberg則提倡短針球周麻醉技術,即以2.5cm的25號或27號針,自顳下方眶緣進針,沿眶底進針2.0cm,一次注入8~10ml麻醉劑。
C.筋膜囊下麻醉:最初由Swan於1956年加以介紹。據認爲,這種方法對虹膜及眼前節組織麻醉效果較結膜下麻醉更爲滿意。20世紀90年代後這種方法開始被普遍使用。具體方法是:以4%利多卡因滴眼,每5min一次,計4次。然後可以做眼部手術準備,包括洗眼、鋪單、貼膠帶、開瞼等。常規剪開結膜暴露術區鞏膜。然後向Tenon囊注射1ml 2%的利多卡因,使其一直擴散到赤道部。當麻醉劑擴散到環眼球360°時即可開始手術。這一方法的主要缺點是易引起結膜水腫和出血,並有引起渦狀靜脈損傷的潛在危險。對正在接受抗凝治療的患者應慎用。
D.表面麻醉:這是一種適合做透明角膜切口的麻醉方法。具體方法是以4%利多卡因點眼,每5min一次,計4次即可開始手術。爲減少眨眼,對側眼可於術前點眼一次。術中如效果不滿意,可隨時追加點眼。對於特殊病人,如術中述疼痛或眼球過度運動,則可追加Tenon囊下麻醉。由於開放眼球後,可能隨時需要追加點眼,因此,麻醉劑應保證無防腐劑。
應該指出,應用表面麻醉,對術者應有嚴格的技術要求。首先,術者應能熟練掌握超聲乳化手術技術,可應急處理術中出現的所有問題。術中儘量避免在結膜和鞏膜組織上過多操作,以免引起患者不適。眼球的穩定性主要靠插入輔助切口的輔助器械來實現,因此增加了眼內操作的難度。
E.眼內麻醉:在表面麻醉基礎上,切開眼球後將1%不含防腐劑的利多卡因直接注射到前房內,可產生較好的眼內麻醉效果。
以上麻醉方法各有其優缺點,應用中切不可過分誇大某種方法的優點,而忽略其缺點。特別是後三種方法是特定環境下的產物,並不提倡常規使用。
還應指出,儘管出現很多局部麻醉方法,但就其操作的規範性,麻醉效果的可靠性以及應用範圍的廣泛性方面,都不如球后麻醉。特別是經過不斷改良,藥物的更合理搭配以及由此而派生出來的球周麻醉技術有更廣泛的臨牀應用價值。
7 顯微手術技術
7.1 (1)手術顯微鏡的調整和使用(Usage of Operation Microscope):
①手術顯微鏡的調整:養成每次手術前對手術顯微鏡進行一次例行調整的習慣,這對手術者來講是非常重要的。
手術顯微鏡的調整包括以下幾個步驟:
A.0位調整:先按下X-Y軸0位按鈕,使鏡頭恢復到中心起始位置;再將聚焦微調系統調整至0位,以獲得最大雙向調整範圍。
B.目鏡調整:先根據術者及助手屈光狀態調整好視度環及瞳距,再進行實測調整。先進行術者調整,即以一眼觀察,清晰聚焦後,另一眼調整視度環直至獲得同樣的清晰像;然後在聚焦不變的情況下,助手按同法進行調試,一直調試到術者和助手可同步獲得清晰影像爲止。
C.倍率調整:爲達到精細聚焦,應在高倍率下清晰聚焦,然後切變到實際應用倍率,這樣將使聚焦質量明顯提高。放大倍率還與視場大小有關。放大倍率爲4×時,視場範圍約爲50mm,可包括整個眼眶;放大倍率爲10×時,則視場範圍約爲20mm,可包括整個眼球表面。超聲乳化手術選擇倍率應在6×至10×之間。
D.工作距離:工作距離指物鏡到焦點平面距離,工作距離由物鏡決定。超聲乳化手術眼外工作部分很少,因此不要求過長的工作距離。一般以175mm爲宜。
E.觀察角度整調:適當調整觀察和照明角度,以獲得最佳紅光反射狀態,這一點對超聲乳手術來講至爲重要。調出紅光反射是一個很不容易的工作,需要極大的耐心和經驗,這要在實踐中不斷摸索和總結。
F.照明亮度的調整:術中可隨操作步驟調整照明亮度,避免過強照明。一般原則是選擇不影響操作的最低照明強度爲佳。
②使用中的注意事項:
A.片面追求高亮度:這是使用手術顯微鏡的一個誤區。亮度過高不僅無益,反而有害。對患者來講,高強度照明持續時間過長,如不進行保護,則可引起視網膜光損傷;對術者來講過強照明可引起眩光等不適感,甚至可引起明顯的疲勞感。過強照明也是縮短燈泡壽命的一個主要原因。
B.倍率過高;這是使用手術顯微鏡的又一誤區。倍率越高,景深越小,視場也越小,因此不利於判斷局部和整體之間的關係。此外,術中不可避免的微小顫動也被放大,可引起視力疲勞,其結果是準確性反而下降。在一般手術中,放大倍率最好不要超過12×。
C.非調焦操作:初學者很容易犯的毛病是缺乏調焦意識,甚至有時在一個焦點平面下完成整個手術過程,術中完全靠眼的調節來適應不同層面的操作。一個訓練有素的術者,在完成一個手術的過程中,幾乎隨操作平面的變化時刻在調整焦距,以使顯微鏡始終處於最佳狀態。這不僅增加了操作的準確性,還使術者眼疲勞減少到最小程度。
D.顯微鏡內外交替操作:是指一會兒在顯微鏡下操作,一會兒在肉眼下操作的交替狀態。這種交替操作的直接結果是極易引起視力疲勞。避免交替操作的關鍵是提高顯微鏡手術技術,以及同助手的良好配合,儘量減少非鏡下操作環節。
E.保養:欲使手術顯微鏡始終處於良好狀態,定期保養是很重要的環節。除此之外,存放環境、防塵防潮措施、清潔管理、故障維修記錄等也是重要因素。光學鏡頭不可隨意塗擦,應以專用清潔劑及鏡頭紙(布)擦拭。使用完畢,應使各機械聯接及調節旋鈕歸0。
7.2 (2)超聲乳化儀和特殊手術器械(Ultrasono-emulsifier and Special Instruments)
①超聲乳化儀:主要由五個部分組成,它們是:超聲發生器(ultrasoundproducer);換能器(transducer);乳化針頭(emulsificationtip);注吸系統(irrigation/aspiration system);控制系統(control system)。在微機控制下,頻率發生器產生弱的超聲脈衝信號,經功率放大後,傳送至換能器。換能器將脈衝信號轉換爲相同頻率的超聲波機械振動,並通過特製的乳化針頭輻射出一定的超聲能量,以乳化組織。同時藉助注-吸系統將破碎的組織清除,在清除過程中,注-吸系統還有一個非常重要的作用,那就是冷卻乳化針頭。
A.超聲發生器:主要由頻率發生器和功率放大器二部分組成。前者是以電信號的相位信息作爲反饋量的反饋控制系統,將輸出的頻率信號分頻,再與晶振輸出信號鑑相,最後將輸出頻率鎖定;後者則一般採用互補推輓式二級放大,將弱電信號放大,產生高電場激勵,使壓電換能器出現逆壓電效應。
B.手柄及乳化針頭:手柄由金屬或高強度陶瓷製成,內藏換能器,乳化針頭可通過螺旋固定於手柄前端。乳化針頭外面則可裝配硅膠套管或硬質套管,灌注液通過外套管向眼內灌注,一方面補充液體,一方面冷卻乳化針頭。注吸管道亦自手柄內通過,通過外接管道與泵系統和灌注瓶相連(圖8.6.5.3-0-15)。

換能器產生的超聲振動頻率可達27~64kHz。其最大振動幅度在空氣中約爲1/3000in,在液體中約爲1/1500in。這種振動頻率及幅度可在乳化針頭端產生大於100000Ib/Sqin的應力。憑藉這一應力可破碎較硬的組織。乳化針頭爲中空管狀,是超聲乳化儀特殊形狀的聲幅射頭,一方面釋放巨大超聲能量,同時又可將破碎的組織吸除。根據頂端斜面角度,乳化針頭可有0°、15°、30°和45°等不同規格。
不同傾斜角度的乳化頭用於不同情況。針頭越銳,其雕刻能力越強;相反,針頭越鈍,則更宜於全堵形成,因而越適合機械劈核。一般情況下,30°角的乳化針頭使用較普遍,因其兼鈍和銳針頭的優點。初學者多選較銳的針頭,善於運用機械劈核手法者則宜選用鈍性針頭。根據特殊功能需要,乳化針頭規格有各方面的改進。比如適合於小切口且避免切口漏水的microflow和microseal針頭、避免產生氣泡的無氣泡針頭等。這一類型針頭是對針體外形及斷面構型加以改進而成。
乳化針頭外面套以硅膠套管,近頂端二側有小孔,灌注液自此流入前房,建立注/吸循環。硅膠套管的作用很重要,一方面保持灌注通暢,另一方面則是針頭的冷卻系統。硅膠套管前面露出的針頭越短,冷卻效果越好,操作越安全,但乳化效率越低;相反,外露針頭越長,效率越高,但冷卻和安全性就差一些。初學者安裝套管時,外露針頭儘量少一點,隨着操作技術不斷熟煉,可逐漸加長。機械劈核時,需要將針頭埋入核質內,因此外露針頭必須足夠長。一般情況下,外露針頭1.5mm爲宜。
C.注-吸系統:注-吸系統主要由泵系統、管道及手柄組成。由泵系統產生負壓吸引,通過管道和手柄傳遞到眼內,將需要清除的組織吸除。泵系統是超聲乳化儀非常重要的組成部分,在某種程度上決定乳化儀性能的好壞。因此,對注-吸系統,特別是對泵系統的結構、運行機制等必須有非常詳盡的瞭解。
目前,臨牀上可見到多種不同運行方式的抽吸泵,但就其產生負壓吸引的作用方式不同,主要可分爲兩種,即蠕動泵(peristaltic pump)和文丘裏泵(Venturi pump)。
蠕動泵是將硅膠管壓在有凸輪的滾筒之間,依靠滾筒的定向轉動,排除管道內液體,使管道內產生負壓。這種泵系統稱爲流量泵。可通過調節轉動速度改變流量來控制負壓水平。蠕動泵作爲可靠的抽吸裝置,在臨牀上已被廣泛採用,其主要缺點是抽吸啓動較慢。
文丘裏泵主要由壓縮氣管道和與之相連的帶有單向閥門的漏斗形排氣裝置所組成。壓縮氣體通過氣道時,可在排氣裝置頂部產生高整氣流,從而使容器內空氣吸出產生負壓。這種泵系統稱作真空泵。這一裝置的突出特點是啓動後即時產生負壓抽吸作用。
以上兩種泵系統各有其優缺點,在很大程度上取決於設計者的出發點和使用者習慣,因此很難在兩者間作出絕對性取捨選擇。
注吸手柄的頭端是一個帶有側孔的盲端,側孔供抽吸用。側孔直徑有0.2、0.3、0.4、0.5mm等不同規格,側孔直徑越大,允許通過液體的流量也越大,抽吸能力也越強。其外面套以硅膠或金屬套管,近頂端二側分別有一小孔,供灌注液通過。
硅膠套管質軟,有較大的柔韌性,如切口規範,有益於切口的封閉,因此在操作過程中,可保持前房的穩定。缺點是當切口過小時,套管可被壓縮而中止灌注,容易引起前房塌陷。金屬套管質硬,在任何情況下可保持穩定流量,不受運動、旋轉以及切口過小等因素影響。但由於金屬套管較硬,常使切口二端留存縫隙,結果灌注液自前房流出,前房不易保持穩定。
根據需要,注-吸頭有直頭、45°彎頭和90°彎頭不同規格,彎頭主要用於吸除12點位皮質用。另有灌注和抽吸分離式注-吸器,分別從切口進入前房,有更好的隨意性和可操作性(圖8.6.5.3-0-16)。
②特殊手術器械:
a.隧道刀:前端爲半月形刀刃,可向前和二側做板層間剝離。根據需要可選擇直型或彎型。
b.穿刺刀:形狀如隧道刀,刀刃爲槍狀,尖端銳利。用於隧道內切口穿刺。刀刃肩寬有2.5mm、2.8mm、3.0mm、3.2mm等規格。
c.擴口刀:形狀與穿刺刀相似,僅頭部爲圓鈍狀,用於擴大隧道切口,以植入硬質人工晶狀體,寬度4.0mm、5.1mm、5.6mm、6.0mm等規格。
d.側切口穿刺刀:刀刃極其細長銳利,用於輔助切口穿刺。根據不同需要,有15°、22.5°、30°及45°刀刃等不同規格供選用。
B.截囊針(刀):由22號注射針頭製成,根據需要,可將針頭彎成各種形狀。
C.角、鞏膜剝離刀:大多爲平板狀及不同形狀的薄片狀。用於角膜、鞏膜不同層次的剝離。可代替隧道刀使用。
D.鑽石刀:是所有刀具中最爲銳利者,因此對組織極少有副損傷,癒合不留瘢痕。用於透明角膜隧道切口。
E.鑷子:
a.撕囊鑷:專用於前囊膜環形撕囊。鑷子頂端有小的彎曲,對合面粗糙或有齒,能牢固牽拉前囊膜。
b.有齒角鞏膜鑷:頭端彎曲,有對合齒。用於角鞏膜牽拉。
c.角膜固定鑷:頭端爲半環形,合攏後爲圓形小孔。有平臺,固可作線鑷用。
d.人工晶狀體鑷:用於摺疊各種類型的摺疊人工晶狀體的摺疊鑷,頭端特殊設計的卡槽,保證摺疊的穩定性和方向性。
用於摺疊人工晶狀體植入的植入鑷,其頭端二葉略向外隆起,形成中空對合狀態,用於夾持摺疊狀態的晶狀體,並將其植入。
硬質人工晶狀體鑷植入鑷的頭端平臺內側面各有凹槽,可穩定夾持晶狀體和植入晶狀體;或爲平臺,以減少損傷晶狀體的機會。有的鑷子平臺內側近頂端各有一凹槽,可準確夾持晶狀體襻將其植入到囊袋內。
e.結線鑷:要求有一定範圍的平臺,對合嚴密。
F.剪刀:
a.囊膜剪:以Vanas剪爲代表,剪刀二葉非常纖細銳利,可準確剪切囊膜及纖維膜。
b.角鞏膜剪:剪刀刃有一定弧度,與角鞏膜緣或角膜移植片弧度相當,有左右之分。
c.虹膜剪:分爲縱形剪和垂直形剪,後者剪刃與手柄成直角。
d.眼內顯微剪:用於玻璃體條索、機化組織、粘連條帶剪切,亦可用於脫位晶狀體取出時剪斷晶狀體襻。
H.晶狀體核處理器:
a.Kellan碎核器:其頭端爲扁鏟形,側面可增加抵止面積,以垂直方向置入雕刻槽內,同乳化針頭協同可將晶狀體核分開。
b.Kansas核墊板:其頭端爲略帶彎曲的平板狀,寬3.0mm,可伸到晶狀體核後面,將晶狀體核托住,同切核器協同可將核切開。
c.Kansas切核器:頭端爲窄條板狀,寬1.5mm,用於切核,可將核一切爲二。
d.Nichamin劈核器(chopper):頭端爲特殊楔形,可在3個方向進行劈裂,表面拋光相當精細,以使在操作中保護後囊膜,這是目前超聲乳化手術中較常用的一個輔助器械。
e.Minami“M”鉤:頭端爲淚滴狀,並呈多角度彎曲,可協同乳化頭對核進行多角度劈裂。
f.Nagahara劈核器(chopper):與Nichamin劈核器有點類似。不過其內刃位於60°角上,因此可有左手勢和右手勢之分。
g.Kellan旋核器:頭端爲小方塊形,乳化過程中可穩定和調整晶狀體核位置,亦可在植入人工晶狀體時,協助人工晶狀體定位在囊袋內。
h.O′Gawa核旋轉鉤:頭端爲鈕釦狀,用於乳化過程中使晶狀體核旋轉及人工晶狀體調位。
i.Koch拉截劈裂鉤:專用於超聲乳化攔截劈裂技術,頭端爲1.5mm長的鉤,可將晶狀體核全厚劈裂成數塊。
I.後囊膜拋光器:頭端圓鈍,表面磨砂處理,用於後囊膜拋光。
J.顯微持針器:有各種類型的顯微持針器。挑選時應注意手持部分要足夠大;頭端要纖細,但不銳,對合嚴密;不刮線,表面不反光。
7.3 (3)術中負壓調整
①基本概念:
A.流量:液體在單位時間內流動的體積,稱爲流量(flow
rate),其單位爲毫升/分鐘(ml/min)。流量與注吸壓力差和阻力大小有關,其三者之間的數字關係爲:
I=U/R
上式中,I爲流量,U爲注吸壓力差,R爲阻力。其中阻力與管道質量及管徑有關。
在眼科與注吸有關的手術中,有二種流量其概念是不同的:一種是灌注流量,另一種則是抽吸流量。
灌注流量:是指液體自瓶內通過灌注通道進入眼內的流動過程和單位時間內流動數量。根據以上公式,灌注流量除和流動通道管徑有關外,主要受灌注液瓶高度影響。操作中灌注不足的主要原因是:①劣質輸液管,管徑小,易摺疊,常使液體流動不暢;②重複使用的輸液瓶膠塞,常因脫落碎屑堵塞針頭而使灌注中斷;③點滴控制器失靈影響灌注;④輸液瓶高度不夠(一般距手術平面爲60cm)。
抽吸流量:是指液體自眼內通過抽吸通道、管道系統被吸出的過程和單位時間內流動數量。這是一個十分重要的概念。在一般情況下,我們所說的流量即指抽吸流量。抽吸流量影響隨行力(follow ability)的大小,隨行力是指將晶狀體碎片抽吸到乳化針頭的能力。在超聲乳化手術中,常用抽吸流量範圍是10~30ml/min,推薦使用流量爲25ml/min。
B.負壓:是一個相對低於大氣壓的測量值,用低於大氣壓的數值表示。海平面的大氣壓約爲760mmHg,所謂“0負壓”,即是與大氣壓相等的負壓值。而設定100mmHg的負壓時,意即低於大氣壓100mmHg。
C.追蹤性能(follows ability):是泵系統通過流量將碎片吸到乳化針頭的能力。在文丘裏泵,由於負壓可即時產生流量變化,因此可在腳踏開關開啓瞬間形成較強的追蹤性能。其直接結果是隻要碎片位於有效距離範圍內,即可被吸住,具有“遠距離吸引”性質。而在蠕動泵,負壓是由流量變化而產生的,當乳化針頭處於開放狀態時,管道內僅是連續性的液體流動,只有在全堵狀態時,纔會產生峯值負壓。在這種情況下,只有距離碎片很近甚或接觸時,才能吸住碎片,我們把它稱作“接觸吸引”。爲了提高蠕動泵系統的隨行力,即接觸吸引的能力,常常通過設定較高的流量來實現,一般可設在30ml/min或更高。
D.順應性:是指硅膠管道順應不同負壓而保持其固有彈性的能力。高順應性意指負壓增加時,管壁不容易產生彈性收縮,只是將能量以預應力的形式儲存,當負壓降低或無負壓吸引時,管道完全恢復初始狀態。因此,順應性也可以理解爲與管壁彈性有關的能量儲備能力。蠕動泵系統是靠排出抽吸管內的流量來產生負壓,故需要更高順應性的管道,以使滾輪更有效地將液體排出。
E.全堵狀態:是指在一定負壓條件下,完全堵塞乳化針頭,實現和保持峯值負壓的操作狀態,此時僅有管道內液體按一定流量被排除。在文丘裏泵系統中,全堵、部分堵塞和開放狀態下,對於實現峯值負壓沒有多大影響;而在蠕動泵系統中,全堵是實現峯值負壓的必備條件。在全堵狀態下,眼內壓持續維持在高水平,因此時只保留灌注。
F.前房瞬間湧動:當堵塞解除瞬間,乳化針頭及管道內的負壓會驟然降低,幾乎同時,需要大量液體補充賴以產生負壓的流量缺失,形成前房瞬間湧動,引起前房突然塌陷。這是初學者在實際操作中經常遇到的問題,當然也是造成角膜內皮損傷的主要原因。防止前房瞬間湧動的最有效措施是降低抽吸流量和負壓設定,這是對初學者需要特別強調的一點。
G.負壓上升時間:負壓上升時間是指從零真空達到設定的峯值負壓所需的時間。文丘裏泵系統屬負壓泵,其負壓上升極快,達到峯值負壓約1秒鐘;而蠕動泵系統屬流量泵,依靠泵的旋轉引起流量變化產生負壓,在全堵狀態下,實現峯值負壓約需數秒。蠕動泵系統實現峯值負壓還依賴於抽吸管的高順應性。區別二者的不同點,在實際操作中是非常重要的。目前,有些蠕動泵機型,通過特殊設計,模仿文丘裏泵工作原理,其負壓上升時間曲線特性也接近文丘裏泵效果。
②負壓調整:
A.如何設定灌注瓶高度:手術期間,當眼內壓突然下降,如得不到及時的液體補充,玻璃體將向前湧動頂壓後囊膜和虹膜隔,角膜內陷,直接的結果是後囊破裂和角膜內皮損傷。此外,如果患者原有視網膜和脈絡膜異常,則易引起嚴重的相關併發症,如視網膜裂孔或脈絡膜上腔出血等。相反,如果眼內壓過高,將使後囊膜承受過高的張力,這是後囊膜張力性破裂的主要原因。長時間術中高眼壓,還可引起玻璃體水化性腫脹以及其他併發症。一般來說,術中眼壓維持在大約30mmHg、灌注瓶距眼平面60~70cm比較合適。這一水平對視神經和視網膜血管是安全的。
B.不同乳化階段的負壓設定:
a.雕刻:雕刻時往往是以完整的晶狀體核作爲對象,具有相當好的穩定環境。也就是說,晶狀體核及皮質在囊袋內處於相對穩定的狀態,基本無移位性活動餘地。在這階段應以低負壓吸引爲主。
b.晶狀體碎塊的乳化:當將整個晶狀體分成若干碎塊後,情形則完全不同。此時,晶狀體碎塊已完全失去了整體核的穩定性,且有較大的活動空間,在灌注液衝力下,可隨意亂躥。此時如無足夠的負壓吸引,以抵消超聲乳化針頭產生的斥力,乳化針頭就不會牢固地吸住碎塊。因此,在處理核碎塊這一過程中,應設定較高負壓。
c.劈裂:是指藉助輔助器械與乳化針頭協同動作,以機械力來將晶狀體核劈開的過程。此時不應或以低乳化能量參與。要想完成這一複雜動作,首先需要乳化針頭有足夠的吸力,能將欲劈裂的晶狀體核或大塊牢牢吸住,並能將其拖動,然後將輔助器械置於對側,向乳化針頭一側劈拉,將晶狀體核攔腰斬斷。
③影響負壓調整的常見因素:
A.管道堵塞:最常見且常被忽視的問題是管道堵塞。灌注管被堵塞,則灌注不良,灌注流量減少或降爲0,此時前房虛脫甚或消失。如繼續抽吸,必然會引起角膜塌陷。灌注管被堵塞常發生部位是灌液瓶端針頭、輸液管。針頭常被膠塞碎屑堵塞,特別是重複使用的輸液瓶更易脫落膠塞碎屑。如有針頭堵塞,即使提高輸液瓶高度,水流亦不暢,操作中只要進入2檔,前房即淺。如遇此種情況,應想到針管堵塞問題。
其次是質量低劣的輸液管道,極易因摺疊而不通暢,或管道口徑小而影響流量。這類問題具有隱蔽性,常常被忽略。
再一個問題是輸液調節器不靈,常是被卡在一固定位置,影響液體流動。當然這類問題也屬於輸液管道質量問題。
最後一個,也是較常見的一個問題,就是乳化針頭外面的硅膠套管破裂。特別是靠近根部有裂隙時,灌注液均漏在切口外面,明顯影響前房內的灌注流量。
以上這些問題均是實際操作中經常遇到的,但常常被忽視,卻一味抱怨機器狀態不好,這一環節應引起足夠重視。
B.切口漏水的主要原因是切口偏大、隧道偏短所致。有些切口表面上看很標準,但隧道過薄、內切口靠後,或內切口不具備活瓣性質均可影響其密閉程度。有一個容易被忽略的問題是,隧道頂端未做內切口穿刺前剝離得很寬(明顯超過3.2mm),當乳化針頭在切口內活動時將內切口撐大。因此,在做隧道切口接近內切口穿刺部位時,控制層間剝離的寬度在3.2mm,是適宜的。此外,保證切口水密閉合最重要一點是形成活瓣式切口。這需要選定恰當的穿刺部位、正確的穿刺方向和規範的穿刺寬度。如果內切口遊離端太厚,則不具備活瓣特點;如太薄,則極易捲曲或移位,均不利於切口關閉。至於切口太靠前,產生過大力矩限制乳化針頭操作,或切口太靠後,虹膜易脫出切口等,都可影響切口的密閉性。然而,一味追求切口密閉,甚至企圖以做小於標準切口的方法來防止漏水,亦不可取。當切口過窄時,勢必壓縮外硅膠套管,明顯影響灌注流量,其後果要比切口漏水更爲嚴重。
C.抽吸管道堵塞的直接後果是不能有效抽吸。此時前房加深,聚集在前房內的乳化的晶狀體物質呈乳白色乳糜狀,使前房呈混沌狀態。此時不應繼續操作。因爲抽吸不暢,直接或間接影響了灌注流量,持續乳化所釋放的能量,會使前房溫度急劇升高,嚴重損傷眼內組織。抽吸管道堵塞最易發生在針頭和手柄部分。當較硬的晶狀體核碎屑被吸入針頭,還來不及乳化時,最易卡在不光滑的排出管道的內壁。操作中,突然前房加深,而乳化針頭前又沒有堵塞碎片,應想到管道中間堵塞。此時要立即停止操作,檢查管道系統,以排除故障。
抽吸管道的順應性也是一個不容易忽視的因素。反覆高溫消毒,會使管道失去固有彈性,順應性降低,不易有效保持負壓值,因此容易被堵塞。經常檢查並及時更換已老化的抽吸管道,是避免這種情況發生的有效措施。
7.4 (4)黏彈劑的應用(Application of Viscoelastics)
黏彈劑手術是近年來眼科顯微手術的重大進展之一,有關黏彈劑的研究是一個發展極爲迅速的領域。所謂黏彈劑手術,是指藉助具有一定黏彈性、無毒、無抗原性的透明大分子膠體物質,在顯微手術中注入到組織腔隙中,以起到填充、保護、潤滑等作用,從而提高手術質量和安全性。黏彈劑手術是伴隨着顯微手術的發展而不斷完善的,其在現代眼科顯微手術技術領域內的重要性已被越來越多的人所認識和承認。
①黏彈劑:黏彈劑必須具備如下條件:A.必須是中性物質,具有等滲透性;B.無任何顆粒和雜質;無熱原及抗原;C.光學上是無色透明體;D.有足夠的黏滯性、假可塑性和彈性;E.具有親水性,可稀釋,便於用常規方法注入和吸出,滯留於眼內的少量此類物質可被吸收;F.對角膜內皮細胞及其他眼內組織無任何毒性及損傷作用;G.理化性質穩定,不因加壓注射、高壓消毒或稀釋等操作而改變其基本理化性質;H.便於分裝、消毒和保存。
黏彈劑的化學特性與其在眼科手術中的安全性有關;而其物理特性則與實現其目標—提高手術質量有關。
黏彈劑的物理特性:黏滯性、可塑性和彈性是黏彈劑最重要的物理特性,它們決定了不同種類黏彈劑的基本性質。只有對黏彈劑的物理特性有深入瞭解,才能發揮其在顯微手術中的作用,以提高手術質量。
A.黏滯性:黏彈劑的黏滯性是指動力學黏滯性,以釐泊(CPS)表示。對於非牛頓性液體(黏彈劑),其動力學黏滯性,是指在某一溫度下,一定剪切率(Shearrate)時的黏度。
B.假可塑性(pseudoplasticity):隨着剪切率增加而黏度下降,這一特性被稱作假可塑性。這是高質量黏彈性應具備的十分重要的特性。假可塑性好的黏彈劑,當靜止時(剪切率爲0~0.001),具有較高黏度,以便產生維持空間的能力;當以高速(剪切率爲1000~10000)通過注射針頭時,具有較低黏度;而當人工晶狀體或手術器械從其中滑過時(剪切率爲1~10),它又爲中等黏度。
C.彈性(elasticity):黏彈劑的彈性是指伸展後回覆正常形態的趨勢。一般以剪切率爲0時的黏滯度來表示。好的黏彈劑的彈性可使其在眼動脈搏動下保留於眼內,否則將會隨搏動而有少量溢出。在撕囊時,黏彈劑的彈性作用可使撕下的囊膜片反折,以便於重新夾住撕扯線的頂端。
黏彈劑的物理特性,在眼科手術中,特別是在現代囊外白內障摘除術和超聲乳化吸除術中的每一步驟,都發揮重要作用。比如在截囊時,必須使用黏彈劑充填前房。使用假可塑性好的黏彈劑,易於從注射器中推出以及手感好,對這一手術步驟十分有利。高黏滯性和高彈性利於維持前房,有助於截囊或撕囊術的順利完成。良好的假可塑性還有助於晶狀體核的挽出。此外黏彈劑附着於角膜內皮的特點對於術中保護角膜內皮亦是十分重要。
目前,商品用眼科黏彈劑不下幾十種,其中常用者約十數種。雖然商品用眼科黏彈劑種類繁多,但基本成分是透明質酸鈉(sodiumhyaluronate,NAHA)、硫酸軟骨素(chondroitinsulfate,CDS)、甲基纖維素(methylcelulose,HPMC)。
A.透明質酸鈉:透明質酸(hyaluronicacid,HA)是Meyer和Palmer於1934年自牛眼玻璃體中首次分離提純並由他們命名。此後,無論在HA的分佈、化學結構和提取方面的研究,還是在其生理功能和臨牀應用方面的研究,都取得了較大進展。HA廣泛存在於哺乳動物的各種組織中,如皮膚、臍帶、眼玻璃體、軟骨等組織中含量甚豐。它以同蛋白結合的形式存在,是動物機體生理所必需的物質。其鈉鹽是由葡萄糖醛酸鈉和乙酰氨基己糖組成的雙糖聚合物,屬黏多糖類物質。
其化學全名爲:(1→4)-o-β-D葡萄糖醛酸鈉-(1→3)-2-乙酰氨基-2-脫氧-β-D葡萄糖。
在諸多商品用黏彈劑中,Healon和Healon GV具有極好的假可塑性。在剪切率爲0時是理想的彈性物質,較其他二種黏彈劑更“黏稠”;而在高剪切率時,則具較少黏性。因此,Healon在維持手術空間和令器械(包括人工晶狀體)自由通過方面,是最理想的材料。
B.硫酸軟骨素:硫酸軟骨素屬黏多糖物質。硫酸軟骨素的分子量約爲2.5萬,由於分子中每一基團要比透明質酸鈉多帶一個負電荷,故對錶面帶正電荷的人工晶狀體有更好的親合力。商品化的硫酸軟骨素有ChondroitioSO4-Ⅰ和ChondroitilSO4-Ⅱ,其濃度分別爲50%和20%。此外,Viscoat是硫酸軟骨素的另一類混合型黏彈劑,其中含透明質酸鈉和硫酸軟骨素分別爲3.0%和4.0%。
硫酸軟骨素不像透明質酸鈉那樣具有很好的假可塑性和內聚性。例如Healon有較好的內聚性,能確保在手術終了時全部被清除,減少了術後眼內壓升高的危險性。相反,Viscoat具有很差的內聚性,手術結束時清除困難,極易造成殘留。
C.甲基纖維素:甲基纖維素是一種與葡萄糖有關的大分子聚合物,化學性質穩定。在所有黏彈性物質中,甲基纖維素的假可塑性比較差,在手術的剪切率範圍內,主要表現爲黏性。
②黏彈劑在白內障手術中的應用:
A.囊外白內障摘除術:
a.截囊前注入黏彈劑,使前房加深,一方面保護角膜內皮,一方面可防止皮質成分溢出,使截囊更爲安全。
b.挽核前注入黏彈劑,可使核挽出更爲順利,並保護上方角膜內皮。
c.吸皮質之前注入黏彈劑,一方面可使瞳孔保持散大狀態,另一方面可使皮質保持相對穩定,增加抽吸皮質的安全性。
d.防止後囊膜破裂和玻璃體脫出,是黏彈劑發揮軟墊作用—黏性堵塞和彈性緩衝作用的結果。
b.防止虹膜和後囊膜前移。
c.欲植入睫狀溝固定型人工晶狀體,可將黏彈劑注入虹膜和前囊膜之間,打開人工晶狀體襻固定通道。
d.欲植入囊袋內固定型人工晶狀體,可將黏彈劑注入囊袋內,使囊袋張開。
e.摺疊人工晶狀體較硬性人工晶狀體,摺疊人工晶狀體對黏彈劑的要求要更高一些。首先要求植入的全過程有非常好的前房和囊袋內存在空間,這要求黏彈劑有較高黏滯性及與高分子量有關的較高彈性。其次要求植入人工晶狀體全過程,包括摺疊人工晶狀體的展開,不會受到任何阻隔;特別是在囊袋內展開時,下襻不會突然彈出,都需要黏彈劑具有相當好的假可塑性和黏滯性。
f.人工晶狀體調整位置之前,注入黏彈劑,可使操作更爲準確、安全。
g.在二期人工晶狀體植入術中,可用於瞳孔後粘連分離、瞳孔成形術、機化膜切開等;在人工晶狀體縫合術中,因操作複雜,必須應用黏彈劑使前房始終保持足夠深度,以使通過切開往返於眼內外的預置固定縫線得以完成。
A.充填前房,以使前房有足夠的操作空間,是黏彈劑最主要的作用之一。在這一階段,要求黏彈劑要有較高的黏滯性,以發揮維持前房空間的作用;要求黏彈劑有絕對透明性,以保持前房結構清晰可見;要求黏彈劑有相當好的假可塑性,以使其容易被注入或吸出。質量低劣的黏彈劑既缺乏足夠的黏滯性,也缺乏足夠的透明性。有些黏彈劑向前房注入時很困難,而一旦切口略有張開既大量溢出;有些黏彈劑注入到前房後,在顯微鏡下可見彌散的微小氣泡混雜。這些黏彈劑起不到應有的作用,應避免使用。
B.撕囊黏彈性可以提供完成環形撕囊的4個基本條件:a.深前房,主要依據高分子量的黏彈性所具有的高黏滯性;b.良好的透明性;c.軟推壓作用,使前囊膜片具有相當的穩定性;d.良好的假可塑性,使前房內器械操作不受任何影響。毫無疑問,Healon
GV是最理想的材料,其次是Healon和Provisc。
C.以BSS做水分離或水分層時始終保持原來前房形態,這要求黏彈劑有極好的黏滯性。同時,即使注入大量BSS也不會產生過高壓力,且保證液體自由循環。因此還要求黏彈劑有較高的假可塑性。滿足以上條件的理想黏彈劑是Provisc和Healon。
D.乳化期間要求黏彈劑仍留在前房,以起到保護角膜內皮及其他眼內結構的作用。低內聚性黏彈劑如Viscoat,是一種分子量較低的短鏈分子物質,即使灌注流量較大,也易於留於前房。同時Viscoat還具有相當好的黏附性,黏附於角膜內皮表面,因此是一種很好的角膜內皮保護劑。乳化期間,對抗各種機械性攪動引起的損傷需要黏彈性有相當好的彈性,在這方面Viscoat也發揮相當好的作用。相反,Healon
GV等因有較長分子鏈及高分子量,當以乳化針頭或注吸器抽吸時,很容易被全部吸除。
E.注吸階段要求黏彈劑在高液體流量條件下,能保留在前房以保護角膜內皮。在這種情況下,具有好黏附性的黏彈性可以對抗高水流的“沖刷”作用而滯留在角膜內皮表面。黏附於角膜內皮的黏彈性還可以阻隔皮質接觸,因此保護內皮免受機械損傷。這一階段應該選擇短鏈低分子黏彈劑。
F.充填囊袋爲植入人工晶狀體做準備,必須用黏彈性充填囊袋。這一過程對黏彈劑的要求是:a.具有高假可塑性,使之注入十分容易;b.具有高黏滯性,使支撐囊袋穩定持久;c.必須絕對透明,無微氣泡;d.必須非常容易清除,即具有較好的黏滯性。毫無疑問,滿足以上條件的最好的黏彈劑是Healon GV、Healon和Provisc。
8 手術步驟
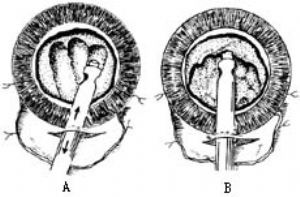
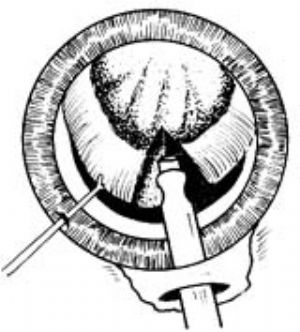
1.切口 沿上方角膜緣剪開結膜約6mm,向後剝離暴露鞏膜,充分止血。距角鞏膜緣後2mm,作平行地緣部的鞏膜板層切開,深度約1/2鞏膜全厚,長度應根據欲植入的晶狀體大小而定。自切口向角膜緣方向作潛行剝離,進入透明角膜內1mm,形成鞏膜隧道(圖1)。
 | 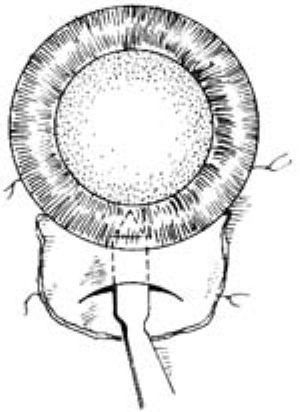 |
| 圖1 | 圖2 |
以3.2mm穿刺刀穿刺進入前房,以形成有自閉功能的活瓣式內口(圖2)。
鞏膜外口亦可作成直線形成反眉狀。
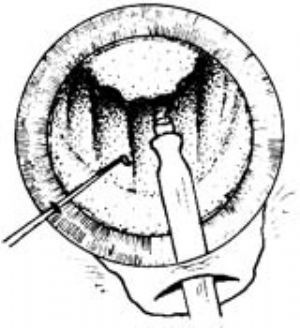
2.撕囊 連續環形撕囊術(continuous circular capsulorhexis,CCC)是典型的超聲乳化術的相關技術。
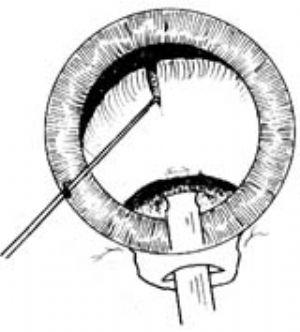
以截囊針在近正中部前囊膜作一小三角瓣,反轉游離側,以截囊針輕輕拉住反轉的囊膜片,按預定方向作環形撕拉,使撕裂作連續的弧形延伸,直至形成6mm直徑的圓形撕開。撕囊過程中,應不斷更換牽拉點和撕拉方向,避免向赤道部放射(圖3)。
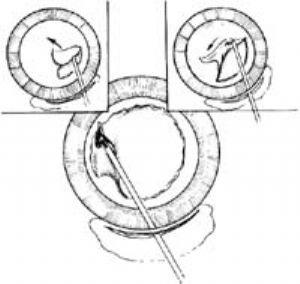 |  |
| 圖3 | 圖4 |
側面觀察如(圖4)。
以上過程如以撕囊鑷來完成,將變得更加容易。
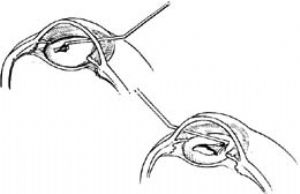
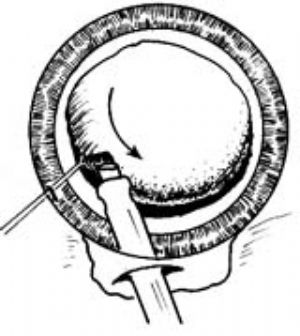
3.水分離術 撕開前囊膜後,以注水鈍針頭自9∶00或3∶00時鐘位的前囊膜瓣下注入BSS。注水時採用輕輕的脈動方式,藉助水的脈動衝擊,使前囊膜和囊下皮質分離。
用同樣的方法可使淺層皮質和深層皮質、深層皮質和核上皮質,以至於核上皮質與核充分分離,以利於隨後的乳化的進行(圖5)。
 |  |
| 圖5 | 圖6 |
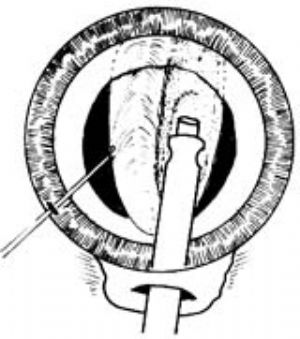
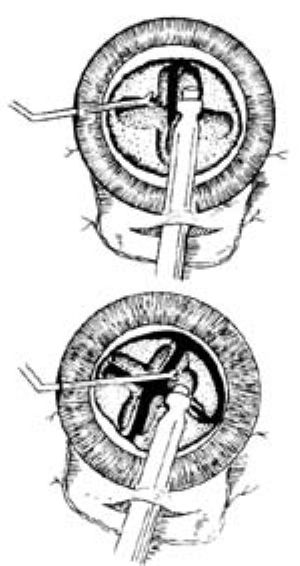
4.晶狀體乳化 擴大內切口至3.2mm,伸入乳化頭,按預定方式依次對核進行乳化吸出。乳化的基本動作是雕刻(sculpting),即以乳化頭釋放的能量將晶狀體核擊碎成乳糜狀(圖6)。
如何將整個晶狀體核依次乳化並吸出,是一個非常複雜的問題,除要求有熟練的基本操作技術以外,還應掌握一些特殊的技術動作。隨着超聲乳化整體技術的不斷完善,針對操作中遇到的各種情況(如核硬度的不同),創新了一大批不同的新方法。每一種新方法均不具有絕對的獨立性,在整體技術中應是相互穿插,相互滲透。
比較實用的技術動作有如下幾種。
牛角面泡法(croissant)自晶狀體正中開始,分別向兩側偏外下方雕刻,形成牛角麪包樣溝槽,加寬加深到一定程度後,旋轉180°,再重複這一過程。最後以一般乳化方法將殘餘部分乳化吸除(圖7)。
 |  |
| 圖7 | 圖8 |
旋轉木馬法(carousel)將晶狀體中心部雕薄後,乳化頭退於上方瞳孔級;中斷灌注,同時以乳化頭稍向下傾斜,隨着晶狀體核上極翹起,順勢插入晶狀體核後面並恢復灌注。此時即可以乳化頭沿核赤道部切線方向乳化晶狀體核,晶狀體核將以旋轉木馬方式旋轉,被由外向內逐層乳化吸除(圖8)。
切削翻轉法(chip and flip)將晶狀體正中雕薄成碗狀後,使其翻轉,從後面將核的其餘部分乳化吸除(圖9)。
 |  |
| 圖9 | 圖10 |
雕刻翹起法(sculpt and tilt)將晶狀體正中雕薄成碗狀後,自上方將殘餘薄片翹起,並逐一乳化吸除(圖10)。
分而治之法(divided and conguer)正中自上而下沿晶狀體核表面作雕刻動作,不斷加深加寬,直至形成深達後面核上皮質的縱形溝槽,再借助輔助器械與乳化頭協同,將其一分爲二。然後依次將1/2碎塊乳化吸除(圖11)。
 |  |
| 圖11 | 圖12 |
十字交叉法(crisscross)是分而治之法的發展。即以同樣的雕刻動作,作成十字形溝槽後,藉助輔助器械將其分成四塊,而後依次將碎塊乳化吸除(圖12)。
攔截劈裂法(stop and chop)在高負壓低能量條件下,將乳化頭直接插入晶狀體核部分,自輔助切口伸入特製器械(如chopper),從核下極繞過,向乳化頭固定方向劈切,使之裂開。旋轉一定角度重複這一動作,可使晶狀體核劈成若干碎塊,然後將其逐一乳化吸除(圖13)。
 | 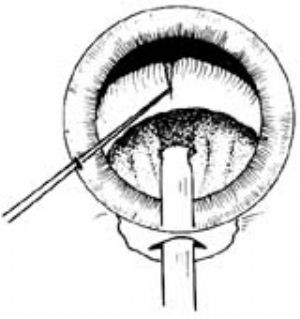 |
| 圖13 | 圖14 |
切削劈裂法(chip and chop)先將核正中部削薄成碗狀,然後藉助特別器械,採取近似於攔截劈裂的方法,將殘餘部分劈裂成若干碎塊,再依次乳化吸除(圖14)。
5.清除皮質 以機械注-吸器清除皮質,其基本操作原則與手動注-吸器大致相同,惟吸力較大,極易吸破後囊膜,操作時應十分小心。
9 人工晶狀體植入
9.1 (1)人工晶狀體材料(Materials of IOL):
①聚甲基丙烯酸甲酯(Polymethylmethacrylate,PMMA):PMMA性能穩定,有較高的抗老化和抗環境變化特性;抗酸、鹼、鹽和有機溶劑。但不耐熱,在100℃以下,PMMA爲固態;超過100℃的環境,PMMA將變成凝膠狀,可注塑成形。
作爲理想的人工晶狀體材料,PMMA也還存在一定缺點。首先是不能加熱消毒,加熱將使其嚴重變形;其次是彈性有限,不能製造適應小切口的彈性晶狀體;對YAG激光耐受有限,而且激光治療後釋放單體具有生物毒性作用。
②硅凝膠(Silicone):硅凝膠作爲軟性人工晶狀體的主要材料之一,在臨牀上得到廣泛作用。其主要成分是二甲基乙烯基硅氧基聚甲基硅氧烷,簡稱甲基乙烯基硅酮,即硅凝膠。硅凝膠比重低,耐高溫、高壓。在220℃~240℃溫度下不發生老化,因此可進行高壓或煮沸消毒。硅凝膠折射率約爲1.41,較PMMA爲小,因此同等屈光度的硅凝膠晶狀體較PMMA晶狀體要厚。
硅凝膠有較好的柔韌性和彈性,因此可摺疊。由於彈性較大,當放鬆摺疊鑷時,可自行迅速展平。如不瞭解這一特性,常常出現彈破後囊膜或出現翻筋斗現象,甚至在眼外準備階段即被“彈失”而不知去向。
硅凝膠易產生靜電,吸附空氣中的微粒及眼內新陳代謝產物。這種黏附在晶狀體表面的顆粒樣物可明顯影響其透明度和透光率,嚴重者可形成膜樣物包繞晶狀體。
儘管硅凝膠有些缺點,但因其結構穩定、組織相容性好,從而可在眼內長期存留等優點,臨牀已被廣泛應用。
③水凝膠(Hydrogel):水凝膠,即聚羥基乙基甲基丙烯酸甲酯(polyhydroxyethylmethacrylate,PHEMA)。
水凝膠具有網狀空間結構,由於有羥基,具有吸水性。脫水狀態時,質硬,半透明,可進行拋光處理。吸水後膨脹,體積增加,當吸水爲40%時,屈光指數爲1.43;充分覆水後質柔韌透明。
由於水凝膠具有網狀結構,可使水分子、離子以及小分子物質自由通過,同時也易使排泄及污物存留,降低其透明性。
④丙烯酸酯多聚物(acrylic,商品名acrysof):丙烯酸酯多聚物是由甲基丙烯酸酯(MMA)、丙烯酸酯(HEMA)及其他交聯體聚合而成的一類多聚物。可被高度純化,性質穩定,透明性極佳。Acrylic在37℃時屈光指數爲1.544,較PMMA爲高,因此,同等屈光度人工晶狀體,Acrysof晶狀體可做得更薄,更適合於小切口植入。Acrysof晶狀體彈性較小,由摺疊狀態到完全展開約需3~5s,因此操作起來比較安全。經過大量的理化及毒理學研究表明,此多聚物有極好的穩定性和生物學相容性,無毒性,植入眼內安全。
⑤記憶體材料(Memory
Material):記憶材料爲甲基丙烯酸甲酯、羥乙基甲基丙烯酸甲酯、甲基丙烯酸酯羥基苯酚及乙烯乙二醇二丙烯酸酯交聯聚合而成的三維共價網狀結構。此材料低於25℃時質軟。加熱使人工晶狀體變軟後,將其捲曲並冷卻,使成硬質捲筒形狀。通過小切口植入眼內,經體溫加熱,通過“記憶”緩慢恢復原來形態。記憶材料爲親水性,可吸水20%,其屈光指數爲1.47,可耐高溫高壓,有極好的生物學相容相。
以上人工晶狀體材料中的後4種,均爲摺疊人工晶狀體材料,其中硅凝膠、水凝膠及丙烯酸酯多聚物材料在臨牀上應用比較廣泛。
9.2 (2)人工晶狀體的選擇(Choice of IOL)
①理想的人工晶狀體標準:1982年Kelman提出了理想的人工晶狀體的10條原則,它們是:A.無論眼球處於靜止狀態或變形,人工晶狀體在眼內不能有絲毫移動。B.在同樣情況下,晶狀體不能對眼內組織產生壓迫。C.當眼球變形時,晶狀體與眼的接觸部位不能有任何改變。D.沒有理化刺激性。E.不會因爲脫位或大小不適而增加再手術的機會。F.不僅對專家,而且對初學者同樣容易植入。G.人工晶狀體任何部位與眼內任何組織不會發生粘連。H.人工晶狀體必須是能適合於任何類型的手術,包括囊內、囊外和超聲乳化白內障摘出術,以及二次人工晶狀體植入術。I.晚期併發症應能預料並能治療。J.同一大小的晶狀體應能適於所有眼。
Hollady(1986)對鏡片構型也從光學和物理學角度提出一些要求,這些要求是:A.良好的分辨率,在空氣中測量應大於100lp/mm。B.無球面差。C.當晶狀體偏心時,引起的屈光改變及球面差變化應很小。D.當晶狀體傾斜時,也應很小引起屈光和球面差方面的變化。E.光譜透射特性應與自然晶狀體一致。F.應有足夠大的光學直徑,以使在發生偏心時不致發生邊緣裸露。G.應爲惰性材料,不會因紫外線照射等化學因素而發生生物降解。H.表面光滑,無粗糙或銳利邊緣。I.比重小,以減少運動慣性和重量。J.厚度應儘量薄。
很顯然,理想的人工晶狀體是不存在的。但可以肯定的一點是,經過反覆的臨牀實踐以及設計生產人員的不懈努力,目前人工晶狀體的質量已達到了相當的水平。進行人工晶狀體選擇時,應參照理想人工晶狀體的標準,結合其他影響因素,進行綜合判斷。
②人工晶狀體的選擇:選擇人工晶狀體時,可從以下幾個方面考慮。
A.包裝質量:包裝是否嚴密可靠,是保證人工晶狀體質量的重要環節。包括屈光度、光學直徑、A常數、晶狀體襻種類、固定方式、傾斜角度、是否爲吸收紫外線等。尤其必須有明確的消毒日期和有效期。對經二次消毒或重新封裝的人工晶狀體(指非正常渠道)要慎用。
B.生產廠家:必須能確認生產國別和生產廠家,如無生產廠家標誌或不能加以確定者不要輕易使用。
C.人工晶狀體類型:選擇後房型人工晶狀體,首選囊袋內固定型,其次爲睫狀溝固定型。事實上,臨牀使用的大多數後房型人工晶狀體,在二種固定方式上有通用性。二次植入應選擇總長度爲13.5mm的後房型晶狀體。新型彈性開放襻前房型人工晶狀體已被證明其使用的安全性,對一些不適合後房型人工晶狀體植入的病例,可行一期或二期前房植入。袋內固定的人工晶狀體類型應具備以下特點:a.單片PMMA或同類材料人工晶狀體。其PMMA襻在囊袋內有最好的順從性和彈性記憶。b.改良短C-襻人工晶狀體,容易植入,且與囊袋構型一致。c.全長爲12.0~12.5mm人工晶狀體,恰與囊袋大小和形狀相適應。d.雙凸人工晶狀體。e.如能確保植入到囊袋內,5.5mm光學直徑的人工晶狀體足矣。f.晶狀體襻向前傾斜10°角,有益於防止術後後囊膜渾濁。
D.人工晶狀體光學部直徑:目前趨向於用6.0mm或6.5mm的大直徑晶狀體,易於固定,光學效果好。但適應小切口白內障手術需要,則5.5mm硬質晶狀體和6.0mm的摺疊晶狀體應用非常普遍。此外,選擇晶狀體直徑時,還應考慮眼部具體情況。比如術中發生後囊膜破裂,爲了固定更可靠,則應選擇大直徑晶狀體較爲合適。
E.晶狀體襻類型:常用的改良J-襻和改良C-襻各有優缺點,前者易於植入,且比較容易調整位置,其缺點是襻與組織接觸範圍小,容易引起局部壞死或變形。後者植入稍顯困難,但植入後穩定性好,對支撐位置的組織很少產生損傷。此外,新近出現的L-襻、鷗翅-襻等人工晶狀體在晶狀體襻構型上也都各有特點。
F.晶狀體屈光度:進行人工晶狀體屈光度計算時,除參考精確計算公式計算結果外,還要參照術前屈光狀態、職業特點,以及患者的特殊需要等,進行綜合分析,加以修正。有時計算結果與已掌握的眼實際屈光狀態相距甚遠,這就需要認真分析,找出產生誤差的可能原因。在特殊情況下,還需要應用特殊的計算方法去處理。比如,曾經歷過PRK或LASIK治療的病例,根據例行檢查所得結果進行計算,往往會出現較大誤差。這是因爲,屈光手術改變了角膜中心正常的拱形結構的緣故。
G.軟性摺疊人工晶狀體的選擇:目前臨牀上已有多種可摺疊人工晶狀體類型供選擇。它們之間的區別除材料不同外,主要表現在彈性的大小、摺疊後展開的速度、植入的方法等方面。如摺疊鑷植入方式要比推注式有更好的隨意性;而植入記憶型晶狀體更爲方便快捷。
10 術中注意事項
1.切口必須規範,過大會因爲漏水而難以保持正常前房深度,過小將使灌注淤塞,影響乳化頭冷卻和前房形成;靠前將影響操作;靠後易引起出血。
2.整個操作應在有足夠的前房深度下進行,注意保護角膜內皮和瞳孔緣。一旦吸住虹膜,應即刻啓動回吐功能,避免牽拉和繼續操作。
3.操作中一旦發現後囊膜破裂,應停止乳化,檢查破損部位及程度並採取相應的保護措施,切忌試圖用乳化頭清除脫出的玻璃體。
4.雕刻是在負壓吸引條件下進行的動作,切不可力圖提高效率而壓迫或推動晶狀體核,這樣作極易使晶狀體核或碎塊被壓入玻璃體腔。
5.超聲能量並非越高越好,水流量亦非越大越好,應根據核的硬度作恰如其份地設定。在雕刻中,亦要根據不同部位、推進速度、喫進深度等隨時調整腳踏板3檔位深度,這種情況有如司機靠踩油門調整車速一樣。
6.晶狀體核碎塊如殘存於眼內,會引起術後持久的炎症反應,故應徹底清除。由於小碎塊隨行能力差,故可隨湍流激過滾動,難於捕捉。此時應停於2檔注-吸位,靠負壓吸牢碎塊後,再以極小的超聲能量將其乳化吸除。
7.一旦晶狀體核掉入玻璃體腔,不可以乳化頭伸入玻璃體腔試圖去吸晶狀體核,因此時玻璃體會堵塞入口。如旋以超聲能量,核非但不會被拉回,反而會被彈出,應予避免。此時應取出乳化頭,按常規方法將碎塊取出。
11 術中併發症及其處理
超聲乳化技術是最能反映術者操作水平、熟練程度、處理異常情況能力的一種手術。瞭解超聲乳化白內障吸除術中併發症並掌握其處理方法,不僅對超聲乳化手術本身,而且對幾乎所有類型白內障手術併發症的處理,都有指導意義。因此,本節內容將以超聲乳化手術爲主線,概述白內障手術術中併發症及其處理。
11.1 (1)超聲乳化手術的併發症(Complications of Phacoemulsification):
①晶狀體核整個或碎塊墜入玻璃體腔:這幾乎是本手術最嚴重且令人生畏的併發症,晶狀體核墜入玻璃體腔可發生於術中任何階段,但最常見是在劈核和乳化碎塊時發生。這種情況一旦發生,原則上應設法將其取出。如果碎塊較小,且位於前玻璃體,可單獨依靠玻璃體切割將其取出。如碎塊較大,且墜入較深,就需要做全玻璃體切割,並藉助核浮起技術(如重水)將其取出。不過,在大多數情況下,還是請玻璃體手術專家協助處理比較安全。
②後囊膜破裂:其嚴重程度比不上核墜落,但其發生率明顯較高,因此後囊膜破裂伴玻璃體脫出仍是臨牀上十分被重視的問題。如果發生在早期,比如乳化晶狀體核階段,應毫不猶豫地改變術式。即擴大切口、藉助黏彈劑,將核挽出。如果玻璃體脫出不多,則可僅做前玻璃體切割;如玻璃體脫出較多,且有較多皮質與玻璃體混雜,以及有皮質碎片脫入到玻璃體腔,則需做全玻璃體切割。處理過程中如瞳孔縮小,或缺乏相應的備用器械(如前玻璃體切割器),這種情況如發生在乳化過程快要結束時,所剩碎塊小而少,則可不必擴大切口,藉助黏彈劑以鑷子將其取出。但如果皮質與脫出的玻璃體呈混雜狀態,則應做前玻璃體切割。
最後,如這種情況發生在注-吸階段,只要脫出玻璃體不多,後囊膜破口範圍又很小,僅需小範圍的前玻璃體切割;而如若破裂範圍大,殘留皮質又多,則需做較大範圍前玻璃體切割或全玻璃體切割。
單純後囊膜破裂(不伴有玻璃體脫出)只要及早發現、採取必要措施,在大多數情況下並不會影響手術進行。清除皮質階段如發現後囊膜破裂,應立即停止抽吸,以黏彈劑注入到破孔表面,將可能要脫出的玻璃體壓住,然後在低負壓低灌注下小心細緻完成下一步操作。如果所剩皮質較多,也可採用“幹吸法”吸除其餘皮質。即先以黏彈劑保護破孔,再以連於注射器的單管平針頭,耐心準確的插入殘餘皮質塊中將其吸除。用這種方法明顯減少了對前房結構的擾動,保護破孔處在靜止狀態。單純後囊膜破裂,只要處理得很好,不影響植入人工晶狀體。甚至仍可植入到囊袋中。
③角膜內皮損傷:角膜內皮損傷是術後角膜失代償的直接原因。任何進入眼內的器械都有可能損傷角膜內皮。前房內操作過多,使角膜內皮受損傷的機會明顯增多。超聲能量也是損傷角膜內皮不可忽視的因素,特別是在初學者更是如此。超聲能量過大,操作時間過長,操作動作過多,往往使角膜內皮受到嚴重損傷,以至失代償。此外,灌注液質量、灌注流量、灌注時間以及附加藥物類別等,都將可能成爲使角膜內皮損傷的因素。很明顯,避免角膜內皮損傷,主要是以預防爲主。包括動力型超聲向抽吸型超聲轉化,提高手術熟練程度,嚴格控制術中所用消耗品質量等。
11.2 (2)與切口有關的併發症(Complications Relating to Incisions):
①隧道切口太淺:隧道頂部板層過薄很容易撕裂,因乳化頭等器械進入牽張而易使其失去固有的彈性和韌性。這些都會使切口失去自閉作用,並易引起術後逆規散光。
②切口過深:切口過深十分容易穿破鞏膜而損傷睫狀體及深層血管,引起出血,特別是對高度近視及鞏膜較薄的老年患者。過深的隧道也不利於自閉作用的形成。如發現隧道過深,或已穿破鞏膜則應做嚴密縫合,另選部位重新做切口。
③內切口過早進入前房:內切口過早進入前房,即切口偏後,較角膜緣切口偏後引起的問題要嚴重得多。因爲術後一旦發生虹膜脫出,將其還納是很困難的,欲使其不受損傷幾乎是不可能的。虹膜脫出如合併瞳孔收縮、前房出血等情況,則會使手術無法進行。另一問題是,由於內切口過於靠後,幾乎不會形成有效的活瓣作用,因此切口不會自閉。
④內切口靠前或隧道過長:由於內切口靠前,或隧道過長,使進入的乳化針頭向上傾斜。如欲在後房平面操作,勢必要將乳化針頭下壓,這將引起角膜產生嚴重的牽拉性皺褶,影響觀察。特別是在處理12點時鐘位的核及皮質時將變得更加困難。
11.3 (3)與環形撕囊有關的併發症(Complications Relating to Cyclo-capsarhexis):
①撕囊大小不當:撕囊過小,將影響下一步操作已如前述,但撕囊過小總比放射狀撕裂後果要好一些。如果囊袋口還不致於使後面操作無法進行,則可加倍小心繼續操作,待植入人工晶狀體後再補充二次撕囊。如撕囊太小影響操作,則應毫不猶豫地擴大撕囊範圍,特別是上方囊袋口開放不充分時更是如此。撕囊過大,如不合並放射狀撕裂,主要的問題是難以將核限制在囊袋內,晶狀體核過早脫出囊袋,有時會影響手術操作。撕囊過大的潛在問題是很容易發生放射撕裂,而一旦發生又很容易擴展到後囊膜或損傷晶狀體懸韌帶,故應儘量避免。
②放射狀撕裂:放射狀撕裂是撕囊過程中最易發生,並進一步引起連帶併發症的異常情況。晶狀體的雙凸結構以及懸韌帶的放射性牽拉,使囊膜處於特殊的張力狀態。一旦破裂有自發向赤道部延伸的傾向,以黏彈劑反向壓迫,可減少這種由懸韌帶牽拉所引起的離心性張力,同時也可抵消玻璃體壓將晶狀體向前推壓作用。術中一旦發現有向周邊部撕裂現象,應立即停止手術,仔細查看撕裂程度採取補救措施。如有機會補救,應先注入黏彈劑加深前房並擴大瞳孔,以撕囊鑷直接夾住近放射緣頂端,反轉向心牽拉,以改變其撕裂方向。這種方法在大多數情況下是有效的。
③術中前囊膜口撕裂:一個很漂亮的撕囊,也可能因術中操作不當,而使完整性遭到破壞,甚至造成嚴重後果。術中前囊膜口撕裂,主要發生在乳化階段,而且大多數出現在首尾相接處。
乳化早期如發現有撕裂,則應儘量避開撕裂處操作,以免撕裂進一步擴大。此時也應儘量避免前房過淺或因灌注流量過大所致的前房過深(晶狀體深陷)。乳化過程中如發現有撕裂,則應停止操作,仔細檢查撕裂範圍。如允許繼續操作,最好通過手法將核脫出囊外,這樣會減少對囊膜口的牽拉。撕裂也可以發生在注-吸階段,特別是撕囊時如有遊離殘片存留,更易被誤吸。清除12點時鐘位皮質時,因能見度差,操作不順手,也容易誤吸前囊膜而使其撕裂。爲避免此種情況發生,最好用特製彎注-吸針頭或用手吸法清除上方皮質。
④懸韌帶離斷:這種情況多發生在老年人以及囊膜韌性較大病例。前者懸韌帶本已脆弱,而後者則因必須增加撕囊的力度,使懸韌帶受到更大牽拉。因外傷或局部慢性炎症所致的前囊膜纖維化就是一個典型的例子。兒童期或青少年白內障,其囊膜彈性大而韌,也容易發生這現象。Morgagnian白內障時囊膜常呈纖維化,懸韌帶明顯脆弱,操作中的任何疏忽,均可導致離斷。一旦發生部分懸韌帶離斷,這一象限的皮質就應採取與離斷區相切的運動方式加以清除。其目的是避免對離斷側進一步牽拉。
11.4 (4)與水分離有關的併發症(Complications Relating to
Hydrodissection):充分的水分離對於成功完成超聲乳化操作是非常重要的。儘管水分離在操作上相對比較簡單,但若有疏忽,一樣會釀成大禍。
①後囊膜破裂:與注水過多過快有關。如果在短時間內注入過量BSS,則因來不及擴散,在局部產生較大壓強,就有可能將後囊膜撐破。針頭插入過深,也可直接刺破後囊膜。此外,撕囊時如已有放射狀撕裂延伸到近赤道部,若仍在此附近進行水分離,往往會使撕裂繞過赤道部向後囊膜擴展。如發現後囊膜已發生破裂,應停止水分離。必要時改成囊外白內障摘除術。
②核脫位於前房:液體注入過量可導致核脫入前房,有時可同時伴有前囊膜破裂。核過早脫於前房,將影響囊袋內或後房超聲乳化操作。發生這種情況,最好藉助於輔助器械將其復位,如果復位困難,也不必強求,可小心在前房超聲乳化,力求不損傷角膜內皮。如若發現核很硬,則不可硬着頭皮在前房操作,寧可擴大切口將其挽出。
③水分離不充分:這是水分離操作中最常見的問題,而且帶有相當的隱蔽性。有經驗的術者,可通過一個注射點獲得充分的水分離;而對無經驗的術者而言,可能多次注射都是無效的。水分離不充分的直接後果是影響核旋轉,這將使後面的乳化操作發生困難。在水分離不充分的病例,爲克服旋轉困難,常常施加更大的牽張力,這使得囊膜和懸韌帶破裂的機會增多。
再一個問題是,由於水分離不充分,清除皮質階段就會出現很多困難。特別是赤道部皮質與囊膜粘着緊密,又很薄,很難脫離囊膜。如果提高負壓吸引,則很容易連同囊膜吸入,造成囊膜破裂的後果。
11.5 (5)與乳化有關的併發症(Complications of Relating to Emulsification Manipulation):這是最易產生併發症的階段。併發症種類繁多,涉及幾乎操作中的每一步驟。
①乳化頭進入前房不當:乳化頭通過隧道切口進入前房時,如果操作不當,可以引起虹膜根部離斷,嚴重時可伴前房出血或瞳孔縮小,還可引起後彈力膜脫離或角膜內皮損傷。
②刻槽時損傷囊膜:應該說,這一階段的操作環境是最好的。晶狀體核有最大的穩定性。且始終被限制在囊袋裏,因此可進行安全操作,但因操作不當,亦可引起不必要的麻煩。首先是雕刻太長,直到囊膜口邊緣,以至誤吸囊膜,稍一牽拉即可引起撕裂。再一個就是雕刻太深,特別是對軟核白內障,有時乳化頭可觸及後囊膜,造成直接損傷。
③旋轉核時損傷囊袋或懸韌帶:這種情況主要在水分離不充分,核在囊袋內未獲得充分遊離時發生。此外,操作不當,對核施加過大壓力或過分推旋晶狀體核都將可能造成囊袋破裂或懸韌帶撕裂。在軟核性白內障,由於抵止點呈軟質,也可能發生輔助器械頂脫核側壁,直接損傷後囊膜。
④分核時囊膜破裂:分核是最易發生後囊膜破裂的階段之一。主要原因是溝槽刻得不規範,分核時基本操作方法有誤。其中最主要的是分核時用力過猛過大,使囊袋被“爆發力”撐開發生撕裂。如溝槽刻得太深,分核時也可能發生因器械滑脫而直接戳破後囊膜的情況。
⑤處理核碎塊時損傷後囊膜或虹膜:當週邊部核碎塊並將其拖拉至中心時,抽吸點的選擇是很重要的。如果抽吸點太靠上,則會使碎塊“點頭”,其下面的不規則斷端可直接劃破後囊膜。對軟核碎塊用能量過大,負壓水平過高,還可能造成穿透,亦可能直接損傷後囊膜。如核碎塊位於前房靠近周邊部或虹膜附近,當接觸碎塊時,常誤吸虹膜使其損傷。此外,核碎塊乳化時,如平面太高,距角膜內皮太近,常因能量釋放或操作過多而損傷角膜內皮。
⑥處理核上皮質時後囊膜破裂:核上皮質是位於內核外一層緻密的皮質殼。當大部分或全部核被處理完後,有時會殘留這一完整結構。由於水分離不充分,這部分皮質和其外面的淺皮質層一起緊密粘着於囊膜,清除這部分皮質比較困難。試圖接觸並造成全堵狀態過程中,如用力過猛或負壓過高,也可能造成後囊膜破裂。一旦吸住某一部分皮質,而過分牽拉也造成懸韌帶離斷。
11.6 (6)與注-吸有關的併發症(Complication of Relating to Jlrrigation and Aspirtation)
①後囊膜破裂:清除皮質過程也是後囊膜容易發生破裂的手術階段。這主要與下列因素有關:
後囊膜完全失去支撐和保護,張力下降;抽吸負壓水平過高;操作距後囊膜過近;淺前房操作;注-吸頭頂端因損傷而形成銳痕;反流裝置(回吐)失靈。後囊膜破裂可大可小,可位於中心,也可位於周邊部,但在大多數情況下伴有玻璃體脫出。術中一旦發現後囊膜破裂,應立即停止手術,仔細查找原因。重要的是注射黏彈劑,保護破口不再擴大。只要破裂範圍小,殘留皮質又不多,則可在低灌注低負壓下繼續完成抽吸。如殘留皮質多,後囊膜破裂範圍又大,則用幹吸法清除皮質較爲安全。
②玻璃體脫出:術中一旦發現玻璃體脫出,原則上應做前玻璃體切割,玻璃體切割範圍則因不同情況而定。如殘留皮質較多,且與脫出玻璃體混合,則不管破裂範圍有多大,都應做徹底的前玻璃體切割,連同殘餘皮質一同清除。操作中應注意保護前囊膜口的完整性,以便能植入睫狀溝固定的人工晶狀體。
③皮質殘留:這主要發生在前囊膜開口及瞳孔過小的病例。二者均影響觀察和判斷皮質塊所在位置、大小及性質。特別是上方周邊部皮質,本來操作上就有一定難度,加之無法觀察,則殘留有時就不可避免。如瞳孔過小影響操作,術中應以1∶100000腎上腺素液做前房灌注,使其散大,或用虹膜牽開器牽開虹膜仔細檢查是否有皮質殘留。再一個原因是,玻璃體壓力較高,使後房及囊袋始終處於關閉狀態。這樣,周邊部皮質就被禁閉在赤道部,因注-吸頭無法接近而成爲“死皮質”。遇到這種情況,應仔細找出原因加以處理,包括補充縫合切口、提高灌注液高度、減少抽吸流量等。當皮質與囊膜緊密粘連且層次較薄時,也可因抽吸困難而被殘留。這種情況在撕囊範圍小和水分離不充分時非常容易出現。
11.7 (7)與人工晶狀體植入有關的併發症(Complications Planting toIoL)
植入人工晶狀體過程中發生的併發症,大多與隧道切口對晶狀體通過的限制有關。切口越小,隧道越長,這種情況越多發生。
①後彈力膜脫離:多發生在切口太小、內切口靠前和隧道過長的病例。晶狀體光學部邊緣可直接頂推,造成後彈力膜脫離。如出現這種情況,應向晶狀體上面注黏彈劑力求改變上翹的狀態,使前緣向下滑入。
②角膜內皮損傷:如果前房過淺時植入晶狀體,特別是前房缺少黏彈劑保護時,晶狀體下緣可刮劃角膜內皮,使其嚴重損傷。注入充足的黏彈劑,使前房形成足夠空間,可避免這種情況的發生。
③虹膜損傷:當存在淺前房,內切口位置又靠後時,晶狀體下襻可推輾上方虹膜,輕者脫色素,重者可造成虹膜根部離斷以至前房出血。簡單的處理方法就是植入人工晶狀體前,向切口下方虹膜表面注入黏彈劑,將虹膜壓陷形成寬暢的通道,然後再按要求植入人工晶狀體。
④後囊膜破裂:當人工晶狀體光學部最大徑越過切口時,往往會徒然轉向下傾,此時如不注意控制下傾角度並掌握推進力度,下襻可彈破後囊膜,產生嚴重後果。預防措施包括掌握正確的推進角度和力度,避免“失空”現象的發生。
當晶狀體最大徑越過切口後,最好挾持後襻根部,輕輕推動晶狀體,使其依靠襻傳遞的彈力緩緩滑入囊袋,即所謂“軟植入”,以鑷子挾持光學部,一直插到囊袋內的“硬植入”,容易造成後囊膜損傷。
⑤懸韌帶離斷:當晶狀體襻缺乏彈性,操作又不規範,則除易損傷後囊膜外,還容易使懸韌帶離斷。當以小撕囊口植入大直徑人工晶狀體時,也容易發生這種情況。
⑥晶狀體襻折斷:當切口過小,或不規範,而植入的人工晶狀體太厚,如欲硬性將其植入,往往會發生襻折斷現象,特別是在植入摺疊人工晶狀體時更是如此。預防的辦法是,寧可略微擴大切口,而不要勉強維護“絕對小切口”概念。此外,在植入人工晶狀體時,先把下襻順入切口,再植入光學部,可減少因襻和光學部重疊所致的“擁擠”現象發生。
⑦人工晶狀體反轉:不管是硬質晶狀體還是可摺疊晶狀體,都有將其植反的可能性,特別是摺疊晶狀體,這種情況更易發生。一旦發現人工晶狀體反轉,應將其復位。注入黏彈劑後,以輔助器械下壓一側光學部,以使產生翹翹板樣反轉。操作中注意保護角膜內皮、虹膜及後囊膜。
12 術後併發症
12.1 (1)角膜失代償(Corneal Decompensation)
角膜失代償是角膜內皮受到嚴重損傷、功能嚴重失調的表現。角膜上皮層間及與前彈力膜之間形成大小不一的水泡,伴角膜基質水腫。
角膜失代償主要與下列因素有關:①在高超生能量釋放條件下長時間操作;②術中機械、化學性損傷,引起大量內皮細胞喪失;③成形玻璃體持續與角膜內皮接觸;④長時間的重度虹膜炎;⑤長期高眼壓引起角膜內皮損傷;⑥嚴重而廣泛的虹膜前粘連。
角膜失代償發生的速度雖有不同,但其轉歸是相同的:嚴重視力障礙,最終形成大泡性角膜病變(bullous keratopathy)。
在處理上,首先考慮病因治療。單純角膜水腫一般可自行恢復,無需特殊治療。角膜失代償則比較複雜。如果玻璃體同角膜接觸時間很短,角膜內皮計數及形態均正常,就應單純行玻璃體切割,解除粘連,以保護角膜;如角膜狀態很差,細胞計數接近臨界值,就應同時考慮行穿透性角膜移植。如僅是單純的玻璃體條索與角膜創口粘連,也可先以YAG激光試行切開。術中是否取出晶狀體必須綜合考慮,因爲有時取出晶狀體所造成的損傷會使術後情況變得更糟。近年來的報道表明,有90%的病人術後角膜移植片清亮,其中67~80%的病人獲得較好視力。
12.2 (2)術後炎症反應(Postoperative Inflamation)
術後炎症反應並非爲超聲乳化手術所特有。所有類型的白內障手術包括人工晶狀體植入術,均經歷了大致相同的手術過程,因此都面臨術後炎症反應問題。
①虹膜炎症反應:因手術刺激,術後引起虹膜炎症反應,在臨牀上比較多見。炎症反應的程度與受刺激的程度、灌注液的種類等有關。臨牀上主要表現爲房水渾濁、浮游細胞、晶狀體表面沉着物及薄膜形成。在極特殊情況下,可出現成形滲出並有前房積膿,這種情況在外傷性白內障術後二次人工晶狀體植入時並不少見。
一個手術過程非常順利的超聲乳化手術,由於可以最大限度的減少機械性刺激,所以術後幾乎無明顯炎症。然後,如果手術不順利,甚至介入更多的補救性手術操作,則術後炎症反應可以很重。超聲乳化手術後炎症反應的臨牀表現與一般白內障手術無異,其轉歸也大致相同。
伴隨着炎症反應,尚有晶狀體表面蛋白膜形成過程。Wolter(1985)認爲,這是一種慢性炎症反應過程:人工晶狀體植入後,引起單核細胞聚集在人工晶狀體周圍,並轉變爲巨噬細胞。巨噬細胞產生蛋白膜,同時部分巨噬細胞轉變爲成纖維細胞、上皮細胞、巨細胞等。含有這種細胞的蛋白膜最終將人工晶狀體包繞。這種蛋白膜可見於各種類型的人工晶狀體,是人眼對作爲異物的人工晶狀體反應過程的一部分。
②纖維蛋白滲出:是術後炎症反應的一種類型,以纖維蛋白膜形成爲其特點。如膜緻密而厚,將嚴重影響視力,此時需要做膜切開以恢複視力。其中部分虹膜與晶狀體表面的粘連可於數週或數月後自然鬆解,而與殘留的晶狀體前囊間的粘連常爲永久性。
12.3 (3)人工晶狀體毒性綜合徵(Toxic Lens Syndrome)
隨着人工晶狀體質量的提高,與人工晶狀體直接有關的毒性反應極爲少見。但作爲一種臨牀現象,仍需加以認識。
人工晶狀體毒性綜合徵最初由Shepard(1980)和Alpar(1982)加以描述。主要臨牀表現爲術後數天或數週,突然出現晶狀體表面色素性沉着物,及無菌性前房積膿,同時伴有玻璃體渾濁。通常眼不疼,充血和結膜水腫極輕。前房水和玻璃體細菌培養爲陰性。偶爾伴頭暈、頭痛和血壓增高。
人工晶狀體毒性綜合徵與晶狀體本身質量有關,據已發表資料主要有以下說法:
①環氧己烷(ethylene oxide,EO)消毒氣體殘留,特別是毒性更大的次產品,如ethylene glycol(EO加水)和ethylene
chlorohydrin(EO和含氧化物溶液)更易引起毒性反應(Stark et al,1980)。
②由EO破壞的革蘭陰性細菌所釋放的熱原沒有被充分洗除(Stark,et al,1980)。
③EO產生的靜電吸附灰塵及其他顆粒,沒有被氫氧化鈉洗除(Stark,et al,1980)。
④拋光成分含有硅和鋁,殘留於幹包裝內(Meltzer,1981)。
⑤致炎物質,如硅、鋁、鋇等自包裝容器溢出(Meltzer,1981)。
⑦單體含量和釋放取決於人工晶狀體的質量,與其有關的證據是術後14~16d晶狀體表面形成巨細胞沉着物(Turkish and Galin,et al,1980)。
⑧因手術創傷及灌注刺激而產生的白細胞反應(亦稱白細胞毒性)(Galin,et al,1977)。
⑨尼龍襻水解和剝落形成白細胞抗體產物,並刺激酶活性增強。這些酶激活的化學反應可使尼龍多聚體分解成可溶性小分子,甚至水解PMMA的酯側鏈(Hessburg,1980)。
⑩複雜的免疫學反應(Galin,et al,1980;Tuberviller,et al,1982)。
?γ-線照射引起平衡鹽液內化學成分改變(Galin,1980)。
?某些質量低劣的PMMA晶狀體,其襻爲含有毒性物質的PMMA鑄壓而成,可引起嚴重的反應。這種晶狀體的襻不是純淨的PMMA,而是含有其他物質,這很可能是產生毒性綜合徵的原因之一(Clayman,1983)。
事實上,隨着人工晶狀體材料的嚴格控制和製作技術的不斷提高,以及消毒條件的不斷改善,這種與晶狀體質量直接關聯的併發症已極爲少見。
12.4 (4)眼內炎(Endophthalmitis)
包括兩種情況,一種是晶狀體皮質過敏性眼內炎,一種是感染性眼內炎。
前者是由於術中殘留大量皮質,或部分皮質及核墜入玻璃體腔所致。伴隨着皮質的吸收過程,表現爲典型的眼內炎徵象:結膜水腫、混合充血;前房渾濁,甚或積膿;玻璃體塵埃樣渾濁或可見膨鬆的晶狀體皮質殘留。患者主訴持續或間歇性眼痛,糖皮質激素可減輕症狀和體徵,但直到皮質完全吸收之前,很少有自行緩解和消退者。
白內障手術和人工晶狀體植入術後感染性眼內炎是重嚴重的併發症之一。臨牀表現爲突然發生眼球疼痛,結膜水腫、充血,並眼瞼水腫;前房玻璃體內大量滲出,有時有前房積膿,病情發展急驟。如爲毒力很強的病原菌感染(如綠膿桿菌),常於術後2~3d發病;如爲毒力較弱的細菌(如表皮葡萄球菌),則症狀可延遲出現。同細菌性眼內炎相比,真菌感染發病較緩和,進展亦較慢,出現明顯的臨牀症狀約需2~4周。
術後眼內炎,同人工晶狀體毒性綜合徵、晶狀體過敏性葡萄膜炎及其他無菌性炎症在發病早期很難在症狀上加以鑑別。但後者對散瞳和局部應用激素反應迅速,可短期內明顯好轉。而前者大多爲48h後發病,伴明顯的自覺症狀,對散瞳和激素治療反應較差。但對毒力較弱細菌引起的眼內炎很難用常規方法進行判斷。因此有人建議,一旦懷疑術後眼內炎,即應警惕感染的可能;若局部應用激素24h內炎症無減輕趨勢,就應按細菌性眼內炎治療,同時做前房穿刺取房水標本進行培養;對高度懷疑感染性眼內炎時,應作玻璃體切割並獲標本進行培養。
一旦確定診斷,即應全身和局部應用足量廣譜抗生素;必要時行玻璃體切割,同時向玻璃體腔內注射抗生素。
對於術後眼內炎重要的是預防。預防措施包括術前徹底清除瞼緣炎、慢性淚囊炎等感染病竈;術前及術中切開眼球前抗生素徹底沖洗結膜囊;無菌透明塑料薄膜覆蓋所有眼周圍及額部皮膚;隨時引流排除滯留於淚湖內的灌注液,以防止滲入眼內;注入眼內的空氣必須經確實消毒,或經0.20~0.22μm微孔濾器;人工晶狀體自包裝容器內取出至植入眼內儘量縮短時間並減少中間環節;術後局部應用抗生素等。
隨着手術技術的提高和消毒方法的改進,人工晶狀體植入術後感染性炎症已很少發生。
12.5 (5)後囊膜渾濁及增殖膜(Posterior Capsular Opacity and Proliferative Membrane)
後囊膜渾濁及增殖膜形成,是幾乎所有類型白內障手術所共同面臨的問題,超聲乳化手術也不例外。有二種情況,一種是增殖膜形成,與後囊膜無關;另一種情況則是與後囊膜本身有關的渾濁形成。
①繼發膜:即人工晶狀體後膜,是早期虹膜夾型人工晶狀體植入後晚期主要併發症。後房型人工晶狀體植入後很少發生。但術後反覆發作的炎症反應,使人工晶狀體周圍形成炎性包裹或纖維膜並不少見。
繼發膜產生的主要原因是房水循環異常及持續性炎症反應。正常情況下,房水經瞳孔循環進入前房,經小梁組織排出眼外;當植入人工晶狀體前移時,瞳孔區被阻,大部分房水經虹膜周切孔循環,使炎性碎片和細胞物質滯留於虹膜後面,同纖維素性滲出一起形成膜樣結構。膜可爲菲薄透明,也可爲緻密渾濁,後者常影響視力。術後立即縮瞳,可使繼發膜發生率明顯增加。
繼發膜的處理主要取決於其嚴重程度和對視力的影響。當視力正常或接近正常,則僅需定期複查;如果因爲炎症反應有使膜進一步發展的趨勢,則需適當散瞳並局部給予糖皮質激素。但當緻密渾濁繼發膜已形成並影響視力,則應考慮手術介入。
②後發障:是後房型人工晶狀體植入術後晚期主要併發症之一。主要表現爲後囊膜增厚渾濁,嚴重影響視力。據統計,後房型人工晶狀體植入術後6個月到2年間,後發膜性白內障的發生率爲20~40%,有的文獻報道其發生率高達60%。
後囊膜增厚渾濁是囊外白內障摘除以及超聲乳化手術術後的慢性進行性過程,主要與炎症反應和上皮細胞增殖有關。前者是手術性創傷、組織碎片殘留(如晶狀體皮質或囊膜碎片)的直接後果;後者則是與晶狀體上皮細胞殘留過多及處理不當相關聯。
考慮到與發病有關的因素,預防和處理後發障的主要措施包括:
A.一期後囊膜切開。即在植入人工晶狀體後,在後囊膜視軸區做一小範圍切開或撕開,以形成正中透明區,可有效防止後發障的形成。但一些學者反對這一作法,理由是:a.臨牀觀察證明,真正需要做後囊膜切開者畢竟佔少數;b.一期後囊膜切開破壞了前、後房之間的屏障;c.晚期後囊膜切開(1年以後),可因後囊膜與玻璃體分離而保留完整的玻璃體前膜,因而其併發症(黃斑囊樣水腫、視網膜脫離、角膜失代償)明顯減少。
B.預防Elschning珍珠障(Elsching′s
pearl)。Elsching珍珠障可發生於術後數月,主要爲晶狀體上皮細胞增殖所致。減少殘留上皮的數量可預防或推遲其發生。主要措施爲:a.大範圍的撕囊;b.小心而謹慎的拋光;c.與後囊膜相適應的合適人工晶狀體;d.或特殊的人工晶狀體設計,即在晶狀體光學中心與周邊部之間有一脊狀隆起,作爲屏障,防止晶狀體上皮向中心部增殖。
C.後囊膜拋光。在某些病例,一旦出現後囊膜渾濁,行後囊膜拋光較後囊膜切開更安全。因爲一些沉着物、炎性碎片或Elschning珍珠障等都是很鬆弛的附着在囊膜上。此時只需輕輕拋光,將其擦掉並吸出即可。但對緻密的纖維膜或晶狀體與後囊膜間沒有足夠空間者不適合這種操作。
D.後囊膜切開。術後發生後發障,如已明顯影響視力,在大多數情況下,可通過手術方法加以解決。其中相當一部分病例,可用YAG激光切開後發障,這一方法簡單、安全、效果好,爲首選。其次可考慮手術介入。
在一些病例,也可考慮行前玻璃體切割,同時做後囊膜切開,這一方法雖較複雜,但清除機化膜及其他渾濁組織更爲完全徹底。
③囊袋皺縮:囊袋皺縮多發生在早期硅凝膠摺疊人工晶狀體植入病例,可以使晶狀體移位偏心,但一般不引起臨牀症狀。在臨牀上比較有意義的是所謂後囊膜皺褶,即當一襻在睫狀溝一襻在囊袋內時,由於後囊膜受力不均而呈現與晶狀體長軸一致的皺褶。由於後囊膜所處的重要位置,任何屈光指數改變都將會嚴重影響視力。因此後囊膜皺褶可引起明顯的視力干擾和障礙。C襻晶狀體襻長,彎度較緩和,支撐力分佈均勻,較之J襻晶狀體不易引起後囊膜皺褶。
當後囊膜皺褶嚴重影響視力時,需要手術針將其切開,使視軸區透明。以YAG激光切開更爲方便。
12.6 (6)青光眼(Glaueoma)
白內障術後青光眼是多病因因素單獨或聯合作用所致。這些因素包括:酶製劑溶解晶狀體懸韌帶;大劑量應用激素;過度燒灼房水靜脈;術後小梁網水腫(特別是在角鞏膜切開情況下更易發生);晶狀體皮質堵塞小梁;前房滯留黏彈性物質等。除此之外,白內障術後其他併發症也可引起繼發青光眼,這些情況包括:玻璃體脫出或術後處理不當引起的瞳孔閉鎖;前房出血;玻璃體出血等。
大多數繼發青光眼可在數天內自行緩解,但眼壓持續增高也足以引起持久性損害和視力喪失,特別對原來就有視神經和視網膜血管病變者更是如此。因此,對於所有類型的術後青光眼都需要進行及時有效的治療,針對不同情況,分別採用碳酸酐酶抑制劑、β-受體阻滯劑、高滲劑等。
在這種情況下,一般應避免使用縮瞳劑。因爲縮瞳劑可加重術後虹膜炎,導致晶狀體和虹膜粘連。在年輕個體,還有促使纖維膜形成及明顯的色素遷移到玻璃體前表面以及人工晶狀體表面的現象。
①瞳孔阻滯性青光眼:某些類型的人工晶狀體植入,容易引起瞳孔阻滯性青光眼,這在術中沒有做充分的虹膜根部切除者更爲多見。早期的虹膜固定型或瞳孔固定型晶狀體,是這種類型的典型代表。後房型晶狀體特別是晶狀體襻與晶狀體平面沒有夾角的後房型晶狀體,也可產生瞳孔阻滯性青光眼,這在我們的經驗中遇見已不止一例。爲了預防這種青光眼的發生,有人建議手術時做足夠大小的虹膜周邊切除。但事實上,隨着人工晶狀體質量的提高,臨牀上已經很少見到瞳孔阻滯性青光眼,因此沒有必要強調術中一定要做虹膜周邊切除。
如果發生了瞳孔阻滯性青光眼,強散瞳有時可以解除阻滯,但卻是暫時的,而且有時會導致晶狀體脫位。因此只能作爲應急的臨時措施而採用。解決問題的根本方法是做周邊虹膜切除。對那些僅切除虹膜實質而色素上皮層依然完整者,以微細的虹膜恢復器自二縫線間伸入眼內將色素上皮劃開即可。若必須做全層虹膜切除,則最好另做切口。
Nd:YAG激光做術後瞳孔阻滯性青光眼的治療有更多的優越性。對殘留的完整的色素上皮,往往只需一次低能量擊射即可切開。對需要做全層切開者,採用8mJ能量,多脈衝,一次擊射,在大多數病例可獲成功。
②惡性青光眼:人工晶狀體植入術後發生惡性青光眼比較少見。在這種病例,大量房水進入玻璃體後面,將虹膜-人工晶狀體隔向前推壓,使房角關閉。在後房型人工晶狀體可發生虹膜嵌閉綜合徵或虹膜夾持綜合徵(captive iris syndrome);而在虹膜固定型晶狀體則可引起晶狀體脫位。不管何種類型晶狀體,重要的是早期發現及時治療,以防止角膜內皮因與晶狀體接觸所致的不可逆損害。
對於所有類型的後房型晶狀體,一旦這種情況發生,則需要強散瞳。同時做鞏膜穿刺吸出玻璃體腔內聚集的房水。液體大多聚集在中心部或靠前部玻璃體內,因此鞏膜穿刺無需進針太深。
在極特殊情況下,散瞳和虹膜周切仍不奏效,可考慮做前部玻璃體切割。做前部玻璃體切割時取扁平部切口,而避免通過原角鞏膜緣切口進行。
③囊膜禁閉綜合徵(capsular block syndrome,CBS):這是一種與撕囊有關的術後併發症。當撕囊十分規整,但撕囊直徑小於人工晶狀體光學直徑時,因人工晶狀體隆起堵塞前囊膜開口,造成嵌閉。此時囊袋內可有大量積液,使囊袋膨大,其結果是向後凸入玻璃體(後囊膜),向前壓迫瞳孔(前囊膜),造成瞳孔阻滯性青光眼發生。術後發生囊膜禁閉綜合徵的時間不定,最早可在術後第一天發生。一旦出現囊膜禁閉綜合徵,應設法切開囊袋,使囊袋內液體引流。
④空氣泡阻滯性青光眼:手術結束時前房注氣過多,大氣泡阻滯了瞳孔以及虹膜周邊切除口,也會引起青光眼。先給予醋氮酰胺或高滲劑,如眼壓有緩解趨勢,則可不必處理前房內氣泡;如眼壓仍持續下降,則需放出前房內氣體,並補充平衡液。放出前房內空氣並非易事,有時操作不當可使氣體鑽入後房,使問題複雜化。最好是用注射針頭,在平衡液灌注下,緩緩吸出大部分氣體。
⑤血影細胞性青光眼(ghost cell glaucoma):術中出血如進入玻璃體,或植入人工晶狀體後,晶狀體襻損傷睫狀體引起的遲發性玻璃體出血,以及虹膜周邊切除距根部過近及虹膜本身的損傷,都可導致出血進入玻璃體。如有大量出血聚集在玻璃體內,變性的血細胞—血影細胞便可進入前房並堵塞小梁組織,引起術後眼壓增高。這一過程大約需數天或數週。
一旦確定診斷,應採取積極措施,藥物治療無效即應考慮前房沖洗和玻璃體切割,以徹底清除血影細胞源。在極特殊情況下方考慮取出人工晶狀體。
⑥色素性青光眼:術後人工晶狀體表面或晶狀體襻反覆摩擦虹膜後表面,可致色素細胞大量脫失,引起眼壓增高。後房型人工晶狀體囊袋內植入已極少見到這種併發症的發生。
12.7 (7)術後眼內出血(Postoperative Intra Ocular Hemorrhage)
①前房出血:角膜緣切口的術後早期,切口癒合的同時,有大量新形成的血管橫跨創口。任何使切口變形和破裂的外傷均可導致不同程度的前房出血。特別在切口對合不良或縫合不嚴密的情況下,肉芽組織形成過多,血管極爲豐富,前房出血的機會更多。術中血管燒灼過多過重、睫狀體損傷、虹膜異常新生血管等都可導致術後早期前房出血。全身因素主要是心血管疾患,特別是控制不良的高血壓、糖尿病、血液病及長期使用抗凝劑等。
前房出血爲鮮紅色,大部分形成液平面。陳舊性出血呈暗紅色,反覆出血可形成下方爲暗紅、上方爲鮮紅的分層現象。一次性少量出血可在數日內自行吸收;如出血較多或反覆出血應當心併發症的發生。當出血超過前房容積的50%時,特別是伴有高眼壓,應警惕發生角膜血染。
後房型人工晶狀體植入,由於位置比較靠後,引起出血的機會較少,特別是囊袋內植入者,這種併發症更爲少見。
治療上以保守爲主。如果前房積血較多並形成凝血塊,單純前房穿刺很難將其清除;如尚未形成明顯的凝血塊,則可以灌注方式將積血從另一穿刺口清除;對已形成大凝血塊,用一般方法難以清除者,還可以考慮通過角膜緣大切口挽出的方法;或者以前玻璃體切割器切除的方法將其吸除。在大多數情況下,單純以同軸注吸針頭清除前房積血,效果是滿意的。
②玻璃體出血:現代囊外白內障摘除術或超聲乳化吸除術,已使這一併發症極少發生。但在極個別不順利的病例,也可因後囊破裂、玻璃體脫出及眼內過多操作,引起術後玻璃體出血。少量玻璃體出血,很少引起視力障礙。有時僅當醫生檢查眼底時才發現,在瞳孔下方的玻璃體前膜內面附有鮮紅的新月形血液。這些血液可持續數週或數月不變。
值得注意的是,有些病例術前即存在引起玻璃體出血的眼內增殖性病變,因手術刺激以及眼內環境改變引起出血。這種情況一旦發生,處理上比較困難。一方面是病因很難確定,另一方面是已經歷了一次白內障手術,馬上再做玻璃體手術,對眼球的再創傷太大。
12.8 (8)與瞳孔有關的併發症(Complications Relations to Pupil)
①瞳孔夾持:瞳孔夾持是指人工晶狀體植入術後,因各種原因致使瞳孔光學部全部或部分滑到虹膜前面,形成晶狀體嵌頓於瞳孔的特殊狀態。這是後房型人工晶狀體植入術後所特有的併發症。瞳孔夾持早期可僅發生瞳孔變形,一般呈紡棰形,狀似貓眼,故又稱作貓眼綜合徵(Cat′s eye syndrome)。晚期可導致瞳孔括約肌損傷、虹膜纖維化、出血或青光眼,但這種後果臨牀上並不多見。
根據發病原因,臨牀上可將瞳孔夾持分成二種類型。一種是術後早期發生的、不伴瞳孔粘連稱爲遊離瞳孔夾持;另一種是術後晚期發生,伴有瞳孔粘連變形,是爲固定性瞳孔夾持。前者多是因爲術後淺前房、過度散瞳或晶狀體位置異常(晶狀體學平面和襻爲同一平面較多見)所致,特別是將帶前傾10°襻的晶狀體反植更易發生;後者主要是因術後持續炎症反應致部分虹膜囊膜粘連,漸漸地因收縮而牽拉虹膜向後,同樣情況也可在虹膜玻璃體粘連中見到。虹膜後粘連與術中的機械性創傷有直接關係,特別是清除皮質過程中,注吸針頭過多在虹膜後面操作,乃至大片的色素上皮脫失,形成創面,這是術後虹膜後粘連的主要原因。然而,這一點卻爲大多數的初學者,甚至已有相當經驗的醫生所忽略。
瞳孔夾持的處理包括二種方法:一是活動瞳孔,即靜脈給予甘露醇後,交替散瞳和縮瞳可望使具晶狀體後退復位。在這一過程中,也可用棉籤按壓晶狀體襻附着處,促使晶狀體後移。如不奏效則需手術介入。散瞳後自角膜緣部切口伸進晶狀體調位鉤或晶狀體板,將晶狀體後壓,同時用乙酰膽鹼縮瞳。以上過程必須按顯微手術常規進行,否則極易引起副損傷或前房出血。
②瞳孔後粘連:後房型晶狀體植入後,瞳孔後緣局部粘連,常不影響視力,也不產生其他嚴重後果,一般不需處理。但如果粘連很廣泛,使瞳孔嚴重變形,甚至出現瞳孔閉鎖,則需採取必要措施,以解除粘連。虹膜後粘連與術後虹膜炎反應嚴重、時間長有關,但最重要的是沒有合理應用激素和及時有效的散瞳有關。
在臨牀上比較多見的另一情況是虹膜同前囊膜片或後囊膜的粘連。這種粘連不能直接看到,故容易被忽視。當散瞳時,粘連部位的瞳孔散大受限,而且常常由於虹膜受牽拉,在虹膜與晶狀體邊緣之間形成一溝槽,這一溝槽逐漸加深擴大,隨之瞳孔也逐漸變形,最終在這一部位可形成固定型瞳孔夾持。這一後果也與術後早期強烈散瞳有關,因此,術後強散瞳不僅不必要,而且應該避免。
粘連一旦形成,鬆解一般不會成功,因爲手術創傷可使其形成更廣泛的粘連。術中注意保護虹膜後面的色素上皮層,術後避免長期散瞳,足量的激素應用可有效的預防這一併發症的發生。
③瞳孔變形和移位:這是所有類型白內障手術都將面臨的臨牀問題。當術中後囊膜破裂並有破璃體脫出,如果對玻璃體問題處理的不合理,很可能就會爲術後發生相關併發症提供了條件。術後瞳孔上移常是玻璃體條索牽拉的結果;術後瞳孔變形常是虹膜嚴重創傷後創面修復過程中的伴發情況。而對於超聲乳化而言,術中“咬傷”虹膜使瞳孔括約肌斷裂,造成術後瞳孔變形則更是常見併發症。一般來說,瞳孔變形如不影響視力,則可不做處理。而瞳孔移位則必須視具體情況而定。如移位很輕,不影響視力,可不予處理;如移位嚴重,特別是向上移位,則可考慮做瞳孔成形術。
12.9 (9)黃斑囊樣水腫(Cystoid Macular Edema)
對於白內障手術來講,黃斑囊樣水腫是術後最不具有預測性的併發症之一。一旦發生,將明顯影響術後視力恢復。而在臨牀處理方面,具有相當的複雜性。
黃斑囊樣水腫(cystoid macular edema,CME)是黃斑部毛細血管通透性增強的直接結果。黃斑區分佈有豐富的軸突(Henle神經纖維層),少量膠質組織,無血管,但卻有相當活躍的代謝過程;相反,對滲出的吸收較其他部位要慢得多。
黃斑水腫的真正原因尚不清楚,但對大多數病例而言,其致病因素是相當複雜的,或爲多因素作用的結果。按照Tennant(1981)的意見,將CME分爲二種類型:急性和慢性型。急性CME發生在術後3個月內,可能與前列腺素釋放有關,對局部應用抗前列腺素製劑和激素治療反應良好。慢性CME則發生較晚,甚至在術後數年發生。這一類型的CME對上述治療毫無反應,視力預後一般不佳。
黃斑囊樣水腫有自愈傾向,視力預後較好。但有相當一部分病例經歷慢性進行性過程,視力損害嚴重。因此,預防黃斑囊樣水腫的發生具有重要的臨牀意義。預防術後發生黃斑囊樣水腫包括二個方面:
①手術預防:包括術式選擇,囊外摘出較囊內摘出安全;人工晶狀體固定方式選擇,囊袋內固定較睫狀溝固定更安全。後者基本上不產生眼內顫動,避免對色素膜組織的摩擦和刺激。此外,無創傷手術,即動作輕柔,準確,不觸及虹膜等,對於減少術後CME發生也十分重要。術中如脫出玻璃體則必須徹底清除,以解除對黃斑部牽拉。
②藥物預防:所謂抗前列腺素製劑,即是非甾體抗風溼和抗炎類製劑,它們可以抑制前列腺素合成。二種抗前列腺素作用較強的製劑是雙氯滅酸(diclofenac)和吲哚美辛(indomethacin)。其他尚有布他酮(oxyphenbutazone)和氟苯布洛芬(flurbiprofen)。前者抗炎作用弱;後者抗炎作用強。但必須強調,全身給予吲哚美辛和其他類抗炎製劑可產生明顯的不良反應和有廣泛的禁忌證。而且全身給藥,對CME作用甚微。因此局部給藥是安全且十分有效的途徑。
大量的臨牀資料證明,消炎痛確實有終止CME的作用,但一經停藥,CME將繼續發展。因此,作爲預防,術後給予吲哚美辛,至少應持續6~9個月,因爲在這期間CME發生率最高。而爲了在術中達到有效濃度,吲哚美辛應在手術前一天開始給予。
此外,爲了加強預防效果,可同時全身和局部給予糖皮質激素和其他非激素性抗炎製劑。
12.10 (10)視網膜脫離(Retinal Detachment)
超聲乳化白內障吸除術及人工晶狀體植入術後,很少發生視網膜脫離。即使發生亦與超聲乳化手術本身大多無直接關係。以往有關視網膜脫離的報道,大多與老式的白內障手術方式有關。
多數學者報道,人工晶狀體植入術後和單純白內障摘出術後視網膜脫離的發生率大致相同。而有些學者認爲,人工晶狀體植入術後視網膜脫離的發病率反而比單純白內障摘出者爲低,這可能與人工晶狀體植入術的選擇標準要比常規白內障摘出術更爲嚴格有關。因爲在人工晶狀體植入組,事先已排除了有視網膜脫離傾向的眼,如高度近視、視網膜病變、對側眼曾經歷視網膜脫離等。但有可靠的證據表明,囊外白內障摘出術後視網膜脫離發生率明顯較囊內摘出爲低(0.9%∶3%)。同樣的結論也適合於人工晶狀體植入術後,即有完整後囊膜的後房型人工晶狀體植入術後視網膜脫離發生率明顯低於前房型或虹膜平面型人工晶狀體植入。因爲人們認爲,除不完整的後囊膜因素外,人工晶狀體震顫和眼內顫動是促進視網膜脫離的重要因素。
人工晶狀體植入術後發生視網膜脫離,處理上比較困難,預後不佳。由於瞳孔散大受限、晶狀體表面沉着物、後囊膜渾濁(特別是周邊部)等因素,使眼底情況難以檢查,特別是周邊部視網膜。在此情況下,也很難對視網膜裂孔進行定位,因此視網膜復位手術難以進行。這在早期的二平面虹膜夾型和囊膜固定型晶狀體表現更爲突出。晶狀體襻和柱腳陰影及反射產生干擾,同時瞳孔受限不能充分散大,使得觀察眼底及裂孔定位幾乎成爲不可能。如若後房型人工晶狀體植入術後發生視網膜脫離,情況要好得多。只要瞳孔沒有任何粘連,可被散得足夠大,藉助於鞏膜壓迫器,以雙目檢眼鏡可檢查幾乎整個眼底。
一旦發現有視網膜脫離,應採用積極態度手術治療。手術方法與無晶狀體眼視網膜脫離手術相同,但應考慮人工晶狀體這一特殊情況。Alpar早期提出的有關人工晶狀體處理原則,至今尚有一定參考價值,這些原則是:
①如白內障手術時間不超過6個月,決定做視網膜脫離手術之前應加固縫合創口。否則術中可能發生白內障切口裂開,晶狀體-角膜內皮接觸。
②虹膜支持型晶狀體,如散瞳有晶狀體脫位的危險時,術前應做晶狀體縫合。
③硬質前房角固定型晶狀體,當做環扎時應十分謹慎,並注意觀察是否有前房出血;如爲彈性襻前房型晶狀體,則需警惕產生晶狀體-角膜內皮接觸。