2 基本信息
《兒童腦膠質瘤診療規範(2021年版)》由國家衛生健康委辦公廳於2021年4月29日《國家衛生健康委辦公廳關於印發兒童血液病、惡性腫瘤相關12個病種診療規範(2021年版)的通知》(國衛辦醫函〔2021〕249號)印發,通知要求各省、自治區、直轄市及新疆生產建設兵團衛生健康委結合臨牀診療實際參照執行。
3 發佈通知
國家衛生健康委辦公廳關於印發兒童血液病、惡性腫瘤相關12個病種診療規範(2021年版)的通知
國衛辦醫函〔2021〕249號
各省、自治區、直轄市及新疆生產建設兵團衛生健康委:
爲進一步提高兒童血液病、惡性腫瘤診療規範化水平,保障醫療質量與安全,按照《關於進一步擴大兒童血液病惡性腫瘤救治管理病種範圍的通知》(國衛辦醫函〔2021〕107號)要求,我委組織國家兒童醫學中心(北京兒童醫院)開展了兒童血液病、惡性腫瘤相關12個病種的診療規範制修訂工作,形成了相關病種診療規範(2021年版)。現印發給你們(可在國家衛生健康委網站醫政醫管欄目下載),請結合臨牀診療實際參照執行。
附件:
5-1.兒童中樞神經系統生殖細胞腫瘤診療規範(2021年版)
國家衛生健康委辦公廳
2021年4月29日
4 全文
4.1 一、概述
膠質瘤(Glioma)是兒童和青少年最常見的中樞神經系統腫瘤,佔所有兒童顱內腫瘤 40%~60%。膠質瘤起源於大腦和脊髓中的膠質前體細胞。根據世界衛生組織(WHO)對腦腫瘤的分類,膠質瘤又分爲低級別(Ⅰ級和Ⅱ級)和高級別(Ⅲ級和Ⅳ級)腫瘤。其臨牀表現非常廣泛,大多數兒童膠質瘤表現爲良性、生長緩慢的病變,WHO 分類爲Ⅰ級或Ⅱ級。這些兒童低級別膠質瘤(Low grade Glioma, LGG)與成人LGG 有着根本的區別,較少發生惡性轉化,整體生存率良好。
然而,相當一部分膠質瘤在短時間內發展迅速,WHO Ⅲ級或Ⅳ級高級膠質瘤(High grade Glioma, HGG),基本上無法治癒,甚至在幾個月內就會致命。
在過去的十年裏,兒童膠質瘤的分子生物學方面取得了前所未有的進展。全球範圍內大規模合作研究已經對不同年齡、不同級別和不同組織學的膠質瘤基因組和表觀遺傳學改變進行了分類。這些研究揭示了具有不同分子、病理和臨牀特徵的生物亞羣,與膠質瘤患者的管理有着明顯相關性。雖然兒童腦腫瘤的病理分類是一門新興的發展很快的特殊學科,但腦膠質瘤的分類目前仍參考2016年WHO中樞神經系統腫瘤分類。本規範主要涉及兒童常見LGG、HGG的診治(兒童室管膜腫瘤有獨立的規範)。
兒童腦膠質瘤治療需要神經外科、影像科、病理科、放療科、腫瘤內科和神經康復科等多學科合作,遵循循證醫學原則,目的是改善兒童膠質瘤患者的日常管理,並對患者進行長期隨訪觀察,以提高生活質量和預防 LGG 的長期後遺症。爲 HGG 患者努力尋找有效的治療手段,採取規範化、個體化綜合治療措施,以期達到最好的治療效果,儘可能延長患兒的無進展生存期(PFS)和總生存期(OS)。
4.2 二、適用範圍
根據病史、查體、影像學檢查、病理形態學、免疫組化、基因檢測、分子生物學等檢查確診的兒童腦膠質瘤。其具體分類見《2016 版 WHO 中樞神經系統腫瘤分類標準》(見附表1)。
4.3 三、診斷
4.3.1 (一)臨牀表現
兒童腦膠質瘤的臨牀表現主要包括顱內壓增高、癲癇發作和神經功能損傷三大類。
4.3.1.1 1.顱內壓增高表現:
腫瘤佔位效應或因佔位堵塞腦室引起腦積水均會引起顱內壓增高表現,包括視盤水腫、噁心、嘔吐、頭痛等,小於兩歲的患兒因其顱縫未完全閉合,可以表現出頭圍異常增大、易激惹、嗜睡、顱神經症狀及嘔吐等。
4.3.1.2 2.癲癇發作:
膠質瘤位於幕上時常引起癲癇症狀,表現爲發作性意識障礙、伴或不伴肢體抽搐等。
4.3.1.3 3.神經功能損傷:
腫瘤生長部位不同,可引起各種神經功能損傷症狀。如生長在下丘腦-視覺通路部位的視路膠質瘤可引起視力下降、視野缺損、激素及電解質代謝紊亂等;位於功能區的膠質瘤可引起一側肢體偏癱;位於腦幹的膠質瘤可引起呃逆、注視麻痹、面部感覺障礙、聽力減退等顱神經損害症狀,侵犯小腦時則可表現出走路不穩、眼球震顫、共濟失調和肌力減退等。
4.3.1.4 4.其他表現:
4.3.1.4.1 (1)間腦綜合徵:
表現爲瘦弱、生長緩慢等。這類兒童可能有頭大、間歇性嗜睡和視覺障礙等。另外,如出現眼視覺困難或行爲異常、斜頸、尿崩症、生長發育落後、脊柱側凸和長期背痛、頭痛持續時間長等需要警惕中樞神經系統腫瘤,尤其是 LGG 的診斷。
4.3.1.4.2 (2)神經纖維瘤病 1 型(neurofibromatosis type 1,NF1):
表現爲多樣性、系統性廣泛損害,可發生於身體任何部位,以多發神經纖維瘤,皮膚色素沉着爲特徵,多分佈於軀幹及四肢皮下,常出生時即有,隨年齡增長而增大,主要沿神經通路呈葡萄狀、叢狀、串珠狀分佈。存在以下兩項症狀即可診斷爲 NF1:①6 個牛奶咖啡斑(青春期後直徑≥1.5 cm,青春期前直徑≥0.5 cm);②任何類型的神經纖維瘤≥2 個或叢狀神經纖維瘤≥1 個;腋窩或腹股溝雀斑狀色素沉着;≥2 個 Lisch 結節(虹膜錯構瘤);蝶骨翼發育不良、缺如或長骨皮質薄、發育不良。患有 NF1 兒童發展爲 WHO I 級和 II 級星形細胞瘤的機率增加;在所有 NF1 患者中,多達 20%患者會發展爲視路膠質瘤(optic pathway glioma,OPG)。
4.3.1.4.3 (3)結節性硬化症:
易發生 LGG,尤其是室管膜下巨細胞星形細胞瘤。TSC1 或 TSC2 的突變會引起哺乳動物雷帕黴素(mTOR)途徑靶點的通路改變,導致增殖增加。室管膜下巨細胞星形細胞瘤通過抑制 mTOR 通路對靶向治療非常敏感。
4.3.2 (二)輔助檢查
4.3.2.1 1.影像學檢查:
影像學診斷要點見附表 2。
4.3.2.1.1 (1)頭顱 CT 和/或頭顱 MRI(平掃、增強):
是目前最主要檢查方法。這兩種成像方法可以相對清晰精確地顯示腦解剖結構特徵及腦腫瘤病變形態學特徵,如部位、大小、周邊水腫狀態、病變區域內組織均勻性、佔位效應、血腦屏障破壞程度及病變造成的其他合併徵象等。觀察:
①病竈的生長部位;
②病竈是否爲實性、囊性或囊實性;
③病竈是單發或多發;
④病竈是否存在鈣化、出血及血供情況;
⑤是否合併其他疾病或畸形。
臨牀擬診 OPG 的患兒首選頭顱 MRI,典型的病變爲視神經、視交叉、視束或下丘腦部位的病竈,T1 加權成像(T1WI)低信號,T2 加權成像(T2WI)呈高信號,均明顯強化。病變多呈多葉狀,偶可見囊變。MRI 彌散加權成像可以鑑別 OPG與下丘腦錯構瘤、髓鞘空泡化,尤其是合併 NF1 患兒。
4.3.2.1.2 (2)頭顱 MRS 分析顱內病竈的良惡性;
頭顱 DTI 分析顱內病竈與傳導束之間的聯繫;DSA 腦血管造影明確顱內病竈的供血動脈、引流靜脈和周邊血管的情況;
4.3.2.1.3 (3)應用神經外科導航系統
把患兒術前的影像學資料與患兒的具體位置通過高性能計算機緊密地聯接起來,準確顯示出患兒顱內病竈的三維空間位置及其鄰近重要神經血管結構;
4.3.2.1.4 (4)臨牀診斷懷疑腦膠質瘤擬行活檢時,可用 PET-CT確定病變代謝活性最高的區域。
4.3.2.2 2.實驗室檢查
(1)一般常規檢查:血常規、凝血常規、肝腎功能、尿常規、心電圖、正位胸片、血清電解質 Na+、K+、Cl-;
(2)內分泌指標檢測:TT3、TT4、FT3、FT4、ACTH、FSH、LH、皮質醇、睾酮、hGH,如果內分泌指標異常需排除腎上腺疾病;
(3)腦脊液檢查:在無禁忌情況下,腰穿送檢腦脊液,腦脊液常規、生化、癌細胞檢查,明確是否存在腦脊液播散轉移;
(4)眼科檢查:完善視力、視敏度、視野、眼底檢查、瞳孔測試、眼球運動等眼科檢查,評估視覺功能受損情況;
(5)腫瘤標記物 AFP、CEA、β-HCG;腦脊液腫瘤脫落細胞檢測;
(6)篩查患兒腫瘤相關性分子標記物(根據當地醫院具體情況可選擇)。
4.3.2.3 3.術前神經功能評估
根據腫瘤累及的腦功能區及患兒的配合程度儘量完善,包括:韋氏兒童智力測驗、西部失語症檢查(WAB)中文版、ABC 失語症檢查、蒙特利爾認知評估量表(MoCA)、抑鬱自評量表(SDS)、焦慮自評量表(SAS)、症狀自評量表(SDL90)。視力損傷者還應完善視力、視野、眼底檢查及視覺誘發電位等。術前合併癲癇發作者應至少完善 24 h 視頻腦電監測。
4.3.2.4 4.病理及分子病理學
標準的腦膠質瘤病理報告內容應包括:患者基本臨牀信息;腫瘤部位;免疫組織化學與分子病理學檢測結果;組織學類型、分級及分子病理學診斷和分級;特殊情況備註等。
根據 2016 年世界衛生組織的《2016 版 WHO 中樞神經系統腫瘤分類標準》,各膠質瘤具有不同的組織學特徵和分子表型特點。但兒童膠質瘤的分子特徵有別於成人,尤其是兒童 LGG 的分子異常與成年膠質瘤不同。例如,毛細胞和瀰漫性星形細胞瘤爲代表的 LGG 涉及 BRAF 激活和 ERK/MAPK 通路的基因組改變在毛細胞性星形細胞瘤的散發病例中非常常見。成人 LGG 表現出頻繁的 TP53 突變。5%~10%的兒童 LGG發生惡性轉化。
4.3.2.4.1 (1)兒童低級別膠質瘤(pediatric low-grade gliomas,PLGG)
PLGG是兒童最常見的腦腫瘤類型,約佔兒童各種顱內腫瘤的25%。最常見類型包括:毛細胞型星形細胞瘤(WHOⅠ級)、多形性黃色細胞型星形細胞瘤(WHOⅡ級)、瀰漫性星形細胞瘤(WHOⅡ級)、節細胞膠質瘤(WHOⅠ級)、胚胎細胞發育不良型神經上皮腫瘤(WHOⅠ級)、血管中心型膠質瘤(WHOⅠ級)及室管膜下巨細胞星形細胞瘤(WHO Ⅰ級)等。PLGG特徵性的基因改變,多累及MAPK信號通路,包括:BRAF基因融合突變或V600E點突變、FGFR1點突變、NF1突變、CDKN2A以及NTRK2突變等。而成人膠質瘤常出現的分子病理改變(如IDH、1p19q缺失,TP53、Tert表達異常等)也鮮見於PLGG。PLGG還有一個不同於成人的顯著臨牀特點,即很少向高級別膠質瘤轉化。
一種界限清楚,生長緩慢的星形細胞瘤,多見於兒童和年輕人,常呈囊性。分子病理學:BRAF V600E基因突變、KIAA1549-BRAF融合基因。毛黏液樣型星形細胞瘤:一種毛細胞樣腫瘤,與毛細胞型星形細胞瘤密切相關,具有明顯的黏液樣基質和以血管爲中心的形態單一的雙極性腫瘤細胞。分子病理學:KIAA1549-BRAF融合基因。
一種預後相對較好的星形細胞腫瘤,常發生於兒童和年輕人,好發於大腦半球的淺表部位,常侵及腦膜。典型的組織學特徵包括表達GFAP的多形性細胞和脂質化細胞,這些細胞常被網狀纖維和嗜酸性顆粒小體包繞。根據核分裂像,可將腫瘤分爲多形性黃色星形細胞瘤(WHO Ⅱ級,<5/10 HPF)和間變性多形性黃色星形細胞瘤(WHO Ⅲ級,≥5/10 HPF)。其中,間變性腫瘤可伴壞死。分子病理學:BRAF V600E基因突變。
瀰漫星形細胞瘤和少突膠質細胞瘤在兒童相對少見,特別是成人絕大多數具有的IDH突變,在兒童鮮見。
一種良性、生長緩慢的腫瘤,典型部位是側腦室壁,由大的節細胞樣星形細胞構成,與結節硬化症密切相關。分子病理學:TSC1、TSC2基因突變。
⑤血管中心型腦膠質瘤:
常見症狀是癲癇發作,是一種生長緩慢的腦膠質瘤,兒童和青年人多見。組織學特點爲血管中心性生長,單形性雙極瘤細胞和室管膜分化。分子病理學:MYB-QKI融合基因。
DNET是一種不常見的良性皮質內病變,常表現爲邊界清楚、楔形囊泡狀皮質內腫塊。大多位於幕上,最好發於顳葉,其次爲頂枕葉。組織學特點是腫瘤主要由少突膠質細胞樣細胞、神經元和星形細胞3種細胞成分混合組成。免疫組化特徵爲突觸囊泡蛋白、神經纖維細絲蛋白和S-100蛋白染色可見,標記陽性的神經元散在分佈於大量少突神經膠質樣細胞間。
⑦節細胞膠質瘤:
是一種含有神經膠質成分和神經元的混合性腫瘤,可能是一種錯構瘤,可發生於顱內的任何部位,但以顳葉最爲多見,是顱內腫瘤中最常見的導致癲癇的原因。腫瘤常爲小結節,邊界清楚但無包膜,質較硬,常有囊變和鈣化。大多數爲良性腫瘤,極少數惡性,病死率低,預後相對良好。好發於兒童。
4.3.2.4.2 (2)兒童高級別膠質瘤( pediatric high-gradegliomas,PHGG)
在兒童高級別膠質瘤中,先天性和嬰兒期膠質母細胞瘤有時在生物學行爲與兒童期和成年期不同,它們往往有更好的預後。先天性高級別膠質瘤通常在產前超聲檢查中發現,常表現爲位於大腦半球的佔位,可產生中線移位和腦積水。先天性和嬰兒高級別膠質瘤中常見 MET/ALK/ROS1/NTRK 改變。也可以攜帶 PTEN 缺失和TP53 的突變,但 EGFR 擴增、IDH 和組蛋白突變少見。這可能是這一類腫瘤有較好預後的原因。
②伴 H3K27M 突變的瀰漫中線膠質瘤:
2016 版 WHO 中樞神經系統腫瘤新分類將分子病理診斷與組織病理診斷相結合,將具有組蛋白 H3 突變的中線結構膠質瘤單獨作爲一個新的類型。此類腫瘤多位於中線部位(丘腦、腦幹及脊髓),好發於兒童和青少年,也可見於成人,其臨牀症狀及影像學檢查無明顯特異性,組織病理學分級爲 WHO Ⅱ級,但腫瘤進展迅速,中位生存期9~12個月,故其臨牀分級爲WHO Ⅳ級。
③瀰漫性橋腦膠質瘤(DIPG):
好發於 5~9 歲兒童,沒有明顯性別差異。因發病部位及浸潤性生長的特點,治療困難,預後極差。H3K27M 基因突變是小兒瀰漫內生性橋腦膠質瘤最常見的基因改變(約佔 80%),預示患者預後更差。
4.4 四、治療
4.4.1 (一)手術治療
4.4.1.1 1.手術的一般原則及目的:
腦膠質瘤手術的基本原則是最大範圍安全切除腫瘤。手術目的包括:明確病理性質及分子診斷;解除佔位效應或打通腦脊液循環通路以解除腦積水,緩解顱高壓症狀;解除或緩解因膠質瘤引發的症狀,如癲癇、眼震、面肌痙攣等;縮小腫瘤體積,減少腫瘤負荷,爲後續放療、化療及其他輔助治療提供條件。
4.4.1.2 2.手術的適應證和禁忌證:
4.4.1.2.1 (1)適應證:
影像學檢查提示顱內佔位;存在明顯的顱內高壓徵象;存在由於腫瘤佔位而引起的神經功能障礙;有明確癲癇發作史;患兒及家屬自願接受手術。
4.4.1.2.2 (2)禁忌證:
嚴重心、肺、肝、腎功能障礙,一般狀況差不能耐受手術者;其他不適合接受神經外科開顱手術的禁忌證。
4.4.1.2.3 (3)當存在以下情況之一時,可選擇病理活檢術:
③腫瘤位於視神經、視交叉、下丘腦、功能區皮質、白質深部或腦幹等部位,且無法滿意切除;
④難以明確是否爲腫瘤,需要鑑別病變性質。活檢方式可以爲立體定向或導航下活檢或開顱顯微鏡下活檢。
4.4.1.3 3.術前腦積水的處理原則
如果患兒入院時已合併嚴重的腦積水症狀,如頻繁的頭痛、嘔吐、甚至昏迷等腦疝症狀,頭顱 CT 或 MRI 提示嚴重的梗阻性腦積水,應在腫瘤切除術前處理腦積水。
手術方式包括腦室穿刺外引流術、腦室-腹腔內分流術(V-P 分流術)、Ommaya 囊置入手術及腦室鏡下三腦室底造口術。制定手術計劃時應考慮患兒終身帶管的風險,如術前考慮偏向於低級別腫瘤,應慎重選擇腦室腹腔分流術。
4.4.1.4 4.術前準備及手術計劃的制定
4.4.1.4.1 (1)術前準備:
若術前出現明顯的顱內高壓症狀,應及時給予脫水藥物緩解顱內高壓,甘露醇劑量通常爲靜脈注射 0.5~2 g/kg,需在 15 min 內迅速滴完。兒童患者體質量小,血容量低,術前應充分預估術中出血量,提前配血。應鼓勵家長指導患兒練習病牀上排尿便,減少術後尿瀦留及便祕機率。
4.4.1.4.2 (2)手術計劃的制定:
術前應完善頭顱 CT、增強 MRI等檢查,有條件者推薦完善術前導航定位及彌散張量成像(DTI)檢查,設計手術入路、判斷膠質瘤與相關神經纖維的解剖關係。囊性腫瘤應判斷囊壁與腫瘤的關係,個性化制定手術方案。
4.4.1.5 5.手術切除程度的判定
強烈推薦腦膠質瘤術後 24~72 h 內複查 MRI,高級別腦膠質瘤以 MRI 增強、低級別腦膠質瘤以 T2/FLAIR 的容積定量分析爲標準,並以此影像作爲判斷後續治療療效或腫瘤進展的基線。以此將切除程度按切除腫瘤體積分爲 4 個等級:即全切除、次全切除、部分切除、活檢,目前具體標準尚不統一。如難以完成 MRI 檢查,也應儘量在 24 h 內複查頭顱CT,初步判斷腫瘤的切除程度。
4.4.1.6 6.術後處理及併發症的防治
4.4.1.6.1 (1)術後處理:
術後應儘量轉入兒童神經重症監護病房進行監護;需根據顱內壓情況選擇是否使用脫水藥物進行降顱壓治療,並適當使用激素穩定患者神經功能狀態;若術後出現發熱,需及時進行腰椎穿刺採集腦脊液進行化驗,積極防治顱內感染;術後應常規監測電解質,積極糾正電解質紊亂;對幕上腦膠質瘤患者,術後應常規應用抗癲癇藥物預防癲癇發作。
4.4.1.6.2 (2)手術併發症:
①術後血腫:術後血腫是術後短期內最危險的併發症之一。其發生原因包括止血不仔細導致的術區出血和因顱內壓迅速下降導致的遠端出血,後者多以硬膜外出血爲主。隨着手術技術的不斷提高及止血材料的不斷升級,術後血腫的發生率已不足 1%。爲避免術後血腫的發生,應在顯微鏡下采取雙極電凝精確止血,止血紗布或海綿壓迫滲血的瘤牀區域,止血完畢後,應請麻醉醫生爲患兒憋氣 30~40 s 同時增加氣道壓力,以提高顱內靜脈壓,觀察有無新的滲血。手術結束後的 6~8 h 內,應及時複查頭 CT,若出現血腫應及時處理。
②顱內感染:顱內感染多表現爲術後高熱、頭痛、腦脊液白細胞明顯升高、糖減少、蛋白升高,外周血白細胞升高及核左移。顱內感染的治療除使用可透過血腦屏障的抗生素外,還應增加腰穿頻率,儘量多的釋放炎性腦脊液,同時行培養及藥敏試驗,必要時行腰大池外引流術。
③術後腦積水和硬膜下積液:位於導水管位置的腫瘤,若手術後導水管重新粘連,腦室內腫瘤術後炎症物質或術後出現顱內血腫及感染導致蛛網膜顆粒堵塞,腦脊液吸收障礙,均會造成術後腦積水。出現腦積水時應首先判斷是否存在顱內感染,非感染患者應及時接受腦室腹腔分流術,若存在顱內感染,應先行腦室穿刺外引流釋放炎性腦脊液,控制感染後,再行 V-P 分流術。
巨大腫瘤切除後及部分腦室內腫瘤切除後常出現硬膜下積液,低齡兒童患者尤爲常見。此時應首先判斷硬膜下積液是否對腦組織形成壓迫,若患兒一般狀態良好,無顱高壓表現,影像學檢查見腦組織鉤回明顯,可繼續動態觀察。若硬膜下積液對腦組織形成壓迫,影像學檢查見中線移位或患兒有顱高壓表現,應行硬膜下積液鑽孔引流術。應注意部分患兒出現硬膜下積液的原因是術後炎症物質或術後出血及感染導致蛛網膜顆粒堵塞,腦脊液吸收障礙,即“真積水,假積液”,此時應在控制感染的前提下,行腦室腹腔分流術,推薦使用可調壓分流泵。
除此之外,術後急性期還可能出現腦水腫、顱內積氣、無菌性腦膜炎等;累及丘腦、下丘腦的膠質瘤術後常會出現明顯的電解質及激素紊亂,尿崩等;腦幹佔位者術後可能出現顱神經麻痹、後組神經症狀;後顱窩腫瘤患者術後可能出現小腦緘默綜合徵等。
4.4.1.7 7.OPG 的手術治療
OPG 的手術指徵目前尚未統一。對於單側視神經損害致嚴重突眼和/或單側視力喪失,進展較快的外生性或含囊性成分的 OPG 可行手術或活檢。若散發 OPGs 患兒有腫瘤播散或出現間腦綜合徵,僅觀察意義不大,應考慮手術治療。手術一般可作爲疾病晚期的治療方式,特別是有顱內壓增高、伴有腦積水的患兒,需要手術切除部分腫瘤,打通腦脊液循環通路,緩解腦積水。手術切除範圍與腫瘤再進展時間無相關性,故腫瘤根治術弊大於利。近年來,隨着術中導航及彌散張量成像等技術的發展,術前行 DTI 重建視覺纖維,明確腫瘤與視覺通路的關係,術中輔以實時導航,指導手術實施,可最大限度的減輕手術對視覺纖維、下丘腦等重要結構的損傷,從而減少併發症的發生。
4.4.2 (二)放射治療
4.4.2.1 1.一般原則:
進行放射治療前需要放射腫瘤學專家對患者進行完整的評估,包括病史和體檢,特別是神經系統的症狀和體徵,並結合外科手術、病理報告和影像學診斷等內容。這些都決定了輻射技術和劑量的選擇。特別是病理診斷的明確至關重要,在一般情況下,至少需要通過活檢以最小的創傷獲得組織病理的診斷,從而使誤診的風險最小化。
4.4.2.2 2.放療的併發症:
在治療的早期主要爲急性(放療後 6周以內)和亞急性損傷(放療後 6 周至 6 個月),射線影響血管的通透性導致腫瘤周圍水腫,從而導致頭疼、噁心嘔吐等顱高壓症狀,因此在放療期間往往需要類固醇治療來降低輻射引起的水腫。除此之外,個別患者也會出現疲勞、脫髮、輻射性皮炎等症狀。這些症狀通常在放療後的 4~6 周內消退。在放射治療結束後的 12~16 周,部分少突膠質細胞可出現短暫的脫髓鞘改變,爲了和腫瘤復發鑑別,可以在放射治療後的 4~6 周給與少量的類固醇藥物,並且行代謝影像檢查(SPTCT、PET、MSR)對治療效果進行評價。
放療的遠期(放療後 6 個月以上)併發症包括中樞神經系統實質壞死、瀰漫性腦白質病、認知功能障礙、發育障礙、生育問題等。中樞神經系統實質壞死是從組織水腫到破壞再到局竈性缺損的症狀,其發生率高達 5%~10%,其確切的發生機制仍不清楚,可能是血管、神經膠質、神經炎性反應之間相互作用的結果。只能通過類固醇、高壓氧和外科減壓進行對症治療,另外應用貝伐單抗也是一個可行的選擇。
由於兒童對放療的耐受更差,特別是高劑量的放療對患兒的生長發育造成嚴重的影響。24 Gy 以上照射可使智商下降,3 歲以下小兒放療後的智能損傷會影響未來生存質量;丘腦下部-垂體總劑量 25~50 Gy,即可發生發育障礙,乳汁異常分泌等垂體功能不全,一般在放療後 2~9 年發病。對生長發育期兒童椎體照射量達 20 Gy 以上時,可出現明顯的椎體發育障礙,由此而造成受照射椎體的形狀、大小的異常。
如患兒接受全脊柱照射,日後即可出現上身短下身長的體型及由此而發生的胸廓畸形,甚至引起身高低於正常標準。同理如作一側脊柱照射,可造成脊柱側彎畸形,尤其放療頸部時,更易造成歪頸。在作脊柱照射及胸腹部腫瘤放療包括脊柱時,脊髓通常不同程度地受到照射,如超劑量照射可能出現一過性放射性脊髓病,其典型臨牀表現爲低頭時向足跟部放射的麻木感。該症狀可自愈,也可能繼之出現肢體麻木無力、運動障礙,即爲慢性放射性脊髓病的臨牀表現。因此,兒童放療時注意限制總劑量,增加分割次數,儘量不合並化療或儘量限制化療藥物的劑量,儘可能減少放療的損傷。
4.4.2.3 3.高級別膠質瘤的放療:
高級別膠質瘤生存時間與放療開始時間密切相關,術後早期放療能有效延長高級別膠質瘤患者的生存期,強烈推薦術後儘早(手術後 2~6 周)開始放療。常規認爲可以開始放療的年齡爲 3 歲,但對於高級別膠質瘤患兒,應適當放寬年齡限制。推薦採用三維適形(3D-CRT)或適形調強技術(IMRT),常規分次,適形放療技術可提高靶區劑量的覆蓋率、適形度及對正常組織保護,縮小不必要的照射體積,降低晚期併發症發生率,放療前圖像驗證(CBCT 或 EPID)是放療質控不可缺少的環節。推薦放射治療照射總劑量爲 54~60 Gy,1.8~2.0 Gy/次,分割30~33 次,1 次/d,腫瘤體積較大和(或)位於重要功能區及 WHO Ⅲ級間變性膠質瘤,可適當降低照射總劑量。儘管3D-CRT 或 IMRT 具有提高靶區適形度、減少正常組織受量,最大限度地縮小照射體積,能夠給予靶區更高的放療劑量,但提高劑量後的療效尚未得到證實,盲目提高照射總劑量或提高分次量,應十分慎重。對於膠質母細胞瘤,推薦放療聯合替莫唑胺(TMZ)聯合應用。
4.4.2.4 4.低級別膠質瘤的放療:
過去認爲腫瘤切除手術之後應儘早放療,但近期研究表明較早的放療對患者的總生存率無明顯影響,而接受放療時間越早,對患兒認知、生長發育及生育能力的影響越大。有研究表明接受放療後的患者較未接受放療的患者,其注意力、執行能力和獲取信息的能力明顯變差。因此目前對於低級別膠質瘤患者來說,放療主要是應用於不能手術切除(或不能二次手術切除)腫瘤及化療後腫瘤快速進展的患者。推薦低級別膠質瘤放療的總劑量爲 45~54 Gy,但這個劑量是否適合 IDH 野生型低級別膠質瘤患者還未知,推薦分次劑量 1.8~2.0 Gy,分次劑量超過 2 Gy 會增加發生遠期認知障礙的風險。放療聯合 PCV 化療的收益要明顯高於單純放療。
OPG 對放療較敏感,一般劑量爲 45~55 Gy,每日劑量爲 1.8 Gy。但兒童放療副作用大,可引起神經發育遲緩,垂體功能受損及遲發的血管效應等。故目前一般原則爲儘量延緩放療的應用,並儘量應用精確的放療技術如立體定向多分割放療,質子治療等等。但對於腫瘤進展或視力惡化的 OPG患兒來說,放療是最有效的治療方式,年齡較大的 OPG 患兒,療效及預後較幼兒好。
4.4.3 (三)藥物治療
目前國內沒有兒童腦膠質瘤的診療建議。本規範重點參考國際較大兒童腫瘤研究組,例如 COG 方案,提供的以下治療方案各醫院根據各自情況選擇應用,部分病人可結合所在醫院實際情況適當改良。
4.4.3.1 1.基本原則:
外科手術仍然是治療 PLGG 的主要方法。切除術是延長無進展和總生存期的重要因素預。因此,PLGG根據手術切除程度可分爲三大類:(1)腫瘤已完全切除;(2)腫瘤次全切除;(3)僅行活檢或無手術途徑。後者值得特別注意,通常累及幕上深中線區、視路/下丘腦和腦幹腫瘤。
腫瘤切除程度影響化療效果。推薦化療應在最大範圍安全切除腫瘤的基礎上進行。術後應儘早開始化療。在保證安全的基礎上,採用最大耐受劑量的化療以及合理的化療療程,應注意藥物毒性。根據組織病理和分子病理結果,選擇合適的化療方案。某些抗腫瘤藥物和抗癲癇藥物會產生相互影響,同時使用時應酌情選擇或調整化療藥物或抗癲癇藥物。另外,根據分子病理學檢查結果,患者可積極參與有效可行的藥物臨牀試驗。
4.4.3.2 2.PLGG 的化療
目前對於 LGG 的化療還存在一定爭議,主要包括:化療的時機、化療方案的選擇、化療與放療次序的安排等。考慮患者的年齡因素以及放射治療的長期副作用,推薦術後化療。化療可致腫瘤縮小。化療也是兒童 OPG 延遲或避免放射治療的一種選擇。另外,化療可縮小患兒下丘腦膠質瘤和間腦綜合徵,對治療有反應的患者體質量增加。因此,尤其對於小於 3 歲的兒童,化療幾乎成爲 OPG 患兒的一線治療方案。PLGG 化療方案可以選擇:
4.4.3.2.1 (1)單用卡鉑方案:
依據美國霍普金斯兒童中心-低級別膠質瘤方案,給予卡鉑 560 mg/m2,總治療時間爲 1 年。
4.4.3.2.2 (2)長春新鹼+卡鉑(VC 方案):
長春新鹼 1.5 mg/m2,卡鉑 560 mg/m2。依據美國兒童腫瘤研究組-低級別膠質瘤(COG-A9952)治療,總療程建議 1 年;依據歐洲 SIOP 方案,總療程建議 18 個月。
4.4.3.2.3 (3)化療中注意事項
①每一療程化療前血常規和血生化,卡鉑前後聽力檢查。每療程要求:中性粒細胞>1×109/L,血小板>100×109/L。不夠上藥標準,可延遲 1 周。
②體質量>10 kg,用體表面積計算,≤10 kg 用體質量計算。嬰兒體質量<5 kg,給與 50%總量。
③建議化療期間和化療後 2 個月內口服複方新諾明以預防卡氏肺囊蟲肺炎,劑量 25 mg/kg,分兩次口服,每週 3 天。
④敗血症、肺炎或其他嚴重感染,體溫正常、生命體徵平穩 7 天恢復化療。有感染存在(4 級),可減少骨髓抑制明顯的藥物 20%。
⑤延遲化療超過 2 周的患者,或伴有中性粒細胞減少症,或血小板計數低於 20×109/L 的患者,下一次卡鉑劑量減少50%。出現長春新鹼相關神經毒性者,應中止用藥直至症狀改善,且下一次長春新鹼劑量減少 50%。腎臟毒性需要複查GFR,可考慮卡鉑減量。
4.4.3.3 3.高級別膠質瘤
主要包括多形性膠質母細胞瘤(WHO Ⅳ級)和間變性星形細胞瘤(WHO Ⅲ級)。在兒科,瀰漫內生型橋腦膠質瘤(DIPG)也包括其中。
最大限度的安全手術切除是兒童高級別膠質瘤治療的基石。輔助細胞毒化療聯合放射治療高級別膠質瘤的療效尚不清楚。兒童高級別膠質瘤的化療目前沒有標準方案。積極參與有效可行的藥物臨牀試驗。可以嘗試的化療方案:
4.4.3.3.1 (1)替莫唑胺+洛莫司汀方案:
在放射治療期間,替莫唑胺 90mg/m2,口服,共 42 天。放療結束 4 周後開始維持治療:洛莫司汀 90 mg/m2,第 1 天,替莫唑胺 160 mg/(m2·d)×5 d,每 42 天 1 個療程,共 6 個週期。
4.4.3.3.2 (2)PEV+PEI 方案:
放療同步化療:PEV:順鉑 20 mg/m2,第 1~5 天,依託泊苷 100 mg/m2,第 1~3 天,長春新鹼 1.5 mg/m2,第 5 天。放療最後一週 PEI:順鉑、依託泊苷(同上),異環磷酰胺 1.5 g/m2,第 1~5天。治療第 10 周起,PEI 維持 6 療程,間隔 4 周。
4.4.3.3.3 (3)PCV方案:
甲基苄肼(PCB)60 mg/(m2·d),第 8~21 天,洛莫司汀(CCNU)110 mg/(m2·d),第 1 天,長春新鹼(VCR)1.5mg/m2,第 8、29 天,8 周爲一週期。
4.4.3.4 4.DIPG 的治療原則
儘管現在對腦幹結構的解剖認識不斷加深,以及神經導航和術中監測技術的不斷進步,但手術切除該類腫瘤仍存在高風險,且由於腫瘤的瀰漫、浸潤性生長導致做不到完整切除,因此手術切除腫瘤不做常規推薦。推薦腫瘤組織活檢手術,活檢的目的是明確病理診斷,依據分子病理指導綜合治療。
目前尚無成熟的放療和化療方案。聯合放療能夠使部分腫瘤的客觀反應率提高,可以參考高級別膠質瘤的放療方案,可根據患者具體情況適當調整放療劑量。化療可以選擇使用TMZ,或推薦合適的患者參加臨牀試驗。
兒童 HGG 和 DIPG 的不同亞組已經根據基因突變的模式和表觀遺傳學特徵進行了區分,這些生物學改變和臨牀特徵有關,也爲進一步靶向藥物的選擇提供依據。
4.4.4 (五)康復治療
康復治療雖然不是兒童腦膠質瘤的核心治療,但科學的康復治療可有效改善患兒的生活質量,促進患兒恢復,更好地接受其他治療,故康復治療應儘早進行,並採用個體化的綜合治療方案。
4.4.4.1 1.物理治療:
術後早期即可由護理人員或家長進行,以運動療法爲主,包括正確體位的擺放、加強翻身、關節活動度練習、肌肉按摩和刺激、肌力訓練、耐力訓練、神經肌肉促進技術訓練、平衡及協調性訓練、步態訓練和呼吸訓練等。
4.4.4.2 2.作業治療:
主要指通過訓練與日常生活、學習、工作有關的各種作業活動,最終以提高患兒在生活自理、工作及休閒活動上的獨立能力爲目的的治療方法。對於兒童患者,主要包括:積極參與各項遊戲、鼓勵參與社交、早期迴歸校園等。
4.4.4.3 3.言語及吞嚥治療:
言語障礙包括失語症及構音障礙,需要根據患兒言語康復評定的結果分別採用促進言語功能恢復的訓練和非言語交流方式的使用訓練,前者包括語音訓練、聽理解訓練、口語表達訓練等,後者包括手勢語、畫圖、交流板、交流手冊及電腦交流裝置使用訓練。吞嚥障礙治療主要包括早期胃管的置入、促進吞嚥功能恢復的康復訓練、逐步恢復飲食性狀、調整進食體位等。
4.4.4.4 4.認知和行爲治療:
認知障礙主要表現爲注意力、記憶力、執行功能、定向力、結構和視空間功能障礙等。認知康復主要包括增強對認知缺損認識和理解的教育、減少認知缺損所造成影響的適應性治療及針對認知缺損的修復性治療,其中適應性和修復性治療時應以患者特定生活方式和工作需要爲導向。規範的認知康復有助於認知功能的改善。
4.4.4.5 5.心理治療:
心理疏導應貫穿於兒童腦膠質瘤治療的全部過程。良好的心理治療有助於消除患兒的恐懼、焦慮及抑鬱。同時也應兼顧對患者兒的家屬、護工的心理支持和教育。
4.4.4.6 6.祖國傳統醫學治療:
祖國傳統醫療的鍼灸、推拿、藥浴和拳操也可選擇用於腦膠質瘤患兒的康復,有助於提高患兒免疫力、促進患兒功能恢復、減輕疼痛及放療、化療的不適反應。
4.5 五、療效評估標準
4.5.1 (一)治療中檢查和隨訪
包括局部和受侵犯部位影像學檢查、眼科檢查、體格檢查、內分泌和免疫功能。內分泌監測:合併內分泌疾病者,內分泌專業隨訪,定期監測激素水平、生長發育。神經心理專業定期隨訪,監測神經認知功能、智力等放療後遺症。治療期間間隔 3 月評估 1 次。
4.5.2 (二)隨訪時間
LGG患者:5年內每3~6個月複查頭顱MRI平掃及增強;>5 年每 12 個月複查頭顱 MRI 平掃及增強。
有症狀的 NF1 相關 OPG 患兒:眼科評估第一年每 3 個月1 次、第二年起每 6 個月 1 次直至 8 歲,之後每 2 年 1 次直至 18 歲。無症狀的 NF1 相關 OPG 患兒:眼科評估每年 1 次直至 8 歲,之後每 2 年 1 次,直至 18 歲。
HGG 患者:末次放療 2~6 周後複查頭顱及全脊髓 MRI 平掃及增強;3 年內:每 2~4 個月複查頭顱 MRI 平掃及增強;大於 3 年:每 6 個月複查頭顱 MRI 平掃及增強。
4.5.3 (三)影像學評價標準
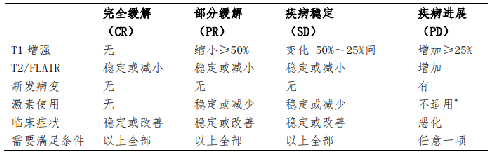
4.5.3.1 1.完全緩解(CR):
CT 或 MRI 顯示病竈消失;
4.5.3.2 2.部分緩解(PR):
病竈範圍減小≥50%,無新病竈;
4.5.3.3 3.輕微反應(MR):
病竈範圍減小<50%,但≥25%;無新病竈;
4.5.3.4 4.穩定(SD):
病竈範圍增加或縮小<25%;無新病竈;
4.5.3.5 5.進展(PD):
有以下任意一條:病竈範圍增加≥25%;出現新病竈;進行性視覺喪失;視乳頭水腫;視神經直徑增加≥2 mm;腫瘤累及視神經的分佈增加。
腦膠質瘤術後 24~72 h 內需複查 MRI(平掃+增強),評估腫瘤切除程度,並以此作爲腦膠質瘤術後基線影像學資料,用於後續比對。膠質瘤治療效果的影像學評價也可參見RANO 標準(附表 3)。
4.6 六、轉診條件及原則
(一)當地醫院沒有規範的病理診斷水平,沒有放療、化療及其合併症診療條件的、沒有治療經驗的、高危、重症以及難治復發的建議轉診至有診療條件及治療基礎的小兒神經外科進一步診治。
(二)經上級醫院治療後穩定、達到完全緩解的患者可轉診至有治療條件的下一級醫院繼續治療,例如康復治療的患者。期間建議定期回上級醫院進行復查。如康復期間發生嚴重合並症,如腦積水、感染、腫瘤復發,轉回上級醫院進行搶救。
5 附表
5.1 表1 2016版 WHO 中樞神經系統腫瘤分類標準
| 腫瘤分類 | WHO 分級 | ICD-O 編碼 |
| 瀰漫性星形細胞和少突膠質細胞腫瘤 | ||
| 瀰漫性星形細胞瘤,IDH 突變型 | Ⅱ | 9400/3 |
| 肥胖細胞型星形細胞瘤,IDH 突變型 | 9411/3 | |
| 瀰漫性星形細胞瘤,IDH 野生型 | Ⅱ | 9400/3 |
| 瀰漫性星形細胞瘤,NOS | Ⅱ | 9400/3 |
| 間變性星形細胞瘤,IDH 突變型 | Ⅲ | 9401/3 |
| 間變性星形細胞瘤,IDH 野生型 | Ⅲ | 9401/3 |
| 間變性星形細胞瘤,NOS | Ⅲ | 9401/3 |
| 膠質母細胞瘤,IDH 野生型 | Ⅳ | 9440/3 |
| 巨細胞型膠質母細胞瘤 | 9441/3 | |
| 膠質肉瘤 | 9442/3 | |
| 上皮樣膠質母細胞瘤 | 9440/3 | |
| 膠質母細胞瘤,IDH 突變型 | Ⅳ | 9445/3 |
| 膠質母細胞瘤,NOS | Ⅳ | 9440/3 |
| 瀰漫性中線膠質瘤,H3 K27M 突變型 | Ⅳ | 9385/3 |
| 少突膠質細胞瘤,IDH 突變和 1p/19q 聯合缺失型 | Ⅱ | 9450/3 |
| 少突膠質細胞瘤,NOS | Ⅱ | 9450/3 |
| 間變性少突膠質細胞瘤,IDH 突變和 1p/19q 聯合缺失型 | Ⅲ | 9451/3 |
| 間變性少突膠質細胞瘤,NOS | Ⅲ | 9451/3 |
| 少突星形細胞瘤,NOS | Ⅱ | 9382/3 |
| 間變性少突星形細胞瘤,NOS | Ⅲ | 9382/3 |
| 其他星形細胞腫瘤 | ||
| 毛細胞型星形細胞瘤 | Ⅰ | 9421/1 |
| 毛黏液樣型星形細胞瘤 | 9425/3 | |
| 室管膜下巨細胞型星形細胞瘤 | Ⅰ | 9384/1 |
| 多形性黃色星形細胞瘤 | Ⅱ | 9424/3 |
| 間變性多形性黃色星形細胞瘤 | Ⅲ | 9424/3 |
| 室管膜腫瘤 | ||
| 室管膜下瘤 | Ⅰ | 9383/1 |
| 黏液乳頭型室管膜瘤 | Ⅰ | 9394/1 |
| 室管膜瘤 | Ⅱ | 9391/3 |
| 乳頭型室管膜瘤 | 9393/3 | |
| 透明細胞型室管膜瘤 | 9391/3 | |
| 伸長細胞型室管膜瘤 | 9391/3 | |
| 室管膜瘤,RELA 融合基因陽性 | Ⅱ/Ⅲ | 9396/3 |
| 間變性室管膜瘤 | Ⅲ | 9392/3 |
| 其他腦膠質瘤 | ||
| 第三腦室脊索樣型腦膠質瘤 | Ⅱ | 9444/1 |
| 血管中心型腦膠質瘤 | Ⅰ | 9431/1 |
| 星形母細胞瘤 | 9430/3 | |
表2 腦膠質瘤影像學診斷要點
| 腫瘤類型 | 影像學特徵性表現 | |
| 低級別腦膠質瘤 | 主要指瀰漫性星形膠質細胞瘤、少突膠質細胞瘤、少突星形膠質細胞瘤 3 種。特殊類型還包括:多形性黃色星形細胞瘤(PXA)、第三腦室脊索瘤樣腦膠質瘤和毛細胞型星形細胞瘤等 | 瀰漫性星形膠質細胞瘤 MRI 信號相對均勻,長 T1,長 T2 和 FLAIR 高信號,多無強化;少突膠質細胞瘤表現同瀰漫性星形腦膠質瘤,常伴鈣化。PXA 多見於顳葉,位置表淺,有囊變及壁結節。增強掃描,壁結節及鄰近腦膜有強化。第三腦室脊索瘤樣腦膠質瘤位於第三腦室內。毛細胞型星形細胞瘤以實性爲主,常見於鞍上和小腦半球。 |
| 變性腦膠質瘤(Ⅲ級) | 主要包括間變性星形細胞瘤、間變性少突膠質細胞瘤。 | 當 MRI/CT 表現似星形細胞瘤或少突膠質細胞瘤伴強化時,提示間變腦膠質瘤可能性大。 |
| Ⅳ級腦膠質瘤 | 膠質母細胞瘤;瀰漫性中線膠質瘤 | 膠質母細胞瘤特徵爲不規則形周邊強化和中央大量壞死,強化外可見水腫。瀰漫中線膠質瘤常發生於丘腦、腦幹等中線結構,MRI 表現爲長 T1 長 T2 信號,增強掃描可有不同程度的強化。 |
| 室管膜腫瘤 | 主要指Ⅱ級和Ⅲ級室管膜腫瘤。特殊類型:黏液乳頭型室管膜瘤爲Ⅰ級。 | 室管膜腫瘤邊界清楚,多位於腦室內,信號混雜,出血、壞死、囊變和鈣化可並存,瘤體強化常明顯。黏液乳頭型室管膜瘤好發於脊髓圓錐和馬尾。 |
表3 腦膠質瘤治療效果評估 RANO 標準