2 基本信息
《兒童自身免疫性溶血性貧血診療規範(2021年版)》由國家衛生健康委辦公廳於2021年4月29日《國家衛生健康委辦公廳關於印發兒童血液病、惡性腫瘤相關12個病種診療規範(2021年版)的通知》(國衛辦醫函〔2021〕249號)印發,通知要求各省、自治區、直轄市及新疆生產建設兵團衛生健康委結合臨牀診療實際參照執行。
3 發佈通知
國家衛生健康委辦公廳關於印發兒童血液病、惡性腫瘤相關12個病種診療規範(2021年版)的通知
國衛辦醫函〔2021〕249號
各省、自治區、直轄市及新疆生產建設兵團衛生健康委:
爲進一步提高兒童血液病、惡性腫瘤診療規範化水平,保障醫療質量與安全,按照《關於進一步擴大兒童血液病惡性腫瘤救治管理病種範圍的通知》(國衛辦醫函〔2021〕107號)要求,我委組織國家兒童醫學中心(北京兒童醫院)開展了兒童血液病、惡性腫瘤相關12個病種的診療規範制修訂工作,形成了相關病種診療規範(2021年版)。現印發給你們(可在國家衛生健康委網站醫政醫管欄目下載),請結合臨牀診療實際參照執行。
附件:
5-1.兒童中樞神經系統生殖細胞腫瘤診療規範(2021年版)
國家衛生健康委辦公廳
2021年4月29日
4 全文
4.1 一、概述
自身免疫性溶血性貧血(autoimmune hemolytic anemia,AIHA)是由於機體免疫功能紊亂,產生紅細胞自身抗體,通過抗體或補體途徑介導紅細胞破壞增多,超過骨髓紅系代償增生能力所致的一組溶血性貧血的統稱。AIHA 於整個兒童期均可發病,發病率無明顯種族差異。國外資料顯示兒童 AIHA年發病率估計爲(0.81~2)/10 萬。爲規範我國兒童 AIHA診治,經國家衛生健康委員會兒童血液病專家委員會專家討論,制定本診療規範。
4.2 二、AIHA 病因與分型
4.2.1 (一)病因與分型
4.2.1.1 1.依據病因分爲原發性和繼發性 AIHA 兩類。
(1)原發性 AIHA:也稱爲特發性 AIHA,這類 AIHA 患兒無明確可引起溶血的基礎疾病。原發性 AIHA 佔兒童 AIHA病例的 40%~50%,大多由溫抗體型自身抗體導致。
(2)繼發性 AIHA:這類 AIHA 患兒有可引起溶血的基礎疾病。兒童 AIHA 病例系列研究顯示:超過 50%具有免疫性疾病,約 10%繼發於感染。所有 AIHA 患兒都需要考慮存在潛在全身性疾病的可能;尤其青少年和 2 歲以下兒童,以繼發性AIHA 更爲多見,病程更爲緩慢。較常見繼發原因如下:
① 自身免疫性疾病:全身性自身免疫性疾病是 AIHA常見的繼發性病因,尤其是大齡兒童,與 AIHA 相關的自身免疫性或炎症性疾病包括系統性紅斑狼瘡(SLE)、乾燥綜合徵、硬皮病、幼年特發性關節炎、皮肌炎、白癜風、潰瘍性結腸炎、自身免疫性肝炎、糖尿病和自身免疫性甲狀腺炎等。異基因造血幹細胞移植後自身免疫排斥也可導致 AIHA 發生。
②免疫缺陷:原發性免疫缺陷病(Primary immunodeficiency, PID)可因免疫功能紊亂而引起繼發性AIHA,AIHA 甚至可以是 PID 確診前的初始表現,特別是普通變異型免疫缺陷病(common variable immunodeficiency,CVID)和溼疹血小板減少伴免疫缺陷綜合徵(Wiskott-Aldrich syndrome,WAS)。自身免疫性淋巴細胞增生綜合徵(autoimmune lymphoproliferative syndrome,ALPS)由於遺傳性淋巴細胞凋亡缺陷造成免疫失調被歸爲PID,可因自身反應性淋巴細胞的擴增和增殖引起 AIHA。獲得性免疫缺陷症,如 HIV 感染,可由於多克隆 B 淋巴細胞激活和 T 淋巴細胞免疫調節功能障礙,引起繼發性 AIHA。
③惡性腫瘤:AIHA 也可繼發於多種惡性腫瘤,甚至發生在惡性腫瘤診斷前。常見腫瘤類型包括霍奇金淋巴瘤、急性白血病、骨髓增生異常綜合徵等。
④感染:是 AIHA 的另一重要原因,常見感染源包括肺炎支原體、EB 病毒、麻疹病毒、水痘病毒、腺病毒、腮腺炎病毒和風疹病毒。此類 AIHA 的自身抗體多爲與紅細胞 I/i多糖抗原特異性結合的 IgM 型自身抗體,臨牀多表現爲冷凝集素病(cold agglutinin disease, CAD)。而多數陣發性冷性血紅蛋白尿(paroxysmal cold hemoglobinuria, PCH)患兒,發病前多有病毒感染表現,但具體病原體一般不能明確。
⑤藥物:藥物可引起紅細胞自身抗體的產生,但需要藥物形成半抗原或需要藥物與紅細胞形成抗原抗體複合物。引起兒童 AIHA 的常見藥物有青黴素類、頭孢菌素類、四環素、紅黴素、丙磺舒、對乙酰氨基酚和布洛芬等。
⑥Evans 綜合徵:當患兒同時存在 AIHA 和免疫性血小板減少症(immune thrombocytopenia,ITP)時,則被稱爲 Evans綜合徵,某些 Evans 綜合徵可伴有自身免疫性中性粒細胞減少。部分患者最初表現爲孤立性 AIHA,在數月甚至數年後再出現其他免疫性血細胞減少;另一些患兒最初發生 ITP,隨後發生 AIHA。Evans 綜合徵佔兒科 AIHA 病例的 15%~30%。與孤立性 AIHA 相比,Evans 綜合徵患兒的 AIHA 多爲繼發性,治療更難,臨牀病程往往呈現慢性複發性。
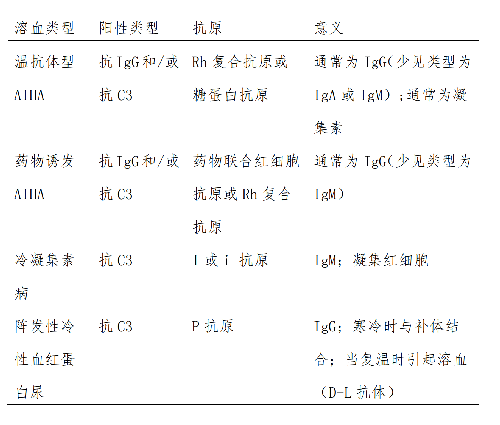
4.2.1.2 2.依據自身抗體與紅細胞結合所需的最適溫度將 AIHA分爲溫抗體型、冷抗體型 AIHA(包括 CAD 及 PCH)。
(1)溫抗體型 AIHA:是兒童原發性 AIHA 的最常見類型,佔 60%~90%,抗體類型常爲 IgG 型。這些抗體在 37 ℃條件下優先結合紅細胞,導致血管外溶血(主要發生於脾臟),繼而引起貧血、黃疸,偶爾引起脾腫大。這類與紅細胞的最適反應溫度爲 35~40 ℃的自身抗體稱爲溫抗體。某些情況下,IgG 型自身抗體數量和密度足以固定補體,從而同時引起血管內溶血。
(2)冷凝集素病(CAD):兒童 CAD 相對少見,約佔 10%,最常發生在肺炎支原體或 EB 病毒感染後。CAD 相關 IgM 自身抗體在低溫條件下(0~4 ℃)與紅細胞 I/i 抗原結合並固定補體,進而介導血管內溶血。這類與紅細胞的最適反應溫度在 30 ℃以下特別是 4 ℃的自身抗體稱冷抗體。此類抗體亦可通過肝臟巨噬細胞介導紅細胞免疫性破壞和清除,引起血管外溶血性貧血。
(3)陣發性冷性血紅蛋白尿症(PCH):是一種幾乎僅發生於兒童的 AIHA,最常發生在病毒感染後。PCH 的特徵爲IgG 自身抗體在低溫下更容易結合、有效固定補體,復溫時引起血管內溶血。
4.2.1.3 3.抗體類型與原發性和繼發性 AIHA 的關係。
(1)溫抗體型 AIHA:分爲原發性(特發性)和繼發性AIHA。繼發性因素包括:自身免疫或炎症性疾病(例如 SLE、Sjogren 綜合徵、硬皮病、幼年型特發性關節炎、皮肌炎、白癜風、潰瘍性結腸炎、自身免疫性肝炎、糖尿病、自免性甲狀腺炎);Evans 綜合徵;PID(例如 CVID、WAS);獲得性免疫缺陷病(例如 HIV 感染);惡性病(例如急性白血病、淋巴瘤);感染和移植後狀態。
(2)CAD:包括原發性(特發性)和繼發性 CAD。繼發性因素包括:感染(例如支原體肺炎、EB 病毒感染);惡性病(例如淋巴瘤);自身免疫性疾病;造血幹細胞移植後。
(3)PCH:包括原發性(特發性)和繼發性 PCH,繼發性多發生於病毒感染後。
4.3 三、臨牀表現
AIHA 的症狀和體徵與其他類型溶血性貧血相同。症狀嚴重程度取決於溶血嚴重程度和發生速率。輕症者可無症狀(僅化驗顯示輕度貧血),嚴重者可存在重度~極重度貧血,甚至危及生命。
4.3.1 (一) 症狀
大多數 AIHA 患兒有貧血相關的症狀和體徵,如無力、乏力、呼吸急促、頭暈、蒼白和/或溶血相關症狀和體徵,如黃疸、茶色尿、醬油色尿等。其他非特異性症狀包括腹痛或發熱。CAD 患兒最常見的表現可有寒冷後紅細胞凝集相關症狀如肢端發紺(即指尖、腳趾等肢端最遠端和耳鼻皮膚變爲深紫色到灰白色);溫暖時症狀消失。排出葡萄酒色、可樂色和黑色血紅蛋白尿常提示有冷抗體型 AIHA 導致的血管內溶血,如 CAD 或 PCH。如果貧血緩慢發生,則心血管系統可以良好代償;而急速發生極重度貧血時則會導致氧供不足的心血管失代償表現。
4.3.2 (二) 病史
須詢問是否有類似發作史、近期急性感染史、服藥史和是否有免疫性疾病病史和/或家族史。
4.3.3 (三) 查體
可能發現蒼白和黃疸,結膜和手掌尤爲明顯。患者常有心動過速和收縮期血流雜音;如急性嚴重 AIHA 發作,可出現心力衰竭。查體可觸及腫大的肝臟和脾臟。
4.4 四、實驗室檢查
4.4.1 (一)初始實驗室檢查
全血細胞計數(complete blood count, CBC)、紅細胞指數、網織紅細胞計數、外周血塗片、直接抗人球蛋白試驗(Direct antiglobulin test,DAT,直接 Coombs 試驗)、尿液分析(試紙尿幹化學檢測法和顯微鏡下觀察)、血尿素氮(blood urea nitrogen, BUN)和肌酐、間接膽紅素、乳酸脫氫酶(lactate dehydrogenase, LDH)、天冬氨酸轉氨酶(AST)。如果有血紅蛋白尿、肺炎支原體感染、寒冷暴露下肢端發紺等,還應測定冷凝集素滴度。疑診新生兒溶血病或血型不合溶血性貧血時可加查間接抗球蛋白試驗。
4.4.1.1 1.全血細胞計數:
貧血常爲重度,伴有網織紅細胞百分比和絕對數升高。白細胞計數和血小板計數通常正常或升高。
球形紅細胞;而存在冷凝集素時,紅細胞可能聚集成小團塊通過自動計數儀器,導致 MCV 假性增大;當網織紅細胞從骨髓中釋放以代償加速的紅細胞破壞時,常可觀察到紅細胞的嗜多染性以及 Howell-Jolly 小體和有核紅細胞。
4.4.1.2 2.直接抗球蛋白試驗(DAT):
是 AIHA 的確診試驗,能識別紅細胞表面的抗體和/或補體類型,以半定量形式評分。DAT 結果的陽性強弱一般與溶血嚴重程度相關。常規 DAT 試驗檢測 IgG 型、IgM 型和/或 C3d 型抗體。少於 5%的患兒儘管有臨牀溫抗體型 AIHA 證據,由於紅細胞表面 IgG 的量低於標準 DAT 能檢測到的閾值而使結果呈陰性。罕見情況下,患兒也可能因僅存在 IgA 型自身抗體,甚至僅存在溫反應性IgM 自身抗體,從而導致常規 DAT 呈現假陰性。此時需採用特定的研究試劑和技術,如微柱凝膠卡或流式細胞儀以助鑑別。對於冷凝集素介導性 AIHA,DAT 結果通常爲抗 C3d 陽性,抗 IgG 陰性。發生這種情況時,應檢查患兒血清是否有冷反應性 Donath-Landsteiner 抗體(D-L 抗體)存在。D-L 抗體是 IgG 型冷熱溶血素,在 0~4 ℃時與紅細胞結合,並吸附補體,但並不溶血;在復溫至 30~37 ℃時誘發溶血(表 1)。
4.4.1.3 3.間接抗球蛋白試驗(IAT):
DAT 的目的是檢查紅細胞表面的不完全抗體,而 IAT 試驗的目的是檢查血清中是否存在遊離抗體。通常用於檢測疑診新生兒溶血病患者母體抗體以及因紅細胞不相容的輸血而產生的血型抗體。
4.4.1.4 4.冷凝集素滴度:
血清冷凝集素滴度是指寒冷暴露下(0~4 ℃)仍可看見紅細胞凝集的血清樣本最大稀釋度。幾乎所有正常人都有低滴度的冷凝集素(<1:40),但感染後的冷凝集素病時,該滴度通常高於 1:256;而淋巴瘤相關性冷凝集素病時,滴度更高,通常高於 1:2000。
4.4.1.5 5.尿液分析與腎功能檢查:
血管內溶血的患兒尿液表現爲血紅蛋白尿(潛血陽性但鏡檢無紅細胞)。慢性血紅蛋白尿會導致尿液含鐵血黃素聚集,表現爲尿沉渣檢測時細胞鐵染色陽性(尿 Rous 試驗陽性)。而血管外溶血(如溫抗體型 AIHA)患者的尿液分析結果僅有尿膽原升高。溶血可引起腎功能不全,因此初始評估時應檢測尿素和肌酐。
4.4.1.6 6.溶血的血清標誌物:
溶血的血清標誌物異常可幫助確定是否有溶血性貧血,但這些檢測對 AIHA 不具特異性:總膽紅素增高,以非結合形式(即間接膽紅素)爲主;血清 LDH和 AST 濃度升高,尤其是血管內溶血時,而 ALT 和其他肝酶基本正常;多數 AIHA 病例中,血清結合珠蛋白(可結合血漿遊離血紅蛋白)水平較低或不存在(小嬰兒合成結合珠蛋白能力弱、且結合珠蛋白也是急性期反應物,存在炎症或感染時其濃度可能升高。因此,患者小於 18 個月齡時,不建議常規檢測結合珠蛋白水平)。
4.5 五、診斷
4.5.1 (一)診斷依據
同時存在溶血性貧血證據(紅細胞破壞證據和代償增生證據)和紅細胞抗體證據(DAT 陽性結果)。
4.5.2 (二)溫抗體型和冷抗體型 AIHA 的診斷標準
4.5.2.1 1.溫抗體型 AIHA。
當以下情況均存在時:
①有溶血性貧血(貧血、間接膽紅素水平高、LDH 水平高、結合珠蛋白水平低)證據;
③如果外周血塗片顯示球形紅細胞且有網織紅細胞增多和紅細胞平均血紅蛋白濃度升高,則支持診斷爲該病,但不是診斷必須。
4.5.2.2 2.CAD。
當以下情況均存在時:①溶血性貧血(貧血、間接膽紅素水平高、LDH 水平高、結合珠蛋白水平低);②DAT結果爲補體 C3 陽性,IgG 陰性;③外周血塗片上紅細胞聚集和較高的冷凝集素滴度支持診斷爲該病,但不是診斷必須。
4.5.2.3 3.PCH。
當以下情況均存在時:①溶血性貧血(貧血、間接膽紅素水平高、LDH 水平高、結合珠蛋白水平低);②DAT結果爲補體 C3 陽性;③冷熱溶血試驗陽性。
4.5.3 (三)確定原發、繼發性
所有新診斷的 AIHA 患兒都應篩查繼發性病因,並常在治療前開展,如抗核抗體、免疫球蛋白定量檢測、血清學檢查以判斷有無肺炎支原體和 EB 病毒感染(僅針對冷凝集素病患兒)、回顧患兒的用藥情況。但對於需要儘快治療、危及生命的重度貧血兒童,則以治療優先。
由於許多情況下繼發性疾病在診斷出 AIHA 後才顯現出來,因此對於病情遷延,即使暫未發現繼發性病因而診斷爲原發性 AIHA 患兒,也應定期重複篩查。
2.如果患兒存在如複發性感染病史、免疫缺陷或自身免疫性疾病家族史、其他血細胞減少(中性粒細胞減少和/或血小板減少)、淋巴結腫大和/或器官腫大病史、體格檢查或實驗室檢查發現異常情況,提示潛在惡性腫瘤、免疫缺陷或自身免疫性疾病時,就需進行相關檢查以明確病因。可根據臨牀表現選擇淋巴細胞亞羣檢測、HIV 檢測、骨髓穿刺和活檢、胸片、腹部超聲檢查或 CT 等影像學檢查、使用流式細胞儀篩查有無 ALPS、通過抗雙鏈 DNA 抗體、C3 和 C4 篩查有無 SLE等。
3.存在同種異體抗體檢測:對於在子宮內或通過之前的輸血暴露於外源紅細胞的 AIHA 患者,應篩查 IAT 判斷患者血漿中是否存在同種異體抗體。若檢出同種異體抗體,則在尋找相匹配的血液時,需要進行擴大的血液分型或基因分型。若存在這些抗體但又未發現,可導致患者發生嚴重的輸血反應(表 2)。
4.6 六、鑑別診斷
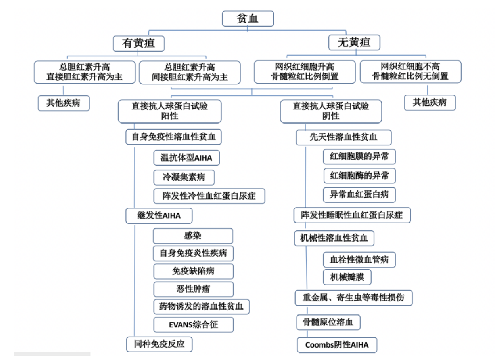
通常所說的 AIHA 是指原發性 AIHA,這些患兒通常具有溶血性貧血的表現、體徵及實驗室證據(例如紅細胞破壞增多及骨髓紅系代償增生的證據),因此,非免疫性原因導致的溶血性貧血需要重點鑑別。其次,兒童的 AIHA 以繼發性AIHA 爲主,診斷過程中尚需要注意明確是否有繼發因素(參看病因與分型)。主要的鑑別診斷如下:
4.6.1 (一)遺傳性球形紅細胞增多症(HS)及其他先天性溶血性貧血
HS 很易與 AIHA 混淆,因爲兩種疾病均存在外周血球形紅細胞和網織紅細胞增多,骨髓中粒紅比倒置,且可能均有脾大、紅細胞滲透脆性升高。但前者可能有家族史,伴膽囊結石,而後者通常沒有。後者 DAT 通常爲陽性,而前者爲陰性。此外,遺傳性橢圓形紅細胞增多症、紅細胞葡萄糖-6-磷酸脫氫酶(G6PD)缺乏症、地中海貧血等其他先天性溶血性貧血,由於同樣具有溶血的表現及體徵而易與 AIHA 相混淆,DAT 同樣是區分 AIHA 與其他原因導致的溶血性貧血的主要依據。
4.6.2 (二)其他類型貧血
血栓性微血管病(例如溶血尿毒綜合徵、血栓性血小板減少症、彌散性血管內凝血等)、機械瓣膜病等均可通過機械力量破壞紅細胞導致溶血性貧血的發生。此類貧血外周血塗片中可見到破碎紅細胞,DAT 檢測爲陰性。巨幼紅細胞性貧血、甲基丙二酸血癥等因維生素 B12 代謝異常,可導致巨大紅細胞出現,骨髓原位溶血,此時可伴有總膽紅素升高,以間接膽紅素升高爲主,網織紅細胞比例或絕對值升高。但前者血清維生素 B12、葉酸水平下降,後者血尿篩查可見甲基丙二酸血癥或尿症,兩者均 DAT 試驗陰性,與 AIHA 不同。
純紅細胞再生障礙性貧血等先天性骨髓衰竭綜合徵、獲得性再生障礙性貧血或暫時性成紅細胞減少症等也可以引起貧血,但這些貧血是由於紅細胞生成減少引起的,相比較於溶血性貧血,這些疾病的網織紅細胞計數通常較低。
4.6.3 (三) 黃疸
兒童出現黃疸時需要具體分析何種膽紅素水平升高。在溶血性貧血中,通常是間接膽紅素升高,而肝臟疾病時通常爲直接膽紅素升高。
4.6.3.1 1.肝病:
氨基轉移酶和凝血因子檢測有助於評估肝臟功能。在溶血性貧血中,間接(非結合)膽紅素水平升高,而肝臟疾病直接(結合)膽紅素水平升高。
4.6.3.2 2.Gilbert 綜合徵:
又稱爲體質性肝功能不良性黃疸,屬一種較常見的遺傳性非結合膽紅素血癥,臨牀表現特點爲長期間歇性輕度黃疸,無貧血症狀。Gilbert 綜合徵爲常染色體顯性遺傳性疾病,患者主要爲青少年,男性多見。
4.6.4 (四)深色尿
尿液中出現血紅蛋白的深色尿可與血尿或肌紅蛋白尿相混淆。此時需要做尿液及生化分析以鑑別。血尿的尿液鏡檢中可見到大量紅細胞,而血紅蛋白尿中通常沒有紅細胞。肌紅蛋白尿的尿液分析與血紅蛋白相似,但肌紅蛋白通常發生於快速大量的肌肉分解,血生化中肌酶水平明顯升高,血紅蛋白尿的患者通常不會有肌酶水平的升高。血紅蛋白尿提示存在病理狀態的血管內溶血,包括 AIHA、紅細胞 G6PD 缺乏症、陣發性睡眠性血紅蛋白尿等。可以通過檢測 G6PD 酶活性、CD55/CD59 水平加以鑑別。
4.6.5 (五)AIHA 鑑別診斷流程圖
4.7 七、治療
4.7.1 (一)一般處理
AIHA 患兒的最佳治療策略需要結合貧血程度、發病的急慢性、症狀和體徵以及自身抗體的特點。如果貧血不嚴重且沒有心衰表現,則 AIHA 患兒可在門診治療;而急性起病時可能需要住院,進行診斷性評估、嚴密監測患者並對危重症患兒開展搶救。
繼發性的 AIHA 需要迅速脫離接觸因素(如藥物)、控制原發病(如感染、腫瘤等),治療纔有好的效果。
4.7.2 (二)支持治療
AIHA 由於存在自身抗體,增加了交叉配血難度,增大了同種抗體致溶血性輸血反應的危險,因此應儘量避免或減少輸血。但如果貧血已經危及生命時也應輸血。輸血時機應根據貧血程度、有無明顯症狀、發生快慢而定。搶救時不強調應用洗滌紅細胞,交叉配血不完全相合時,可選用多份標本交叉配血中反應最弱的輸注,並需要緩慢輸注,密切觀察有無輸血反應。此時輸注的供體紅細胞在 AIHA 患者體內存活時間與患者自身紅細胞相近,但即使輸注的紅細胞在循環中僅能存在較短的時間,仍可幫助改善貧血症狀和體徵。輸血前加用糖皮質激素可以減少或減輕輸血反應的發生。
對於急性溶血性貧血患兒,出現嚴重症狀時能排除同種抗體者,需要立即輸注紅細胞;對於慢性貧血者,HGB 在 70g/L 以上可以不輸血;HGB 在 50 g/L~70 g/L 時,如果有不能耐受的症狀時可以適當輸血;HGB 在 50 g/L 以下時應考慮輸血。存在冷抗體型自身抗體的患兒,更易發生重度溶血性輸血反應。對於此類患者,降低溶血性輸血反應可能性的策略包括:輸注前和過程中加熱血製品至 37 ℃;以緩慢的速度開始輸血,並定期檢測血漿和尿液樣本有無遊離血紅蛋白。在罕見的情況下,輸血使溶血加重時,可伴顯著的血紅蛋白血癥及血紅蛋白尿,應該充分補液和鹼化以防止腎功能衰竭。
PCH 患兒通常有突發但自限性溶血,治療的主要措施是使患者保暖及避免接觸冰冷液體。大多數冷凝集素(IgM)的CAD患兒是由肺炎支原體或EB病毒感染所致。貧血往往很輕,大部分病例不需要藥物治療。與 PCH 一樣,其管理包括使患者保暖及避免接觸冰冷液體。治療基礎病因(如對支原體感染患者應用抗生素)也是另一重要方面。
4.7.3 (三)藥物治療
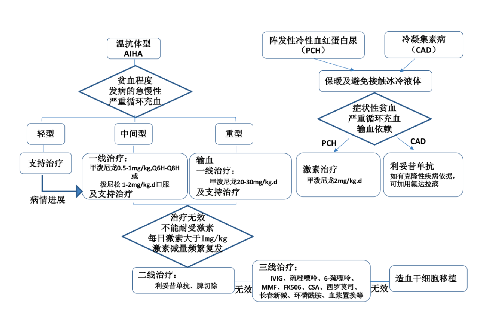
4.7.3.1 1.溫抗體型 AIHA:
通常易反覆和呈現慢性過程,不經治療常不能緩解,需給予藥物治療。
4.7.3.1.1 (1)一線治療
糖皮質激素是溫抗體型 AIHA 的一線治療。推薦在無糖皮質激素禁忌情況下應用。對於溫抗體型 AIHA,糖皮質激素常在 24 h~48 h 內起效,治療反應率爲 50%~80%,但減量過快或突然停用時易復發。PCH 患兒通常有自限性溶血,但可能需要短期使用糖皮質激素以減少溶血和改善貧血。少數情況下,糖皮質激素對 CAD 可能有效。
① 初始劑量取決於貧血的程度:重度貧血患兒需住院治療,在最初的24~72 h,每6~8 h靜脈給予甲潑尼龍(1~2)mg/kg。嚴重者也可以採用衝擊劑量,如甲潑尼龍30 mg/(kg·d),最大劑量爲1 g/d,連續3 d;隨後改爲常規劑量維持。輕中度貧血患兒可以接受口服強的松治療,劑量(1~2)mg/(kg·d),最大劑量爲60 mg/d。
② 減量可先快後慢:糖皮質激素用至紅細胞比容大於30%或者 HGB 水平穩定於 100 g/L 以上才考慮減量,並根據患者耐受情況在 2~6 個月內逐漸減量,例如每月減少 2.5~10.0 mg。後期應將糖皮質激素緩慢減量,直到血紅蛋白、網織紅細胞計數、LDH 和結合珠蛋白正常。
③ 治療過程中需嚴密監測併發症:兒童長期應用糖皮質激素可引起多種併發症,包括體質量增加、生長受損、精神和認知症狀、高血壓、高血糖、骨質疏鬆、股骨頭壞死和白內障等。
④ 其他治療和監測:需要注意鹼化利尿(嚴重貧血時不強調水化。血管內溶血時需要適度鹼化。血管外溶血時無需鹼化)、利膽去黃,並注意電解質平衡。定期臨牀評估及監測血紅蛋白水平、網織紅細胞計數、LDH 和 DAT,監測頻率取決於疾病嚴重程度和治療。實驗室檢測通常首先每週監測1 次;隨着臨牀情況的穩定,檢查的間隔時間可以逐漸延長。
通常監測至少 1 年。如在完全緩解後,DAT 仍爲陽性,則需進一步尋找繼發性病因,如 Evans 綜合徵或系統性紅斑狼瘡。
⑤ 治療反應:預期反應:約 80%的患者應用糖皮質激素治療會獲得初始反應。研究顯示,大多數患兒在 1 個月內出現血紅蛋白水平恢復,但 72%的患兒接受了至少 6 個月的治療。
復發:AIHA 患者常復發,15%~40%的患者在獲得初始反應後最初 6 個月到 1 年期間發生復發。復發治療通常是重新開始既往能夠有效維持患者緩解的最低劑量潑尼松治療。糖皮質激素依賴:是指對於減量頻繁複發或服用低劑量潑尼松(每日≤0.2 mg/kg)不能維持緩解的患者。
⑥療效標準:
痊癒:繼發於感染者,在原發病治癒後,AIHA 也治癒。表現爲無臨牀症狀、無貧血、DAT 陰性。CAD 者冷凝集素效價正常,PCH 者冷熱溶血試驗陰性。
完全緩解:臨牀症狀消失,紅細胞計數、HGB 水平和網織紅細胞百分比均正常,血清膽紅素水平正常。DAT 陰性。
部分緩解:臨牀症狀基本消失,HGB>80 g/L,網織紅細胞百分比<4%,血清膽紅素<34.2μmol/L。DAT 陰性或仍然陽性但效價較前明顯下降。
無效:仍然有不同程度貧血和溶血狀態,實驗室未達到部分緩解標準。
此外,一線治療還包括和糖皮質激素聯合使用的靜脈免疫球蛋白(intravenous immunoglobulin,IVIG)衝擊治療,對溫抗體型 AIHA 有效,劑量爲 0.4 g/(kg·d),連續 5 d靜脈輸注;或 1 g/(kg·d),連續 2 d 衝擊治療。對於復發或難治性 AIHA,可以考慮多次使用。IVIG 對成人 AIHA 是一種非常有吸引力的選擇,但大多數患兒單獨應用 IVIG 無反應,即使產生反應,療效也通常短暫。
4.7.3.1.2 (2)二線治療
以下情況需要予二線治療:1~2 個月內糖皮質激素治療無反應的患者,不耐受糖皮質激素逐漸減量、每日維持劑量>1 mg/kg 的潑尼松劑量,糖皮質激素依賴,其他禁忌或不耐受糖皮質激素治療,AIHA 復發。
① 利妥昔單抗:靜脈給藥,每劑 375 mg/m2,每週 1 次,應用 2~4 周,反應率爲 60%~85%。也有報道顯示小劑量利妥昔單抗(100 mg/次,每週 1 次,連續 4 次),可降低經濟負擔及不良反應,而不降低療效,但臨牀數據及隨診時間有限。利妥昔單抗應用時需要注意過敏反應,大多數發生於首次輸注時,治療前可採用對乙酰氨基酚和抗組胺藥預防。嚴重不良反應包括重度的輸液相關反應、乙肝病毒感染再激活、重度的皮膚黏膜反應和進行性多竈性白質腦病。應在開始利妥昔單抗治療前對所有患者根據當地指南進行乙肝病毒(HBV)的篩查,不應對處於乙肝活動期的患兒使用利妥昔單抗治療。對於 HBV 血清學檢測陽性的患者,在開始接受治療前應諮詢肝病專科醫生的意見,同時應對其開展監測以預防 HBV 再激活的發生。
②脾切除:脾切除是慢性或頑固性 AIHA 患兒有效治療手段;約 2/3 的患兒有短期改善,通常在手術後 2 周內改善明顯。幼兒脾切除後存在莢膜細菌所致膿毒症風險,因此 3歲以下患兒應避免進行脾切除,最好延遲至 6 歲以後進行。準備脾切除的患者,應該在術前適當的時間進行抗肺炎鏈球菌、腦膜炎奈瑟菌和 B 型流感嗜血桿菌的免疫。已進行了脾切除的患兒酌情予長效青黴素預防性治療,並應囑患者在出現發熱時立即就醫。
(3)難治性 AIHA:對於糖皮質激素、利妥昔單抗和/或脾切除治療失敗的難治性 AIHA、以及在應用利妥昔單抗和/或脾切除後仍依賴類固醇治療的難治性 AIHA 患兒,可能需要更積極的治療。
此時雖然尚有一些治療選擇,但都不如糖皮質激素、利妥昔單抗和脾切除有效。
①硫唑嘌呤和 6-巰嘌呤:6-巰嘌呤及其前體藥物硫唑嘌呤是免疫抑制藥物,主要影響輔助性 T 淋巴細胞功能,從而減少自身抗體的合成併發揮“類固醇助減”作用。這兩種藥物可能都需要 2~3 個月以上的治療才能出現臨牀反應。應用過程中,需注意出現骨髓抑制、肝功損害、皮疹等副作用可能。
② 環孢素 A:主要影響 T 淋巴細胞功能。建議起始口服劑量爲每日 5 mg/kg,每 12 h 1 次,維持血藥濃度(谷濃度)100~200 μg/L。由於環孢素 A 需要達到有效血藥濃度後才起效,建議初期與糖皮質激素聯用。環孢素 A 不良反應有齒齦增生、多毛、高血壓、膽紅素增高、腎功能受損等。
③ 嗎替麥考酚酯、他克莫司和西羅莫司:這些免疫抑制劑可用於復發、難治 AIHA 患者,它們的應用可能發揮“類固醇助減”作用,從而減少維持緩解所需糖皮質激素的劑量。目前關於這些藥物用於 AIHA 治療的數據較少。
④ 細胞毒製劑:可以減少自身抗體生成的細胞毒製劑包括長春新鹼、長春花鹼和環磷酰胺。但這些藥物一般具有骨髓抑制性及致突變作用,在兒童患者中應謹慎使用。
⑤血漿置換:血漿置換對冷凝集素 IgM 介導的 AIHA 效果較好(37 ℃時 80% IgM 型抗體呈遊離狀態);但對溫抗體型 AIHA 效果不佳,且置換常帶入大量補體。
⑥造血幹細胞移植:AIHA 患者進行成功的造血幹細胞移植已有報道、僅用於其他所有治療均失敗的重度 AIHA 患者。
4.7.4 (三)繼發性 AIHA
對於某些原因的繼發性 AIHA,治療時還需考慮:
4.7.4.1 1.Evans 綜合徵:
許多 Evans 綜合徵患者採用糖皮質激素治療無效,需開展二線治療。嗎替麥考酚酯和西羅莫司可能有效。ALPS 最有可能是 Evans 綜合徵的患兒免疫系統失調的基礎病因,因此,表現爲 Evans 綜合徵的所有患兒都必須篩查有無 ALPS。
4.7.4.2 2.免疫缺陷:
具有基礎免疫缺陷患者的 AIHA 治療與原發性 AIHA 相似,大多數患者對糖皮質激素治療有反應。然而,具有基礎免疫缺陷的患者,特別是 CVID,在脾切除或利妥昔單抗治療後可發生重度感染。因此,對這類患者需密切監測感染性併發症發生可能。
4.7.4.3 3.ALPS:
ALPS 患者發生 AIHA 時,通常表示自然病程的轉變,並且需要開始或加強治療。有自身免疫表現的患者比僅有淋巴組織增生的患者通常更難對免疫抑制治療產生反應。這些患者可能需要免疫抑制劑聯合免疫調節劑治療,如,糖皮質激素、利妥昔單抗、IVIG、嗎替麥考酚酯和西羅莫司。
4.7.4.4 4.藥物誘發的 AIHA:
對於疑似藥物誘發的 AIHA 患者,必須停用可疑藥物。很多情況下,需應用糖皮質激素以減慢溶血速度;如果患者臨牀情況惡化,也可考慮血漿置換。重度快速進展性貧血患者可能需要靜脈給予大劑量甲潑尼龍(每日 30 mg/kg,治療 3 d;日均最大劑量 1 g),隨後口服潑尼松且根據療效逐漸減少每日劑量。
4.7.5 (四)兒童 AIHA 的治療流程圖
4.8 八、預後
據報道,在 1994~2014 年間進行治療的 AIHA 患兒病死率爲 3%~4%,死亡的主要病因是脾切除患者發生過於嚴重的膿毒症、Evans 綜合徵患者發生災難性的出血(同時併發 ITP)以及基礎疾病(惡性腫瘤)。
PCH 和繼發於肺炎支原體或 EB 病毒感染的 CAD 患兒可急性起病、病情較重,但大多數患者在起病後數週至數月內可獲得完全緩解,病程常具有自限性,預後好。相比之下,IgG介導的溫抗體型 AIHA 患兒常爲慢性病程,以間斷復發爲特點。
4.9 九、轉診條件
4.9.1 (一)從上級醫院轉診到下級或基層醫院
2. 臨牀狀態穩定,無心力衰竭、腎功能不全等併發症,血紅蛋白水平穩定或逐步回升;
3.治療方案確定且後續治療可以在當地醫院完成。
4.9.2 (二)從基層醫院轉診到上級醫院
出現以下情況可從基層醫院向上級醫院轉診。轉診前需嚴格評估病情,必要時需輸血支持治療。轉診過程中需嚴密監測生命體徵,需備有必要的急救設施及藥品。
3. 當前的診斷、治療和隨診無法在基層醫院完成。