2 註解
聽覺醫學是一門研究生理、病理狀態下聽覺功能及聽力障礙康復的科學。聽覺醫學是第二次世界大戰後才發展起來的一門年輕學科,最初源於聽力檢測技術,屬耳科學範疇,其基礎是耳的解剖和生理以及有關的聲學知識,以後隨着電聲和數字信號處理及芯片等技術的發展以及對基礎醫學認識的不斷提高而發展,逐漸成爲一門獨立的學科。聽覺醫學涉及多門學科,包括耳科學、神經科學、生理學、病理學、心理學及教育學等,是一門新興的邊緣學科。
現代科學技術的進步,極大地促進了醫學科學的發展。21世紀的醫學發展趨勢是分子生物學、醫學信息學、基因工程、微創技術及預防醫學的發展。聽覺醫學由於其自身的特點,決定了其與高科技含量的成果緊密結合的必要。我們相信聽覺醫學將有更大的發展,併爲人類健康做出更大的貢獻。
3 聽覺醫學發展簡史
在醫學科學史中,有許多傑出科學家爲聽覺醫學和耳科學的發展做出了不朽貢獻,他們從耳的解剖到生理、從耳科學各種檢查技術的發明到耳科疾病治療手段的創新,給我們留下了深刻的回憶。
早在文藝復興時期,近代解剖學創始人維薩里(Andreas Vesalius,1514-1564)在1543年發表了劃時代的著作《人體的構造》(De corporis humani fabrica)。 維薩里對卵圓窗、蝸窗、鼓 岬、前庭、半規管和咽鼓管進行了簡單描述,有學者認爲是他命名了錘骨、砧骨和橙骨。儘管他對耳科學解剖方面的貢獻比不上對大體解剖的影響,但他仍被認爲是最早的耳科解剖學家。

與維薩里同時代的歐斯塔修(Bartolomeo Eustachi,1513-1574)是意大利羅馬解剖學家,著有《解剖學記錄》(1714年出版),書中正確描述了聽骨、內耳蝸軸及咽鼓管(Eustachian管)。


意大利文藝復興時期百科全書式的學者吉羅拉莫•卡爾達諾(Girolamo Cardano,1501~1576)於1550年發現將震動的音叉置於門齒上即可感覺到聲音,表面聲音可通過骨質傳到內耳感覺裝置,即骨導現象。


安東尼奧·斯卡帕(Antonio Scarpa,1752~1832)出生於意大利特雷維索省(Treviso)。除了Scarpa神經節(前庭神經節)是 斯卡帕最早發現外,其實最早描述膜迷路和內淋巴、最早準確描繪耳蝸前庭神經終末支分佈的人也是斯卡帕。1772年 斯卡帕發表了他的第一篇論文《耳的圓窗結構,或第二鼓膜的解剖學觀察》。1774年, 斯卡帕開始研究神經系統,1774年發表了關於神經節和神經叢研究的論文,這是 斯卡帕最重要的工作。其它以斯卡帕命名的名詞還有:Scarpa’s fluid(內淋巴)、Scarpa’s foramen(鼻齶神經孔)、 Scarpa’s hiatus(蝸孔)、Scarpa’s membrane(圓窗膜、第二鼓膜)、Scarpa ’s nerve(鼻齶神經)等。
耳蝸螺旋管的發現者是Friedrich Christof Rosethal(1780~1829)。Rosethal因爲發現了耳蝸裏的骨性蝸軸的正確結構而被譽贊。有趣的是,在Scarpa關於螺旋器的詳細描述中,沒有提及螺旋管,僅暗指耳蝸兩個骨性部分之間有一空間位置。經過大量親自解剖之後,Rosethal發現他自己觀察到的與Scarpa描述的不一致。這個伴隨鼓階繞着蝸軸旋轉的螺旋型的管被稱爲Rosethal管,裏邊有耳蝸螺旋神經節。

阿方索·柯替(Alfonso Corti, 1822~1876),意大利人。1850 年初到達德國維爾茨堡,在克利克(Kolliker,瑞士解剖學家、組織學家和動物學家)的指導下研修內耳解剖與組織學。柯替在一篇著名的論文中描述了下列以他的名字命名的結構:螺旋器(柯替器)、柱細胞(pillar of Corti)、柯替隧道(tunnel of Corti)、外毛細胞、蓋膜(Corti′s membrane)和基底膜。


耳蝸管前庭壁的發現者:恩斯特·萊斯內爾(Ernst Reissner,1824~1878)。在Corti發表關於螺旋器論文的同一年,萊斯內爾在膜迷路工作原理的闡述上取得了巨大進步。爲了準備醫學學位論文,萊斯內爾選擇雞、奶牛、豬和人的胚胎進行迷路研究。他在1851年發表的論文裏,第一次揭示了內淋巴膜迷路是一個封閉的系統,它漂浮於外淋巴中的方式與腦和脊髓漂浮於腦脊液中的方式相同。他描述了迷路中的前庭膜,後來被命名爲Reissner膜。
奧托·弗里德里希·代特(Otto Friedrich Deiters,1834~1863)出生于波恩,1856年獲醫學學位, 此後,代特曾在柏林與著名的病理學家魏爾嘯(Virchow)一同工作,側重於耳和神經系統的研究。1860年,代特描述了內毛細胞和現在以他的名字命名的支持細胞,即Deiters細胞。
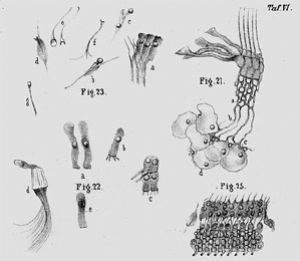
維克托·亨森(Viktor Hensen,1835~1924)出生於德國 石勒蘇益格(Schleswig)。1854~1856年, 亨森曾在維爾茨堡(Wusburg)師從於Kolliker和Virchow。1863 年,亨森描述了現在以他的名字命名的Hensen細胞和蓋膜上的Hensen紋。Hensen紋是蓋膜上突起的三角形亞結構,覆蓋在內毛細胞上。

弗里德里希·馬修·克勞迪厄斯(Friedrich Matthew Claudius,1822~1869)出生於德國呂貝克(Lubeck)。1856年, 克勞迪厄斯描述了現在以他的名字命名的細胞(Claudius細胞) ,該細胞位於螺旋器上Hensen細胞的外側。

Arthur Boettcher(1831~1889)出生於德國Bauske,曾在法國和奧地利求學,研究人類迷路的解剖。1856年,25歲的Boettcher描述了現在以他的名字命名的細胞(Boettcher細胞),此外,以Boettcher命名的結構還有Boettcher神經(位於內聽道內的耳蝸神經)和Boettcher管(連接球囊和橢圓囊的小管)。
Jean-Pierre Nuel(1847~1920)出生於盧森堡的Tetange。他的知名是對耳科學的貢獻,特別是對內耳解剖的研究。1872年,Nuel描述了現在以他的名字命名的解剖結構-Nuel間隙。
Hermann von Helmholtz(1821~1894)出生于波茨坦。他的研究領域是神經生理學、視覺及聽覺生理學,在這兩個領域取得了傑出的成就。他在生理聲學最重要的著作是《音樂理論的生理基礎——音調的感覺》(On the Sensations of Tone As a Physiological Basis for the Theory of Music)。在這本書裏,他把耳解剖、耳生理、物理、數學、聽覺心理融爲一體,用認識論的方法分析感覺、神經傳導、音樂理論與外部世界之間的聯繫,進一步擴展了內耳共鳴的假說。Helmholtz用音叉、汽笛、重弦、玻璃瓶樣共鳴腔等進行試驗,將Corti描述的內耳解剖與音調和共振結合起來,提出了類似於鋼琴絃共鳴的共振理論。Helmholtz認爲,耳的不同部位因不同的音調而振動,內耳的基底膜接受到感覺後,再把感覺傳導到聽神經纖維。由於對耳蝸解剖的誤解,他錯誤地認爲Corti柱或基底膜上的纖維對各種音調的聲音起反應。現在我們知道對音調起作用的應該是毛細胞。雖然他的共振理論不完全正確,但是爲內耳音調識別的“定位理論”打下了基礎。





喬治·馮·貝克西(Georg von Békésy,1899~1972),匈牙利裔美國物理學家。1899年6月3日生於匈牙利的布達佩斯;1972年6月13日卒於夏威夷。貝克西是一個外交官的兒子。他曾在瑞士伯爾尼大學學習,1920年畢業,隨後入布達佩斯大學繼續深造,1923年獲得博士學位。以後,貝克西幾乎用了四分之一世紀的時間從事匈牙利電話系統的聲學研究工作。同時他又在布達佩斯大學擔任教學工作。貝克西的工作未曾受到第二次世界大戰的干擾。戰後,蘇聯軍隊佔領了這個國家,貝克西便於1946年來到瑞典,1947年來到美國,後一直在哈佛大學工作。他設計了一臺用於測量聽覺功能的聽力計。同時,還提出了有關聽覺的理論,從而替代了首先由黑爾姆霍茲提出的理論。
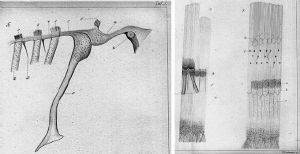
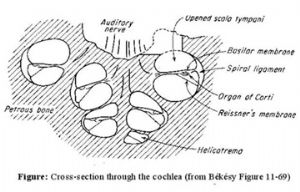
爲了了解他的學說,我們首先要解釋一下聲音的傳遞。聲波由外耳道空氣傳至鼓膜,並通過鼓膜的振動傳遞給中耳的三塊聽小骨:錘骨、砧骨和鐙骨。通過它們將振動送到內耳中。內耳的耳蝸是主要的聽覺器官,由前庭階、鼓階和位於中間的蝸管組成,是一封閉小室,當前庭階起點處的卵圓窗內移時,鼓階末端的圓窗(蝸窗)就向外凸出,聲音的壓力波就這樣穿過內耳液,使位於蝸管的基底膜產生位移。基底膜由兩萬四千多根並行的纖維構成,這些纖維順着耳蝸的縱向漸漸展寬。而耳蝸可以對聲音的頻率進行初步分析,耳蝸底部感受高音調,頂部感受低音調,中等音調的感受則與耳蝸中部有關。
關於聽覺器官如何對聲音進行分析的問題,有許多假說,而以位置學說受到多數人的贊同。位置學說的基本觀點認爲:不同音調引起耳蝸基底膜不同部分的振動,音頻分析首先決定於基底膜的振動位置。位置學說中又以共振學說(resonance theory)提出最早和流行最爲廣泛。黑爾姆霍茲(H. von Helmholtz)於1867年首次提出共振學說,他把耳蝸基底膜視爲對不同頻率聲波的共振元件。這些元件選擇性地對一定頻率的聲波發生共振。近蝸底的橫纖維短,與高頻音共振;近蝸頂的橫纖維長,與低頻音共振。聲音是由各種頻率的基本振動混合而成的,每個聲音激勵起基底膜某些纖維的同時振動。哪一部分基底膜共振,哪裏的毛細胞就興奮,聲音就由此轉爲神經衝動,經聽神經傳入中樞,引起音調的感覺。根據共振學說,每秒16~20000次的聲波就認爲是由基底膜上大約24000條橫纖維分別予以共振而得到初步分析。共振學說在實驗及臨牀上也得到證明,如蝸底受傷,則高音感受發生障礙;蝸頂受損,則低音感受消失。
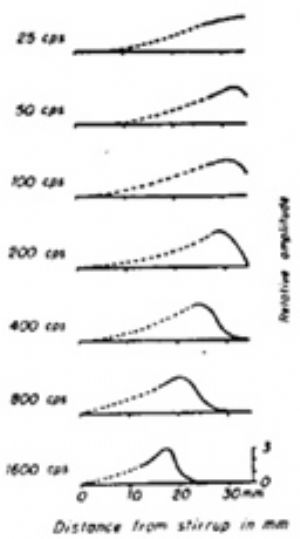
至20世紀40年代,橫纖維的共振現象因一些實驗事實而受到懷疑。貝克西1951年對剛死的人的屍體的耳蝸進行了直接觀察,未發現基底膜的橫向纖維有足夠產生共振的張力。因此認爲,將基底膜的橫向纖維視爲共振元件是不正確的。他採用人工方法代替鐙骨以不同頻率振動卵圓窗時,有一大段基底膜以行波的方式隨之振動。振動從蝸底開始,逐漸向蝸頂推進,其幅度也隨之逐漸加大,直到基底膜的某一部位,振幅達到最大值時,振動即停止前進而逐漸消失。就像人在抖動一條綢帶時,有行波沿綢帶向遠端傳播一樣。對不同頻率的聲波刺激,基底膜最大振幅所在部位也不同。聲波頻率越低,最大振幅所在部位越靠近蝸頂;聲波頻率越高,其最大振幅所在部位越靠近蝸底鐙骨底板。因此認爲頻率的分析決定於基底膜行波的最大振幅所在部位,這就是聽覺的行波學說(traveling wave theory)。行波學說爲位置學說的一個流派,也可說是共振學說的發展,目前已爲大多數學者所公認。鑑於這個結果,1961年,貝克西因“發現了耳蝸內部刺激的物理機制”而榮獲諾貝爾醫學和生理學獎。成爲在這個學科範疇中第一個獲得諾貝爾獎金的物理學家。他的研究生涯可以用諾貝爾獎評語加以概括:“毫無疑問,如果沒有貝克西,我們就不可能對聽覺刺激和物理機制有如此清楚的瞭解。”
4 貝多芬耳聾之謎
我們都非常熟悉世界著名作曲家貝多芬(Ludwig van Beethoven,1770-1827)和他的不朽的作品,但讓我們更驚訝的是,他的最偉大的作品《第九交響曲》竟是他耳朵全聾後的傑作。耳聾者能作音樂,已是奇蹟,更何況所作的又是世間最偉大的作品!
貝多芬的耳病起於1798年他28歲的時候,直到57歲(1827年)逝世,其間二十餘年全是耳聾爲祟的時期。然而他大部分的作品卻在這時期產生。到了後來全聾期,他仍是堅持作曲,終於作出了最偉大的《第九交響曲》而擱筆。臨終的時候,他口中還這樣嘆到:“唉!我只寫了幾個音符!”。

貝多芬何以會耳聾的呢?根據病歷,許多醫學專家認爲貝多芬是先天梅毒病人。由於梅毒的慢性進行性損害使他的聽力喪失。也有醫生認爲貝多芬的耳聾是某種結核病引起的,還有人認爲是由Paget病或Whipple病所致。這位音樂家一生貧病交加,得過天花、傷寒、水痘、營養失調、肝損傷等疾病,這衆多因素也能促使聽力衰退,但真相如何,目前已難以澄清。
根據早年貝多芬寫給朋友Wegeler醫生的書信分析,貝多芬早期的聽力損失以高頻爲主,並伴有重振和嚴重的耳鳴,耳聾的性質可能是傳導性的。後來他的健康每況愈下,晚期還患有進行性黃疸,嘔吐,腹瀉和持續水腫。1827年3月26日這位偉大的音樂家在維也納去世,死因爲現今的肝腎綜合徵。當時Johann Wagner和Rokitansky兩位醫生一起對貝多芬做了屍檢。貝多芬的耳廓很大,外形不規則,耳甲寬闊。外耳道蓋滿鱗片,鼓膜被鱗片覆蓋。顳骨巖部,尤其是耳蝸周圍血管豐富,乳突很大,內襯含血管的膜性組織。位聽神經皺縮並有脫髓鞘改變。許多耳科專家贊同貝多芬的耳聾屬於耳蝸型耳硬化症,這可以解釋其進行性混合性高頻聽力減退伴有重振,音語辨別率減低和耳鳴,發病年齡亦與該病相符。然而在屍檢中未發現鐙骨底板固定。
因爲耳病,貝多芬漸漸失去了聽覺,可以想象他的悲痛和絕望,他曾經想到自殺,甚至連遺囑都寫好了。但是,經過無數次激烈的思想鬥爭之後,貝多芬挺過來了,決心堅強地活下去,把自己的音樂才華獻給人類。於是,貝多芬以頑強的毅力同耳聾做鬥爭,勇敢地向命運挑戰。據說,他請機械師爲他特製了一個助聽器來幫助作曲。開始,他戴上助聽器,還可以聽到一些微弱的聲音,但是後來漸漸感到助聽器也不管用了。他又請人爲他特製了一支小木棒,創作時,他將這支小棒的一端插在鋼琴共鳴箱裏,另一端咬在牙齒中間,利用小木棒的震動,來察覺音調,幫助作曲,就這樣,一直堅持到他去世。


I shall seize Fate by the throat; it shall certainly not bend and crush me completely.
(我要扼住命運的咽喉,它將無法使我完全屈服)
-- Ludwig van Beethoven, letter to F G Wegeler, 1801
兩耳失聰的貝多芬爲什麼還能創作出偉大的作品呢?這就與內心聽覺有關了。音樂的內心聽覺是一種心理現象,它是一種不依賴音響,僅憑記憶表象和思維而準確地構成內心音樂意象的能力,或者說是音樂的各種音響以聽覺表象的形式在人腦中的想象與再現,它與人的過去感知音樂的經驗積累、對音樂感性體驗的質量以及人的音樂審美情感都有着直接、內在的聯繫,是人在音樂實踐活動中逐步培養建立起來的。內心音樂聽覺發展水平的高低,直接影響着音樂創作、音樂表演及音樂欣賞等音樂實踐活動的質量以及創作靈感的產生。在貝多芬這樣傑出的作曲家腦海裏,早已積累了各式各樣的音樂音響,並掌握了各種音樂表現手段。他“顯然是利用了過去所積累的豐富材料和敏慧的聽覺經驗的高度修養,以及強有力的音樂想象力和深刻的音樂邏輯手段。”他的耳聾“迫使他利用了聽覺表象的綜合及純理智的,非感性的發展。”音樂家在過去經驗積累的基礎上,可以完成對音樂作品的構思,只有豐富的音響想象,嫺熟的創作技巧,並把熾熱的激情全部傾注在樂譜上,才能創作出不朽的音樂作品,這正是由於他們早已具備了非凡的內心音樂聽覺能力的緣故。貝多芬在失聰後以頑強的毅力創作了《第九交響曲》,並在首演時,親自指揮交響樂團進行了演奏。被稱爲捷克新音樂之父的斯美塔那也是兩耳全聾後創作了交響詩《我的祖國》。他們所創作的不朽的名作,正是音樂內心聽覺重要作用的佐證。
5 聽覺醫學研究方法
爲了觀察、分析生物體感覺器官的生理和病理現象,必須首先了解這些器官的形態與結構。我們知道機體最基本的結構和功能單位是細胞(cell),細胞數量衆多、形態多樣,並具有各自的結構特徵、代謝特點及功能活動。同類的細胞及其產生的細胞間質共同組成組織(tissue),在人體,有4種基本組織,即上皮組織、結締組織、肌組織和神經組織,這些組織按一定規律組合成器官(organ)。器官具有一定的形態結構,執行特定的生理功能,如作爲聽覺器官的耳和作爲視覺器官的眼,等等。
隨着現代科學技術的發展,科學家們發明了各種方法和相應的精密儀器用來研究、分析、檢測生物體各器官的構造和功能。在聽覺醫學研究中,科學家可以根據目的的不同選擇不同的方法來研究聽覺器官,並進而瞭解其生理功能。下面,我們將從三個方面簡要介紹聽覺醫學的研究方法。
5.1 形態學方法
聽覺器官-耳主要位於顱底的顳骨之中,相關的結構及其毗鄰關係十分複雜,而且各結構非常微小,因此,爲了研究耳的形態結構,研究者常藉助可以放大數倍的解剖顯微鏡或手術顯微鏡,在鏡下使用顯微解剖器械(如解剖刀、鑷、剪刀等)對標本進行解剖,特別是中耳和內耳的重要結構藏在顳骨內,所以研究者必須用高速磨鑽細心打開顳骨,才能暴露其中的結構。通過這樣的解剖研究,可以瞭解各器官的形態結構特徵,以及各結構之間的空間毗鄰關係,這些知識對一位耳科醫生來說是非常重要的,熟練掌握聽覺器官的相關解剖知識是做好耳科醫生的前提之一。臨牀醫師也常用顯微解剖和顯微手術方法研究人體頭頸部的神經、血管、顱骨和各組織器官的結構關係,在此基礎上提出手術入路和切除病竈的方法。


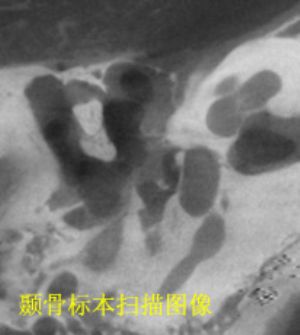
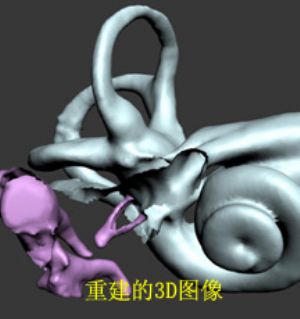
現代的影像技術已經非常先進,藉助計算機斷層掃描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)來研究顳骨以及耳的解剖也是一個有效方法。CT在顯示骨性結構方面見長,而MRI長於顯示軟組織。使用這些影像技術對標本或活體掃描後,可以獲得連續的斷面圖像,研究者再對這些圖像進行分析、測量等工作。但是目前臨牀上用於診斷目的的影像技術在顯示微細結構(如毫米級以下的結構)的能力還很有限。現在有一種只用於研究目的的顯微CT(MicroCT)可以掃描小標本快或小動物,它可以清楚地顯示毫米級以下甚至數微米級的結構,這是研究者的一個好幫手。
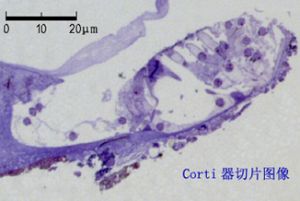
但是,通過解剖或顯微解剖的方法仍然不能觀察組織細胞的微細結構特徵,必須藉助各種光學顯微鏡(簡稱光鏡)觀察組織切片才能達到這個目的,這是醫學研究的基本技術之一。通常用的光學顯微鏡可放大1500倍左右,分辨率爲0.2μm。而組織切片的製作工藝比較複雜,例如常用的石蠟包埋切片的方法是,先取出要研究的小組織快,用甲醛等溶液進行固定處理,再用乙醇脫水、二甲苯透明,之後用石蠟包埋組織塊,使用切片機將組織塊切成數微米的薄片,將這些切片貼在玻璃片(即載玻片)上,在用二甲苯脫蠟之後,對切片進行染色,常用的染色方法是蘇木精和伊紅染色,簡稱HE染色。蘇木精爲鹼性染料,能將細胞核染成藍色;伊紅爲酸性染料,常將細胞質染成淡紅色。染色後進行封片就可以用顯微鏡觀察組織細胞的結構了。


電子顯微鏡(簡稱電鏡)的發明和使用,使人類探索生命奧祕的步伐大大加快了。電子顯微鏡的分辨率爲0.2nm[注意:1mm(毫米)=1000μm(微米),1μm=1000nm(納米)],比光鏡高1000倍,可放大幾萬倍到幾十萬倍,通過它,人們可以觀察到細胞內更微細的結構,這些在電鏡下所見的結構稱爲超微結構(ultrastructure)。電鏡又分爲透射電鏡和掃描電鏡。
透射電鏡(transmission electron microscope,TEM)是由電子發射器發射的電子束穿透樣品,經過磁場的聚合放大後,在熒光屏上顯像。一般要對樣品的超薄切片(切片厚50~80nm)進行電子染色,如用重金屬鹽鉛、鈾等進行電子染色,以增加物像的反差而提高結構的清晰度。掃描電鏡(scanning electron microscope,SEM)是研究細胞或器官表面立體微細結構的電子儀器。由電子發射器發射一束細電子束,在樣品表面一點一點移動,掃描整個樣品表面,產生代表樣品形貌的電子信號,經過放大在熒光屏上成像,圖像清晰而富有立體感。
其它還有諸如熒光顯微鏡、倒置相差顯微鏡、激光共聚焦顯微鏡等儀器用於研究組織細胞的微細結構及其功能活動。




組織化學和細胞化學技術:組織和細胞由各種化學成分組成,不同的組織和細胞會有不同的化學組成。組織化學和細胞化學技術就是應用化學反應和物理反應原理檢測組織和細胞內某種化學成分並進行定位定量及相關功能研究的一種實驗技術。如糖類、脂類、酶、核酸等可與試劑發生化學、物理反應,形成有色的終末產物,然後可以在顯微鏡下觀察分析。

組織與細胞培養技術(tissue and cell culture):是將離體的細胞、組織甚至器官,放置在合適的培養液中,在無菌和適當的溫度下進行培養,使之生存和生長的一種技術。組織培養可用於研究各種理化因子(溫度、藥物、毒物等)對活細胞的直接影響,並能隨時在顯微鏡下觀察、攝影記錄。還可以與其它技術方法結合,研究某種因素對細胞增殖、分化、代謝、運動、吞噬、分泌等的影響,也可以研究細胞癌變和逆轉等機制,達到在體實驗難以達到的研究目的。




5.2 電生理技術
電生理技術(Electrophysiological Techniques)是以多種形式的能量(電、聲等)刺激生物體,測量、記錄和分析生物體發生的電現象(生物電)和生物體的電特性的技術,是醫學研究的主要方法之一。
1922年,兩位美國科學家厄蘭格(J.Erlanger)和蓋塞(H.S.Gasser)首先用陰極射線示波器記錄神經動作電位,並證明神經纖維越粗,傳導衝動的速度越快。這一方法學的進步奠定了現代電生理學的技術基礎。他們倆人因此而獲得1944 年諾貝爾獎。早期的電生理技術只能記錄大量細胞的同步的電活動,以後逐漸向微觀和整體兩個方面發展。在微觀方面,1949年,G.Ling 和 R.W.Gerard 開始用微電極插入細胞內記錄其電活動,使電生理技術達到細胞水平。1976年 E. Neher 和B. Sakmann 應用改進的膜片鉗技術,可以記錄細胞膜上單個離子通道的電流量,爲從分子水平闡明神經元活動打下基礎,因而獲1991 年諾貝爾獎。在整體方面,20世紀60年代起,由於應用了計算機,人們能從人或動物的體表記錄到非常微弱的體內深部小羣細胞的電活動。這類測量對機體毫無損傷,因此對臨牀診斷有重要意義。
電生理技術大致包括電生理測量技術、刺激技術和信號的處理和分析技術等方面。
①生物電測量技術。用電極將微弱的生物電引出,經生物電放大器將它放大,再經示波器等顯示其波形並記錄下來,以便觀察、分析和保存。引導生物電的電極分大電極和微電極兩類。大電極記錄到的是許多細胞(例如一個器官)的電活動綜合而成的生物電,例如心電、腦電、肌電等。微電極的尖端直徑小於1微米,也可大至幾微米( 玻璃管、金屬絲)。用微電極可在細胞水平上對生物電現象進行觀測和研究。細胞發生的生物電的能量很低,必須用放大器放大才能觀測。大電極用的生物電放大器應該噪聲低、漂移小,具有很強的抑制外界和生物體內電干擾的能力。微電極放大器需具有極高的輸入電阻和減小輸入電容的補償電路,使生物電能保真地放大。顯示和記錄時常用的有磁帶記錄儀,筆寫記錄器,XY記錄儀和示波器等。
②生物體電學特性的測量技術。此種技術常用於對生物體的電阻、電容和電感等參數的測量。例如使一定量的電流流過細胞膜,測量它在細胞膜上產生的電位差,根據歐姆定律,即可算出細胞膜的電阻。這類測量對於生物電產生和傳播過程的研究有重要意義。
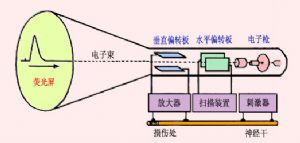
神經在接受刺激時,在受刺激的部位產生了一個可傳導的電變化,並以一定的速度傳向肌細胞或其它細胞,這一點可以用陰極射線示波器爲主的生物電測量儀器測得。上圖中由射線管右側電子槍形成的電子束連續射向熒光屏,途中經過兩對板狀的偏轉電極;當電子束由水平偏轉板兩極之間通過時,由於板上有來自掃描發生器裝置的鋸齒形電壓變化,使射向熒光屏的電子束以一定的速度作水平方向的反覆掃動;這時,如果把由兩個測量電極引導來的生物電變化經放大器放大後加到垂直偏轉板的兩極,那麼電子束在作橫掃的同時又作垂直方向的移動。這樣,根據移動電子束在熒光屏上形成的光點的軌跡,就能準確地測量出組織中的微弱電變化的強度及其隨時間變化的情況。如果神經幹在右端受到刺激,神經纖維將產生一個傳向左端的動作電位,當它傳導到同放大器相連的第一個引導電極處時,該處的電位暫時變得相對地較負,於是在一對垂直偏轉板上再現電位差,在熒光屏上可看到一次相應的光點波動;當動作電位傳導到第二個引導電極處時,該處也將變得較負,於是熒光屏上會出現另一次方向相反的光點波動;這樣記到的兩次電位波動,稱作雙相動作電位。把神經標本作一些特殊處理,如將第二個記錄電極下方的神經幹損傷,使該處不能產生興奮,那麼再刺激神經右端時,在示波器上只能看到一次電位波動,這稱爲單相動作電位。另外,用其它技術方法還可使記錄電極中的一個電極處的電位保持恆定或經常處於零電位狀態,亦即使此電極成爲參考或無關電極,於是在實驗中記錄到的電變化就只反映與另一電極(稱爲有效電極)接觸處的組織或細胞的電變化,這稱爲單極記錄法。

刺激技術 包括設計製造刺激器,使能產生所需形式和參數的刺激能量,將刺激能量施加在欲刺激的部位上,減少刺激帶來的副作用。有電、光、聲和機械等多種刺激器,其中以電刺激器用得最多。一般要求電刺激器的參數(如強度、持續時間等)有適當的變化範圍,可精細調節和穩定。方波是電刺激中最常用的波形,因爲它簡單、易於發生、控制精確、刺激量便於計算。
信號的處理和分析技術 電子計算機逐漸被廣泛應用於生理信號的處理和分析,不僅可以提高效率和測量精度,而且可以建立新的測量方法、開闢新的研究領域。常用的有自動測量、信號分析、信號提取、信號識別、信號判別及信號源定位等。
5.3 分子生物學技術
隨着細胞生物學的發展,新方法、新技術的不斷涌現,細胞研究已從細胞整體和亞細胞的超微結構水平深入到分子水平。在揭示細胞基因定位、基因表達、基因調控等細胞的遺傳機制,爲實現基因轉移、改變細胞的基因組分,分子生物學展示了其獨特的技術領域,也極大地促進了聽覺醫學的發展,如耳聾的遺傳性研究、聽毛細胞功能的分子機制,內耳幹細胞的研究等等。
聚合酶鏈反應(polymerase chain reaction,PCR)是一種快速的特定的DNA片段體外擴增技術,1985年由美國K.B.Mullis等人發明。PCR技術的基本原理是,在體外利用模板DNA、特定的寡聚核苷酸引物和耐熱DNA聚合酶(Taq酶),通過模板DNA高溫變性解鏈、低溫復性和中溫延伸過程合成一條互補的DNA鏈。反覆重複這一過程,模板DNA就可得到大量擴增。將擴增產物進行電泳,經溴化乙錠染色,在紫外燈照射下肉眼能見到擴增特異區段的DNA帶。PCR方法操作簡便,特別是自動熱循環儀(又叫DNA擴增儀)的發明,使PCR反應過程可以電腦控制,實現了自動化。PCR技術的發明雖然時間不長,但目前這一技術及其衍生的其他實驗技術在生命學科、醫學工程、遺傳工程、疾病診斷等領域已得到了廣泛的應用,Mullis也因此獲得了1993年諾貝爾化學獎。



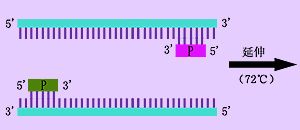
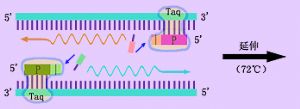
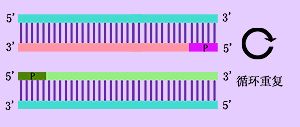
核酸分子雜交技術(nucleic acid molecular hybridization)是目前分子生物學和細胞生物學研究中廣泛應用的一種技術,是檢測RNA或DNA序列片段的主要方法。該方法首先使雙鏈的DNA解聚成兩條單鏈,然後加入用放射性核素標記的RNA或DNA序列片段(稱爲RNA或DNA探針)。在雜交液中復性劑的作用下,通過特定鹼基序列配對的互補性,標記的RNA或DNA探針和相應的RNA或DNA形成特定的雙鏈分子。即便兩條單鏈分子來自於不同的動物或品系,只要鹼基序列同源或部分同源,也會形成雙鏈分子或部分雙鏈分子。所以該過程稱爲分子雜交,形成的異質性雙鏈核酸分子稱爲雜交分子。
原位雜交(in site hybridization)是利用核酸分子雜交技術,檢測細胞內mRNA和DNA序列片段,原位研究細胞合成某種多肽或蛋白質的基因表達。如染色體原位雜交是研究遺傳基因、抗原基因、受體基因、癌基因等在染色體上的定位與表達。細胞原位雜交是研究細胞內編碼某種蛋白質的基因轉錄物mRNA在胞質內的定位與表達。原位雜交是一種簡單、直接和精確的核酸定位方法,具有極高的敏感性和特異性,已成爲當前細胞生物學和分子生物學研究的重要手段。
DNA指紋(DNA finger printing)分析技術 在人和動物的基因組中,廣泛存在着與小衛星DNA相似的另一類短小重複單位,由於這些重複單位在基因組中出現的數目和頻率不同而表現出多態性。只要用一種簡單重複順序的DNA探針,經基因組DNA的製備、DNA限制性內切酶的酶解、DNA限制性片段的凝膠電泳、Southern印跡或幹膠、標記探針、分子雜交後,就可以同時檢出許多獨立分佈的位點,爲人和動物的遺傳分析提供大量高度多態的遺傳標記。這種方法在產前診斷、人類基因製圖、腫瘤標記、骨髓移植、親子鑑定、大家系中檢測與疾病位點緊密連鎖的限制性DNA片段等方面的研究,有極廣闊的應用前景。
6 前沿與展望
6.1 毛細胞再生
內耳毛細胞喪失是導致耳聾的主要原因之一,噪音、感染和衰老等都會導致毛細胞喪失。鳥類的毛細胞可在損傷後自然再生。但哺乳動物則缺少這個能力。目前科學家們正在研究如何促進毛細胞的再生。早先,科學家通過導入人體版Hath1基因到新生大鼠的耳蝸細胞中,在試管中培養出新毛細胞,引起轟動。又據報道,日本研究人員通過導入一個早先發現爲毛細胞生長所必需的基因Math1,能成功誘導豚鼠生長出新的毛細胞。用一種經過改造無毒的病毒做載體,密歇根大學Yehoash Raphael領導的研究小組將Math1基因插入到豚鼠耳蝸的液體中,從而導致該基因的過量表達。30或60天后處死豚鼠,科學家在轉基因豚鼠中檢測到新形成的毛細胞,而在對照豚鼠中則沒有檢測到。而且,Raphael的研究小組還發現神經元向一些新毛細胞伸出了分支狀的軸突。這些研究表明,基因轉移可以成功再生成熟內耳的毛細胞。這是內耳毛細胞再生研究領域一項非常重要的進展。但是科學家也警告說,這一技術應用到耳聾病人的治療還是一個遙遠的目標。科學家還不知道新生的毛細胞功能是否安全,他們必需找到大量培養毛細胞的方法。只有等到開發出更安全、無需病毒的基因治療載體系統後才能進行人體臨牀試驗。然而,這些最新研究數據的意義重大,它表明發育基因或許可用於成熟組織中的治療。
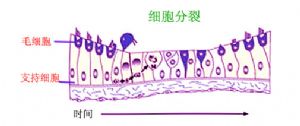

6.2 內耳幹細胞研究
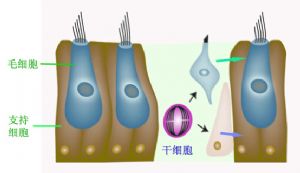
感音神經性耳聾大多是由於耳蝸毛細胞或與其相連的蝸神經元受到損害所引起。哺乳動物內耳感覺上皮不能通過自發再生來修復失去的毛細胞和神經元。然而,最近的研究發現內耳感覺上皮存在成體幹細胞,內耳幹細胞具有多潛能性,可以分化產生毛細胞、支持細胞、神經元和神經膠質細胞。另外,科學家在體外由胚胎幹細胞中獲得了內耳前體細胞。這些前體細胞表達一系列內耳毛細胞發育過程中特有的標記基因。經過體外分化後,部分胚胎幹細胞來源的前體細胞顯示出毛細胞特有的表型;將標記的胚胎幹細胞來源的內耳細胞前體移植到小雞胚胎內耳中,發現移植的前體細胞可以整合到宿主內耳上皮,並且分化爲毛細胞。還有很多研究表明成體幹細胞內耳移植後可以分化爲神經節神經元。內耳幹細胞的發現開闢了一條細胞生物學治療感音神經性耳聾的新途徑,使得應用內耳幹細胞替代損傷的內耳感覺細胞具有可觀的前景。但是,目前還有很多問題需要深入研究,如 :幹細胞移植到損傷的內耳後,這些移植細胞是否能夠整合進損傷的哺乳動物耳蝸並在正確的位置分化成爲毛細胞;新生的毛細胞是否具有功能;是否能夠和殘存的神經節神經元形成連接等,更重要的是需要證實其聽力是否得到了改善,這是幹細胞治療感音神經性耳聾的最終目標。
6.3 聽覺腦幹植入術
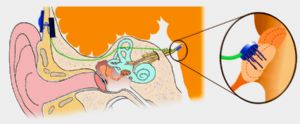
一種聽性腦幹植入(auditory Brainstem Implant,ABI)裝置可以幫助部分極重度聾患者恢復聽力。這些患者由於其聽神經的缺失或損傷,通過電子耳蝸對內耳進行電刺激是無效的。ABI裝置同電子耳蝸一樣也是由電極序列構成,但它越過耳蝸和聽神經直接刺激腦幹的聽神經核團。ABI最早是在上世紀70年代末期由洛杉磯House Ear學院的醫生和研究人員開發的。傳統的ABI技術刺激的是腦幹蝸神經腹核表面。ABI先由外部的言語處理器和接受器將聲波轉換成電脈衝的形式,然後將電脈衝傳給植入到腦幹蝸神經腹核表面的鉑制微電極陣列進行刺激。微電極序列從耳後乳突的開口處插入,伸到與蝸神經腹核相鄰的第四腦室外側隱窩。蝸神經腹核是將聲音的頻率信息按音調排列,傳到高級聽覺中樞。但遺憾的是,ABI表面電極的頻響範圍和頻率分辨率不盡如人意、ABI植入者即使經過數月乃至數年的實踐仍難以達到理解語言的程度。因此,只有實現微電極陣列深入到蝸神經腹核內部,才能進一步提高ABI的性能。新一代ABI的微電極序列刺入蝸神經腹側核中,直接刺激其神經元。研究人員在與人類具有非常相似的聽覺系統的貓身上進行的、永久性刺入式電極定位研究獲得了成功,使這種新的刺激方式成爲可能。相信刺入式微電極帶來的音調選擇性的提高,能夠提高聾人植入後的言語理解力。
6.4 耳聾蛋白質組學
基因的功能是通過其編碼蛋白質來實現的。隨着人類基因組計劃的完成,蛋白質組學已成爲一個新的研究熱點。蛋白質組學是對一個基因組或一種細胞、組織、器官所表達的全部蛋白質成分的分析。蛋白質組學分析可強有力地補充DNA測序及研究RNA表達的不足。蛋白質是生物體的效應分子,檢測蛋白質比檢測DNA及RNA更能反應機體在細胞水平的變化。目前,耳聾的分子遺傳學研究使得對內耳基因表達和聽覺相關基因有了較深入的認識。顯微解剖設備和技術的進步, 使得內耳不同部位的組織能夠被精細地分離。這些進展促進了蛋白質組學在聽覺研究領域的應用,也使感音神經性聾、梅尼埃病等疾病蛋白質組學研究得以開展。科學家應用蛋白質組學技術,已經在人體和小鼠內耳鑑定出數十種表達蛋白質,例如,Prestin蛋白在外毛細胞側壁質膜高表達,該處是外毛細胞電機械活動發生的地方,轉運的陰離子對外毛細胞的運動是必需的。Prestin蛋白通過直接電壓置換,調控外毛細胞的活動,是外毛細胞的馬達蛋白。該蛋白缺陷導致聽力敏度下降100倍以上。又如,POU3F4和POU4F3缺陷導致內耳發育障礙和畸形, 前者致鐙骨固定、外淋巴壓力增高, 後者的基因敲除小鼠無毛細胞發育、缺乏螺旋和前庭神經節。某些耳聾病理存在活性氧分子增多,氧化修飾導致蛋白質(如抗調亡蛋白質、信號傳導蛋白質、細胞骨架蛋白)功能降低, 也可能與耳聾有重要關係。
6.5 聾病基因研究
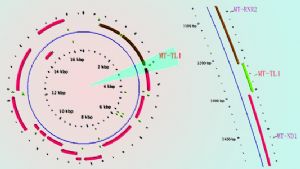
在線粒體DNA(mtDNA)上MT-TL1基因中, A3243G突變位點已經被發現與耳聾相關
上世紀90 年代以來,科學家們在破譯聽覺耳聾基因及其功能的研究方面取得了突破性的進展。聽覺基因的發現給我們展示了聽覺功能的分子奧祕。瞭解這些基因在毛細胞結構、細胞外基質、離子內環境穩態、轉錄因子等各個方面作用以及它對耳聾表型的影響,將極大地提高我們對聽覺的分子病理機制的理解。基因敲除是近年來發展和成熟起來的一項生物學新技術。通過在小鼠胚胎幹細胞基因組水平的同源重組,造成目的基因的缺失突變,可以瞭解基因失活後對發育、生長、衰老以及器官、組織或細胞結構功能的影響,從而既可確切地從整體水平研究基因功能,又可建立疾病的動物模型。軍事醫學科學院基因工程研究所用基因打靶技術研究SMADs 基因的功能方面已取得研究成果,並獨立研製基因剔除小鼠和基因敲入小鼠模型,包括SMAD3, SMAD4, SMAD5 完全基因剔除小鼠和SMAD4 條件基因剔除小鼠。SMADs 基因是最新發現的哺乳動物體內轉化生長因子-β(transfoming growth factor-β,TGF-β) 信號轉導途徑中一個重要的新基因家族。他們發現基因缺陷導致小鼠嚴重聽力障礙,並且內耳聽覺器官包括毛細胞、支持細胞和螺旋神經節等出現不同程度的損害。建立這樣的基因缺陷導致聾病的動物模型,可以作爲聽功能基因研究新的平臺,將對聽覺基因功能和聾病的分子機制研究有重要的意義,爲最終的聾病基因治療提供理論上的實驗依據。
6.6 中耳炎疫苗研究
急性中耳炎是兒童中極其普遍的一種疾病,常常繼發於呼吸道感染,由於抗生素的濫用,加上耐藥菌株的增多,抗生素的療效越來越差,對耐藥病菌有效的抗生素仍有待開發。研究表明,引起急性中耳炎發病的病原體多爲呼吸道感染的細菌和病毒,最主要的有肺炎鏈球菌、流感嗜血桿菌、莫拉卡他球菌及流感病毒等。反覆發生肺炎鏈球菌性急性中耳炎的兒童體內抗肺炎鏈球菌莢膜多糖抗體(主要是IgA, IgG2)明顯較正常低,因此可通過合適的疫苗免疫技術提高機體的抗體水平,起到防病治病的目的。疫苗的使用不但能降低中耳炎的發病率、有效地治療中耳炎,同時能減少抗生素的應用、減輕患者的經濟負擔。90年代研製出的7價肺炎鏈球菌多糖一蛋白結合疫苗是對肺炎球菌疫苗的重要突破。目前7價肺炎鏈球菌蛋白結合疫苗所包含的血清型較有限,如何使該疫苗中載體蛋白能結合更多的血清型是目前面臨的問題。對於載體蛋白的選擇目前多用是白喉類毒素、破傷風類毒素或變異白喉毒素,將肺炎鏈球菌本身的蛋白如溶血素作爲載體蛋白應是今後的研究方向。一種新的針對流感嗜血桿菌和卡他性鼻炎支原體的疫苗正在研製中。研究還表明流感疫苗最有可能起到普遍適用的預防中耳炎的作用。減少兒童中耳炎發病的一種更好的物質應是疫苗複合物,它既對細菌、又對病毒產生免疫應答,且能在嬰幼兒中應用。發展更先進的粘膜免疫技術、利用DNA技術及基因工程製備疫苗將是未來的方向。期望在不久的將來預防及治療中耳炎的疫苗能進 入兒童計劃免疫。