1 概述
頭孢拉定是β-內酰胺類抗生素,頭孢菌素類藥,爲白色或類白色結晶性粉末;微臭。屬於第一代頭孢菌素,抗菌作用與頭孢氨苄相仿。對革蘭陽性及陰性菌均有殺菌作用,在酸性條件下穩定,空腹時服用吸收迅速,不受青黴素酶的影響,對大多數產生青黴素酶的金黃色葡萄球菌和大腸埃希菌亦有顯著的抗菌活性。口服吸收好,肌肉注射後吸收較差,用於治療敏感菌所引起的呼吸道感染、生殖泌尿道感染和軟組織感染。可口服、靜脈注射給藥。口服最高量爲4g/d,嚴重感染時可靜脈注射,偶見發生血栓性靜脈炎。對青黴素過敏者用本藥應小心。過敏體質和嚴重腎功能不全者慎用。
6 藥理作用
頭孢拉定爲廣譜抗生素,作用機制與其他頭孢菌素相同,爲抑制細菌細胞壁的合成[1]。對革蘭陽性及陰性菌均有殺菌作用,在酸性條件下穩定,空腹時服用吸收迅速,不受青黴素酶的影響,對大多數產生青黴素酶的金黃色葡萄球菌和大腸埃希菌亦有顯著的抗菌活性[1]。
頭孢拉定對不產青黴素酶和產青黴素酶金黃色葡萄球菌、凝固酶陰性葡萄球菌、A組溶血性鏈球菌、肺炎鏈球菌和草綠色鏈球菌等革蘭陽性球菌的部分菌株具良好抗菌作用[2]。
厭氧革蘭陽性菌對本品多敏感,脆弱擬桿菌對本品呈現耐藥。[2]
本品對淋病奈瑟菌有一定作用,對產酶淋病奈瑟菌也具活性;對流感嗜血桿菌的活性較差。[2]
對革蘭陽性菌包括對青黴素敏感和耐藥的金黃色葡萄球菌(耐甲氧西西林金黃色葡萄球菌除外)的抗菌作用強於第二代和第三代頭孢菌素;對革蘭陰性菌的作用不及第二代頭孢菌素,更不及第三代頭孢菌素;
7 藥代動力學
頭孢拉定口服後吸收迅速,空腹口服0.5g後1小時到達血藥峯濃度(Cmax)11~18mg/L,血消除半衰期(t1/2β)爲1小時[2]。靜脈注射0.5g,5min後血藥濃度爲46μg/ml;肌內注射0.5g,1~2h後血藥濃度達峯值,爲6μg/ml。
頭孢拉定在組織體液中分佈良好,肝組織中的濃度與血清濃度相等,在心肌、子宮、肺、前列腺和骨組織中皆可獲有效濃度[2]。
腦組織中藥物濃度僅爲同期血藥濃度的5%~10%,腦脊液中濃度更低[2]。(靜脈滴注2~4g,腦脊液中濃度僅有1.2~1.5μg/ml)。
頭孢拉定可透過血一胎盤屏障進入胎兒血循環,少量經乳汁排出[2]。口服500mg,羊水中濃度約爲1.3μg/ml。
頭孢拉定血清蛋白結合率爲6%~10%[2]。半衰期約爲1h。
6小時累積排出給藥量的90%以上,少量可自膽汁排泄,後者的濃度可爲血清濃度的4倍[2]。口服0.5g後,24h尿排出量超過給藥量的99%;靜脈注射後6h,尿排出量超過給藥量的90%;肌內注射後6h,尿中排出量約爲給藥量的66%;另有少量藥物可隨膽汁排泄。
10 不良反應
頭孢拉定不良反應較輕,發生率約6%。噁心、嘔吐、腹瀉、上腹部不適等胃腸道反應較爲常見。藥疹發生率1%~3%,假膜性腸炎、嗜酸性粒細胞增多、周圍血象白細胞及中性粒細胞減少等見於個別患者。少數患者可出現暫時性血尿素氮升高,血清氨基轉移酶、血清鹼性磷酸酶一過性升高。[2]
2.消化系統:噁心、嘔吐、腹瀉和腹部不適等症狀較爲多見,偶見假膜性腸炎。
3.血液系統:少數患者用藥後可出現嗜酸粒細胞增多、白細胞總數或中性粒細胞減少等。
4.腎毒性:少數患者用藥後可出現暫時性尿素氮升高,但尚無嚴重腎臟毒性反應的報道。
11 注意事項
頭孢拉定可暫時性改變嬰兒的腸道菌羣平衡而導致腹瀉,哺乳期婦女應慎用。
(4)頭孢拉定主要經腎排出,腎功能減退者須減少劑量或延長給藥間期[2]。
(6)對一種頭孢菌素過敏者對其他頭孢菌素類藥也可能過敏。對青黴素類、青黴素衍生物過敏者也可能對頭孢菌素過敏。
(7)藥物對檢驗值或診斷的影響:(1)直接抗人球蛋白(Coombs)試驗可呈陽性反應;(2)以硫酸銅法測定尿糖可呈假陽性反應。
12 藥物相互作用
(1)與慶大黴素或阿米卡星合用,對某些敏感菌株有協同抗菌作用,但可增加腎毒性[2]。
(2)頭孢菌素可延緩苯妥英鈉在腎小管的排泄,丙磺舒可減少頭孢拉定經腎排泄[2]。
14 用法用量
14.1 口服給藥
(1)成人:
一日總量不超過4g[2]。
(2)兒童:一次6.25~12.5mg/kg,每6~8小時1次。[2]
14.2 靜脈給藥
成人:每次0.5~1g,每6小時1次,靜脈滴注或靜脈注射。每天最高量爲8g;
小兒(1週歲以上):每次12.5~25mg/kg,每6小時1次,靜脈滴注或靜脈注射。
14.3 腎功能不全時劑量
腎功能減退者須減少劑量或延長給藥間期。肌酐清除率大於每分鐘20ml時,其推薦劑量爲每6小時0.5g;肌酐清除率爲每分鐘5~20ml時,其劑量爲每6小時0.25g;肌酐清除率小於每分鐘5ml時,其劑量爲每12小時0.25g。
16 頭孢拉定中毒
頭孢拉定(頭孢環己烯、先鋒黴素Ⅵ)屬於第一代頭孢菌素,抗菌作用與頭孢氨苄相仿。口服吸收好,肌肉注射後吸收較差,血漿蛋白結合率低6%~10%,半衰期16.3h,用於治療敏感菌所引起的呼吸道感染、生殖泌尿道感染和軟組織感染。可口服、靜脈注射給藥。口服最高量爲4g/d,嚴重感染時可靜脈注射,偶見發生血栓性靜脈炎。對青黴素過敏者用本藥應小心。過敏體質和嚴重腎功能不全者慎用。[3]
1.腎功能有損傷者服用本藥,可致本藥在體內的半衰期延長,且加重腎臟損害,應避免長期、大量服用。
2.出現過敏反應時,應立即停藥,給予抗過敏治療。
17 頭孢拉定藥典標準
17.1 品名
17.1.1 中文名
17.1.2 漢語拼音
Toubaolading
17.1.3 英文名
Cefradine
17.2 結構式
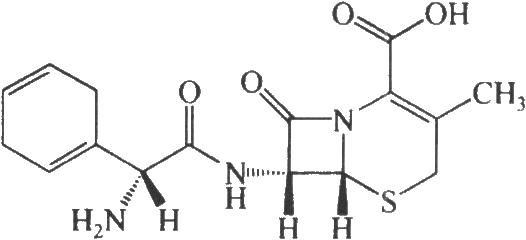
17.3 分子式與分子量
C16H19N3O4S 349.40
17.4 來源(名稱)、含量(效價)
本品爲(6R,7R)-7-[(R)-2-氨基-2-(1,4-環己烯基)乙酰氨基]-3-甲基-8-氧代-5-硫雜-1-氮雜雙環[4.2.0]辛-2-烯-2-羧酸。按無水物計算,含C16H19N3O4S不得少於90.0%。
17.5 性狀
本品爲白色或類白色結晶性粉末;微臭。
17.5.1 比旋度
取本品,精密稱定,加醋酸鹽緩衝液(取醋酸鈉1.36g,加水約50ml溶解,用冰醋酸調節pH值至4.6,加水稀釋至100ml)溶解並定量稀釋製成每1ml中約含10mg的溶液。依法測定(2010年版藥典二部附錄Ⅵ E),比旋度爲+80°至+90°。
17.6 鑑別
(1)取本品與頭孢拉定對照品適量,分別加水溶解並稀釋製成每1ml中約含6mg的溶液,作爲供試品溶液與對照品溶液。照薄層色譜法(2010年版藥典二部附錄Ⅴ B)試驗,吸取上述兩種溶液各5μl,分別點於同一硅膠G薄層板[經105℃活化後,置5% (ml/ml)正十四烷的正己烷溶液中,展開至薄層板的頂部,晾乾]上,以0.1mol/L枸櫞酸溶液-0.2mol/L磷酸氫二鈉溶液-丙酮(60:40:1.5)爲展開劑,展開,取出,於105℃加熱5分鐘,立即噴以用展開劑製成的0.1%茚三酮溶液,在105℃加熱15分鐘後,檢視。供試品溶液所顯主斑點的位置和顏色應與對照品溶液所顯主斑點的位置和顏色相同。
(2)在含量測定項下記錄的色譜圖中,供試品溶液主峯的保留時間應與對照品溶液主峯的保留時間一致。
(3)取本品適量,溶於甲醇,於室溫揮發至幹,取殘渣照紅外分光光度法(2010年版藥典二部附錄Ⅳ C)測定,本品的紅外光吸收圖譜應與對照的圖譜(《藥品紅外光譜集》722圖)一致。
以上(1)、(2)兩項可選做一項。
17.7 檢查
17.7.1 結晶性
取本品少許,依法檢查(2010年版藥典二部附錄Ⅸ D),應符合規定。
17.7.2 酸度
取本品,加水製成每1ml中含10mg的溶液,依法測定(2010年版藥典二部附錄Ⅵ H),pH值應爲3.5~6.0。
17.7.3 溶液的澄清度與顏色
取本品5份,各0.55g,分別加碳酸鈉0.15g和水5ml溶解後,溶液應澄清無色;如顯渾濁,與1號濁度標準液(2010年版藥典二部附錄Ⅸ B)比較,均不得更濃;如顯色,與黃色或黃綠色5號標準比色液(2010年版藥典二部附錄Ⅸ A第一法)比較,均不得更深(供注射用)。
17.7.4 頭孢氨苄
照含量測定項下的方法製備供試品溶液;另取頭孢氨苄對照品約20mg,精密稱定,置50ml量瓶中,加流動相約30ml超聲使溶解,再用流動相稀釋至刻度,搖勻,精密量取5ml,置50ml量瓶中,用流動相稀釋至刻度,搖勻,作爲對照品溶液。照含量測定項下的色譜條件,取對照品溶液10μl注入液相色譜儀,調節檢測靈敏度,使對照品溶液主成分色譜峯的峯高約爲滿量程的25%。精密量取供試品溶液和對照品溶液各10μl,分別注入液相色譜儀,記錄色譜圖,按外標法以峯面積計算,含頭孢氨苄按無水物計,不得過5.0%。
17.7.5 有關物質
精密稱取本品適量,加流動相溶解並定量稀釋製成每1ml中含1mg的溶液,作爲供試品溶液;精密量取適量,用流動相定量稀釋製成每1ml中含5μg的溶液,作爲對照溶液;另精密稱取頭孢氨苄、雙氫苯甘氨酸和7-氨基去乙酰氧基頭孢烷酸對照品各適量,置同一量瓶中,先加7.3%鹽酸溶液4ml,超聲使溶解,再用對照溶液定量稀釋製成每1ml中含上述3種雜質對照品各10μg的混合溶液,作爲雜質對照品溶液。照含量測定項下的色譜條件,取雜質對照品溶液20μl,注入液相色譜儀,以220nm爲檢測波長,洗脫順序依次爲:7一氨基去乙酰氧基頭孢烷酸、雙氫苯苷氨酸、頭孢氨苄和頭孢拉定,各峯之間的分離度均應符合要求。精密量取對照溶液20μl注入液相色譜儀,以254nm爲檢測波長,調節檢測靈敏度,使主成分色譜峯的峯高約爲滿量程的25%。再分別精密量取供試品溶液、雜質對照品溶液和對照溶液各20μl,分別注入液相色譜儀,先以254nm爲檢測波長測定,再以220nm爲檢測波長重新進樣,分別記錄色譜圖至主成分峯保留時間的2.5倍,供試品溶液色譜圖中如有雜質峯,除頭孢氨苄外,雙氫苯甘氨酸(220nm檢測)和7-氨基去乙酰氧基頭孢烷酸(254nm檢測)按外標法以峯面積計算,不得過1.0%;其他單個雜質(254nm檢測)峯面積不得大於對照溶液主峯面積的4倍(2.0%),其他各雜質(254nm檢測)峯面積的和不得大於對照溶液主峯面積的5倍(2.5%)。
17.7.6 頭孢拉定聚合物
照分子排阻色譜法(2010年版藥典二部附錄Ⅴ H)測定。
17.7.6.1 色譜條件與系統適用性試驗
用葡聚糖凝膠G-10 (40~120μm)爲填充劑,玻璃柱內徑1.0~1.4cm,柱長30~45cm。以pH 8.0的0.2mol/L磷酸鹽緩衝液[0.2mol/L磷酸氫二鈉溶液-0.2mol/L磷酸二氫鈉溶液(95:5)]爲流動相A,以水爲流動相B,流速爲每分鐘1.0~1.5ml,檢測波長爲254nm。量取0.2mg/ml藍色葡聚糖2000溶液100~200μl,注入液相色譜儀,分別以流動相A、B進行測定,記錄色譜圖。按藍色葡聚糖2000峯計算理論板數均不低於400,拖尾因子均應小於2.0。在兩種流動相系統中藍色葡聚糖2000峯的保留時間比值應在0.93~1.07之間,對照溶液主峯與供試品溶液中聚合物峯與相應色譜系統中藍色葡聚糖2000峯的保留時間的比值均應在0.93~1.07之間。稱取頭孢拉定約0.2g,置10ml量瓶中,加2%無水碳酸鈉溶液4ml使溶解後,加0.6mg/ml的藍色葡聚糖2000溶液5ml,用水稀釋至刻度,搖勻。量取100~200μl注入液相色譜儀,用流動相A進行測定,記錄色譜圖。高聚體的峯高與單體與高聚體之間的谷高比應大於2.0。另以流動相B爲流動相,精密量取對照溶液100~200μl,連續進樣5次,峯面積的相對標準偏差應不大於5.0%。(對照溶液進行測定前,先用含0.2mol/L氫氧化鈉與0.5mol/L氯化鈉的混合溶液200~400ml沖洗凝膠柱,再用水沖洗至中性。)
17.7.6.2 對照溶液的製備
取頭孢拉定對照品適量,精密稱定,加水溶解並定量稀釋製成每1ml中約含頭孢拉定10μg的溶液。
17.7.6.3 測定法
取本品約0.2g,精密稱定,置10ml量瓶中,加2%無水碳酸鈉溶液4ml,使溶解後,用水稀釋至刻度,搖勻。立即精密量取100~200μl注入液相色譜儀,以流動相A爲流動相進行測定,記錄色譜圖。另精密量取對照溶液100~200μl注入液相色譜儀,以流動相B爲流動相進行測定,記錄色譜圖。按外標法以峯面積計算,含頭孢拉定聚合物以頭孢拉定計不得過0.05%。
17.7.7 2-萘酚
照高效液相色譜法(2010年版藥典二部附錄V D)測定。
17.7.7.1 色譜條件與系統適用性試驗
用十八烷基硅烷鍵合硅膠爲填充劑;以甲醇一水(55:45)爲流動相,流速爲每分鐘1ml,檢測波長爲225nm。取對照品溶液20ul注入液相色譜儀,調節流動相中甲醇比例使2一萘酚峯的保留時間約爲7分鐘,理論板數按2一萘酚峯計算不少於3000,2一萘酚峯與相鄰峯的分離度應不小於1.5。
17.7.7.2 測定法
取本品適量,精密稱定,加流動相溶解並定量稀釋製成每1ml中約含頭孢拉定10mg的溶液,充分振搖,過濾,取續濾液作爲供試品溶液;另取2一萘酚對照品適量,精密稱定,加流動相溶解並定量稀釋製成每1ml中約含2一萘酚0.5ug的溶液,作爲對照品溶液,精密量取上述兩種溶液各20ul,分別注入液相色譜儀,記錄色譜圖。按外標法以峯面積計簋,含2一蓁酚的量不得討0.05%(供口服制劑用)或不得討0.0025%(供注射用)。[4]
17.7.8 水分
取本品,照水分測定法(2010年版藥典二部附錄Ⅷ M第一法 A)測定,含水分不得過6.0%。
17.7.9 熾灼殘渣
取本品1.0g,依法檢查(2010年版藥典二部附錄Ⅷ N),遺留殘渣不得過0.2%。
17.7.10 重金屬
取熾灼殘渣項下遺留的殘渣,依法檢查(2010年版藥典二部附錄Ⅷ H第二法),含重金屬不得過百萬分之二十。
17.7.11 可見異物
取本品5份,每份各2.0g,加3.0%精氨酸溶液(經0.45μm濾膜濾過)溶解後[4],依法檢查(2010年版藥典二部附錄Ⅸ H),應符合規定(供注射用)。
17.7.12 不溶性微粒
取本品3份,各2.0g,加3.0%精氨酸溶液(經0.45μm濾膜濾過)製成每1ml中含50mg的溶液[4],依法檢查(2010年版藥典二部附錄Ⅸ C),每1g樣品中含10μm以上的微粒不得過6000粒,含25μm以上的微粒不得過600粒(供注射用)。
17.7.13 細菌內毒素
取本品,2.6%無內毒素碳酸鈉溶液使溶解,依法檢查(2010年版藥典二部附錄Ⅺ E),每1mg頭孢拉定中含內毒素的量應小於0.20EU(供注射用)。
17.7.14 無菌
取本品,用2.6%無菌碳酸鈉溶液溶解後,轉移至不少於500ml的0.9%無菌氯化鈉溶液中,用薄膜過濾法處理後,依法檢查(2010年版藥典二部附錄Ⅺ H),應符合規定(供注射用)。
17.8 含量測定
照高效液相色譜法(2010年版藥典二部附錄Ⅴ D)測定。
17.8.1 色譜條件與系統適用性試驗
用十八烷基硅烷鍵合硅膠爲填充劑;水-甲醇-3.86%醋酸鈉溶液-4%醋酸溶液(1564:400:30:6)爲流動相;流速爲每分鐘0.7~0.9ml;檢測波長爲254nm。取頭孢拉定對照品溶液10份和頭孢氨苄對照品貯備液(0.4mg/ml)l份,混勻,取10μl注入液相色譜儀,記錄色譜圖,頭孢拉定峯和頭孢氨苄峯的分離度應符合要求。
17.8.2 測定法
取本品約70mg,精密稱定,置100ml量瓶中,加流動相約70ml超聲使溶解,再用流動相稀釋至刻度,搖勻,精密量取10μl注入液相色譜儀,記錄色譜圖;另取頭孢拉定對照品溶液,同法測定。按外標法以峯面積計算,即得。
17.9 類別
β-內酰胺類抗生素,頭孢菌素類。
17.10 貯藏
17.11 製劑
(1)頭孢拉定幹混懸劑 (2)頭孢拉定片 (3)頭孢拉定膠囊 (4)頭孢拉定顆粒 (5)注射用頭孢拉定
17.12 版本
《中華人民共和國藥典》2010年版
18 注射用頭孢拉定藥典標準
18.1 品名
18.1.1 中文名
18.1.2 漢語拼音
Zhusheyong Toubaolading
18.1.3 英文名
Cefradine for Injection
18.2 來源(名稱)、含量(效價)
本品爲頭孢拉定加適量助溶劑精氨酸製成的無菌粉末。按無水、無精氨酸物計算,含頭孢拉定(C16H19N3O4S)不得少於90.0%;按平均含量計算,含頭孢拉定(C16H19N3O4S)應爲標示量的95.0%~115.0%[4]。
18.3 性狀
本品爲白色或類白色粉末。
18.4 鑑別
在含量測定項下記錄的色譜圖中,供試品溶液主峯的保留時間應與對照品溶液主峯的保留時間一致。
18.5 檢查
18.5.1 鹼度
取本品,加水製成每1ml中含頭孢拉定0.1g的溶液,依法測定(2010年版藥典二部附錄Ⅵ H),pH值應爲8.0~9.6。
18.5.2 溶液的澄清度與顏色
取本品5瓶,按標示量分別加水製成每1ml中含頭孢拉定0.1g的溶液,溶液應澄清無色;如顯渾濁,與1號濁度標準液(2010年版藥典二部附錄Ⅸ B)比較,均不得更濃;如顯色,與黃色或黃綠色8號標準比色液(2010年版藥典二部附錄Ⅸ A第一法)比較,均不得更深。
18.5.3 頭孢氨苄
取本品的內容物,混合均勻,精密稱取適量,加流動相溶解並定量稀釋製成每1ml中含頭孢拉定0.7mg的溶液,作爲供試品溶液;另取頭孢氨苄對照品約20mg,精密稱定,置50ml量瓶中,加水溶解並稀釋至刻度,搖勻,精密量取5ml,置50ml量瓶中,用水稀釋至刻度,搖勻,作爲對照品溶液。照頭孢拉定項下的方法測定,含頭孢氨苄不得過頭孢拉定和頭孢氨苄總量的6.0%。
18.5.4 有關物質
取本品的內容物,混合均勻,精密稱取適量,加流動相溶解並定量稀釋製成每1ml中含頭孢拉定1mg的溶液,作爲供試品溶液。照頭孢拉定項下的方法測定,檢測波長爲254nm。供試品溶液色譜圖中如有雜質峯,除頭孢氨苄外,7-氨基去乙酰氧基頭孢烷酸按外標法以峯面積計算,不得過1.0%;其他單個雜質峯面積不得大於對照溶液主峯面積的5倍(2.5%),其他各雜質峯面積的和不得大於對照溶液主峯面積的6倍(3.0%)。
18.5.5 水分
取本品,照水分測定法(2010年版藥典二部附錄Ⅷ M第一法 A)測定,含水分不得過5.0%。
18.5.6 含量均勻度
以含量測定項下測得的每瓶頭孢拉定含量計算,應符合規定(2010年版藥典二部附錄Ⅹ E)。
18.5.7 不溶性微粒
取本品,按標示量加微粒檢查用水製成每1ml中含50mg的溶液,依法檢查(2010年版藥典二部附錄Ⅸ C),標示量爲1.0g以下的折算爲每1g樣品中含10μm以上的微粒不得過6000個,含25μm以上的微粒不得過600個。標示量爲1.0g以上(包括1.0g)的每個供試品容器中含10μm以上的微粒不得過6000個,含25μm以上的微粒不得過600個。
18.5.8 細菌內毒素
取本品,依法檢查(2010年版藥典二部附錄Ⅺ E),每1mg頭孢拉定中含內毒素的量應小於0.20EU。
18.5.9 無菌
取本品,用適當溶劑溶解後轉移至不少於500ml的0.9%無菌氯化鈉溶液中,用薄膜過濾法處理後,依法檢查(2010年版藥典二部附錄Ⅺ H),應符合規定。
18.5.10 其他
應符合注射劑項下有關的各項規定(2010年版藥典二部附錄Ⅰ B)。
18.6 含量測定
照高效液相色譜法(2010年版藥典二部附錄Ⅴ D)測定。
18.6.1 色譜條件與系統適用性試驗
用十八烷基硅烷鍵合硅膠爲填充劑;以含0.027mol/L辛烷磺酸鈉的0.027mol/L磷酸氫二鈉溶液(用磷酸調節pH值至8.0)-甲醇(75:25)爲流動相;檢測波長爲206nm。取頭孢拉定對照品約30mg、精氨酸對照品約15mg與頭孢氨苄對照品5mg,置100ml量瓶中,加水溶解並稀釋至刻度,搖勻。取10μl注入液相色譜儀,記錄色譜圖頭孢氨苄峯、頭孢拉定峯和精氨酸峯之間的分離度均應符合要求。
18.6.2 測定法
取本品10瓶,分別加水溶解並定量稀釋製成每1ml中含頭孢拉定0.3mg的溶液,精密量取10μl注入液相色譜儀,記錄色譜圖;另取頭孢拉定對照品約30mg與精氨酸對照品約15mg,精密稱定,置100ml量瓶中,加水溶解並稀釋至刻度,搖勻,同法測定。按外標法以峯面積計算每瓶中C16H19N3O4S的含量。並求出10瓶的平均含量。另精密稱取本品內容物適量,加水溶解並定量稀釋製成每1ml中含頭孢拉定0.3mg的溶液,同法測定,按外標法以峯面積計算供試品中C16H19N3O4S和C6H14N4O2的含量。
18.7 類別
β-內酰胺類抗生素,頭孢菌素類。
18.8 規格
(1)0.5g (2)1.0g (3)2.0g
18.9 貯藏
密閉,在涼暗處保存。
18.10 版本
《中華人民共和國藥典》2010年版
19 頭孢拉定幹混懸劑藥典標準
19.1 品名
19.1.1 中文名
19.1.2 漢語拼音
Toubaolading Ganhunxuanji
19.1.3 英文名
Cefradine for Suspension
19.2 含量或效價規定
本品含頭孢拉定(C16H19N3O4S)應爲標示量的90.0%~120.0%。
19.3 性狀
本品爲加矯味劑的粉末;氣芳香,味甜。
19.4 鑑別
取本品,照頭孢拉定項下的鑑別(1)或(2)項試驗,顯相同的結果。
19.5 檢查
19.5.1 酸度
取本品,加水製成每1ml中含頭孢拉定25mg的混懸液,依法測定(2010年版藥典二部附錄Ⅵ H),pH值應爲3.5~6.0。
19.5.2 沉降體積比
取本品,按服用時的比例,加水用力振搖1分鐘,靜置45分鐘,應符合規定(2010年版藥典二部附錄Ⅰ O)(供多劑量用)。頭孢氨苄 取本品,照含量測定項下的方法製備供試品溶液,照頭孢拉定項下的方法檢查,含頭孢氨苄不得過頭孢拉定和頭孢氨苄總量的6.0%。
19.5.3 水分
取本品,照水分測定法(2010年版藥典二部附錄Ⅷ M第一法 A)測定,含水分不得過1.5%。
19.5.4 溶出度
取本品或精密稱取本品(多劑量)適量(約相當於頭孢拉定0.25g),照溶出度測定法(2010年版藥典二部附錄Ⅹ C第二法),以0.1mol/L鹽酸溶液900ml爲溶出介質,轉速爲每分鐘50轉,依法操作,30分鐘時,取溶液適量,濾過,精密量取續濾液適量,用0.1mol/L鹽酸溶液定量稀釋製成每1ml中約含頭孢拉定28μg的溶液,作爲供試品溶液;另取頭孢拉定對照品適量,精密稱定,加0.1mol/L鹽酸溶液溶解並定量稀釋製成每1ml中約含頭孢拉定28μg的溶液,作爲對照品溶液。照頭孢拉定含量測定項下的方法測定,按外標法以峯面積計算每份供試品的溶出量。限度爲標示量的80%,應符合規定。
19.5.5 其他
應符合口服混懸劑項下有關的各項規定(2010年版藥典二部附錄Ⅰ O)。
19.6 含量測定
取裝量或重量差異項下的內容物,混合均勻,精密稱取適量(約相當於頭孢拉定70mg),置100ml量瓶中,加流動相約70ml超聲使頭孢拉定溶解,再用流動相稀釋至刻度,搖勻,濾過,取續濾液,照頭孢拉定項下的方法測定,即得。
19.7 類別
β-內酰胺類抗生素,頭孢菌素類。
19.8 規格
(1)0.125g (2)0.25g (3)1.5g (4)3.0g
19.9 貯藏
19.10 版本
《中華人民共和國藥典》2010年版
20 頭孢拉定膠囊藥典標準
20.1 品名
20.1.1 中文名
20.1.2 漢語拼音
Toubaolading Jiaonang
20.1.3 英文名
Cefradine Capsules
20.2 含量或效價規定
本品含頭孢拉定(C16H19N3O4S)應爲標示量的90.0%~110.0%。
20.3 性狀
本品內容物爲白色至淡黃色粉末或顆粒。
20.4 鑑別
取本品的內容物,照頭孢拉定項下的鑑別(1)或(2)項試驗,顯相同的結果。
20.5 檢查
20.5.1 頭孢氨苄
精密稱取本品內容物適量,照含量測定項下的方法製備供試品溶液,照頭孢拉定項下的方法測定,含頭孢氨苄不得過頭孢拉定和頭孢氨苄總量的6.0%。
20.5.2 有關物質
取裝量差異項下的內容物,混合均勻,精密稱取適量,加流動相溶解並定量稀釋製成每1ml中含頭孢拉定1mg的溶液,作爲供試品溶液。照頭孢拉定項下的方法測定,檢測波長爲254nm。供試品溶液色譜圖中如有雜質峯,除頭孢氨苄外,7-氨基去乙酰氧基頭孢烷酸按外標法以峯面積計算,不得過1.0%;其他單個雜質峯面積不得大於對照溶液主峯面積的5倍(2.5%),其他各雜質峯面積的和不得大於對照溶液主峯面積的6倍(3.0%)。
20.5.3 水分
取本品,照水分測定法(2010年版藥典二部附錄Ⅷ M第一法 A)測定,含水分不得過7.0%。
20.5.4 溶出度
取本品,照溶出度測定法(2010年版藥典二部附錄Ⅹ C第一法),以0.1mol/L鹽酸溶液900ml爲溶出介質,轉速爲每分鐘100轉,依法操作,45分鐘時,取溶液適量,濾過,精密量取續濾液適量,用溶出介質定量稀釋製成每1ml中約含25μg的溶液,照紫外-可見分光光度法(2010年版藥典二部附錄Ⅳ A),在255nm的波長處測定吸光度;另取裝量差異項下的內容物,混合均勻,精密稱取適量(相當於平均裝量),按標示量加溶出介質溶解並定量稀釋製成每1ml中含25μg的溶液,濾過,取續濾液,同法測定,計算每粒的溶出量。限度爲80%,應符合規定。
20.5.5 其他
應符合膠囊劑項下有關的各項規定(2010年版藥典二部附錄Ⅰ E)。
20.6 含量測定
取裝量差異項下的內容物,混合均勻,精密稱取細粉適量(約相當於頭孢拉定70mg),置100ml量瓶中,加流動相70ml超聲15分鐘,再振搖10分鐘,使頭孢拉定溶解,再用流動相稀釋至刻度,搖勻,濾過,取續濾液,照頭孢拉定項下的方法測定,即得。
20.7 類別
β-內酰胺類抗生素,頭孢菌素類。
20.8 規格
(1)0.125g (2)0.25g (3)0.5g
20.9 貯藏
20.10 版本
《中華人民共和國藥典》2010年版
21 頭孢拉定顆粒藥典標準
21.1 品名
21.1.1 中文名
21.1.2 漢語拼音
Toubaolading Keli
21.1.3 英文名
Cefradine Granules
21.2 含量或效價規定
本品含頭孢拉定(C16H19N3O4S)應爲標示量的90.0%~110.0%。
21.3 性狀
本品爲可溶顆粒或混懸顆粒;氣芳香,味甜。
21.4 鑑別
取本品,照頭孢拉定項下的鑑別(1)或(2)項試驗,顯相同的結果。
21.5 檢查
21.5.1 酸度
取本品,加水製成每1ml中含頭孢拉定25mg的混懸液,依法測定(2010年版藥典二部附錄Ⅵ H),pH值應爲3.5~6.0。
21.5.2 頭孢氨苄
取本品,照含量測定項下的方法製備供試品溶液,照頭孢拉定項下的方法檢查,含頭孢氨苄不得過頭孢拉定和頭孢氨苄總量的6.0%。
21.5.3 水分
取本品,照水分測定法(2010年版藥典二部附錄Ⅷ M第一法 A)測定,含水分不得過1.5%。
21.5.4 溶出度
取本品,照溶出度測定法(2010年版藥典二部附錄Ⅹ C第二法),以0.1mol/L鹽酸溶液900ml爲溶出介質,轉速爲每分鐘50轉,依法操作,45分鐘時,取溶液適量,濾過,精密量取續濾液適量,用0.1mol/L鹽酸溶液定量稀釋製成每1ml中約含頭孢拉定28μg的溶液,作爲供試品溶液;另取頭孢拉定對照品適量,精密稱定,加0.1mol/L鹽酸溶液溶解並定量稀釋製成每1ml中約含頭孢拉定28μg的溶液,作爲對照品溶液。照頭孢拉定含量測定項下的方法測定,按外標法以峯面積計算每袋的溶出量。限度爲標示量的80%,應符合規定。
21.5.5 其他
應符合顆粒劑項下有關的各項規定(2010年版藥典二部附錄Ⅰ N)。
21.6 含量測定
取裝量差異項下的內容物,研細,混合均勻,精密稱取細粉適量(約相當於頭孢拉定70mg),置100ml量瓶中,加流動相70ml超聲15分鐘,再振搖10分鐘,使頭孢拉定溶解,再用流動相稀釋至刻度,搖勻,濾過,取續濾液,照頭孢拉定項下的方法測定,即得。
21.7 類別
β-內酰胺類抗生素,頭孢菌素類。
21.8 規格
(1)0.125g (2)0.25g
21.9 貯藏
21.10 版本
《中華人民共和國藥典》2010年版
22 頭孢拉定片藥典標準
22.1 品名
22.1.1 中文名
22.1.2 漢語拼音
Toubaolading Pian
22.1.3 英文名
Cefradine Tablets
22.2 含量或效價規定
本品含頭孢拉定(C16H19N3O4S)應爲標示量的90.0%~110.0%。
22.3 性狀
本品爲薄膜衣片,除去包衣後顯類白色或微黃色。
22.4 鑑別
取本品的細粉適量,照頭孢拉定項下的鑑別(1)或(2)項試驗,顯相同的結果。
22.5 檢查
22.5.1 頭孢氨苄
精密稱取本品的細粉適量,照含量測定項下的方法製備供試品溶液,照頭孢拉定項下的方法測定,含頭孢氨苄不得過頭孢拉定和頭孢氨苄總量的6.0%。
22.5.2 有關物質
取本品10片,精密稱定,研細,精密稱取適量,加流動相溶解並定量稀釋製成每1ml中含頭孢拉定1mg的溶液,作爲供試品溶液。照頭孢拉定項下的方法測定,檢測波長爲254nm。供試品溶液色譜圖中如有雜質峯,除頭孢氨苄外,7-氨基去乙酰氧基頭孢烷酸按外標法以峯面積計算,不得過1.0%;其他單個雜質峯面積不得大於對照溶液主峯面積的5倍(2.5%),其他各雜質峯面積的和不得大於對照溶液主峯面積的6倍(3.0%)。
22.5.3 水分
取本品,照水分測定法(2010年版藥典二部附錄Ⅷ M第一法 A)測定,含水分不得過6.0%。
22.5.4 溶出度
取本品,照溶出度測定法(2010年版藥典二部附錄Ⅹ C第二法),以0.12mol/L鹽酸溶液900ml爲溶出介質,轉速爲每分鐘75轉,依法操作,60分鐘時,取溶液適量,濾過,精密量取續濾液適量,用溶出介質定量稀釋製成每1ml中約含頭孢拉定25μg的溶液,照紫外-可見分光光度法(2010年版藥典二部附錄Ⅳ A),在255nm的波長處測定吸光度;另取本品10片,研細,精密稱取適量(相當於平均片重),按標示量加溶出介質溶解並定量稀釋製成每1ml中約含頭孢拉定25μg的溶液,濾過,取續濾液,同法測定,計算每片的溶出量。限度爲85%,應符合規定。
22.5.5 其他
應符合片劑項下有關的各項規定(2010年版藥典二部附錄Ⅰ A)。
22.6 含量測定
取本品10片,精密稱定,研細,精密稱取適量(約相當於頭孢拉定70mg),置100ml量瓶中,加流動相70ml超聲15分鐘,再振搖10分鐘,使頭孢拉定溶解,用流動相稀釋至刻度,搖勻,濾過,取續濾液,照頭孢拉定項下的方法測定,即得。
22.7 類別
β-內酰胺類抗生素,頭孢菌素類。
22.8 規格
(1)0.25g (2)0.5g
22.9 貯藏
22.10 版本
《中華人民共和國藥典》2010年版