7 概述
腸扭轉手術用於腸梗阻的手術治療。 小腸扭轉是一種嚴重的腸梗阻情況。它將導致部分腸繫膜血管或全腸繫膜血管阻塞而有部分或全部小腸壞死。因此,應急速解除扭轉恢復腸繫膜血管的循環。小腸扭轉的病例除有腸梗阻的症狀外,因有腸繫膜血管堵塞尚有早期休克症狀。
8 小腸相關解剖
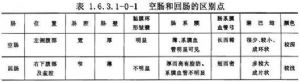
小腸係指胃幽門至盲腸間的腸管,含十二指腸,空腸與迴腸。空腸與迴腸是小腸的主要部分,通稱小腸。空腸與迴腸是腹腔中面積最大,高度活動的器官。起始於Treitz韌帶(十二指腸空腸曲)盤曲於中腹部與下腹部,部分爲大網膜及結腸所覆蓋。若患者無腹部手術史,手術時從左上腹取出的小腸多爲空腸,從盆腔取出者多半爲迴腸。空腸與迴腸間無明顯的分界線,但在結構上有若干區別點(表1.6.3.1-0-1)。手術時,可藉助這些區別點,辨認空、迴腸。腸管有一定的伸縮性,故在活體與標本測量的長度不一致。一般測量的結果是空、迴腸長6m。現在認爲最適合的方法是從鼻放置細聚乙烯管讓其自然到達回盲部,測量其長度。用此方法測得空、迴腸的長度爲2.6m。小腸上部的2/5爲空腸,下部3/5爲迴腸。
小腸系膜甚寬,附着於第2腰椎左側腹後壁,向右斜行至右骶髂關節之下。腸繫膜內含有血管、神經、淋巴管、淋巴結及脂肪。腸繫膜附着部能防止扭轉,影響循環。手術時,根據系膜的走向能辨別遊離腸段的近、遠端。腸繫膜根部至腸緣的距離在小腸起始部爲最短,末端迴腸部亦較短,而跨過脊柱的部分爲最長,一般不超過20~25cm。
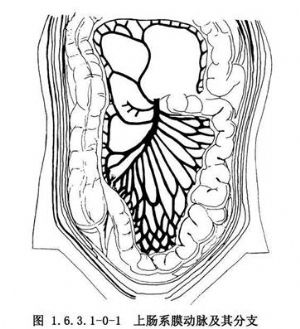
小腸的血供來自上腸繫膜動脈,它是腹主動脈的第2個大分支。上腸繫膜動脈自胰腺的鉤狀突部穿出,跨過十二指腸第3段,進入小腸系膜根部,然後分出右結腸動脈,回結腸動脈和10~20個小動脈分支(圖1.6.3.1-0-1)。前2支動脈經腹膜後或系膜根部供應升結腸、盲腸及末端迴腸。因此,當腸繫膜上動脈損傷或梗死時,隨損害部分的高低可引起空腸、迴腸、在半結腸或部分空腸、迴腸的缺血壞死。
小腸動脈分支位於小腸系膜內,形成吻合網(動脈弓),再由動脈弓分出直支到達腸壁內。小腸上部系膜動脈弓僅一個(初級弓),直支較長,周圍脂肪較少,愈向遠端小腸動脈弓愈多。由初級弓分出動脈支吻合爲2級、3級弓,動脈直支較短(圖1.6.3.1-0-2)。系膜內脂肪亦較多。在腸繫膜緣,血管又再分支。腸管壁的血管與環形肌層平行走行,先後穿過漿膜,肌層和黏膜下層。主要的動脈分支與直支被破壞後,這些血管供應的腸管便易發生壞死。

小腸靜脈的分佈與動脈大致相同。最後匯合成爲腸繫膜上靜脈。它與上動脈並行,在胰頸的後方與脾靜脈匯合形成門靜脈。腸繫膜上靜脈損傷或發生栓塞時,也可致小腸靜脈充血、壞死和腹膜炎。
小腸腸壁分爲漿膜、肌肉和黏膜3層。肌肉又分爲外層縱肌和內層環肌。黏膜下層爲較強的彈力纖維與結締組識。不論用哪種方式縫合腸壁,縫線必需通過這一層。
小腸黏膜下層有聚合淋巴結與淋巴板(Peyer’s patches),尤以迴腸部爲多。小腸部的淋巴流入腸壁、鄰近血管弓部與上腸繫膜動脈主幹部等3個部位的淋巴結,然後進入乳糜池。
小腸的主要生理功能是消化和吸收。除胰液、膽液及胃液等可繼續在小腸內起消化作用外,小腸黏膜腺體也能分泌含有多種酶的鹼性腸液。其中主要的是多肽酶(腸肽酶)。它能將多肽變爲可由腸黏膜吸收的氨基酸。食糜在小腸內分解爲葡萄糖、氨基酸、脂肪酸後,即被小腸黏膜吸收。小腸黏膜上有很多絨毛。每一個絨毛被柱狀上皮細胞多層覆蓋,含有一個毛細血管襻和淋巴管(乳糜管),因而使吸收面積大爲增加,構成近10萬m2的吸收面積。葡萄糖、氨基酸及40%脂肪酸系由毛細血管吸收,經過門靜脈到達肝內。其餘60%脂肪酸則由乳糜管吸收,到達乳糜池及胸導管內。除食物外,胃液、膽液、胰液,腸液內的電解質,以及攝入的大量電解質也在小腸內被吸收進入血液循環。小腸被大量切除後,營養的吸收將受到影響。吸收最差的是脂肪,其次是蛋白質。碳水化合物是易被吸收的營養物質。根據臨牀實踐,空腸與迴腸保留100cm以上,並有回盲部,經過機體的代償,仍能維持營養的消化,吸收。末段迴腸對蛋白質、脂肪、碳水化合物有良好的吸收功能,並具有對某些微量物質(銅、維生素B12)與膽汁的特定吸收功能。因此,大量小腸切除後,雖然切除的長度相當,但營養不良在迴腸被切除的病例較爲明顯。
小腸是產生免疫球蛋白的場所,特別是IgA。一般認爲它由laminal propria的血漿細胞產生。
小腸也可以產生縮膽素(cholecys tokinin)、促胰酶素(pancreozymin)、腸高糖素(enteroglucagon)、腸血管活性肽(VIP vasoactive intestinal peptide)、胃抑制多肽(GIP gastric inhibitory polypetide)、生長抑素(somatostatin)等物質。這些物質直接影響消化系統其他器官如膽囊、胰腺等的功能。
腸黏膜尚具有屏障功能,能阻擋腸腔內細菌、毒素越過腸壁進入淋巴系統或門靜脈內。
小腸由自主神經系統支配。交感神經纖維自第9、第10脊髓節分出,進入上腸繫膜神經節。節後神經伴隨腸繫膜上動脈進入小腸。副交感神經節前纖維通過迷走神經與腸內神經叢的神經元相接。刺激副交感神經,則增加腸管之張力和運動及腸腺分泌。刺激交感神經,則腸管之張力鬆弛,運動受抑制,且血管收縮。腸內神經包括腸肌內Auerbach神經叢和黏膜下Meissner神經叢兩部分。刺激腸肌叢部分使腸管平滑肌收縮,刺激黏膜下叢部分抑制平滑肌。
小腸的肌肉有節段性收縮和蠕動兩種運動型式。前者是局部周徑收縮。上段小腸每分鐘約收縮9次,遠段小腸每分鐘收縮11次。這一動作使腸內容物得到攪拌,使之與更大範圍的黏膜相接觸。蠕動爲小腸自上而下的收縮,每分鐘1或2次,1次數釐米。在消化吸收過程,小腸有自上而下的環形收縮,起自胃或十二指腸,每分鐘推移6~8cm,每次持續4~5min。小腸的運動受肌漿蛋白因子(myogentic factor)、神經原性因子(neurogenic factor)與內分泌因子(hormonal factors)的調控。
綜上所述,小腸是人體吸收營養的主要器官,它具有極其強大的代償功能。儘管如此,外科醫師在處理小腸病變時,仍應考慮到這些功能的重要性,要儘量保留可保留的腸管。
9 適應症
腸梗阻可因粘連束帶、扭轉、套疊、腸管病變、狹窄、腸內異物、腫瘤等引起。可以是急性發作也可以是慢性發作。梗阻可以是完全性的,也可以是部分性的。當經非手術治療無效或出現腹膜炎症狀時爲解除梗阻,可以根據梗阻的程度與腸襻的血運情況,採用不同的手術方式。術前應對病人的重要器官功能及內穩態的情況進行檢查:如有器官功能嚴重障礙,宜先行糾正,慎重考慮手術的時機。
10 術前準備
腸梗阻病人常因嘔吐、胃腸減壓、不能進食而有內穩態失衡,慢性腸梗阻病人更可能有營養不良。因此,在術前應對內穩態進行調整使之恢復正常,即使在急性梗阻的情況下也應做這方面的處理。在慢性梗阻病人則更可以進行較全面的檢查與治療,且可對營養狀態加以調理,改善病人的營養狀態。應用腸外營養支持可獲得滿意的效果。
由於水、電解質與酸鹼紊亂以及營養不良,尤其是那些病程較長的慢性腸梗阻病人,術前應對肝、腎功能進行監測、處理。防止手術而加重這些器官的損害。
12 手術步驟
進入腹腔後即可見腸襻呈瘀血狀且有血性腹水。此時,可以左手提起一段腸襻,右手循系膜向系膜根部探查。從橫結腸系膜根部或下腹部找到扭轉的系膜根部。辨清扭轉的方向,確定順鐘向還是逆鐘向。一般逆鐘向多於順鐘向。辨認清楚後,將整個小腸向扭轉的相反方向恢復(圖1.6.3.1-1)。可以是180°~720°扭轉。復位後,應判斷腸管是否仍有生機。

13 術中注意要點
小腸扭轉復位及處理後,小腸的循環將有所恢復,但腸管是否仍有生機,有時甚難判斷,需要反覆處理及觀察。一般可根據下述幾點來判定腸管的生機:①腸管及系膜有無嚴重淤血及出血點;②腸漿膜層的色澤是否正常;③有無腸蠕動存在;④系膜靜脈有無血栓;⑤系膜動脈及腸緣動脈有無搏動;⑥腹腔內有無臭味。其中動脈搏動是重要的標誌。如有可疑,可在腸繫膜根部或腸繫膜的較大分支部用普魯卡因、苄胺唑啉或罌粟鹼注射解除血管痙攣,恢復動脈搏動。當腸管循環存在時,病人吸入純氧後,腸管的顏色能很快地由發紺轉爲紅色。若有準備,亦可在動脈注射熒光素,再用紫外線燈照射,可估計血液灌注的範圍。多普勒超聲儀也可用來檢測該區域腸繫膜動脈供血的情況。
經觀察證實全部小腸的血運已恢復,可吸淨腹腔內的滲液並以溫等滲鹽水清洗。這些滲液中含有大量細菌與毒素,清除後可減輕機體因吸收這些毒素而產生的症狀。其後,仔細觀察與檢查腸管是否還有區域性壞死或是損破,若有,則可給予切除,修補等相應處理。處理完善後,腹腔內放置引流。全小腸扭轉在復位後雖恢復了血液循環,但應考慮到腸黏膜不能耐受缺血,時間稍長(>6h)即可產生壞死脫落。因此,在那些發病時間較長的病人,除術後對腹部嚴密觀察外,還應考慮在24h後進行二次觀察剖腹探查術(second-look laporotomy)。如有腸管出現延遲性壞死,可再做切除或曠置造口術。
局部節段性小腸壞死可做部分切除吻合,切除線應在肯定的健康腸管組織上。血循環有障礙的腸管切除得不夠將導致術後發生吻合口瘻等嚴重併發症。但是,過多地切除小腸則會影響病人日後營養的消化與吸收功能出現短腸綜合徵。需要術者認真判斷腸切除的範圍。
小腸扭轉可以是全小腸扭轉,也可以是以部分粘着的小腸爲軸而扭轉,還有的是腹腔內有間隙、內疝,小腸進入後扭轉。在這些情況下,除解除扭轉外還應消除這些造成扭轉的原因。
14 術後處理
腸扭轉手術術後做如下處理:
小腸扭轉有腸管的阻塞,也有腸繫膜血管的阻塞。其病理生理改變遠較單純的腸管阻塞爲嚴重。有明顯的內穩態紊亂,腹腔內滲出液多,細菌與毒素進入腹膜腔的量大,易造成腹膜炎。故術後應重視水、電解質、酸鹼平衡的糾正,輸入膠體以維持膠體滲透壓。必要時可給予腎上腺皮質激素,減輕機體的應激狀態。
腹腔內放置引流,特別是雙套管負壓引流以減少腹膜炎的發生。腸梗阻、腸血循環障礙都是腸細菌易位的誘因,可以引起腸源性感染。術後加強廣譜抗生素與抗厭氧菌藥物的應用實爲必要。
腸缺血時間稍長後,腸黏膜將壞死成潰瘍、出血。有時出血量甚多,可造成休克,且多在術後2周左右出現。除觀察外,可給予腸外營養使腸道休息。亦可給予生長抑素(somatostatin)等控制胃腸液的分泌,減少消化液對屏障已被損壞的黏膜的再一步損害。
對腸管缺血時間長的病人,應考慮做小腸外置造口,既曠置了病變最重的部分又提供了直接觀察腸黏膜改變的窗口。
爲了使病人能保留有一定長度的腸管,有時對那些活力處於臨界狀態的腸管不得不加以保留。這些病人術後24h的觀察必需很仔細,當發現有腸管失去活力的徵象時應立即再剖腹處理。但是,有些病人的腸管雖已失去活力但腹部或全身並無症狀出現。爲進一步瞭解保留的腸管是否成活,可在24h後再次剖腹觀察(二次剖腹探查)並做相應的處理。再次剖腹觀察在這些病人十分必要,是一種保證安全的措施,以免壞死的腸管遺留在腹內,產生嚴重的後果。
再次剖腹觀察通常在全身麻醉下進行,拆除第1次手術的腹壁切口縫線後進入腹腔,觀察腹腔內是否有血性腹水、腸管是否有失活狀態。值得注意的是不要遺漏局竈性的腸管壞死。根據發現的情況給予全部、部分或節段腸切除吻合。