2 基本信息
《血友病A診療指南(2022年版)》由國家衛生健康委辦公廳於2022年4月3日《國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知》(國衛辦醫函〔2022〕104號)印發,要求各省、自治區、直轄市及新疆生產建設兵團衛生健康委組織做好實施工作。
3 發佈通知
國家衛生健康委辦公廳關於印發腫瘤和血液病相關病種診療指南(2022年版)的通知
國衛辦醫函〔2022〕104號
各省、自治區、直轄市及新疆生產建設兵團衛生健康委:
爲進一步提高腫瘤和血液病診療規範化水平,保障醫療質量安全,維護患者健康權益,我委委託有關單位制修訂了腫瘤和血液病相關病種診療指南。現印發給你們(見附件,可在國家衛生健康委網站醫政醫管欄目下載),請各地衛生健康行政部門組織做好實施工作。
附件:
2.膀胱癌診療指南(2022年版)
5.胰腺癌診治指南(2022年版)
6.腎癌診療指南(2022年版)
7.乳腺癌診療指南(2022年版)
8.子宮內膜癌診療指南(2022年版)
12.甲狀腺癌診療指南(2022版)
13.腦膠質瘤診療指南(2022年版)
16.瀰漫性大B細胞淋巴瘤診療指南(2022年版)
17.骨髓增生異常綜合徵伴原始細胞增多(MDS-EB)診療指南(2022年版)
18.慢性髓性白血病診療指南(2022年版)
19.血友病A診療指南(2022年版)
20.慢性淋巴細胞白血病-小淋巴細胞淋巴瘤診療指南(2022年版)
國家衛生健康委辦公廳
2022年4月3日
4 診療指南全文
血友病A診療指南(2022年版)
4.1 一、概述
血友病 A(Hemophilia A,HA)是一種遺傳性出血性疾病,呈 X 染色體連鎖隱性遺傳。臨牀上主要表現爲凝血因子Ⅷ(FⅧ)質或量的異常。臨牀表現以關節、肌肉、內臟和深部組織自發性或輕微外傷後出血難以停止爲特徵,常在兒童期起病,反覆關節出血可導致患者逐漸出現關節活動障礙而致殘。男性人羣中,HA 的發病率約爲1/5000,而女性血友病患者極其罕見。我國血友病的患病率爲2.73/100,000人口,其中 HA 佔 80%~85%。HA 是由於單一凝血因子缺乏或質量異常導致的疾病,對血友病的早期識別和診斷,可以通過合理、正確的預防治療,或出血後及時的替代治療,避免出血以及出血造成的關節損傷及殘疾等,使患者可以正常生活。
4.2 二、臨牀表現
由於 FⅧ在內源性凝血途徑中具有重要作用,HA患者臨牀表現爲可發生在全身任何部位的出血。其中最常見的出血部位爲關節、肌肉和深部組織,也可有胃腸道、泌尿道、中樞神經系統出血以及拔牙後出血不止等。若不及時治療可導致關節畸形和假性腫瘤等,嚴重者甚至可以危及生命。外傷或手術後持續出血也是本病的特點。
出血程度與 FⅧ活性相關,輕型患者一般很少出血,只有在損傷或手術後才發生出血;重型患者則自幼即有出血,身體的任何部位都可出血;中間型患者出血的嚴重程度介於輕型和重型之間。
當男性患者尤其兒童出現自發出血、外傷或手術後出血不止等表現時,需考慮出血性疾病,包括血友病的可能。追問患者家族史,並進一步完善實驗室檢查以確診。
4.3 三、實驗室檢查
4.3.1 (一)篩選試驗。
包括血小板計數、外周血塗片(血小板形態)、凝血酶原時間( prothrombin time,PT)、活化的部分凝血活酶時間(activated partial thromboplastin time,APTT)、凝血酶時間(thrombin time,TT)、纖維蛋白原定量等。HA 患者僅表現爲 APTT 延長,但部分輕型HA 患者APTT僅輕度延長或爲正常高限。血小板計數和形態,以及其他凝血指標均應正常。
4.3.2 (二)確診試驗。
凝血因子檢測:APTT 延長提示內源性凝血過程異常,需檢查與此相關的凝血指標,包括FⅧ、FⅨ、FXII活性及血管性血友病因子抗原(VWF∶Ag)。FⅧ活性(FⅧ:C)降低或缺乏,VWF∶Ag 正常,FⅧ∶C/VWF∶Ag 明顯降低,提示 HA。
4.3.3 (三)抑制物檢測。
4.3.3.1 1.檢測時機。
HA 患者治療效果較既往降低,以及接受手術前,均應檢測 FⅧ抑制物。對於兒童患者,建議在首次接受FⅧ產品治療後的前 20 個暴露日每 5 個暴露日檢測1 次,在21~50個暴露日內每 10 個暴露日檢測1 次,此後每年至少檢測2次,直至 150 個暴露日。
4.3.3.2 2.抑制物篩選。
採用 APTT 糾正試驗,即正常血漿和患者血漿按1∶1混合後,於即刻和 37℃ 孵育 2 小時後分別再測定APTT,並與正常人和患者本身的 APTT 進行比較,即刻可糾正。如孵育2小時不可糾正,提示存在凝血因子抑制物(APTT 糾正試驗解讀見附表 1)。
4.3.3.3 3.抑制物滴度。
確診抑制物必須測定抑制物滴度。如果在1~4周內連續 2 次用 Bethesda 法或者 Nijmegen 法檢測發現患者抑制物滴度≥0.6 BU/ml,則判定爲陽性。若抑制物滴度>5 BU/ml,則爲高滴度抑制物;若抑制物滴度≤5 BU/ml,則爲低滴度抑制物。
4.3.4 (四)基因檢測。
建議對患者進行基因檢測,以便確定致病基因,爲同一家族中的攜帶者檢測和產前診斷提供依據。此外,可以通過基因突變判定患者產生抑制物的風險。
4.4 四、臨牀分型
根據 FⅧ的活性水平,可將HA 分爲輕型、中型、重型三型(見附表 2)。因子活性<1%爲重型;活性1%~5%爲中型;活性>5%~40%爲輕型。
4.5 五、診斷和鑑別診斷
4.5.1 (一)診斷。
根據患者自幼發病、反覆嚴重出血,尤其關節出血的臨牀表現,結合 FⅧ因子活性和抗原下降伴FⅧ基因突變的實驗室檢查,可以確診。
4.5.2 (二)鑑別診斷。
4.5.2.1 1.血管性血友病(von Willebrand disease,VWD):
VWD 是由於 vWF 質或量缺陷所致的常染色體遺傳性疾病,多爲顯性遺傳。患者有出血傾向,但主要以皮膚黏膜出血爲主。因 vWF 具有增加 FⅧ:C 穩定性、防治其降解,並促進其生成和釋放的作用,因此,VWD 患者可出現FⅧ活性下降。故患者 FⅧ活性下降時需排除 VWD,女性患者尤甚。VWD確診及分型需檢測 vWF 抗原及活性(瑞斯託黴素輔因子活性,vWFR:Co)、膠原結合實驗、FⅧ結合實驗、血小板黏附和聚集試驗、vWF 蛋白電泳等。基因診斷也是診斷手段之一。
4.5.2.2 2.獲得性 HA:
是循環中出現抗FⅧ的自身抗體導致FⅧ活性下降的一種自身免疫性疾病,需要與HA,尤其HA合併抑制物的患者進行鑑別。獲得性HA 特點爲既往無出血史和陽性家族史,多發生於惡性腫瘤、自身免疫病患者及圍產期女性,但約半數的患者無明顯誘因,免疫抑制治療有效。
4.5.2.3 3.其他遺傳性凝血因子缺乏:
發現單純APTT 延長的患者,在進行確診試驗時,還需完善FⅨ、FⅪ、FⅫ、FⅤ、FⅩ等可導致 APTT 延長的凝血因子活性檢測,以排除相應的凝血因子缺乏性疾病。
4.6 六、治療
4.6.1 (一)治療原則。
HA 患者需採取 FⅧ的替代治療,無出血時進行規律替代治療(預防治療),其目的是阻止出血,從而最大限度保護關節功能,若有出血應及時給予足量的按需治療,進行手術或者其他創傷性操作時,應進行充分的替代治療。以阻止圍手術期出血。HA 患者應避免肌肉注射和外傷。
4.6.2 (二)替代治療。
4.6.2.1 1.替代治療藥物選擇。
HA 的替代治療首選基因重組FⅧ製劑或病毒滅活的血源性 FⅧ製劑,難以獲得上述藥物時可選用冷沉澱或新鮮冰凍血漿等。每輸注 1IU/kg 體重的FⅧ可使體內FⅧ活性(FⅧ∶C)提高 2%,所需 FⅧ輸注量計算見以下公式。FⅧ在體內的半衰期爲 8~12 小時,要使體內FⅧ:C保持在一定水平,需每 8~12 小時輸注1 次。FⅧ首次需要量=(需要達到的FⅧ濃度−患者基礎FⅧ濃度)× 體重(kg)× 0.5;首劑用藥後,依情可每8~12 小時輸注首劑的一半劑量,直至完全止血。個體的回收率和半衰期差異較大,建議有條件的單位檢測患者的藥代動力參數,如回收率和半衰期等,並根據結果指導治療。
4.6.2.2 2.替代治療的實施。
替代治療分爲按需治療和規律替代治療(預防治療)。
4.6.2.2.1 (1)按需治療:
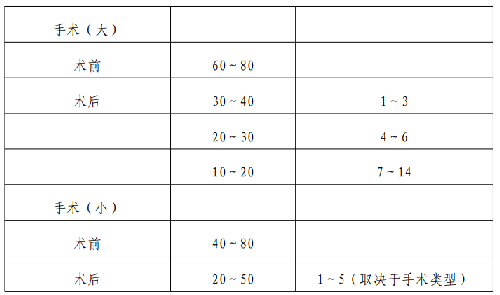
是指患者發生急性出血或時的治療,目前最有效的止血措施仍是 FⅧ替代治療,原則是早期、足量、足療程。替代治療 FⅧ劑量和療程應考慮出血部位和出血嚴重程度(見附表 3)。
4.6.2.2.2 (2)圍手術期替代治療:
是指手術前、手術中和手術後進行的替代治療,目的在於保證HA 患者手術的順利實施和手術後的順利康復。具體替代治療方案見附表4。
4.6.2.2.3 (3)預防性治療:
是指爲了防止出血而定期給予的規律性替代治療。由於按需治療只是出血後治療,無法阻止重型 HA 患者反覆出血導致關節殘疾,而預防性治療目標是維持正常關節和肌肉的功能,因此尤爲關鍵。預防性治療是兒童 HA 患者的首選治療方法。對兒童患者應設定年關節出血次數小於 3 次的目標,以儘量避免關節損傷的發生以及由於關節出血造成不可逆性關節殘疾。成年患者是否堅持預防性治療尚無共識,但國內外的經驗都已證明短期三級預防治療即可減少出血次數並改善生活質量。此外,對於近期出血加重,尤其是靶關節出血頻率增加的患者,建議進行 4~8 周的短期預防治療以阻斷出血-關節損傷的惡性循環。這種治療可以結合強化物理治療或放射性滑膜切除術。
預防性治療通常分爲以下三種:
①初級預防治療:於患兒確診後、第 2 次關節出血前及年齡小於3 歲且無明確證據(查體或影像學檢查)證實存在關節病變時,開始規律性持續替代治療;
②次級預防治療:關節有2 次或多次出血後,但查體和(或)影像學檢查沒有發現關節病變時開始規律性持續替代治療;
③三級預防治療:查體和影像學檢查證實存在關節病變後纔開始規律性持續替代治療。爲預防關節殘疾的發生,建議重型患兒發生第一次關節出血、嚴重肌肉出血、顱內出血或其他危及生命的出血即應開始預防治療。有關節出血和關節病變史的患兒應該根據病情及早開始預防治療,並儘可能達到年關節出血次數或年出血次數<3 次的目標。
預防治療理論上應保持 FⅧ谷濃度水平>1%,但預防性治療尚無國際統一標準方案,根據WFH2020 血友病管理指南,預防性治療方案如下:
①高劑量方案:每次25~40IU/kg,每隔天 1 次。
②中劑量方案:每次15~25 IU/kg,每週3次。
③小劑量方案:每次 10~15IU/kg,每週2~3 次;繼而每劑30 IU/kg 每週 2 次;繼而每劑25 IU/kg 隔日1 次。
④藥代動力學指導下的預防資料:通過個體藥代動力學參數檢測,根據患者實際需求制定預防治療方案,相比於大劑量方案,可以在保證療效前提下達到優化治療劑量及頻次、優化資源分配的目的。
雖然目前最佳預防方案還有待確定,但與按需治療相比,小劑量方案雖然可以明顯減少血友病患兒出血,但並不能減少關節病變的發生。建議在經濟條件允許的血友病患兒中實施中劑量預防治療方案,或根據年齡、靜脈通路、出血表型、藥代動力學特點以及凝血因子製劑供應情況,制定最佳的個體化方案。
4.6.3 (三)非因子治療。
4.6.3.1 1.艾美賽珠單抗:
是一種雙特異性單克隆抗體,通過模擬 FⅧa 的輔因子功能,可同時橋接FⅨa 和FⅩ,使FⅩ在沒有 FⅧ的情況下得以繼續激活,重新恢復生理性凝血通路。國內已獲批用於 HA 合併 FⅧ抑制物患者的常規預防性治療,在美國和歐盟也可以用於不合並FⅧ抑制物的HA 患者的常規預防性治療。推薦的給藥方案爲前4 周給予負荷劑量3mg/kg ,每週 1 次皮下注射,以快速達到目標血藥濃度,第5 周起給予維持劑量 1.5 mg/kg,每週1 次。
4.6.3.2 2.去氨基-8-D-精氨酸加壓素(DDAVP):
輕型HA患者出血時可選 DDAVP,少數中間型HA 也可能有效,但對重型HA 患者無效。推薦劑量爲 0.3~0.4μg/kg,以50ml生理鹽水稀釋後緩慢靜脈滴注(至少30 分鐘),每12 小時1次,用 藥 1~3 天。使用後凝血因子濃度升高>30%或較前上升>3 倍爲有效。該藥多次使用後療效差,如效果不佳時應及時補充 FⅧ製劑。用藥期間應監測FⅧ∶C。不良反應包括暫時性面色潮紅、水鈉瀦留等。由於水鈉瀦留等不良反應,2 歲以下患兒禁用。幼兒應用時需要限水,並提前進行預試驗。預試驗有效患兒也可使用專供血友病患者使用的DDAVP鼻噴劑來控制輕微出血。
4.6.3.3 3.抗纖維蛋白溶解藥物:
常用藥物有氨甲環酸、6-氨基己酸、氨甲苯酸等。此類藥物對口腔、舌、扁桃體、咽喉部出血及拔牙引起的出血有效,但對關節腔、深部肌肉和內臟出血療效較差,泌尿系統出血時嚴禁使用,並要避免與凝血酶原複合物合用。使用劑量:6-氨基己酸每次50~100mg/kg,每 8~12 小時 1 次;氨甲環酸每次10mg/kg,靜脈注射或每次 25 mg/kg 口服;氨甲苯酸 2~6mg/kg,每8 小時1次。也可漱口使用,尤其在拔牙和口腔出血時,5%的氨甲環酸溶液10ml 含漱 2 分鐘,每日 4 次,連用7 天。4.止痛治療:根據疼痛程度,選用對乙酰氨基酚或阿片類藥物,也可選擇 COX-2 類解熱鎮痛藥。原則上禁服阿司匹林或其他非甾體類解熱鎮痛藥,以及所有可能影響血小板功能的藥物。
4.6.4 (四)物理治療。
鼓勵患者在非出血期進行適當的、安全的有氧運動(游泳、功率車、慢跑、快走等),配合適宜負荷的抗阻力量訓練和自我牽伸,以預防和減少出血的反覆發生。出血時處理要遵循 PRICE 原則,包括制動(Prohibition)、休息(Rest)、冷敷(Ice)、壓迫(Compression)、抬高(Elevation)。肌肉和關節出血時,PRICE 原則是在輸注凝血因子以提高凝血因子水平基礎上的重要處理措施,及時使用夾板、模具、柺杖或輪椅制動可使出血的肌肉和關節處於休息體位,使用冰塊或冷物溼敷可有效減輕炎性反應。建議冰敷每 4~6 小時使用 1 次,每次5~10 分鐘左右(每次不超過 10 分鐘),直至腫脹和疼痛減輕。另外,經過專業培訓的康復醫師/治療師可對患者進行評估,包括肢體功能、個體活動性和社會參與能力等方面,並根據評估結果,指導患者進行康復訓練,預防、減輕、減少肌肉關節的功能障礙,提升日常活動能力和生活質量。
4.7 七、併發症的處理
4.7.1 (一)併發抑制物的治療。
HA 患者接受 FⅧ替代治療後產生的同種中和性抗體稱爲抑制物,重型 HA 患者抑制物產生率爲20%~30%,中型或輕型 HA 也有約 5%~10%的機率產生抑制物。持續合併存在抑制物則是血友病的嚴重併發症,將導致血友病患者出血症狀更加難控制、致命性出血風險增高,進一步降低生活質量。存在抑制物時分爲止血治療和清除抑制物兩方面治療。
4.7.1.1 1.止血治療。
(1)大劑量 FⅧ:僅限用於合併低滴度抑制物(≤5BU/ml)的 HA 出血患者。所需要FⅧ的量包括用於中和抑制物的量以及止血所需要的量。用於中和抑制物的FⅧ用量算法如下:體重 (kg) × 80 × [(1−紅細胞比容)×抑制物滴度(BU)]。在此基礎上需要額外增加50IU/Kg 的FⅧ,以保證體內可以檢測到 FⅧ:C 的提高。如止血效果不佳,可增加給藥劑量或縮短給藥間隔,或更換爲旁路治療。如爲低滴度高反應性抑制物(再次輸注FⅧ後抑制物滴度>5BU/ml),則考慮在用藥 3~5 天后,則更換爲旁路途徑止血。
(2)旁路途徑製劑:適用於合併高滴度抑制物(>5BU/ml)或免疫誘導耐受(immune tolerance induction,ITI )治療失敗或 ITI 治療中出血的患者。可供選擇的“旁路 途 徑 ” 藥物包括活化凝血酶原複合物(activatedprothrombin complex concentrate,aPCC)和基因重組活化凝血因子Ⅶ(rFⅦa)。rFⅦa 的使用方法爲靜脈注射90μg/kg ,每 2~4 小時 1 次或270 μg/kg 單次給藥。目前國內無 aPCC,可用凝血酶原複合物(prothrombin complexconcentrate,PCC)替代,PCC 推薦劑量:每次50~100U/kg,間隔 8~12 小時,每天劑量不超過200U/kg。對併發顱內出血等危及生命出血的、出現抑制物的兒童,一旦急性出血穩定,需要使用 PCC 或 rFⅦa 進行至少6 個月的預防性治療。
(3)艾美賽珠單抗:艾美賽珠單抗預防治療在控制出血、恢復靶關節功能、提高血友病患者生活質量方面都有幫助。用藥方案與前述一致,用藥前24 小時停用旁路製劑。如在預防治療期間如發生突破性出血,應首選使用rFⅦa進行治療,初始劑量應≤90 μg/kg,重複給藥時,治療間隔應大於 2 小時。同時爲避免血栓發生,應儘量避免使用aPCC或 PCC 類藥物。對於合併低滴度抑制物患者,也可採用FⅧ治療突破性出血。
4.7.1.2 2.清除抑制物。
ITI 是指抑制物陽性患者長期規律性頻繁接受凝血因子製劑治療,從而達到外周免疫耐受,是目前公認的唯一的清除抑制物的方法。HA 合併抑制物陽性患者的ITI 成功率約爲70%。
4.7.1.2.1 (1)ITI 開始時間:
目前國際上並無共識何時爲ITI最佳開始時間,但目前傾向於一旦確診,無論抑制物滴度高低都應立即開始 ITI。
4.7.1.2.2 (2)凝血因子製劑的選擇:
血源性FⅧ濃縮製劑或rhFⅧ均可選擇,並無證據提示哪種製劑更優,但當使用rhFⅧ進行 ITI 治療不成功時,可考慮改用富含vWF的血源性 FⅧ濃縮製劑。
4.7.1.2.3 (3)ITI 方案:
①一線治療:i高劑量:200 IU/(kg· d);ii 中劑量:100 IU/(kg·d); iii 低劑量:25~50IU/kg,隔日1 次或每週 3 次。高劑量組與低劑量組相比,在誘導免疫耐受成功率方面並無差別,但高劑量組起效更快且治療期間出血症狀顯著減少。另外,低劑量ITI 可與艾美賽珠單抗聯合應用。有研究發現,這樣既可減少凝血因子用量,又避免了頻繁出血。一旦開始 ITI,不宜隨意中止,以免影響後續ITI的療效。開始 ITI 後,應該每週檢測1 次抑制物滴度,如果抑制物滴度升高或半年內抑制物滴度下降幅度低於20%,應該逐步增加 ITI 劑量直至 200 IU/(kg·d);如果劑量已經達到 200 IU/(kg·d),建議改爲二線方案。
②二線治療:目前無標準二線治療,可考慮換用不同的FⅧ產品,比如從rhFⅧ換爲血源性 FⅧ,也可聯合人源CD20 單抗清除抑制物治療,但遠期療效及安全性仍需要進一步評估。
4.7.1.2.4 (4)ITI 療效評估標準:
①完全耐受:抑制物持續陰性(<0.6 BU/ml)且 FⅧ回收率>66%、FⅧ半衰期>6小時;
②部分耐受:抑制物滴度<5BU/ml,雖然FⅧ回收率小於 66%和/或半衰期小於 6 小時,但使用FⅧ治療可以阻止出血;
③無效:不能達到完全或部分耐受。一般來說,在3~6 個月內抑制物滴度下降不足20%或經過3~5 年的ITI後抑制物滴度仍>5BU/ml。
4.7.1.2.5 (5)ITI 療效的預測:
目前認爲有如下特徵的患者ITI療效可能較好:
①開始 ITI 之前抑制物滴度<10BU/ml;
②抑制物滴度歷史峯值<200 BU/ml;
③ITI 期間抑制物滴度峯值<100BU/ml;
④從診斷到開始ITI 的時間<5 年;
⑤ITI開始後沒有間斷。
而有如下特徵的患者 ITI 療效可能較差:①開始ITI之前抑制物滴度≥10 BU/ml;②抑制物滴度歷史峯值≥200BU/ml;③ITI 期間抑制物滴度峯值>100 BU/ml;④從診斷到開始 ITI 的時間>5 年;⑤ITI 開始後間斷>2 周。
4.7.1.2.6 (6)終止 ITI 的時機:
達到完全耐受者,轉入預防性治療;達到部分耐受者,若能應用FⅧ充分治療及阻止出血症狀,可考慮停止 ITI 治療;ITI 治療開始後的3 個月若未能將抑制物滴度降低 20%以上,或ITI 治療3~5 年仍未能達到完全耐受或部分耐受者。
4.7.2 (二)血友病性關節病的處理。
血友病性關節病是指由於反覆關節出血導致關節功能受損或關節畸形,是血友病患者常見的嚴重併發症。爲保護關節和避免殘疾,需要立即開始有效的三級預防治療和多學科治療。在患者保持一定 FⅧ谷濃度情況下,進行正規的物理治療和康復訓練,同時需定期關節結構[X 線、磁共振檢查(MRI)、超聲]和功能評估。可適當地應用鎮痛劑減輕疼痛,並根據病情開展滑膜切除、關節置換等矯形手術。如果要進行手術,必須要有經驗的血液科專科醫師、骨科專科醫師、出/凝血實驗室技術人員以及康復科醫師等組成綜合關懷團隊,以保障患者圍手術期的各項指標評估、手術方案的確定與順利實施以及術後的康復等。
4.7.3 (三)血友病性假性腫瘤的處理。
血友病性假性腫瘤是血友病一種少見但致命的併發症,其本質是發生在肌肉或骨骼的一種囊性包裹的血腫,通常是出血後凝血因子替代治療不充分而長期慢性出血的結果。因假性腫瘤常包裹周圍臟器,造成徹底切除困難。圍手術期及術後需要多學科診療團隊合作,以防止併發症的發生和假性腫瘤復發。
4.7.4 (四)血液傳播疾病的防治。
常見的血液傳播性病毒爲人類免疫缺陷病毒、丙型肝炎病毒、乙型肝炎病毒等。建議對使用血源性因子預防治療的血友病患者進行病毒檢測;對HBsAb 陰性者進行乙肝疫苗注射。一旦罹患血液傳播病毒感染,建議患者在血友病多學科診療團隊指導下進行相應抗病毒治療。使用不含任何血液成分的基因重組因子能杜絕已知和未知病原體的感染風險。
4.8 附錄 1:
表 1.APTT 糾正試驗解讀
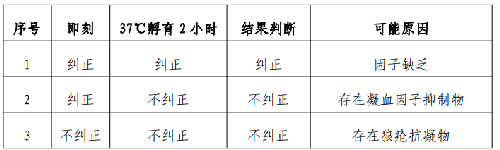
表 2.血友病A 臨牀分型
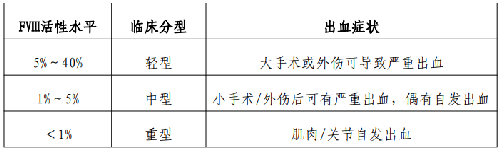
表 3.獲取凝血因子不受限時的替代治療
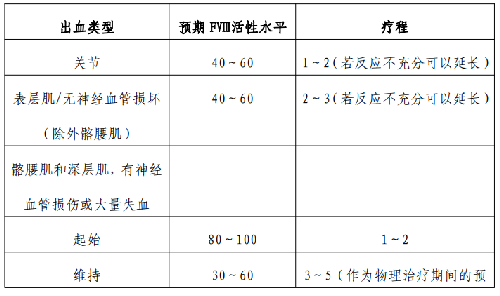
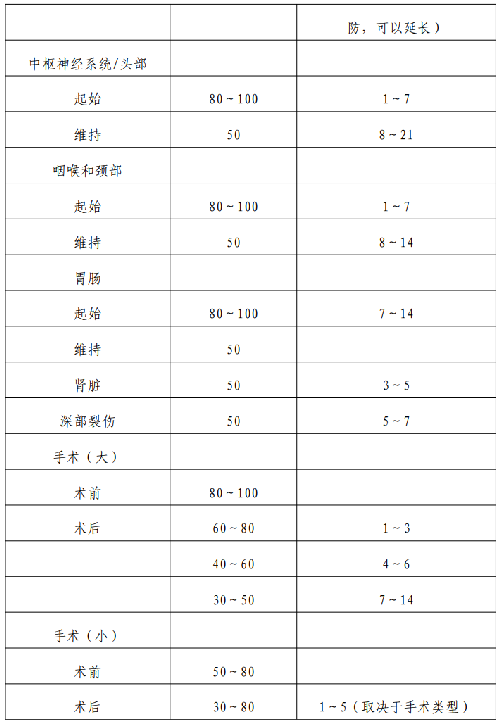
表 4.獲取凝血因子受限時的替代治療

4.9 附錄2:血友病A 診療指南(2022年版)編寫審定專家組
(按姓氏筆畫排序)
組長:黃曉軍
成員:王婧、付海霞、許蘭平、江倩、江浩、張曉輝、楊申淼、張圓圓、賈晉松、黃曉軍、路瑾