1 概述
霍奇金病(hodgkin’s disease, HD)又稱惡性霍奇金淋巴瘤、惡性淋巴肉芽腫病,舊稱何傑金病,是惡性淋巴瘤的一大類型。霍奇金病是一種慢性進行性、無痛的淋巴組織腫瘤,由於發病的部位不同,其臨牀表現多種多樣。
1832年Thomas Hodgkin報道了7例疾病的臨牀病史和尸解發現,這些病例後來以他的名字命名。1856年Samuel Wilks描述了10例“與脾臟病變有關的淋巴結增大的特殊病例”其中包括4例霍奇金報告的病例;其後,他將以後陸續發現的15例病例命名爲霍奇金病(Hodgkin’s disease),報道於1865年。13年後,Craigie、Bennett和Virchow報道了第1例白血病。Dreschfield(1892)和Kundret(1893)將腫瘤細胞爲淋巴系統的病例稱爲淋巴癌。Carl Sternberg(1898)和Dorothy Reed(1902)最早定義霍奇金病,儘管英國、德國和法國的許多研究者早已能識別這一具有特徵性的多核巨細胞。1926年,FOX研究了3例霍奇金起源的病例標本的微觀特徵,進一步明確了其中2例疾病的組織病理學診斷。Jackson和Parker最早致力於霍奇金病的組織病理學分型,將他們的發現與預後相聯繫。至1966年,Lukes、Butler和Hicks明確提出並建議分型應與臨牀表現和病因相關。他們的建議在Rye會議中進行了修改、簡化,從那以後,Rye分型一直是一種標準的分型法。
在過去幾十年中,隨着新的免疫學和分子生物學資料的獲得,對霍奇金病(Hodgkin’s DiSease HD)認識進一步深入,2種不同的淋巴瘤亞型被證實屬於這個範疇,即經典型和結節性淋巴細胞爲主型。大多數學者證實霍奇金病中腫瘤細胞(RS細胞)起自B淋巴細胞,因此部分學者提出應將霍奇金病修正其名,稱爲“霍奇金淋巴瘤”(Hodgkin’s lymphoma,HL)。霍奇金淋巴瘤的定義爲:霍奇金淋巴瘤是一種惡性淋巴瘤,它在非腫瘤細胞的背景下含有特徵性RS細胞;並根據RS細胞的形態學和免疫表型及細胞背景的成分而區分亞型。1994年,國際淋巴瘤研究組由此提出了新的分型法,作爲修訂的歐美淋巴瘤分類法(REAL)的一部分;這些概念被歸入了WHO 2001年的淋巴細胞腫瘤的分型中。WHO分型中,霍奇金淋巴瘤包括經典型霍奇金淋巴瘤(classical Hodgkin’s lymphoma)和結節性淋巴細胞爲主型霍奇金淋巴瘤(Nodular lymphocytic predominance Hodgkin’s lymphoma),經典型霍奇金淋巴瘤又包括:結節硬化型(Nodular sclerosis)、混合細胞型(mixed cellularity)、淋巴細胞削減型(lymphocytic depiction)和富於淋巴細胞的經典霍奇金淋巴瘤(lymphocyte-rich classical Hodgkin’s lymphoma)4種。
霍奇金淋巴瘤獨特的細胞組成和大多數其他的惡性腫瘤不同,它具有少量腫瘤細胞(Reed-Sternberg細胞和其變異型)及其典型的炎症背景。由於惡性細胞即RS細胞和他們的變異型細胞通常佔所有細胞的1%不到,這對研究帶來一定困難,因此他們的性質一直是一個謎。很多不同類型的細胞被假定爲RS細胞的來源。Reed在他原始的文獻中描述了RS細胞,並推測RS細胞來源於“增生的(竇狀隙樣)內皮細胞”。最近,應用顯微解剖分離單個的惡性細胞,分子技術放大並分析他們的基因,細胞的特性日益明確。幾乎所有經典型霍奇金淋巴瘤和結節性淋巴細胞爲主型霍奇金淋巴瘤患者的惡性細胞都顯示了單克隆B細胞起源。Stein、Hummel和Chen概括了實驗室資料證實,RS細胞和淋巴細胞和(或)組織細胞均與生髮中心B細胞有關係。在經典型霍奇金淋巴瘤,RS細胞可能由於重排的免疫球蛋白基因非翻譯區發生體細胞突變,而不能合成免疫球蛋白。在結節性淋巴細胞爲主型霍奇金淋巴瘤,免疫球蛋白的基因編碼區既完整並具有潛在的功能。
Peters於1950年制訂了本病的臨牀分期方法,強調了解剖學對疾病的診斷性評估作用。1952年,Kinmouth介紹了淋巴造影術,便於檢測盆腔和腹膜後淋巴結的病變。在Stanford大學通過對65例病人剖腹和脾臟切除,對脾門、主動脈旁和腸繫膜淋巴結及肝臟活檢發現許多患者的脾臟頻繁受累。這些診斷性操作提高了對疾病播散情況的瞭解以及與預後的關係,有關內容被歸入1965年的Rye會議制訂的分期中,其進一步的修改是1971年Ann Arbor霍奇金病分期。這一分期方法得到了廣泛的應用。此後,1989年和1993年又有了Cotswa分期和AJCC臨牀分期,但均不及Ann Arbor普及。
Pusey(1902)和Senn(1903)率先應用Roentgen在1896年發現的X線檢查手段,報道了淋巴結病治療後的消退。鑑於幾乎所有的未治療區域都存在潛在的復發風險,1932年Gilbert建議淋巴瘤累及區和未累及區都應進行全身性治療。Peters(1950)最早證實放射治療具有治癒性的療效。超高壓放射治療的發展, (Kalplan,1962)使殺腫瘤的放射劑量(正常組織耐受範圍內)完全到達淋巴區域。目前在早期霍奇金淋巴瘤中單一放療的效果肯定,也可與化療聯合。
霍奇金淋巴瘤的化療起源於戰爭時期芥氣工作的副產品。隨着對氮芥研究的進展,一系列抗代謝藥物合成以及大量烷化劑和抗體從各種植物、真菌和微生物中提取出來。DeVita和他的同事們率先應用高效聯合化療:“MOPP”(氮芥、長春新鹼、丙卡巴肼、潑尼松)方案,通過實驗性研究證實這些藥物無交叉毒性。之後,米蘭研究所提出的ABVD方案被廣泛證明其療效優於MOPP方案,從而取代MOPP方案,成爲晚期霍奇金淋巴瘤的金標準治療方案。聯合化療使進展期霍奇金淋巴瘤成爲可治癒的疾病。
7 流行病學
7.1 分佈
據流行病學調查,霍奇金淋巴瘤(Hodgkin’s lymphoma,HL)在世界各地的發病情況差異較大,在歐美國家多發,佔淋巴瘤的45%左右,居淋巴瘤之首位。而我國和日本發病率較低。1983年我國全國淋巴瘤協作組對9009例淋巴瘤回顧性資料分析結果,霍奇金淋巴瘤佔8%與日本(7.6%)較接近。
7.2 年齡
霍奇金淋巴瘤確診時患者的中位年齡爲26~31歲。最初認爲霍奇金淋巴瘤患者的第1個發病高峯爲20~29歲,第2個發病高峯爲60歲以上。現已明確第2個發病高峯源於錯誤的病理分型。來自美國癌症研究院SEER(Surveillance,Epidemiology and End Results Program)的最新資料表明,上述錯誤分類的病例大部分爲侵襲性非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL),而不是混合細胞型霍奇金淋巴瘤或淋巴細胞消減型霍奇金淋巴瘤。一般而言,結節硬化型(Nodular sclerosis,NS)最常見,70%以上的病例在40歲以下發病,無第二發病高峯。其他的組織學亞型如淋巴細胞爲主型(lymphocytic predominance,LP),混合細胞型(mixed cellularity,MC)和淋巴細胞消減型(lymphocytic depletion,LD),發病率較低但是隨着年齡增加發病率逐步增高。
7.3 性別
男性霍奇金淋巴瘤的發病率約爲女性的1.4倍。男性發病高於女性,主要見於小於10歲的兒童以及50多歲的老年人。10歲和40歲之間的年齡段女性發病佔主要地位,因爲這一年齡段是NSHL的發病高峯,而女性NSHL比男性NSHL更多見。
7.4 種族
霍奇金淋巴瘤主要是美國白色人種的惡性腫瘤,在所有霍奇金淋巴瘤病例中,白色人種佔90%以上。
7.5 風險因素
霍奇金淋巴瘤的病因仍不清楚,現在認爲與遺傳傾向(genetic susceptibility)和感染有關,尤其是EB病毒感染與霍奇金淋巴瘤發病密切相關。目前的流行病學資料都支持上述兩種病因,但是遺傳傾向和感染引起的霍奇金淋巴瘤亞型不同。
7.5.1 (1)感染因素
7.5.1.1 ①EB病毒感染
在發展中國家,大部分霍奇金淋巴瘤病例爲EBV陽性。在發達國家,大約有40%~50%的霍奇金淋巴瘤病例與EBV感染有關,這些病例主要爲兒童和老年人,而在青年結節硬化型霍奇金淋巴瘤患者中較少見。例如,在肯尼亞(Kenya),100%的兒童病例爲EBV潛在膜蛋白-1(Latent Membrane Protein-1,LMP-1)陽性,其中的25例具有Ⅰ型和(或)Ⅱ型EBV病毒。在這一研究中,只有63%的肯尼亞成年人爲LMP-1陽性。最近,對1546例霍奇金淋巴瘤病例進行流行病學分析,發現混合細胞型比結節硬化型,兒童比青年人,男性比女性,西班牙人(Hispanics)比白人的EBV陽性率顯著高。
2000年,美國的霍奇金淋巴瘤新發病人數約爲7500,從20世紀70年代以來降低了16%左右。在日本,對1955~1999年之間霍奇金淋巴瘤的EBV陽性率進行研究發現,隨着時間發展,EBV的總陽性率逐漸降低,1955~1969年爲52%(23例中12例),1970~1984年爲46%(39例中18例),1985~1999年爲35%(44例中13例)。有趣的是,結節硬化型的EBV陽性率顯著降低,1955~1969年爲45%,1970~1984年爲21%,1985~1999年爲4%,而其他經典型霍奇金淋巴瘤並不顯著降低,3個年段分別爲63%,78%,67%。EBV的陽性率在一定程度上受到社會-經濟狀態和種族-遺傳背景的影響。在過去幾十年中,日本的生活水平有了顯著提高,生活方式也發生了很大改變,從傳統型轉變爲西方式。因此,在非工業化國家和工業化早期國家隨着工業化進展,霍奇金淋巴瘤的EBV陽性率可能會降低。
當EBV存在於霍奇金淋巴瘤患者時,在所有的腫瘤細胞中都可檢測到單克隆EBV基因組。但並非所有的霍奇金淋巴瘤患者EBV都爲陽性,而EBV病毒在淋巴系惡性腫瘤中所起的作用是什麼,這些都有待進一步研究。
7.5.1.2 ②HIV
霍奇金淋巴瘤是發生於HIV陽性人羣的最常見的AIDS相關腫瘤。在HIV感染的患者中,霍奇金淋巴瘤的發生率約增高7倍左右。目前已報道了300多例HIV感染的霍奇金淋巴瘤病例,主要爲歐洲國家(如意大利,西班牙和法國),美國較少,亞洲國家如日本和中國更少見。在HIV感染的患者中霍奇金淋巴瘤發病風險增高,而且這一人羣中霍奇金淋巴瘤的組織學類型、生物學行爲以及預後與其他非HIV感染的霍奇金淋巴瘤患者有很大不同。HIV陽性且患有晚期霍奇金淋巴瘤的患者常具有結外病變。這些患者的預後因素常與HIV有關而不是霍奇金淋巴瘤。與非HIV感染的霍奇金淋巴瘤患者相比,HIV感染的霍奇金淋巴瘤患者對化療的反應率較低,複發率更高,感染性併發症更多見,總生存率更低。而且與非HIV感染的霍奇金淋巴瘤不同,大部分HIV相關霍奇金淋巴瘤病例中EBV爲陽性(佔80%~90%)。RS細胞(Reed-Sternberg cell)中EBV的LMP-1高度表達,LMP-1作爲持續被激活的腫瘤壞死因子受體樣分子發揮作用,導致促進細胞激活、生長和生存的信號途徑被激活,最終形成上述HIV相關霍奇金淋巴瘤特有的不良特徵。
7.5.2 (2)遺傳傾向
對雙胞胎進行研究證實,同卵雙胞胎比異卵雙胞胎的霍奇金淋巴瘤發病風險顯著高。但是一般而言,在所有霍奇金淋巴瘤患者中,家族性霍奇金淋巴瘤的發病率不到5%。回顧性分析328例家族性霍奇金淋巴瘤患者發現,發病高峯爲15~34歲,而散發的霍奇金淋巴瘤發病年齡曲線較寬。對60例各個家族中的霍奇金淋巴瘤患者進行研究,未發現同一家族中所有患者的腫瘤組織中都存在EBV或EBV血清學陽性,而且10對同卵雙胞胎中只有1對同時爲EBV陽性。這些資料表明,EBV對家族性霍奇金淋巴瘤的發病不起主要作用。
7.5.3 (3)其他
其他風險因素還有接觸除莠劑和某些職業如木工、家畜飼養和肉類加工。另外霍奇金淋巴瘤的發病還受社會經濟狀況的影響,那些出身於高階層家庭,受過高等教育或小型家庭的人患霍奇金淋巴瘤的危險性增高。在經濟比較落後的國家和地區,兒童和青年人霍奇金淋巴瘤發病率也高於經濟較發達的國家和地區。
8 霍奇金病的病因
8.1 EBV
霍奇金淋巴瘤是少數幾種流行病學傾向於感染爲病因的惡性腫瘤之一。早期認爲霍奇金淋巴瘤發病可能與EBV感染有關,這是由於一些研究證明有單核細胞增多症病史的病人霍奇金淋巴瘤復發風險增高,以及霍奇金淋巴瘤病人EBV抗原的滴度增高。儘管長期以來對流行病學和血清學資料有所懷疑,但一直到1987年Weiss等應用Southern blot方法才證實霍奇金淋巴瘤中存在EBV基因組,證明EBV與較多經典霍奇金淋巴瘤有關。目前,應用高度敏感的原位雜交技術,18%~50%的霍奇金淋巴瘤爲EBV(+)。此外,應用直接抗EBV探針檢測顯示,一些霍奇金淋巴瘤組織樣本中很明顯存在EBV附加體DNA,提示EBV感染發生於腫瘤細胞克隆性擴增之前。EBV(+)的惡性細胞表達病毒潛在膜蛋白(LMP1),此蛋白可防止B細胞凋亡(通過誘導Bcl-2可介導此效應發生),這一證據進一步證明EBV對霍奇金淋巴瘤發病起着積極的作用。轉基因動物模型實驗證明,病毒潛在膜蛋白具有致癌作用。再有,LMP1可上調很多細胞基因,包括CD23、CD39、CD40和MHCⅡ類分子及細胞黏附分子如LFA-1、LFA-3和ICAM-1。EBV基因組的檢測與混合細胞型霍奇金淋巴瘤有關。有研究發現,在混合細胞型中EB病毒陽性病例的比例(58%)比結節硬化型(18%,P<0.001)顯著增高。有關EB病毒感染的病因學說由於RS細胞中分離出EB病毒基因組而進一步得到證實。最近,有報道認爲CD99下調是霍奇金-RS細胞產生的基本要求。而EBV潛在膜蛋白(LMP-1)的高表達可導致CD99下調,前者在EBV相關性霍奇金淋巴瘤的霍奇金-RS細胞中是高表達的。表明EBV LMP-1蛋白在CD99轉錄調節下調中起着重要作用,導致霍奇金-RS細胞的發生。但EB病毒不能解釋所有的病例,尤其是發達國家中最常見的類型——結節硬化型。在美國和歐洲,大部分霍奇金淋巴瘤與EBV無關,尤其是青年人,只有20%是EBV HRS+。Deleclue等分析了一例復發霍奇金淋巴瘤病例,原發腫瘤爲EBV HRS+,但復發標本爲EBV HRS-,推測在疾病進展過程中病毒丟失,但無正式證據證明原發腫瘤和復發腫瘤克隆是一致的。而且,此病人發病時僅5歲,因此不能代表典型青年人羣體。很清楚有些霍奇金淋巴瘤病例是EBV血清學陰性的,因此EBV並不是所有病例的病因。
8.2 其他感染因素
在非EBV相關性病例中較爲可能的病因是其他感染因素。皰疹病毒在自然界中分佈廣泛,可能與霍奇金淋巴瘤的發病有關。最近,有研究顯示人類皰疹病毒-6(human herpesvinus-6,HHV-6)基因組整合至宿主淋巴細胞的DNA中。而且霍奇金淋巴瘤病人HHV-6抗體滴度增高,與老年人相比,抗體滴度在青年人中更高,在EBV HRS-病例中比EBV HRS+病例高。HHV-8是人類皰疹病毒家族中最新發現的病毒,雖然EBV和HHV-8之間基本無同源序列,但有一些功能特徵相同,EBV能上調許多細胞基因,而這些基因與HHV-8基因組有同源性。但目前尚無證據表明HHV-8與霍奇金淋巴瘤發病有關。
多瘤病毒JC一直被認爲與急性淋巴母細胞白血病的發病有關,而此病與青年型霍奇金淋巴瘤在流行病學上有許多共同特徵。曾有人在霍奇金淋巴瘤中檢測SV40或親淋巴乳多空病毒,未得到陽性結果。應用PCR技術46例霍奇金淋巴瘤中檢測JC和BK,未發現病毒基因組。其他研究也不支持腺病毒5和12,人類T細胞淋巴瘤病毒Ⅰ、Ⅱ或人反轉錄病毒5。
9 發病機制
9.1 基因異常
絕大多數經典霍奇金淋巴瘤患者伴有克隆性細胞遺傳學異常,這種異常隨不同病例而不同,且克隆內異常也爲異質性,提示染色體不穩定。許多病例顯示14q異常,類似B細胞性淋巴瘤,但很少發生t(14;18)的異常。2個研究組應用熒光原位雜交技術(伴或不伴熒光免疫分型),發現所有霍奇金淋巴瘤病例的RS細胞顯示克隆數值異常。早期報道中,約1/3的霍奇金淋巴瘤中發現Bcl-2重排,但其他實驗室未檢測到Bcl-2重排。而且,在高反應性組織中如反應性扁桃體中也發現Bcl-2重排。與EBV有關的轉化蛋白能夠上調培養細胞中的Bcl-2,這一證據進一步表明Bcl-2表達與霍奇金淋巴瘤之間的關係。Bcl-2過度表達的免疫組化研究得到的結論並不一致。但是,Bcl-2表達似乎與組織學、EBV(+)或t(14;18)易位無關,Bcl-2表達的增強可能存在於背景細胞,並且對霍奇金淋巴瘤的發病不起重要作用。但一個研究組應用細胞遺傳學分析法,明確證實了腫瘤細胞存在Bcl-2重排,而不發生t(14;18)。最近,在霍奇金淋巴瘤中發現新的凋亡抑制因子Bcl-X(L),94%的霍奇金淋巴瘤中Bcl-X(L)爲陽性,且大多數RS細胞爲高強度表達。在非霍奇金淋巴瘤中表達率低(<20%),但網狀中心淋巴瘤除外。故推測,Bcl-X(L)在RS中的異常表達對於凋亡的抑制可能是霍奇金淋巴瘤的發病原因。未發現Bcl-X(L)與EBV表達存在相關性。經免疫組化分析,在CD30 的霍奇金和其他淋巴瘤中已檢測到P53抑癌基因表達。但是最近的研究發現,在8例霍奇金淋巴瘤中霍奇金和RS細胞都無P53突變。
最近,Humboldt等報道,從霍奇金淋巴瘤病人淋巴結活檢樣本中,IκBα mRNA在HRS細胞中過度表達,並檢測到IκBα基因突變,產生C端截斷的蛋白質,推測此蛋白質不能抑制NF-κB-DNA結合活性,而防止HRS細胞凋亡,並引發增殖。因此與霍奇金淋巴瘤發病有關。
NLPHL的細胞遺傳學資料很少,而且細胞遺傳學異常的研究結果也不一致。Tilly等報道的大系列霍奇金淋巴瘤中,只有1例NLPHL,此例NLPHL具有46XY核型。Hansmann等報道了一例高二倍體NLPHL,6q-, 21,及幾個未明確的標誌。研究發現,起源於NLPHL的DEV細胞系列具有下述核型異常:48,XXY,t(3;14)(3;22),t(3;7),del3,-2, 12, mar。分析霍奇金淋巴瘤的倍體情況,5例NLPHL中3例爲非整倍體,未檢測到四倍體,而四倍體常見於經典霍奇金淋巴瘤。Bcl-2基因重排只在一小部分病例中檢測到,應用免疫組化檢測Bcl-2蛋白表達,陽性病例數很少。據此推測,Bcl-2轉位可能對NLPHL發病不起重要作用。
9.2 霍奇金淋巴瘤患者腫瘤細胞的起源
長期以來一直認爲,霍奇金淋巴瘤中不同組織學類型代表同一疾病的形態學變異,其中HRS細胞處於反應性背景中,而每一組織亞型均有特徵性細胞組成。在過去20年中,人們逐漸發現上述概念只是部分正確,如結節性淋巴細胞爲主型霍奇金淋巴瘤與霍奇金淋巴瘤的其他類型不同,是不同的生物學疾病。
9.2.1 (1)經典霍奇金淋巴瘤中HRS的細胞起源
最早有關HRS表達Ig的免疫組化研究如1974年Garvin等及隨後Taylor等,他們的研究證實在霍奇金淋巴瘤活檢標本中可獲得HRS表達IgG的結果,表明HRS起源於產生Ig的B細胞,但是其他免疫組化研究顯示HRS起源於非淋巴系細胞。其後直到單克隆抗體技術的應用,發現了CD30分子。證明經典霍奇金淋巴瘤的HRS選擇性表達CD30,而正常個體只在一些活化的淋巴母細胞中表達。這一資料首次證明HRS爲淋巴細胞起源。基因水平研究表明,HRS發生克隆性Ig基因重排,在Rajewsk系列中13例霍奇金淋巴瘤中檢測到12例,stein也報道25例中檢測到24例發生重排,證明95%的HLs爲B細胞起源。序列分析證明,在重排的V區具有高負荷的體細胞突變。由於一些經典HLs的HRS細胞表達一或多個T細胞抗原以及40%的霍奇金淋巴瘤中的細胞系列具有T細胞表型和基因型,故推測剩餘的5%經典霍奇金淋巴瘤起源於轉化的T細胞。但由於在HRS細胞中還未檢測到重排的TCR基因,這一推測無法證實。最近的研究發現,經典霍奇金淋巴瘤起源於生髮中心B細胞而不是生髮中心後B細胞;B細胞系子代可發生兩種獨立的轉化,一種形成HRS細胞,另一種形成NHL;產生霍奇金淋巴瘤的轉化完全改變了普通祖細胞的形態學和免疫表型(不表達CD20、CDl0、Bcl-6和IgM並下調突變機制,表達CD30和CDl5)而轉化爲NHL的細胞或多或少保留了B細胞系祖先的特徵。某一特定病例中的HRS細胞羣體完全起源於單個轉化細胞,並克隆增殖。WHO(2001)分類中認爲結節性淋巴細胞爲主型霍奇金淋巴瘤起自生髮中心母細胞分化階段的B細胞,而經典型霍奇金淋巴瘤98%起自生髮中心分化階段中的成熟B細胞。
9.2.2 (2)NLPHL中淋巴細胞和(或)組織細胞(H和L)的細胞起源
淋巴細胞爲主型霍奇金淋巴瘤,是特徵性的腫瘤細胞[淋巴細胞和(或)組織細胞]的亞型,與進行性轉化的生髮中心的巨大結節有關。免疫組化研究表明(H和L)細胞是B細胞系列。因爲它們表達大量B細胞標誌包括CD19,CD20,CD22,CD79a和J鏈,且最近的分子學研究也提示:H和L。細胞是轉化的中心母細胞。在主要的克隆羣體中,免疫球蛋白重鏈持續發生體細胞高突變。在發達國家,EBV很少與H和L細胞有關聯,可能與本病發病無關。H和L細胞常被CD3、CD4、CD57、CD40、L-的T細胞圍繞,但此T細胞玫瑰花結的意義尚不清楚。NLPHL可能與大細胞淋巴瘤共同發生或轉爲大B細胞淋巴瘤。大量研究表明至少在一些病例中,B-DLCL和NLPHL在克隆上存在相關性。NLPHL也可具有與富組織細胞B細胞淋巴瘤(HRBCL)相似的結節或大塊區域,至少某些HRBCL病例起源於NLPHL。富T細胞B細胞淋巴瘤(TCRBCL)也可能存在上述情況。有關NLPHL細胞基因方面的資料很少,且各研究組所報道的細胞基因異常也不一致。
9.3 細胞因子
霍奇金淋巴瘤的主要組織學特徵爲:相當數量的膠原硬化、炎症細胞和惡性RS細胞,而RS細胞及背景細胞產生的細胞因子導致了各業型上的區別。在這些細胞之間有複雜的旁分泌和自分泌作用。RS細胞和反應性細胞產生的各種細胞因子既影響RS細胞又影響周圍細胞環境。例如,轉化生長因子-β1,(TGF-β1)mRNA在結節型霍奇金淋巴瘤的嗜酸性粒細胞中已被測到。儘管TGF-β1的作用決定於它與其他因子和靶細胞的相互作用,但它可以刺激成纖維細胞增生併產生膠原,可能對膠原的形成起着重要的作用,後者是結節型霍奇金淋巴瘤的特徵。對本病的發病起重要作用的另一細胞因子是IL-5。IL-5是嗜酸性粒細胞的生長因子,而嗜酸性粒細胞在一些霍奇金淋巴瘤中是主要的背景細胞,在RS細胞中也發現了IL-5mRNA。此外,RS也分泌IL-1,IL-9,腫瘤壞死因子-α,粒細胞-巨噬細胞克隆刺激因子和巨嗜細胞刺激因子。IL-6存在於10%~60%的RS細胞中,它可誘導漿細胞增生並能促進淋巴細胞增生和成熟。霍奇金淋巴瘤的不同組織學特徵可能是RS和反應性背景細胞如T淋巴細胞、組織細胞和嗜酸性細胞分泌的多種細胞因子網絡的結果。
10 病理生理
霍奇金病的瘤細胞成分複雜,伴有各種炎症細胞及血管增生,常形成肉芽腫樣結構,偶或壞死,晚期發生纖維化,其瘤巨細胞稱Reed-Sternbery細胞(簡稱R-S細胞),有診斷價值。
典型的R-S細胞體積較大,直徑15~45μm,圓或卵圓形,亦可稍不規則,埋在背景細胞中,胞質較豐富,半透明,淡嗜伊紅或嗜雙色性,雙核或1個分葉核,胞核也較大,直徑8~20μm,圓或卵圓形,染色質粗塊狀,常凝集於核膜,分佈不均勻,有明顯間隙。核仁很大,大都呈圓形,嗜伊紅或嗜雙色性,核仁周圍有空暈,形似病毒包涵體。有時也可見到多核仁或無核仁。雙核R-S細胞的胞核大小、形態相同,並緊密貼在一起,形如鏡影,又稱鏡影細胞,有重要的診斷價值。巨核或多核R-S細胞的胞核巨大,扭曲、重迭、分葉或多核。腔隙形R-S細胞的核周出現蒼白腔隙,胞核呈分葉狀,核仁小,核周僅有少量着色的胞質。腔隙的出現是由於經福爾馬林固定,使胞質收縮在覈周而引起。淋巴/組織細胞優勢型R-S細胞,體積較大,胞質嗜伊紅或嗜雙色性,核扭曲、分葉,呈空泡狀,核仁小,嗜鹼性。固縮型R-S細胞,核染色質濃染固縮如塗墨狀,外形不規則。
各型R-S細胞在霍奇金病中很少單一類型出現,而是以一類爲主伴一至幾個其它類型R-S細胞。按照目前普遍接受的Rye國際會議的分類,可將淋巴結組織象分爲以下四型。
(一)淋巴細胞優勢型
好發於35歲以下的中青年,常侵犯頸部單個或一組淋巴結,臨牀常爲I期或Ⅱ期,預後好,5年生存率達60%。又可分爲瀰漫型及結節型兩型,以前者多見。
1、瀰漫型 淋巴結結構正常或部分破壞,淋巴細胞或組織細胞增生爲主,L/H型R—S細胞不均勻散在分佈,並見由其衰亡後形成的固縮型R—S細胞,這叄者同時存在是本型的特點,少見典型的R—S細胞,嗜酸性粒細胞、中性粒細胞及漿細胞很少或缺如,無壞死和纖維化。
2、結節型 在瀰漫型背景基礎上出現散在的腫瘤性結節狀結構,結節內可有上述瀰漫型的相似改變,有時見轉化型生髮中心。
淋巴結內膠原纖維增生將淋巴樣組織分隔成大小不等的結節。典型的R-S細胞不多,但腔隙性R-S細胞多見,有不等量的嗜酸性粒細胞、中性粒細胞、漿細胞、纖維母細胞、組織細胞和不典型的單一核細胞,偶見壞死。該型常見於第Ⅱ期。
(叄)混合細胞型
處於淋巴細胞優勢型和淋巴細胞消減型之間,有不等量的典型R—S細胞、嗜酸性粒細胞、中性粒細胞、淋巴細胞、組織細胞和不典型單一核細胞。可見壞死和纖維化。無增粗的膠原束。本型見於臨牀各 期,症狀明顯,預後差,5年生存率爲30%。
(四)淋巴細胞消減型
淋巴細胞少,可見較多典型的R—S細胞以及廣泛而瀰漫的纖維化,但無膠原纖維束形成。本型多爲老年男性,有明顯的臨牀症狀,病變可累及全身淋巴結及肝、脾等臟器,預後很差,平均存活4~42個月。
本病的非特異型皮膚損害中,僅見慢性炎症浸潤。特異性皮損中可見大的細胞團塊,常深達皮下組織,組織學表現,很少像淋巴結中所見的那樣典型,難以分型。R-S細胞較少,纖維化和膠原纖維束的形成不顯着,仔細尋找纔可發現少數分葉或多核巨細胞,但不一定有特徵性的核仁。有明顯的淋巴細胞、組織細胞和嗜酸性粒細胞浸潤。
霍奇金病的免疫組化顯示本病的瘤細胞對很多種抗體均可標染,包括LCA、EMA、HLA-DR、Ia樣抗原、α1—Anti—T、溶菌酶、IL-2R、Vimetin及PCNA等,較爲理想的抗體是LeuMl及Ki-1。
電鏡下可見瘤細胞核膜逐漸加深凹陷,一個核分成對稱的二個葉,即光鏡下的鏡影細胞。核仁像編織的線團樣的核仁網,常伴核仁衛星竈,即明顯的“包涵體樣”改變。迄今雖從免疫組化及電鏡方面做了大量的工作,但霍奇金病的瘤細胞來源仍不十分清楚。
11 霍奇金病的臨牀表現
霍奇金病爲主要侵犯淋巴系統的惡性疾病,由於病變侵犯部位的不同,其臨牀表現亦各異。本病常見於男性,男女之比,歐美爲1.5:1,我國則爲2.65:1,發病年齡的第一個高峯在15~34歲之間,第二高峯在50歲以後,但我國未見此雙峯特點。病變大都原發於淋巴結,5%~9%的病例原發於淋巴結以外的部位,如實質性器官及皮膚。淋巴結受累的部位依次是:頸部及鎖骨上淋巴結(60%)、腋下淋巴結(20%)、腹股溝淋巴結(15%)、脾(10%)及肝(7%)。通常表現爲周圍淋巴結無痛性腫大,少數病人飲酒後可有腫大淋巴結疼痛感。
11.1 初發症狀與腫瘤首侵部位
表1所示具有單一初發症狀的504例患者中(同時有2或3個首發症狀未統計在內),以表淺淋巴結腫大爲首發症狀者佔絕大部分(75%),其中頸淋巴結腫大佔多數;腹部症狀表現爲腹痛、腹部腫塊;胸部症狀有胸悶、胸痛、咳嗽、氣短和胸部腫物;頭頸部症狀有咽痛、扁桃體腫大和鼻塞等;周身症狀主要表現爲發熱。腫瘤的首侵部位見表2,絕大多數爲表淺淋巴結,腹腔淋巴結包括腸繫膜和腹膜後淋巴結,還有縱隔淋巴結。霍奇金病首發結外受侵較少,主要爲小腸、胃和咽淋巴環。


11.2 周身症狀
周身症狀包括發熱、盜汗和體重減輕,其次是皮膚瘙癢和乏力。就診時伴有周身症狀者較多(55%),出現周身症狀是預後不佳的表現。霍奇金病的發熱較常見,並有一定特點。約有1/6的霍奇金病患者可出現這種週期性發熱。其發熱特點是在數天逐漸上升,體溫在38~40℃,持續數天。然後逐漸下降至正常。經過10天~6周或更長的時間間歇期,體溫又開始上升,如此週而復始,反覆出現,並逐漸縮短間歇期。
皮膚瘙癢亦是霍奇金病較爲常見的一種症狀,由局部可逐漸發展至全身,開始輕度皮癢,可使表皮脫落,皮膚增厚,嚴重瘙癢,可抓破皮膚,引起感染和皮膚色素沉着。另一特殊症狀爲飲酒痛,即飲酒後引起腫瘤部位疼痛,表現在酒後數分鐘至幾小時內發生。
11.3 淋巴結腫大
淋巴結腫大是霍奇金病最常見的臨牀表現,其中表淺淋巴結腫大最爲常見,在首侵腫瘤部位中佔86%,如加上腹腔和胸腔淋巴結腫大,則佔首侵部位的92%,(表2)。此結果與國外資料相似,霍奇金病侵犯淋巴結佔9l%,結外受侵佔9%。表淺淋巴結腫大較易發現和診斷,但初期亦易誤診爲淋巴結炎或淋巴結結核。主要以頸部淋巴結腫大最多,其次爲腋下和腹股溝淋巴結,其他還有頜下、耳前、耳後、頦下、枕部、滑車上和膕窩等淋巴結腫大則較少。
縱隔淋巴結腫大,包括肺門淋巴結腫大。在首侵腫瘤中僅佔2%(表2),但在就診時侵犯縱隔較多見。常爲兩側,多個淋巴結腫大,可以壓迫上腔靜脈,引起上腔靜脈壓迫綜合徵,也可壓迫食管和氣管,引起吞嚥受阻和呼吸困難。引起喉返神經麻痹者少見,但肺癌縱隔淋巴結轉移引起聲帶麻痹則較常見,此點可作鑑別診斷時參考。
腹腔淋巴結腫大,包括腸繫膜、腹膜後和盆腔淋巴結腫大。腫瘤增大時可擠壓胃腸道引起腸梗阻,壓迫輸尿管可引起腎盂積水,甚至產生尿毒症。
11.4 咽淋巴環
咽淋巴環包括扁桃體、鼻咽部和舌根部,在霍奇金病首侵部位中佔3%(表2),腫物增大時,可影響進食和呼吸或出現鼻塞,觸之腫物有一定硬度,並常伴有頸部淋巴結腫大。抗炎治療無效時,應儘早作腫物活檢,以確定診斷。
11.5 脾臟腫大
脾大較常見,屍檢時發生率更高。Rosenberg(1972)報道53例Ⅲ期患者,43例(8l%)有脾臟受侵,但原發於脾的霍奇金病則少見。臨牀表現爲巨大脾臟,質地較硬,可有結節,此時較易診斷。在臨牀觸診脾臟腫大時,則不能輕易診爲脾首侵。而檢查脾臟不大,也不能完全排除脾首侵。
11.6 肝臟腫大
臨牀檢查肝受侵者較脾少見,因肝受侵病變常爲瀰漫性的,肝CT檢查常不易診斷,有時可顯示有佔位病變,經肝穿刺活檢或剖腹探可確診,但在屍檢中的發生率並不少見。臨牀表現爲肝臟瀰漫性腫大,質地中等硬度,少數可捫及結節,肝功檢查多正常。
11.7 胃腸道病變
在ML的結外病變中,以小腸和胃較常見,其他還有食管、結腸、直腸,還可侵犯胰腺,但均罕見。原發於胃腸道的霍奇金病較NHL少見。
11.8 胸腔內病變
除縱隔、肺門淋巴結腫大外,還可侵犯胸膜和心包膜,產生胸腔積液和心包積液。肺受侵可出現大片浸潤或肺內結節病變,由於支氣管黏膜病變也可阻塞支氣管,引起肺不張。心臟受侵甚罕見。
11.9 神經系統病變
神經系統病變多發生在晚期,主要爲腦內病變和脊髓侵犯和脊髓受壓表現。霍奇金病中較少見。
11.10 泌尿生殖系統病變
霍奇金病較NHL少見,霍奇金病的腎臟侵犯佔13%。腎臟受侵多爲雙側浸潤性病變,或多發性小結節,也可爲孤立性較大腫塊,腎廣泛浸潤可引起尿毒症。但臨牀甚少見。原發於膀胱病變也很少見。生殖系統亦可發生於睾丸。
11.11 骨病變
骨病變骨侵犯常在屍檢時發現,發生率可達45%~60%。Shanks等(1971)收集1525例生存患者中,骨侵犯佔13.9%。骨侵犯的臨牀表現,首先爲固定部位的局部疼痛和壓痛,有報道骨侵犯108例中,72例爲多發,36例爲單發,其中8例由淋巴結直接侵犯。主要侵犯的部位爲胸椎、腰椎、肋骨,其次爲骨盆、股骨和頸椎等。產生骨膜反應的較多,尤其是長骨。骨病變的性質可爲溶骨性(75.4%)、硬化性(13.6%)或兩者兼有(5.2%)。
11.12 皮膚病變
局部或全身皮膚瘙癢是霍奇金病的常見症狀,一般在瘙癢處皮膚並無明顯病變,有人認爲是疾病活動的指徵。皮膚和皮下的繼發病變常發生於疾病晚期。非特異性皮膚表現,以帶狀皰疹較常見,這可能與霍奇金病患者免疫功能低下,易受病毒感染有關。原發性皮膚的ML爲蕈樣肉芽腫(mycosis fungoides)。
11.13 骨髓侵犯
骨髓侵犯多見於NHL,而霍奇金病甚少見。報道霍奇金病合併急性白血病有34例,包括急性粒單核細胞型、原粒細胞型、單核細胞型、幹細胞型和裏-施細胞型白血病。大多數患者的骨髓穿刺塗片檢查結果均在正常範圍,少數出現粒細胞系明顯增生,粒/紅比值高,反映中性粒細胞產生增多和(或)紅細胞系產生減少,裏-施細胞只發現於個別病例。
11.14 其他病變
11.15 分期標準
Dorothy Reed(1902)將霍奇金病(霍奇金病)分爲兩期。無全身性症狀爲Ⅰ期,出現進行性衰弱、惡病質、發熱、貧血等爲Ⅱ期。Peters(1950)根據淋巴結區受侵的範圍將霍奇金病分爲3期,所有結外侵犯均屬於Ⅲ期,每期又根據全身症狀的有、無,分爲“B”、“A”。1965年的Rye會議將霍奇金病分爲4期,所有結外侵犯均屬於Ⅳ期。表3是霍奇金病的Ann Arbor會議(1971)的分期系統,至今仍沿用未變。

12 霍奇金病的併發症
霍奇金病最常見的併發症主要見於感染、發熱,見於中樞神經系統感染、如新型隱球菌感染;也可發生血源性化膿性腦膜炎或腦腫瘤。胸悶、胸痛、咳嗽氣短、吞嚥受阻、呼吸困難、腹痛、腸梗阻、腎盂積水、尿毒症、黃疸、腹水、肝硬化、貧血、神經系統病變、脊髓壓迫症狀、腦出血等。這些既是霍奇金病的臨牀表現,亦是它的併發症。
13 實驗室檢查
13.1 病理活檢
病理活檢是確診霍奇金淋巴瘤及病理類型的主要依據。霍奇金淋巴瘤最常採用的是淋巴結活檢,當累及其他組織如皮膚等也可做活檢和印片,以助確診。肝、脾穿刺塗片及病理檢查如有適應證,也可予以適當考慮。其他結外侵犯的也儘可能取活檢證實,如縱隔淋巴結腫大,特別是無淺表淋巴結腫大的病人,也要在全面檢查後行CT下穿刺活檢。
13.2 外周血
約10%的病人有小細胞低色素性貧血,大多數由胃腸道少量失血引起。晚期常有嚴重貧血,白細胞數一般在正常範圍,也可出現白細胞總數和中性粒細胞增多。晚期病人常常有白細胞和淋巴細胞的減少,嗜酸性細胞的增加,尤其是伴有皮膚特異性損害時,血小板早期多爲正常,疾病晚期或伴有脾亢或放療、化療後減少,也可因伴發ITP而減少,甚至發生出血傾向。血液中RS細胞極罕見。併發白血病時,可有白血病的血象特點。
13.3 骨髓象
早期正常,約有3%,病例骨髓塗片可找到RS細胞,對診斷有特殊價值,但呈RS細胞白血病者極爲罕見,骨髓活檢發現RS細胞及其單核細胞變異型陽性率高於塗片,可達9%~22%。霍奇金淋巴瘤骨髓受侵常伴廣泛纖維化。LD或MC易合併骨髓受侵,而NS和NLP很少見。併發ANLL時可顯示白血病骨髓象的特點。
13.4 血沉
血沉在活動期增快,緩解期正常,爲測定緩解期和活動期較爲簡便的方法。
13.5 血清β2-微球蛋白
Hagberg等對189例未經治療腎功能正常的惡性淋巴瘤患者檢測血清β2-MG,Ⅰ、Ⅱ期霍奇金淋巴瘤患者有11%升高,Ⅲ、Ⅳ期有83%升高。
13.6 可溶性白介素-2受受體(SIL-2R)
霍奇金淋巴瘤患者的霍奇金淋巴瘤細胞和RS細胞大多數表達IL-2R,IL-2R水平與疾病的嚴重程度有關,具有較明顯的臨牀症狀或復發的病人SIL-2R常升高。
13.7 血清鐵蛋蛋白(SF)測定
活動期患者SF增高,緩解期病人SF下降,復發時又增高,提示對霍奇金淋巴瘤病人進行SF測定有助於瞭解腫瘤擴散範圍,有助於瞭解疾病的活動情況。
13.8 外周血鐵蛋白測定
13.9 血清生化檢查
如中性粒細胞鹼性磷酸酶(NAP)、血清鹼性磷酸酶(AKP)及血清乳酸脫氫酶(LDH)隨病情進展而增高;血漿蛋白電泳測定約半數晚期病例顯示γ球蛋白含量減少。血清α2-球蛋白升高。早期有40%病人IgG、IgA稍升高,而IgM降低。CRP、C3及Fg也可升高,上述檢查雖不能肯定診斷,但對病情及預後的判定可能有所幫助。
14 輔助檢查
14.1 X線檢查
各類型淋巴瘤累及縱隔的X線徵大體相似,典型霍奇金淋巴瘤胸部病變常表現爲前縱隔雙側不對稱的淋巴結腫大影,輪廓清楚,邊緣可呈直線狀或波浪狀,密度均勻無鈣化;側位胸片見腫瘤位於中縱隔的中上部。支氣管受侵可致狹窄阻塞,表現爲肺不張的X線特徵。約有30%侵及胸膜表現爲胸腔積液。有的可見病理性骨折。胃腸道淋巴瘤通過鋇劑造影可見腔內不規則充盈缺損,局部不規則的狹窄或擴張;有些可出現龕影,局部僵直,蠕動減弱或消失,較難與消化道腫瘤相鑑別。
14.2 淋巴造影術
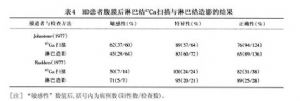
淋巴造影術目的是診斷和治療霍奇金淋巴瘤。對膈上受侵的Ⅰ~Ⅱ期霍奇金淋巴瘤,當腹部和盆腔CT陰性,尤其是要進行根治性放療時才考慮做淋巴造影術。淋巴造影術在提供正常大小淋巴結精細結構方面具有優勢,是霍奇金淋巴瘤患者腹膜後和盆腔淋巴結相當精確的方法,其敏感性和特異性在90%以上。通過分期剖腹術對CT和淋巴管造影進行比較,結果證明淋巴管造影檢查霍奇金淋巴瘤患者後腹膜淋巴結比CT的敏感性高10%,且更特異和精確。在某些方面淋巴造影術能夠彌補腹部CT掃描的不足。表4。
14.3 CT
CT對於霍奇金淋巴瘤的診斷性評估是必不可少的,爲淋巴瘤分期首選影像方法。與胸部X線相比CT能更精確的識別縱隔、心包、胸膜、肺和胸壁疾病,並且CT能識別上腹部淋巴結和腫大的肝、脾病變。胸片陰性者CT可檢出5%~30%病變,對於胸片異常者,可多發現25%~42%胸片漏診的病變。腹部、盆腔CT能準確發現增大的淋巴結,但只能以大小確定異常(≥1.5cm爲異常),無法觀察淋巴結內部結構的改變;對於實質器官,應常規做增強掃描,有助於發現病變和做出鑑別診斷。但是如果上腹部淋巴結大小正常或脾淋巴結病變,則CT無法檢測到這些隱伏病變,而這些病變的發生率爲20%~25%。表5。

14.4 B超
B超爲淋巴瘤分期常用的第2種手段,可多軸面掃查,能發現腹部、盆腔淋巴結腫大和器官受侵。
14.5 MRI
MRI易於顯示胸腔腫大淋巴結,採用專門的脈衝頻率可增強淋巴瘤的顯示。MRI的作用在於鑑別治療後纖維化與腫瘤復發或殘存;當患者對碘造影劑過敏時,MRI不僅容易鑑別淋巴結與血管,還能同時檢出肝、脾、腎、胰腺等實質器官的受侵。最近,Dohner等研究了30例淋巴瘤病人MRI與骨髓活檢的關係,除4例不符外,其餘MRI與骨髓活檢結果一致。認爲MRI是確定淋巴瘤骨髓侵犯的一個敏感方法,MRI可確定霍奇金淋巴瘤及高度惡性NHL的骨髓侵犯,從而對骨髓形態學評估作一個補充。
14.6 淋巴結掃描
據報道對未經治療的霍奇金淋巴瘤陽性診斷率爲88%,並能發現普通X線無法顯示的病竈。目前常用的是核素(Ga)掃描。Ga-67掃描有助於識別隱伏的霍奇金淋巴瘤,尤其可證實具有殘餘X線攝影異常的病人的持續病變。但是,鎵掃描偶有假陽性或假陰性結果,可高至30%~50%。PET成像技術目前處於初步階段,但具有應用前景(表4)。
14.7 99mTc全身骨掃描
其原理是將放射性核素99mTc標記在PL上作爲示蹤劑,利用PL高度聚集於肝、脾、淋巴、骨髓等網狀內皮系統的特點,用γ相機進行體外顯像。由於骨髓網狀內皮細胞吞噬膠體的活性與骨髓造血組織總活性水平相平行,故骨髓攝取99mTc-PL的量能夠間接反應各部分骨髓造血組織的活性水平。患者全身性骨髓的異常和其功能狀態可由骨髓γ顯像片直接顯示。故骨髓顯像對於瞭解惡性淋巴瘤患者骨髓功能活性水平,尋找骨髓受侵病竈,選擇穿刺定位和合理治療間隔,並隨訪觀察,均有重要臨牀價值。
15 霍奇金病的診斷
淋巴結腫大、間歇性發熱及皮膚劇癢爲本病的叄大表現,因此出現此類情況時要考慮到本病,應及時做淋巴結或皮膚活檢,切片中找到典型R—S細胞有助於確診。爲了做到適當的分期,除要求有完整的病史、體檢及化驗檢查外,應做X線平片、下腔靜脈及下肢淋巴結造影檢查及CT掃描等,並結合活檢進行分期。
15.1 確診主要依賴病變淋巴結或腫塊的病理活檢檢查
值得注意的是,淋巴結或結外淋巴組織的組織學診斷也常有困難,有些有經驗的病理學家認爲,誤診率可達25%。因此,對疑難病例,有時也要參考臨牀表現及發展的經過,此時應由臨牀醫師與病理學家共同進行討論,可能有助於提高確診率。表6。

15.2 分期
對分期方法的完整了解,對於指導完成有效而全面的有關診斷方面的檢查工作至關重要。作爲分期所進行的各種實驗室檢驗,必須因人而異地選用,而不是不加考慮地完成。目前在早期霍奇金淋巴瘤常規分期中建議應用的方法概括於下表7中,除了診斷性研究外,還應當測定全血細胞計數、血清生化和紅細胞沉降率(ESR)。歐洲和加拿大研究中已將ESR作爲早期霍奇金淋巴瘤的重要預後指標。值得注意的是,骨髓活檢檢出率很低所以在具有正常血細胞計數的無症狀早期病人在一般不行骨髓活檢。

在霍奇金病的每一期中,存在一組根據其病變部位、瘤塊大小和症狀的輕重而具有預後較好或更差的患者。目前常用的霍奇金淋巴瘤分期方法是1971年在Ann Arbor會議上通過的標準(表8)。Ann Arbor分類法中規定的這些與預後有關的因素,以及分期中的亞類所具有的重要性,已越來越多地被人們所認識,因爲治療的方法現在是根據每位患者的臨牀情況而有針對性地選用。在有關E類病損和ⅢA期的患者的預後和治療意義上存在不同意見。例如,病理分期屬ⅢA可被進一步分爲:①預後良好的腹部病變只限於上腹部淋巴結和(或)脾臟的Ⅲ1組;②預後略差者;其病變已延及下腹部中包括腹主動脈旁、髂窩,或腹股溝等處淋巴結的Ⅲ2組。

非常侷限的結外淋巴樣細胞惡變,或延及鄰近組織,但仍在主要淋巴聚集地附近,用E表示。Ⅳ期病變指結外器官瀰漫受侵,如肝臟。如果有一個或多個淋巴系統以外的器官受侵的病理證據,則用以器官的代表字母並註明(+)表示。S代表脾臟,骨髓(M)、肺實質(L)、胸膜(P)、肝臟(H)、骨髓(O)、皮膚(D)等,分別以相應字母註明。
1989年Cotswald淋巴細胞消減型會議將Ann Arbor分期予以補充、修改,此分期更明確地指出在任何一期中腫瘤負荷與預後的影響。如果治療後有殘餘,又不能區分是良性還是惡性,則用Cru標記。此分期主要用於霍奇金病,非霍奇金淋巴瘤也可參考應用。1991年建議使用的Cotswald分期系統(表9),與Ann Arbor相同,也分爲4期。然而,Cotswald分期作了許多修改,如Ⅲ期中的解剖分期。Cotswald分期中Ⅰ期和Ⅱ期與Ann Arbor相同,Ⅲ期病變累及橫膈兩側淋巴結,根據解剖部位進一步分亞組。病變處於Ⅲ期侷限於上腹部,包括脾臟、脾門淋巴結、腹腔淋巴結、肝門淋巴結。則定爲Ⅲ1期。病變處於Ⅲ期,腹腔淋巴結累及包括腹主動脈旁、髂部或腹股溝淋巴結爲Ⅲ2期。內臟受累爲Ⅳ期病變,如肺、肝或骨髓侵犯等,而非病變淋巴結的直接蔓延。來自於病變淋巴結的直接蔓延,如縱隔腫塊直接擴散蔓延至肺定爲ⅡE期。A或B症狀定義同Ann Arbor分期。

大腫塊爲縱隔腫塊大於胸腔直徑1/3以上,或任何淋巴結腫塊最大直徑>10cm以上,以X表示。CS和PS分別指臨牀分期和病理分期。美國癌症聯合會1993年對霍奇金淋巴瘤進行了臨牀分期(表10)。

分期的各項檢查及意義:
(1)常規檢查項目:
②實驗室檢查:血細胞計數,血沉,尿素氮,尿酸,電解質,肝功能測定;骨髓液抽吸與活檢;血清乳酸脫氫酶(LDH)及β2-微球蛋白水平;腦脊液檢查常規及塗片找惡性細胞;人免疫缺陷病毒(HIV)、EB病毒血清學檢查;如果有胸腔積液、腹腔積液、心包腔積液則予穿刺抽液查常規並塗片查腫瘤細胞;分子生物學檢測,如PCR擴增、流式細胞儀檢測,以斷定病變是單克隆還是多克隆,以及分析DNA的質與量。
③腹部和盆腔B超聲檢查:B超聲檢查的優點與不足與CT掃描類似,但其特殊優點是沒有放射線的危害,可經常、反覆使用。另外,對腔內積液者,可以用B超定位,尤其包裹性積液,定位後能爲臨牀醫師指示最佳穿刺部位。
④放射學檢查:胸部攝影,胸正側位片仍爲一種最基本和常用的檢查方法。可發現較明顯的縱隔、肺門淋巴結腫大和肺部及胸膜病變。側位片對於發現隆突下和內乳淋巴結較有幫助,當縱隔淋巴結病變較大時,側位片亦可對其在前、中縱隔的分佈有一估計,並觀察氣管是否有受壓移位;靜脈尿道造影;CT掃描爲淋巴瘤分期的首選影像方法,包括頸部、胸部、腹部與盆腔的CT掃描;磁共振檢查,磁共振成像(MRI)的診斷價值與CT類似,其比CT掃描的優點是隻需接受放射線,對骨骼及顱腦的影像較CT掃描清晰,而對內臟器官的效果則不如CT,當患者對碘造影劑過敏時,MRI不僅容易鑑別淋巴結與血管,還能同時檢出肝、脾、腎、胰腺等實質器官的受侵,而且在骨髓異常信號區活檢以提高陽性率等方面有應用前景。
⑤必要時檢查項目:剖腹探查,淋巴結與肝臟活檢,脾臟切除;骨骼放射攝影,放射性核素骨顯像;正電子發射斷層掃描(C-PET),可全身立體成像,不易遺漏病竈。
(2)淋巴檢查:淋巴造影可以顯示淋巴結的內部結構。有利於發現未增大的病變淋巴結,並能鑑別腫瘤或良性病變所致淋巴結腫大。但顯示範圍侷限,有些淋巴結不能顯影,不能顯示內臟。胸腹部CT掃描顯示病變範圍全面,能顯示淋巴造影不能顯示的淋巴結組與內臟。但不能觀察內部結構,只能以大小或密度辨別正常或異常。
(3)剖腹探查在分期中的價值:能瞭解較小病竈與病變性質;增加對病程發展與擴展方式的瞭解;脾切除便於以後的放療,減少左側放療併發症。但手術本身有一定的併發症,甚至導致死亡。脾切除影響機體的免疫功能。對Ⅵ期患者的必要性不大。但近10多年來,由於診斷技術的進展,可以用CT、MRI、B超聲等檢查瞭解深部臟器及淋巴結情況,剖腹探查分期已顯得不那麼重要了。剖腹探查分期同時切脾,對病人有一定損害,手術死亡率約爲0.1%,也有報道更高的死亡率。此外有一些合併症,如感染、膈下膿腫、肺栓塞、胃腸道出血、潰瘍、肺炎等,所以剖腹探查手術應持慎重態度。
(4)肝臟活檢:霍奇金病肝侵犯通常見於以下患者:淋巴造影時部位較高的主動脈旁淋巴結陽性,脾腫大的患者病理爲淋巴細胞削減型或混合細胞型。這些患者應作肝臟活檢。經皮肝臟穿刺能發現20%左右患者有肝侵犯,肝穿刺陽性再作腹腔鏡檢查可增加10%的陽性率。腹腔鏡能在直視下作多次針吸活檢。此外,腹腔鏡也能看到胃、腸繫膜、脾與脾門的病變,併發症比剖腹探查術低,對肝侵犯的診斷率不亞於剖腹探查術。
(5)核素67Ga掃描:鎵能被存活的腫瘤細胞攝取,鎵的攝取量取決於組織學上的惡性程度和病變是否活動。據報道對於胸部的活動期病變,敏感性、特異性和準確性可超過90%。對於腹部病變,因爲鎵從腸道排泄,故可靠性較差,對腹膜後淋巴結的敏感性爲10%~60%。掃描前靜脈注射67Ga 148MBq(4mCi),注射後72h內完成掃描。爲了清潔腸道,掃描前一天晚上與當天清晨,口服瀉藥。主要用於鑑別治療後纖維變與腫瘤殘存或復發。
16 鑑別診斷
近年來,有兩類淋巴瘤:即富T細胞/組織細胞性大B細胞性淋巴瘤(T/HRL-BCL)和T細胞ALCL被發現與霍奇金淋巴瘤有明顯的形態學上的重疊,從而引起鑑別診斷上的困難。其次,伴有間變性細胞學的DLBCLs可能難以與Ⅱ期LDHI或NSHL相鑑別。
16.1 富T細胞/組織細胞性大B細胞性淋巴瘤(T/HRLBCL)
在過去幾年中,幾個研究組報道了與瀰漫性LPHL或MCHL形態學特徵相近的一種少見的淋巴瘤,以小T淋巴細胞和表達B細胞抗原的分散的大腫瘤細胞爲主。典型病人表現爲進展性病程,預後差。這些病例現被命名爲富組織細胞或富T細胞性大B細胞性淋巴瘤。T/HRLBCL究竟構成一個獨特的疾病或僅僅是NLPHL的一個進展性變異型尚不明確,但由於它具有進展性臨牀病程,所以應與NLPHL或經典霍奇金淋巴瘤區分。
T/HRLBCL是一種瀰漫性腫瘤。具有富淋巴細胞性背景,伴有類上皮樣組織細胞小簇和分散的大單核細胞,提示爲LP或經典霍奇金淋巴瘤。這種大細胞可類似於爆米花樣細胞、免疫細胞和中心母細胞或三者都相似。
腫瘤細胞表達CD20和其他全B抗原,胞質輕鏈可表達也可不表達,採用Southern雜交印跡方法或全切片PCR技術可檢測到免疫球蛋白基因重組。但也可能檢測(-)。類似NLPHL,它們常爲EMA,但CD15-、CD30-和EBV-。背景淋巴細胞爲CD57-的T細胞,缺乏FDC聚集。
在與NLPHL鑑別診斷方面,大細胞的免疫表型的價值是有限的,因爲二者的免疫表型很相似;但在T/HRLBCL往往容易檢測到Ig輕鏈。此外.對CD20進行染色可顯示結節形狀和富B細胞背景,有利於NLPHL的診斷。濾泡中有FDC聚集(CD21)和存在大量CD57 細胞同樣提示NLPHL。在鑑別T/HRLBCL與經典霍奇金淋巴瘤時,免疫表型的檢測是必要的,有幫助的。如果大細胞表達CD20,而不表達CD15和CD30,診斷傾向於T/HRLBCL,若表達CD15或CD30則提示經典霍奇金淋巴瘤。若診斷爲經典霍奇金淋巴瘤的病例僅表達CD20,則其預後比表達CD15和(或)CD30,CD20/-的霍奇金淋巴瘤病例明顯不佳(表11)。

16.2 間變性大細胞性淋巴瘤(ALCL)
間變性大細胞性淋巴瘤是一種以惡性大細胞爲特徵的淋巴瘤,具有明顯的核仁和豐富的胞質,可類似單核或多核的RS細胞變異型。腫瘤細胞呈黏附性生長,常侵犯淋巴結竇。此外腫瘤細胞通常比RS細胞小。核仁較不明顯,常爲豆形或馬蹄形,核仁外周無暈輪。與單核RS細胞的圓形細胞核相反,ALCL的腫瘤細胞具有一個明顯的核旁核窩。ALCL在年齡分佈上呈雙峯曲線,在兒童和成人各有一個發病高峯。雖然ALCL臨牀上呈侵襲性,但它典型的具有良好的治療反應。尤其是兒童。由於ALCL的治療和霍奇金淋巴瘤不同。所以正確的診斷非常重要。
16.3 慢性淋巴結炎
一般的慢性淋巴結炎多有感染竈,有急性期,如足癬感染,可致同側腹股溝淋巴結腫大,或伴紅、腫、熱、痛等急性期症狀,或只有淋巴結腫大伴疼痛。急性期過後,淋巴結縮小,疼痛消失。而慢性淋巴結炎的淋巴結腫大一般約0.5~1.0cm,質地較軟、扁、多活動。與之相反,霍奇金淋巴瘤腫大淋巴結具有大、豐滿、質韌的特點,必要時需切除活檢。
16.4 急性化膿性扁桃體炎
除有不同程度的發熱外,扁桃體多爲雙側腫大,紅、腫、痛,且其上附有膿苔,捫之質地較軟,炎症控制後,扁桃體可縮小。而霍奇金淋巴瘤侵及扁桃體,可雙側也可單側,也可不對稱的腫大,捫之質地較硬、韌,稍晚則累及周圍組織,有可疑時可行扁桃體切除或活檢行病理組織學檢查。
16.5 淋巴結結核
淋巴結結核爲特殊慢性淋巴結炎.腫大的淋巴結以頸部多見,多伴有肺結核,如果伴有結核性全身中毒症狀,如低熱、盜汗、消瘦乏力等則與霍奇金淋巴瘤不易區別;淋巴結結核之淋巴結腫大,質較硬、表面不光滑,質地不均勻,或因乾酪樣壞死而呈囊性,或與皮膚粘連。活動度差,OT試驗呈陽性反應。淋巴結穿刺或活檢可找到郎漢斯細胞或上皮樣細胞。
值得注意的是,霍奇金淋巴瘤病人可以患有結核病,這可能是由於長期抗瘤治療、機體免疫力下降,從而易患結核等疾患,因此臨牀上應當提高警惕。我國醫學科學院腫瘤醫院曾有一例霍奇金淋巴瘤患者,經抗腫瘤治療後緩解一段時間,但後來持續低熱、雙肺門有放射狀陰影,經抗炎、抗真菌治療無效,而懷疑霍奇金淋巴瘤復發,給予化療,最後屍檢證實爲結核,未找到霍奇金淋巴瘤證據。
16.6 結節病
結節病多見於青少年及中年人,多侵及淋巴結,可以多處淋巴結腫大,常見於肺門淋巴結對稱性腫大,或有氣管旁及鎖骨上淋巴結受累,淋巴結多在2cm直徑內,質地一般較硬,也可伴有長期低熱。結節病的確診需取活檢,可找到上皮樣結節,Kein試驗在結節病90%呈陽性反應,血管緊張素轉換酶在結節病人之淋巴結及血清中均升高。
16.7 組織細胞性壞死性淋巴結炎
組織細胞性壞死性淋巴結炎在中國多見,多爲青壯年,臨牀表現爲持續高熱,但周圍血之白細胞數不高,用抗生素治療無效,酷似惡性網織細胞增生症。組織細胞性壞死性淋巴結炎之淋巴結腫大,以頸部多見,直徑在1~2cm,質中或較軟,不像霍奇金淋巴瘤的淋巴結。確診需行淋巴結活檢,本病經過數週後熱退而愈。
16.8 Castleman病
Castleman病是一種少見的慢性淋巴結增生性疾病,臨牀分爲局竈性和多中心性。局竈型以單個胸、腹腔或淺表淋巴結緩慢性腫大,直徑多爲3~7cm。以胸腔內特別是縱隔最常見,其次爲頸部、腋下、腹部,亦可見於結外組織。多中心型以多處淋巴結緩慢增大,形成巨大腫塊,伴有全身症狀。實驗室檢查示:貧血(100%)或同時有白細胞、血小板計數降低,多克隆免疫球蛋白增高,ESR增快,類風溼因子及抗核抗體可陽性。淋巴結穿刺見血管顯著增生和透明樣變或伴漿細胞增多。
16.9 白血病
從血及骨髓象即可作出診斷,但究竟爲淋巴細胞白血病還是淋巴瘤累及骨髓需結合病史、臨牀及實驗室檢查進行鑑別。臨牀上一般以淋巴結腫痛爲主要症狀者稱爲淋巴瘤,當出現白血病血象者即認爲淋巴瘤合併白血病。
16.10 淋巴結轉移癌
17 霍奇金病的治療
17.1 治療常規
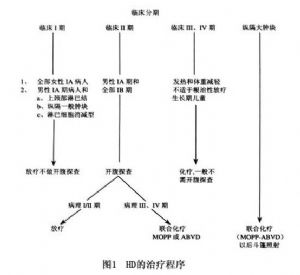
霍奇金病一般按臨牀分期採用化療和放射治療。
(1)ⅠA和ⅡA期首選放射治療(次全淋巴結照射或區域照射)。
(2)ⅠB、ⅡB和ⅢA期首選全淋巴結照射。
(3)ⅢB期和LD亞型首選化療,以後可酌情進行放射治療。
(4)縱隔大腫塊(橫徑>1/3胸腔橫徑)應先作化療2週期,腫物縮小後再放療。
(5)Ⅳ期病人以化療爲主,目前爲多數學者接受的治療方案(圖1)。
①劑量:每4~6周40~44Gy。
②照射野:次全淋巴結(STLI)照射膈上病變採用斗篷野和全肋形野照射,膈下病變採用倒丫野和斗篷野。全淋巴結(TLI)照射即斗篷野加倒丫野。
③兒童患者由於處於發育期:爲了防止放射引起的發育障礙,放療劑量應適當降低,照射野也適當限制,如改爲局部擴大野。
根據不同年齡劑量調整如下:<5歲 20Gy,5~10歲 25Gy,11~15歲 30Gy。早期霍奇金病通過照射可取得良好根治性效果。美國Stanford大學的結果如表12。近年來對於早期霍奇金病由於治癒率高和減少第2原發癌的發生,治療趨向保守。適當病例可以進行區域性照射加化療,遠期結果和全淋巴結照射相同。

17.2 化學治療
隨着新藥的增多,特別是近20年來聯合化療的發展和經驗的積累,霍奇金病的化療效果已有明顯提高。常用化療方案如表13。
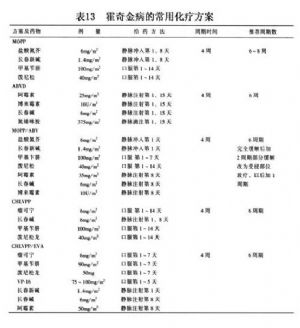
約75%~80%的霍奇金病病人通過MOPP治療可達完全緩解,約60%~65%的病人可得治癒。ABVD作爲與MOPP不交叉耐藥的補充治療,可在一定程度上提高MOPP的療效(表14,15)。


經多年的臨牀研究,ABVD方案對男性生殖細胞的抑制較MOPP輕,爲暫時性;第2原發尤其是急性白血病很少。進一步研究,意大利學者比較了半程MOPP加半程ABVD即MA/MA比全程MOPP加全程ABVD,即MM/AA的結果,完全緩解率均爲90%,5年無病生存率前者爲78%,後者爲72%,也無顯著區別。
MOPP-ABV方案取消了達卡巴嗪(氮烯咪胺),多柔比星(阿黴素)劑量加到35mg/m2,給藥方法也有一定改善,通過170例7年隨訪說明:①完全緩解率84%,②7年生存率80%,③7年無病生存率65%,與MOPP-ABVD無明顯區別,但病人耐受性較好。歐洲新設計的CHLVPP/EVA方案:苯丁酸氮芥(瘤可寧)6mg/m2口服,丙卡巴肼(甲基苄肼)90mg/m2口服,潑尼松龍50mg口服,第1~7天;VP-16 75~100mg/m2,口服,第1~5天;長春新鹼1.4mg/m2靜脈注射,第1天;長春鹼6mg/m2和多柔比星(阿黴素)50mg/m2靜脈注射,第8天。通過701例5年隨訪說明:5年生存率92%,5年無病生存率85%,但病人發生急性粒細胞白血病和MDS的相對較少。
18 預後
從上述討論,不難看出通過適當的治療多數霍奇金病可能治癒。除了注意前述的治療原則以外,應注意以下兩方面:
18.1 復發病人的處理
對於初次治療失敗或治療後復發的病人,應採取特殊的強化處理。這些病人的腫瘤細胞大都具有一定抗藥性,甚至具有多藥耐藥基因(mdr)和P糖蛋白的表達。因此,選用互不交叉耐藥的化療如ABVD方案及高劑量化療加自體骨髓移植和粒細胞-集落刺激因子(G-CSF)可取得較好的療效。Armitage等和Carella等報道,這樣治療的病人可有35%~45%長期生存。造血幹細胞輸注也已取得一定結果,但遠期療效有待觀察。目前認爲,這樣的治療主要適用於第1次治療緩解期不是1年的霍奇金病病人,不適於年邁、一般狀況不佳、多處病變且對常規化療抗拒的病人。
18.2 治療的遠期併發症
由於有效的治療可使多數病人長期生存,化療及(或)放療的遠期併發症值得注意。其中比較重要的有:
18.2.1 (1)急性粒細胞白血病(AML)
發生於治療後2~10年,可有多種分子生物學異常,特別是第5和第7染色體。目前一般認爲:①單放射很少引起AML;②MOPP 6週期治療的病人在10年內發生AML的風險爲1.5%~3.0%;③ABVD單用也很少引起AML;④有些報告認爲烷化劑與放療有協同作用,美國NCI統計在應用MOPP方案治療的霍奇金病病人中,14例發生AML,其中13例爲合併放療的病人。發生AML的風險在5年爲3%,10年爲10%,高峯爲治療後6年。這組霍奇金病病人AML的發生率爲正常人的96倍。意大利米蘭的報告單用MOPP治療的病人12年積累發生AML的佔1.4%;MOPP加放療的爲10.2%;先做放療以後再用MOPP解救的病人爲15.5%。但最近的報告則說明這種協同效應並不明顯。⑤霍奇金病病人治療後10~12年,發生AML的風險恢復到正常。因之烷化劑如氮芥、苯丁酸氮芥(瘤可寧)、亞硝脲類、丙卡巴肼是主要引起AML的藥物。
18.2.2 (2)NHL
長期生存的霍奇金病病人發生NHL已屢有報道。多數爲中度惡性結外NHL,特別是原發於消化道B細胞NHL。我院1243例霍奇金病中有2例分別在治後6年和12年發生NHL。
18.2.3 (3)其他實體瘤
也有一定程度的增多,特別是照射區域如甲狀腺癌等。