3 註解
免疫耐受(immunologic tolerance)是指免疫活性細胞接觸抗原性物質時所表現的一種異性的無應答狀態(a state of specific unresponsiveness)。它是免疫應答的另一種重要類型,其表現與前述的正相免疫應答相反,亦與各種非特性的免疫抑制不同,後者無抗原特異性,對各種抗原均呈無應答或低應答(表13-1)。
按照免疫耐受形成的特點,可分爲天然與獲得兩種。
免疫耐受既可天然獲得,亦可人工誘導。前者稱天然耐受(naturaltolerance),後者稱獲得耐受(acpuiredtolerance)。外來的或自身的抗原均可誘導免疫耐受,這些抗原稱耐受原(tolerangen)。針對自身抗原呈現的免疫耐受(self tolerance)。
按照免疫耐受的程度,又可分爲完全耐受和不完全耐受。後者又有多種形式。如僅對T細胞或B細胞產生的耐受分別稱T細胞耐受或B細胞耐受。又如免疫活性細胞僅對抗原分子上的某一特定決定簇產生耐受而不涉及對其它決定簇的應答,這些現象稱爲分離耐受(splittolerance)。不完全耐受尚可表現爲抗體分泌細胞在再次受抗原刺激後,產生低親和力抗體或缺失抗體類別轉換,是爲免疫偏離(immune deviation)。
4 免疫耐受現象的發現
4.1 天然耐受現象
1945年Owen觀察到異卵雙生小牛胎盤血管融合,血液交流而呈自然的聯體共生,可在一頭小牛的血液中同時存在有兩種不同血型抗原的紅細胞,成爲血型鑲嵌體(chimeras)。這種小牛不但允許抗原不同的血細胞在體內長期存在,不產生相應抗體,而且還能接受雙胞胎另一小牛的皮膚移植而不產生排斥反應。但是不能接受其他無關個體的皮膚移植。Owen稱這一現象爲天然耐受。Burnet等人認爲異卵雙生牛體內,對異型血細胞的耐受現象的產生是由於胚胎期免疫功能尚未成熟,異型血細胞進入胚胎牛體內,能引起對異型細胞產生抗體的免疫細胞克隆受抑制或被消滅,故此小牛出生後對胚胎期接觸過的異型紅細胞抗原不會發生免疫應答。根據這個理論,不少人進行了誘導實驗性耐受工作。
4.2 實驗誘導的耐受性
1953後Medawar等將CBA系黑鼠的淋巴細胞接種入A系白鼠的胚胎內,待A系白鼠出生8周後,將CBA黑鼠的皮膚植至該A系白鼠體上,可存活不被排斥。這一實驗證實了胚胎期接觸抗原物質,出生後對該抗原就有特異的免疫耐受現象。這一發現使人們對於耐受機制的認識有了重大的突破,提示胚胎期接觸抗原將導致耐受。其後又證明在成年動物也可引起免疫耐受性,但較胚胎期困難的多。
5 影響免疫耐受形成的因素
抗原性物質進入機體後,有時導致正相免疫應答,有時導致免疫耐受或負相免疫應答。這兩種不同免疫應答的出現,取決於諸多因素的影響,而主要與抗原物質及機體兩方面的因素有關。
5.1 抗原方面的因素
5.1.1 抗原的性質
耐受原僅是一個功能性定義,有許多因素可影響某抗原使之成爲免疫原或耐受原。例如牛或人的丙種球蛋白(BGG、HGG)呈大分子聚合狀態時具免疫原性,而分子較小的非聚合單體則是良好的耐受原。給動物注射這種耐受原後,對以後再注入的聚合丙種球蛋白表現爲無應答。一般來說分子量小的抗原其免疫原性差,導致耐受能力強,並隨分子量大小而遞減或遞增。例如多聚鞭毛素(分子量104KD)、單體鞭毛素(分子量40KD)及由單體鞭毛素提取的成分A(分子量18kD)三者的免疫原性依次遞減,而致耐受原性則依次遞增。
此外,可溶性抗原常爲致耐原,而顆粒性抗原則易於引起正相免疫應答。易被吞噬細胞迅速攝取的抗原常誘發免疫應答,而緩慢或不易被吞噬細胞攝取的抗原則多爲致耐原。抗原表位密度高,即抗原分子表面具有許多相同重複的抗原決定簇者,其致耐原強。
5.1.2 抗原的劑量
足以誘導耐受的抗原劑量隨抗原種類、動物的種屬、品系及年齡、且參與效應細胞類型等的不同而有所差異。一般來說,抗原劑量越大所誘導的耐受越完全和持久。
Mitchison在1964年首先報告高、低帶耐受性(high-zone,low-xone tolerance)現象。當他給小鼠注射低劑量(10-8M)與高劑量(10-5M)牛血清白蛋白(BSA)後,動物出現耐受。而中等劑量(10-7M)BSA引起良好的免疫應答。
T、B細胞產生耐受所需抗原劑量明顯不同。T細胞所需抗原量較B細胞要小100-10000倍,而且發生快(24小時內達高峯),持續長(數月)。而B細胞形成耐受不但需要抗原量大,且發生緩慢(1-2周),持續時間短(數週)(表13-2)。
表13-2 低帶與高帶耐受主要特徵比較
Waigle研究指出,小劑量抗原引起T細胞耐受,而大劑量抗原則引起T細胞和B細胞都耐受。
致耐受所需抗原量與個體的年齡有關,即隨年齡相應增大。與抗原的類別亦有關,即強免疫原性抗原大量注入時能引起耐受,繼續注入大量抗原使耐受性增強;胸腺非依賴抗原高劑量易致耐受,胸腺依賴抗原用高、低劑量均可引起耐受。
5.1.3 抗原注射途徑
一般來說,抗原經靜脈注射最易誘導耐受性,腹腔注射次之,皮下及肌肉注射最難。但不同的部位靜脈注射引起後果可各異。HGG經頸靜脈注入引起免疫,腸繫膜靜脈注入引起耐受;IgG或白蛋白注入靜脈能致耐受,注入周圍靜脈則引起免疫應答。有些半抗原經皮內注射能誘導抗體生成及遲髮型變態反應,但通過口服則發生耐受性。
通過腸繫膜及門靜脈注射易於致耐受的原因可能是由於肝起着生物學過濾的作用,將抗原解聚,聚合抗原被肝內枯否細胞吞噬降解,從而除去了免疫原性強的抗原部分,剩下非聚合抗原進入外周血流或淋巴道。
5.2 機體因素
5.2.1 年齡因素
年齡與耐受易感程度密切相關。Owen與Billingham等人的資料表明胚胎期與新生期的免疫系統接觸抗原(不論是天然或人工的)後,極易導致終生或長期的耐受性。其後,許多實驗證實這一現象的普遍性。這主要與免疫系統發育未成熟有關,體外實驗證明未成熟細胞大30倍以上。成年機體一般亦不易誘導耐受,常須聯合應用其他免疫抑制措施,以加速其誘導過程。
5.2.2 遺傳因素
小鼠免疫耐受及維持的難易程度隨品系不同而異。自身免疫病好發鼠(NZB×NAW)F1品系難於誘導耐受,所誘導出的耐受性維持時間短。所有自發產生類似人類系統性紅斑狼瘡(SLE)品系小鼠不易用半抗原或非聚合的免疫球蛋白誘發耐受。
5.2.3 免疫抑制的聯合應用
前已提及,單獨使用抗原一般不易對成年機體誘發耐受性,而常需要與各種免疫抑制措施聯合應用。常用的有效方法是全身淋巴組織照射,應用抗淋巴細胞血清(anti-lym-phocyte serum,ALS),抗TH細胞抗體(人抗CD4、小鼠抗L3T4),環磷酰胺,環孢素A,糖類皮質激素等免疫抑制藥物。
上述現象不僅已被許多實驗所證明,而且在器官移植臨牀工作中已被證實是延長移植物存活的有效措施,認爲是常規防止移植物排斥的方法。
單純免疫抑制藥物並不能誘導出抗原特異性的免疫耐受。這些藥物必須與抗原聯合應用,在免疫耐受形成過程中起促進作用,降低耐受原劑量,阻斷抗原刺激後免疫活性細胞的分化。
例如環磷酰對抗原誘導免疫耐受有促進作用。現已證明,環磷酰胺同時作用於T及B細胞。它參與免疫耐受誘導的機制可能與其阻止B細胞表面免疫蛋白受體的再生有關。
又如全身淋巴組織照射時用鉛板遮蔽骨髓、肺及其他生命重要的非淋巴器官,因此劑量即使高達40戈瑞(Cy)亦無副反應。這種處理可使機體胸腺及二級淋巴器官中已成熟的淋巴細胞受到破壞,造成類似新生期的狀態。此時胸腺和二級淋巴器官中未成熟的淋巴細胞可重新形成集落,細胞表面雖有抗原受體表達但尚未發育成熟。因此,全身淋巴組織照射後能用多種抗原誘導出持久的免疫耐受,如輸注同種異體骨髓能建立起同種骨髓嵌合體且不發生移植物抗宿主病。這種情況下,耐受性的維持與體內產生特異性的抑制細胞有關,稱爲天然抑制細胞。這種細胞見於新生及照射過的動物脾內,它們不具有通常T細胞表面標誌,表型類似NK細胞,但對NK細胞敏感的靶細胞並無殺傷作用。
5.3 免疫耐受的細胞學基礎
免疫耐受的細胞學基礎是T細胞和/或B細胞對某種抗原物質產生了免疫耐受性。而且只要T、B細胞兩者之一產生了免疫耐受性,均可導致免疫系統對該抗原處於負應答狀態。Chiller等將新生小鼠摘除胸腺,再用亞致死劑量的X射線照射以殺滅一切具有免疫功能的淋巴細胞,使之成爲無免疫功能小鼠,也稱“活試管”。另用大劑量單體人丙種球蛋白(HGG)注入另一同品系小鼠,造成高區帶免疫耐受,處死後取其胸腺細胞(Tt)和骨髓細胞(Bt);再取同系正常小鼠的胸腺細胞(Tn)和骨髓細胞配成四組:Tt+Bt,Tt+Bn,Tn+Bt和Tn+Bn,分別注入四隻活試管小鼠。然後用適量多聚HGG免疫接種,結果除Tn+Bn組能產生相應抗體外,其餘3組均不產生。若改用適量多聚火雞丙種球蛋白(TGG)進行免疫刺激,四組均能產生相應抗體。此實驗除證明免疫耐受有特異性外,也說明T、B細胞在形成免疫耐受中的作用。實驗還發現T細胞在注入耐受原後,即形成免疫耐受性,持續150天,而且大小劑量的耐受原均可使其耐受。而B細胞在注入耐受原後10天才形成免疫耐受性。持續50天即消退,只在注入高劑量耐受原時才形成免疫耐受性。從而說明T細胞比B細胞更易致免疫耐受。T細胞與B細胞免疫耐受性比較見表9.1。
6 免疫耐受的維持和終止
6.1 影響免疫耐受持續時間的因素
6.1.1 抗原因素
抗原的持續存在是維持機體免疫耐受性的必要因素。因免疫系統中不斷有新的免疫活性細胞產生,持續存在的抗原可使新生的免疫細胞不斷耐受。一旦體內的抗原消失,則已建立起來的免疫耐受可使耐受性也逐漸消退,對特異抗原可重新出現免疫應答。
多次重複注射耐受原可使耐受狀態延長,持續時間長短與使用抗原次數有關。
抗原的性質與耐受性維持時間也有關。一些有生命的耐受原,如活的淋巴細胞、病毒等能在體內繁殖,此種抗原在體內持續時間長,因而誘導的耐受性亦不易消退。在一些無生命的抗原中,分解緩慢的抗原較分解迅速的抗原所誘導的耐受性持續時間長。如D氨基酸多聚體在體內分解緩慢,只需一次性注射就誘導出長達一年的耐受狀態。
6.1.2 機體因素
免疫系統處於未成熟狀態時,如胎兒、新生期、經適當的免疫制措施後,所誘導的免疫耐受性維持時間長。
6.2 免疫耐受的終止
6.2.1 自發終止
已建立了耐受性的個體如無抗原的再度刺激,免疫耐受性隨着體內抗原被清除而自行消退,重新出現對特異抗原的免疫應答,此即爲免疫耐受性的自發終止。
6.2.2 特異終止
1.注射化學結構改變的耐受原如通過理化及生物因素使抗原結構改變。
2.注射置換載體的新抗原將耐受原的半抗原部分連接到另一載體上,形成新抗原。例如,事先以BSA-DNP誘發家兔產生耐受性,將DNP連接至HAS上,若將其注射至耐受家兔,可使其再度出現抗DNP抗體,即原有的特性免疫耐受性終止。
3.注射與耐受原有交叉反應的抗原具有共同抗原決定簇的各種抗原物質能夠誘導交叉反應。人體對自身抗原有免疫耐受性,接受交叉抗原刺激後,可能導致自身耐受性的終止,而出現自身免疫性。
7 免疫耐受的機制
1975年著名免疫學家Burnet提出克隆選擇學說,並以克隆清除(clonaldeletion)學說解釋免疫耐受現象。他的觀點曾對免疫學的發展產生深遠影響。隨着近代基礎免疫學,尤其是免疫調節研究的迅速發展,當前對免疫耐受機制的認識已遠遠超越了這一學說當時的涵義。它的發生涉及到免疫應答過程中任何一個正、負調節系統。下述幾種重要觀點,其各自均有相應的實驗證據。
7.1 克隆清除
Burnet的克隆選擇學說提出體內約存在着102-107具有免疫活性的細胞克隆,每一克隆細胞都具有其特異的、能與其相應抗原決定簇起反應的受體。但處於未成熟階段的T、B反應細胞系因接觸抗原而被清除,則造成免疫耐受。現知大量未成熟自身反應性T細胞在胸腺內因接觸相應的自身抗原後,發生程序性死亡而被清除,這是維持自身耐受最有效的機制。
克隆清除學說強調了免疫耐受誘導過程的中樞衰竭機制。這一學說尚不能解釋許多客觀存在的現象:①已建立的耐受性可以、甚至易於被破壞,即對原先的耐受原重新出現免疫應答;②給已建立耐受性的動物輸注同品系正常動物的淋巴細胞(含反應克隆)並不能使動物恢復對耐受原的免疫應答;③將已建立耐受動物的淋巴細胞轉移到同品系正常動物體內,能使其產生對相同抗原的耐受性;④成年機體對大多數自身抗原雖呈免疫耐受,但業已發現成年機體內可檢測到對自身抗原起反應的T和B細胞克隆的存在。
以上事實提示,在免疫耐受,尤其是獲得性免疫耐受的機體內,自身反應細胞克隆並未被徹底清除,而是處於功能受抑或無能狀態(clonalanergy)。凡是細胞表面抗原受體被封閉,抗原不能與細胞表面受體結合,缺少T細胞或巨噬細胞的輔助作用,以及T細胞與巨噬細胞主動抑制作用,抗獨特型網絡的主動抑制等都可能參與耐受的誘導過程。導致反應細胞克隆的不應答,而不能發生正相免疫應答。
7.2 克隆不應答
7.2.1 免疫活性細胞缺乏激活信號
現已知T細胞必須的激活信號至少包括:①由特異抗原與自身MHCⅠ類或Ⅱ類抗原的複合物激發的信號;②由協同刺激因子(costimulator)激發的信號。缺乏足夠的激活信號則導致免疫不應答。目前認爲,一些針對胸腺內不表達的自身抗原(如器官特異抗原)的自身反應性T細胞克隆存在於正常機體,但因帶有這些自身抗原的細胞表面通常有具有MHCⅡ類抗原,因此不能激活相應T細胞克隆。
7.2.2 免疫活性細胞激活受阻
1.免疫活性細胞表面抗原受體被封閉則可產生不應答。適量雙價或多價抗原與免疫活性細胞表面抗原受體結合,受體聚集成帽狀,使細胞活化而產生免疫應答(圖13-1B)。而單價抗原(monomeric antigen)與免疫活性細胞表面抗原各個受體結合(圖13-1A),抗原佔據整個細胞的表面受體,對受體起封閉作用,則不能激活免疫細胞。如分子表面有許多相同重複決定簇的非胸腺依賴抗原在體內不易被分解,能與B細胞表面的抗原受體呈牢固、廣泛交聯,可使受體封閉。高劑量多價抗原使細胞表面抗原受體廣泛交聯,使液態鑲嵌的細胞膜不能流動,膜受體呈“凍結”狀態,細胞不被活化(圖13-1C)。
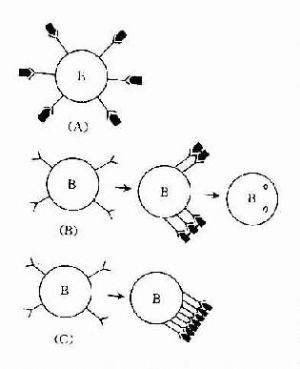
2.抗原不能抵達免疫活性細胞表面有時機體在初次接觸抗原後,產生抗體過剩,抗體與再次進入的抗原在體液中結合,使抗原不能到達細胞表面受體上,因而也可造成免疫無反應性。
7.2.3 缺乏輔助細胞
胸腺依賴抗原(自然界大多數抗原均屬此類)激發免疫應答均需TH細胞巨噬細胞的參與,若缺乏輔助細胞,免疫活性細胞單獨不能作出有效應答。
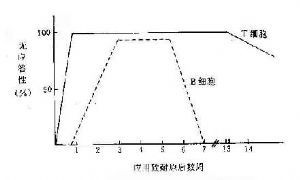
1.缺乏輔助性T細胞(TH) 前已述及T/B細胞對同一抗原產生耐受性時,表現不同的特徵。小劑量抗原便足以使T細胞產生耐受,此時B細胞雖未產生耐受,但因失去T細胞的輔助而不能活化,但是T細胞的耐受性維持時間大大超過B細胞(如圖13-2所示)。B細胞雖恢復免疫應答,但T細胞仍處於耐受狀態,因而出現T、B反應性呈分離狀態的區域(表13-3)。這時,B細胞仍缺乏必要的T細胞輔助而不能產生有效的免疫應答。
2.缺乏巨噬細胞輔助巨噬細胞在免疫應答形成中,起着重要的攝取抗原、加工和呈遞抗原的作用,從而參與了特異性免疫應答。所以巨噬細胞的功能缺陷也是耐受誘導的重要的原因。
| T細胞 | B細胞 | |
| 克隆清除 | 蛋白質抗原胸腺內誘導 機制:不成熟T細胞與抗原高親和力結合導致和序性細胞死亡(PCD) | 蛋白質抗原及非蛋白質抗原導部位骨髓或周圍尚不肯定 機制、:程序性細胞死亡(PCD) |
| 克降不應答 | APC缺乏協同刺激因子 | 多價抗原與不成熟B細胞結合 |
| 抗原性質 | 可溶性蛋白質靜脈或口服無佐劑參與 | 大劑量多糖類抗原多聚蛋白質抗原(重複表位)無TH參與 |
| 耐受期限 | 期限長 | 期限短 |
| 抗原耐受劑量 | 劑量低 | 劑量高 |
7.3 抑制細胞的作用
7.3.1 TS細胞的作用
70年代Gershon等首先提出TS細胞的現象。將耐受動物的脾或胸腺細胞轉輸給同品系正常動物後,使後者獲得耐受性,又稱爲傳染性耐受(infectious tolerance)。如果在轉輸前將脾細胞用抗Thy-1血清加補體處理,去除T細胞,則受體動物不會發生過繼性耐受。
TS細胞的作用通常是抗原特異性的,它可能是通過阻止抗原呈遞,阻斷TH細胞的功能。抑制B細胞分化以及阻斷B細胞分化爲抗體分泌細胞等環節發揮作用。
7.3.2 自然抑制細胞的作用
自然抑制(natural suppressor,NS)細胞主要抑制T細胞參與的免疫應答,無抗原特異性。這些細胞可能在新生與成年動物的耐受誘導中均起作用。NS細胞形態上爲大顆粒淋巴細胞(large granularlymphocytes,LGL),見於胚胎及新生期、出生後數天內消失,抗原不能誘導,表面無T、B細胞特有的標誌、對B細胞無抑制作用,成年動物照射後,先是NS細胞的再現,照射後短期內導入抗原,繼之便出現TS細胞。照射促使骨髓移植物存活,可能與此種機制有關。抑制功能:混合淋巴細胞反應、TC細胞生成GVH反應。
7.3.3 巨噬細胞的抑制作用
已有文現獻報告抑制性單核-巨噬細胞亞羣的存在。其抑制作用可能是由花生四烯酸代謝產物所介導。因阿司匹林和消炎痛能逆抑制作用。我國學者發現耐受動物的腹腔巨噬細胞有抑制同系正常動物混合淋巴細胞反應的作用,此作用並有抗原特異性。在對照組中,正常動物的巨噬細胞卻能增強抗原特異性的混合淋巴細胞反應。
7.3.4 抗獨特型網絡的作用
每個T、B細胞克隆均具有其獨特型。B細胞表面及分泌的免疫蛋白超變區抗原結合部位是獨特型的物質基礎。免疫球蛋白獨特型結構本身具抗原性,被相應細胞克隆識別而產生抗獨特型抗體可進一步誘導抗-抗獨特型第一系列連鎖反應。對免疫應答起“自限”作用。T、B細胞參與的免疫應答均受獨特特型網絡的調節。有人報道給新生鼠注射抗特型抗體導致長期獨型耐受,而對成年動物注射抗獨特型抗體,可引起短暫的獨特型耐受。
8 免疫耐受的臨牀意義
首先,免疫耐受的誘導、維持和破壞影響着許多臨牀疾病的發生、發展和轉歸。人們企圖誘導和維持免疫耐受性來防治超敏性疾病、自身免疫性疾病以及移植物的排斥反應。某些感染性疾病以及腫瘤生長過程中,設法解除免疫耐受、激發免疫應答將有利於對病原體的清除及腫瘤的控制。
根據免疫耐受發生機制的多樣性,對Ⅰ型變態反應患者誘導免疫耐受的可能途徑是通過B克隆清除或主動抑制。處理的方法有注射表面高密度多聚耐受原、變性蛋白抗原或脫敏療法等。
自身免疫病的發生至今認爲主要與自身耐受的破壞有關,去除導致耐受破壞的因素,當然有利於對自身免疫病的防治。
現代醫學雖然已將古人幻想的器官移植變爲現實,但同種異體免疫排斥現象仍是器官移植中主要存在的問題。免疫抑制療法上的進步有利於延長移植物存活,但非特異抑制所帶來的副作用仍有待解決。若能將特異抑制(免疫耐受)成功地應用於臨應,收到較好的效果,無疑是在此領域中的重大突破。
在麻風及慢性粘膜皮膚念珠菌病患者中,若體內出現良好的細胞免疫應答,雖抗體生成低下或甚至缺如,臨牀預後仍良好,並常伴隨有效的防禦性免疫。反之,如細胞免疫水平低下,抗體效價雖高,而預後較差,多呈進行性感染。這種分離耐受現象對感染性疾病的預後有重要影響。乙型肝炎病毒攜帶者伴有極輕微的肝炎病變,可能與新生期發生感染而使機體對病毒產生部分耐受性有關。
在對腫瘤患者的免疫治療中,解除患者的免疫耐受狀態也是一項有意義的措施。近年,美國兩家實驗室報導將一種協同刺激因子B7的基因轉染黑色素瘤細胞,並用這種轉染細胞進行防治黑色素瘤的實驗性研究,獲得可喜的成功。爲這一領域的研究開闊了新的途徑。
8.1 防止器官移植的排斥反應
目前防止器官移植排斥反應主要是採取組織配型和免疫抑制的方法。雖然這些方法也有效地提高了器官移植的存活率,但由於MHC抗原的多態性,尋找組織相容性合適類型的供者是非常困難的,另外,免疫抑制劑的毒副作用也十分明顯。因此誘導受者產生對供者器官特異性免疫耐受,是防止器官移植排斥反應最理想的方法。此外由於同種異體移植器官的短缺,因此,除了要開展同種異體移植耐受的研究外,更有必要開展異種移植耐受的研究。
8.2 自身免疫病和超敏反應的防治
機體免疫系統針對自身組織成分的抗體和致敏淋巴細胞在機體正常情況下可以有限度的存在,特別在老年人體內更爲明顯,多數屬於生理現象。當自身免疫引起相應組織器官的功能障礙並出現臨牀症狀者,稱爲自身免疫病。當自身組織抗原性發生改變,病原微生物交叉抗原的出現,免疫系統發育異常或免疫調節功能紊亂時,可導致自身耐受的終止,從而引起自身免疫病的發生。因此提高機體對自身成分的免疫耐受性是防治自身免疫病的根本方法。同樣誘導機體對變應原產生耐受性,可消除超敏反應的發生。用口服抗原誘導免疫耐受性,已在動物試驗中證明了對多種自身免疫病如糖尿病、類風溼關節炎有明顯療效,並在臨牀治療糖尿病,防止I型超敏反應等疾病上也獲得初步成功。
8.3 腫瘤及感染性疾病的治療
腫瘤的發生是由於機體對突變細胞不能及時識別和清除,也即對其產生免疫耐受的結果。乙型肝炎病毒(HBV)之所以能在體內持續存在,其主要原因之一也是免疫系統對它們產生了免疫耐受。研究這種耐受產生的原因和條件,就可以設法終止機體對某些特定抗原的耐受性,從而增強機體的主動免疫監視和免疫防禦的功能。
8.4 控制生殖過程
胎兒是一種特殊的“異體移植物”,但母體對異己的子代胚胎組織具有免疫耐受性而不進行排斥,研究母-胎耐受的機理,並控制這一過程,可以通過重建母胎耐受而防止自然流產的發生,同時也可以用免疫干預手段,打破母胎耐受進行早期人工流產以達到計劃生育的目的。