4 概述
立體定向放射外科是利用立體定向外科的原理,選擇性地確定包括正常或病變組織的顱內靶點,使用大劑量管束電離射線精確地集中照射靶點而產生局竈性破壞,從而達到治療的目的。爲了產生此種效果,必須使放射線的劑量高度集中,使射線從不同方向射入並在靶點集中成爲焦點;靶點周圍放射線劑量陡減,方可使之幾乎不受到損害。因此,對機器設計的要求極高。只有在近20年內結合了立體定向神經外科、放射治療科、影像診斷與電子計算機的最新發展,才使之日臻成熟,而作爲一個新興學科引起世界各國的普遍重視。
放射外科的原理與傳統的放射治療不同,前者爲單次集中放射使靶點短期內接受大量射線,從而引起其組織細胞本身及周圍毛細血管變性壞死;後者則爲多次反覆散漫照射,由於腫瘤細胞對射線較正常組織敏感,因而可利用其間的差異使腫瘤細胞首先遭到破壞,而正常組織得以保存。放射外科與普通神經外科亦有顯著不同。首先它避免了傳統神經外科手術,無出血、感染及機械性損傷顱內重要功能結構的危險,且可對腦深部包括腦幹在內的手術禁區的病變(如腫瘤、腦血管畸形等)進行有效的治療;其次,它從根本上改變了傳統的手術切除的觀念。過去認爲只有手術切除纔算治療,而放射外科經大劑量射線一次照射後,從影像角度雖病變依然存在,但組織已經發生凝固、壞死等改變,體積不會繼續增大,而逐漸被吸收或爲膠質瘢痕所代替。這種治療概念首先由瑞典Leksell(1951)提出,最初他將X線球管安裝在腦立體定向儀的弧形臂上不斷移動照射,以後又試用過質子光束和加速器作放射源,效果都不理想。1968年他採用60鈷,利用其可分散安裝的特性,於球形中心形成焦點,製成第一代γ刀。此後又作了許多技術修正,才逐漸於20世紀80年代投入臨牀使用。與此同時或稍後,世界上還有一些單位研究採用其他放射源進行放射外科治療,形成一個比較完整的立體定向放射外科體系。
5 治療裝置
目前比較普遍使用的治療裝置有下列數種:
5.1 1.伽瑪刀(γ刀)
1967年Leksell及其同事在瑞典Karolinska設計並安裝了第一臺γ刀。該機採用立體定向的原理,標定病人顱內靶點的座標位置,再用179個60Co源排列成半球形,經過準直器使窄條射線束精確地從不同方向對靶點集中照射,在靶區形成焦點,產生盤形壞死竈,前後徑3mm,左右徑5~7mm。這種照射野的設計,由於邊緣劑量陡降而使靶點周圍組織免遭破壞,其邊緣銳利,有如刀割,故稱γ刀。他們以此治療多動症、惡痛及數例顱咽管瘤,取得了一定效果。1970年Leksell設計出第二代γ刀,採用201個60Co放射源,使其產生球形放射野,周圍劑量遞減分佈更陡,位置誤差減少到0.1mm,且可更換準直器,可採用多個等中心,以治療形狀不整及大小不一的病變。這個富於創造性及實用性的成果受到全世界神經外科的重視。1984年Burge於瑞典設計了第三代γ刀,使用CT定位的頭部框架,並配備了電子計算機進行圖像分析,使之更加安全可靠,這種機器分別安裝在阿根廷首都布宜諾斯艾利斯及英國的謝菲爾德市。1987~1989年美國原子能委員會及FDA等機構對其進行了歷時數年的審查,獲准進入美國市場,並在匹茲堡市建立了北美第一臺γ刀治療中心。此後取得了更爲廣泛的認可與利用。
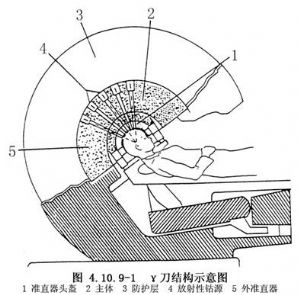
目前,γ刀由瑞典醫科達(Elekta)公司生產。其主體結構是一個半球形的金屬屏蔽系統。其中排列了201個60Co放射源,每個鈷源均有雙重不鏽鋼屏蔽,其發射的γ射線經準直器限束後,形成狹窄光束,聚焦於半球的中心。準直器分內外兩層,外層與鈷源一起固定於主機內(圖4.10.9-1)。內準直器爲半球形盔,孔洞直徑分爲4、8、14、18mm四種,可根據病變大小選擇應用;也可通過堵塞部分準直孔來適應不同形狀的腫瘤。病人治療時,首先戴上定向框架進行CT、MRI或DSA血管造影定位。所得資料經電子計算機進行圖像分析,利於電子計算機的專家系統完成劑量計算、方案選擇、驗證等工作。最後將病人頭部連同框架固定在內準直器內,使其靶點位於半球形的中心。開動機器,使病人進入主體結構內,使內外準直器的孔洞對接,開始了病人的治療。新一代的γ刀配備有不斷改進的劑量計劃軟件,使其操作進入了程序化、規範化,減少了人力計算,使之更加精確。
20世紀90年代初,我國深圳奧沃公司在瑞典靜態式γ刀的基礎上,設計研製了旋轉式γ刀。該機採用旋轉聚集的原理,將30個可旋轉照射的60Co源圍繞靶區中心裝置在半球形殼體上。治療病人時,每個源體均以病竈爲中心作錐面旋轉聚焦運動。由於射線束不以固定路徑穿越健康組織,使照射劑量分散,從而在每個單位體積內只受到瞬間或微量的照射。在保證源體和準直器精確旋轉和射野之精確聚焦的基礎上,提高了輻射野邊界的清晰度和規則性,減少了輻射半影,提高了“刀”的鋒利程度。此外,該機還在治療計劃系統、立體定向準直系統的設計上進行了修改,使其獨創的動態旋轉掃描立體定向的治療方法具有一定的革新意義。1997年5月美國FDA正式批准該機進入美國市場。
5.2 2.X刀
20世紀50年代初期,醫學工程學家推出了直線加速器。該機採用微波電場將電子加速到高能而產生高能量的X線和電子線。由於其在腫瘤治療上具有一系列的優點,在臨牀上得到了廣泛的應用。20世紀80年代初,法國的Betti及阿根廷的Derechlinsky等人在巴黎及布宜諾斯艾利斯開始將腦立體定向手段與直線加速器結合,對顱內靶區進行集中照射,開創了等中心直線加速器(lineac)放射外科即X刀的技術探索。意大利Colombo也同時提出了X刀的理論及方法。
在立體定向投照技術方面,由於計算機工業的發展,圖像處理技術大量應用於醫學,出現了高清晰度CT、MRI與DSA血管造影技術;還可將其圖像經電子計算機處理實現三維重建。在腫瘤治療方面,爲了使輻射線高劑量區的分佈形狀在三維方向上與病變(靶區)形狀一致,而提出適形放射治療(conformal radiotherapy, CRT)的理論。20世紀80年代末期,推出了應用計算機處理,將CT掃描的二維圖像重建並與二維等劑量分佈相結合的治療計劃軟件(therapy planning system, TPS),使放療方案的設計更爲合理。在此基礎上,20世紀90年代初美國及德國相繼推出了適用於頭部的立體定向放射外科技術。他們使用圖像三維重建與放射治療三維分佈相結合的軟件,根據Colombo方案將常規醫用電子直線加速器加以改進,採用專用的準直器與立體定向頭部框架,推出了適用於頭部的直線加速器立體定向放射外科治療系統,習稱“X刀”。有些廠家還推出可重複定位的無創頭部定位框架或無框頭架,將過去採用顱骨螺釘固定頭環的方法改爲根據病人面容塑形的面罩或通過病人牙齒咬合、枕部固定墊與頭部相結合的非侵入式頭環,以便在分次照射時使病人頭部可重複精確定位。
目前,X刀多使用計算機控制的直線加速器,機架圍繞等中心點作0°~360°旋轉。依其垂直旋轉與治療牀180°範圍內的水平旋轉,在靶區形成多個非共面的聚焦照射弧,使照射線集中於等中心點上。德國Leibinger等公司的X刀將病人固定在病人支撐系統(couch-based sysrem)上,使加速器機架圍繞病人作360°旋轉。荷蘭Philips公司則根據波士頓、佛羅里達大學醫院的經驗,專門設計了固定在地面上的頭部支架(floor-standing),將此支架與固定病人的立體定向框架連爲一體,且裝置方便,易於操作(圖4.10.9-2)。各型X刀的治療計劃均靠計算機的治療計劃系統完成。其軟件設計與計算機型號略有不同。新一代的軟件可三維成像。顯示病竈不同層面的照射劑量分佈,並能迅速完成治療計劃的優選,具有精確、優質、高效的功能。由於這種治療一般採用單次或4~6次的分段大劑量照射,爲避免出現誤差,每次治療前均需對機器的準確度進行驗證,故需配備模擬靶點的驗證系統。在治療方案擬訂後,可先在人體模擬底板上對病竈的三維座標進行驗證。然後再用Winston-Lutz技術進行拍片,覈對精確度可達0.3±0.1mm。

20世紀90年代初,首先在美國,以後在加拿大、德、法、意、荷、英等國相繼建立了自己設計的X刀。至1993年底,全世界安裝使用的X刀達到210臺,其中北美就有150餘臺。1995年我國北京、廣州、深圳等地也相繼推出3~4種不同類型的產品,通過監控在市場上銷售。目前世界上各家產品採用的基本技術相似,但不完全相同。如所用的頭部框架,美國Radionic公司爲BRW/CRW型頭架,加拿大Tipal公司爲Olivier-Bertrand-Tipal型頭架,德國Leibinger/Fischer公司爲改良的Reichert-Mundinger(Zmorano-Dujovny)型頭架。X刀在近幾年內的迅速發展,有與γ刀並架齊驅之勢。
5.3 3.粒子束
用於立體定向放射外科的電離輻射線,除高能光子(X線、γ線)外,還有荷電離子(包括質子、氦離子線等,習稱爲“粒子刀”)。這些輻射線的生物物理特性均適於立體定向放射外科,但不相同。光子線在組織中沿着次級粒子徑跡輻射,其線性能量傳遞(linear energy transfer,LET)較小,一般稱爲低LET線。照射時,其對腫瘤細胞的生物效應隨其含氧情況及處於不同細胞生長週期而異。即乏氧細胞和G0期細胞對之不太敏感。此外,光子穿透組織時可與之發生反應,電離效應隨進入組織的深度而遞減。若要使深部病竈獲得較理想的劑量分佈,必須沿多角度、多截面旋轉弧進行照射,方能使照射劑量匯聚到一點,實現靶點病竈的治療。加速的荷電粒子爲高LET線,如質子、π負介子及氦、碳、氧、氖等重粒子,與光子輻射有不同的生物物理特性。它們在放射生物學及物理劑量分佈上均有優勢。一般高LET線對乏氧細胞與氧合好的細胞差別不大,其潛在的致死損傷及致死損傷的修復也小。在物理性能方面,除快中子外,其他以質子線爲代表的粒子線均帶有電荷。帶電粒子在組織、水或其他介質中,都有一定的射程。當粒子射入介質後,在介質表面的能量損傷較小,隨着深度增加粒子的運動速度逐漸變慢,能量損耗也增大。接近射程終點時,粒子能量雖然很小,運動也很慢,但能量損失突然增加,形成電離吸收峯,即Bragg峯;最後粒子靜止,能量急劇下降爲零。Bragg峯值最高處,LET值最大。其位置(即深度)可用改變粒子入射能量或外加吸收體的方法來調節,以適應照射位於不同深度的腫瘤。
1904年Bragg首先指出,荷電粒子束因其特殊的物理特性,可在組織深部形成一個高劑量區,用於深部腫瘤的治療。這些特性包括:①可很好地控制線束的邊界,使之停止在深部靶區邊緣內,從而減少或避免劑量外泄;②一般情況下Bragg峯區域比較窄,現有兩種方法可使其加寬以適應臨牀的需要。第一種方法爲調節能量;即在照射時,通過粒子能量在一定範圍內的連續改變,使其峯幅加寬。第二種方法爲固定粒子能量,但在粒子輻射的途徑上加一種“山”字形濾過器,也可使其峯幅加寬。選擇不同的濾過器,便可使腫瘤照射野獲得理想的劑量分佈。其中第二種方法比較容易實現,故採用較多。
頭部的重粒子放射外科治療始於1954年。首例病人在加利福尼亞大學的Berkeley lawrance試驗室(LBL)利用其高能物理研究所的同步迴旋加速器“BEVALAC”的空餘機時進行治療。由該機產生184MeV的氦離子線,抑制垂體激素分泌,以減輕乳腺癌轉移所致的惡痛。以後經過世界各地實驗室的採用,方法不斷改進,治療了大批病例。1975~1996年Fabrikant在其實驗室共收治各種癌症患者2487例,其中He離子治療2054例,C和Ne離子治療433例,取得了很高的治療比和有效率。在顱內腫瘤方面,除抑制垂體分泌減輕轉移癌病人的惡痛外,還治療了大批垂體瘤、腦動靜脈畸形和其他腫瘤。
粒子束的治療多用迴旋加速器的射線峯值電離區進行。加速器的位置不能移動,病人臥於可作三維調節的定向固定系統內,以便使射線對準病人顱內的病竈。不斷沿水平軸轉動病人頭部,並沿垂直軸轉動治療牀以形成多平面旋轉照射弧(圖4.10.9-3)。Fabrikant採用分次照射,整個治療分3~4次完成。病人頭部固定選用無創固定法,做一個熱塑料面膜以固定頭顱。通過垂直定位的X線片和線束管曝光法使荷電離子束對準靶點,通過光圈調整線束形狀,進行照射。重複投照時,病人頭部可精確地放置到原來的位置。照射劑量及Bragg峯的寬度藉助過濾器來調節。

5.4 4.質子束
美國波士頓哈佛加速器實驗室的Kjelberg於1962年開始採用質子線定向Bragg電離吸收峯治療腦動靜脈畸形。他採用一次照射法,病人頭顱固定於BRW立體定向框架內,作腦血管造影確定畸形血管的血管巢(Nidus)的位置,確定其三維座標值,並以之爲照射靶點;而不選擇擴大增粗的供血動脈或引流靜脈。劑量設計時,要詳細評估靶容積內有無重要的功能結構。根據靶體大小、形狀進行調節和成形。病人一般於治療後次日出院。根據病情訂出複查計劃。由於每個病人對劑量反應不一,需加強隨診。Luxton(1993)對γ刀、X刀及質子或重粒子束三種裝置的性能優缺點進行了總結。經過30餘年的臨牀觀察,證明其不失爲一種良好的腫瘤放射治療的能源。Kraft(1990)總結其優點爲:①劑量分佈好;②旁散射少;③穿透性能強;④侷限劑量高。特別是專爲醫院設計的能量爲70~250MeV的醫用質子加速器,在今後10~15年內可能會在較大的腫瘤放射治療中心立足。至1993年4月已有美、日、俄、英、法、瑞士、瑞典、比利時的13家醫院建立了質子治療設備,共收治12395例患者。1990年美國羅馬林達大學建立了世界上第一臺專爲治療用的質子加速器,適用於治療視網膜惡性黑色素瘤、顱底及頸椎肉瘤、生長較慢的顱內病竈等。
6 適應症
立體定向放射外科與γ刀適用於:
6.1 1.腦血管畸形
目前見諸報道的放射外科治療的腦血管畸形有腦動靜脈畸形(AVM)、海綿狀畸形、硬腦膜動靜脈瘻等。放射外科已被公認是AVM的理想治療方法之一。其機制是照射後畸形血管內皮細胞異常增生,血管壁膠質纖維增生和纖維化,血栓形成,最終導致畸形血管完全閉塞。血管巢的中心照射劑量一般在30~50Gy,周邊劑量15~25Gy。文獻報道,治療後經腦血管造影檢查,1年時血管完全閉塞率爲30%~50%,2年閉塞率爲60%~90%。閉塞率與畸形血管巢的大小有關,血管巢體積越小,治癒率越高。γ刀治療前配合栓塞治療可以提高閉塞率。對於較大的AVM,可以分次或分塊治療。治療後3年,若畸形血管仍未完全閉塞者,可以考慮二次γ刀治療或其他治療方法。AVM經γ刀治療後,在血管完全閉塞之前,仍有出血之虞,年出血率爲2%~5%,與AVM的自然出血率大致相當。伴有癲癇發作者治療後部分病人症狀消失或明顯改善,但也有少數病人(病竈在皮層者)γ刀治療後出現新的癲癇發作(多爲急性期反應)。AVMγ刀治療後少數病人可出現腦組織水腫。海綿狀畸形血管壁較薄,壁內缺乏肌層和彈力層,放射外科治療後,不易產生血管閉塞,且治療效果不易判斷,因此,對海綿狀畸形的治療應慎重。目前只對那些有癲癇症狀的、小的或病人強烈要求治療者,才試行γ刀治療。由於治療後易出現腦水腫,病竈劑量應在14Gy以下爲宜。最近有報道硬腦膜動靜脈瘻患者經γ刀治療可取得良好效果。
6.2 2.顱內腫瘤
(1)聽神經瘤:既往聽神經瘤的治療一直以手術爲主。由於腫瘤位置深,周圍毗鄰重要結構,如腦幹、血管、顱神經等,手術較困難,術後併發症較多,尤其是術後聽神經和面神經的損傷。γ刀應用在很大程度上減少了上述併發症。瑞典的Karolinska醫院早在1968年就試用γ刀治療聽神經瘤,體外聽神經瘤細胞培養實驗照射,30Gy便可致腫瘤不可恢復的損害。近來還有人經屍檢證實在原照射區腫瘤發生邊界清晰的壞死,說明γ刀雖不像一般外科手術那樣切除腫瘤,卻可使之失活而代以皺縮及瘢痕化,故影像複查時瘤體縮小、皺縮或未增大,都意味着治療有效。現有長達20年的隨訪資料:92%的病人γ刀治療後獲得這一效果;51%聽力保持在治療前水平;90%以上的病人保存面神經功能。聽神經瘤的周邊劑量一般爲10~15Gy。較大的聽神經瘤(>3.0cm),一般不宜γ刀治療,除了療效不佳外,大的腫瘤治療後易出現腦幹和小腦水腫,症狀加重,仍需開顱手術。
其他顱神經鞘瘤如面神經瘤、三叉神經瘤等的治療及轉歸,與聽神經瘤基本相同。
(2)腦膜瘤:傳統的神經外科治療均以手術切除爲主,但近年來發現手術全部切除者仍有19%復發,手術部分切除者複發率高達40%,其中尤以顱底部的腦膜瘤最爲突出,複發率可達26%~81%。近來有人主張進行放射外科治療,其理由是:腫瘤邊界清晰,易於接受此種治療;腦膜瘤在CT與MRI圖像上顯影清晰,易於劑量計算;腦膜瘤生長緩慢且不轉移,治療後有足夠時間觀察;腦膜瘤爲腦膜供血,放射外科可對其加大照射劑量。臨牀報告,照射1年後15%縮小,85%未增大;2年後54%縮小,38%未增大,8%在照射野外復發,無死亡及嚴重併發症。因此,尤其適用於高齡、體弱不能手術者、術後殘留或復發、腫瘤位於腦幹、大血管或顱神經等危險部位者。腦膜瘤γ刀治療後易出現腦組織水腫,尤以凸面和側腦室三角區腦膜瘤反應爲重。視腫瘤大小,腦膜瘤的周邊劑量一般爲12~18Gy。
(3)垂體瘤:γ刀已成爲治療垂體瘤的一種重要治療手段。許多報道認爲,只要適應證選擇得當,其療效是肯定的。垂體微腺瘤、術後殘留復發或高齡體弱不能耐受手術者均可接受γ刀治療。Ganz等報道14例γ刀治療後患者,觀察18個月以上,邊緣劑量介於10~25Gy之間,腫瘤均得到良好控制,腫瘤消失、縮小或不再增大。不同類型的垂體瘤治療劑量不同,功能性垂體瘤高於無功能性垂體腺瘤,糾正內分泌紊亂的照射劑量遠高於控制腫瘤生長的劑量。垂體微腺瘤或小垂體瘤在不影響視神經受量時,應儘量提高照射劑量,腫瘤周邊可以達到25~30Gy。腫瘤較大,接近視神經、視交叉者,在規劃中要特別注意保護視路,確保視交叉視神經受量不超過10Gy。超過10Gy後,部分病人可出現視力下降。目前,人們正着力於選擇針對不同類型垂體瘤,既能最有效地控制瘤體,又能降低異常激素分泌,且不產生永久性併發症的最佳劑量。
(4)顱咽管瘤:顱咽管瘤位於腦底深部,周圍有大血管、顱神經和下丘腦等重要結構,手術危險大,難以全切,併發症較多,且術後極易復發。γ刀治療克服了上述缺點。對於較小的實質性腫瘤或手術殘留的實質部分可行γ刀治療,對於囊性和實質性混合的腫瘤,可結合立體定向抽吸和核素內放射治療。γ刀治療後數月腫瘤可消失或縮小,但隨着時間延長,腫瘤仍常復發。腫瘤周邊劑量一般爲10~14Gy,若腫瘤較大,視神經、視交叉不能辨認者,周邊劑量就控制在10Gy以內。
(5)膠質瘤:膠質瘤大多是惡性腫瘤,治療上應以手術和放射治療爲主,γ刀只是作爲一種輔助治療手段。有資料表明,對於瘤體較小、邊界相對清晰或手術後殘留的膠質瘤,γ刀治療可以延長生存期和提高病人生活質量。Coffey等人用γ刀治療18例高惡度膠質瘤,隨訪30個月,平均存活時間10個月(2~29個月),有的病人存活超過2年。
膠質瘤在腦內呈浸潤性生長,邊界不清,在治療時,可適當放寬照射野數毫米,儘可能將所有腫瘤包括照射野內,以防復發。γ刀治療後復發死亡病人的屍檢證明,照射野內腫瘤已全部壞死,而在其周圍腫瘤廣泛生長,證明覆發是由照射區外的腫瘤生長所致。有報告綜合治療即手術、放療、化療和放射外科治療可顯著提高患者的生存期,亦有采取X刀分次放射治療的。X刀在分次治療惡性腫瘤上有其優越性。
膠質瘤γ刀治療後易出現周圍腦組織水腫,治療前後可給予激素和脫水劑,以減輕反應。
(6)腦轉移瘤:腦轉移瘤大多體積較小,邊界清楚,很適於γ刀治療,治療後腫瘤控制率高、併發症少,腫瘤大多在數週至數月內消失或縮小,特別是瘤周水腫在治療後短期內即可明顯減輕。有大宗病例文獻報道,腦轉移瘤經放射外科治療的控制率可達90%以上,結合原發腫瘤的其他治療,可明顯延長病人的生存質量。腫瘤周邊治療劑量一般爲12~18Gy。對於多發腦轉移瘤可結合全腦分次照射。
6.3 3.功能性神經外科
γ刀在設計的初衷主要是用於功能神經外科,通過破壞腦內神經核團以治療惡痛、帕金森病及精神病等。放射外科治療的第一例病人即是通過照射半月節來治療三叉神經痛,但由於早期影像學的侷限性,腦內核團不能直接在造影片上顯示,因而受到限制。隨着現代影像學的發展,尤其是CT、MRI、SPECT、PET等技術的完善,γ刀在功能神經外科的應用正逐漸呈上升趨勢。目前開展的主要有三叉神經痛、癲癇、帕金森病以及躁鬱症和強迫症等,初步臨牀結果令人滿意,但因時間尚短,病例數尚少,遠期療效仍需進一步觀察。
(1)三叉神經痛:三叉神經痛的病因尚未明確,顯微神經外科發現絕大多數是由於三叉神經根部受微小血管的壓迫所致。目前三叉神經根微血管減壓術療效滿意,但因需開顱手術,且有一定風險,患者往往不易接受。早期的γ刀治療靶點定位在三叉神經半月節,隨着經驗的增加和影像分辨率的提高,目前靶點一般選擇三叉神經感覺根橋腦入口處,中心最大劑量爲60~90Gy,既可有效緩解疼痛,又不會影響功能,治療的風險與併發症遠遠低於手術。一般選擇的適應證爲:病史在2年以上,服用藥物效果不佳;患者不願接受手術或體質較差不能接受手術。需要指出的是,患者接受γ刀治療後多數不會馬上疼痛緩解,需要經過數月後逐步減輕直至消失,有的病人還可出現面部感覺麻木或短暫的咀嚼無力。美國匹茲堡大學Maesawa等(2001)總結220例患者的結果,治療後1年內疼痛完全緩解或部分緩解率爲85.6%;疼痛完全緩解率術後6個月爲64.9%,1年爲70.3%,33個月爲75.4%;因爲部分病人有復發,隨訪5年中完全或部分緩解率最終爲55.8%。
(2)癲癇:目前認爲癲癇發作的基本原因是腦皮質內出現高幅的爆發性的放電區域,稱爲“致癇竈”,其發病機制目前尚無一致結論。γ刀治療癲癇的機制主要有以下幾種理論:①致癇神經傳導阻滯;②癲癇神經元對放射線高度敏感學說;③放射外科可引起癲癇啓動神經元減少,興奮性降低;④放射外科可以產生致癇竈的放射性壞死,類似於病竈切除而達到抗癲癇作用。初期是在治療伴發癲癇的腫瘤或血管畸形的過程中發現,隨着原發病竈的好轉,癲癇發作也得到控制。Lindquist(1991)報告1970~1984年間治療247例動靜脈畸形(AVM)患者中59例伴有癲癇發作,治療後52例發作停止。1988年Barcia-Salorio進行了動物實驗,在貓額葉硬膜下埋藏鈷氧化物製成動物模型,然後局部用10Gy的劑量照射,結果貓的癲癇發作消失,腦電圖檢查結果也得到改善,隨後應用於臨牀,效果滿意。近10年來,隨着電生理、神經影像學的飛速發展以及諸多新技術的臨牀應用,致癇竈的定位也越來越精確,並逐漸向着三維、無創方向發展。應用放射外科治療的條件也趨於成熟。國外已有少量應用γ刀治療癲癇取得滿意療效的報道。韓國Whang(2000)報道1990~1995年間治療31例中23例病人隨訪超過1年,所有病人均爲難治性癲癇,癲癇發作的病程1到25年,平均爲11.6年。隨訪中,12例病人療效佳(Engle’s評分Ⅰ級),並且其中有3例停用了抗癲癇藥物。此外有2例發作頻率減少(Engle’s評分Ⅱ級和Ⅲ級),其餘的9例發作頻率無變化(Ⅳ級)。2000年12月法國Regis等報告應用γ刀治療25例難治性顳葉內側癲癇病人,隨訪超過24個月的16例,其中13例(佔81%)發作停止,2例減輕,平均顯效期爲10.5個月(6~12個月)。治療後平均11個月(7~22個月)在MRI檢查中發現形態學改變,有3例出現頭痛(其中2例伴有噁心嘔吐),在給予少量激素治療後症狀消失,顯示放射外科對難治性癲癇療效可靠並可以大大減少併發症。癲癇是一復雜病種,具有多樣的病因和類型,目前仍存在不少的未知因素,在治療上也有多種選擇。難治性癲癇的治療多年來一直困擾着臨牀醫生,γ刀開創了一條新的途徑,其治療創傷小,安全有效,尤其近年來採用低劑量聚焦照射的方法,對腦組織的不良反應極小,正越來越多地得到臨牀醫師的認可。
(3)帕金森病:帕金森病是發生於中年以上的中樞神經系統較常見的變性疾病,發病原因不明,主要病變在黑質及紋狀體,以震顫、肌強直、運動減少、姿勢與平衡障礙爲主要症狀。γ刀治療源自立體定向丘腦(或蒼白球)切開術,由於不需開顱,因而避免了手術可能造成出血、感染的危險。病例選擇的適應證爲:單側或雙側肢體以震顫和(或)強直等爲主要症狀,已影響生活和工作能力者;病程在2年以上,服藥無效或不能繼續接受藥物治療者。
γ刀雖具有無創、安全的優點,但由於治療前不再進行靶點的電生理驗證,也無法制作可逆性、臨時性的毀損竈,因此對於靶點的定位,毀損竈的大小、準直器的選擇、中心最大劑量,以及對周圍重要結構的影響必須進行周密謹慎的計劃。目前靶點的選擇主要爲丘腦腹外側核或蒼白球。在丘腦腹外側核團中,治療有效的核團有位於前下部的腹嘴前核(Voa)、後部的腹嘴後核(Vop)以及後下部的腹後中間核(Vim)。其中Voa核毀損後主要對緩解肌強直作用明顯,Vop核毀損後,對緩解震顫有效。近年來的臨牀結果顯示,毀損Vim覈對緩解震顫效果最佳。蒼白球腹後核毀損主要用於緩解強直症狀,對於運動遲緩症狀的緩解效果較差,並有加重的可能。一般選擇直徑4mm的準直器,中心最大劑量140~160Gy。γ刀治療後其毀損竈是逐漸形成的,症狀的緩解平均爲治療後4~6個月,因此應至少隨訪1年後才能評價其療效,並在術後半年、1年應複查MRI以顯示毀損竈的變化。2000年12月美國Young等報道應用γ刀毀損Vim核治療158例以震顫爲主的患者(其中帕金森病102例,原發性震顫52例,由梗塞、腦炎、腫瘤繼發的震顫4例),隨訪4年以上,88%的患者震顫症狀得到完全緩解或接近完全緩解,而且沒有出現併發症。
7 禁忌症
自放射外科開始臨牀使用以來,至今治療病例已逾數十萬例,其開始階段,醫生較爲謹慎,所選的病變體積和所用的照射劑量均較小。近來,隨着臨牀的廣泛應用,治療疾病的種類逐漸增多,所選的病變體積和所用的照射劑量也逐漸加大,經過隨訪,發現有些病人已出現一些不良反應,因此Lawrence(1991)提出應注意加強病變體積、照射劑量與治療反應之間關係的研究:①病變照射體積越大,治療反應越大,因此對於大型病變的照射劑量不可過大。②顱神經較腦組織更易受到照射損害,如垂體瘤、聽神經瘤照射後可發生視、聽、面、三叉神經等遲發性損害,故治療時對這些神經通路及重要神經結構的劑量都不可過大。垂體瘤治療時,照射範圍應距視路5~7mm。③隨着臨牀應用日益廣泛,應加強劑量與腫瘤體積相關性(dose-volume relationship)的研究。
8 術前準備
1.術前必須有正確的定位診斷。儘可能地避開顱內重要結構,增加手術的安全性和爭取良好的效果。
2.皮膚準備,手術前1天先用肥皂及水洗淨頭部,手術當日晨剃光頭髮。也可在手術前夕剃頭。
3.手術當日晨禁食。
4.術前晚可給苯巴比妥0.1g口服,以保證安靜休息。術前1h再給苯巴比妥0.1g,阿托品0.4mg或東莨菪鹼0.3mg肌注。
10 手術步驟
1.安裝定位框架 框架的種類依機器類別而有不同。如γ刀採用Leksell的G型框架,Phillips SRS等中心直線加速器採用BRW型框架,Fischer等中心直線加速器採用Riechert-Mundinger框架,Varian等中心直線加速器採用BRW框架等。
2.根據病情需要進行影像學檢查。一般顱內佔位性病變或功能性疾患用CT或MRI,腦血管畸形用DSA。
3.劑量計算 根據影像檢查所得圖像,確定靶點的座標位置,並結合病變的三維圖像形狀確定照射的等中心劑量分佈圖,輸入專用的計算機,根據計算機軟件設計求得照射的劑量處方,其中包括照射的座標位置、照射次數、時間及所需準直器大小等。
4.照射 根據計算機所得的劑量處方,調整好病人頭部框架的座標,固定到該機器專用的手術檯上,進行照射。如依劑量處方在一個治療中需要進行多次照射,則可依照處方要求,調整框架座標位置,逐次照射。每次照射稱爲一次靶丸(shot),每次治療由一或多個靶丸組成。
5.照射完畢,取除頭部框架,返回病房。