1 拼音
yī yòng wù huà qì chǎn pǐn zhù cè jì shù shěn chá zhǐ dǎo yuán zé
《醫用霧化器產品註冊技術審查指導原則》由國家食品藥品監督管理局於2012年5月10日食藥監辦械函[2012]210號印發。
本指導原則旨在指導和規範醫用霧化器產品的技術審評工作,幫助審評人員理解和掌握該類產品原理/機理、結構、性能、預期用途等內容,把握技術審評工作基本要求和尺度,對產品安全性、有效性作出系統評價。
本指導原則所確定的核心內容是在目前的科技認識水平和現有產品技術基礎上形成的,因此,審評人員應注意其適宜性,密切關注適用標準及相關技術的最新進展,考慮產品的更新和變化。
本指導原則不作爲法規強制執行,不包括行政審批要求。但是,審評人員需密切關注相關法規的變化,以確認申報產品是否符合法規要求。
2 一、適用範圍
本指導原則適用於第二類醫用霧化器產品(或稱霧化器)。該產品以超聲振盪或氣體壓縮機驅動的方式將藥物霧化供患者吸入。
本指導原則所稱的醫用霧化器屬於《醫療器械分類目錄》中6823-6超聲霧化器,以及《關於冷熱雙控消融針等166個產品醫療器械分類界定的通知》(國食藥監械[2011]231號)文中二(六十三)規定的壓縮式霧化器,類代號6821。
本指導原則不適用於以其他原理將藥物霧化的器具,如網式霧化器;也不適用於採用無源的方式將藥物霧化的器具,如由醫院中心供氣系統或鋼瓶提供的經過壓縮的氧氣或醫用氣體作爲氣源的藥物霧化器具。
3 二、技術審查要點
3.1 (一)產品名稱
在《醫療器械命名規則》發佈實施之前,產品的名稱應以發佈的國家標準、行業標準以及《醫療器械產品分類目錄》中的產品名稱爲依據。沒有國家標準、行業標準以及《醫療器械產品分類目錄》中無相應產品名稱的產品,其命名也應以體現產品技術結構特徵、功能屬性爲基本原則。
產品名稱可主要依據霧化的原理及方式來命名,如:“醫用超聲霧化器”或者“醫用壓縮式霧化器”。
3.2 (二)產品的結構和組成
產品的結構和組成應首先說明產品的主要部件,如有必要再對主要部件的組成進行說明。
醫用超聲霧化器一般主要由主機、霧化杯、送霧管、吸嘴或吸入面罩組成,其中的主機可由超聲波發生器(超聲換能器)、透聲薄膜、送風裝置、調節和控制系統組成。醫用超聲霧化器產品實例如圖1所示。
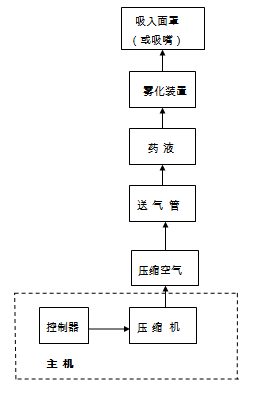
醫用壓縮式霧化器一般主要由主機、送氣管、霧化裝置、吸嘴或吸入面罩組成,其中主機主要由壓縮泵、過濾組件和控制系統組成。醫用壓縮霧化器產品實例如圖2所示。

圖2 醫用壓縮霧化器產品實例
3.3 (三)產品的工作原理
3.3.1 1.醫用超聲霧化器
超聲霧化器由超聲波發生器產生的高頻電流經過安裝在霧化缸裏的超聲換能器使其將高頻電流轉換爲相同頻率的聲波,由換能器產生的超聲波通過霧化缸中的耦合作用,通過霧化杯底部的透聲薄膜,從而使超聲波直接作用於霧化杯中的液體。當超聲波從杯底經傳導到達藥液表面時,液—氣分界面即藥液表面與空氣交界處,在受到垂直於分界面的超聲波的作用後(即能量作用),使藥液表面形成張力波,隨着表面張力波能量的增強,當表面張力波能量達到一定值時,在藥液表面的張力波波峯也同時增大,使其波峯處的液體霧粒飛出(霧粒直徑的大小隨超聲波的頻率增大而縮小,即超聲波頻率與霧粒的尺寸成反比)。由於超聲波而產生的霧粒具有尺寸均一,動量極小,故容易隨氣流行走,藥液產生霧粒的數量隨超聲波能量的增加而增多(即超聲波的功率與霧粒的數量成正比)。在醫用超聲霧化器將藥液分裂成微粒後,再由送風裝置產生的氣流作用而生成藥霧,藥霧經送霧管輸送給患者。
圖3 醫用超聲霧化器工作原理示意圖
3.3.2 2.醫用壓縮霧化器
醫用壓縮霧化器一般是通過氣體壓縮機產生的壓縮氣體爲驅動源來產生及傳輸氣霧的,其工作原理示意圖如圖4所示,其中的霧化裝置工作原理示例如圖5所示:壓縮機產生的壓縮空氣從噴嘴噴出時,通過噴嘴與吸水管之間產生的負壓作用,向上吸起藥液。吸上來的藥液衝擊到上方的隔片,變成極細的霧狀向外部噴出。
圖4 醫用壓縮霧化器工作原理示意圖
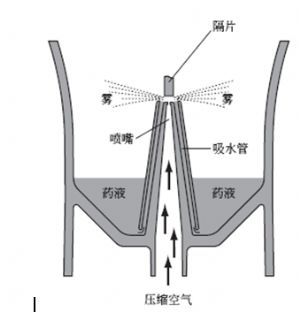
圖5 醫用壓縮霧化器霧化裝置圖示例
3.4 (四)產品的作用機理
呼吸系統是一個開放的系統,藥液在被霧化爲微粒後,患者吸入這些藥霧後,藥霧能直接吸附於患者的口腔、咽喉、氣管、支氣管、肺泡等處,經其粘膜吸收而達到治療的目的。
3.5 (五)產品適用的相關標準
GB/T 191-2008 | 包裝儲運圖示標誌 |
GB/T 2829-2002 | |
GB 9706.l-2007 | 醫用電氣設備 第1部分:安全通用要求 |
GB/T 14710-2009 | |
GB 15980-1995 | 一次性使用醫療用品衛生標準 |
GB/T 16886.1-2011 | |
YY 0109-2003* | 醫用超聲霧化器 |
YY0505-2005 | 醫用電氣設備 第1-2部分:安全通用要求 並列標準:電磁兼容 要求和試驗 |
EN 13544-1:2007 | Respiratory therapy equipment-Part 1: Nebulizing systems and their components |
*注:該標準已經完成修訂,目前尚未正式發佈,審查時應查看新標準是否實施。
上述標準包括了註冊產品標準中經常涉及到的標準。有的企業還會根據產品的特點引用一些行業外的標準和一些較爲特殊的標準。
產品適用及引用標準的審查可以分兩步來進行。首先對引用標準的齊全性和適宜性進行審查,也就是在編寫註冊產品標準時與產品相關的國家、行業標準是否進行了引用,以及引用是否準確。可以通過對註冊產品標準中“規範性引用文件”是否引用了相關標準,以及所引用的標準是否適宜來進行審查。此時,應注意標準編號、標準名稱是否完整規範,年代號是否有效。
其次對引用標準的採納情況進行審查。即,所引用的標準中的條款要求,是否在註冊產品標準中進行了實質性的條款引用。這種引用通常採用兩種方式,文字表述繁多內容複雜的可以直接引用標準及條文號,比較簡單的也可以直接引述具體要求。
注意“規範性引用文件”和編制說明的區別,通常不宜直接引用或全面引用的標準不納入規範性引用文件,而僅僅以參考文件在編制說明中出現。
如有新版強制性國家標準、行業標準發佈實施,產品性能指標等要求應執行最新版本的國家標準、行業標準。
3.6 (六)產品的預期用途
3.7 (七)產品的主要風險
風險管理報告應符合YY/T0316-2008《醫療器械 風險管理對醫療器械的應用》的有關要求,判斷與產品有關的危害,分析和評價相關風險,控制這些風險並監視控制的有效性。主要審查要點包括:
1. 是否參考YY/T0316-2008附錄C和附錄E進行產品有關的安全特徵判定和風險分析,見附件《醫用霧化器風險分析》;
2. 是否參考YY/T0316-2008附錄D進行風險評價和風險控制;
3. 風險管理、剩餘風險及生產和生產後監視相關方法是否參考YY/T0316-2008附錄F、G、J。
3.8 (八)產品的主要技術指標
本章給出醫用霧化器需要考慮的基本技術性能指標,製造商可參考相應的行業標準,根據自身產品的技術特點制定相應的性能指標。如行業標準中有不適用條款,企業在標準的編制說明中必須說明理由。鑑於目前壓縮式霧化器沒有相應的行業標準,故推薦審評人員參考下面的相關技術指標。
(1)超聲振盪頻率:霧化器超聲工作頻率與標稱頻率的偏差:≤±10%。
(2)最大霧化率:霧化器的最大霧化率必須不小於其企業標準、使用說明書(或銘牌)上的規定。
(3)霧化器水槽內溫度:霧化器水糟內水溫≤60℃。
(4)整機噪聲試驗:霧化器正常工作時的整機噪聲:≤50dB(A計權)。
(5)霧化量調節性:霧化器的霧化率宜能調節。
(7)風量調節裝置:霧化器宜在適當部位安裝風量調節裝置。
(8)定時誤差:霧化器宜有定時控制裝置,其控制時間與標稱時間的偏差不大於10%。
(9)連續工作時間:霧化器在常溫下,採用交流電源供電時,連續工作4小時以上,儀器應能正常工作;如採用直流電源供電時,連續工作1小時以上,產品標準規定的時間霧化器應能正常工作。如製造商在產品標準中規定了連續工作時間,則依據產品標準規定。
(10)外觀與結構:霧化器外觀應整潔,色澤均勻,無傷痕、劃痕、裂紋等缺陷。面板上的文字和標誌應清晰可見;霧化器塑料件應無氣泡、起泡、開裂、變形以及灌注物溢出現象;霧化器的控制和調節機構應安裝牢固、可靠,緊固部位應無鬆動;霧化器的水槽、管道應無泄漏。
(11)環境試驗:應根據產品特點,在企業標準中按GB/T14710規定氣候環境和機械環境試驗的組別,並在隨機文件中說明。試驗時間、恢復時間及檢測項目按表1的補充規定執行。
(12)吸嘴、吸入面罩:若吸嘴或吸入面罩具有醫療器械註冊證,應驗證相關註冊證件;若吸嘴或吸入面罩不具有醫療器械註冊證,製造商應公佈吸嘴、吸入面罩材料的具體成分或者提供其材質的相關證明,依據GB/T16886.1標準對其進行細胞毒性、刺激性、致敏的評價,並要求其微生物指標應符合GB15980標準的要求。
(13)等效體積粒徑分佈:與實際顆粒具有相同體積的同物質的球形顆粒的直徑叫做等效體積粒徑。按照激光散射法或EN13544-1規定的瀑布撞擊法檢測,等效體積粒徑分佈應符合製造商的規定。
(14)安全性能要求:應符合GB 9706.1、YY0505的全部要求。
2. 醫用壓縮式霧化器主要技術要求一般應包括以下內容:
(2)壓力範圍:正常狀態壓力:正常工作條件下,本體所產生的壓力應該在製造商規定的範圍以內(如60kPa~130kPa)。異常狀態壓力:當本體發生異常情況,本體所產生的最大壓力應該在製造商規定的範圍以內(如150kPa~400kPa)且不發生管體破裂現象。
(5)整機噪音試驗:吸入器正常工作時的整機噪音應符合製造商規定的噪聲要求。
(6)連續工作時間:霧化器在常溫下,採用交流電源供電時,連續工作4小時以上,儀器應能正常工作;如採用直流電源供電時,連續工作1小時以上,產品標準規定的時間霧化器應能正常工作。如製造商在產品標準中規定了連續工作時間,則依據產品標準規定。
(7)外觀與結構:霧化器外觀應整潔,色澤均勻,無傷痕、劃痕、裂紋等缺陷。面板上的文字和標誌應清晰可見;霧化器塑料件應無氣泡、起泡、開裂、變形以及灌注物溢出現象;霧化器的控制和調節機構應安裝牢固、可靠,緊固部位應無鬆動。
(8)環境試驗:應根據產品特點,在企業標準中按GB/T14710規定氣候環境和機械環境試驗的組別,並在隨機文件中說明。試驗時間、恢復時間及檢測項目按表1的補充規定執行。
(9)吸嘴、吸入面罩:若吸嘴或吸入面罩具有醫療器械註冊證,應驗證相關註冊證件;若吸嘴或吸入面罩不具有醫療器械註冊證,製造商應公佈吸嘴、吸入面罩材料的具體成分或者提供其材質的相關證明,依據GB/T16886.1標準對其進行細胞毒性、刺激性、致敏的評價,並要求其微生物指標應符合GB15980標準的要求。
(10)等效體積粒徑分佈:與實際顆粒具有相同體積的同物質的球形顆粒的直徑叫做等效體積粒徑。按照激光散射法或EN13544-1規定的瀑布撞擊法檢測,等效體積粒徑分佈應符合製造商的規定。
(11)安全性能要求
應符合GB 9706.1,YY0505-2005的全部要求。
3.9 (九)產品的檢測要求
超聲霧化器出廠前逐臺檢測產品主要項目應至少包括:最大霧化率、霧化器水糟內溫度、整機噪聲試驗、霧化量調節性、低水位報警裝置、風量調節裝置、定時誤差、連續工作時間、外觀和調節機構,應符合標準的要求。
壓縮式霧化器出廠前應逐臺檢測產品主要項目應至少包括:噴霧速率、殘液量、氣體流量、噪音、外觀與結構,應符合標準的要求。
型式檢驗項目爲標準中全部要求。
3.10 (十)產品的臨牀要求
1. 醫用超聲霧化器、醫用壓縮式霧化器可豁免臨牀試驗,審評時應要求生產企業提交書面說明。
書面說明的審評分爲兩種情況。
(1)若申報產品與已上市同類產品在作用原理、工作原理、生產工藝、預期用途和適用範圍等方面完全相同,則書面說明可以包括申請產品與已上市產品實質性等同說明等內容,建議產品的對比資料中提供該產品與已上市產品所聲明適用藥物種類的霧化顆粒等效體積粒徑分佈。
(2)若申請註冊的產品在結構組成、生產工藝、預期用途和適用範圍等方面與已上市產品有小的差別,則申請企業應在書面說明中詳細說明這種差別,並說明這種差別是否會形成新的產品安全性和有效性的風險,若這種差別可能形成新的影響產品安全性和有效性的風險,則申請企業應視風險嚴重程度補充臨牀評價資料或臨牀試驗資料。
若書面說明不能充分評價產品的安全性和有效性,生產企業應按照《醫療器械註冊管理辦法》(國家食品藥品監督管理局令第16號)的要求提交臨牀試驗資料。生產企業可對申報產品進行臨牀試驗,或者提交同類產品的對比說明和臨牀試驗資料。
2.申報產品的臨牀試驗資料要求
(1)臨牀試驗應符合《醫療器械臨牀試驗規定》(國家食品藥品監督管理局令第5號)的要求。
(2)臨牀試驗機構應爲國家食品藥品監督管理局認定公佈的藥品臨牀試驗基地。
(3)臨牀試驗方案和報告的要求
臨牀試驗方案應合理、科學並滿足倫理要求,臨牀試驗的項目內容應能反映產品的使用特性和預期目的,並與產品的安全性、實用性、可靠性、有效性密切相關。方案中病例數的確定理由應充分、科學;選擇對象的標準(診斷、納入、排除、中途退出等)、範圍應明確;符合該產品預期用途的評價要求;明確研究的療程、持續時間、對照組設置、臨牀效果的評價指標、評價標準、評價方法和統計分析方法。臨牀試驗方案應通過倫理委員會的批准。
臨牀研究報告的主要內容應與試驗方案要求一致。在主要內容中,應重點描述設計方案的要點,包括:方案修改情況(如有),受試對象及樣本量,設盲方法,對照類型,隨機分組方法,試驗各階段順序、觀察指標,有效性及安全性判定標準,數據管理及統計分析方法等。結果中表明隨機化人數、完成與未完成試驗人數及未完成原因;明確不同組間人口學指標和基線特徵,以確定可比性;對所有療效指標(主要和次要終點指標)進行統計分析,並比較處理組間差異。如有可能,應說明效應產生的時間過程。統計結果的解釋除統計學意義外,應着重考慮其臨牀意義。安全性評價應包括臨牀不良事件和嚴重不良事件,對後者應詳細描述和評價; 對試驗中的所有不良事件均應進行分析,並應比較組間差異。
臨牀試驗結論應明確該產品的安全和有效性,闡明對個體患者或針對人羣時所獲的利益和可能的風險。
3.同類產品對比說明及臨牀試驗資料的要求
提交同類產品的臨牀試驗資料、對比說明及所對比的同類產品批准上市的證明。
(1)臨牀試驗資料包括臨牀文獻或臨牀試驗報告。臨牀文獻應是省級以上核心醫學刊物公開發表的能夠說明產品預期使用效果的學術文獻、專著、文獻綜述等。臨牀試驗報告需有醫院簽章,其內容應能驗證該產品的預期用途,符合《醫療器械臨牀試驗規定》的要求。
(2)同類產品的對比說明應包括產品基本原理、結構組成、材料、主要技術性能指標、適用範圍、禁忌症等方面的比較,以充分證明申報註冊產品與已批准上市產品爲同類產品。
(3)應提供所對比的同類產品註冊證和登記表複印件。
3.11 (十一)產品的不良事件歷史記錄
暫未發現不良事件。
3.12 (十二)產品介紹、標籤和包裝標誌
1. 產品介紹、標籤和包裝標識的編寫應符合《醫療器械介紹、標籤和包裝標識管理辦法》、GB9706.1-2007《醫用電氣設備 第1部分:安全通用要求》及相關標準的規定。
2. 介紹的內容:
(1)介紹一般應包括產品名稱、規格型號、產品工作原理、預期用途、企業名稱、生產地址、註冊地址、聯繫方式和售後服務方式、許可證號、註冊證號、標準編號。
(2)介紹中對產品的描述應包括:
—建議用戶使用的最大和最小氣流量(對壓縮式霧化器應同時給出對應氣流量時的壓力)。
—最大、最小霧化量和霧化速率、推薦的氣流量,並描述其對應試驗時的壓力範圍。
—推薦使用的最大和最小溶液承載量。
—在最大藥液承載量情況下,正常使用時藥液杯中的溫度如果超出環境溫度,應明確其可達到的最大溫度。
—最大噪聲。
—關於霧化器可以霧化藥物種類的說明,對使用懸浮或高濃度藥液禁止使用的說明等。
—明確驅動氣體的種類,如不用氧氣驅動,則應警示該設備不能使用氧氣;若可以使用氧氣(氧氣的濃度>23%),則應明確氧氣安全使用的注意事項。
—建議給出在正常操作情況下,最大和最小壓力和流量情況下的霧化顆粒等效體積粒徑分佈圖。
—對於採用PVC材料製造的藥液容器或部件,應說明該產品的材料及其增塑劑成分,並提示臨牀醫護人員考慮其風險,建議臨牀醫護人員對高風險人羣使用替代產品。
(3)GB9706.1中有關介紹的相關要求:
使用說明書:
—應包括控制器顯示器和信號的功能說明,操作順序、可拆卸部件及附件的裝卸方法及使用過程中消耗材料的更換等的說明。霧化器產品介紹中應包括重新組裝的程序,並應給出在正式使用前確認重新組裝正確的推薦操作方法。
—必須向使用者和操作者說明由他們自己來進行的清洗、滅菌、預防性檢查和保養的方法,以及保養的週期,此外,還必須提出哪些部件由其他人進行預防性檢查和保養。
在正常使用時要與患者接觸的設備部件,使用說明書要包括有關可以使用的清洗、消毒或滅菌方法的細節,或在必要時規定合適的消毒劑,並列出這些設備部件可以承受的溫度、壓力、溼度和時間的限度。應明確其能夠承受的清潔滅菌週期。
針對更換部件及清洗說明,應重點考慮藥液杯承裝不同藥液後的殘留問題如何解決,採取何種更換或清洗應說明。
—介紹中應包括監測、提示以及保護措施:比如描述驗證產品提示作用的方法;壓力釋放閥安裝的細節。
—介紹中應包括電磁兼容性的相關描述:如周圍環境中超出YY0505標準要求的電磁干擾可能會影響霧化器的性能。
—介紹中應包括由於設備處置導致可能風險產生後的處理方式,應包括產品對環境保護的影響。
—介紹中必須說明設備上的圖形、符號、警告性說明和縮寫含義。
—只打算將信號輸出和信號輸入部分和符合產品標準要求的規定設備相連接時,必須在使用說明書中予以說明。
—配有一次性電池的設備,必須要有警告,若在一段時間內不可能使用設備時必須取出這些電池;配有可充電電池的設備,必須要有如何安全使用和保養的說明;有特定供電電源或電池充電器的設備,必須規定特定電源或電池充電器必須保證符合產品標準要求。
技術介紹:
—企業聲明的最不利條件下氣體輸出的壓力和流量特性;
—若使用,應包括不同氣源的流量範圍;
—安裝單向閥和壓力釋放閥的細節;
—可重複使用部件的壽命。
除此之外,技術介紹還應包括GB9706.1中有關技術介紹的要求,比如所有設備或設備部件外部標記數據、爲安全運行必不可少的所有特性參數(或指明可以找到這些參數的出處)、爲安裝設備和將設備投入使用時要採取的一些特別措施和特別條件、產品的電路圖、元器件清單、圖注、校正細則,或其他有助於用戶方的合格技術人員修理由廠方指定可修理的設備部件所必需的資料、運輸和貯存時的允許環境條件。
(4)介紹中注意事項應包括以下內容:
—應醒目地標識出本產品應在醫生指導下購買和使用;
—應明確本產品使用的環境、使用人羣以及限制使用的藥物種類,應遵醫囑考慮藥物霧化使用的適用性;
—明確本產品是否爲多人使用或僅限同一個人使用,若多人使用應描述其風險及處理方法;
—明確本產品與人體接觸的附件是否爲一次性使用或僅限同一個人使用,若該附件一次性使用則應描述相關標識及用後的產品處理情況,若該附件僅限同一個人使用應描述其風險及處理方法;
—勿在藥液杯中存有藥液時放置或攜帶;
—使用後必須將電源拔下;
—清潔保養時必須將電源拔下。
3.13 (十三)註冊單元劃分的原則和實例
醫用霧化器產品註冊單元的劃分應考慮霧化原理、技術結構是否相同,採用同一霧化原理且技術結構相同則可以作爲一個註冊單元。
霧化原理不同,如超聲霧化器和壓縮式霧化器不能作爲一個註冊單元。
技術結構不同,如未安裝內置風機、定時裝置等的簡易式霧化器,與普通霧化器技術結構不同,不能作爲一個註冊單元。
3.14 (十四)同一註冊單元中典型產品的確定原則和實例
同一註冊單元中的典型產品是指能夠代表本註冊單元內其他產品安全性和有效性的產品,其結構和功能最複雜、風險最高。霧化器的典型產品應選擇能夠覆蓋註冊單元內全部產品功能的產品,例如霧化量調節範圍最大的產品。
4 三、審查關注點
(一)產品電氣安全性能和主要技術性能是否執行了國家和行業的強制性標準,性能指標的確定是否能滿足產品的安全有效性,霧化顆粒等效體積粒徑分佈是否做出了要求。
(二)介紹中必須告知用戶的信息是否完整,如應明確本產品使用的環境、使用人羣和限制使用的藥物種類;應明確產品一次性使用部件的使用注意事項等。
(三)產品的主要風險是否已經列舉,並通過風險控制措施使產品的安全性在合理可接受的程度之內。
(四)產品中裝藥液的容器、接觸藥液的部件應要求企業明確使用的材料,並且說明該材料採用的塑化劑。對霧化器的藥液容器及其部件,建議不得采用鄰苯二甲酸酯類塑化劑,或者提供證據表明其材料符合GB15593-1995關於醇溶出物的限量要求。
5 附件:醫用霧化器風險分析
標準 條款 | YY/T0316-2008附錄C標準要求 | 特徵判定 | 可能的危害 | ||
C.2.1 | |||||
— 對疾病的診斷、預防、監護、治療或緩解, | 是 | 療效果 | |||
— 或對損傷或殘疾的補償,或 | —— | ||||
—— | |||||
成人 | 操作危害: 兒童使用時請確保有監護人在場,否則錯誤使用可能引起症狀惡化。 不完整的使用說明書等。 | ||||
—— | |||||
—— | |||||
C.2.2 | |||||
應當考慮的因素包括植入的位置、患者羣體特徵、年齡、體重、身體活動情況、植入物性能老化的影響、植入物預期的壽命和植入的可逆性 | —— | ||||
C.2.3 | |||||
C.2.4 | 在醫療器械中利用何種材料或組分,或與醫療器械共同使用或與其接觸? 應當考慮的因素包括: | ||||
— 和有關物質的相容性; | —— | ||||
PVC | |||||
— 與安全性有關的特徵是否已知; | —— | ||||
—— | |||||
C.2.5 | 應當考慮的因素包括: | ||||
氣流壓力 | |||||
— 對其的控制、質量、數量、強度和持續時間; | 參見各產品介紹 | 不完整的使用說明; 性能特徵不適當的描述; 不適當的預期使用規範; 限制未充分公示。 | |||
依據企業提供資料定 | |||||
C.2.6 | 應當考慮的因素包括: | ||||
— 物質是供給還是提取; | 供給藥液 | 藥液的種類、用量、用法請遵醫囑,否則可能引起症狀惡化; 不完整的使用說明等。 | |||
— 是單一物質還是幾種物質; | 依據企業信息提供 | 藥液的種類、用量、用法請遵醫囑,否則可能引起症狀惡化。 不完整的使用說明等。 | |||
依據企業信息提供 | - | ||||
C.2.7 | |||||
可能用於再次使用 | 限制未充分公示; | ||||
C.2.8 | 醫療器械是否以無菌形式提供或預期由使用者滅菌,或用其他微生物學控制方法滅菌? 應當考慮的因素包括: | ||||
一次性面罩等可爲一次性使用,其餘產品可爲重複使用 | |||||
— 儲存壽命的標示; | 依據企業信息提供 | - | |||
— 重複使用週期次數的限制; | 依據企業信息提供 | 不完整的使用說明。 | |||
依據企業信息提供 | |||||
依據企業信息提供 | 不完整的使用說明。 | ||||
C.2.9 | |||||
應當考慮的因素包括使用的清潔劑或消毒劑的類型和清潔週期次數的限制。醫療器械的設計可影響日常清潔和消毒的有效性。另外,應當考慮清潔劑或消毒劑對器械安全性和性能的影響。 | 依據企業信息提供 | ||||
C.2.10 | |||||
應當考慮的因素包括: | |||||
— 溫度; | 介紹中未進行說明提示,可能引起燙傷。 | ||||
— 溼度; | —— | ||||
— 大氣成分; | —— | ||||
— 壓力; | —— | ||||
— 光線 | —— | ||||
C.2.11 | 是否進行測量? | ||||
—— | |||||
C.2.12 | |||||
—— | |||||
C.2.13 | |||||
應當考慮的因素包括識別可能涉及的任何其他醫療器械、醫藥或其他醫療技術和與其相互作用有關的潛在問題,以及患者是否遵從治療。 | 本產品與藥品聯合使用 | 介紹中沒有詳細說明,藥液的種類、用量、用法請遵醫囑,可能引起症狀惡化。 | |||
C.2.14 | 是否有不希望的能量或物質輸出? | ||||
應當考慮的與能量相關的因素包括噪聲與振動、熱量、輻射(包括電離、非電離輻射和紫外/可見光/紅外輻射)、接觸溫度、漏電流和電場或磁場。 | 可能會有漏電流、接觸溫度、電磁 | 電磁能危害: 由於本體的動作的電磁波的影響,引起其他醫療機器的誤動作。 熱能危害: 由於長時間的使用,本體表面溫度上升可能引起燙傷。 漏電流危害: 噪音危害: | |||
- | |||||
—— | |||||
C.2.15 | |||||
受電磁干擾 | 高、低溫溼度危害: (治療)使用過程中,由於高低溫溼度的變化等引起本體故障。 墜落危害: 由於高處墜落的原因,導致本體故障; 電磁能危害: | ||||
C.2.16 | |||||
應當考慮的因素包括: | |||||
— 對能源和致冷供應的影響; | —— | ||||
— 毒性物質的散發; | —— | ||||
— 電磁干擾的產生。 | 可能 | 電磁能危害: 由於本體的動作的電磁波的影響,引起其他醫療機器的誤動作。 | |||
C.2.17 | 醫療器械是否有基本的消耗品或附件? | ||||
應當考慮的因素包括消耗品或附件的規範以及對使用者選擇它們的任何限制。 | 有 | 不完整的使用說明; 性能特徵不適當的描述; 不適當的預期使用規範; 限制未充分公示。 | |||
C.2.18 | |||||
應當考慮的因素包括: | |||||
— 維護或校準是否由操作者或使用者或專門人員來進行? | 依據企業自定情況 | - | |||
依據企業自定情況 | - | ||||
C.2.19 | |||||
- | |||||
C.2.20 | 醫療器械是否有儲存壽命限制? | ||||
應當考慮的因素包括標記或指示和到期時對醫療器械的處置。 | 有 | - | |||
C.2.21 | 是否有延時或長期使用效應? | ||||
應當考慮的因素包括人機工程學和累積的效應。其示例可包括含鹽流體泵有隨着時間推移的腐蝕、機械疲勞、皮帶和附件鬆動、振動效應、標籤磨損或脫落、長期材料降解。 | 依據企業實際情況 | 不完整的使用說明; 性能特徵不適當的描述; 不適當的預期使用規範; 限制未充分公示。 | |||
C.2.22 | 醫療器械承受何種機械力? | ||||
—— | |||||
C.2.23 | 什麼決定醫療器械的壽命? | ||||
應當考慮的因素包括老化和電池耗盡。 | 老化、消毒滅菌 | 操作危害: 由於長期使用導致部件老化,有可能不能正常動作,起症狀惡化。 不完整的使用說明; 性能特徵不適當的描述; 不適當的預期使用規範; 限制未充分公示。 | |||
C.2.24 | |||||
應當考慮的因素包括:器械使用後是否自毀?器械已使用過是否顯而易見? | 可能 | 不完整的使用說明; 性能特徵不適當的描述; 不適當的預期使用規範; 限制未充分公示。 | |||
C.2.25 | |||||
不完整的使用說明; 性能特徵不適當的描述; 不適當的預期使用規範; 限制未充分公示。 | |||||
C.2.26 | |||||
依據企業實際情況 | 操作危害: 兒童使用時請確保有監護人在場,否則錯誤使用可能引起症狀惡化; 藥液的種類、用量、用法請遵醫囑,否則可能引起症狀惡化。 不完整的使用說明。 | ||||
C.2.27 | 如何提供安全使用信息? | ||||
應當考慮的因素包括: | |||||
— 信息是否由製造商直接提供給最終使用者或涉及的第三方參加者,如安裝者、護理者、衛生保健專家或藥劑師,他們是否需要進行培訓; | 依據企業實際情況 | 操作危害: 兒童使用時請確保有監護人在場,否則錯誤使用可能引起症狀惡化; 藥液的種類、用量、用法請遵醫囑,否則可能引起症狀惡化。 不完整的使用說明。 | |||
— 試運行和向最終使用者的交付,以及是否很可能/可能由不具備必要技能的人員來安裝; | 依據企業實際情況 | 操作危害: 兒童使用時請確保有監護人在場,否則錯誤使用可能引起症狀惡化; 不完整的使用說明。 | |||
依據企業實際情況 | 不完整的使用說明。 | ||||
C.2.28 | |||||
應當考慮的因素包括新技術或新的生產規模。 | 依據企業實際情況 | - | |||
C.2.29 | 醫療器械的成功使用,是否關鍵取決於人爲因素,例如用戶界面? | ||||
C.2.29.1 | 用戶界面設計特性是否可能促成使用錯誤? | ||||
應當考慮的因素是可能促成使用錯誤的用戶界面設計特性。界面設計特性的示例包括:控制和顯示器、使用的符號、人機工程學特性、物理設計和佈局、操作層次、驅動裝置的軟件菜單、警示的可視性、報警的可聽性、彩色編碼的標準化。適用性的附加指南見 IEC 60601-1-6,報警的附加指南見YY/T 0316-2008/ISO 14971:2007、IEC 60601-1-8 | 可能 | - | |||
C.2.29.2 | |||||
應當考慮的因素包括: | |||||
— 使用錯誤的後果; | 霧化量和霧化時間不符合臨牀治療要求 | - | |||
— 分散注意力的情況是否常見; | 不常見 | - | |||
不常見 | - | ||||
C.2.29.3 | 醫療器械是否有連接部分或附件? | ||||
有 | 操作危害: 部件之間沒有很好的組裝,導致不能正常動作,症狀惡化。 不適當的預期使用規範。 | ||||
C.2.29.4 | |||||
應當考慮的因素包括間隔、編碼、分組、圖形顯示、反饋模式、出錯、疏忽、控制差別、可視性、動或變換的方向、以及控制是連續的還是斷續的、和設置或動作的可逆性。 | —— | ||||
C.2.29.5 | |||||
應當考慮的因素包括在不同環境下的可視性、方向性、使用者的視力、視野和透視、和顯示信息的清晰度、單位、彩色編碼、以及關鍵信息的可達性。 | 依據企業實際情況 | - | |||
C.2.29.6 | |||||
應當考慮的因素包括層次的複雜性和數量、狀態感知、路徑設置、導向方法、每一動作的步驟數量、順序的明確性和存儲問題,以及有關其可達性的控制功能的重要性和偏離規定的操作程序的影響。 | 依據企業實際情況 | 不完整的使用說明; 性能特徵不適當的描述; 不適當的預期使用規範; 限制未充分公示。 | |||
C.2.29.7 | |||||
是,由專業醫生指導使用 | 操作危害: 兒童使用時請確保有監護人在場,否則錯誤使用可能引起症狀惡化,甚至附件等被吸入咽喉; 藥液的種類、用量、用法請遵醫囑,否則可能引起症狀惡化。 不完整的使用說明。 | ||||
C.2.30 | |||||
應當考慮的因素是錯誤報警、不報警、報警系統斷開,不可靠的遠程報警系統的風險和醫務人員理解報警系統如何工作的可能性。IEC 60601-1-8[26]給出了報警系統的指南。 | - | ||||
C.2.31 | 醫療器械可能以什麼方式被故意地誤用? | ||||
應當考慮的因素是連接器的不正確使用、喪失安全特性或報警不能工作、忽視製造商推薦的維護。 | 可能存在 | 本體在被褥下長時間使用,導致本體溫度升高而使外殼變形,不能正常動作,甚至火災以及燙傷等; 沒有使用專用配件(如過濾片、電源適配器等)的情況下,而導致本體動作不正常,症狀惡化等; 送氣管被彎曲,而導致氣流的阻塞,而導致本體動作不正常,症狀惡化。 不完整的使用說明書等。 | |||
C.2.32 | |||||
應當考慮的因素包括數據被修改或被破壞的後果。 | —— | ||||
C.2.33 | |||||
應當考慮的因素是必要的把手、手柄、輪子、制動、機械穩定性和耐久性。 | 多爲便攜式 | 墜落危害: 由於高處墜落的原因,導致本體故障。 不完整的使用說明書等。 | |||
C.2.34 | |||||
應當考慮的因素例如是生命支持器械的輸出特徵或報警的運行。有關醫用電氣設備和醫用電氣系統的基本性能的討論見IEC 60601-1 | 不完整的使用說明; 性能特徵不適當的描述; 不適當的預期使用規範; 限制未充分公示。 | ||||
6 醫用霧化器產品註冊技術審查指導原則編制說明
6.1 一、指導原則編寫的目的
(一)本指導原則編寫的目的是用於指導和規範醫用霧化器產品註冊申報過程中審評人員對註冊材料的技術審評。
(二)本指導原則旨在讓初次接觸該類產品的註冊審評人員對產品機理、結構、主要性能、預期用途等各個方面有個基本瞭解,同時讓技術審評人員在產品註冊技術審評時把握基本的尺度,對產品安全性、有效性作出系統評價。
6.2 二、指導原則編寫的依據
(一)《醫療器械監督管理條例》
(二)《醫療器械註冊管理辦法》(局令第16號)
(三)《醫療器械臨牀試驗規定》(局令第5號)
(四)《醫療器械介紹、標籤和包裝標誌管理規定》(局令第10號)
(五)《醫療器械標準管理辦法》(局令第31號)
(六)關於印發《境內第一類醫療器械註冊審批操作規範(試行)》和《境內第二類醫療器械註冊審批操作規範(試行)》的通知(國食藥監械[2005]73號)
(七)國家食品藥品監督管理局發佈的其他規範性文件
6.3 三、指導原則中部分具體內容的編寫考慮
(一)霧化器產品的實現原理有多種,超聲式霧化器和壓縮式霧化器產品因其特點是我國主要上市產品,故納入本指導原則的範圍。其他原理的霧化器如網式霧化器,文氏管霧化器等在臨牀上應用非常少,不能代表霧化器的典型結構,故未列入。
(二)產品的主要技術指標主要依據行業標準YY0109-2003《醫用超聲霧化器》及其正在修訂的版本,也重點參考了FDA的醫用霧化器審評指導原則以及歐盟採用的EN13544-1標準。
重點是增加了霧化顆粒等效體積粒徑分佈要求,因爲這些要求對產品有效性有直接重要影響。通過對國家局湖北醫療器械質量監督檢驗中心的調研,也確認了該要求已經列入了行業標準YY0109的上報稿中,並可以採用激光散射法進行檢驗。
(三)產品的預期用途綜合了已批准上市產品的核準範圍及FDA的醫用霧化器審評指導原則。
(四)產品的主要風險參照YY/T0316標準建議的方法進行編制,以產品特徵判定爲分析思路,根據產品特性和預期用途進行詳細判定,並根據判定結果進行了風險分析,彙總到一個表格中,供審評人員參考。
(五)產品的介紹重點編寫了產品使用注意事項及產品描述,該部分主要參考了FDA的醫用霧化器審評指導原則,以降低產品使用風險。其中提到的霧化顆粒等效體積粒徑分佈圖對臨牀不同藥物應用該產品有必要的指導作用,但由於目前國內企業缺乏檢測能力,故作爲參考列出。
(六)產品的臨牀試驗要求建議豁免臨牀試驗資料,主要依據是國家局起草的《第二類醫療器械臨牀豁免目錄(徵求意見稿)》以及歐美對醫用霧化器的註冊邀請。《豁免目錄》中列入了超聲霧化器,理由是霧化器的有效性能主要取決於霧化顆粒等效體積粒徑分佈,而該指標通過檢測可以驗證。另外,壓縮式霧化器的性能指標和預期用途與超聲霧化器一致,可以採用同樣的臨牀試驗要求。通過對各省市局醫用霧化器的監管情況調研,基本也不要求進行臨牀試驗。通過臨牀機構的調研,醫用霧化器的臨牀試驗方案也難以設計,理由是臨牀試驗難以排除藥物作用,以及有效性可以通過檢測霧化顆粒等效體積粒徑分佈來確認。
6.4 四、其他產品
網式霧化器可參照本指導原則。
6.5 五、指導原則編寫人員
本指導原則的編寫成員由遼寧省食品藥品監督管理局技術審評人員、行政審批人員、檢測人員共同組成,以充分利用各方面的信息和資源,綜合考慮指導原則中各個方面的內容,儘量保證指導原則正確、全面、實用。
編寫過程中得到了國家食品藥品監督管理局湖北醫療器械質量監督檢驗中心、相關生產企業、醫療機構專家的支持,在此表示感謝。
6.6 參考文獻
1. BS EN 135441-1:2007 Respiratory therapyequipment- part1:Nebulizing systems and their components.[S] British Standards Institution,2007
2. YY 0109-2003 醫用超聲霧化器[S].2003.
3. FDA. Reviewer guidance for nebulizers, metereddose inhalers, spacers and actuators. [EB/OL] .[1993-10-1].http://www.fda.gov/.
4. 馮民.超聲波霧化器2種常見故障[J]. 醫療設備信息,2005,20(9):93.
5. 徐小普,朱顯武.間歇式霧化器控制器的研製[J].中國醫療器械雜誌,2010,34(3):206-207.
6. 孟慶美.燒傷病房超聲霧化器使用過程中交叉污染相關因素分析[J].解放軍護理雜誌 2003,20(10):45.
7. 國家食品藥品監督局.已上市吸入氣霧劑變更拋射劑研究技術要求的通知[EB/OL].[2011-04-22]http://www.sda.gov.cn
8. 袁玉如, 王佑娟,曾繼軍.應用4650I型壓縮機霧化器進行支氣管激發試驗的研究[J].華西醫大學報,2000,31(2):262-264.