3 重組乙型肝炎疫苗(漢遜酵母)藥典標準
3.1 品名
3.1.1 中文名
3.1.2 漢語拼音
Chongzu Yixing Ganyan Yimiao(Hanxun Jiaomu)
3.1.3 英文名
Recombinant Hepatitis B Vaccine(Hansenula polymorpha)
3.2 定義、組成及用途
本品系由重組漢遜酵母表達的乙型肝炎(簡稱乙肝)病毒表面抗原(HBsAg)經純化,加入鋁佐劑製成。用於預防乙型肝炎。
3.3 1 基本要求
生產和檢定用設施、原材料及輔料、水、器具、動物等應符合“凡例”的有關要求。
3.4 2 製造
3.4.1 2.1 生產用菌種
3.4.1.1 2.1.1 名稱及來源
以DNA重組技術構建的表達HBsAg的重組漢遜酵母工程菌株。菌種號爲HBsAgU35-16-9或其他批准的重組漢遜酵母工程菌株。
3.4.1.2 2.1.2 種子批的建立
原始種子批HBsAgU35-16-9在酵母完全培養基上連續擴增2代爲主種子批,主種子批連續擴增2代爲工作種子批。
3.4.1.3 2.1.3 種子批菌種的檢定
3.4.1.3.1 2.1.3.1 HBsAg基因序列測定
3.4.1.3.2 2.1.3.2 HBsAg外源基因和酵母MOX基因的檢定
擴增得2條PCR產物的DNA電泳條帶長度應爲:HBsAg外源基因DNA 761bp;酵母MOX基因DNA 2072bp。
3.4.1.3.3 2.1.3.3 外源基因整合於宿主染色體中的檢定
種子批菌種基因組DNA應無遊離質粒DNA電泳條帶;擴增的PCR產物中應有HBsAg外源基因DNA電泳條帶。
3.4.1.3.4 2.1.3.4 HBsAg外源基因拷貝數檢定
種子批菌種採用雜交法檢測,整合HBsAg外源基因拷貝數應在30個以上。
3.4.1.3.5 2.1.3.5 整合基因穩定性試驗
3.4.1.3.6 2.1.3.6 培養物純度
將菌種接種至酵母完全培養基中,於33℃培養14~18小時後,將培養物分別接種於胰酪腖大豆肉湯培養基與液體硫乙醇酸鹽培養基,於30~35℃培養7天,應無細菌和其他真菌檢出。
3.4.1.4 2.1.4 菌種保存
種子批應於液氮中保存,工作種子批於-70℃保存時應不超過6個月。
3.4.2 2.2 原液
3.4.2.1 2.2.1 發酵
取工作種子批菌種,於適宜溫度和時間,經錐形瓶、種子罐和生產罐進行三級發酵,收穫漢遜酵母。
3.4.2.2 2.2.2 培養物的檢定
3.4.2.2.1 2.2.2.1 HBsAg外源基因拷貝數檢定
按2.1.3.4項進行。
3.4.2.2.2 2.2.2.2 培養物純度
將培養物分別接種於胰酪腖大豆肉湯培養基與液體硫乙醇酸鹽培養基,於30~35℃培養7天,應無細菌和其他真菌檢出。
3.4.2.3 2.2.3 純化
採用適宜的方法破碎漢遜酵母,離心除去細胞碎片,用硅膠吸附,柱色譜法和溴化鉀密度梯度離心法或其他適宜方法純化HBsAg後,進行除菌過濾,即爲原液。
3.4.2.4 2.2.4 原液檢定
按3.1項進行。
3.4.2.5 2.2.5 原液保存
予2~8℃保存應不超過3個月。
3.4.3 2.3 半成品
3.4.3.1 2.3.1 甲醛處理
原液中按終濃度爲100μg/ml加入甲醛,於37℃保溫適宜時間。
3.4.3.2 2.3.2 鋁吸附
將蛋白質和鋁劑以一定比例混合,置適宜溫度下吸附一定時間,經洗滌後即爲鋁吸附產物。
3.4.3.3 2.3.3 配製
用無菌生理氯化鈉溶液按最終蛋白質含量爲20μg/ml稀釋鋁吸附產物,可加入適宜濃度的硫柳汞防腐劑,即爲半成品。
3.4.3.4 2.3.4 半成品檢定
按3.2項進行。
3.4.4 2.4 成品
3.4.4.1 2.4.1 分批
3.4.4.2 2.4.2 分裝
3.4.4.3 2.4.3 規格
每瓶0.5ml。每1次人用劑量0.5ml,含HBsAg 10μg。
3.4.4.4 2.4.4 包裝
3.5 3 檢定
3.5.1 3.1 原液檢定
3.5.1.1 3.1.1 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.5.1.2 3.1.2 蛋白質含量
應爲100~300μg/ml(2010年版藥典三部附錄Ⅵ B第二法)。
3.5.1.3 3.1.3 特異蛋白帶
採用還原型SDS-聚丙烯酰胺凝膠電泳(2010年版藥典三部附錄Ⅳ C),分離膠膠濃度15%,上樣量爲0.5μg,銀染法染色。應有分子質量爲20~25kD的蛋白帶;可有多聚體蛋白帶。
3.5.1.4 3.1.4 純度
採用分子排阻色譜法(2010年版藥典三部附錄Ⅲ D),親水甲基丙烯酸樹脂體積排阻色譜柱;排阻極限10000kD,孔徑100nm;粒度17μm;流動相爲含0.05%疊氮鈉的1mmol/L PBS(pH7.0);上樣量10μl;檢測波長280nm,按面積歸一化法計算,HBsAg含量應不低於99.0%。
3.5.1.5 3.1.5 細菌內毒素檢查
應小於5EU/ml(2010年版藥典三部附錄Ⅻ E凝膠限度試驗)。
3.5.1.6 3.1.6 宿主細胞DNA殘留量
應不高於10ng/劑(2010年版藥典三部附錄Ⅸ B第一法)。
3.5.1.7 3.1.7 宿主細胞蛋白質殘留量
應不超過總蛋白質含量的1.0%(2010年版藥典三部附錄Ⅸ E)。
3.5.1.8 3.1.8 N端氨基酸序列測定(每年至少測定1次)
用氨基酸序列分析儀測定,N端氨基酸序列應爲:(Met)-Glu-Asn-Ile-Thr-Ser-Gly-Phe-Leu-Gly-Pro-Leu-Leu-Val-Leu。
3.5.1.9 3.1.9 聚山梨酯20殘留量
應不高於10μg/20μg蛋白質(2010年版藥典三部附錄Ⅵ H)。
3.5.2 3.2 半成品檢定
3.5.2.1 3.2.1 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.5.2.2 3.2.2 pH值
應爲5.5~7.0(2010年版藥典三部附錄Ⅴ A)。
3.5.2.3 3.2.3 鋁含量
應爲0.45~0.60mg/ml(2010年版藥典三部附錄Ⅶ F)。
3.5.2.4 3.2.4 硫柳汞含量
應不高於2.0μg/ml(2010年版藥典三部附錄Ⅷ B)。
3.5.2.5 3.2.5 細菌內毒素檢查
應小於5EU/ml(2010年版藥典三部附錄Ⅻ E凝膠限度試驗)。
3.5.2.6 3.2.6 吸附完全性試驗
將供試品於6500g離心5分鐘取上清液,依法測定(2010年版藥典三部附錄Ⅹ A)參考品、供試品及其上清液中HBsAg含量。以參考品HBsAg含量的對數對其相應吸光度對數作直線迴歸,相關係數應不低於0.99,將供試品及其上清液的吸光度值代入直線迴歸方程,計算其HBsAg含量,再按下式計算吸附率,應不低於95%。
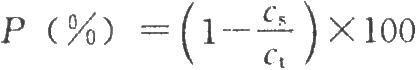
式中P爲吸附率,%;
cs爲供試品上清液的HBsAg含量,μg/ml;
ct爲供試品的HBsAg含量,μg/ml。
3.5.2.7 3.2.7 滲透壓摩爾濃度
應爲280mOsmol/kg±65mOsmol/kg(2010年版藥典三部附錄Ⅴ H)。
3.5.3 3.3 成品檢定
3.5.3.1 3.3.1 鑑別試驗
3.5.3.2 3.3.2 外觀
應爲乳白色混懸液體,可因沉澱而分層,易搖散,不應有搖不散的塊狀物。
3.5.3.3 3.3.3 裝量
依法檢查(2010年版藥典三部附錄Ⅰ A),應不低於標示量。
3.5.3.4 3.3.4 化學檢定
3.5.3.4.1 3.3.4.1 pH值
應爲5.5~7.0(2010年版藥典三部附錄Ⅴ A)。
3.5.3.4.2 3.3.4.2 鋁含量
應爲0.45~0.60mg/ml(2010年版藥典三部附錄Ⅷ F)。
3.5.3.4.3 3.3.4.3 硫柳汞含量
應不高於2.0μg/ml(2010年版藥典三部附錄Ⅶ B)。
3.5.3.4.4 3.3.4.4 遊離甲醛含量
應不高於15μg/ml(2010年版藥典三部附錄Ⅵ L)。
3.5.3.4.5 3.3.4.5 聚乙二醇6000殘留量
應小於200μg/ml(2010年版藥典三部附錄Ⅵ G)。
3.5.3.5 3.3.5 體外相對效力測定
應不低於1.0(2010年版藥典三部附錄Ⅹ A)。
3.5.3.6 3.3.6 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.5.3.7 3.3.7 異常毒性檢查
依法檢查(2010年版藥典三部附錄Ⅻ F),應符合規定。
3.5.3.8 3.3.8 細菌內毒素檢查
應小於5EU/ml(2010年版藥典三部附錄Ⅻ E凝膠限度試驗)。
3.6 4 保存、運輸及有效期
3.7 5 使用說明
【藥品名稱】
通用名稱:重組乙型肝炎疫苗(漢遜酵母)
英文名稱:Recombinant Hepatitis B Vaccine(Hansenula polymorpha)
漢語拼音:Chongzu Yixing Ganyan Yimiao (Hanxun Jiaomu)
【成分和性狀】
本品系由重組漢遜酵母表達的乙型肝炎病毒表面抗原( HBsAg)經純化,加入鋁佐劑製成。爲乳白色混懸液體,可因沉澱而分層,易搖散。
【接種對象】
(1)新生兒,特別是母親爲HBsAg、HBeAg陽性者。
(2)從事醫療工作的醫護人員及接觸血液的實驗人員。
【作用與用途】
接種本疫苗後,可刺激機體產生抗乙型肝炎病毒的免疫力。用於預防乙型肝炎。
【規格】
每瓶0.5ml。每1次人用劑量0.5ml.含HBsAg 10μg。
(1)於上臂三角肌肌內注射。
(2)免疫程序爲3針,分別在0、1、6月接種,新生兒在出生後24小時內注射第1針,每次注射1劑疫苗。
【不良反應】
常見不良反應:
接種後24小時內,在注射部位可能感到疼痛和觸痛,多數情況下於2~3天內自行消失。
罕見不良反應:
(1)接種者在接種疫苗後72小時內,可能出現一過性發熱反應,一般持續1~2天后可自行緩解。
(2)接種部位輕、中度的紅腫、疼痛,一般持續1~2天后可自行緩解,不需處理。
極罕見不良反應:
(1)接種部位可出現硬結,一般1~2個月可自行吸收。
(2)局部無菌性化膿:一般要用注射器反覆抽出膿液,嚴重時(破潰)需擴創清除壞死組織,病時較長,最後可吸收癒合。
(3)過敏反應:過敏性皮疹、阿瑟反應。阿瑟反應一般出現在接種後10天左右,局部紅腫持續時間長,可用固醇類藥物進行全身和局部治療。
(4)過敏性休克:一般在注射疫苗後1小時內發生,應及時注射腎上腺素等搶救措施進行治療。
【禁忌】
(2)患急性疾病、嚴重慢性疾病、慢性疾病的急性發作期和發熱者。
(3) 妊娠期婦女。
【注意事項】
(1)以下情況者慎用:家族和個人有驚厥史者、患慢性疾病者、有癲癇史者、過敏體質者。
(2)使用時應充分搖勻,如出現搖不散的凝塊、異物、疫苗瓶有裂紋或標籤不清者,均不得使用。
(3)疫苗瓶開啓後應立即使用。
(4)應備有腎上腺素等藥物,以備偶有發生嚴重過敏反應時急救用。接受注射者在注射後應在現場觀察至少30分鐘。
(5)注射第1針後出現高熱、驚厥等異常情況者,一般不再注射第2針,對於母嬰阻斷的嬰兒,如注射第2、3針應遵照醫囑。
(6)嚴禁凍結。
【貯藏】
於2~8℃避光保存和運輸。
【包裝】
按批准的執行。
【有效期】
36個月。
【執行標準】
【批准文號】
【生產企業】
企業名稱:
生產地址:
郵政編碼:
電話號碼:
傳真號碼:
網 址:
3.8 版本
《中華人民共和國藥典》2010年版