3 基本信息
ICS 11.080
C 59
中華人民共和國衛生行業標準WS/T 647—2019《溶葡萄球菌酶和溶菌酶消毒劑衛生要求》(Hygienic requirement for lysostaphin and lysozyme disinfectants)由中華人民共和國國家衛生健康委員會於2019年01月30日《關於發佈〈過碳酸鈉消毒劑衛生要求〉等6項推薦性衛生行業標準的通告》(國衛通〔2019〕4號)發佈,自2019年07月01日起實施。
4 發佈通知
關於發佈《過碳酸鈉消毒劑衛生要求》等6項推薦性衛生行業標準的通告
國衛通〔2019〕4號
現發佈《過碳酸鈉消毒劑衛生要求》等6項推薦性衛生行業標準,編號和名稱如下:
WS/T 647—2019 溶葡萄球菌酶和溶菌酶消毒劑衛生要求
WS/T 651—2019 醫用低溫蒸汽甲醛滅菌指示物評價要求
上述標準自2019年7月1日起施行。
特此通告。
國家衛生健康委員會
2019年1月30日
5 前言
本部分按照 GB/T1.1-2009 給出的規則起草。
本部分起草單位:上海市疾病預防控制中心、中國疾病預防控制中心環境與健康相關產品安全所、復旦大學。
本部分主要起草人:田靚、朱仁義、袁政安、沈偉、沈瑾、邱俠、陸婉英、黃青山、李國棟、陸曄、趙曉蔚、黃晉江、吳宏宇。
6 標準正文
6.1 1 範圍
本標準規定了溶葡萄球菌酶和溶菌酶消毒劑的原料要求、技術要求、應用範圍、使用方法、運輸貯存和包裝、標籤標誌和介紹、檢驗方法。
本部分適用於以溶葡萄球菌酶和(或)溶菌酶爲主要殺菌成分的酶類消毒劑。
6.2 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅注日期的版本適用於本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
GB/T 191 包裝儲運圖示標誌
GB 27950 手消毒劑衛生要求
GB 27951 皮膚消毒劑衛生要求
GB 27954 黏膜消毒劑衛生要求
中華人民共和國藥典(2015年版)
消毒技術規範(2002年版)衛生部 (衛法監發〔2002〕282號)
消毒產品標籤介紹管理規範 衛生部(衛監督發﹝2005﹞426號)
6.3 3 術語和定義
下列術語和定義適用於本文件。
3.1
酶類消毒劑 enzyme disinfectant
以酶爲主要殺菌成分的消毒劑。
3.2
溶葡萄球菌酶 lysostaphin
3.3
溶菌酶 lysozyme
能水解細菌中黏多糖的酶。亦稱胞壁質酶、N-乙酰胞壁質聚糖水解酶。
3.4
酶活性單位 enzyme activity unit
酶活性的度量單位。1個酶活性單位指在特定條件下,在單位時間內轉化單位底物(或轉化底物中單位有關基團)的酶量。
6.4 4 原料要求
6.4.1 4.1 溶葡萄球菌酶
白色或微黃色粉末,無臭、易溶於水;按乾燥品計算,酶活性單位應≥100U/mg。
6.4.2 4.2 溶菌酶
符合國家藥品標準中溶菌酶的要求。
6.4.3 4.3 生產用水
6.4.4 4.4 其他原料
爲食品級或化學純或符合藥典規定的原料,符合國家有關規定,不得使用工業級。
6.4.5 4.5 禁用物質
不應含有抗生素、抗真菌藥物、激素以及國家規定的其他禁用物質。
6.5 5 技術要求
6.5.1 5.1 外觀
不分層、無沉澱和懸浮物、無異味。
6.5.2 5.2 理化指標
5.2.1 pH 值
pH值爲5.0~8.0。
5.2.2 有效含量
消毒劑中溶葡萄球菌酶的活性範圍爲0.5U/mL~20U/mL,溶菌酶的活性範圍爲10000U/mL~200000U/mL。
產品有效成分含量在設定值或標示中心值的80%~150%之內。
5.2.3 穩定性
≥12個月。
6.5.3 5.3 殺滅微生物指標
作用濃度和時間按產品標籤介紹的要求,殺滅微生物指標應符合表1要求。
用於手消毒應符合GB 27950的要求;用於皮膚消毒應符合GB 27951的要求;用於黏膜消毒應符合GB 27954的要求。
表1 殺滅微生物指標
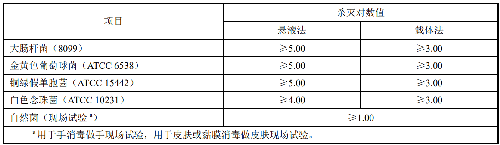
a 用於手消毒做手現場試驗,用於皮膚或黏膜消毒做皮膚現場試驗。
6.6 6 應用範圍
6.7 7 使用方法
6.7.1 7.1 手消毒
7.1.1 衛生手消毒
取適量消毒劑於手心,雙手互搓使均勻塗布每個部位,作用時間符合GB 27950的要求。
7.1.2 外科手消毒
外科洗手後,取適量消毒劑均勻塗布於雙手、前臂和上臂下1/3的皮膚,作用時間符合GB 27950的要求。
6.7.2 7.2 皮膚消毒
7.2.1 完整皮膚
取消毒劑原液,或將消毒劑原液用符合《中華人民共和國藥典(2015年版)》的純化水或無菌水稀釋至介紹規定濃度,均勻噴霧或用醫用棉拭子擦拭皮膚表面,作用時間應符合GB 27951的要求。
7.2.2 破損皮膚
從原包裝倒出後一次性使用。取消毒劑原液,或將消毒劑原液用符合《中華人民共和國藥典(2015年版)》的無菌水稀釋至介紹規定濃度,沖洗破損皮膚表面,作用時間應符合GB 27951的要求。
6.7.3 7.3 黏膜消毒
7.3.1 口腔黏膜
從原包裝倒出後一次性使用。用消毒劑原液,或將消毒劑原液用符合《中華人民共和國藥典(2015年版)》的純化水或無菌水稀釋至介紹規定濃度,均勻噴霧或用醫用棉拭子擦拭或含漱,作用時間按照介紹,最長作用時間5min。
從原包裝倒出後一次性使用。用消毒劑原液,或將消毒劑原液用符合《中華人民共和國藥典(2015年版)》的純化水或無菌水稀釋至介紹規定濃度,用醫用棉拭子擦拭或灌洗或沖洗,作用時間按照介紹,最長作用時間5min。
6.8 8 運輸、貯存和包裝
6.8.1 8.1 運輸
運輸產品時應避免日曬、雨淋。不可與有異味或影響產品質量的物品混裝運輸。
6.8.2 8.2 貯存
室溫或陰涼處保存,避光、密閉、乾燥,不可與有異味或影響產品質量的物品同處貯存。
6.8.3 8.3 包裝
產品的包裝無毒和清潔,包裝材質符合相應材料的化妝品包裝要求。產品的包裝密封,能保證產品的穩定性以及在儲存運輸、使用過程中的安全性。包裝儲運圖示標誌應符合GB∕T l91要求。
6.9 9 標識要求
6.9.1 9.1 標籤和介紹
6.9.2 9.2 注意事項
介紹至少包括以下內容:
——避免接觸拮抗物。不能與陰離子表面活性劑、Ba2+、Ca2+、Mg2+等同時使用。
——置於兒童不易觸及處。
——對蛋白質過敏者慎用。
6.10 10 檢驗方法
6.10.1 10.1 外觀
6.10.2 10.2 pH 值測定
6.10.3 10.3 有效含量測定
10.3.2 溶菌酶活性測定
6.10.4 10.4 穩定性測定
按《消毒技術規範(2002年版)》的方法,用微生物法進行穩定性實驗。有效期<24個月,用自然留樣法測定;有效期爲24個月,根據產品性能,選用37℃存放90d的方法,或用自然留樣法測定。在有效期內,有效成分含量不得低於標示量的下限值。
6.10.5 10.5 殺滅微生物試驗
按《消毒技術規範(2002年版》有關規定測定。宜採用懸液法;若選用載體法時,應採用非吸附性材料(金屬、玻璃、豬皮等)做載體。
7 附錄A(規範性附錄)溶葡萄球菌酶酶活性測定
7.1 A.1 原理
以偶聯活性豔藍染料KNR的金黃色葡萄球菌細胞壁肽聚糖(KNR-PG)爲色源底物,根據酶作用過程中定量地釋放帶有KNR染料基團的小分子可溶性片段產物,在除去未反應的不溶性底物後,對上清液進行比色測定溶葡萄球菌酶酶活性。
在pH10.0的1.2mL反應體系下,37℃溫度下,在波長595nm處,每分鐘使KNR-PG溶液吸光度值增加0.35的酶量爲1個溶葡萄球菌酶酶活性單位。
7.2 A.2 試劑
A.2.1 溶葡萄球菌酶標準品溶液:按照溶葡萄球菌酶活性單位定義,對溶葡萄球菌酶凍乾粉進行標定。需要時,用Tris-HCl緩衝液溶解,配製成0.9 U/mL的標準品溶液,-20 ℃貯存,每次試驗用1支,避免反覆凍融。
A.2.6 甘氨酸-氫氧化鈉緩衝液:0.2 mol/L,pH 10.0。
A.2.7 三羥甲基氨基甲烷鹽酸緩衝液(Tris-HCl緩衝液):0.05 mol/L,pH 7.5。
A.2.8 色源底物KNR-PG溶液:按照附錄C方法製備色源底物KNR-PG,用甘氨酸-氫氧化鈉緩衝液以1:5質量體積比例均勻懸浮。
7.3 A.3 試驗步驟
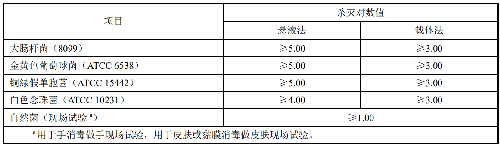
7.3.1 A.3.1 標準曲線的製備
取潔淨乾燥的微量離心管6只,標號,按表A.1順序每管中加入對應量的溶葡萄球菌酶標準品溶液(A.2.1),再加入不同量的0.2mol/L甘氨酸-氫氧化鈉緩衝液(A.2.6)。然後按序號加入色源底物KNR-PG溶液(A.2.8)130μL,每管加入底物後迅速在旋渦混合儀上混勻。將加好溶液的微量離心管迅速移入37℃的恆溫水浴鍋中定時反應20min。從水浴中取出微量離心管,每管中加入300µL95%乙醇終止反應,10000r/min離心10min,離心結束後,取上清液於595nm處,以0號管爲空白測定吸光度。根據測得的吸光度值及相對應的標準品溶葡萄球菌酶酶活性(U/mL),求得線性迴歸曲線:
C0=(A-B)/K…………………(A.1)
式中:
A——吸光度;
B——截距;
K——標準曲線的斜率。
表A.1 標準曲線製備
7.3.2 A.3.2 樣品的測定
待測樣品的測定方法同標準曲線,取50µL用於測定。平行測定3次,計算平均值。
7.4 A.4 結果計算
C = C0×V反/V樣×N…………………(A.2)
式中:
V反——反應體系體積,爲0.9mL;
V樣——樣品加入體積,爲0.05mL;
N——樣品稀釋倍數。
8 附錄B(規範性附錄)溶菌酶酶活性測定
8.1 B.1 原理
溶菌酶通過溶解革蘭陽性菌細胞壁使細菌溶解,菌液在可見光範圍內的吸光度降低,以溶壁微球菌爲底物,用分光光度法,以450nm波長處菌液單位時間內吸光度降低程度測定溶菌酶酶活性。在室溫25℃、pH爲6.2時,在波長450nm處,每分鐘引起吸收度下降0.001爲1個溶菌酶酶活性單位。
8.2 B.2 試劑
B.2.1 磷酸鹽緩衝液:取磷酸二氫鈉10.4 g與磷酸氫二鈉7.86 g及乙二胺四乙酸二鈉0.37 g,加水溶解至1000 mL,調節pH至6.2。
B.2.2 溶壁微球菌[Micrococcuslysodeik,CGMCC1.0634]。
8.3 B.3 試驗步驟
量取樣品,用磷酸鹽緩衝液稀釋成約1000U/mL的溶液,稀釋所用倍數記爲N。
B.3.2 底物懸浮液的製備
臨用前配製。稱取溶壁微球菌15mg~20mg,加磷酸鹽緩衝液0.5mL~1mL,在研鉢內研磨3min,再加磷酸鹽緩衝液適量,使總體積約爲50mL,懸浮液於25℃±0.1℃在450nm波長處測得的吸收度爲0.70±0.05。
B.3.3 樣品測定
量取25℃±0.1℃的底物懸浮液3mL,置比色池中,在450nm的波長處測定吸收度,作爲0s的讀數A0,然後量取25℃±0.1℃的供試品溶液0.15mL(相當於溶菌酶7.5μg),加到比色池中,迅速混勻,用秒錶計時,至60s時再測定吸收度A;同時量取磷酸鹽緩衝液0.15mL,同法操作,做爲空白試驗,測得0s的讀數A'0及60s的讀數A'。
平行測定3次,計算平均值。
8.4 B.4 結果計算
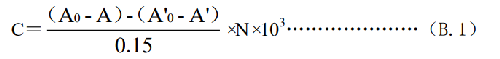
式中:
N ——稀釋倍數。
9 附錄C(規範性附錄)溶葡萄球菌酶色源底物製備
9.1 C.1 試劑
C.1.1 三氯乙酸(TCA)
C.1.2 0.05mol/L三羥甲基氨基甲烷鹽酸緩衝液(Tris-HCl)
取三羥甲基氨基甲烷6.0g,加水800mL溶解,用鹽酸調節pH至7.5後,用水稀釋至1000mL。
取氫氧化鈉10.0g,加水1000mL溶解。
C.1.4 其他試劑
金黃色葡萄球菌、生理鹽水、胰蛋白酶、豔藍染料(KNR染料)、疊氮鈉、純水。
9.2 C.2 製備方法
C.2.1 按照《消毒技術規範(2002年版)》有關規定製備金黃色葡萄球菌懸液。
C.2.2 對菌懸液121℃ 20min滅菌後進行離心,收集菌體。
C.2.4 用7倍菌體質量的10%TCA溶液懸浮菌體,4℃放置72h。
C.2.6 用5倍菌體質量的5%TCA溶液懸浮菌體,90℃水浴10min。
C.2.8 用5倍菌體質量的Tris-HCl懸浮菌體,按0.5mg/mL濃度加入胰蛋白酶,置於37℃水浴24h。
C.2.11 用少量純水懸浮菌體,於4℃下對純水透析24h。
C.2.12 離心,收集沉澱。
C.2.13 按7倍菌體質量,配製0.25N的氫氧化鈉溶液適量。
C.2.14 用配製好的0.25N的氫氧化鈉溶液的一半體積懸浮菌體。
C.2.15 按1/7的菌體質量稱取KNR染料,用剩餘的氫氧化鈉溶液進行溶解。
C.2.16 在懸浮的菌液中加入配製好的染料,37℃水浴24h。
C.2.17 離心,純水洗滌至上清液無色,用少量純水懸浮菌體,轉移至保存容器內,按10mg/L濃度加入疊氮鈉,4℃保存。