3 基本信息
ICS 11.080
C 50
中華人民共和國衛生行業標準WS/T 650—2019《抗菌和抑菌效果評價方法》(Evaluting Method for Efficacy of Antibacterial and Bacteriostasis)由中華人民共和國國家衛生健康委員會於2019年01月30日《關於發佈〈過碳酸鈉消毒劑衛生要求〉等6項推薦性衛生行業標準的通告》(國衛通〔2019〕4號)發佈,自2019年07月01日起實施。
4 發佈通知
關於發佈《過碳酸鈉消毒劑衛生要求》等6項推薦性衛生行業標準的通告
國衛通〔2019〕4號
現發佈《過碳酸鈉消毒劑衛生要求》等6項推薦性衛生行業標準,編號和名稱如下:
WS/T 647—2019 溶葡萄球菌酶和溶菌酶消毒劑衛生要求
WS/T 651—2019 醫用低溫蒸汽甲醛滅菌指示物評價要求
上述標準自2019年7月1日起施行。
特此通告。
國家衛生健康委員會
2019年1月30日
5 前言
本標準按照GB/T1.1-2009的規定進行編寫。
本標準由江蘇省疾病預防控制中心、中國疾病預防控制中心環境與健康相關產品安全所、山東省疾病預防控制中心、黑龍江省疾病預防控制中心負責起草。
本標準主要起草人:徐燕、談智、張流波、陳越英、吳曉松、林玲、孫啓華、崔樹玉、趙華偉、吳克、張文生、王裕榮、吳曉、沈瑾、李炎、孫巍、王玲、王嵬、王曉蕾、褚宏亮。
6 標準正文
6.1 1 範圍
本標準適用於具有抗菌和(或)抑菌功能產品的抗菌、抑菌效果的鑑定。
6.2 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅所注日期的版本適用於本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
FZ/T 73023 抗菌針織品
消毒技術規範 (2002版) 衛生部(衛法監發〔2002〕282號)
6.3 3 術語和定義
下列術語和定義適用於本文件。
3.1
抗菌 antibacterial
採用化學或物理方法殺滅或妨礙細菌生長繁殖,可減少其數量以及活性的過程。
3.2
抑菌 bacteriostasis
3.3
持續抗菌作用 sustained antibacterial action
具有抗菌作用的消毒產品塗於物體表面,持續7d以上仍具有殺滅或妨礙細菌生長繁殖作用。
3.4
中和劑 neutralizer
在殺滅微生物試驗中,用以消除試驗微生物與消毒劑的混懸液中,以及微生物表面上殘留的消毒劑,使其失去對微生物抑制和殺滅作用的試劑。
6.4 4 評價方法的選擇原則
6.4.1 4.1 抗菌試驗與抑菌試驗區別
抗菌試驗:測定抗菌產品對細菌和真菌的抗菌作用,試驗過程中需要用中和劑終止殺菌作用。
抑菌試驗:測定抑菌產品對細菌和真菌的抑菌作用,試驗過程中不需要使用中和劑終止抑菌作用。
6.4.2 4.2 根據產品性能選擇合適的評價方法
6.4.2.1 4.2.1 抑菌效果評價方法的選擇原則
抑菌類產品選擇抑菌效果評價方法。液體抑菌產品選擇懸液定量抑菌試驗,膏體或半固體凝膠類、黏稠狀抑菌產品選擇載體浸泡定量抑菌試驗,溼巾類或其他自身含有抑菌成分的產品選擇載體抑菌試驗,肥皂類固體抑菌產品選擇抑菌環試驗,含有可溶性抑菌成分的紡織品選擇浸漬抑菌試驗,含有持續抑菌作用的抑菌洗液選擇滯留抑菌試驗。
6.4.2.2 4.2.2 抗菌效果評價方法的選擇原則
抗菌類產品選擇抗菌效果評價方法。液體抗菌產品選擇懸液定量殺菌試驗,凝膠狀或膏狀抗菌產品選擇載體浸泡定量殺菌試驗,溼巾類或其他自身含有抗菌成分的產品選擇載體殺菌試驗,含有可溶性抗菌成分的紡織品選擇浸漬抗菌試驗。
含有不可溶抗菌成分的紡織品、無紡布、纖維等,經鑑別不含可溶性抗抑菌成分後,採用燒瓶振盪試驗。
含有不可溶抗菌成分的瓷磚、塑料、金屬、塗料等,採用貼膜試驗;對於塗於表面,乾燥後具有持續抗菌作用的產品,進行持續抗菌試驗。
6.5 5 評價方法
6.5.1 5.1 抑菌效果
6.5.1.1 5.1.1 懸液定量抑菌試驗
6.5.1.1.1 5.1.1.1 適用範圍
適用於液體抑菌製劑如衛生洗液、抑菌噴霧劑等對微生物抑菌效果的測定。
6.5.1.1.2 5.1.1.2 試劑、培養基及器材
5.1.1.2.1 試驗菌株
金黃色葡萄球菌(ATCC 6538)、大腸桿菌(8099)、白色念珠菌(ATCC 10231)及根據抑菌劑特定用途所用的其他菌株。
5.1.1.2.2 試劑
稀釋液: 0.03 mol/L 磷酸鹽緩衝液(PBS)(pH7.2~7.4),培養基:金黃色葡萄球菌和大腸桿菌的培養使用營養瓊脂培養基,白色念珠菌的培養使用沙氏瓊脂培養基。
5.1.1.2.3 器材
恆溫水浴箱、計時器、Ⅱ級生物安全櫃等。
6.5.1.1.3 5.1.1.3 試驗步驟
取試驗菌24h新鮮斜面培養物用PBS洗下,用PBS稀釋至約5.0×105 CFU/mL~4.5×106 CFU/mL菌懸液備用。取無菌試管,先加入5.0 mL樣品(根據使用說明書要求使用原液或稀釋液),置20℃±1℃ 水浴中5min後,再加入0.1 mL試驗用菌懸液,迅速混勻並立即計時。待試驗菌與樣品相互作用至介紹的規定時間,分別吸取1.0 mL試驗菌與樣品混合液接種2個平皿,傾注培養基。菌量無法計數時,以PBS做10倍系列稀釋,選適宜稀釋度分別吸取1.0 mL接種2個平皿,做活菌培養計數。同時用PBS代替樣品,進行平行試驗,作爲陽性對照。陽性對照回收菌落數在1.0×104CFU/mL~9.0×104CFU/mL之間。取同批次PBS、培養基作陰性對照。所有試驗樣本和對照樣本均在36℃±1℃培養,細菌繁殖體培養48h觀察最終結果;白色念珠菌培養72h觀察最終結果。試驗重複3次,計算抑菌率。
6.5.1.1.4 5.1.1.4 抑菌率計算

式中:
X—抑菌率,%;
A0—陽性對照組回收菌量,單位爲 CFU/mL;
A1—試驗組回收菌量,單位爲 CFU/mL。
6.5.1.1.5 5.1.1.5 結果判定
抑菌率≥50%~90%,判有抑菌作用;抑菌率≥90%,判有較強抑菌作用。
6.5.1.2 5.1.2 載體浸泡定量抑菌試驗
6.5.1.2.1 5.1.2.1 適用範圍
適用於膏體或半固體凝膠類、黏稠狀抑菌產品對微生物抑菌效果的測定。
6.5.1.2.2 5.1.2.2 試劑、培養基及器材
載體爲10 mm×10 mm脫脂白平紋布片,脫脂方法依照《消毒技術規範》(2002版)進行,使用前壓力蒸汽滅菌備用,電子天平(d=0.01g),其它同5.1.1.2。
6.5.1.2.3 5.1.2.3 操作步驟
取試驗菌24h新鮮斜面培養物用PBS洗下,用PBS稀釋至約5.0×106CFU/mL~5.0×107CFU/mL製成菌懸液備用。用微量移液器滴染10 μl菌懸液於滅菌載體上,36℃±1℃烘乾或室溫晾乾備用。
按5 g/片的量稱取樣品於無菌平皿內,置20℃±1℃水浴5min,用無菌鑷子取染菌載體,使載體完全浸沒於樣品中,立即計時。待染菌載體與樣品相互作用至介紹的規定時間,分別取染菌載體加入5.0mLPBS試管中,混勻,振盪,將試驗菌洗下,分別吸取1.0 mL樣液,按活菌培養計數方法測定存活菌數,每管樣液接種2個平皿。如平板上生長的菌落數較多時,可用PBS進行10倍系列稀釋後,再進行活菌培養計數。取10.0 g與試驗樣品同質材料不含抑菌成分的對照樣品浸泡2片染菌載體進行平行試驗,作爲陽性對照。陽性對照回收菌量爲1.0×104CFU/片~9.0×104CFU/片。取同批次PBS、培養基作陰性對照。
所有試驗樣本和對照樣本均在36℃±1℃培養,細菌繁殖體培養48h觀察結果;白色念珠菌培養72h觀察結果。試驗重複3次,計算抑菌率。
6.5.1.2.4 5.1.2.4 抑菌率計算

式中:
X—抑菌率,%;
6.5.1.2.5 5.1.2.5 結果判定
抑菌率≥50%~90%,判有抑菌作用;抑菌率≥90%,判有較強抑菌作用。
6.5.1.3 5.1.3 載體抑菌試驗
6.5.1.3.1 5.1.3.1 適用範圍
適用於含溶出性抑菌成分的溼巾、無紡布口罩、衛生巾、護墊、尿布等固體類抑菌產品對微生物抑菌效果的測定。
6.5.1.3.2 5.1.3.2 試劑、培養基及器材
見5.1.1.2。
6.5.1.3.3 5.1.3.3 試驗步驟
取試驗菌24h新鮮斜面培養物用PBS洗下,用PBS稀釋至約105CFU/mL~106CFU/mL,製成菌懸液備用。
用滅菌剪刀在無菌條件下將試驗樣品和對照樣品分別剪成20 mm×30 mm樣片備用。試驗時滴加0.1 mL菌懸液。對照樣片染菌前需經壓力蒸汽滅菌。取無菌平皿,用無菌鑷子取2片試驗樣片,勿重疊,置20℃±1℃水浴5min,在每一樣片上滴加0.1 mL試驗用菌懸液,立即計時。待試驗菌與樣片接觸作用至介紹的規定時間,分別夾取染菌樣片加於5.0 mLPBS試管中,混勻。振盪洗脫,分別吸取1.0 mL樣液,按活菌培養計數方法測定存活菌數,每管樣液接種2個平皿。如平板上生長的菌落數較多時,可10倍系列稀釋後,再進行活菌培養計數。
同時用與試驗樣品同質材料不含抑菌成分的對照樣片2片代替試驗樣片進行試驗,作爲陽性對照,陽性對照回收菌量爲1.0×104CFU/片~9.0×104CFU/片;取同批次PBS、培養基作陰性對照。
所有試驗樣本和對照樣本均在36℃±1℃培養,細菌繁殖體培養48h、白色念珠菌培養72h觀察最終結果。試驗重複3次,計算抑菌率。
6.5.1.3.4 5.1.3.4 抑菌率計算
見式(2)。
6.5.1.3.5 5.1.3.5 結果判定
抑菌率≥50%~90%,判有抑菌作用;抑菌率≥90%,判有較強抑菌作用。
6.5.1.4 5.1.4 抑菌環試驗
6.5.1.4.1 5.1.4.1 適用範圍
適用於含溶出性抑菌物質,可製成直徑爲5 mm片狀物的固體抑菌產品的抑菌效果鑑定;也可用於鑑別抗抑菌樣品中是否含有可溶性抑菌物質。
6.5.1.4.2 5.1.4.2 試劑、培養基及器材
遊標卡尺,其它見5.1.1.2
6.5.1.4.3 5.1.4.3 試驗步驟
將試驗菌24h新鮮斜面培養物用PBS洗下,稀釋至5.0×105CFU/mL~5.0×106CFU/mL備用。
抑菌片的製備:溶出性固體抑菌產品,直接製成直徑爲5 mm,厚度不超過4 mm圓片(塊),每4片爲一組。
陰性對照樣片的製備:取同種材質不含抑菌成分的樣本,製成與試驗組大小相同的圓片(塊)。
用無菌棉拭子蘸取濃度爲5.0×105CFU/mL~5.0×106CFU/mL試驗菌懸液,在適宜的培養基平板表面均勻塗抹3次。每塗抹1次,平板應轉動60°,最後將棉拭子繞平板邊緣塗抹一週。蓋好平皿,置室溫乾燥5min。
每次試驗貼放1個染菌平板,每個平板貼放4片試驗樣片,1 片陰性對照樣片,共5片。用無菌鑷子取樣片貼放於平板表面,陰性對照樣片貼於平板中心位置,試驗樣片貼於四周,貼放好後,用無菌鑷子輕壓樣片,使其緊貼於平板表面。各樣片中心之間相距25 mm以上,與平板的周緣相距15 mm以上。蓋好平板,置36℃±1℃培養16h~18h觀察結果,試驗重複3次。
用遊標卡尺測量抑菌環的直徑(包括貼片)並記錄,測量抑菌環時,應選均勻而完全無菌生長的抑菌環進行,測量其直徑應以抑菌環外沿爲界。
6.5.1.4.4 5.1.4.4 結果判定
陰性對照樣片應無抑菌環產生,試驗樣品抑菌環直徑>7 mm者,判爲有抑菌作用;抑菌環直徑≤7 mm者,判爲無抑菌作用。
6.5.1.5 5.1.5 浸漬抑菌試驗
6.5.1.5.1 5.1.5.1 適用範圍
適用於溶出性抑菌織物(如抑菌毛巾、口罩、內衣等)抑菌效果的測定。
6.5.1.5.2 5.1.5.2 試劑、培養基及器材
5.1.5.2.1 試驗菌株見 5.1.1.2.1
5.1.5.2.2 試樣
在距試樣布邊10 cm以上、離布端1 m以上部位,剪取直徑爲5 cm的圓形試樣若干,取3份試樣分別裝於3個錐形瓶中,蓋好瓶口備用(需用試樣數量要根據纖維類別及織物織法而定,以能吸收1 mL菌液且錐形瓶中不留殘液爲度)。另同法剪取與試樣相同材質但不含抑菌劑對照織物若干,取2份分別裝於2個錐形瓶中,蓋好瓶口,121℃滅菌15min備用。
5.1.5.2.3 試劑和培養基
0.03 mol/L PBS(pH7.2~7.4),肉湯培養基、營養瓊脂培養基、沙氏培養基。
5.1.5.2.4 菌懸液的製備
用接種環將保存的菌種以劃線法接種到營養瓊脂平板,36℃±1℃培養24h,取典型的菌落移種到含肉湯培養基的錐形瓶中,36℃±1℃培養24 h,用肉湯對培養液進行系列稀釋,使菌懸液的含菌量爲1.0×105CFU/mL~5.0×105CFU/mL。
6.5.1.5.3 5.1.5.3 試驗步驟
分別取1 mL菌懸液加入2份準備好的錐形瓶內試樣和1份對照織物上,確保其均勻分佈,且錐形瓶中不留多餘液,封好瓶口,以防蒸發造成細菌死亡。分別在一個盛有已接種菌懸液的試樣和對照織物的錐形瓶中加入100 mLPBS,置渦旋振盪器上振盪1min洗滌細菌,分別吸取1.0 mL樣液或10倍系列稀釋液接種2個平皿,作爲“0”接觸時間樣本和對照織物上的細菌數。
將另一個裝有已接種菌懸液試樣的錐形瓶於36℃±1℃培養20h±2h,加入100 mLPBS,置渦旋振盪器上振盪1min洗滌細菌,分別吸取1.0 mL樣液或10倍系列稀釋液接種2個平皿,作爲試驗組。陰性對照組,試樣不接種菌懸液,在“0”接觸時間加入100 mLPBS,置渦旋振盪器上振盪1min取樣,接種平皿。
陽性對照組,另取1個裝有對照織物的錐形燒瓶,接種1 mL菌懸液後,在36℃±1℃培養20 h±2h,加入100 mLPBS,置渦旋振盪器上振盪1min洗滌細菌,分別吸取1.0 mL樣液或10倍系列稀釋液接種2個平皿。將陰性和陽性對照樣本與試驗組樣本一併放36℃±1℃培養48h,計數菌落數,試驗重複3次。
6.5.1.5.4 5.1.5.4 計算抑菌率
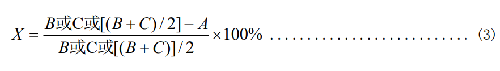
式中:
X—抑菌率,%;
C—“0”接觸時間對照織物上的細菌數,單位爲 CFU/mL;
如果“B”和“C”差別較大時,取較大值;如果“B”和“C”差別不大時,取平均值。
6.5.1.5.5 5.1.5.5 結果判定
試驗成立條件要求:“0”接觸時間對照織物的平均回收菌量爲1×103CFU/mL~5×103CFU/mL;陰性對照應無菌生長,陽性對照菌數比0接觸時間的菌數明顯增加。各次試驗的抑菌率均≥50%,即可判定該樣片具有抑菌作用。
6.5.1.6 5.1.6 滯留抑菌效果試驗
6.5.1.6.1 5.1.6.1 適用範圍
適用於有持續抑菌作用的抑菌洗液類抑菌產品的滯留抑菌效果鑑定。
6.5.1.6.2 5.1.6.2 試劑、培養基及試驗器材
試驗菌株:金黃色葡萄球菌(ATCC 27217)
試驗產品: 試驗品爲25套按順序編號的樣品。每套2瓶,一瓶爲測試樣品,另一瓶爲不含抗(抑)菌劑的對照樣品。不含抑菌劑的用品 25瓶(試驗調整階段用)。
胰蛋白酶大豆肉湯培養基(TSB)、胰蛋白酶大豆瓊脂培養基(TSA)、羊血、經脫纖維處理、0.075mol/L的磷酸鹽緩衝液、70%酒精、金屬筒 (直徑2.2 cm、高度3 cm)、一次性接種環(直徑4 mm)、小塑料碗(直徑2.2 cm,高2.5 mm,)、膠帶(Darapore,3M公司生產)、尼龍刮菌棒、 聚乙二醇單辛基苯基醚(曲拉通X-100;Triton-X 100 ) 500 mL、外用抗生素軟膏、玻璃彎棒、皮膚消毒劑等 。
6.5.1.6.3 5.1.6.3 試驗步驟
5.1.6.3.1 調整階段
試驗開始前7d至14d, 受試者使用不含抗(抑)菌成分的香皂、洗髮水和沐浴液進行日常的洗手、洗澡,此階段持續至少7d,但不超過14d。
5.1.6.3.2 清洗階段
清洗階段共3d,受試者每天用有持續抑菌作用的抑菌洗液類樣品清洗一側前臂, 用對照樣品清洗另一側前臂,清洗過程如下:
先清洗左臂,用水溫爲35℃~37℃的流動水潤溼前臂內側; 取樣液3 mL於手心中;從手腕至臂肘上下塗擦60s; 用流動的清水沖洗前臂15s, 不要搓擦;用紙巾沾幹前臂,不要搓擦;用不含抑菌成分的對照樣品重複以上步驟清洗右臂;按上面所描述的試驗步驟每日清洗前臂3次,每次間隔至少1h,在最後一次清洗之後,需記錄好時間,在12h之後,進行滯留效果檢測。在第9次清洗前臂以後,受試者不能洗澡、淋浴或洗淨前臂,直到試驗結束。
5.1.6.3.3 試驗階段
最後一次清洗後的 12h或24h,將在受試者每隻前臂上劃出一個試驗區,對試驗區進行接種、封包和回收存活細菌,具體步驟如下:
將金黃色葡萄球菌(ATCC 27217)連續轉種3代,取第3代培養物接種於胰蛋白大豆肉湯培養基(TSB)中,在36℃±1℃的條件下培養20h±2h。然後用TSB適當稀釋菌懸液,使菌懸液濃度約爲108CFU/mL~109CFU/mL。
接種: 在受試者的每隻前臂中間部位(不要在手腕和肘皺褶處),用帶有印墨直徑爲3.00 cm的玻璃量筒扣在皮膚上,劃分出一個試驗區。使用加樣器取10μL上述菌懸液,接種於前臂試驗區(菌落數爲106CFU/試驗區~107CFU/試驗區),用一次性接種環,把接種物塗成一圓形,使其與試驗區邊緣應有4 mm~5 mm的距離。
封包:細菌接種後立即用小塑料碗扣於染菌區上面 ,再用膠帶將小塑料碗固定在皮膚上,記錄封包的時間。
回收存活細菌: 接種後2h±5min 對前臂上接種的區域進行取樣。將金屬筒放置於試驗區中間部位,不要接觸到蓋有印墨的邊緣。將1 mL含0.1% Triton-X 100的0.075 mol/L磷酸鹽緩衝液吸移至金屬筒內,用尼龍刮菌棒刮洗金屬筒罩住區域內的皮膚60s,將筒內液體吸移至試管內,再加1 mL含0.1%TritonX-100的0.075 mol/L磷酸鹽緩衝液,對該區域內的皮膚進行第二次刮洗30s,將第二次擦洗的液體,注入含第一次刮洗液體的試管中。
實驗區試驗後的消毒處理:對抑菌樣品組清洗後的實驗區採樣之後,需用70%的酒精對實驗區進行消毒。然後對無抑菌成分的對照組清洗後的實驗區以同樣方法進行採樣、消毒。實驗結束後,用皮膚消毒劑對兩隻前臂進行消毒處理,處理後清水沖洗,擦乾,再塗少量的抗生素軟膏。
接種與培養:對每一個取樣進行接種,以0.0375 mol/L磷酸鹽緩衝液對樣品進行10倍系列稀釋,選適當稀釋度取0.1 mL接種於2個含5%羊血的TSA平板表面,用玻璃彎棒塗勻,在36℃±1℃的培養箱中培養48h±4h,計數菌落數。
6.5.1.6.4 5.1.6.4 抑菌率的計算

式中:
X--抑菌率%
A--對照平均菌落數, 單位爲 CFU/試驗區
B--試驗平均菌落數, 單位爲 CFU/試驗區
6.5.1.6.5 5.1.6.5 判定標準
實驗不得少於16人次,抑菌率均≥ 50%,可判定該產品在規定的時間內有滯留抑菌作用。
6.5.2 5.2 抗菌效果
6.5.2.1 5.2.1 懸液定量殺菌試驗
6.5.2.1.1 5.2.1.1 適用範圍
適用於液體抗菌產品(如液體抗菌液、抗菌噴霧劑等)對微生物抗菌效果的測定。
6.5.2.1.2 5.2.1.2 試劑、培養基及器材
中和劑(用PBS配製),其它見5.1.1.2。
6.5.2.1.3 5.2.1.3 菌懸液配製
取試驗菌24h新鮮斜面培養物用PBS洗下,用PBS稀釋至約5.0×105CFU/mL~4.5×106CFU/mL菌懸液備用。
6.5.2.1.4 5.2.1.4 中和劑鑑定試驗
5.2.1.4.1 分組
第1組:5.0 mL中和劑 + 0.1 mL菌懸液 → 培養
第2組:(0.5 mL抗菌劑 + 4.5 mL中和劑)+ 0.1 mL菌懸液 → 培養
第3組:5.0 mL稀釋液 + 0.1 mL菌懸液 → 培養
5.2.1.4.2 步驟
根據試驗分組,準備試管和平皿,進行編號。
第1組:取5.0 mL中和劑,置20℃±1℃水浴中10min後,加入0.1 mL試驗菌懸液,混勻,作用10min,用中和劑做10倍系列稀釋,選適宜稀釋度分別吸取1.0 mL接種於2個平皿中,做活菌培養計數。
第2組:取4.5 mL中和劑於試管內,加入0.5 mL抗菌劑,混勻,置20℃±1℃水浴中10min製成中和產物,加入0.1 mL試驗菌懸液,混勻,作用10min,用中和產物做10倍系列稀釋,選適宜稀釋度分別吸取1.0 mL接種於2個平皿中,做活菌培養計數。
第3組:取5.0 mLPBS,置20℃±1℃水浴中10min,加入0.1 mL試驗菌懸液,混勻,作用10min,用PBS做10倍系列稀釋,選適宜稀釋度分別吸取1.0 mL接種2個平皿,做活菌培養計數。
第4組:分別吸取稀釋液(PBS)、中和劑各1.0 mL於同一無菌平皿內,倒入上述試驗同批次的培養基15 mL~20 mL,作爲陰性對照組培養觀察。
5.2.1.4.3 結果判定
第1、2、3組有相似量試驗菌生長,且菌量在1.0×104CFU/mL~9.0×104CFU/mL;計算組間菌落數誤差率,其組間菌落數誤差率應不超過15%;第4組無菌生長,否則,說明試劑有污染,應更換無污染的試劑重新進行試驗。
試驗重複3次,每次試驗均應符合以上要求。
6.5.2.1.5 5.2.1.5 試驗步驟
取無菌試管,先加入5.0 mL抗菌劑(介紹規定的使用濃度),置20℃±1℃ 水浴中5min後,再加入0.1 mL試驗用菌懸液,迅速混勻並立即計時。
待試驗菌與抗菌劑相互作用至各預定時間(以介紹規定時間爲T,時間分別爲0.5T,T,1.5T),分別吸取0.5 mL試驗菌與抗菌劑混合液加於4.5 mL中和劑中,混勻。
各管試驗菌與抗菌劑混合液經中和劑作用10min後,分別吸取1.0 mL樣液,按活菌培養計數方法測定存活菌數,每管樣液接種2個平皿。如平板上生長的菌落數較多時,可用PBS進行10倍系列稀釋後,再進行活菌培養計數。
同時用PBS代替消毒液,進行平行試驗,作爲陽性對照。陽性對照回收菌落數在1.0×104CFU/mL~9.0×104CFU/mL。取同批次稀釋液、中和劑、培養基作陰性對照。
所有試驗樣本和對照樣本均在36℃±1℃培養,對細菌繁殖體培養48h觀察最終結果;對白色念珠菌需培養72h觀察最終結果。試驗重複3次,計算殺菌率。
6.5.2.1.6 5.2.1.6 殺菌率計算

式中:
X—殺菌率,%;
A—陽性對照組回收菌量,單位爲 CFU/mL;
B—試驗組回收菌量,單位爲 CFU/mL。
6.5.2.1.7 5.2.1.7 結果判定
介紹規定時間的殺菌率≥90%,判有抗菌作用;介紹規定時間的殺菌率≥99%,判爲較強抗菌作用。
6.5.2.2 5.2.2 載體浸泡定量殺菌試驗
6.5.2.2.1 5.2.2.1 適用範圍
適用於粘稠狀(半固體)抗菌產品如抗菌洗手液、抗菌沐浴露、抗菌凝膠、膏狀抗菌產品等對微生物抗菌效果的鑑定。
6.5.2.2.2 5.2.2.2 試劑、培養基及器材
中和劑(PBS配製),其它見5.1.2.2。
6.5.2.2.3 5.2.2.3 染菌載體製備
取試驗菌24h新鮮斜面培養物用PBS洗下,用PBS稀釋至約5×106CFU/mL~5×107CFU/mL製成菌懸液備用。用微量移液器滴染10μl菌懸液於滅菌載體上,36℃±1℃烘乾或室溫晾乾備用。
6.5.2.2.4 5.2.2.4 中和劑鑑定試驗
5.2.2.4.1 試驗分組
第2組:(含抗菌劑的載體 + 5.0 mL中和劑)+染菌載體→ 培養
第3組:5.0 mL稀釋液 +染菌載體→ 培養
5.2.2.4.2 試驗步驟
根據試驗分組,準備試管和平皿,依次進行編號。
第1組:取5.0 mL中和劑於無菌平皿中,置20℃±1℃水浴5min,加入1片染菌載體,作用10min,取出菌片放入5.0 mL中和劑試管內,作用10min後,置渦旋振盪器上振盪1min或在手掌上用力振打80次,將試驗菌洗下,用中和劑做10倍系列稀釋後,選擇適宜稀釋度,分別吸取1.0 mL接種於2個平皿中,做活菌培養計數。
第2組:取5.0 mL中和劑於無菌平皿內,加入1片沾有抗菌樣本的載體,混勻,置20℃±1℃水浴作用10min製成中和產物。再用無菌鑷子取1片染菌載體,浸於中和產物中作用10min後,用無菌鑷子取出染菌載體移入含5.0 mL中和產物試管中,作用10min,振盪,將試驗菌洗下,用中和產物做10倍系列稀釋,選適宜稀釋度分別吸取1.0 mL接種於2個平皿中,做活菌培養計數。
第3組:取5.0 mLPBS於無菌平皿中,置20℃±1℃水浴5min,加入1片染菌載體,作用10min,取出菌片放入5.0 mLPBS試管內,作用10min後,振盪,將試驗菌洗下,用PBS做10倍系列稀釋, 選適宜稀釋度分別吸取1.0 mL接種於2個平皿中,做活菌培養計數。
第4組:分別吸取稀釋液(PBS)與中和劑各1.0 mL於同一無菌平皿內,倒入同批次的培養基15~20mL,培養觀察。
5.2.2.4.3 結果判定
第1、2和3組有相似量試驗菌生長,且菌量在1.0×104CFU/片~9.0×104CFU/片。計算組間菌落數誤差率,其組間菌落數誤差率應不超過15%。第4組無菌生長,否則,說明試劑有污染,應更換無污染的試劑重新進行試驗。試驗重複3次,每次試驗均應符合以上要求。
6.5.2.2.5 5.2.2.5 試驗步驟
按5 g/片的量稱取抗菌樣品於無菌平皿內,置20℃±1℃水浴5min,用無菌鑷子取染菌載體,使載體完全浸沒於抗菌樣品中,立即計時。
待染菌載體與抗菌劑相互作用至各預定時間(以介紹規定時間爲T,時間分別爲0.5T,T,1.5T),分別取染菌載體加入5.0 mL中和劑試管中,混勻。
經中和劑作用10min後,振盪,將試驗菌洗下,分別吸取1.0 mL樣液,按活菌培養計數方法測定存活菌數,每管樣液接種2個平皿。如平板上生長的菌落數較多時,可用PBS進行系列10倍稀釋後,再進行活菌培養計數。
取與試驗樣品同質材料不含抗菌成分的對照樣品代替抗菌樣品浸泡2片染菌載體,進行平行試驗,作爲陽性對照。陽性對照回收菌量爲1.0×104CFU/片~9.0×104CFU/片。取同批次稀釋液、中和劑、培養基作陰性對照。
所有試驗樣本和對照樣本均在36℃±1℃培養,細菌繁殖體培養48h觀察結果;白色念珠菌培養72h觀察結果。試驗重複3次,計算殺菌率。
6.5.2.2.6 5.2.2.6 殺菌率計算

式中:
X—殺菌率,%;
A—對照樣品的回收菌量,單位爲 CFU/片;
B—試驗樣本回收菌量,單位爲 CFU/片。
6.5.2.2.7 5.2.2.7 結果判定
介紹規定時間的殺菌率≥90%,判有抗菌作用;介紹規定時間的殺菌率≥99%,判有較強抗菌作用。
6.5.2.3 5.2.3 載體殺菌試驗
6.5.2.3.1 5.2.3.1 適用範圍
適用於添加有殺菌劑的衛生溼巾或可溶性抗菌物質的載體類產品的抗菌性能效果的鑑定。
6.5.2.3.2 5.2.3.2 試劑、培養基及器材
中和劑(PBS配製),其它見5.1.1.2
6.5.2.3.3 5.2.3.3 菌懸液配製及樣片製備
取試驗菌24h新鮮斜面培養物用PBS洗下,用PBS稀釋至1.0×105CFU/mL~ 9.0×105CFU/mL,製成菌懸液備用。
用無菌剪刀將抗菌產品和材質相同但不含抗菌成分的對照樣品分別剪成20 mm×30 mm樣片備用。試驗時滴加0.1 mL菌懸液。對照樣片染菌前需經121℃15min滅菌處理。
6.5.2.3.4 5.2.3.4 中和劑鑑定試驗
5.2.3.4.1 試驗分組
第1組:5.0 mL中和劑 + 染菌對照樣片 → 培養
第2組:(5.0 mL 中和劑 + 抗菌樣片)+ 染菌對照樣片 → 培養
第3組:5.0 mL稀釋液 + 染菌對照樣片→ 培養
5.2.3.4.2 試驗步驟
根據試驗分組,準備試管和平皿,依次進行編號。
第1組:取5.0 mL中和劑於無菌試管內,置20℃±1℃水浴5min,用無菌鑷子取1片染菌對照樣片加入試管內,作用10min,振盪將試驗菌洗下,用中和劑做10倍系列稀釋後選擇適宜稀釋度分別吸取1.0 mL接種於2個平皿中,做活菌培養計數。
第2組:取5.0 mL中和劑於無菌試管內,用無菌鑷子取1片抗菌樣片加入試管內,振盪混勻置20℃±1℃水浴作用10min製成中和產物,再夾入1片染菌對照樣片,作用10min,振盪將試驗菌洗下,用中和產物做10倍系列稀釋,選擇適宜稀釋度分別吸取1.0 mL接種2個平皿,做活菌培養計數。
第3組:取5.0 mLPBS於無菌試管內,置20℃±1℃水浴5min,用無菌鑷子取1片染菌對照樣片加入試管內,作用10min,振盪將試驗菌洗下,用PBS做10倍系列稀釋後選擇適宜稀釋度分別吸取1.0 mL接種2個平皿,做活菌培養計數。
第4組:分別吸取稀釋液與中和劑各1.0 mL於同一無菌平皿內,傾注同批次的培養基15 mL~20 mL,培養觀察。
5.2.3.4.3 結果判定
第1、2和3組有相似量試驗菌生長,且菌量在1.0×104CFU/片~9.0×104CFU/片。計算組間菌落數誤差率,其組間菌落數誤差率應不超過15%。第4組無菌生長,否則,說明試劑有污染,應更換無污染的試劑重新進行試驗。
試驗重複3次,每次試驗均應符合以上要求。
6.5.2.3.5 5.2.3.5 試驗步驟
取無菌平皿,用無菌鑷子取3片試驗樣片,勿重疊,置20℃±1℃水浴5min,在每一樣片上滴加0.1 mL試驗用菌懸液,立即計時。
待試驗菌與樣片相互作用至各預定時間(以介紹規定時間爲T,時間分別爲0.5T,T,1.5T),分別夾取染菌樣片加於5.0 mL中和劑試管中,混勻。
經中和劑作用10min後,振盪將試驗菌洗下,分別吸取1.0 mL樣液,按活菌培養計數方法測定存活菌數,每管樣液接種2個平皿。如平板上生長的菌落數較多時,可10倍系列稀釋後,再進行活菌培養計數。
同時用不含殺菌成分,其他成分相同的對照樣片2片代替試驗樣片,進行平行試驗,作爲陽性對照。陽性對照回收菌落數在1.0×104CFU/片~9.0×104CFU/片。取試驗同批次稀釋液、中和劑、培養基作陰性對照。
所有試驗樣本和對照樣本均在36℃±1℃培養,細菌繁殖體培養48h、白色念珠菌需培養72h觀察最終結果。試驗重複3次,計算殺菌率。
6.5.2.3.6 5.2.3.6 殺菌率計算
見5.2.2.6。
6.5.2.3.7 5.2.3.7 結果判定
介紹規定時間的殺菌率≥90%,判有抗菌作用;介紹規定時間的殺菌率≥99%,判有較強抗菌作用。
6.5.2.4 5.2.4 浸漬殺菌試驗
6.5.2.4.1 5.2.4.1 適用範圍
適用於抗菌毛巾、抗菌棉襪、抗菌棉布、抗菌紗布口罩等含有溶出性抗菌材料的抗菌織物對微生物抗菌效果的試驗。
6.5.2.4.2 5.2.4.2 試劑、培養基及器材
中和劑(PBS配製,針對樣品中所含可溶性抗菌成分進行中和劑鑑定試驗),其它見5.1.5.2
6.5.2.4.3 5.2.4.3 試驗步驟
分別取1 mL菌懸液加入2份準備好的錐形瓶內試樣和1份對照織物上,確保其均勻分佈,且錐形瓶中不留多餘液,封好瓶口,以防蒸發,造成細菌死亡。
分別在一個盛有已接種菌懸液的試樣和對照織物的錐形瓶中加入100 mL中和劑,置渦旋振盪器上振盪1min洗滌細菌,取1.0 mL做10倍系列稀釋,選適當稀釋度以傾注法接種平皿,作爲“0”接觸時間樣本和對照織物上的細菌數。
將另一個裝有已接種菌懸液試樣的錐形瓶於36℃±1℃培養20h±2h,加入100 mL中和劑,置渦旋振盪器上振盪1min洗滌細菌,取1.0 mL做10倍系列稀釋,選適當稀釋度以傾注法接種平皿,作爲試驗組。陰性對照組:試樣不接種菌懸液,在“0”接觸時間加入100 mL中和劑,置渦旋振盪器上振盪1min取樣,接種平皿。
陽性對照組:另取1個裝有對照織物的錐形燒瓶,接種1 mL菌懸液後,在36℃±1℃培養20 h±2h,加入100 mL PBS,置渦旋振盪器上振盪1.0min洗滌細菌,取1.0 mL做10倍系列稀釋,選適當稀釋度以傾注法接種平皿。
將陰性和陽性對照樣本與試驗組樣本一併放36℃±1℃培養48h,計數菌落數。試驗重複3次。
6.5.2.4.4 5.2.4.4 殺菌率的計算
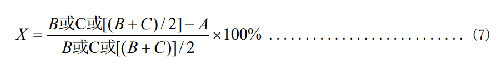
式中:
X—殺菌率,%;
C—“0”接觸時間對照織物上的細菌數, CFU/mL;
如果“B”和“C”差別較大時,取較大值;如果“B”和“C”差別不大時,取平均值。
6.5.2.4.5 5.2.4.5 結果判定
“0”接觸時間對照織物的平均菌落數應在1.0×103CFU/mL~5.0×103CFU/mL 。
陰性對照應無菌生長,陽性對照菌數比0接觸時間的菌數明顯增加。
各次試驗的殺菌率均≥90%,即可認定該樣品具有抗菌作用;殺菌率≥99%,判有較強抗菌作用。
6.5.2.5 5.2.5 振盪燒瓶試驗
6.5.2.5.1 5.2.5.1 適用範圍
適用於添加有非溶出性抗菌物質的抗菌產品對微生物抗菌效果的鑑定。
注1:在進行振盪燒瓶試驗前,需要鑑定其抗菌成分是否可溶出,如果有溶出性抗菌材料,參照可溶出抗菌材料檢測,無溶出性抗菌材料,可選用振盪燒瓶法進行。
注2:非溶出性抗菌材料的鑑定:將樣品置於無菌蒸餾水浸泡 24h,取浸泡液參照 5.1.1 檢驗是否有抑菌效果,或將樣品裁成直徑 5 mm 圓片參照 5.1.4 檢驗是否有抑菌環。如果無抑菌效果,說明樣品屬非溶出性抗菌材料,進行振盪燒瓶試驗。
6.5.2.5.2 5.2.5.2 試劑、培養基及器材
搖牀,天平,其它見5.1.1.2
6.5.2.5.3 5.2.5.3 試驗步驟
5.2.5.3.1 對於抗菌無紡布口罩、衛生巾、衛生護墊、尿布、尿不溼、無紡布一次性內褲等產品,對微生物抑菌效果的試驗方法參照 GB15979 進行。
結果判定:不加樣片組的菌落數在1.0×104CFU/mL~9.0×104CFU/mL,且樣品振盪前後平均菌落數差值在10%以內,試驗有效;被試樣片組抑菌率與對照樣片組抑菌率的差值≥26%,判產品具有抗菌作用。
5.2.5.3.2 對於抗菌毛巾、抗菌棉襪、抗菌棉布、抗菌紗布口罩等含非溶出性抗菌材料的針織類抗菌織物對微生物抗菌效果按照 FZ/T73023 標準進行檢測和評價。
6.5.2.6 5.2.6 貼膜試驗
6.5.2.6.1 5.2.6.1 適用範圍
適用於PE抗菌底模、PE打孔膜及PE抗菌包裝袋、抗菌塑料、抗菌地板、抗菌瓷磚等產品抗菌效果測定。通過將細菌污染於樣品表面,然後用塑料薄膜覆蓋,使細菌與樣品表面充分接觸,以測定其抗菌效果。
6.5.2.6.2 5.2.6.2 試劑、培養基及試驗器材
5.2.6.2.1 試驗菌株
金黃色葡萄球菌(ATCC 6538)、大腸桿菌(8099)、白色念珠菌(ATCC10231),也可根據抗菌用品特定用途選用其他菌株。
5.2.6.2.2 試劑
pH7.2~7.4 的0.03 mol/L PBS,營養瓊脂培養基,營養肉湯培養基,沙氏瓊脂培養基,沙氏液體培養基。
5.2.6.2.3 試驗器材
薄膜爲不影響細菌生長和不吸水的材料,厚度不規定,使用面應有較好的粘合性,邊長爲40 mm±2 mm的正方形;無菌塑料袋、樣片:將試樣及對照試樣(與試樣同質不含抗菌組分)分別製成邊長爲50 mm±2 mm的正方形,其中抗菌樣片3個,對照樣片6個。
6.5.2.6.3 5.2.6.3 實驗步驟
將試驗菌24h新鮮斜面培養物用PBS洗下製成菌懸液。將菌懸液用1/500的營養肉湯稀釋成2.5×105CFU/mL~1.0×106CFU/mL試驗用菌懸液。
將樣片試驗面朝上放於無菌平皿中,取0.4 mL 菌懸液滴染於樣片中央,塗勻。薄膜覆蓋,小心觸壓薄膜,使菌液均勻散開,以免菌液溢出薄膜外。蓋上平皿蓋。同時取對照樣片放於無菌平皿中,取0.4mL菌懸液滴染於樣片中央,塗勻。按試驗樣片方法用薄膜覆蓋,蓋上平皿蓋。
將裝有接種過菌液的試驗樣片和對照樣片的平皿(3個抗菌樣片和3個對照樣片),置36℃±1℃、相對溼度不低於90%的條件下培養24h。
以無菌操作方式用鑷子將覆蓋膜和樣片放入無菌塑料袋中,然後加入10 mL肉湯培養液,用手充分揉搓袋中的樣片和覆蓋薄膜,將細菌洗下。
吸取1 mL洗下的菌液,取適當稀釋度接種2個平皿,加入15 mL~20 mL營養瓊脂,待瓊脂凝固後,翻轉平皿使底向上,置36℃±1℃培養48h。
將另3個對照樣片“0”時間接種菌液後,立即用鑷子將覆蓋膜和樣片放入塑料袋中,洗脫和接種方法與試驗樣片相同;以試驗用同批次稀釋液接種培養基作爲陰性對照,試驗重複3次。
6.5.2.6.4 5.2.6.4 存活菌數的計算
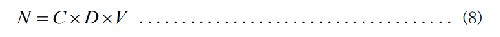
式中:
D—稀釋倍數;
6.5.2.6.5 5.2.6.5 結果的計算與判定
5.2.6.5.1 試驗成立條件
各次試驗陰性對照均無菌生長;對照樣片接種後直接求出活菌數的對數值應:

式中:
L最小值—最小活菌數的對數值;
L平均值—平均活菌數的對數值;
對照樣片“0”時間接種後的活菌數平均值不少於1.0×105CFU/樣片;覆蓋了薄膜的對照樣片培養24h後的活菌數不少於 1.0×104CFU/樣片。
5.2.6.5.2 抗菌活性值的計算
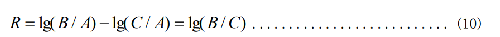
式中:
R—抗菌活性值;
A—對照樣片“0”時間接種後的活菌數的平均值,單位爲 CFU/樣片;
B—對照樣片在接種後培養24h的活菌數的平均值,單位爲 CFU/樣片;
C—抗菌樣片在接種後培養24h的活菌數的平均值,單位爲 CFU/樣片。
5.2.6.5.3 結果判定
各次試驗抗菌活性值均≥1.0,可判定該試樣具有抗菌作用;各次試驗抗菌活性值均≥2.0,可判定該試樣具有較強抗菌作用。
6.5.2.7 5.2.7 持續抗菌試驗
6.5.2.7.1 5.2.7.1 適用範圍
6.5.2.7.2 5.2.7.2 試劑、培養基及器材
試驗菌株:金黃色葡萄球菌(ATCC6538)、大腸桿菌(8099)、黑曲黴菌(ATCC16404)等載體:布片、玻片、不鏽鋼片等
試劑:稀釋液(含0.01%吐溫80的0.03mol/L的PBS)、中和劑(PBS配製)、營養瓊脂、麥芽浸膏瓊脂等。
6.5.2.7.3 5.2.7.3 試驗步驟
5.2.7.3.1 長效抗菌劑樣片的製備:
根據長效抗菌劑所用載體,如木板、金屬板、塑料板等裁成50 mm×50 mm,製備抗菌樣片。按照抗菌劑塗抹要求,將抗菌劑塗布於樣片表面,室溫乾燥備用,作爲實驗組;未經任何處理的樣片(經壓力蒸汽滅菌處理)作爲對照組;兩組樣片在室溫下存放於實驗室。
5.2.7.3.3 長效抗菌實驗步驟
實驗室試驗:兩組樣片於室溫存放至長效抗菌劑介紹規定的持續作用時間(如7d,15d和30d等),後,取出實驗組和對照組進行試驗。將24h新鮮培養的菌懸液染到載體上,實驗組染菌載體作用至介紹規定時間後(如2.5min、5min、10min、20min等)投入中和劑中,混勻後稀釋接種;同時用對照組樣片染菌進行平行試驗,對照組染菌載體在相同時間投入稀釋液中,混勻後稀釋接種。細菌繁殖體36℃±1℃培養48h、黑曲黴菌30℃±1℃培養72h觀察最終結果,對照載體染菌後的回收菌量在1.0×104CFU/片~9.0×104CFU/片。取試驗同批次稀釋液、中和劑、培養基作陰性對照。試驗重複3次,計算殺菌率。
現場實驗:選擇病房或其他公共場所表面作爲試驗現場,選擇相似場所一組作爲對照組,一組作爲實驗組。對照組不做任何處理,試驗組噴塗抗菌劑,對照組以常規方式清潔消毒,實驗組噴塗抗菌劑後,日常僅清水擦拭,至規定時間(長效時間如7d,15d、30d)後進行採樣。對照組用無菌棉籤沾稀釋液採樣,實驗組用無菌棉籤沾中和劑採樣,採樣面積爲50 cm2 ,對照組和實驗組均爲30個樣本。所有試驗樣本和對照樣本經適當稀釋接種後, 36℃±1℃培養48h觀察結果,計算殺菌率。
6.5.2.7.4 5.2.7.4 殺菌率計算

式中:
X—殺菌率,%;