4 別名
再次冠狀動脈搭橋術;coronary artery bypass;再次冠狀動脈旁路移植術;ReCABG
7 概述
再次手術是一個複雜的、費時間的、危險性較初次手術高的一種手術。再次手術最常見原因是靜脈橋的再狹窄和閉塞,同時可與自身冠狀動脈病變的進展並存。初次進行的原位左內乳動脈-左前降支移植10年通暢率約爲90%,應用大隱靜脈的僅50%上下。應用壁厚和口徑粗的大隱靜脈橋,早期衰竭率更高,應用遊離動脈橋移植能否得到與原位左內乳動脈-前降支移植同樣的早期效果,尚有爭議。
冠狀動脈介入性治療,包括血管成形術和血管內支架,爲冠狀動脈再狹窄病例提供了一種可選擇方法,而且手術病死率和病殘率較低,但晚期效果較差。經大隱靜脈橋血管腔內摘除竈性斑塊和血栓早期通常是成功的,然而平均約6個月後,經造影證實再狹窄的發生率大約爲60%。
8 適應症
再次冠狀動脈旁路移植術適用於:
臨牀指徵一般可參考初次手術要求,多爲難以應用藥物控制的嚴重心絞病。再次手術前的冠脈造影所見有以下三種情況:①1條以上主要血管橋閉塞;②自身冠狀動脈粥樣硬化進展;③血管橋閉塞加自身冠脈病變加重,後者的比例較低。再次手術組的病例和初次手術組比年齡一般都較大,多在70歲以上,女性較多,左主幹病變和瀰漫性或多支病變亦較多,左室功能較差,合併糖尿病、慢性肺部病變和高血壓的發病率亦增高。以上都是一些高危因素,都將增加手術危險性和術後併發症。再次手術的危險性大約爲初次手術的2~3倍,術後圍術期心肌梗死率、呼吸道併發症和出血開胸探查率亦較高,雖都不是手術的禁忌,但對再次手術病例的選擇應更慎重。有的病例初次手術的內乳動脈-前降支血管橋尚通暢,其他主要血管橋因病變而閉塞需要再手術,這種情況下,通暢的內乳動脈血管橋不應構成手術的禁忌,而且在再手術時應注意防止損傷。對移植5年以上有明顯病變的靜脈橋有的主張在再手術時均應予以切除和再移植,已得到共識,因爲這類靜脈橋一旦有明顯病變則有迅速發展的可能,有報道在幾周前造影尚通暢的靜脈橋再次手術時已完全閉塞。
9 冠脈解剖
正常冠狀動脈主幹和主要分支均在冠狀溝和前後室間溝中的心外膜下行走,並沿途發出許多分支。冠狀動脈粥樣硬化的病變大多數都在近心臟表面的大冠狀動脈分支上,呈節段性,且多發生在動脈分叉部位,如左冠狀動脈分爲前降支和左旋支處,前降支分出對角支處,右冠狀動脈緣支和後降支分出處等。心壁內冠狀動脈狹窄很少見。冠狀動脈狹窄按其程度可分爲4級,管腔直徑減少25%以內者爲Ⅰ級;25%~50%爲Ⅱ級;50%~75%爲Ⅲ級,超過75%者爲Ⅳ級。管腔縮小50%以上即Ⅲ級病變,可出現明顯臨牀症狀。冠狀動脈狹窄程度可用直徑法表示,但臨牀上多用面積法表示。二者關係或換算見圖6.46.1.2-0-1。

冠狀動脈解剖及影像學表現見圖6.46.1.2-0-2~6.46.1.2-0-11。
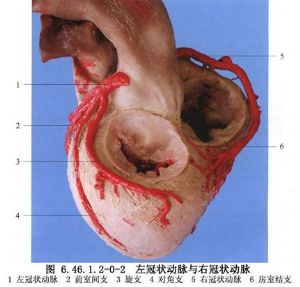

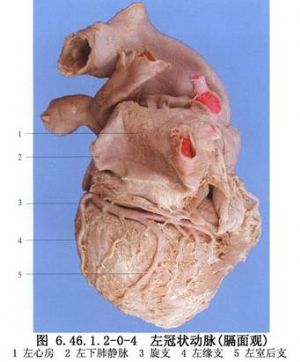


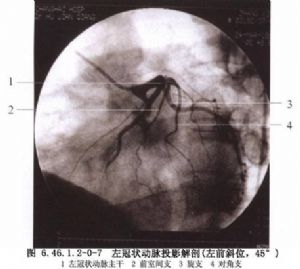
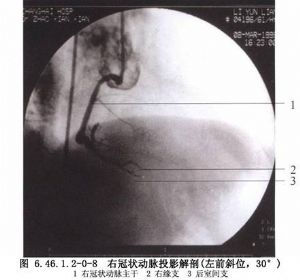

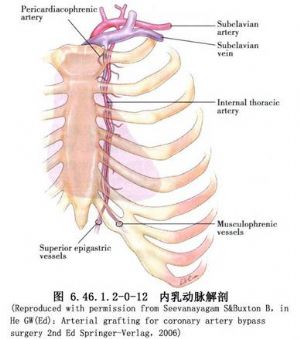
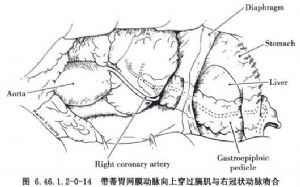
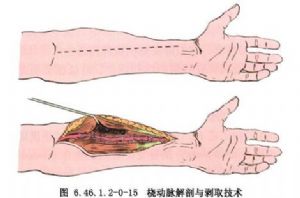
冠狀動脈旁路移植術是應用移植血管橋手段以改善狹窄遠端的心肌缺血。血管橋的選擇是保證手術成功和遠期效果的重要條件,其中生物學性質更爲重要。應用最多的血管橋仍是大隱靜脈和內乳動脈,假如這兩種血管橋不夠時,還可採用右胃網膜動脈、橈動脈和腹壁上動脈等。選擇的條件是:①有足夠到達靶血管的長度;②內徑2~3mm,和靶血管直徑要相稱,即1∶1到2∶1;③管壁厚度<1mm;④帶蒂(原位)移植優於遊離血管橋移植;⑤10年通暢率>80%,一般認爲動脈橋較靜脈橋遠期通暢率高,特別是帶蒂內乳動脈(圖6.46.1.2-0-12~6.46.1.2-0-15)。

選擇血管橋時還應把病人情況加以考慮,如80歲以上、伴惡性病變、糖尿病、肥胖、肺功能低下、腎功能損害、凝血或血小板功能障礙及急症手術病例,對靜脈橋的選擇條件可以放寬。關於完全採用動脈橋的問題,一度引起人們關注,當今對左前降支都主張選用原位內乳動脈移植,非主要冠狀動脈狹窄,多數仍採用大隱靜脈橋。
10 術前準備
除按一般冠脈旁路移植術術前準備外,必須充分估計到再次手術的危險性。要詳細詢問初次手術史,初次手術適應證是什麼?做了什麼手術?再次手術適應證和初次有什麼區別?若有可能應參閱其既往住院病歷和手術記錄,包括前次手術做過幾支血管橋、血管橋材料和移植部位,升主動脈狀況;要仔細閱讀近期冠狀動脈造影、認真評估尚存在的血流通暢的血管橋,自身冠狀動脈病變情況和左室功能,這樣有助於設計再次手術方案和提醒術中應注意事項。
術前10d一般應停用阿司匹林或其他抗血小板藥物,術前2~3d停用抗凝藥,有利於預防術中和術後滲血。另外,體外循環期間應用抑肽酶也能減少出血和輸血量,但不會影響血管橋的早期通暢率。
麻醉和氣管插管後安置好體外除顫電極,可置於兩外側腋部或單一後背部除顫電極,以便在心臟未遊離前一旦出現室顫可及早體外除顫。開胸後假如心外粘連緻密,當電極板不能直接與心表接觸,亦可將電極置入胸膜腔在心包外除顫。
11 手術步驟
由於再手術病例病情一般都比較重,出血多,手術時間長,所以麻醉誘導前或氣管插管後應及時建立心電、血壓,包括血流動力學監測,並準備血液(紅細胞)回收裝置。
基本手術技術在許多方面都和初次手術時相似,但是再次手術在手術徑路和吻合技術上也有許多不同之處和注意事項。
1.再次手術徑路:
(1)胸骨正中切口:體位和血管橋準備同初次手術,切開胸骨顯露心臟時難度較大。假如胸骨後與心臟有緻密粘連,特別是有跨越中線的血管橋、升主動脈瘤和某些左室功能低下病例,在切開胸骨前有時需先做股動、靜脈插管。股靜脈插管可送至下腔靜脈,建立體外循環,若一旦發生致命性大出血時,可吸回胸腔失血和作循環支持。開胸時最好應用擺動鋸細心地鋸開胸骨,由下而上一段一段的鋸,而後將切口向外上牽拉,在直視下逐步銳性剝離胸骨後粘連,每側分開2~4cm後,再插入胸骨牽開器逐步將切口牽開。
(2)左側開胸切口:左側開胸是另一種安全而方便的,可供選擇的再次手術徑路。選用這一徑路的病例主要是處理前降支的對角支、迴旋支、有時對右冠狀動脈左室後支的手術也可採用;前降支和右冠狀動脈的手術不能選用這一徑路。對前降支的內乳動脈橋仍保持通暢者,以及升主動脈有嚴重鈣化或瘤樣擴張時,這一徑路特別安全而方便。病人採右側臥位,左胸在上方,經第5肋骨牀開胸,擺體位時可將病人左髖部稍向後轉,同時消毒左腹股溝,應用與血管平行的切口顯露左股動、靜脈,分別插入動脈和下腔靜脈導管(28~32F)。以便必要時立即建立體外循環。然後可再經肺動脈插入第2根靜脈導管,左心也常插管引流,體溫降至22℃,誘導心臟停搏。當病人鼻咽溫度下降到25℃時,體外循環流量可降至1L/(min·㎡)。
2.手術操作 做胸骨正中切口,按常規準備和選擇可移植的血管橋。左內乳動脈功能好,做內乳動脈前降支吻合是首選材料;其次是大隱靜脈;假如大隱靜脈前次手術已用完,可選用胃網膜右動脈、橈動脈或小隱靜脈。
在鋸開胸骨過程或遊離前縱隔粘連時誤傷無名靜脈,常常難以立即修復,有時需先切斷和分離後再修復。術中若誤傷通暢的靜脈橋或右心室,可造成嚴重出血,必須立即靜脈注射肝素經股動、靜脈插管或升主動脈和右房插管,開始體外循環,應用吸引器將失血及時吸入人工心肺裝置,及時回輸給病人,並妥善處理心臟和血管損傷。
胸骨完全劈開後分離胸骨後兩側粘連,在心前區軟組織無張力情況下應用牽開器逐步牽開手術野,先在心包外應用電刀由下而上逐步分離心包與胸壁粘連(圖6.46.1.2-1)。左內乳動脈-前降支血管橋一般在前縱隔中線附近或稍偏左,注意切勿損傷。假如在遊離胸骨後粘連時離斷心前血管橋,特別是內乳動脈-前降支血管橋,可突然造成心肌缺血和心搏驟停,這種情況在立即建立體外循環前,尚應同時做心臟擠壓以保證腦心等重要臟器供血。對心表粘連一般應用銳性分離,鈍性分離容易損傷心外膜下靜脈和心肌組織,要特別小心。

對二次手術病例分離心包與心肌粘連時,一般先經心包分離右室前壁、膈肌、依次右房、升主動脈,右側一般顯露出右心房,繼續分離升主動脈前方四周粘連,直達弓的下緣,必要時還得遊離和牽開無名靜脈,以便做動脈插管和血管橋近端吻合口用。分離升主動脈左側時容易損傷肺動脈,若一旦肺動脈損傷,最好在建立體外循環後修復。在剝離左室前,一般主張先阻閉升主動脈和誘導心臟停搏,因爲心臟排空和停搏後再剝離左心室比較方便,創傷也比較小,特別有利於防止病變靜脈橋內栓子脫落,造成遠端心肌梗死。剝離左室面應從隔面開始,這個部位粘連比較輕,而且容易找到界面,然後逐步分離左心緣的心包粘連,直至顯露左心尖(圖6.46.1.2-2)。由於原位左內乳動脈或遊離血管橋的存在,可使得顯露左室側壁很困難,而且容易損傷血管橋,在這種情況下應用心表面彩超多普勒探測,有助於標出左和(或)右內乳動脈橋和主動脈斑塊部位,可指導手術者在整個手術過程中注意保護冠狀動脈前降支,包括已移植的血管橋。術中操作時還要避免牽拉和觸壓有病變的靜脈橋,防止橋內硬化斑上的小栓子脫落。

左室遊離後,尋找鑑定老的血管橋和病變血管橋,可從心尖開始向上尋找左內乳動脈橋與前降支吻合部位。若心包內未找到,左內乳動脈可能位於胸膜腔內,遊離後予鉗閉。處理右內乳動脈橋也可採用同樣方式。若內乳動脈橋未能得到安全證實,暫不鉗閉,待將體溫降至22℃,體外循環流量降至1~2L/min再進行旁路移植手術。心臟停搏下阻閉內乳動脈橋的目的是防止體外循環灌注血流的進入心臟和造成心肌復溫,這樣會抵消冷心臟停搏液對心肌的保護效果。
(1)大隱靜脈-前降支病變血管橋處理:先於前降支原先吻合口部位進行探查,將吻合口上下方前降支及鄰近吻合口的大隱靜脈橋予以分離,在再次手術中若內乳動脈可以應用,有4種方式可供選擇:
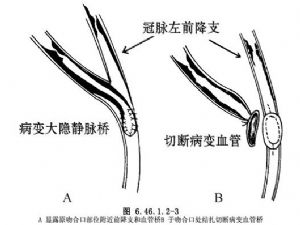
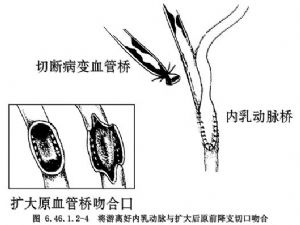
①於原吻合口將狹窄或閉塞的大隱靜脈橋離斷和結紮(圖6.46.1.2-3),擴大冠狀動脈原吻合口,將內乳動脈遠端與前降支吻合(圖6.46.1.2-4)。
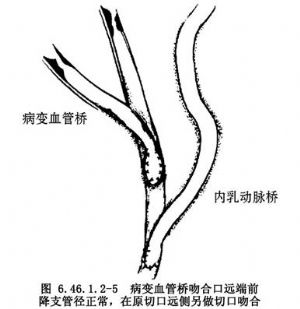
②若原吻合口遠端前降支口徑夠大,可直接在原吻合口遠側另做冠狀動脈切口進行內乳動脈-前降支吻合術(圖6.46.1.2-5)。
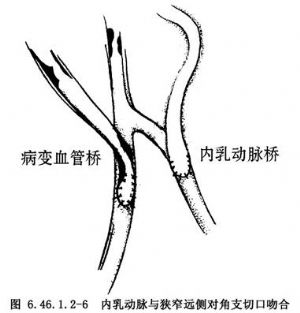
③若原吻合口遠側管徑較細,前降支狹窄遠側尚有較粗對角支,可將內乳動脈與對角支吻合(圖6.46.1.2-6)。
④若病變血管橋原吻合口遠側前降支亦出現狹窄(圖6.46.1.2-7右上插圖),有兩種方法可供選擇:A.將病變血管橋遠端吻合處結紮離斷,經原吻合口將切口向遠側延伸至超過狹窄部位,以血管片加寬管腔後,在補片上另做切口行內乳動脈吻合(圖6.46.1.2-7);B.在原大隱靜脈血管橋的遠側和近側的前降支上做序貫式吻合(圖6.46.1.2-8)。


若再次手術時無內乳動脈可用,採用大隱靜脈橋時,血管橋近端吻合口,對胸骨正中切口病例一般仍選擇升主動脈上,即在原先血管橋吻合部位進行(圖6.46.1.2-9),整個移植步驟可在一次阻閉升主動脈期間完成。

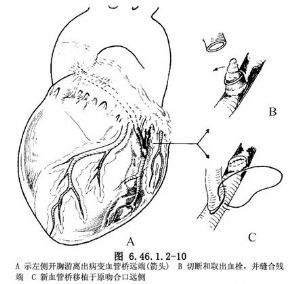
(2)迴旋支血管橋閉塞處理:若冠脈造影證實前降支無病變或前降支血管橋保持通暢,且無需處理,此時可採用左後外開胸切口。先尋找和遊離病變支遠端吻合口,及其上、下冠狀動脈和大隱靜脈血管橋,切斷病變血管橋遠端,若管腔內有血栓予以摘除。縫合並結紮原血管橋近側和遠側端,於原吻合口遠側另做迴旋支切口,與新血管橋進行端-側吻合(圖6.46.1.2-10)。
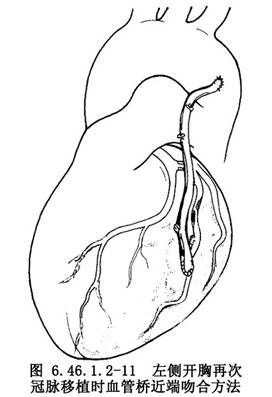
假如用左後開胸切口徑路,所移植血管橋的近端吻合口應選在降主動脈近端或左鎖骨下動脈側壁上,待復溫和心臟復跳後,下側壁鉗夾閉部分降主動脈壁,在動脈壁上打孔和進行血管橋近端的吻合(圖6.46.1.2-11)。
12 術中注意要點
再次手術中處理原先靜脈橋是一個比較複雜問題。替換靜脈橋,其決策是依據今後是否有潛在性狹窄和血管硬化性血栓形成;新血管橋質量和實用性,病人年齡,冠狀動脈解剖也影響決心。從理論上講已移植5年以上的靜脈橋應替換。因爲這類靜脈橋可能有病變,和可能由於移植物病變進行性發展而需再次手術。
關於新的內乳動脈移植到前降支和原先移植而出現狹窄的靜脈橋間的競爭血流,一般認爲並不一定引起移植物閉塞。有報道在移植術後4年22例左內乳動脈中有20例仍通暢。Nayia等分析了387例左前降支再狹窄二次手術病例,手術共分成4組觀察,發現應用內乳動脈移植到前降支,結紮老的移植物的手術病死率(7.9%),明顯高於未結紮組(2.1%);內乳動脈-前降支移植後,結紮靜脈移植物組,有19%病例顯示灌注不良,提示在這種情況下留下靜脈移植物是有益的。
在首劑心臟停搏液給予後可以結紮和切除尚保持通暢的靜脈血管橋,單純結紮尚通暢的靜脈橋的危險性是硬化栓子的脫落,掉入冠狀循環或升主動脈;結紮前切斷靜脈橋或同時逆行灌注心臟停搏液進行連續縫合,可以降低冠腦血管栓塞危險,在完成近端吻合口前,細心沖刷主動脈,可將栓子放出。假如老血管橋血流很少,又不妨礙新血管橋行徑,最好將其留下。
手術結束開放升主動脈阻閉鉗,繼續進行體外循環心臟復甦,直到體溫正常和心臟活動完全恢復。在此期間應注意及時補足失血量,徹底止血。終止體外循環,應用魚精蛋白中和肝素。再次手術中應用魚精蛋白時還應予以注意,可能出現3種不利反應:①低血壓;②過敏樣反應;③嚴重肺血管收縮。對初次手術時已有過反應病例,以及對胰島素依賴性糖尿病人使用時,更要特別小心,或從試驗劑量開始,不出現反應後再緩慢經升主動脈注射。值得指出的是二次手術病例病情一般都比較重,左室功能也較差,脫機往往是一個值得重視的問題:除應適當延長體外循環輔助灌注時間外,停機前要持續靜脈給予正性肌力藥物和血管擴張劑,經上述處理遇上或估計難以停機,應及早使用主動脈內球囊反搏或心室輔助裝置,以支持循環功能,可以提高重症病例存活率。