5 概述
在永久性心臟起搏的方法中,心內膜起搏對病人的創傷小,在局麻下即可進行,即使是心肺功能差的高齡病人或病情危重者亦能耐受。但在少數需行永久性心臟起搏的病人中由於某種原因,必須應用心肌起搏,因此從事心臟起搏的醫師必須掌握心肌起搏的技術,以備在必要的情況下有選擇第二種方法的餘地。
心肌電極起搏需要在全身麻醉或硬脊膜外麻醉下進行,手術創傷較大,但電極應固定穩妥可靠,無電極移位的併發症。心肌起搏的併發症多爲開胸及心包切開的併發症。
8 手術步驟
目前常用的埋植心肌電極的手術徑路有左側胸部前切口及經劍突胸骨胸膜外切口。若在心臟直視手術後埋植心肌電極,則仍利用胸骨正中切口。
8.1 1.左前胸切口
病人仰臥位,左肩背稍墊高約30°,經左側第5肋間開胸。一般不需切斷第5助軟骨。顯露心包後,在左側膈神經前方2cm處縱行切開心包長約5cm,仔細止血並用縫線固定,顯露出左心室心尖部。在左冠狀動脈前降支及迴旋支之間的部位選擇無脂肪及無血管區埋植心肌電極。在縫合電極前必須進行起搏閾值及各種電參數的測試。閾值的測定用特製的針狀電極刺入心肌內。起搏閾值應在1V或2mA以下,R波幅度應<4mV,心肌阻抗在500~1200Ω之間。若不符合上述標準應另行尋找符合要求的心肌部位。
一般常用的有2種心肌電極,即柱狀心肌電極(圖6.56.2.1.3-1)及不需縫合的螺旋形電極(圖6.56.2.1.3-2)。柱狀電極由鉑銥合金(10%鉑90%銥)製成,面積爲12mm2,電極進入心肌的深度爲3.5~5.0mm。柱狀電極的硅膠帽上有4個小孔,作爲縫合固定之用。
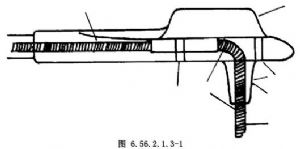

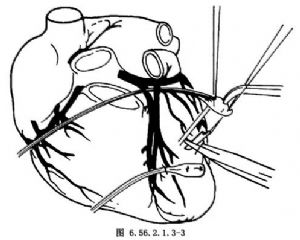
柱狀電極埋植法;選擇好左心室無脂肪無血管區,先用兩根細絲線穿過心肌電極硅膠帽上的兩個小孔縫合心肌。縫線再由另外兩個小孔引出做褥式縫合,但暫不結紮。用尖刀片在將要埋植電極的心肌上刺一小口,深約3mm,然後將柱狀電極插入心肌切口中,結紮褥式縫合的縫合線,電極即可固定在心肌內(圖6.56.2.1.3-3)。在膈神經後方的心包上做心包引流,間斷縫合心包切口。將導線固定在心包上,但切勿過緊。置胸腔引流管接水封瓶。將胸腔內的電極導線經心包切口及皮下遂道引至左下腹部,並在該部做皮下囊袋埋植起搏器。最後依次縫合胸部切口。
螺旋形電極埋植法:螺旋形電極的優點是不必在心肌上做切口,也不要縫合,因此使用方便,更適用於經劍突胸骨胸膜外切口。目前常用的螺旋形電極有美國Medtronic公司生產的6917及6917A型及美國C.P.I公司生產的4312及4313型電極。此種電極均系鉑銥合金(10%鉑,90%銥)製成。6917型心肌電極爲三轉螺旋,高度爲6mm,電極面積爲12mm2適合用於壁厚的左心室起搏。6917A型爲二轉螺旋,高度爲3.5mm,適用於壁較薄的右心室起搏。
經開胸方法埋植螺旋電極後的心包處理方法與埋植柱狀心肌電極相同。
8.2 2.經劍突及經劍突胸骨胸膜外切口
經劍突胸膜外切口及劍突胸骨胸膜外切口埋植螺旋形心肌電極具有手術創傷小又能達到穩妥固定電極的優點,因此近年來已成爲埋植心肌電極的主要徑路(圖6.56.2.1.3-4)。只將劍突切除而不切除胸骨下端時叫做經劍突胸膜外徑路。爲了更好的顯露心包,除切除劍突外還須咬除少許胸骨下端骨組織,叫做經劍突胸骨胸膜外徑路。

上述兩種切口只限於埋植無縫線螺旋形電極,所顯露的心臟部位爲右心室。
手術可在局麻,或硬脊膜外麻醉及全麻下進行。仰臥位,於下胸椎及腰部墊枕使胸肋角向前上方凸出。皮膚切口以劍突爲中點向上5cm達胸骨下1/3,向下約7~8cm達上腹部。腹部切口部分切開白線達腹膜外,注意勿切開腹膜,若誤將腹膜切開須用細絲線仔細縫合。在腹白線之頂端遊離劍突,並將附着在劍突上的肌纖維充分遊離,用Kocher鉗將劍突提起,將劍突用電刀切除。用示指或大彎鉗伸向胸骨後遊離胸骨與心包間的疏鬆組織,同時用紗布球將膈肌推向下方。徹底切除劍突是顯露良好的手術野的關鍵。用大拉鉤將膈肌拉向下方即顯露出心包,若心包顯露不滿意時,可將胸骨下端咬除1~1.5cm,即可獲得滿意的顯露。當將膈肌向下方牽拉時,同時用兩把拉鉤將兩側肋緣向上方牽拉,則心包顯露得更加滿意,遊離縱隔後組織時注意勿損傷兩側胸膜。
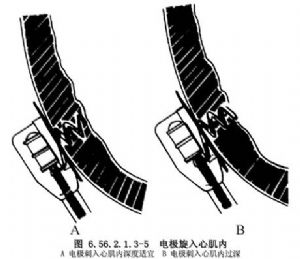
心包充分顯露後遊離心包外的脂肪,使心包的纖維膜露出,並縫牽引線提起心包。在被提起的心包上做直的或倒Y形切口,切口邊緣用細絲線固定及仔細止血。用拉鉤伸入到心包切口內並向上提即顯露出右心室前壁及部分膈面。選擇右心室壁無脂肪及無血管區將螺旋電極旋入心肌內(圖6.56.2.1.3-5)。在旋入心肌電極前也必須測定起搏閾值及各種電參數,右心室心肌電極起搏較左心室起搏稍高,R波幅度較左心室稍低,但長期起搏還是滿意的。
電極固定後間斷縫合心包切口,並將導線固定在心包切口的邊緣上。心包內置硅膠引流管接水封瓶。依次縫合切口。手術後24h拔除引流管。
經劍突切口埋植心肌電極後除少數病例可能有心包摩擦音及少量心包積液外無其他併發症,而一般小量心包積液無需處理,待其自然吸收。
無論是柱狀或螺旋狀心肌電極的埋植,必須選擇心肌的無脂肪及無血管區域。電極若埋植在脂肪內是難以起搏的,而刺傷冠狀血管的分支也會招致出血。應用旋入式電極時,必須在心動週期的收縮期旋入,持具要與心肌保持直角,否則電極不易固定且易於撕裂心肌引起出血。
由於右心室壁較左心室壁薄,因此在旋入電極時勿超過3~3.5mm,過深則易於造成心肌撕裂或出血。在旋入電極時可能出現短暫室速,因此應嚴密監測心電圖改變。必要時可靜脈內滴入利多卡因以減輕心肌的激惹性。
心肌起搏的最大優點是電極固定穩妥,脫位的可能性極小。應用經劍突胸膜外進路,對病人創傷大大少於開胸手術,因此即使是小兒亦可耐受。
心肌電極起搏後,應持續心電監護24h。全身應用抗生素3~5d。注意保持心包及胸腔引流管的通暢,一般於24~48h後拔管。
9 術中注意要點
當心內膜電極進入右室時可出現偶發的室性早搏或短暫的室性心動過速,這往往是證明電極已進入右室的標誌。當電極已穩定地定位於右室心尖部則很少出現室性心律失常。對個別的室早或短暫的室速不致引起血流動力學改變,更不致發展爲室顫,因此除嚴密監視心電示波外不必進行處理。若在試探電極進入右室時出現較頻繁的短暫室速,應中止操作並靜脈滴入利多卡因,減少心室的激惹性,以免發展爲心室顫動。
對高齡的老人,嚴重心肌缺血者及術前長時間靜脈滴入異丙基腎上腺素者進行右室插管時易於引起連續的室性心動過速甚至發展爲心室顫動,因此必須做好電擊除顫的復甦的準備。
10 術後處理
經靜脈心內膜起搏手術後,應持續心電監護48h,密切觀察起搏及感知狀況。術後當日要密切觀察切口及囊袋有無出血及血腫。無特殊情況應早期下牀活動。一般情況下需臥牀24~48h,而電極移位與下牀活動無直接關係,心房起搏可臥牀3d後下地活動。心肌電極起搏後注意胸腔或縱隔引流管的通暢,24~48h後即可拔管。
11 併發症
11.1 1.手術切口及囊袋血腫
切口及囊袋血腫的發生多爲手術中止血不徹底造成。極個別病例由於術前長時期應用有抗凝作用的藥物,而在術前未及時停用,也是造成術後出血的原因之一。於手術後當日切口疼痛劇烈,局部腫脹隆起,觸診有波動,即應考慮爲局部血腫。
局部穿刺可抽出新鮮血液。明顯的切口囊袋積血必須及時再次手術,經原切口進入囊袋,吸出所有積血塊並徹底止血,沖洗囊袋。切口可完全縫合,全身應用抗生素,預防血腫的繼發感染。
11.2 2.感染
可分爲早期及晚期感染。早期感染多發生在3d至2周內,多爲金黃色葡萄球菌所致的局部囊袋感染,若早期處理得當很少釀成全身的血行感染。局部化膿性感染,原則上應取出起搏器,在另一側胸壁重新埋植起搏器。取出之起搏器經過清洗及環氧乙乙烷消毒後仍可應用,但電極必須更換。
晚期感染多發生在手術1個月後,多由白色葡萄球菌引起,常表現爲局部囊袋自行破潰,流出白色稀薄膿汁,可無全身及局部症狀。對晚期局部感染的處理原則上亦須取出起搏器,經嚴密消毒後再重新埋植在另一側胸壁,電極需要更換。文獻中也有用保守療法控制感染成功的病例,但這要根據具體情況決定治療方針。從外科處理原則考慮,首先應除去已感染的異物,否則感染難以控制,甚至造成全身感染。
起搏器埋植後的全身血行感染是最嚴重的併發症,一般發生在於術2周後。發生全身感染的病例可能同時存在着局部囊袋的感染,但也可能局部無感染現象,而是單一的全身感染。這是由於在植入電極時向血液內帶入致病菌而引起敗血症。在處理起搏器術後的敗血症時,必須取去整個起搏系統(電極及起搏器),在強有力的抗菌治療的控制下,重新更換起搏器及電極。
11.3 3.囊袋皮膚壓迫壞死
由於囊袋過緊或老式起搏器的形狀有棱角或突起部分可壓迫皮膚壞死,繼發感染而造成起搏器的外露。其處理方法與發生感染時相同。
11.4 4.來自感知方面的併發症
(1)低感知;脈衝發生器,不能感知自身心律的R波或P波時稱爲低感知,低感知的表現爲起搏脈衝在自身心率超過按需頻率(低限頻率)時亦不受抑制,即發生起搏脈衝與自身心律的競爭現象。低感知可以是完全的不感知,即按需起搏變爲固定頻率起搏,也可能是少數自身心律未感知,而多數感知正常。發生低感知的原因多爲電極接觸的那一部分心肌的R波或P波(心房起搏時)幅度低於起搏器的靈敏度,此時可調整起搏器的感知靈敏度。
心房起搏後發生低感知的機會要多於心室起搏,因此在進行心房起搏時必須應用符合要求的SSⅠ型起搏器,而不宜用一般的心室按需型起搏器。
(2)過感知:或稱超感知,指起搏器的感知靈敏度過高,以致除心電信號以外的肌電信號也被起搏器感知而發生脈衝發放的抑制現象。這種過感知可使起搏中止而病人感到一過性頭暈。甚至暈厥現象。目前的R波抑制型起搏器設計有自動轉換爲固定頻率起搏功能,可避免發生肌電信號感知後的停搏現象。
解決肌電信號的感知可改單極心內膜起搏爲雙極心內膜起搏。若爲感知靈敏度可程控的起搏器可將感知靈敏度調低,或在起搏器外殼上套一硅膠隔離套等方法。
11.5 5.電池提前耗竭
表現爲起搏次數減少及脈寬的延長。若起搏次數或磁頻率下降4或5次/min,脈寬延長10%應作爲更換起搏器的指標。
11.6 6.來自導線和電極的起搏故障
(1)導線絕緣層破損:常發生在導線易受壓迫及磨損的部分,如鎖骨下(鎖骨下靜脈穿刺安置電極時)、頸部及導線與起搏器連接處。表現爲局部脈衝式電刺激或超感知現象(起搏抑制)。此時脈衝發放不規律,亦可能爲間斷性,應手術探查電極,證實後更換電極。
(2)導線斷裂:往往與絕緣層破損同時發生。可在X線片上發現斷裂處,臨牀上可表現爲起搏失靈,但心電圖上仍有脈衝發放的標記。也可能表現爲不規則的脈衝發放抑制現象。處理方法與導線絕緣層破損同。
(3)電極移位:多發生在術後1周內,表現爲起搏失效,但仍有規律的脈衝發放。電極移位也可表現爲閾值升高(電極與心內膜接觸不良),但感知功能仍存在,X線胸片可證實電極的移位。處理爲重新安放電極。
(4)心肌穿孔:電極尖端過硬及長時間的與心內膜衝擊可使薄壁的右心室穿孔,電極尖端突於心包內引起起搏失靈及心肌刺激現象。X線片可發現電極穿出到心包內。處理可將電極重新安置,不會因出血而引起心包填塞。
11.7 7.來自電極-心內膜界面的起搏故障
起搏閾值升高或稱“輸出阻滯”,是指起搏閾值超過起搏器的輸出能量而造成的不能使心肌除極-收縮的一種不正常現象。安置心內膜電極當時所測得的起搏閾值叫做急性閾值,一般在1.0V、0.5ms以下。急性閾值因局部炎症水腫,在術後3周左右可升高至原有的3倍或更高,以後隨着局部水腫的消失起搏閾值在4~6周後逐漸平穩,但較早期急性閾值爲高,此爲慢性起搏閾值。
若慢性起搏閾值超過起搏器的輸出能量即發生起搏失效。此時心電圖上仍有規則的脈衝發放,X線片無電極移位現象,若爲輸出能量可程控的起搏器可將脈寬或輸出電壓調高。早期的閾值升高(2周內)可靜脈滴注地塞米松類藥物可減輕電極界面的炎性反應。近年均使用的一種可緩慢釋放微量地塞米松硫酸硫酸鈉(1mg)的電極可減少局部的炎症反應,對輸出阻滯的發生有預防作用。
11.8 8.人工環形運動心動過速(artificial circus movement tachycardia,ACMA)
雙腔心臟起搏後除可發生一般單腔心臟起搏之併發症外尚有其特有的併發症,即人工環形運動心動過速或稱起搏器爲媒介的心動過速(pacemaker mediated tachycardia,PMT),其典型症狀爲與起搏上限頻率一致的陣發性心動過速。此種心動過速發生的機制爲:①自身傳導系統內存在逆行A-V傳導:②所用的起搏器必須有心房感知及心室觸發功能:如心房同步心室起搏(VAT),心房同步心室抑制起搏(VDD)及全自動型起搏(DDD);③逆行傳入心房的P波必須在心室後心房反拗期以外。傳導可經過心臟的正常傳導系統,亦可經過附加的傳導徑路。
在人工環形運動的環中,自身的傳導系統成爲逆行傳導支,而心房電極,具有感知及觸發功能的起搏器及心室電極則成爲環的前向傳導支,因此也可說在應用DDD起搏時,等於人工地在心臟上安置了一個附加傳導系統。逆行傳導時間爲100~400ms。傳導速度越慢,越容易發生環形運動心動過速。
由於逆行傳導的存在是發生這種折返性心動過速的重要原因之一,因此在進行DDD起搏時必須檢測有無逆行傳導及其時間。若存在有逆行傳導可將心房反拗期程接到較逆行傳導時間長15~25ms。若使用的起搏器不能程控心房反拗期則最好不用DDD起搏而改用房室順序(DVI)起搏。必須指出,逆行房室傳導受許多因素的影響,而且可以是間斷性的,因此即使在進行臨牀電生理檢查時未證實有逆行傳導,但亦不能排除日後發生人工環形運動心動過速的可能性。
延長心室起搏及感知後的心房反拗期是預防DDD起搏時發生人工環形運動心動過速的一個有效措施。目前的DDD起搏器,其心房反拗期可程控到400ms,而絕大多數逆行傳導時間在300ms以內,因此可有效地防止此類心動過速的發生。降低起搏上限頻率也是預防心動過速的方法之一,但減低上限頻率及延長心房反拗期都會使心房同步次數減少,這又不利於發揮生理性心臟起搏的優點。
一旦證實爲人工環形運動心動過速可先試用藥物治療如胺碘酮,而且亦有預防作用。大多數DDD起搏時的人工環形運動心動過速是由於一個室性早搏引起的,因此預防早搏的發生亦是預防環形運動心動過速的一個措施。若應用藥物不能控制此類心動過速的發生可將DDD方式起搏程控爲DVI或VVI方式起搏,心動過速可被有效的制止。