1 拼音
yào pǐn diàn zǐ jiān guǎn jì shù zhǐ dǎo yì jiàn
《藥品電子監管技術指導意見》由國家食品藥品監督管理局於2010年12月24日國食藥監辦[2010]489號發佈。
2 一、藥品電子監管工作的基本要求
(一)按照全面規劃、分佈實施、逐步推進原則,分類分批對藥品實施電子監管。
(二)根據《關於實施藥品電子監管工作有關問題的通知》(國食藥監辦〔2008〕165號)、《關於基本藥物進行全品種電子監管工作的通知》(國食藥監辦〔2010〕194號)和《關於保障藥品電子監管網運行管理事項的通知》(國食藥監辦〔2008〕585號)要求,相關企業按照規定時間辦理中國藥品電子監管網入網手續,申請數字證書,對納入藥品電子監管的藥品必須在上市產品最小銷售包裝上加印(貼)統一標識的藥品電子監管碼(以下簡稱監管碼),配備相應條碼掃描設備,並按規定在中國藥品電子監管網系統核注覈銷藥品生產、經營相關數據。
(三)藥品生產企業可按照《關於實施藥品電子監管工作有關問題的補充通知》(食藥監辦〔2008〕153號)中的《藥品電子監管碼印刷規範》,根據實際情況自由選擇噴、貼、打印等賦碼方式。
(四)藥品生產、經營批發企業實施藥品電子監管工作時,應根據實際情況,綜合考量自身的規模、財力和企業資源計劃(ERP)系統現狀,設計好技術改造方案,因地制宜、實事求是地自由選擇合適的、可信賴的系統集成商,或者自主進行生產線改造以及購置相關硬件設備。國家食品藥品監督管理局已公佈中國藥品電子監管網相關接口標準,並開通了系統集成商測試服務,具體參見《關於做好基本藥物全品種電子監管實施工作的通知》(國食藥監辦〔2010〕237號)、《關於開通藥品電子監管系統集成商測試服務的通知》(食藥監辦函〔2010〕465號)。
(五)爲方便國家局和各省局日常監管工作的開展,中國藥品電子監管網可將系統中藥品相關監管信息與各省級藥品監管網絡系統進行數據共享,具體方案參見《關於進一步推進藥品電子監管工作實現監管數據共享的通知》(食藥監辦函〔2009〕214號)。由於各省級藥品監管網絡系統的多樣性,請省局向國家局提出具體需求,共同商討數據交換方案。
(六)爲方便用戶使用,中國藥品電子監管網根據實際運行情況,不斷升級完善,監管部門及藥品生產、經營批發企業用戶要及時關注系統的升級情況。
(七)藥品生產、經營批發企業在實施藥品電子監管工作中,政策解釋、藥品註冊等問題可諮詢國家局;系統操作、技術難點等可諮詢中國藥品電子監管網技術部門。
3 二、監管部門操作指南
(一)藥品電子監管網入網操作
1. 申請入網流程
監管用戶申請入網,由各省局、地市局、區縣局填寫紙質和電子《監管部門入網登記表》,交省局彙總後統一發送中信二十一世紀運營中心進行辦理(見附件1)。
2.爲企業代付數字證書費用操作流程
按國家局相關文件要求執行。
3.數字證書續費流程
監管用戶數字證書服務費用爲300元/把/年。自數字證書派發之日起,在1年內爲有效期。自有效期到期日起逾期2個月未繳納服務費,中國藥品電子監管網將凍結數字證書。各級食品藥品監管部門需按時辦理數字證書續費手續。各級已入網食品藥品監管部門需要新增中國藥品電子監管網的使用人,可辦理新增數字證書;在使用的數字證書發生丟失時,使用者需儘快辦理數字證書掛失、補辦手續,註銷原數字證書並領取新數字證書;數字證書發生損毀時,使用者需儘快辦理數字證書報損手續,進行證書的維修;數字證書損壞嚴重已無法維修,需辦理數字證書補辦手續(見附件1)。
1. 維護藥品字典
藥品字典是中國藥品電子監管網運行的基礎數據,由國家局負責進行維護,包括新增、修改、刪除等;省局、地市局和區縣局只可進行查詢操作。
2. 維護藥品批准文號信息
批准文號信息是生產企業生產所需的基礎數據,由國家局用戶負責爲入網的生產企業維護,包括企業名稱、藥品通用名、劑型、規格、批准文號;其他信息,包括批准文號有效期、藥品有效期、商品名稱、藥品包裝規格等,由企業用戶自行補充完整;省局、地市局和區縣局用戶只可進行查詢操作。
(三)企業基本信息管理(省級局)
1. 審覈企業入網申請
企業在線提交入網申請後,各省局用戶需對其所轄範圍內企業的入網申請進行審覈,地市局和區縣局用戶只能查詢其所轄範圍內企業入網申請的審覈情況。
2. 審覈企業變更名稱申請
企業可通過企業客戶端申請進行企業名稱變更,該變更申請需省局進行審覈,審覈通過後方可生效。各省局用戶負責企業名稱變更申請審覈,地市局和區縣局用戶只能查詢企業名稱變更申請的審覈情況。
3. 查看企業基本信息
食品藥品監管部門可對其所轄範圍內企業的基本信息進行查詢,包括企業的入網信息、用戶信息以及《藥品生產質量管理規範》(GMP)和《藥品經營質量管理規範》(GSP)證書信息等。
(四)食品藥品監管部門內部基本情況統計
通過 【監管網實施情況統計】 功能的“中國藥品電子監管網監管用戶登錄情況統計報表”,查看區域內已經入網食品藥品監管部門配備的數字證書的數量、編號、登錄次數、入網時間、距離末次的登錄時間等信息。
(五)生產環節監管
1. 監管轄區內藥品生產情況
(1) 查看生產企業入網後,監管碼申請、下載、激活的情況
通過【監管網的實施情況統計】功能的“企業在電子監管網使用情況統計表”,監管用戶可查詢本轄區內所有生產企業的監管碼申請、下載、激活及使用情況,並可導出電子表格(Excel)文件。
(2) 查看生產企業某藥品的生產、銷售、庫存統計報表
通過 【企業生產經營狀態統計】功能的“企業產銷存統計表”,監管用戶可按月份查詢本轄區內生產企業的藥品產銷存數據,並可導出Excel文件。
通過【企業生產經營狀態統計】功能的“藥品流向統計”,監管用戶可查詢轄區內藥品從生產到流通的情況,包括藥品的註冊信息、監管碼使用信息、生產信息、庫存信息、末端單位的收貨信息等,並可分別導出Excel文件。
(4) 查看已採購入網藥品的未入網企業信息
被已入網企業添加爲往來單位並作爲收發貨單位的未入網企業,即已採購或銷售入網藥品的未入網企業,在監管網系統中,統稱爲“末端單位”。通過【企業生產經營狀態統計】功能的“末端單位的收貨信息統計”,可查詢所轄區內末端單位的藥品流通信息。
(5) 查看生產企業某批次藥品的流向
通過【藥品流向查詢】功能,根據藥品信息或產品批次號,監管部門可查詢所轄區內生產企業某批次藥品的流向信息,或者經營批發企業庫存的某批次藥品的流向信息。
(6) 查看某單盒藥品的流向信息
通過【碼流向查詢】功能,監管用戶可根據藥品外包裝上的監管碼,查詢該藥品的基本信息、生產流通信息、庫存信息以及該碼的關聯關係信息。
2. 進行藥品召回
通過【藥品召回】功能,國家局在作出責令召回決定後,可在監管網發起責令召回。各級食品藥品監管部門可通過監管網確定被召回藥品是否在所轄範圍內,並可查詢已召回藥品的召回進度。召回工作完成後,國家局或省局可進行召回結束處理。
3. 特殊藥品生產管理
(1) 特殊藥品的計劃管理
通過【計劃管理】功能,國家局可進行麻醉藥品、第一類精神藥品生產和收購計劃的管理,從而對麻醉藥品、第一類精神藥品的生產企業進行產量跟蹤和控制。該功能包括計劃的錄入、計劃年度的定義等。
(2) 查看特殊藥品定點生產企業的計劃執行情況
通過【企業執行進度查詢】功能,監管用戶可定期查詢所轄區域定點生產企業特殊藥品實際生產數量與計劃數量的年度和月度對比情況。
(3) 特殊藥品生產報表
【國家局特藥報表】功能給出了多種麻醉藥品生產情況統計報表,用於監管用戶分類別統計麻醉藥品、第一類精神藥品和第二類精神藥品的生產、銷售情況。
(六)流通環節監管
1. 查看轄區內藥品流通、庫存情況
如需查看區域內藥品流通信息,可使用 【藥品流向查詢】 功能,通過某一品種藥品的詳細信息查詢該品種在轄區內的流通流向信息。
如需查看轄區內某批次或某品種藥品的庫存情況,可使用 【藥品流向統計】功能,查看指定日期所轄範圍內,藥品的生產、庫存、碼使用量等信息。
3. 查看某批次藥品的轄區內流向
如需查看區域內藥品流通信息,可使用 【藥品流向查詢】 功能,通過某一品種藥品的詳細信息,查詢轄區內該品種從生產企業、流通企業到使用單位環節的流向信息。
4. 查看某企業藥品的購銷存情況
如需查看某企業藥品的購銷存情況,可使用【企業產銷存統計表】功能,查看轄區內某企業藥品在指定月份的入、出庫及庫存情況。
如需查看某藥品末端單位的進貨情況,可使用【末端單位的收貨信息統計】功能,查看轄區內某指定日期藥品使用單位(醫院、藥店)的進貨情況。
6. 特殊藥品批發企業管理
(1) 特殊藥品經營報表
【國家局特藥報表】功能給出了多種麻醉藥品經營情況統計報表,用於監管用戶分類別統計麻醉藥品、第一類和第二類精神藥品的採購、銷售、庫存情況。
(2) 查看特殊藥品運輸信息
如需查看特殊藥品運輸信息,可使用【運輸信息管理】功能,查看所轄範圍內流通的特殊藥品運輸信息。
(七)市場稽查
1. 某抽檢藥品真僞、來源的核查
如需抽檢藥品真僞、來源,可使用抽檢藥品上所賦的監管碼通過【碼流向查詢】功能,查看該監管碼對應的藥品信息與藥品上的信息進行比對檢驗。
2. 經營批發企業某批次藥品的來源覈查
如果想覈查經營批發企業某批次藥品的來源,可使用【藥品追溯查詢】功能,查看該批次藥品從生產一直到當前經營批發企業的流經渠道。
(八)異常情況的發現和處理
1. 預警的觸發機制
(1) 超計劃生產預警
該預警僅針對麻醉藥品、第一類精神藥品生產企業生產情況進行預警。生產企業年度生產入庫總量超過批准的年度計劃生產量的5%時,將觸發預警。
(2) 超計劃購買預警
該預警僅針對麻醉藥品、第一類精神藥品全國性批發企業採購情況進行預警。全國性批發企業年度採購麻醉藥品、第一類精神藥品總量超過批准購買的年度計劃採購數量的5%時,將觸發預警。
(3) 購買數量異常增長預警
購買異常增長只針對經營麻醉藥品、第一類精神藥品的定點批發企業。系統將對定點批發企業的年度、半年度、季度、月度的麻醉藥品、第一類精神藥品進行環比、同比比較。當發現定點批發企業環比、同比數值超過預設閥值時,將觸發預警。以下預警閥值作爲默認值:
同比:季度30%、半年度50%、全年度70%;
環比:月度30%、季度50%。
(4) 批准文號已過期預警
企業上報入出庫數據中的藥品生產日期,或藥品入出庫時間超過該藥品的批准文號有效期,則觸發預警。
(5) 企業證書已過期預警
企業註冊時填寫的GMP或者GSP超過企業填寫的經營許可證等證書的有效期限,則系統觸發預警。
(6) 藥品未勾兌預警
系統定時自動勾兌發貨單位及收貨單位雙方的出入庫數據,其中一方未及時上報出入庫信息,導致單據無法勾兌,則系統觸發預警。
(7) 藥品勾兌不符預警
系統定時自動勾兌發貨單位及收貨單位雙方的出入庫數據,雙方單據內監管碼未能完全匹配,則系統觸發預警。
(8) 藥品臨近有效期預警
企業上報入出庫藥品數據的時間與藥品有效期截止日小於三個月,則系統觸發預警。
(9) 藥品已過有效期預警
企業上報入出庫藥品數據的時間小於藥品有效期截止日,則系統觸發預警。
(10) 庫存報損報溢預警
企業用戶上報的藥品報損(報溢)數量,超過該藥品的產品批號總激活量(生產入庫量)5%,則系統觸發預警。
2. 設置預警類型
各級食品藥品監管部門可根據各自承擔的監管職責,設置本級或者下級監管部門需要查看以及處理的預警類型,沒有設置的預警將不會在預警地圖上顯示。
3. 預警觸發、處理的情況統計
如需查看預警觸發和處理情況統計,監管用戶可使用【預警報表統計】功能,查看所轄範圍內各類預警的數量及處理情況。
4. 預警處理
(1) 監管用戶處理預警
預警一旦觸發後,在預警地圖中以預警紅燈的方式在相應區域展示,如該區域預警全部被處理,則紅燈關閉。關閉已觸發預警,可使用【預警處理】功能預警進行處理,監管用戶處理預警時需要說明處理結果。(此操作爲人工關閉預警方式。)
(2) 企業用戶處理預警
預警觸發後,會同時給相關預警企業發送預警消息,企業收到系統預警消息後,可根據預警消息的類型、消息提示進行數據修正或者補報。在企業進行修正後,系統根據修正情況自動關閉該預警,同時政府端預警顯示爲“已處理”,該預警無需監管用戶進行人工再次處理。(自動關閉預警功能目前僅針對批准文號已過期、企業證書已過期、未勾兌、勾兌不符類型的預警信息。特殊藥品預警、藥品臨近有效期、藥品已過期預警企業不能處理,必須由監管用戶手工處理。)
以上內容具體操作詳見附件2。
(九)數據共享
爲方便國家局和各省局日常監管工作的開展,中國藥品電子監管網可將系統中藥品相關監管信息與各省級藥品監管網絡系統進行數據共享,具體方案見《中國藥品電子監管網數據共享實施方案》(見附件3)。由於各省級藥品監管網絡系統的多樣性,請省局向國家局提出具體需求,共同商討數據交換方案。
4 三、生產企業操作指南
(一)中國藥品電子監管網入網、續費操作
1. 申請入網流程
企業申請入網前請先登錄中國藥品電子監管網(http://www. drugadmin.com),填寫《企業入網登記表》,並郵寄相關紙質材料進行審批。
企業可查看了解入網進程,方法爲:
登錄www.drugadmin.com“企業登錄入口”→輸入組織機構代碼、登錄用戶名和密碼→查看入網進程。入網進程表通過圖形展現,以顏色區分完成進度,紅色爲已完成步驟,藍色爲待完成步驟,綠色爲未完成步驟。另外,監管網會在每個入網階段發送提醒郵件至聯繫人郵箱,指導企業進行下步操作。
2.數字證書政府代付費操作流程
按照國家局相關文件要求執行。
3. 數字證書續費流程
企業用戶數字證書服務費用爲300元/把/年。自數字證書派發之日起,在1年內爲有效期。自有效期到期日起逾期2個月未繳納服務費,中國藥品電子監管網將凍結該數字證書。數字證書發生丟失時,使用者需儘快辦理數字證書掛失、補辦手續,註銷原數字證書並領取新數字證書;數字證書發生損毀時,使用者需儘快辦理數字證書報損手續,進行證書的維修;數字證書損壞嚴重已無法維修,需辦理數字證書補辦手續。
4. 數字證書註銷流程
如因各種業務原因,企業申請註銷企業數字證書時,需按以下情況操作:
註銷全部數字證書,經所屬食品藥品監管部門同意後,企業填寫本單位所有數字證書註銷申請,並加蓋所屬食品藥品監管部門公章後,提交中國藥品電子監管網運營中心進行註銷;
註銷部分數字證書,企業填寫數字證書註銷申請,並加蓋企業公章後,提交運營中心進行註銷。
5. 數字證書退費流程
如果企業數字證書註銷後,可對該證書的服務費結餘進行退費,具體可聯繫中國藥品電子監管網客服人員。
6. 監管網匯款要求和賬戶信息
用戶向監管網繳付費用時請採用公對公轉賬模式進行匯款。
以上內容具體操作詳見附件4。
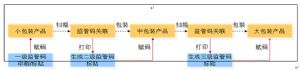
(二)生產線賦碼改造
生產企業選擇賦碼方案時,需要首先確定最小銷售包裝如何賦碼,最小銷售包裝由於體積較小,因此賦碼時需要考慮監管碼標籤的體積,粘貼的位置,印刷方式等多方面因素;其次需要考慮中包裝、外包裝監管碼標籤的樣式和印刷方式,並且在粘貼位置上需要考慮如何儘量方便流通環節的掃描。
1.最小銷售包裝賦碼
根據國家局文件要求,納入電子監管的藥品必須在上市產品最小銷售包裝上加印(貼)統一標識的藥品電子監管碼(以下簡稱監管碼)。
(1)監管碼印刷樣式
監管碼標識由20位數字、一維條形碼及提示信息組成,可根據產品包裝特點選用三種式樣進行賦碼。監管碼樣式見《關於基本藥物進行全品種電子監管工作的通知》(國食藥監辦〔2010〕194號)。
(2) 監管碼印製標準參數
印刷監管碼時,根據要求最小條碼密度爲7mils,摺合條碼寬度約爲28mm,爲提高一次掃碼成功率及掃描速度,建議使用10mils以上密度(最小模塊寬度爲10mils時,摺合條碼寬度約爲42mm)。
具體監管碼樣式見《關於基本藥物進行全品種電子監管工作的通知》(國食藥監辦〔2010〕194號)。
(3) 監管碼的印刷位置
監管碼應印製於產品包裝明顯可見之處,方便生產線掃描及建立包裝關聯關係,並應避免與商品條碼、自定義的物流碼等其它條碼印製在一起,以免誤掃。
(4) 監管碼的顏色搭配
監管碼印刷時條、空符號的顏色反差越大越好。推薦採用白色作底,黑色作條的顏色搭配。如果要在彩色背景下印製監管碼,務必要先進行打樣測試。
(5) 監管碼質量檢驗標準及判定規則
監管碼印刷需符合國家標準GB/T 14258—2003《信息技術 自動識別與數據採集技術 條碼符號印刷質量的檢驗》、GB/T 18347—2001《128條碼》。
(6) 監管碼標籤印刷方式
監管碼標籤的印刷方式主要分爲外包裝直接印刷(噴印)、貼標兩種方式。其中噴印在印刷廠內進行,適合小包裝賦碼;貼標一般爲製藥企業內部進行,適合中、大包裝賦碼。
外包裝直接印刷方式:
外包裝直接印刷指將監管碼直接印刷在藥品的外包裝上。從技術角度主要分爲數碼印刷、熱轉印、UV噴印、水性噴印,下表列出這幾種印刷方式的特性對比:
數碼印刷 | 熱轉印 | UV噴印 | 水性噴印 | |
對紙張品牌要求 | 低 | 低 | 低 | 中 |
對紙盒表面處理 | 無 | 無 | 無 | 中 |
對紙盒大小 | 有要求 | 無要求 | 無要求 | 無要求 |
對於紙盒克重 | 有要求 | 無要求 | 無要求 | 無要求 |
加工監管碼等級 | 最高 | 次高 | 中等 | 較低 |
耗材成本 | 最高 | 次高 | 中等 | 較低 |
主要缺陷 | 很少 | 速度低 | 乾燥不良 | 乾燥不良 |
耐摩擦力 | 次高 | 低 | 最高 | 較高 |
環保性能 | 不環保 | 環保 | 環保 | 環保 |
成本 | 最高 | 次高 | 中等 | 較低 |
(7) 選擇監管碼印刷企業
若委託印刷廠直接將監管碼印刷在包材上,可將下載並解密後的監管碼交與印刷廠委託印刷。在選擇印刷企業時,需注意以下幾點:
a.藥品生產企業應當對承印其監管碼標識的印刷企業進行印刷管理能力考查,對達到監管碼印刷要求的印刷企業,方可與其簽訂印刷加工合同,合同內容要對印刷質量作出明確說明。承印企業應當保證所印製的監管碼標識達到《監管碼印刷規範》中所規定的要求。
b.應強化監管碼數據安全管理意識,嚴格遵守國家有關法律、法規和部門規章的規定。承印監管碼標識的企業應是具有從事包裝裝潢印刷品印刷業務資質的企業,應建立健全承印驗證制度、承印登記制度、印刷品管理制度、印刷品交付制度、印刷殘次品銷燬制度等管理制度。承印企業應保證入網企業的監管碼數據在印刷環節中的數據安全,確保數據不外流。
c.藥品生產企業應當建立相應的印刷品、監管碼管理制度,明確規定監管碼印刷品出入庫登記及處理辦法。藥品生產企業及承印企業都要明確監管碼的保管及移交的負責人員,所有記錄應完整。
d.印刷企業應嚴格按照監管碼印刷質量要求進行印刷,並進行質量抽檢。監管碼印製過程中如出現殘次等質量問題,要及時進行殘次品的銷燬工作。
(8) 最小銷售包裝賦碼的特殊規定
經國家局研究確定,大輸液類藥品可僅在外包裝賦碼,無需在袋(瓶)上加印(貼)監管碼。
其他包裝過小、異形包裝藥品按照國家局有關規定執行。
2.藥品中包裝、外包裝賦碼
中包裝、外包裝的賦碼一般採用貼標或高解像噴碼機兩種方式完成。貼標方式即購買已經制作完的標籤(印刷廠),再通過手工、自動貼標賦碼;或者自購工業級條碼打印機自行打印監管碼標籤,再通過手工、自動貼標賦碼。高解像噴碼機方式即在包裝生產線上架設高解像噴碼機,使之與賦碼系統相聯,在中、外包裝完成後直接在線噴印監管碼。在線噴碼一般用在自動化程度比較高的包裝生產線,設定好以後一般不需要人工進行干預。
3.監管碼各級包裝的賦碼要求
(1) 監管碼賦碼操作要確保一件一碼。
(2) 藥品的最小銷售包裝及各級銷售包裝上必須賦碼(另有規定的除外),並且建立各級包裝上監管碼的對應關係。
(3) 建議藥品最小銷售單元包裝數量和上一層級包裝數量的比例關係不超過20:1。
(4) 監管碼標籤的粘貼位置要醒目,不得覆蓋藥品包裝上的商標、藥品名稱、批准文號、生產日期、生產批號、有效期等藥品說明關鍵信息,且不得與國家對藥品包裝的各項法律法規的要求相牴觸。
(5) 藥品最大包裝賦監管碼時,要將同一監管碼標籤打印至少兩份,並分別水平粘貼在外包裝的兩個相互垂直的平面上,以方便產品堆放時的掃描作業。監管碼標籤最好在外箱上的產品批號附近粘貼,方便信息管理。同時爲避免監管碼太靠底邊無法識別,建議保持監管碼底部與箱底邊保證最小30mm的距離。見圖示:
(6) 爲使藥品最大包裝監管碼便於物流企業使用,建議外包裝的條碼精度至少爲10mils 或0.25mm。
4.生產線改造
(1) 關於企業生產線改造的政策支持和要求
對於生產線改造:
a.國家局政府網站、中國藥品電子監管網已公開《中國藥品電子監管網接口標準》(見附件5)。藥品生產企業或者系統集成商都可按照此公開的接口標準進行系統開發、實施及測試工作。具體見《關於做好基本藥物全品種電子監管實施工作的通知》(國食藥監辦〔2010〕237號)。
b.藥品生產、經營批發企業實施藥品電子監管工作時,應根據實際情況,綜合考量自身的規模、財力和企業自身的ERP系統現狀,設計好技術改造方案,因地制宜、實事求是地自由選擇合適並可信賴的系統集成商或者自主進行生產線改造以及購置相關硬件設備。
c.爲方便生產企業選擇系統集成商,保障藥品生產企業能夠按照國家局的總體部署和相關文件要求完成實施工作,中國藥品電子監管網開通系統集成商測試服務。具體見《關於開通藥品電子監管系統集成商測試服務的通知》(食藥監辦函〔2010〕465號)。
(2) 系統集成商的職責
系統集成商從類型上分爲兩類:生產線賦碼系統集成商、手持終端系統集成商。
生產線賦碼關聯系統集成商:爲藥品生產企業提供並實施符合監管網接口標準的生產線賦碼關聯方案及軟硬件系統。
手持終端系統集成商:爲藥品生產和經營批發企業提供並實施符合監管網接口標準的入出庫核注覈銷設備及軟件。
企業在選擇生產線系統集成商實施藥品電子監管工作時,需注意以下幾點:
a.系統集成商是否具有基於監管碼的藥品生產線賦碼關聯系統的設計實施能力和經驗。按照《關於開通藥品電子監管系統集成商測試服務的通知》(食藥監辦函〔2010〕465號)文件要求,中國藥品電子監管網及時在國家局政府網站和中國藥品電子監管網網站公佈通過測試的系統集成商名單供生產企業參考。
b.系統集成商的方案及產品是否成熟,是否與企業的生產要求和生產條件相匹配。企業應選擇易使用、易維護、可擴展的集成商系統方案,而不要選擇僅僅只能滿足當前要求的系統方案。避免因企業生產要求和生產條件的變化而產生後繼問題。
c.儘量瞭解系統集成商已有企業客戶的使用情況,以及客戶口碑。爭取前往使用類似方案和系統的企業參觀,聽取同行用戶的使用心得和建議,客觀瞭解系統集成商的真實情況。
d.注重系統集成商的售後服務和承諾。避免因系統集成商的服務不到位,導致企業將面臨嚴重而無法解決的問題。
(4) 生產線賦碼關聯系統方案的基本要求
生產線賦碼關聯系統的總體需求可概括爲:掃描記錄藥品各級包裝上的監管碼,並且建立它們之間的對應關係。
下面的圖例分別示意賦碼關聯系統的基本架構和基本業務流程。

生產線賦碼關聯系統基本架構示意圖
生產線賦碼關聯系統基本業務流程示意圖
生產線賦碼關聯系統的總體需求可概括爲:掃描記錄藥品各級包裝上的監管碼,並且建立它們之間的對應關係。
由於企業的生產包裝環節需要進行一系列與產品相關的生產設置、記錄、調整等。因此,對於生產線賦碼關聯系統的軟件功能需要同時考慮到企業的生產條件和生產要求,系統的可靠性和穩定性必須在功能要求中有所體現。
功能要求:
序號 | 功能說明 |
1 | |
2 | 軟件系統應提供主流的採集、打印、顯示等設備通訊、控制及數據處理功能。 軟件應當支持在生產過程中通過硬件控制對產品進行賦碼,以批次爲單位對產品小包裝、中包裝、大包裝建立唯一且準確的監管碼包裝關聯關係,實現對每件產品的信息流地在線控制。軟件系統應當支持異地分佈數據集中處理。 |
3 | |
4 | 軟件應當支持在線打印監管碼標識,可根據用戶要求進行設置調整。 |
5 | |
6 | 軟件應當具備監管碼的集中管理功能,包含監管碼的下載、分配(供應商的權限)、印刷管理、驗收、入庫、銷售出庫、上傳等各流程的閉環化管理。對企業已生產完成並完成上傳中國藥品電子監管網的監碼數據,還應提供數據的歸檔和備份等功能 |
7 | 軟件應當支持按照包裝批次創建生產任務,根據要求可設置相應參數。執行生產任務時可在現場控制電腦上顯示出每個工位的實時包裝數量等信息,可按照分流數量設置並控制每箱中包裝分料操作。 |
8 | |
9 | 軟件應當提供系統診斷功能,方便診斷系統錯誤。外部條件導致系統中斷情況下(比如斷電),系統能自動修復錯誤並快速恢復生產任務。 |
10 | |
11 |
性能要求:
序號 | 功能說明 |
1 | 軟件主體應當方便系統的維護、服務和升級,同時方便用戶的使用和管理。生產線賦碼系統應保持生產線賦碼關聯操作的獨立性、穩定性、連續性、規範性。 |
2 | 系統應當同時支持SQL Server、Oracle等主流數據庫,應當充分考慮生產模式下多條生產線並存時,大批量數據的處理和存儲能力。 |
3 | 軟件應當確保生產關聯操作的準確性、數據存儲的及時性、可靠性。 |
4 | |
5 |
(6) 常見硬件列表
生產線賦碼關聯系統可分爲自動線、半自動線和手工線,分別需要使用不同的硬件設備支持系統的基本功能實現。
下表列出當前市場常見的一些硬件類型供參考:
序號 | 設備類別 | 設備名稱 | 常見品牌 |
1 | 掃描設備 | 手持式掃碼器 | Datalogic、Motorola等 |
2 | 固定式掃碼器 | Cognex、Microscan、Datalogic等 | |
3 | 平臺式掃碼器 | Datalogic、Motorola等 | |
4 | 打印設備 | 條碼打印機 | Zebra、Intermec、Tsc等 |
5 | 貼標設備 | 即印即貼貼標機 | 艾利、三拓、達爾嘉等 |
6 | 普通貼標機 | 艾利、三拓、達爾嘉等 | |
7 | 工業電腦 | 控制一體機 | 研華、西門子等 |
8 | 普通工控機 | 研華、西門子等 | |
9 | 控制機 | PLC控制櫃 | 各集成商提供 |
10 | 賦碼平臺 | 手動賦碼平臺 | 各集成商提供 |
11 | 自動線賦碼平臺 | 各集成商提供 |
5. 聯調測試
爲保證生產企業數據上傳的正確性,企業改造或升級完成後,需與中國藥品電子監管網進行聯調測試。測試依據爲中國藥品電子監管網、國家局政府網站公佈的《中國藥品電子監管網接口標準》(見附件5)。在聯調測試通過後,企業方可正式進入中國藥品電子監管網企業端平臺進行正式的監管碼申請,數據上報。
企業與中國藥品電子監管網進行聯調測試流程如下:
(1) 打開中國藥品電子監管網(http://www.drugadmin.com),選擇“生產線接口測試通道”,使用數字證書、企業用戶名、密碼登錄。
(2) 進入後,下載測試流程、測試要點、測試報告模板、測試報告樣例、測試用的企業客戶端。
(3) 熟悉和了解測試流程、測試要點,並安裝測試用的客戶端。
(4) 根據測試流程、測試要點及步驟的提醒進行相關聯調測試工作,完成測試報告。
(5) 再次進入 “生產線接口測試通道,點擊“提交測試報告”,填寫基本信息,將測試中使用的關聯關係文件和入出庫文件打包成一個文件上傳;將測試報告上傳(如有多份測試報告,打包成一個文件上傳)。
(6) 等待中國藥品電子監管網測試審批結果。
(7) 中國藥品電子監管網審覈測試通過後,企業可進入中國藥品電子監管網企業端正式平臺進行監管碼數據申請和填報工作。
6.首次生產流程
在進行藥品生產之前,企業用戶需要確認本企業在中國藥品電子監管網系統中是否已被分配藥品信息。如果檢查藥品目錄後,發現藥品目錄中缺少本企業要生產的入網藥品,或被分配的藥品信息有誤,需及時與中國藥品電子監管網運營中心聯繫。
企業藥品目錄中初次分配的藥品信息只含有藥品通用名、劑型、製劑規格等基本資料,不含藥品的包裝信息。需企業在申請監管碼之前,補充完善藥品的包裝信息。
(3) 申請、下載、解密監管碼
如果需要獲得監管碼,須在企業客戶端中提出監管碼申請,選擇需申請監管碼的藥品通用名、劑型、規則、包裝規格(從企業藥品目錄中選擇),並輸入包裝比例、申請數量等信息。企業申請成功後,在正常情況下,中國藥品電子監管網能及時爲企業生成監管碼。生成後,企業可進行監管碼文件的下載以及解密。企業如需使用監管碼本地生成功能,需配備監管碼安全管理器。
藥品目錄維護完整以後,中國藥品電子監管網系統可將藥品目錄信息導出爲.XML格式的文件(文件格式見附件5),用於企業生產線賦碼系統使用。
(5)建立並生成關聯關係文件
在每批次藥品生產結束後,生產線賦碼系統會生成該批次的關聯關係文件。文件中記錄了本批次所用監管碼數據,以及生產日期、生產批號等信息。生成的關聯關係文件爲.XML格式的文件。
關聯關係文件接口定義見《中國藥品電子監管網接口標準》(附件5)。
(6) 關聯關係文件上傳
生產企業在本次生產結束後,需要將賦碼系統生成關聯關係文件通過企業客戶端上傳。上傳時間建議在藥品抽檢或者批簽發合格後再上傳。
(7) 首次上傳時異常情況解決方法
在首次生產並上傳關聯關係文件時,可能出現的幾種情況及解決方法如下:
a.已將關聯關係文件拷貝至客戶端安裝計算機,此時點擊“關聯關係上傳”頁面的“查詢”按鈕後,提示無查詢結果。
解決辦法:該情況有兩種可能:
關聯關係文件沒有放置在正確的文件夾下。關聯關係文件應存放在企業客戶端指定的關聯關係文件導入目錄下,該目錄由企業用戶自行設置。
關聯關係文件解析錯誤。可將該頁面的查詢條件中“解析狀態”修改爲“解析失敗”,重新查詢。如果結果行爲高亮紅色顯示,表示解析失敗,雙擊結果即可查看失敗原因。
b.上傳的關聯關係文件顯示爲高亮紅色,無法上傳
解決辦法:如果結果行爲高亮紅色顯示,表示該文件系統解析失敗。鼠標左鍵雙擊結果行即可查看解析失敗原因,根據失敗原因修改關聯關係文件重新解析即可。如果失敗原因是生產線賦碼系統生成的關聯關係文件不符合《中國藥品電子監管網接口標準》(附件5)要求,請聯繫生產線系統集成商協助解決問題。
c.關聯關係文件已經顯示解析成功,但是查詢該批次的監管碼並未激活
解決辦法:關聯關係文件上傳分爲三個步驟:解析操作,企業用戶將關聯關係文件存放在關聯關係導入目錄下,點擊企業客戶端的關聯關係上傳頁面的“查詢”按鈕,進行解析操作;上傳操作,解析成功後,企業用戶點擊頁面“上傳”按鈕,進行上傳操作;系統處理,上傳成功後,監管網系統對關聯關係文件進行系統處理,覈對文件中的藥品信息、包裝信息、生產信息以及監管碼信息。以上三個操作都處理成功,監管碼才被激活。
d.解密後的監管碼文件哪些是最小銷售包裝的監管碼
解決辦法:下載解密後的監管碼文件數量根據藥品類型分爲三種情況:
麻醉藥品、第一類和第二類精神藥品——爲2個.txt格式的監管碼文件,一個是含最小銷售包裝的監管碼文件,另一個是含所有外包裝的監管碼文件,即外包裝的監管碼可混用。
血液製品、疫苗、中藥注射劑——爲1個.txt格式的監管碼文件,所有包裝級別的監管碼都在一個文件中給出,即各包裝級別的監管碼可混用。
基本藥物——根據包裝級別數量分別給出各級監管碼文件,即N級包裝就有N個.txt格式的監管碼文件,各級監管碼不能混用。
在印刷和賦碼時,根據監管碼文件對應的包裝級別在包裝上進行賦碼。
7.日常生產流程
(1) 申請、下載、解密監管碼;建立並生成關聯關係文件;關聯關係文件上傳的具體操作同“三(二)6.(5)”。
(2)修改批號、生產日期等藥品生產數據
企業在激活監管碼後,如發現關聯關係中某些信息(生產日期、產品批號等)不正確,可進行相應修改。
(3) 導入賦碼系統的監管碼無法識別
生產線賦碼系統不能識別生產線上掃描出的監管碼,說明企業用戶沒有及時從企業客戶端導出最新的藥品信息文件至賦碼系統中,賦碼系統無法尋找監管碼對應的藥品信息及包裝信息。出現此情況,企業用戶在企業客戶端導出最新的藥品信息文件,再將文件導入生產線賦碼系統中即可。
(4) 委託生產企業,如何上傳數據
委託生產情況,可由企業根據具體情況採用如下任何一種方式進行操作,國家局不做具體限定。
a.企業A申請數字證書,企業B生產完成後,將生產數據傳給企業A,企業A進行數據上傳操作。
b.企業A申請數據證書,將數字證書一同委託給企業B,企業B生產完成後,使用企業A的數字證書上傳生產數據。
無論哪種上傳方式,企業A必須申請數字證書,即誰註冊的藥品誰負責上報生產信息。
(5)既屬於四大類藥又屬於基本目錄藥品,統一按照四大類藥品進行管理。
(三)配備條碼掃描終端
企業在進行賦碼藥品的入出庫時,必須記錄賦碼藥品外包裝上的監管碼,形成入出庫記錄並上報電子監管網。條碼掃描終端就是用於記錄監管碼的硬件設備。企業至少配備或者改造一把條碼掃描終端,用於掃描入出庫藥品的監管碼。
1.通用條碼掃描終端的軟硬件要求
(1) 掃描終端的硬件指標要求
監管碼掃描終端可選擇各家設備供應商的產品,硬件上應當滿足下面的業務要求。
a.數據採集器的掃描引擎爲激光掃描引擎,且掃描景深儘量大(掃描中等密度條碼不低於30cm)。
b.要求硬件設備可靠、穩定、堅固、耐用,建議滿足IP54以上工業等級。
c.存儲容量儘量大,斷電不丟失數據和應用程序。
d.掃描終端硬件顯示屏爲帶背光液晶顯示。
監管碼掃描終端的總體需求可概括爲:在藥品的出入庫、批發銷售等流通過程中,通過監管碼掃描終端掃描藥品外包裝上的監管碼,將藥品各流通環節的物流信息準確地記錄下來,滿足藥品生產和經營批發企業入庫核注、出庫覈銷和數據通訊的要求。
監管碼掃描終端上開發的軟件必須符合《中國藥品電子監管網接口標準》(附件5)。
功能點 | 生產企業 | 運營企業 | 使用單位 | 第三方物流 |
用戶登錄 | √ | √ | √ | √ |
通訊參數設置 | √ | √ | √ | √ |
系統時間設置 | √ | √ | √ | √ |
操作員數據下載 | √ | √ | √ | √ |
往來單位列表下載 | √ | √ | √ | |
生產入庫 | √ | √ | ||
退貨入庫 | √ | √ | √ | |
採購入庫 | √ | √ | √ | √ |
調撥入庫 | √ | √ | √ | √ |
銷售出庫 | √ | √ | √ | |
退貨出庫 | √ | √ | √ | √ |
抽檢出庫 | √ | √ | √ | √ |
調撥出庫 | √ | √ | √ | √ |
銷燬出庫 | √ | √ | √ | √ |
業務數據上傳 | √ | √ | √ | √ |
關聯關係數據上傳 | √ | √ | ||
委託客戶列表下載 | √ | |||
委託客戶設置 | √ |
2. 無線上傳條碼掃描終端的軟硬件要求
如企業用戶希望使用無線條碼掃描終端,進行監管碼的掃描和上傳,則上傳條碼掃描終端除滿足上述軟硬件要求外,還應滿足如下條件:
(1) 硬件要求:支持GPRS或者802.11局域無線通訊。
(2) 軟件要求:
a.無線上傳的功能要求,即掃描終端在監管碼採集完成後直接生成完整的含監管碼的單據信息,並可通過無線網絡直接上傳中國藥品電子監管網。
b.軟件自更新功能,軟件可自動或手動更新,而不必重新安裝。更新後必須確保業務數據不丟失。
3.選擇、配備條碼掃描終端
(1) 企業如何購買新的掃描終端
企業購買監管碼掃描終端可選擇任何滿足監管網接口標準的設備,但務必要求供應商的掃描終端設備上已經安裝相應軟件,並提供軟硬件服務。
如果企業具備可訪問互聯網的無線局域網環境(WiFi網絡),或者具備GPRS廣域網訪問條件(手機上網),則可選擇滿足監管網接口標準的無線上傳條碼掃描終端,但務必要求供應商的掃描終端設備上已經安裝相應軟件,並提供快捷軟硬件升級服務。
中國藥品電子監管網網站上已提供測試通過的掃描設備的型號和供應商供企業參考。
(2) 企業如何重複利用現有的條碼掃描終端
如企業已有條碼掃描設備,例如RF,PDA等,希望將該設備重複利用。此時可在國家局政府網站下載《中國藥品電子監管網接口標準》(附件5),並選擇軟件開發商根據該接口在設備上開發相應的中國藥品電子監管網掃描軟件即可。
(四)倉庫
1.掃描、上傳藥品生產入庫數據
特殊藥品生產入庫:
特殊藥品指麻醉藥品、第一類和第二類精神藥品。在特殊藥品生產完畢進行生產入庫時,必須進行藥品的掃描操作,並將掃描的監管碼數據導入中國藥品電子監管網客戶端進行上傳。
手持終端數據導入客戶端(見附件6:導入入出庫單文件)。
上傳單據(見附件6:入出庫單上傳)。
非特殊藥品生產入庫:
非特殊藥品在關聯關係上傳並處理成功後,中國藥品電子監管網將自動生成相應的生產入庫單,無需進行額外生產入庫的掃描上傳。
2. 掃描、上傳藥品銷售出庫數據
在藥品進行銷售出庫時,必須對出庫藥品的外包裝監管碼進行掃描,並將掃描的監管碼數據導入中國藥品電子監管網客戶端進行上傳。
手持終端數據導入客戶端(見附件6:導入入出庫單文件)。
上傳單據(見附件6:入出庫單上傳)。
3. 異常業務的處理
(1) 藥品發生退貨時操作流程
在發生下游企業退貨時,必須對退貨入庫藥品的外包裝監管碼進行掃描,並將掃描的監管碼數據導入中國藥品電子監管網客戶端進行上傳。
(2) 藥品出現零頭出入庫時操作流程
零頭藥品指入庫或者出庫藥品小於最小賦碼包裝單位,所以無監管碼的藥品。例如10支/盒的注射劑,退貨入庫5支。此時需要按製劑單位進行零頭入出庫,無需掃描監管碼。
(3) 藥品被抽檢時,如何操作
藥品被抽檢時,分爲以下幾種情況:
a.如果藥品抽檢只是檢查外觀,然後立即放回原包裝,不必操作。
b.如果抽檢後不再歸還藥品,屬於銷燬性抽檢,此時需要進行抽檢出庫操作:
★如藥品抽檢時,關聯關係已經建立並上傳,而且需要將被抽檢藥品的大包裝箱內重新放入新藥品進行補充,此時進行如下操作:
記錄下被抽檢藥品監管碼和新放入藥品的監管碼。
在企業客戶端中,使用“監管碼替換”功能,用新藥品監管碼替換下被抽檢藥品監管碼。
在企業客戶端中,使用“監管碼註銷”功能,將被替換下的監管碼註銷。
★如藥品抽檢時,關聯關係已經建立並且上傳,但無需將被抽檢藥品的大包裝箱補充完整,此時進行如下操作:
記錄下被抽檢藥品監管碼。
在企業客戶端中,使用“監管碼註銷”功能,將被抽檢藥品監管碼註銷。
(中國藥品電子監管網系統已支持手持終端進行“抽檢出庫”操作,如用戶手持終端已升級並支持該功能,可直接在手持終端進行抽檢出庫,無需進行以上兩步驟。如果手持終端不支持抽檢出庫,請聯繫集成商升級手持終端。)
★如藥品抽檢時,關聯關係尚未建立,則無需進行額外操作。
監管碼替換(見附件6:監管碼替換)。
監管碼註銷(見附件6:監管碼註銷)。
(4) 藥品入出庫時,監管碼被磨損,如何操作
a.如果磨損監管碼無法掃描,但是可肉眼辨認出條形碼下方的20位數字,此時可在手持終端的掃描界面手工錄入20位數字碼。
b.如果磨損監管碼已經無法肉眼辨認,此時可取出包裝內的一箇中包裝或者小包裝藥品,手工記錄下監管碼,再使用企業客戶端的“監管碼關聯關係查詢”功能,查出其上級監管碼,再在手持終端中手工錄入。
c.如磨損藥品爲最小銷售包裝,此時可使用零頭入出庫功能進行填報入出庫。
(5) 下游企業藥品進行補貨,如何操作
中國藥品電子監管網重點監管企業的入出庫動作,並非監管企業的財務記錄,因此補貨時可同樣採用銷售出庫類型。
(6) 藥品退回時,藥品外包裝無監管碼,如何處理
如藥品爲中包裝、大包裝,則需拆開外包裝,掃描下一級包裝的監管碼,上傳入庫單。
如果藥品爲最小銷售包裝,則需進行零頭入庫操作。
(7) 疫苗的批簽發,如何操作
爲避免關聯關係上傳後,批簽發未合格,導致需進行關聯關係撤回等操作。建議待批簽發合格後,再上傳關聯關係數據。
(五)處理預警消息
在系統觸發預警後,會向監管部門以及相關預警企業同時發送預警。向企業預警的方式爲預警消息。企業登錄客戶端後,可在消息中心查看預警消息,並根據預警信息進行某些預警的處理。
以下對各種類型預警消息如何處理分別進行說明:
1. 藥品臨近有效期預警
該預警消息表示企業進行入出庫的藥品在三個月內即將到期。
該預警消息企業無法自行處理,需聯繫食品藥品監管部門進行處理。
2. 藥品已過有效期預警
該預警消息表示企業進行入出庫的藥品已經過期。
該預警消息企業無法自行處理,需聯繫食品藥品監管部門進行處理。
3. 批准文號已過期預警
該預警消息表示企業生產或入出庫藥品的批准文號已過期。該類預警只能由藥品生產企業進行處理。
處理方法爲在“企業藥品目錄”功能中,更新預警藥品的“批准文號有效期”爲最新日期。
4. 企業證書過期預警
該預警消息表示企業註冊時填寫的相關資質證書已過期,包括GMP證書、GSP證書、藥品生產許可證、藥品經營許可證。
處理方法爲在“企業基本信息”功能中,更新已過期證書的有效期爲最新日期。
5. 超計劃生產預警
該預警信息表示定點生產企業生產的麻醉藥品和精神藥品超過國家規定的年度計劃生產量。
該預警消息企業無法自行處理,需聯繫食品藥品監管部門進行處理。
6. 未勾兌預警
該預警消息表示企業在規定時間內沒有上傳與上游出庫單匹配的入庫單,或者與下游入庫單匹配的出庫單。
處理方法爲企業根據預警消息的內容,找到漏傳的藥品單據,補傳相應單據。
7. 勾兌不符預警
該預警消息表示企業進行入出庫的藥品與上游出庫單信息藥品匹配不符,或者與下游入庫單藥品信息匹配不符。
處理方法爲企業根據預警消息的內容,查看與之勾兌的單據詳細信息,找出勾兌不符的原因。如發現爲多掃描藥品,可刪除預警單據內多餘監管碼;如果發現爲漏掃藥品,可補充掃描後再次上傳新單據與之匹配;如果發現爲錯掃藥品,可刪除單據內錯傳的監管碼,重新上傳含有正確監管碼的新單據與之匹配,或者進行監管碼的轉移操作。
8. 庫存報損報溢預警
該預警消息表示該企業對某批次的藥品進行了大量的庫存報損或者報溢。
該預警消息企業無法自行處理,需聯繫食品藥品監管部門進行處理。
以上內容具體操作詳見附件6。
四、經營批發企業操作指南
(一)藥品電子監管網入網、續費操作
經營批發企業入網、續費操作與生產企業相同,可參見生產企業入網、續費操作章節。
(二)配備條碼掃描終端
具體操作同“三(三)”。
(三)倉庫
1. 掃描、上傳藥品採購入庫數據
(1) 特殊藥品採購入庫
在特殊藥品進行採購入庫時,必須進行藥品的掃描操作,並將掃描的監管碼數據導入中國藥品電子監管網客戶端進行上傳。
手持終端數據導入客戶端(見附件7:導入入出庫單文件)。
上傳單據(見附件7:入出庫單上傳)。
(2) 非特殊藥品採購入庫
非特殊藥品採購數據上報可採用兩種方式:根據上游企業出庫單進行確認入庫的方式,以及掃描入庫藥品監管碼並上傳單據的方式。
手持終端數據導入客戶端(見附件7:導入入出庫單文件)。
上傳單據(見附件7:入出庫單上傳)。
2. 掃描、上傳藥品銷售數據
在藥品進行銷售出庫時,必須對出庫藥品的外包裝監管碼進行掃描,並將掃描的監管碼數據導入中國藥品電子監管網客戶端進行上傳。
手持終端數據導入客戶端(見附件7:導入入出庫單文件)。
上傳單據(見附件7:入出庫單上傳)。
3. 利用往來單位的自定義編號,減少單據錄入工作量
中國藥品電子監管網系統支持企業用戶在添加往來單位時,自行爲每個往來單位添加自定義編號,並將往來單位列表導入手持終端,以便在入出庫掃碼時可輸入自定義編號選擇收發貨單位,減少單據上傳時的錄入工作量。
往來單位管理(見附件7:往來單位)。
往來單位導出(見附件7:導入導出)。
(如果手持終端不支持往來單位導入,請聯繫集成商升級手持終端。)
4. 異常業務的處理
(1) 藥品發生退貨時操作流程
在發生下游企業退貨時,必須對退貨入庫藥品的外包裝監管碼進行掃描,並將掃描的監管碼數據導入中國藥品電子監管網客戶端進行上傳。
(2) 藥品出現零頭出入庫時操作流程
零頭藥品指入庫或者出庫藥品小於最小賦碼包裝單位,屬於無監管碼的藥品。例如10支/盒的注射劑,退貨入庫5支。此時需要按製劑單位進行零頭入出庫(見附件7:零頭入出庫),無需掃描監管碼。
(3) 藥品被抽檢時,如何操作
藥品被抽檢時,分爲以下幾種情況:
a.如果藥品抽檢只是檢查外觀,然後立即放回原包裝,不必操作。
b.如果抽檢後不再歸還藥品,屬於銷燬性抽檢,此時需要進行抽檢出庫操作:
★如藥品抽檢時,關聯關係已經建立並上傳,而且需要將被抽檢藥品的大包裝箱內重新放入新藥品進行補充,此時進行如下操作:
記錄下被抽檢藥品監管碼和新放入藥品的監管碼。
在企業客戶端中,使用“監管碼替換”功能,用新藥品監管碼替換下被抽檢藥品監管碼。
在企業客戶端中,使用“監管碼註銷”功能,將被替換下的監管碼註銷。
★如藥品抽檢時,關聯關係已經建立並且上傳,但無需將被抽檢藥品的大包裝箱補充完整,此時進行如下操作:
記錄下被抽檢藥品監管碼。
在企業客戶端中,使用“監管碼註銷”功能,將被抽檢藥品監管碼註銷。
(中國藥品電子監管網系統已支持手持終端進行“抽檢出庫”操作,如用戶手持終端已升級並支持該功能,可直接在手持終端進行抽檢出庫,無需進行以上兩步驟。如果手持終端不支持抽檢出庫,請聯繫集成商升級手持終端。)
★如藥品抽檢時,關聯關係尚未建立,則無需進行額外操作。
監管碼替換(見附件7:監管碼替換)。
監管碼註銷(見附件7:監管碼註銷)。
(4) 藥品入出庫時,監管碼被磨損,如何操作
a.如果磨損監管碼無法掃描,但是可肉眼辨認出條形碼下方的20位數字,此時可在手持終端的掃描界面手工錄入20位數字碼。
b.如果磨損監管碼已經無法肉眼辨認,此時可取出包裝內的一箇中包裝或者小包裝藥品,手工記錄下監管碼,再使用企業客戶端的“監管碼關聯關係查詢”功能,查出其上級監管碼,再在手持終端中手工錄入。
c.如磨損藥品爲最小銷售包裝,此時可使用零頭入出庫功能進行填報入出庫。
(5) 下游企業藥品進行補貨,如何操作
中國藥品電子監管網重點監管企業的入出庫動作,並非監管企業的財務記錄,因此補貨時可同樣採用銷售出庫類型。
(6) 藥品退回時,藥品外包裝無監管碼,如何處理
如藥品爲中包裝、大包裝,則需拆開外包裝,掃描下一級包裝的監管碼,上傳入庫單。
如果藥品爲最小銷售包裝,則需進行零頭入庫操作。
(四)物流碼與監管碼的合併應用
1. 監管碼與物流碼合併應用原理
對於藥品行業來說,監管碼的編碼規範和核注覈銷原理使得監管碼可方便地被當做物流條碼來使用,從而在藥品的供應鏈體系中輕鬆地實現各個環節的數據共享,貫穿整個貿易過程,並通過監管碼數據的採集、反饋,提高整個物流系統的經濟效益。
監管碼由藥品類別碼、單件序列號和加密碼三部分組成,通過藥品類別碼就可區分出藥品的生產廠家、藥品通用名、劑型、製劑規格、包裝規格、商品名稱及批准文號,監管碼進入市場流通後,還帶有生產日期、有效期、批號信息,並且通過包裝規格可計算出完整包裝內的藥品數量。在整個物流過程中可用此來唯一標識一個固定包裝的貨物。監管碼完全可代替物流條碼來標識物流過程的藥品。
從應用範圍看,監管碼貫穿藥品的整個流通環節,從生產、經營到消費者,監管碼的流動過程也就是藥品實物的流通過程。監管碼的編碼規範由中國藥品電子監管網制定,保證條碼規範的統一、標準,所以無論哪個流通環節都可依據電子監管碼獲取藥品信息,在任何一個流通環節,無論哪個廠商生產的哪種藥品,只要加貼藥品電子監管碼,就可被任何一個流通環節的主體識別,監管碼都可被解析、識讀,從而往來單位之間無須因爲物流條碼的編碼規範、碼制的不同而給應用帶來困擾,而且讀取監管碼就可得到監管碼對應的完整的流轉信息,包括髮貨單位、收貨單位的信息。
基於監管碼的這些屬性,經營批發企業在實際業務過程中可以應用這些監管碼來改善工作的效率,提高工作的質量。
2. 利用監管碼進行盤點
由於監管碼的屬性信息包含藥品的包裝規格信息,企業在盤點的過程中可以通過掃描每個箱體或外包裝的監管碼計算出商品的數量。
3. 利用監管碼進行結算
對於藥店來說,監管碼中的類別碼能對應藥品的種類、批准文號、劑型規格以及包裝規格,因此類別碼完全可以作爲收銀系統的藥品標識用於結算。藥店可以自行維護類別碼和藥品屬性的對應關係,也可以通過中國藥品電子監管網系統動態下載該對應關係。
按照規定,所有賦碼藥品的外包裝箱都印有包裝碼,那麼企業可以利用這個碼來實現物流中藥品的自動分揀。規範要求藥品外包裝中長寬面都貼有監管碼,碼的密度必須大於10mils, 同時碼的下沿必須保持和傳送帶30mm的距離。這樣物流企業可以很容易在傳送帶上自動識別這個碼,當系統識別箱碼後,可以根據碼所關聯單據的往來單位信息來指定箱子應流向的發貨區域。
5. 利用監管碼進行復核輔助檢驗
對於藥品物流企業來說,無論是入庫還是出庫環節,按照GSP的管理要求,倉庫人員都必須對操作的藥品進行復覈驗查的工作,即保證藥品的外觀和包裝標籤必須和相關藥品交易單據以及藥品證明文件一致,其中最重要的檢查內容就是保證包裝上的生產批號、生產廠商、規格型號與單據保持一致。
由於監管碼的後臺屬性信息中本身就包含生產批號、生產廠商、規格型號,企業可以通過掃描監管碼獲得這些後臺屬性信息,並和企業信息系統中的單據信息進行自動比對。這樣既可以降低複覈崗位的工作強度,同時在複覈的工作中就完成監管碼的出入庫掃描工作。總體來說,出入庫的掃描工作既不增加物流企業的工作量,又可以提高複覈的效率和工作質量。
企業要實現這樣的業務融合需要中國藥品電子監管網的數據下發,同時涉及已有信息系統的擴展,因此需要一定投入,更適合中大型的醫藥物流企業。企業可以聯繫客戶代表或中國藥品電子監管網運營中心諮詢相關解決方案。
(五)處理預警消息
經營批發企業預警消息處理方法同生產企業,涉及預警類型略少,分別爲:
1.藥品臨近有效期預警;
2.藥品已過有效期預警;
3.超計劃購買預警;
4.未勾兌預警;
5.勾兌不符預警;
6.庫存報損報溢預警。
以上內容具體操作詳見附件7。
五、中國藥品電子監管網客戶服務
(一)客服電話
中國藥品電子監管網全國統一客戶服務電話:95001111。
個別地區如無法撥通,可撥打010-95001111。
(二)QQ客戶代表
爲給企業提供更加快捷、方便的服務,並及時瞭解和滿足企業的需求,中國藥品電子監管網在原有語音服務平臺基礎上(95001111/010-84607666),開通了“QQ羣在線服務”,並自2010年8月25日正式啓用。
1.羣設置規則
各省QQ羣號碼見:
http://www1.drugadmin.com/show.php?contentid=1235
每個羣均設置客戶代表,負責羣管理併爲用戶提供在線服務交流。該羣在不斷增加中,請留意中國藥品電子監管網的更新。
2.服務對象、服務內容和服務時間
(1)服務對象:針對已成功加入中國藥品電子監管網的用戶。
(2)服務內容:
爲用戶提供藥品電子監管政策和中國藥品電子監管網業務以及系統操作的諮詢;
指導用戶進行中國藥品電子監管網系統操作,並及時協助用戶解決操作時遇到的問題;
(3)服務時間
法定工作日的9:00-12:00,13:00-17:00。
(三)網站信息
企業使用、實施中的最新問題解答、政策規定可登錄下列網址查看:
國家食品藥品監督管理局政府網站-藥品電子監管專欄:http://www.sfda.gov.cn
中國藥品電子監管網:http://www.drugadmin.com/
(四)聯繫方式
地址:北京市朝陽區霄雲路26號鵬潤大廈A座8層 中國藥品電子監管網運營中心
郵編:100125
傳真:010-51342277
郵箱:sfdaservice@95001111.com