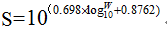1 拼音
jiàn kāng chéng nián zhì yuàn zhě shǒu cì lín chuáng shì yàn yào wù zuì dà tuī jiàn qǐ shǐ jì liàng de gū suàn zhǐ dǎo yuán zé
《健康成年志願者首次臨牀試驗藥物最大推薦起始劑量的估算指導原則》由國家食品藥品監督管理局於2012年5月15日國食藥監注[2012]122號印發。
2 一、概述
首次臨牀試驗是創新性藥物研發過程中的重要里程碑之一,它是第一次在人體中探索新化合物是否可以成藥,第一次驗證在此之前獲得的所有動物數據與人體的相關性。在物種差異尚未完全明確的情況下,它是安全性風險最高的一個臨牀試驗。因而,在試驗設計和具體實施上要格外慎重。
首次臨牀試驗一般以單次、遞增的方式給藥,其目的是探索人體對新化合物的耐受性,以及新化合物在人體中的藥代動力學特徵。有時,它也可顯示新化合物在人體中的藥效動力學特徵。
本指導原則着重介紹了估算新化合物在健康成年志願者中開展首次臨牀試驗的最大推薦起始劑量(MaximumRecommended Starting Dose, MRSD)的思路、策略和方法,旨在確保受試志願者的安全。
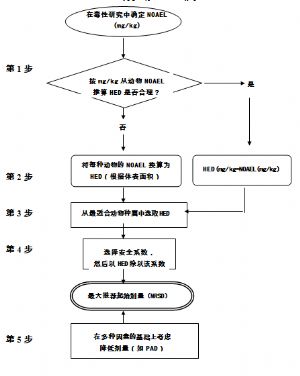
MRSD的推算方法有多種。本指導原則參考國外已發佈的有關估算首次臨牀試驗MRSD的指導原則、國際上研究者常用的已趨成熟的估算方法,並結合我國新藥研發的現狀和特點,介紹了以動物毒理學試驗的未見明顯毒性反應劑量(No Observed Adverse Effect Level, NOAEL)爲基礎,使用人體等效劑量(Human Equivalent Dose, HED)的推導方式。也介紹了以生物暴露量爲基礎,接近藥理作用機制的推導方式。另外,針對臨牀前數據的可預測性把握不大的藥物,還簡要介紹了以最低預期生物效應劑量(Minimal Anticipated Biological Effect Level,MABEL)法的推導方式。研究者最終採用的最大起始劑量應該是各種推算方法中得出的較低劑量,以最大程度地保證受試者的安全。
在一個新化合物進入臨牀試驗之前, 申請人應完成一系列的臨牀前研究。其中包括:藥效學研究、動物藥代動力學研究(吸收、分佈、代謝和排瀉)、毒理學及毒代動力學研究。在確定MRSD時,應考慮所有的臨牀前研究數據,以達到既避免不良反應,又能迅速達到I期臨牀試驗的目標。
MRSD的確定應由多部門、多專業背景的資深專家共同探討。每一個新化合物首次臨牀試驗的風險都會因其創新程度、化學結構、作用機制、給藥途徑、與生物靶點的結合強度、臨牀前研究所用的動物種屬等因素而不同。因此,MRSD必鬚根據藥物的特點具體情況具體分析。申請人和研究者應綜合分析所有的臨牀前研究數據,充分分析其臨牀風險,設計出科學安全的MRSD。
3 二、適用範圍
本指導原則適用於經過臨牀前研究後的新化合物在開始首次臨牀試驗時確定其在成年健康志願者中的MRSD,但不涉及臨牀試驗中劑量遞增方案或最大允許劑量。本指導原則表述的估算方法主要適用於擬全身暴露的藥物,對於局部應用、鼻腔內、組織內和腔室內給藥途徑以及植入的儲庫型等劑型可能還要考慮其他一些因素,但可採用類似的原理。新生物製品可以參照進行研究,但本指導原則不適用於在生理濃度下使用的內源性激素和蛋白(例如重組凝血因子)或預防性疫苗。
某些類別的藥物(例如許多細胞毒類藥物或生物製劑)的首次臨牀試驗常常是在患者而不是在健康志願者中開展。特別是懷疑或已知一種藥物有不可避免的毒性時,其首次臨牀試驗通常使用患者而不是健康志願者。本指導原則不討論在患者中確定MRSD的問題,但推薦的許多原理和某些方法可能適用於這類試驗的設計。
4 三、估算方法概述
4.1 (一)以毒理試驗劑量爲基礎估算MRSD
本方法是從毒理試驗中得到一系列NOAEL,並計算出相應的HED,然後選擇一個HED用於推算MRSD。本指導原則將詳細介紹如何在受試動物中確定NOAEL、NOAEL換算爲HED、最適合動物種屬的選擇及安全係數(SafetyFactor, SF)的應用。
毒性反應的數據應進行分析後才能用於計算MRSD。另外,雖然NOAEL可直接用於MRSD的計算,但其他數據(暴露量, 毒性反應關係、藥理學數據或相關藥物以往的臨牀經驗等)可能影響合適動物種屬的選擇、劑量換算和安全係數的選擇。
通常情況下,可以根據動物NOAEL計算HED。如果HED是根據其他數據,如藥理學活性劑量(Pharmacologically Active Dose,PAD)計算得出的,應在估算MRSD時予以說明。
4.2 (二)以生物暴露量爲基礎估算MRSD
由於動物種屬間藥物吸收、分佈、代謝和排泄的差異,給藥劑量常常與藥物產生的效應不直接相關,而與暴露量更相關。在瞭解了動物暴露量/毒性反應關係、藥代動力學、藥理學數據以及它們與人體的相關性後,可以暴露量爲基礎,用PK/PD的方法推算人體起始劑量。
5 四、以毒理試驗劑量爲基礎估算MRSD
5.1 (一)第1步:未見毒性反應劑量(NOAEL)的確定
計算MRSD時首先要分析和評價現有的動物研究數據,以確定每項毒理試驗中的NOAEL。文獻上對NOAEL有不同的定義,但計算MRSD時應使用以下定義:與對照組相比未使毒性反應顯著增加的劑量。但是,在確定NOAEL時,如果某種毒性反應具有生物學意義,則無論是否具有統計學差異,都應該予以考慮。從合適的動物毒理試驗中確定的NOAEL已被廣泛地接受用於確定健康志願者的安全起始劑量。
在動物毒理試驗中確定NOAEL的關鍵是如何判斷毒性反應,通常有三種情況:(1)明顯的毒性反應,如明顯臨牀症狀、肉眼和顯微鏡下可見的損害;(2)毒性反應的替代指標,如血清肝酶水平升高;(3)過度放大的藥效反應。不同藥物的毒性反應在性質和程度上可以有很大的差異,而對某種反應是否判定爲毒性反應往往有不同意見。但是,NOAEL作爲健康志願者中劑量設定的推算基礎已被廣泛接受。原則上,Ⅰ期臨牀試驗的健康志願者在起始劑量下不應該出現任何臨牀前試驗中觀察到的毒性反應。
NOAEL不等同於未觀察到反應的劑量(No Observed Effect Level,NOEL),後者是指任何反應,而不只是毒性反應,儘管在有些情況下兩者可能相同。與NOEL不同,NOAEL是指在動物中觀察到的某些反應可能是可以接受的藥效學作用,且不會帶來安全性擔憂。NOAEL亦不應與觀察到毒性反應的最低劑量(Lowest Observed Adverse Effect Level,LOAEL)或最大耐受劑量(Maximum ToleratedDose,MTD)相混淆。後面的兩個概念都是以毒性反應的發現爲基礎,一般不用於成年健康志願者起始劑量的確定。
有些情況下,與毒性反應相關的生物利用度數據、代謝特徵和血漿藥物濃度等非臨牀數據可以影響NOAEL的確定。例如,藥物吸收出現飽和現象時,仍未發現毒性反應,此時應當使用最低飽和劑量而不是最高的無毒劑量來計算HED。
5.2 (二)第2步:人體等效劑量(HED)的計算
1.根據體表面積換算
通過相關動物數據確定NOAEL之後,應選擇最恰當方法將動物劑量外推到人體等效劑量,即將NOAEL換算成HED。對於動物全身性給藥的毒性終點,如MTD或NOAEL,如果將劑量歸一化爲體表面積劑量(即mg/m2),通常在不同種屬間可呈現良好的比例關係。有研究顯示,對於抗腫瘤藥物,以體表面積(mg/m2)計算劑量時,導致10%齧齒類動物死亡的劑量(LD10)和非齧齒類動物的MTD均與人體的MTD有很好的相關性。體表面積歸一化法是從動物劑量估算HED普遍接受的做法。
在某些情況下,使用其他的劑量歸一化方法也可能是合適的,例如:在某些情況下可以直接將mg/kg表示的NOAEL劑量推算到人體等效劑量。當不使用體表面積歸一化方法進行HED的換算時,應當充分說明所用方法的合理性。
雖然體表面積歸一化方法是不同動物間等效劑量換算的一種適宜方法,但將mg/kg劑量換算成mg/m2劑量時的轉換系數不能一成不變,因爲體表面積隨體重變化而變化,因此轉換系數取決於所用動物的體重。
2.使用mg/kg換算的依據
在某些情況下根據體重成比例換算[即設定HED(mg/kg)=NOAEL(mg/kg)]可能更爲合適。如考慮對某一藥物按mg/kg換算,現有的數據應當顯示不同動物種屬間NOAEL的mg/kg劑量相似。當滿足以下條件時,使用mg/kg外推至HED比使用mg/m2法更爲適宜:
(1)不同動物種屬間NOAEL的mg/kg劑量相似。但需要注意的是有時這種相似的NOAEL mg/kg劑量僅僅是由於生物利用度的差異引起的。
(2)如果不同動物的毒理研究中只有2個NOAEL,則必須具備以下條件之一:
l 藥物爲口服給藥並且劑量受局部毒性限制。如:各種屬間生理學模型胃腸室重量與體重的W0.94成比例。胃腸容量決定了藥物在胃腸中的濃度,則具有胃腸局部毒性的藥物的毒性反應按mg/kg(W1.0)換算是合理的。
l 藥物在人體的毒性反應依賴於某暴露參數,而不同種屬之間這一參數與mg/kg劑量密切相關。例如,人體反義寡核苷酸全身給藥後所產生的補體激活依賴於Cmax。對於某些反義核酸類藥物,各種動物種屬之間Cmax與mg/kg劑量相關,在這種情況下按mg/kg換算是合理的。
l 對某一藥物來說,在不同種屬之間其他藥理學和毒理學終點,如MTD、最低致死劑量和藥理學活性劑量具有可比性,也可按藥物的mg/kg劑量換算。
l 血漿藥物濃度(Cmax和AUC)和mg/kg劑量之間有顯著的相關性。
值得注意的是對於小鼠、大鼠和犬,按mg/kg換算得到的HED比默認的mg/m2方法得到的值分別高12、6和2倍。如果不能滿足以上條件,仍應使用mg/m2法計算HED,以便得出一個較爲安全的MRSD。
3.種屬間不按mg/m2進行劑量換算的其他情況
(1)藥物劑量受局部毒性反應限制的其他給藥途徑(例如局部用藥、鼻腔內、皮下、肌肉內給藥),應以給藥部位的濃度(例如mg/使用面積)或使用部位的藥物總量(mg)來換算。
(2)某些給至解剖腔室但隨後很少分佈至腔室外的藥物。例如鞘內、膀胱內、眼內或胸膜內給藥。這些藥物在不同種屬間應當按照腔室體積和藥物的濃度換算。
(3)分子量大於100000道爾頓的血管內給藥的蛋白,應當按mg/kg換算。
5.3 (三)第3步:最適合動物種屬的選擇
毒理研究可得到一系列NOAEL,並計算出相應的HED,然後選擇一個HED用於推算MRSD。這一HED應當從最適合的動物種屬中選擇。在沒有種屬相關性數據的情況下,一般默認最敏感的動物種屬(即HED最低的種屬)是推算成年健康志願者臨牀試驗MRSD最適合的動物。
在某些情況下,可以不將最敏感動物種屬默認爲最適合動物種屬。這些情況包括:(1)動物種屬間藥物的吸收、分佈、代謝和排泄存在差異;(2)以往的同類藥物研究經驗提示特定動物模型可以更好地預測人體不良反應。另外,對於某些生物製品(例如人體蛋白),最適合動物種屬的選擇需要考慮這些製品的特性,動物是否表達相關受體或表位等因素也可以影響動物的選擇。
在確定某一新藥人體首次給藥的MRSD時,並不知道該藥物在人體的吸收、分佈和消除參數。當動物體內的代謝特徵及計算的HED均有很大差異時,基於體外試驗獲得的相應的藥物代謝特徵顯得十分有意義。對於某類特定藥物,同類藥物的前期研究可能已經表明,某一特定的動物模型更加適合評價其安全性。例如,在評價磷硫酰反義藥物非臨牀安全性時,猴被認爲是最適合的動物,因爲猴出現了與人相同的劑量限制性毒性反應(例如補體激活),而齧齒類動物沒有出現。對於這類藥物,MRSD通常是根據猴NOAEL的HED來確定,而並不考慮這一HED是否低於齧齒類動物的HED,除非新反義藥物在齧齒類動物中也出現了獨特的劑量限制性毒性。
5.4 (四)第4步:安全係數的使用
根據最合適動物種屬的NOAEL確定了HED後,可用安全係數提供一個安全閾值,以保護接受MRSD的受試者的安全。當考慮到從動物外推到人體時,需要考慮以下因素對安全係數變化的影響:(1)人的藥理學活性高於試驗動物所帶來的不確定性;(2)在動物中檢測某些毒性反應的難度(例如頭痛、肌痛、精神障礙);(3)受體密度或親和力的差異;(4)無法預期的毒性反應;(5)藥物ADME的種屬差異。以上這些因素的影響是需要降低根據動物NOAEL的HED推算出的人體初始劑量。
在實際應用中,臨牀試驗的MRSD是用HED除以安全係數來確定。通常使用的安全係數是10。這個數值是根據歷史經驗確定的,但並不一定適用於所有情況,安全係數應該根據實際情況加以適當調整。當安全性風險增大時,安全係數應當加大;而有數據證明安全性風險減小時,安全係數可適當減小。安全係數就像一個浮動標尺,根據對健康志願者安全型風險的增減而適當調整。安全係數增減的程度要通過對現有數據的分析來確定。安全係數的增加和減少,尤其是調整到低於10的情況,必須有充分明確的理由。
1.增大安全係數
當非臨牀毒理研究數據提示有安全性方面的擔憂時,可能需要增大安全係數。如果發現多個方面的擔憂,則安全係數應相應地增大。此時,MRSD將由HED除以一個大於10的安全係數進行計算得到。需要增大安全係數的情況包括:
l 劑量反應曲線斜率很陡時:在最合適動物或多種動物中出現明顯的毒性反應,並呈現出斜率陡的劑量反應曲線時,提示對人的風險較大。
l 嚴重毒性反應:嚴重的毒性反應或對器官系統(如:中樞神經系統)的損害,提示對人的風險增加。
l 不可監測的毒性反應:不可監測的毒性反應主要是指動物中發現的但用臨牀病理標誌物難以監測的組織病理學變化。
l 無先兆症狀的毒性反應:如果動物中出現的明顯毒性反應沒有明確的先兆症狀,則在人體試驗中可能難以知道何時達到毒性劑量。
l 生物利用度變異度大:在幾種動物中生物利用度差異大或生物利用度較差,或者用於推導HED的動物生物利用度較差,提示可能低估了人體毒性反應。
l 不可逆的毒性反應:動物中不可逆的毒性反應提示對臨牀試驗受試者有可能造成永久性損傷。
l 不明原因的死亡:導致不能用其他指標來預測死亡率。
l 產生效應的劑量或血漿藥物濃度有很大的差異:如果在不同動物種屬間或某種動物的不同個體間,產生毒性反應的劑量或暴露水平有很大的差異,那麼預測人體中某個毒性劑量的能力會降低,則需要更大的安全係數。
l 非線性藥代動力學:當血漿藥物濃度的升高與劑量不相關時,預測人體中與劑量相關的毒性的能力會降低,可能需要更大的安全係數。
l 劑量-反應數據不足:毒理試驗設計欠妥(例如劑量組不夠、給藥間隔寬等)或給藥組內不同動物間反應有很大的差異,可能導致難以描繪劑量-反應曲線。
l 新的治療靶點:以往未在臨牀上評價過的治療靶點會增加確定人體安全起始劑量的難度。
l 現實動物模型的限制性:某些類別的治療性生物製品可能有非常有限的種屬間交叉反應,或有明顯的免疫原性,或其作用機制在動物與人之間是不一致的,那麼來自動物研究的安全性數據在應用範圍和可解釋性方面可能都非常有限。
2.降低安全係數
藥物的毒理學實驗的實施和設計均十分完善時,安全係數小於10是合適的。這一策略僅用於受試藥物各項特徵研究十分透徹,且按相同的途徑、方案和療程給藥,具有當有相似的代謝特徵和生物利用度,在所有試驗種屬(包括人)中有類似的毒性反應特徵的情況下。另外,當藥物引起的毒性易於監測、可逆、可以預測並顯示出劑量-反應關係,且毒性反應的種類和程度在試驗種屬間一致時(程度上可以通過劑量和暴露量進行換算),也可以使用較小的安全係數。
5.5 (五)第5步:藥理學活性劑量(PAD)的考慮因素
藥理學活性劑量(PAD)的選擇取決於許多因素,並且因藥理作用類別和臨牀適應症的不同而有顯著的差異。因此,PAD的選擇超出了本指導原則的範圍。然而,一旦確定下來MRSD,將MRSD與從適當的藥效學模型中推導的PAD進行比較是有益的。如果PAD來自體內研究,可以根據體表面積轉換系數估算出藥理學HED。這一HED值應當與MRSD進行比較。如果藥理學HED低於MRSD,按照實際情況或科學原因而降低臨牀起始劑量是恰當的。此外,某些類別的藥物或生物製品(例如血管擴張劑、抗凝劑、單克隆抗體或生長因子)的毒性反應可能源於過度的藥理學作用,此時PAD可能是一個比NOAEL更靈敏的提示潛在毒性的指標,因此可能需要降低MRSD。
6 五、以生物暴露量爲基礎估算MRSD
某一劑量下的暴露量是可以測定的,它的高低由動物種屬特定的藥代動力學參數和給藥方案決定。如能獲得人體的藥代動力學參數,研究者可以將劑量和暴露量相關聯。在早期動物試驗中,通過不同的給藥方案和所得的暴露量建立藥物在動物中的藥代動力學模型,獲得關鍵的動物藥代動力學參數,如清除率(CL)、分佈容積(Vd)、生物利用度(F)等。當試驗數據或研究程度還不足以建立藥代動力學模型時,最簡單的方式是在靜脈給藥途徑下,測定某一劑量下的暴露量,根據藥代動力學的基本原則(Dose=CL×AUC;T1/2=0.693Vd/CL),計算出動物的清除率和分佈容積。
有了動物的藥代動力學參數,可以用不同的方式推算人體藥代動力學參數。最簡單是異速增長模型推算法(AllometricScaling),即以不同動物種屬的體表面積、體重或其他生理常數[如腦重、最大生命值(MaximumLife-span Potential, MLP)]的對數值爲橫座標,以其藥代動力學參數的對數值爲縱座標,用線性回歸法推算人體相應的藥代動力學參數(CL、Vd)。爲了保證估算人體藥代動力學參數的準確性,最好從3種以上動物體內獲得其藥代動力學參數。
異速增長模型推算法一般適合於推算以腎小球濾過爲主要代謝機制的藥物的清除率。當藥物的主要代謝機制是肝代謝時,可以用體外肝微粒體或離體肝細胞試驗獲得肝代謝速度,來推算人體清除率。當藥代動力學機制相當複雜時,則需要運用更復雜的藥代動力學手段來推算。目前最受關注的是基於不同動物生理藥動學模型(PhysiologicallyBased Pharmacokinetic Model,PBPK)。
根據推算所得的人體藥代動力學參數(CL、Vd、F)及從藥理試驗中所得的藥物的生物活性暴露量, 採用藥代動力學公式,推算藥物的生物活性劑量。
以生物暴露量爲基礎的人體起始劑量的估算一般包括以下幾個步驟:
1.根據臨牀前藥理學模型(體內或體外模型),在考慮了物種之間的靶點結合率差異和血清蛋白結合率差異後,獲得能產生藥效的關鍵暴露量(生物活性暴露量)。這個暴露量可以是Cmin、Cmax或AUC等參數。
2.在選定的合適動物種屬中,獲得在NOAEL下的暴露量(NOAEL暴露量)。
3.用NOAEL暴露量除以對應的生物活性暴露量,預測可能的安全閾值(SafetyMargin)。在此過程中需考慮物種之間的靶點結合率差異和血清蛋白結合率差異。
4.根據毒理試驗中所出現毒性的靶器官、嚴重程度、可監測性、可恢復性等和暴露量的關係,以及藥效學試驗中藥效活性和暴露量的關係等,評估此前預測的安全閾值是否可被接受。
5.如果安全閾值可被接受,用一種或幾種種屬生理推算法 [有或無相關係數的異速增長模型推算法(AllometricInterspecies Scaling)、Detricks 等價時間曲線法(DedricksPlots)、生理藥動學模型法等],估算藥物在人體內的藥代動力學參數。
6.根據步驟1中得出的生物活性暴露量和步驟5中得出的人體藥代動力學參數,基於不同的給藥方式運用到相應的藥代動力學數學模型中估算出人體的生物活性劑量。根據安全範圍的大小,除以適當的安全係數,得到以暴露量爲基礎的人體起始劑量。在考慮了適當的安全係數後,得到的人體起始劑量下的遊離藥物暴露量應該不超過NOAEL的遊離態藥物暴露量的1/10。在估算遊離藥物暴露量時,應考慮物種之間的血清蛋白結合率差異。
7 六、以最低預期生物效應劑量推算MRSD
對於某些作用機制和作用靶點認識有限、臨牀前數據的預測價值低的藥物,其安全性風險可能更高。可以以最低預期生物效應劑量(MABEL)爲其人體初始劑量。該方法的本質與前面描述的以暴露量爲基礎的估算策略是一致的。爲計算最低預期生物效應劑量,研究者必須從藥理試驗中,根據受體結合特點或功能特點,預測出人體最低生物活性暴露量。繼而綜合暴露量、藥代動力學和藥效動力學特徵,根據藥物的具體情況採用特定的PK/PD模型,推算出最低預期生物效應劑量。
8 七、總結
本指導原則提供了確定在成年健康志願者中開展新藥臨牀試驗的最大推薦起始劑量的策略。一種情況下可用相關動物的NOAEL換算爲HED,除以適當安全係數,得到MRSD。另一種情況下,可用相關動物的暴露量和藥代動力學參數換算爲人體藥代動力學參數,根據預測的人體生物活性暴露量推算人體預期生物效應劑量。一般來說,從安全性的角度考慮,研究者應採用較低的起始劑量。另外,對於臨牀前數據的可預測性把握不大的藥物,採用最低預期生物效應劑量作爲人體初始劑量可能更爲合適。
無論採用何種方法估算,申請人應向臨牀研究者和審評機構提供充分的臨牀前研究數據,包括藥效、毒理、藥代動力學、毒代動力學數據,用於確定首次臨牀試驗最大推薦起始劑量的估算方法及評價該劑量的合理性。
首次臨牀試驗最大推薦起始劑量的確定應由多部門、多專業共同探討,應綜合所有的臨牀前數據及類似化合物或同一作用機制化合物既往的臨牀經驗和數據,憑藉可靠的科學判斷,以確保受試者的安全和試驗設計的合理性。鼓勵申請人就藥物首次臨牀試驗最大推薦起始劑量的相關問題與審評機構進行討論。
9 參考文獻
l FDA. Guidance for industry: Estimating the Maximum SafeStarting Dose in Initial Clinical Trials for Therapeutics in Adult HealthyVolunteers. 2005.7
l EMEA. Guideline on Strategies toIdentify and Mitigate Risks for First-In-Human Clinical Trials with InvestigationalMedicinal Products. 2007.7
l Dedrick Rl. Animal Scale-Up. J PharmacokinetBiopharm 1973: 1: 435-461
l Mordenti J. Man versus Beast. J Pharm Sci,1986: 75: 1028-1040
l Boxenbaum H. Interspecies Scaling, Allometry,Physiological Time and the Ground Plan of Pharmacokinetics. J PharmacokinetiBiopharm. 1982: 10: 201-207
l Boxenbaum H. Interspecies PharmacokineticsScaling and the Evolutionary-Comparative Paradigm. Drug Metab Rev. 1984:15:1071-1121
l Mahmood I. Balian Jd. Interspecies Scaling: Predicting PharmacokineticParameters of Antiepileptic Drugs in Humans from Animals with Special Emphasison Clearance. J Pharm Scie. 1996: 85: 411-414
l R. Scott Obach. Prediction of Human Clearance of Twenty-NineDrugs from Hepatic Microsomal Intrinsic Clearance Data: an Examination of InVitro Half-Life Approach and Nonspecific Binding to Microsomes. DrugMetabolism And Disposition. 1999:27:1350-1359
10 名詞解釋
最大推薦起始劑量:MRSD(MaximumRecommended Starting Dose): 在臨牀試驗中推薦使用的最大起始劑量。在成人健康志願者的臨牀試驗中,MRSD被預測不會產生毒性反應。劑量的單位(例如mg/kg或mg/m2)隨研究領域而異。
未見明顯毒性反應劑量:NOAEL(No Observed Adverse Effect Level): 與對照組相比,在某受試動物種屬中不會產生明顯毒性反應的最高劑量。確定NOAEL時應當考慮有生物學意義的毒性反應(即使沒有統計學意義)。
最大無反應劑量:NOEL(No Observed Effect Level):在某受試動物中不會產生任何反應的最高劑量。
最小毒性反應劑量:LOAEL(Lowest Observed Adverse EffectLevel): 在某受試動物物種中產生毒性反應最輕的劑量。
最大耐受劑量:MTD(Maximum Tolerated Dose): 毒性試驗中未產生不可接受毒性的最高的劑量。
藥理學活性劑量:PAD(Pharmacologically Active Dose): 在受試動物中能產生預期的藥理作用的最低劑量。
人體等效劑量:HED(Human Equivalent Dose): 能預期在人體試驗中得到與動物試驗相同程度的反應的劑量,在本文中,HED指對應於NOAEL 的人等效劑量。當參照其他人類相關劑量(例如PAD)而不是NOAEL時,研究人員應該特別註明此用法。
體表面積轉換系數:BSA-CF(Body Surface Area ConversionFactor): 根據不同的體表面積,該係數將動物劑量(mg/kg)轉換爲人等效劑量(HED);體表面積-轉換系數是受試種屬的體表面積與人體平均體表面積之比。
安全係數:SF(Safety Factor): 將HED除以該係數以得到一個更安全的MRSD。
W: 體重(單位:kg)
12 附錄B 從動物劑量(mg/kg)通過體表面積歸一化方法
推算HED的步驟
在實際應用中,從以mg/kg爲單位的動物毒理研究劑量通過體表面積歸一化法推算至人體等效劑量HED也可通過以下步驟:
1. 體表面積的通用計算公式:
Log10S=0.698×log10W+0.8762
即:
其中: S:體表面積,單位cm2
W:體重,單位g
2. 計算人和動物的體表面積:
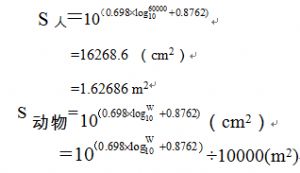
其中:人以60kg體重計算
動物體重用W表示。
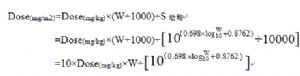
4. 計算從mg/kg劑量轉化爲體表面積劑量(mg/m2)的換算因子km:
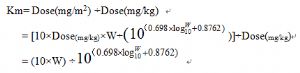
5. 根據體重計算Km實例值
種屬 | 參考體重 (kg) | 體表面積 (m2) | Km |
人 | 60 | 1.6268 | 36.88 |
20 | 0.80 | 26.47 | |
小鼠 | 0.020 | 0.006086 | 3.29 |
倉鼠 | 0.080 | 0.01602 | 4.99 |
大鼠 | 0.150 | 0.02484 | 6.04 |
大鼠 | 0.300 | 0.04029 | 7.45 |
白鼬 | 0.300 | 0.04029 | 7.45 |
豚鼠 | 0.400 | 0.04925 | 8.12 |
兔 | 1.8 | 0.14073 | 12.79 |
犬 | 10 | 0.46580 | 21.47 |
靈長類 | |||
猴a | 3 | 0.20102 | 14.92 |
微型豬 | 20 | 0.7557 | 26.47 |
小型豬 | 40 | 1.2259 | 32.63 |
a:例如:食蟹猴、恆河猴、短尾猴
【附:用EXCEL自動化表格公式方法:
=10*W/POWER(10,(LOG10(W)*0.698+0.8762))】
6. 轉換動物NOAEL劑量(mg/kg)至HED