2 註解
2016年諾貝爾生理學或醫學獎由日本科學家大隅良典(Yoshinori Ohsumi)獲得。獲獎理由是“發現了細胞自噬機制。”

Yoshinori Ohsumi
圖片來源:東京工業大學網站

Yoshinori Ohsumi今年三月在北京 張宏供圖
大隅良典,1945年2月9日出生於日本福岡。1974年從東京大學獲得博士學位。1974年至1977年,他在美國洛克菲勒大學做博後,隨後返回日本,任職於東京大學。2009年起,爲東京工業大學教授。
今年的諾貝爾獎獲得者發現並闡明瞭細胞自噬的機制——這是細胞成分降解和循環利用的一個基本過程。
自噬(autophagy)一詞來源於希臘語auto-,意爲“自我”,和phagein,即“吞噬”。因此,autophagy便引申爲“自噬”。這個定義出現在上個世紀60年代,當時,科研人員首次觀察到細胞能破壞自身成分,用膜將這些成分包裹,形成袋狀囊泡並轉移給溶酶體(lysosome)進行降解回收。此前人們對細胞自噬過程幾乎毫無瞭解,因而相關研究一直是困難重重,直到上個世紀90年代初,大隅良典在一系列實驗中,巧妙地利用麪包酵母(baker's yeast)找到了細胞自噬所需的基因。通過繼續研究,大隅良典闡明瞭酵母自身內自噬的基本原理,並證明類似的複雜機制也存在於人體細胞內。
大隅良典的發現爲我們瞭解細胞是如何循環利用自身成分,樹立了新典範。他的發現爲我們瞭解並意識到細胞自噬在飢餓適應、感染反應等許多生理過程中的至關重要性開闢了新道路。自噬基因的突變會導致疾病的產生,自噬過程在包括癌症和神經性疾病在內的多種體內環境中充當的不可或缺的角色。
上世紀50年代,科學家觀察到一種特別的細胞微結構(這種微結構的學名又叫做“細胞器”),這種細胞器含有能夠消化蛋白質、碳水化合物和脂肪的酶。後來研究人員將這種細胞器稱爲溶酶體,相當於降解細胞成分的工作站。比利時科學家Christian de Duve就因爲發現這種溶酶體而獲得1974年諾貝爾生理學或醫學獎。到了60年代,科學家們在溶酶體中有時可以找到大量的細胞組成物質甚至是完整的細胞器。因此,科學家們認爲細胞內存在着一種過程——將細胞內的“大型貨物”送到溶酶體那兒。進一步的生化和顯微分析也顯示,一種新的囊泡會將細胞成分打包送到溶酶體處進行降解(圖一)。發現溶酶體的Christian de Duve使用了“自噬”這個合成詞描述這一過程。這種囊泡則被稱爲“自噬體”(autophagosome)。

圖一:我們的細胞有着各種特別的細胞器。溶酶體就是這樣的一種細胞器,它含有各種可以消化細胞成分的酶。細胞內還存在一種被稱爲“自噬體”的新型囊泡。當自噬體形成時,它會包裹住某些細胞成分,比如那些被破壞的蛋白質和細胞器。最終,它與溶酶體相融合,這些細胞成分便會降解爲更小成分。這一過程爲細胞的更新提供了養分和構建基礎。
在上世紀70到80年代,科研人員將注意力放在了對另一種降解蛋白質的物質即“蛋白酶體”的研究上。在這個研究領域裏,就有Aaron Ciechanover, Avram Hershko和Irwin Rose三位科學家因爲發現泛素調節蛋白的降解而獲得2004年諾貝爾化學獎。蛋白酶體能夠有效地先後降解多個蛋白質,不過這種機制並沒有解釋細胞是如何處理更大的蛋白質複合物和破舊的細胞器的。那麼自噬過程能夠給出解釋嗎?如果可以,那其機制又是什麼呢?
一個突破性實驗
大隅良典曾活躍於多個研究領域,在1988年開始建立自己的實驗室時,他將研究重點放在液泡中蛋白質的降解方面。酵母細胞相對比較容易研究,所以經常被用於人類細胞研究模型。對於研究在複雜細胞通路中具有重要作用的基因來說,它們尤其有用。但是大隅良典面臨着一個主要的挑戰:酵母細胞很小,內部結構在顯微鏡下很難區分,所以他就難以確定酵母細胞中是否存在着自噬作用。怎麼辦呢?他就想着,在自噬過程激活時,如果他能打斷液泡中的降解過程,那麼自噬體就應當在液泡中聚集,並能在顯微鏡下可見。於是他培養了缺乏液泡降解酶的酵母細胞,並通過飢餓化細胞刺激自噬作用。結果是驚人的!幾個小時內,液泡內就充滿了未被降解的小囊泡(圖二).這些小囊泡就是自噬體,大隅良典的實驗證明瞭自噬存在於酵母細胞中。更重要的是,他現在能夠鑑別參與這一工程的關鍵基因了。這是一項重大的突破,大隅良典於1992年發表了這項結果。

圖二:在酵母中(圖左),液泡相當於哺乳動物細胞中的溶酶體。大隅良典培育了缺乏液泡降解酶的酵母細胞。當這些細胞飢餓時,自噬體就會快速聚集在液泡中(圖中)。他的實驗證明瞭自噬存在於酵母細胞。下一步,大隅良典研究了數千種變異酵母細胞(圖右),並鑑別出了15個對自噬至關重要的基因。
大隅良典利用改造過的酵母菌株,其中吞噬體因飢餓而聚集。如果自噬重要基因失活,這種聚集不應該發生。大隅良典將酵母細胞暴露於一種化學物質,可隨機在許多基因中誘發突變,隨後他誘導自噬。他的策略成功了!在發現酵母自噬一年內,他就鑑別出了第一個對於自噬至關重要的基因。他隨後的一系列精巧的研究發現,由這些基因編碼的蛋白具有功能性。這些結果顯示,自噬由一組蛋白和蛋白複合體調控,各自調節自噬體形成的不同階段。(圖三)
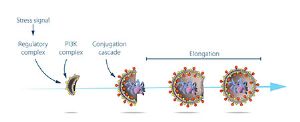
圖三:大隅良典研究了由關鍵自噬基因編碼的蛋白的功能。他勾畫了壓力信號如何發動自噬,以及蛋白和蛋白複合體促進不同階段自噬體形成的機制。
在發現了酵母中的細胞自噬機制後,仍有關鍵的問題待解。其他機體中是否存在着響應機制來調控這一過程?很快,科學家弄清了我們的細胞中也存在着完全一樣的機制。用於研究人類細胞自噬重要性的工具現在已經可得。
感謝大隅良典和其他跟進研究的人,我們現在知道自噬調控重要的生理功能,以便細胞組件得以降解和循環。自噬能夠快速提供能量燃料,及爲細胞組件更新提供材料,從而對細胞響應飢餓或其他應激至關重要。在感染後,自噬能夠清除入侵的胞內細菌和病毒。自噬對於胚胎髮育和細胞分化也發揮作用。細胞還利用自噬清除受損蛋白和細胞器,這是一種質量控制機制,對於抵消衰老帶來的副作用至關重要。
中斷的自噬作用已被認爲與帕金森症、2型糖尿病及其它老年易患病相關。自噬基因的變異能導致基因疾病。干擾自噬作用被認爲與癌症相關。目前相關研究正在緊密展開,以期開發相關藥物能在多種疾病中標靶自噬作用。
雖然自噬作用已爲人所知超過50年,但直到大隅良典上世紀90年代顛覆性的研究之後,它的重要作用纔得到確認。因爲這一貢獻,大隅良典被授予今年的諾貝爾生理學或醫學獎。