1 拼音
quán cí yì chǐ yòng yǎng huà gào cí kuài chǎn pǐn zhù cè jì shù shěn chá zhǐ dǎo yuán zé
《全瓷義齒用氧化鋯瓷塊產品註冊技術審查指導原則》由國家食品藥品監督管理局於2012年5月10日食藥監辦械函[2012]210號印發。
本指導原則旨在指導和規範全瓷義齒用氧化鋯瓷塊產品的技術審評工作,幫助審評人員理解和掌握該類產品原理/機理、結構、性能、預期用途等內容,把握技術審評工作基本要求和尺度,對產品安全性、有效性作出系統評價。
本指導原則所確定的核心內容是在目前的科技認識水平和現有產品技術基礎上形成的,因此,審評人員應注意其適宜性,密切關注適用標準及相關技術的最新進展,考慮產品的更新和變化。
本指導原則不作爲法規強制執行,不包括行政審批要求。但是,審評人員需密切關注相關法規的變化,以確認申報產品是否符合法規要求。
2 一、適用範圍
本指導原則適用於全瓷義齒用氧化鋯瓷塊產品(以下簡稱氧化鋯瓷塊)。該產品以氧化鋯爲主要材料,用於製作牙科固定義齒的冠、橋、嵌體、貼面。
3 二、技術審查要點
3.1 (一)產品名稱的要求
氧化鋯瓷塊的命名應採用《醫療器械分類目錄》或國家標準、行業標準中的通用名稱,或以產品結構和預期用途爲依據命名。例如:全瓷義齒用氧化鋯瓷塊。
3.2 (二)產品的結構和組成
氧化鋯瓷塊主要成分爲:氧化鋯、氧化釔、氧化鋁及其他氧化物。材料成分(重量百分比)一般爲:
氧化鋯(含氧化鉿、氧化釔)(ZrO2+HfO2+Y2O3):≥99%;
氧化釔(Y2O3):4.5%~6.0%;
氧化鉿(HfO2):≤5%;
氧化鋁(Al2O3):≤0.5%;
其他氧化物: ≤0.5%。
如圖1所示,氧化鋯瓷塊按照形狀一般分爲圓柱體、長方體及定製幾何體。

圖1 氧化鋯瓷塊示例
3.3 (三)產品的工作原理
1.氧化鋯瓷塊是製作全瓷義齒的材料
氧化鋯瓷塊是製作全瓷義齒的材料,相當於製作金屬烤瓷修復體的合金材料,如鈷鉻合金。氧化鋯瓷塊通常採用CAD/CAM(計算機輔助設計/計算機輔助製造)方法製作全瓷義齒,製作流程舉例如下:
(1)對牙齒或牙模進行數字掃描,獲得牙模三維數據;
(2)按照牙模數據進行CAD設計,設計瓷塊加工模型;
(3)採用數控機牀按照瓷塊加工模型進行CAM製造,製成全瓷義齒內冠;
(4)全瓷義齒內冠經空氣燒結或真空燒結,以達到臨牀使用要求的強度和美觀效果;
(5)用瓷粉在全瓷義齒內冠表面上釉,形成瓷瓷結合,製作出全瓷義齒。
2.氧化鋯瓷塊的成型工藝
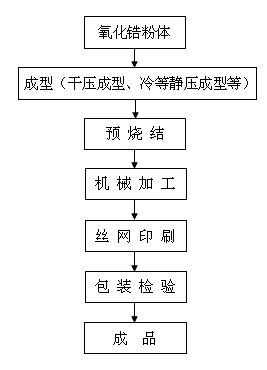
氧化鋯瓷塊的成型工藝目前主要有兩種。
國內外生產企業主要採用“等靜壓成型”或“幹壓成型”工藝,流程見圖2。優點是工藝簡單,適合大工業生產;缺點是透光性稍差,整體性能略低。
少數國外生產企業如美國Glidewell採用“注漿成型”工藝,優點是生產出來的氧化鋯瓷塊透光性好,整體性能如強度、密度等較高;缺點是工藝複雜。
關鍵工藝是粉體成型和瓷坯預燒結,對產品的性能指標有直接影響。
圖2 氧化鋯瓷塊典型生產工藝流程
3.4 (四)產品的作用機理
3.5 (五)產品適用的相關標準
GB/T 191-2008 | 包裝儲運圖示標誌 |
GB/T2828.1-2003 | |
GB/T 2829-2002 | |
GB/T 6387-1986 | 齒科材料名詞術語 |
GB/T 16886.10-2005 | |
YY/T 0127.9-2009 | |
YY/T 0127.10-2009 | |
YY/T 0127.13-2009 | |
YY/T 0127.14-2009 | |
YY/T 0268-2008 | |
YY 0466-2003 | |
YY 0716-2009 | 牙科陶瓷 |
ISO 6872-2008 | Dentistry — Ceramic materials |
ISO 13356-2008 | Implants for surgery —Ceramic materials based on yttria-stabilized tetragonal zirconia (Y-TZP) |
上述標準包括了註冊產品標準中經常涉及到的標準。有的企業還會根據產品的特點和用途引用一些行業外的標準和一些較爲特殊的標準。
產品適用及引用標準的審查可以分兩步來進行。首先對引用標準的齊全性和適宜性進行審查,也就是在編寫註冊產品標準時與產品相關的國家標準、行業標準是否進行了引用,以及引用是否準確。可以通過對註冊產品標準中“規範性引用文件”是否引用了相關標準,以及所引用的標準是否適宜來進行審查。此時,應注意標準編號、標準名稱是否完整規範,年代號是否有效。其次對引用標準的採納情況進行審查。即所引用的標準中的條款要求,是否在註冊產品標準中進行了實質性的條款引用。這種引用通常採用兩種方式,文字表述繁多內容複雜的可以直接引用標準及條文號,比較簡單的也可以直接引述具體要求。
注意“規範性應用文件”和編制說明的區別,通常不宜直接引用或全面引用的標準不納入規範性引用文件,而僅僅以參考文件在編制說明中出現。
如有新版強制性國家標準、行業標準發佈實施,產品性能指標等要求應執行最新版本的國家標準、行業標準。
3.6 (六)產品的預期用途
該產品以氧化鋯爲主要材料,用於製作牙科固定義齒的冠、橋、嵌體、貼面。
3.7 (七)產品的主要風險
風險管理報告應符合YY/T0316-2008《醫療器械 風險管理對醫療器械的應用》的有關要求,審查要點包括:
3. 風險可接收準則,降低風險的措施及採取措施後風險的可接收程度,是否有新的風險產生;
以下依據YY/T0316附錄E列舉了氧化鋯瓷塊的危害分析,審查人員還應結合具體產品的情況。針對產品的各項風險,企業應採取應對措施,確保風險降到可接受的程度。
可預見的事件序列 | 危害處境 | 損害 | |
(1) 材料有非電離輻射 | |||
(2) 材料強度不夠 | |||
(3) 不正確的配方 | |||
產品變質或質量降低 | 產品製作過程中損壞,無法使用 | ||
(5) 意外的機械破壞 | 包裝損壞或產品損壞 | 產品無法使用 | |
(7) 不適當的操作說明 | 產品製作過程中損壞,無法使用 | ||
(8) 由不熟練/未經培訓的人員使用 | |||
(9) 對副作用的警告不充分 | 患者在使用過程中的意外情況:如突然咬到硬物(砂子、鐵屑等) |
3.8 (八)產品的主要技術指標
本章給出氧化鋯瓷塊產品需要考慮的基本技術性能指標,企業可參考相應的標準,根據企業自身產品的技術特點和用途制定相應的性能指標。如國家標準中有不適用條款,企業在標準的編制說明中必須說明理由。
1. 企業針對手動系統和聲稱兼容的自動加工系統推出的不同形狀的氧化鋯瓷塊都應有尺寸和誤差要求。
2. 氧化鋯瓷塊表面應無斑點裂紋及可見異物。
3. 氧化鋯瓷塊密度應在標示值的±0.05g/cm3內。
4. 氧化鋯瓷塊燒結密度應不小於6.0 g/cm3。
5. 按YY0716-2009中規定的三點彎曲試驗(或雙軸彎曲試驗)測試,經介紹規定的程序燒結後的樣塊,撓曲強度應不小於800MPa(或根據不同用途參照ISO 6872標準表1中關於撓曲強度的要求)。
6. 按YY0716-2009中規定的Ⅱ型陶瓷的試驗方法進行試驗,經介紹規定的程序燒結後的樣塊,化學溶解性應小於100μg/cm2。
7. 氧化鋯瓷塊的生物相容性應按照標準YY/T 0268的規定選擇試驗項目,一般要求評價產品的細胞毒性、口腔粘膜刺激性、遲髮型超敏反應、亞慢性(亞急性)全身毒性及遺傳毒性。
8. 按YY0716-2009中規定的方法進行試驗時,氧化鋯瓷塊中鈾-238的活性濃度不應大於1.0Bq.g-1。
9. 按ISO13356-2008中4.2規定的原子吸收光譜分析等方法進行試驗時,氧化鋯瓷塊的成分應符合企業聲稱的產品成分。
3.9 (九)產品的檢測要求
出廠檢驗項目至少應包括上述主要技術指標中的1-6項。
型式檢驗由有資質的檢驗機構進行。型式檢驗時,按相應的標準要求進行,所有適用條款應全部合格。
3.10 (十)產品的臨牀要求
氧化鋯瓷塊產品屬於製作全瓷義齒的材料,全瓷義齒屬於定製式固定義齒中的一種,依據《關於印發豁免提交臨牀試驗資料的第二類醫療器械目錄(試行)的通知》(國食藥監械[2011]475號)文件,定製式固定義齒可以豁免提交臨牀試驗資料,因此本產品也可豁免臨牀試驗。但應同時提交申報產品與已上市同類產品的對比說明。對比說明應當包括工作原理、產品材質、結構組成、主要技術指標、預期用途等內容。
3.11 (十一)產品的不良事件歷史記錄
暫未發現不良事件。
3.12 (十二)產品介紹、標籤和包裝標誌
產品介紹、標籤和包裝標誌的編寫要求應符合《醫療器械介紹、標籤和包裝標識管理規定》、《醫療器械用於醫療器械標籤、標記和提供信息的符號》和相關標準的要求。
1.使用說明書
(2)生產企業名稱、註冊地址、生產地址、聯繫方式及售後服務單位;
(3)生產企業許可證編號、註冊證編號、產品標準編號;
(6)產品使用說明:應包括製作全瓷義齒的程序和燒結溫度等重要信息;
(7)內容物的最小淨重(單位爲克),淨體積(單位爲立方厘米),以及獨立瓷塊的數量;
(9)注意事項:避免與硬物發生碰撞,搬運中避免劇烈擠壓、受力和震動;未經燒結成瓷不可直接用於人體義齒或口腔修復;本產品需由專業技工製作,由專業醫生裝鑲、調整和佩戴;
2.標籤和包裝標識
-產品名稱。
-生產廠的名稱(或經銷商的名稱)。
-產品的商品名。
-內容物的最小淨重,單位爲克;淨體積,單位爲立方厘米。獨立單位的數量,比如預成的瓷片或瓷塊。
(2)下列信息應清楚標記在氧化鋯瓷塊上:
-產品的商品名;
-可供齒科加工設備識別的條形碼或射頻編碼(若適用)。
3.13 (十三)註冊單元劃分的原則和實例
氧化鋯瓷塊註冊單元劃分按照醫療器械註冊管理辦法第二十七條要求,“醫療器械產品的註冊單元原則上以技術結構、性能指標和預期用途爲劃分依據”實施,應從以下三個方面來考慮。
1.成分:氧化鋯瓷塊的主要成分不同應劃分爲不同的註冊單元。
2.工藝:氧化鋯瓷塊成型工藝及流程不同應劃爲不同的註冊單元。
例1:“注漿成型”工藝和“等靜壓成型”、“幹壓成型”工藝生產的氧化鋯瓷塊劃爲不同的註冊單元。
例2:因成分不同,導致撓曲強度和密度燒結等性能不同的瓷塊應劃爲不同的註冊單元。
3.14 (十四)同一註冊單元中典型產品的確定原則和實例
4 三、審查關注點
(一)產品的原材料和工藝是影響氧化鋯瓷塊質量的主要因素,因此應重點審查原材料的組成,氧化鋯的含量是否符合標準規定等,同時評價其生產工藝是否成熟可控。
(二)產品的安全有效性主要取決於其技術性能是否達到了要求,因此應重點審查產品標準是否規定了合理的要求,尤其是表面質量、密度、撓曲強度、生物相容性。
(三)產品的風險主要取決於其預期用途,氧化鋯瓷塊用於製作全瓷義齒和植入性醫療器械的風險不同,如植入物的氧化鋯材料應執行更嚴格ISO13356標準,因此應審查其預期用途是否爲製作全瓷義齒。
(四)產品的風險還取決於介紹中告知用戶的信息是否充分,因此應重點審查介紹的內容,如用氧化鋯瓷塊製作全瓷義齒的程序和燒結溫度及注意事項等。
5 全瓷義齒用氧化鋯瓷塊產品註冊技術審查指導原則編制說明
5.1 一、指導原則編寫的原則
(一)本指導原則編寫的目的是用於指導和規範第二類全瓷義齒用氧化鋯瓷塊產品註冊申報過程中審查人員對註冊材料的技術審評。
(二)本指導原則旨在讓初次接觸該類產品的註冊審查人員對產品機理、結構、主要性能、預期用途等各個方面有個基本瞭解,同時讓技術審查人員在產品註冊技術審評時把握基本的尺度,對產品安全性、有效性作出系統評價。
5.2 二、指導原則編寫的依據
(一)《醫療器械監督管理條例》
(二)《醫療器械註冊管理辦法》(局令第16號)
(三)《醫療器械臨牀試驗規定》(局令第5號)
(四)《醫療器械介紹、標籤和包裝標誌管理規定》(局令第10號)
(五)《醫療器械標準管理辦法》(局令第31號)
(六)關於印發《境內第一類醫療器械註冊審批操作規範(試行)》和《境內第二類醫療器械註冊審批操作規範(試行)》的通知(國食藥監械[2005]73號)
(七)國家食品藥品監督管理局發佈的其他規範性文件
5.3 三、指導原則中部分具體內容的編寫考慮
(一)全瓷義齒用氧化鋯瓷塊除本指導原則所述預期用途外,也可以製作活動修復體的連接橋等,但在臨牀上應用非常少,不能代表氧化鋯瓷塊的典型用途,故未列入。彩色氧化鋯瓷塊由於目前國內尚未註冊該類產品,故在編寫時未列入,但國外存在該類產品,如3M公司,擬待我國註冊該類產品後修訂此指導原則。
(二)產品的主要技術指標主要依據行業標準YY0716-2009《牙科陶瓷》,也重點參考了ISO 6872-2008和ISO 13356-2008兩份國際標準,增加了氧化鋯瓷塊成分要求,因爲該要求對產品安全、有效性有較大影響。其他要求如內部質量主要針對外科植入器械用氧化鋯材料,故未作此要求。另外,氧化鋯瓷塊使用前要進行燒結,因此放尺率(或收縮率)也是衡量產品質量的一項指標,本指導原則編寫是增加了瓷塊密度的要求,因爲放尺率或收縮率可以通過瓷塊密度和燒結後密度計算得到。計算公式如下,供審評人員參考。
(三)產品的預期用途綜合了已批准上市產品的核準範圍及專家的意見。按照管理類別,該產品不用於製作植入性器械,如樁核、種植義齒。
(四)氧化鋯瓷塊是定製式全瓷義齒的原材料,不是最終產品,一般要經過設計、燒結等加工工藝才能用於臨牀。並且全瓷義齒是定製式產品,一般難以進行對照或單目標值試驗設計,即通過臨牀試驗來進行安全有效驗證是困難的。另外,產品行業標準中的撓曲強度、化學溶解性等性能都是對燒結後的瓷塊即全瓷義齒內冠進行檢驗,依此驗證瓷塊產品的安全有效。故建議審評氧化鋯瓷塊的臨牀要求時,可以考慮評價產品製作全瓷義齒的設計確認技術資料,如在義齒製作機構開展的設計確認,來代替臨牀試驗資料。
(五)產品的不良事件歷史記錄主要從遼寧省藥品不良反應監測中心數據庫中查找,未發現上報的不良事件。調研中瞭解到臨牀使用上偶見因瓷塊內部質量不好,導致加工時斷裂或無法滿足要求,不會用於患者。
5.4 四、其他產品
採用氧化鋯瓷塊製作的定製式全瓷義齒可參照國家局發佈的《定製式義齒產品註冊技術審查指導原則》。
5.5 五、指導原則編寫人員
本指導原則的編寫成員由遼寧省食品藥品監督管理局醫療器械產品註冊技術審評人員和行政審批人員、國家食品藥品監督管理局瀋陽醫療器械質量監督檢驗中心人員組成,以充分利用各方面的信息和資源,綜合考慮指導原則中各個方面的內容,儘量保證指導原則正確、全面、實用。