1 拼音
Bxíng chāo shēng zhěn duàn shè bèi (dì èr lèi )chǎn pǐn zhù cè jì shù shěn chá zhǐ dǎo yuán zé
《B型超聲診斷設備(第二類)產品註冊技術審查指導原則》由國家食品藥品監督管理局於2009年6月18日食藥監辦械函[2009]231號發佈。
本指導原則旨在指導和規範第二類B型超聲診斷設備的技術審評工作,幫助審評人員理解和掌握該類產品原理/機理、結構、性能、預期用途等內容,把握技術審評工作基本要求和尺度,對產品安全性、有效性作出系統評價。
本指導原則所確定的核心內容是在目前的科技認識水平和現有產品技術基礎上形成的,因此,審評人員應注意其適宜性,密切關注適用標準及相關技術的最新進展,考慮產品的更新和變化。
本指導原則不作爲法規強制執行,不包括行政審批要求。但是,審評人員需密切關注相關法規的變化,以確認申報產品是否符合法規要求。
3 二、技術審查要點
3.1 (一) 產品名稱的要求
B型超聲診斷設備產品的命名應採用《醫療器械分類目錄》或國家標準、行業標準中的通用名稱,或以產品結構和應用範圍爲依據命名。B型超聲診斷儀是指頻率範圍在2~7.5 MHz以內,主要採用B型成像方式,用於醫學臨牀診斷的通用設備(依據GB 10152-1997標準)。
依據GB 10152-1997標準,其產品名稱應爲B型超聲診斷設備,但在實際應用中常採用的名稱有:B型超聲診斷儀、機械扇掃B型超聲診斷儀、數字化B型超聲診斷儀、線陣掃描B型超聲診斷儀、凸陣掃描B型超聲診斷儀、相控陣掃描B型超聲診斷儀等。建議規範名稱爲XXX型(系列)+ B型超聲診斷儀。若採用數字化波束成形技術的數字化設備,其規範名稱爲XXX型(系列)+ 數字化B型超聲診斷儀。
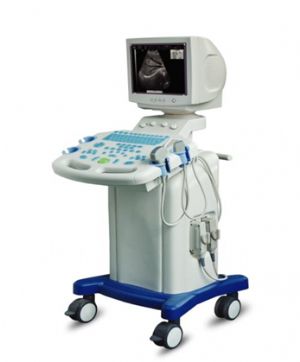
3.2 (二)產品的結構和組成
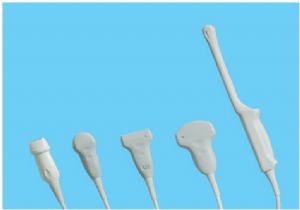
B型超聲診斷儀的結構型式可爲便攜式、臺車式,主要由主機(含軟件)、顯示器、探頭和附件(如圖像記錄儀、圖像存儲器、彩色打印機、穿刺架等)組成。探頭主要由陣列換能器、傳輸線、連接器(可以含有控制器)等組成。探頭應明示基元數(如64、80、96、128)、頻率、陣列長度或曲率半徑。產品圖示舉例:
3.3 (三) 產品工作原理
超聲波頻率在20kHz以上。醫學常用的診斷性超聲頻率範圍一般在1~10MHz。超聲波波長短,易於集中成一束射線,因此具有很好的直線定向傳播特性。超聲波在體內傳播過程中,各種組織的聲學界面產生不同的反射波和透射波,其中一部分可以返回換能器,再由換能器將聲信號轉換成電信號,並由主機接收放大以聲像圖形式顯示於屏幕上。
B型超聲診斷儀主要由探頭和主機兩部分組成。超聲波的發射與接受均由探頭來完成。主機供給一定頻率、一定激勵電壓的電訊號作用於探頭,探頭產生一定頻率的超聲波。B型超聲診斷儀以光點亮度明暗顯示體內某一斷層界面回聲信號的強弱。信號強弱用灰階表示(通過多陣元探頭的多聲束連續掃描,可將不同亮度光點組合成平面斷層二維圖像)。B超診斷儀可獲得人體軟組織器官的實時二維斷層圖像,清晰地觀察臟器形態、解剖層次及毗鄰關係。
超聲波能夠區分兩個相鄰界面回聲信號最短距離的能力稱爲分辨力。通常,頻率越高,則波長越短,分辨力越高,穿透能力越弱;反之,頻率越低,則波長越長,分辨力越低,穿透能力越強。因此檢查淺表器官如甲狀腺、乳腺等,多采用高頻探頭,如線陣7.5MHz探頭,而對心臟、腹部等深部臟器,則採用低頻探頭,如凸陣3.5MHz探頭,以增加其穿透性。
3.4 (四)產品作用機理
因該產品爲非治療類醫療器械,故本指導原則不包含產品作用機理的內容。
3.5 (五)產品適用的相關標準
GB/T 191-2008 | 《包裝儲運圖示標誌》 |
GB 9706.1-2007 | 《醫用電氣設備 第1部分:安全通用要求》 |
GB 9706.9-2008 | 《醫用電氣設備 醫用超聲診斷和監護設備專用安全要求》 |
GB 9706.15-2008 | 醫用電氣設備 第1-1部分:安全通用要求 並列標準:醫用電氣系統安全要求 |
GB 10152-1997 | |
GB/T 14710-1993 | |
GB/T 16846-2008 | 《醫用超聲診斷設備聲輸出公佈要求》 |
YY/T 1142-2003 | |
YY/T 1084-2007 | |
YY/T 0108-2008 | |
YY 0505-2005 | 《醫用電氣設備 第1-2部分:安全通用要求-並列標準:電磁兼容-要求和試驗》 |
GB/T 16886.1-2001 | |
GB/T 16886.5-2003 | |
GB/T 16886.10-2005 |
上述標準包括了註冊產品標準中經常涉及到的標準。有的企業還會根據產品的特點引用一些行業外的標準和一些較爲特殊的標準。
產品適用及引用標準的審查可以分兩步來進行。首先對引用標準的齊全性和適宜性進行審查,也就是在編寫註冊產品標準時與產品相關的國家、行業標準是否進行了引用,以及引用是否準確。可以通過對註冊產品標準中“規範性引用文件”是否引用了相關標準,以及所引用的標準是否適宜來進行審查。此時,應注意標準編號、標準名稱是否完整規範,年代號是否有效。
其次對引用標準的採納情況進行審查。即,所引用的標準中的條款要求,是否在註冊產品標準中進行了實質性的條款引用。這種引用通常採用兩種方式,文字表述繁多內容複雜的可以直接引用標準及條文號,比較簡單的也可以直接引述具體要求。
注意“規範性應用文件”和編制說明的區別,通常不宜直接引用或全面引用的標準不納入規範性引用文件,而僅僅以參考文件在編制說明中出現。
如有新版強制性國家標準、行業標準發佈實施,產品性能指標等要求應執行最新版本的國家標準、行業標準。
3.6 (六)產品的預期用途
產品具體適用範圍應與申報產品性能、配置等一致,必要時應有相應的臨牀試驗資料支持。
常見的預期用途如下:
配3.5MHz線陣或凸陣探頭:主要供人體腹部臟器超聲診查用。若有M型輝度調製顯示功能並有臨牀試驗資料支持,還可用於心功能參數的測量;
如配7.5MHz高頻線陣探頭,可用於人體淺表器官如甲狀腺、乳腺的超聲診查;
如配6.5MHz R13凸陣探頭,可用於經陰道腔內女性生殖器官的超聲診查。
3.7 (七)產品的主要風險
B型超聲診斷儀的風險管理報告應符合YY/T 0316-2008《醫療器械風險管理對醫療器械的應用》的有關要求,判斷與產品有關的危害,估計和評價相關風險,控制這些風險並監視控制的有效性。主要的審查要點包括:
1.與產品有關的安全性特徵判定,可參考YY/T 0316-2008的附錄C,附錄C的清單是不詳盡的,確定產品安全性特徵應具有創造性,應當仔細考慮“會在哪兒出錯”;
2.危害、可預見的事件序列和危害處境判斷,可參考YY/T0316-2008附錄E、I;
3.風險控制的方案與實施、綜合剩餘風險的可接受性評價及生產和生產後監視相關方法,可參考YY/T 0316-2008附錄F、G、J。
B型超聲診斷儀的初始可預見性危害主要存在於產品設計、生產和使用環節。如產品設計方面的初始可預見危害主要有:超聲能量不恰當輸出、電能危害,熱能危害(探頭表面溫度)、生物不相容性(如探頭材料等),等等;生產方面的初始可預見危害主要有:不合格材料、部件的非預期使用(採購或供方控制不充分),部件焊接、粘合和連接的不完整(製造過程控制不充分),等等;使用的初始可預見危害有:未限制非預期使用,未限制使用環境及人員,未告知正確使用、維護、保養設備的方法等導致設備不能正常使用、誤診等。
以下依據YY/T0316-2008的附錄E(表E.2)從九個方面提示性列舉了B型超聲診斷儀的可能存在的初始危害因素,提示審查人員從以下方面考慮。
通用類別 | |
不完整的要求 | 設計參數的不恰當規範:可觸及金屬部分、外殼、應用部分、信號輸入/輸出部分等與帶電部分隔離/保護不夠,電介質強度不夠,導致對電擊危險防護不夠,可能對使用者或患者造成電擊危害;人體接觸的探頭溫度過高,可能引起燙傷;便攜式提拎裝置不牢固,帶腳輪設備鎖定不良,移動式設備易翻倒,設備支撐件強度不足,設備面、角、邊粗糙,對飛濺物防護不夠,都可能對使用者或患者造成機械損傷;顯示器輻射可能對操作者產生危害;對環境的電磁干擾超標,干擾其他設備正常工作;等等。 運行參數不恰當規範:聲輸出過大,輻照時間過久,特定條件下,超聲波在體內轉化成熱能可致胎兒眼睛等敏感器官受損;等等。 性能要求不恰當規範:性能參數如探頭側向、軸向分辨率、盲區、最大探測深度、幾何位置精度等不符合GB10152的要求,可導致誤診;等等。 服務中的要求不恰當規範:使用說明書未對設備及探頭維護、保養方式、方法、頻次進行說明,導致設備及探頭不能正常使用;等等。 壽命的結束:使用說明書未對設備/附件的使用壽命和貯藏壽命進行規定,導致設備/附件超期非正常使用導致圖像質量等性能指標降低,安全性能出現隱患;等等。 |
製造過程 | 製造過程更改的控制不充分:控制程序修改未經驗證,導致設備性能參數指標不符合標準要求;等等。 |
運輸和貯藏 | 不恰當的包裝:產品防護不當導致設備運輸過程中損壞;等等。 |
環境因素 | 物理學的(如熱、壓力、時間):過熱環境可能導致設備不能正常工作;等等。 化學的(如腐蝕、降解、污染):強酸強鹼導致設備/探頭損害;非預期使用於有麻醉劑的環境中,可能因爲電氣連接、設備結構、靜電預防不良等引起混合氣體爆炸;等等。 |
處置和廢棄 | 沒提供信息或提供信息不充分:未在使用說明書中對探頭防護套的處置和廢棄方法進行說明,或信息不充分;未對設備廢棄的處置進行提示性說明;等等。 |
配方 | |
人爲因素 | 設計缺陷引發可能的使用錯誤,如: 易混淆的或缺少使用說明書:如缺少詳細的使用方法、缺少必要的技術參數、缺少必要的警告說明、缺少電路圖和元器件清單、缺少運輸和貯存環境條件的限制;設備在故障狀態(如變壓器過載、斷開保護接地線、設備的元器件出現故障)下運行可產生危險警示不足;使用不適當的探頭;使用前未檢查設備工作狀態;操作說明過於複雜,不易懂;未說明如何正確維護、保養設備/附件;等等。 器械的狀態不明確或不清晰:探頭有無輸出無法分辨;等等。 設置、測量或其它信息的顯示不明確或不清晰:測量標尺未標示單位和比例;等等。 錯誤顯示結果:公式錯誤導致測量結果顯示錯誤;等等。 控制與操作不對應,顯示信息與實際狀態不對應:系統顯示工作頻率與探頭實際工作頻率不一致;等等。 與已有的器械比較,樣式或佈局有爭議:顯示參數與多數設備通用的顯示參數佈局不相同,可能引起參數記錄錯誤;等等。 由缺乏技術的/未經培訓的人員使用:使用者/操作者未經培訓或培訓不足,不能正確使用和維護保養設備;等等。 副作用警告不充分:使用超聲對患者進行診查時,可能產生非預期生理效應,如對胎兒危害;等等。 |
失效模式 |
3.8 (八)產品的主要技術指標
產品標準的審查是產品主要技術性能指標審查中最重要的環節之一。
B型超聲診斷儀主要技術性能指標可以分解爲技術性能要求和安全要求兩部分。其中有些技術性能要求和安全要求又是相關聯的。
標準中規定的要求部分是否齊全,可以通過對是否具有以下主要內容進行審評:
1.安全要求
(1)安全要求應符合GB 9706.1-2007和GB 9706.9-2008標準規定。若爲醫用電氣系統,則還應符合GB 9706.15-2008的要求。
(2)聲輸出參數公佈要求:設備的聲輸出參數必須按GB/T 16846-2008的規定檢驗,若聲輸出參數不能滿足免於公佈條件,應以技術手冊、使用說明書、背景資料的形式予以公佈。免於公佈的聲輸出參數的數據必須經國家食品藥品監督管理局認可的檢驗機構的認可。
2.環境試驗要求
設備的環境試驗應按GB/T14710-1993中第2章的規定,明確所屬氣候環境試驗組別和機械環境試驗組別,並在註冊產品標準、使用說明書中說明。
設備的環境試驗條件除應根據所屬組別按GB/T14710-93確定外,試驗時間、恢復時間及檢測項目按GB10152-1997表1的補充規定執行。
3.整機性能指標
對設備主機和與之配套的(含選配探頭)每一個探頭必須給出下列參數:
探頭標稱頻率(單位MHz)
探測深度(單位mm)
側向(橫向)、軸向(縱向)分辨力(單位mm)
橫向 、縱向幾何位置精度(%)
盲區 (單位mm)
上述參數指標原則上應符合GB10152-1997附錄B的相關要求。通常第二類管理B型超聲診斷儀屬C檔或D檔,整機性能參數高於C檔的,製造商可參考B檔要求在註冊產品標準明示整機性能指標,但不得聲稱爲B檔設備。具體要求詳見GB10152-1997附錄B。
若配置寬頻探頭,則應分別明示同一寬頻探頭在系統不同工作頻率下的性能指標。例:96基元R60寬頻凸陣探頭(頻率範圍2.0MHz-5.0MHz),則應給出系統工作頻率在特定頻率點(例如:2.5、3.5、5.0MHz)指定模式下的整機性能指標。
例:配置3.5MHz R60凸陣寬頻探頭(頻率範圍2.0MHz-5.0MHz)的整機性能指標
表3 性能參數
序號 | 性 能 | 性 能 指 標 | ||
1 | MHz | 3.5 | 2.5 | 5.0 |
2 | 側向(橫向)分辨力 mm | ≤3(深度≤80) ≤4(80<深度≤130) | ≤3(深度≤80) ≤5(80<深度≤160) | ≤2(深度≤40) ≤3(40<深度≤80) |
3 | 軸向(縱向)分辨力 mm | ≤2(深度≤80) ≤3(80<深度≤130) | ≤2(深度≤130) ≤3(130<深度≤170) | ≤1(深度≤40) ≤2(40<深度≤80) |
4 | 盲區 mm | ≤5 | ≤6 | ≤3 |
5 | 最大探測深度 mm | ≥170 | ≥180 | ≥100 |
6 | 幾何位置精度 % | 橫向≤15 縱向≤10 | 橫向≤15 縱向≤10 | 橫向≤10 縱向≤10 |
4.電源電壓適應範圍:額定電壓±10%
5.連續工作時間:>8h
6.正常工作條件(包括環境溫度、相對溼度、大氣壓力、電源等);
(1)B超表面應光潔、色澤均勻、無傷斑、劃痕、裂紋等缺陷,面板上文字和標誌應清晰;
(2)控制和調節機構應靈活、可靠,緊固部位應無鬆動。
8.探頭的生物相容性要求:預期與體表及粘膜表面進行一時接觸(〈24h),按GB/T16886.1-2001給出的指導原則進行評估,提供相關資料證明細胞毒性試驗、過敏試驗和皮內刺激試驗符合相關標準要求。
9.使用功能要求(包括軟件功能):例如:主機工作頻率切換、探頭自動識別、電影回放、增益調節範圍、圖像放大倍率、焦點選擇、灰階分級、工作模式選擇、邊緣增強級數選擇、動態範圍級數、體標組和體標選擇、字符和標誌顯示、測量和計算、管理功能、圖像處理或打印功能等。
11. 電磁兼容性要求:應符合YY 0505-2005等相關標準要求。
12. 若有M型輝度調製顯示功能,則應按YY/T0108-2008要求,增加M模式下相關技術指標,主要有距離顯示誤差、時間顯示誤差並在製造商隨機文件中公佈。
3.9 (九)產品的檢測要求
出廠檢驗前至少應逐臺檢測第八部分產品主要技術指標中的:外觀和結構要求、整機性能指標(探頭標稱頻率、探測深度、側向或橫向、軸向或縱向分辨力、橫向、縱向幾何位置精度、盲區)、軟件功能、電氣安全要求中的接地阻抗、漏電流、電介質強度;其它應檢測項目(如附件穿刺架要求)。若有M型輝度調製顯示功能,還應檢測距離顯示誤差和時間顯示誤差。
3.10 (十)產品的臨牀要求
1.符合《醫療器械註冊管理辦法》附件12規定,執行國家標準、行業標準的B型超聲診斷儀,國內市場上有同類型產品,不要求提供臨牀試驗資料。
2.不符合上述規定的,應提供相應的臨牀試驗資料,臨牀試驗資料的提供應符合國家有關規定。
3.11 (十一)該類產品的不良事件歷史記錄
暫未見相關報道。
3.12 (十二)產品介紹、標籤和包裝標識
產品介紹一般包括使用說明書和技術介紹,兩者可合併。介紹、標籤和包裝標識應符合《醫療器械介紹、標籤和包裝標識管理規定》及相關標準(特別是GB 9706.1、GB 9706.9、GB10152、GB/T16846和YY0505)的規定。
醫療器械介紹、標籤和包裝標識的內容應當真實、完整、準確、科學,並與產品特性相一致。醫療器械標籤、包裝標識的內容應當與介紹有關內容相符合。醫療器械介紹、標籤和包裝標識文字內容必須使用中文,可以附加其他文種。中文的使用應當符合國家通用的語言文字規範。醫療器械介紹、標籤和包裝標識的文字、符號、圖形、表格、數字、照片、圖片等應當準確、清晰、規範。
1.介紹的內容
使用說明書內容一般應包括產品名稱、商品名稱(若有)、型號、規格、主要結構及性能、預期用途、安裝和調試、工作條件、使用方法、警示、注意事項、保養和維護、儲存、故障排除、標籤和包裝標識、出廠日期、生產許可證號、註冊證號、執行標準、生產企業名稱、地址和聯繫方式、售後服務單位等。
技術介紹內容一般包括概述、組成、原理、技術參數、規格型號、圖示標記說明、系統配置、外形圖、結構圖、控制面板圖,必要的電氣原理圖及表等。
2.使用說明書審查一般關注點
(1)產品名稱、型號、規格、主要性能、結構與組成應與註冊產品標準內容一致;產品的適用範圍應與註冊申請表、註冊產品標準及臨牀試驗資料(若有)一致。
(2)生產企業名稱、註冊地址、生產地址、聯繫方式及售後服務單位應真實並與《醫療器械生產企業許可證》、《企業法人營業執照》一致;《醫療器械生產企業許可證》編號、醫療器械註冊證書編號、產品標準編號位置應預留;
3.使用說明書中有關注意事項、警示以及提示性內容主要應包括:
(1)提醒注意由於電氣安裝不合適而造成的危險;
(2)設備是否能與心臟除顫器及高頻手術設備一起使用的聲明;若可與心臟除顫器及高頻手術設備一起使用,安全使用的方法與條件;
(3)設備可否直接應用於心臟的聲明;
(4)多臺設備互連時引起漏電流累積而可能造成的危險;必要時列出可與設備相連並安全使用的設備的要求;
(5)可靠工作所必須的程序;
(6)若有附加電源,且其不能自動地保持在完全可用的狀態,應提出警告,規定應對該附加電池進行定期檢查和更換。應說明電池規格和正常工作的小時數;電池長期不用應取出說明;可充電電池的安全使用和保養說明。
(7)與患者接觸的探頭正確使用、消毒和防護的詳細方法;預防性檢查和保養的方法與週期。必要時規定合適的消毒劑,並列出這些設備部件可承受的溫度、壓力、溼度和時間的限值。正常使用或性能評估時,對探頭部件可浸入水中或其他液體中部位的說明。
(8)對設備所用的圖形、符號、縮寫等內容的解釋,如:所有的電擊防護分類、警告性說明和警告性符號的解釋。
(9)該設備與其他裝置之間的潛在的電磁干擾或其他干擾資料,以及有關避免這些干擾的建議。
(10)如果使用別的部件或材料會降低最低安全度,應在使用說明書中對被認可的附件、可更換的部件和材料加以說明。
(11)指明有關廢棄物、殘渣等以及設備和附件在其使用壽命末期時的處理的任何風險;提供把這些風險降低至最小的建議。
(12)熔斷器和其他部件的更換的警示。
(13)多用途超聲設備的超聲輸出水平的能力遠大於超聲設備特定應用下的典型值時,應給出關於避免不需要聲輸出控制設置和水平的指令。
(14)應警示“探頭禁止掃描眼部”;“ 在合理的範圍內,應使用盡可能低的輸出功率。檢查身體的時間不宜過長,僅以能作出診斷所必需的時間爲限。延長使用時間會損害人體的健康”。由於超聲部分能量可轉化爲熱能,熱能對胎兒有潛在危害,因此還應警示“在具有臨牀指徵需要時,儀器的使用者必須對聲輸出有足夠的瞭解或能獲得相關的熱指數值。在空氣中即可覺察出其自熱的超聲探頭,不可用於經陰道探查;應特別注意減少對胚胎或胎兒的輻照聲輸出功率和輻照時間。”
(2)生產企業名稱、註冊地址、生產地址、聯繫方式;
(4)產品生產日期或者批(編)號;
(5)電源連接條件、輸入功率;
5.關於聲輸出資料公佈:申報者應按GB16846-2008要求在介紹中對聲輸出參數是否應公佈做出說明。
若不符合聲輸出資料免於公佈的條件,則在介紹中至少應公佈下列15個參數:最大時間平均聲功率輸出(最大功率)、峯值負聲壓、輸出波束強度、空間峯值時間平均導出聲強、超聲設備主機的設置(系統設置)、換能器輸出端面至最大脈衝聲壓平方積分點(對連續波系統,爲最大平均平方聲壓)之間的距離(LP)、-6d B脈衝波束寬度(Wpb6)、脈衝重複頻率(prr)、輸出波束尺寸、算術平均聲工作頻率(fawf)、聲開機係數、開機模式、聲初始係數、初始模式、聲輸出凍結。建議公佈下列2個參數:換能器輸出端面距離(若適用)和換能器投射距離典型值。
若符合免於聲輸出資料公佈條件的,則應在介紹中聲明峯值負聲壓、輸出波束強度、空間峯值時間平均導出聲強符合免於公佈要求的數值並註明其標稱頻率。
3.13 (十三)註冊單元劃分的原則和實例
1.按工作原理不同可分爲模擬設備和數字化設備(採用數字化波束成形技術的設備),模擬設備和數字化設備應按不同註冊單元單獨註冊。
2.按設備主要性能指標和配置可劃分爲
(1)單接口單探頭設備(凸陣);
(2)單接口單探頭設備(線陣);
(3)單接口多探頭或多接口多探頭設備(凸陣、線陣、相控陣等),(3)可覆蓋(1)、(2);
(4)寬頻單接口單探頭設備(線陣);
(5)寬頻單接口單探頭設備(凸陣);
(6)寬頻單接口多探頭或多接口多探頭設備(線陣、凸陣、相控陣等),(6)可覆蓋(4)、(5);
同一工作原理的以上六個註冊單元中,若生產企業同時生產(1)、(2)和(3),則允許將上述三個型號歸入同一註冊單元。若同時生產(4)、(5)和(6),則充許將上述三個型號歸入同一註冊單元。原則上寬頻設備與非寬頻設備不得歸入同一註冊單元。
3.14 (十四)同一註冊單元中典型產品的確定原則
同一註冊單元應按產品風險與技術指標的覆蓋性來選擇典型產品。典型產品應是同一註冊單元內能夠代表本單元內其他產品安全性和有效性的產品,應優先考慮結構最複雜、功能最全、風險最高、技術指標最全的型號。同一註冊單元中,若主要技術指標不能互相覆蓋,則典型產品應爲多個型號。
4 三、審查關注點
(一)關於產品名稱: 採用數字化波束成形技術的設備,產品名稱可以冠以“數字化”字樣。僅爲PC平臺的B型超聲診斷儀,產品名稱不得冠以“數字化”字樣。
(二)關於產品管理類別:原則上頻率範圍在2~7.5 MHz以內,主要採用B型成像方式(可以同時包含M模式)的黑白超聲診斷設備,可以按第二類醫療器械管理。基於多普勒效應的超聲彩色血流成像設備(可以同時包含二維灰階成像部分),按第三類醫療器械管理。
(二)關於產品註冊適用標準:適用GB 10152-1997 的產品,無論其申報註冊的產品標準是否直接採用GB 10152-1997 ,產品性能指標不得低於GB 10152-1997 適用部分。建議編寫註冊產品標準,以準確反映每類產品獨特的技術特徵。
(三)關於型式試驗:產品如分基本配置和選配配置,均應要求申報單位送檢獨立註冊單元中包括基本配置(如標配探頭)和選配配置(如選配探頭)在內的,完整的典型產品。
(四)關於產品的聲輸出參數:型式試驗報告中應有相關內容。符合公佈條件的,申報企業應在產品隨機文件予以完整、正確公佈。產品實際探測深度較深者,尤其應注意產品聲輸出過大的風險。
(五)關於適用範圍:應與機型、配置相一致。聲稱有特殊適用範圍如心功能評價等應提供相應的臨牀試驗資料。
(六)關於臨牀試驗資料:依據《醫療器械註冊管理辦法》附件12,臨牀試驗資料是臨牀評價資料和臨牀試驗(試用/驗證)資料的總稱。
5 B型超聲診斷設備(第二類)產品註冊技術審查指導原則編制說明
5.1 一、指導原則編寫目的
本指導原則旨在指導和規範第二類B型超聲診斷設備的技術審評工作,幫助審評人員理解和掌握該類產品原理/機理、結構、性能、預期用途等內容,把握技術審評工作基本要求和尺度,對產品安全性、有效性作出系統評價。
由於B型超聲診斷技術仍在不斷髮展,審查員仍需從風險分析的角度認真確認申報產品的預期用途與風險管理是否相當;由於我國醫療器械法規框架仍在構建中,審查員仍需密切關注相關法規、標準及超聲技術的最新進展,關注審評產品實際結構組成、功能、預期用途等方面的個性特徵,以保證產品審評符合現行法規安全、有效的要求。
5.2 二、指導原則編寫依據
本指導原則主要依據《醫療器械監督管理條例》、《醫療器械註冊管理辦法》(局令16號)、《醫療器械臨牀試驗規定》(局令5號)、《醫療器械介紹、標籤和包裝標識管理規定》(局令10號)、《醫療器械標準管理辦法》(局令31號)、產品註冊相關規範性文件及相關標準的要求,結合B型超聲診斷設備的特點,制定本指導原則。
5.3 三、指導原則編寫格式
本指導原則正文的編寫大綱主要遵從國家食品藥品監督管理局於2005年9月香山會議確定的編寫大綱進行編制。
5.4 四、指導原則部分內容的編寫說明
本指導原則定稿過程中,相關各方對一些問題尚存不同意見,主要有以下一些:
(一)關於產品名稱:本指導原則未對數字化超聲診斷設備進行定義並單獨分類是基於以下原因:學術界、產業界及管理層對數字化超聲診斷設備的定義尚未達成一致意見。目前已上市的數字化超聲診斷儀(例如:採用數字化波束成形技術或PC平臺的超聲診斷儀)不能從性能指標與傳統意義的超聲診斷設備加以區別。對數字化超聲診斷儀名稱使用的界定,多數意見認爲採用數字化波束成形技術的設備方可稱爲數字化B型超聲診斷儀,但部分意見認爲採用PC平臺的超聲診斷儀也可稱爲B型數字化超聲診斷儀。 本指導原則傾向於第一種意見。
(二)關於作用機理:B型超聲診斷儀爲診斷設備而非治療設備,故本指導原則不包含作用機理部分的內容。
(三)關於產品註冊臨牀試驗資料的要求:按《醫療器械註冊管理辦法》附件12規定,執行GB10152-1997國家標準的B型超聲診斷設備,國內市場上也有同類型產品,可以不要求提供臨牀試驗資料。考慮到技術進步、產品的改進及產品適用範圍的不斷擴大,本指導原則建議用於心功能評價等非常規預期用途的B型超聲診斷設備,仍需提供包括臨牀試驗、臨牀評價在內的相關資料,方可覈准其相關預期用途。
(四)關於產品不良事件歷史記錄:鑑於我國的醫療器械不良事件報告制度正在建立之中,本指導原則暫未列出已經確認的不良事件。
5.5 五、指導原則編寫人員
受國家食品藥品監督管理局委託,江蘇省食品藥品監督管理局醫療器械處承擔本指導原則的編寫工作。