1 拼音
W S / T 6 8 5 — 2 0 2 0 xiāo dú jì yǔ kàng yì jūn jì zhōng kàng zhēn jūn yào wù jiǎn cè fāng fǎ yǔ píng jià yāo qiú
2 英文參考
Analytical method and evaluation requirements of antifungal drugs in disinfectant and antibactertial and bacteriostatic agents
3 基本信息
ICS 11.080
C 50
WS
中華人民共和國衛生行業標準WS/T 685—2020《消毒劑與抗抑菌劑中抗真菌藥物檢測方法與評價要求》(Analytical method and evaluation requirements of antifungal drugs in disinfectant and antibactertial and bacteriostatic agents)由中華人民共和國國家衛生健康委員會於2020年07月20日發佈,自2021年02月01日起實施。
4 發佈通告
關於發佈《消毒試驗用微生物要求》等4項推薦性衛生行業標準的通告
國衛通2020年14號
現發佈《消毒試驗用微生物要求》等4項推薦性衛生行業標準,編號和名稱如下:
WS/T 683—2020消毒試驗用微生物要求
WS/T 684—2020消毒劑與抗抑菌劑中抗菌藥物檢測方法與評價要求
WS/T 685—2020消毒劑與抗抑菌劑中抗真菌藥物檢測方法與評價要求
WS/T 686—2020消毒劑與抗抑菌劑中抗病毒藥物檢測方法與評價要求
上述標準自2021年2月1日起施行。
特此通告。
國家衛生健康委
2020年7月20日
5 前言
本標準按照 GB/T 1.1—2009 給出的規則起草。
本標準起草單位:山東省疾病預防控制中心、中國疾病預防控制中心環境與健康相關產品安全所、山東省青島市食品藥品檢驗研究院、江蘇省疾病預防控制中心、山東省德州市疾病預防控制中心、山東省濟寧市疾病預防控制中心、北京市疾病預防控制中心。
本標準主要起草人:崔樹玉、楊彬、蘇冠民、姜大峯、辛成龍、沈瑾、張流波、盧京光、徐燕、董健、劉鈞、孫惠惠、陳金東、王金燕、朱峯、楊曉、丁曉靜、王萍。
6 標準正文
6.1 1 範圍
本標準規定了消毒劑與抗抑菌劑中抗真菌藥物的檢測方法和評價要求。
本標準適用於消毒劑與抗抑菌劑中灰黃黴素、硝酸益康唑、氟康唑、酮康唑、克黴唑、聯苯苄唑、
硝酸咪康唑、氟胞嘧啶、鹽酸萘替芬及其它抗真菌藥物的測定和評價。
6.2 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅注日期的版本適用於本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
6.3 3 術語和定義
下列術語和定義適用於本文件。
3.1
抗真菌藥物 antifungal drugs
具有抑菌和(或)殺菌特性、用於預防和治療真菌性感染的藥物,包括抗真菌藥物和按處方藥物管理的化學合成藥物。
6.4 4 檢測方法
6.4.1 4.1 原理
樣品經1%甲酸乙腈超聲提取後,膏霜劑型樣品需經N-丙基乙二胺淨化,其他劑型樣品不需淨化,用超高效液相色譜-串聯質譜儀測定,外標法定量。
6.4.2 4.2 試劑和材料
除非另有說明,所用試劑均爲色譜純,實驗用水爲GB/T 6682規定的一級水。
4.2.1 試劑
4.2.1.1 乙腈(CH3CN)。
4.2.1.2 甲酸(HCOOH)。
4.2.1.3 N-丙基乙二胺(C5H14N2)。
4.2.2 試劑配製
4.2.2.1 0.1%甲酸水溶液:取甲酸 1.0 mL,用水定容至 1000 mL,混勻。
4.2.2.2 1%甲酸水溶液:取甲酸 10.0 mL,用水定容至 1000 mL,混勻。
4.2.2.3 0.1%甲酸乙腈溶液:取甲酸 1.0 mL,用乙腈定容至 1000 mL,混勻。
4.2.2.4 1%甲酸乙腈溶液:取甲酸 10.0 mL,用乙腈定容至 1000 mL,混勻。
4.2.2.5 0.1%甲酸乙腈水溶液:取乙腈 300 mL,加入甲酸 1.0 mL,用水定容至 1000 mL,混勻。
4.2.3 標準品
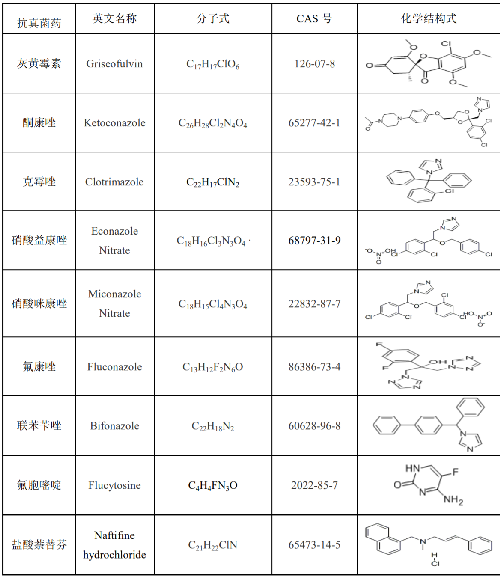
灰黃黴素、酮康唑、克黴唑、硝酸益康唑、硝酸咪康唑、氟康唑、聯苯苄唑、氟胞嘧啶、鹽酸萘替芬純度均大於98.5%或經國家認證並授予標準物質證書的標準物質,其他相關信息參見附錄A。
4.2.4 標準溶液配製
4.2.4.1 標準儲備液(1000 μg/mL):分別準確稱取標準品 50.0 mg(精確至 0.1 mg),用少量乙腈溶解後,轉移至 50 mL 容量瓶中,加乙腈使溶解並定容至刻度,混勻,即配製成質量濃度爲 1000 μg/mL的標準儲備液,-20℃±2℃冷凍保存,有效期 3 個月。
4.2.4.2 混合標準中間液:取上述標準儲備液適量,用乙腈配置成酮康唑質量濃度爲 10 μg/mL、氟胞嘧啶質量濃度爲 5 μg/mL、氟康唑、灰黃黴素、聯苯苄唑質量濃度爲 1 μg/L、硝酸益康唑、硝酸咪康唑、鹽酸萘替芬和克黴唑質量濃度爲 0.5 μg/mL 的混合標準中間液,冷藏避光保存,有效期 1 個月。
4.2.4.3 混合標準系列溶液:吸取不同體積的混合標準中間液,用空白樣品提取液配製成適當質量濃度的標準工作溶液,酮康唑的質量濃度爲 10 μg/L、25 μg/L、50 μg/L、100 μg/L、150 μg/L、200 μg/L,氟胞嘧啶的質量濃度爲 5 μg/L、12.5 μg/L、25 μg/L、50 μg/L、75 μg/L、100 μg/L,氟康唑、灰黃黴素、聯苯苄唑的質量濃度爲 1 μg/L、2.5 μg/L、5 μg/L、10 μg/L、15 μg/L、20 μg/L,硝酸益康唑、硝酸咪康唑、鹽酸萘替芬和克黴唑的質量濃度爲 0.5 μg/L、1.25 μg/L、2.5 μg/L、5 μg/L、7.5 μg/L、10 μg/L,臨用現配。
4.2.5 材料
有機系濾膜:孔徑爲0.22 μm。
6.4.3 4.3 儀器和設備
4.3.1 超高效液相色譜-串聯質譜儀:帶電噴霧離子源(ESI 源)。
4.3.3 離心機:轉速≥9000 r/min。
4.3.4 渦旋混合器。
4.3.5 超聲波清洗器。
6.4.4 4.4 分析步驟
6.4.4.1 4.4.1 樣品前處理
稱取0.5 g(精確至1 mg)試樣置於15 mL離心管中,加入8.0 mL 1%甲酸乙腈,渦旋1 min,加入50 mgN-丙基乙二胺,超聲提取30 min,離心(9000 r/min)5 min,將上清液轉移至10 mL容量瓶,1%甲酸乙腈定容至刻度。混勻後取1.0 mL置於10 mL容量瓶,用0.1%甲酸乙腈水溶液定容至刻度,混勻後轉移至離心管,離心(9000r/min)5 min,取上清液經濾膜過濾後備用。
稱取0.5 g(精確至1 mg)試樣置於15mL離心管中,加入8.0 mL 1%甲酸乙腈,渦旋1 min,超聲提取30 min,離心(9000 r/min)5 min,將上清液轉移至10 mL容量瓶,1%甲酸乙腈定容至刻度。混勻後取1.0 mL置於10 mL容量瓶,用初始流動相定容至刻度,混勻後轉移至離心管,離心(9000 r/min)5 min,取上清液經濾膜過濾後備用。
6.4.4.2 4.4.2 樣品測定
4.4.2.1 液相色譜參考條件
液相色譜參考條件如下:
a) 色譜柱:C18柱(柱長 100 mm,內徑爲 2.1 mm,粒徑爲 1.7 μm),或相當者;
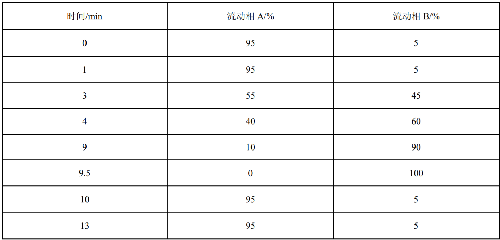
b) 流動相:A 相爲 0.1%甲酸水溶液,B 相爲 1%甲酸乙腈溶液;
c) 流速:0.3 mL/min;
d) 柱溫:30℃;
e) 進樣體積:2 μL;
4.4.2.2 質譜參考條件
質譜參考條件如下:
a) 電離方式:ESI+;
b) 離子源溫度:150℃;
c) 毛細管電壓:3.0 kV;
d) 脫溶劑氣溫度:400℃;
e) 脫溶劑氣(N2)流量:800 L/h;
f) 錐孔氣(N2)流量:150 L/h;
h) 其他質譜參數:見附錄 C。
4.4.2.3 標準曲線的製作
將混合標準系列溶液,按質量濃度由低到高依次進樣注入液相色譜串聯質譜儀中,測得相應的峯面積。以各抗真菌藥物標準工作溶液的質量濃度爲橫座標,以各抗真菌藥物的峯面積爲縱座標,繪製標準曲線。以離子對定性,採用外標法進行定量分析,標準圖譜參見附錄D。
4.4.2.4 定性測定
在相同測試條件下,試樣中目標化合物色譜峯的保留時間與相應標準色譜峯的保留時間相比較,變化範圍在±2.5%以內,且檢測到的相對離子丰度,應與質量濃度相當的標準溶液中相對離子丰度一致,其相對離子丰度比偏差應符合表1要求。
表1 相對離子丰度的最大允許偏差
| 相對離子丰度/% | >50 | >20~≤50 | >10~≤20 | ≤10 |
| 允許的最大偏差/% | ±20 | ±25 | ±30 | ±50 |
4.4.2.5 定量測定
按照外標法進行定量計算,標準溶液和試樣溶液中抗真菌藥物的響應值均應在儀器線性響應範圍內。如果濃度超過標準曲線範圍,應稀釋到合適質量濃度後分析。
將試樣溶液進樣注入液相色譜-串聯質譜儀中,以保留時間和兩對離子(特徵離子對/定量離子對)所對應的色譜峯面積相對丰度進行定性,根據標準曲線計算試樣溶液中目標化合物的質量濃度。
6.4.4.3 4.4.3 空白試驗
6.4.4.4 4.4.4 結果計算和表述

式中:
X——試樣中目標化合物的含量,單位爲微克每千克(μg/kg);
ρ——由標準曲線計算出的試樣溶液中目標化合物的質量濃度,單位爲微克每升(μg/L);
K——稀釋倍數;
m——樣品稱樣量,單位爲克(g)。
計算結果保留三位有效數字。
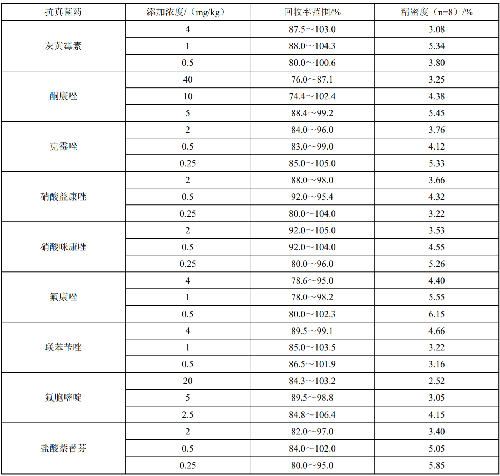
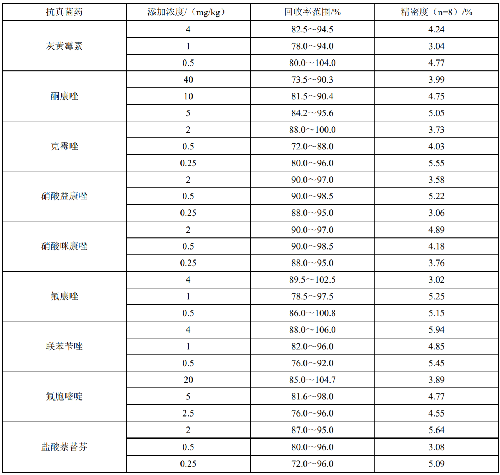
6.4.4.5 4.4.5 精密度
在重複性條件下獲得的兩次獨立測定結果的絕對差值不應超過算術平均值的15%。本方法的回收率
和精密度見附件E。
6.4.4.6 4.4.6 檢出限和定量限
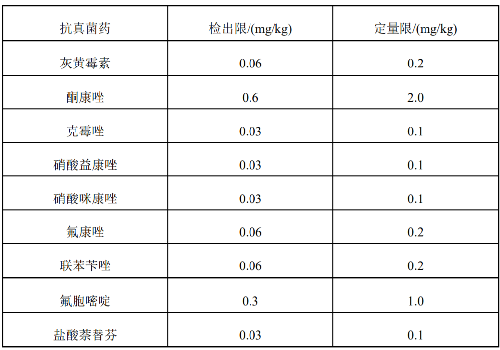
當取樣量爲0.5 g,定量體積爲10 mL時,本方法的檢出限和定量限見附件F。
6.5 5 其他抗真菌藥物的檢測方法
《中華人民共和國藥典》未涵蓋的抗真菌藥物的檢測方法。可參考文獻報道的方法,通過認證後方可使用。
6.6 6 評價要求
6.2 消毒劑與抗抑菌劑中灰黃黴素、酮康唑、克黴唑、硝酸益康唑、硝酸咪康唑、氟康唑、聯苯苄唑、氟胞嘧啶、鹽酸萘替芬含量或總量均不應超過 100 mg/kg。
7 附錄
7.1 附錄A(資料性附錄)標準品相關信息
7.2 附錄B(規範性附錄)超高效液相色譜梯度洗脫程序
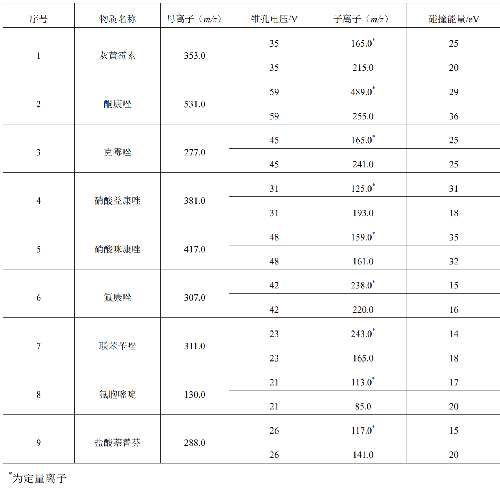
7.3 附錄C(規範性附錄)質譜參考條件
質譜參考條件見C.1。
表C.1 質譜參考條件
7.4 附錄D(資料性附錄)
參考圖譜
參考圖譜見圖D.1。
說明:
1——灰黃黴素(3.89min);
2——酮康唑(3.83min);
3——硝酸咪康唑(5.69min);
4——硝酸益康唑(5.02min);
5——聯苯苄唑(4.41min);
6——氟康唑(2.96min);
7——鹽酸萘替芬(4.13min);
8——克黴唑(4.32min);
9——氟胞嘧啶(0.80min)。

圖C.1 參考圖譜
7.5 附錄E(規範性附錄)回收率與精密度
7.6 附錄F(規範性附錄)方法檢出限和定量限