2 附錄XVIII A 中藥質量標準分析方法
2.1 驗證指導原則
中藥質量標準分析方法驗證的目的是證明採用的方法是否適合於相應檢測要求。在建立中藥質量標準時,分析方法需經驗證;在處方、工藝等變更或改變原分析方法時,也需對分析方法進行驗證。方法驗證過程和結果均應記載在藥品質量標準起草說明或修訂說明中。
需驗證的分析項目有:鑑別試驗、限量檢查和含量測定,以及其他需控制成分(如殘留物、添加劑等)的測定。中藥製劑溶出度、釋放度等檢查中,其溶出量等檢測方法也應作必要驗證。驗證內容有:準確度、精密度(包括重複性、中間精密度和重現性)、專屬性、檢測限、定量限、線性、範圍和耐用性。應視具體方法擬訂驗證的內容。附表中列出的分析項目和相應的驗證內容可供參考。
2.1.1 一、準確度
準確度係指用該方法測定的結果與真實值或參考值接近的程度,一般用回收率(%)表示。準確度應在規定的範圍內測試。用於定量測定的分析方法均需做準確度驗證。
2.1.1.1 1.測定方法的準確度
可用已知純度的對照品做加樣回收測定,即於已知被測成分含量的供試品中再精密加入一定量的已知純度的被測成分對照品,依法測定。用實測值與供試品中含有量之差,除以加入對照品量計算回收率。
在加樣回收試驗中須注意對照品的加入量與供試品中被測成分含有量之和必須在標準曲線線性範圍之內;加入的對照品的量要適當,過小則引起較大的相對誤差,過大則干擾成分相對減少,真實性差。
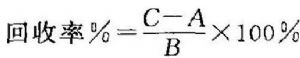
式中 A爲供試品所含被測成分量;B爲加入對照品量;
C爲實測值。
2.1.1.2 2.數據要求
在規定範圍內,取同一濃度的供試品,用6個測定結果進行評價;或設計3個不同濃度,每個濃度各分別製備3份供試品溶液進行測定,用9個測定結果進行評價,一般中間濃度加入量與所取供試品含量之比控制在1:1左右。應報告供試品取樣量、供試品中含有量、對照品加入量、測定結果和回收率(%)計算值,以及回收率(%)的相對標準偏差(RSD%)或可信限。
2.1.2 二、精密度
精密度係指在規定的測試條件下,同一個均勻供試品,經多次取樣測定所得結果之間的接近程度。精密度一般用偏差、標準偏差或相對標準偏差表示。
在相同操作條件下,由同一個分析人員在較短的間隔時間內測定所得結果的精密度稱爲重複性;在同一個實驗室,不同時間由不同分析人員用不同設備測定結果之間的精密度稱爲中間精密度;在不同實驗室由不同分析人員測定結果之間的精密度稱爲重現性。
2.1.2.1 1.重複性
在規定範圍內,取同一濃度的供試品,用6個測定結果進行評價;或設計3個不同濃度,每個濃度各分別製備3份供試品溶液進行測定,用9個測定結果進行評價。
2.1.2.2 2.中間精密度
爲考察隨機變動因素對精密度的影響,應進行中間精密度試驗。變動因素爲不同日期、不同分析人員、不同設備等。
2.1.2.3 3.重現性
當分析方法將被法定標準採用時,應進行重現性試驗。例如建立藥典分析方法時通過不同實驗室的複覈檢驗得出重現性結果。複覈檢驗的目的、過程和重現性結果均應記載在起草說明中。應注意重現性試驗用的樣品本身的質量均勻性和貯存運輸中的環境影響因素,以免影響重現性結果。
2.1.2.4 4.數據要求
均應報告標準偏差、相對標準偏差或可信限。
2.1.3 三、專屬性
專屬性係指在其他成分可能存在下,採用的方法能正確測定出被測成分的特性。鑑別試驗、限量檢查、含量測定等方法均應考察其專屬性。
2.1.3.1 1.鑑別試驗
應能與可能共存的物質或結構相似化合物區分。不含被測成分的供試品,以及結構相似或組分中的有關化合物,均不得干擾測定。顯微鑑別、色譜及光譜鑑別等應附相應的代表性圖像或圖譜。
2.1.3.2 2.含量測定和限量檢查
以不含被測成分的供試品(除去含待測成分藥材或不含待測成分的模擬複方)試驗說明方法的專屬性。色譜法、光譜法等應附代表性圖譜,並標明相關成分在圖中的位置,色譜法中的分離度應符合要求。必要時可採用二極管陣列檢測和質譜檢測,進行峯純度檢查。
2.1.4 四、檢測限
檢測限係指供試品中被測物能被檢測出的最低量。確定檢測限常用的方法如下。
2.1.4.1 1.直觀法
用一系列已知濃度的供試品進行分析,試驗出能被可靠地檢測出的最低濃度或量。
2.1.4.2 2.信噪比法
僅適用於能顯示基線噪聲的分析方法,即把已知低濃度供試品測出的信號與空白樣品測出的信號進行比較,算出能被可靠地檢測出的最低濃度或量。一般以信噪比爲3:1或2:1時相應濃度或注入儀器的量確定檢測限。
2.1.4.3 3.數據要求
應附測試圖譜,說明測試過程和檢測限結果。
2.1.5 五、定量限
定量限係指供試品中被測成分能被定量測定的最低量,其測定結果應具一定準確度和精密度。用於限量檢查的定量測定的分析方法應確定定量限。
常用信噪比法確定定量限。一般以信噪比爲10:1時相應濃度或注入儀器的量進行確定。
2.1.6 六、線性
線性係指在設計的範圍內,測試結果與供試品中被測物濃度直接呈正比關係的程度。
應在規定的範圍內測定線性關係。可用一貯備液經精密稀釋,或分別精密稱樣,製備一系列供試品的方法進行測定,至少製備5個濃度的供試品。以測得的響應信號作爲被測物濃度的函數作圖,觀察是否呈線性,再用最小二乘法進行線性迴歸。必要時,響應信號可經數學轉換,再進行線性迴歸計算。數據要求:應列出迴歸方程、相關係數和線性圖。
2.1.7 七、範圍
範圍係指能達到一定精密度、準確度和線性,測試方法適用的高低限濃度或量的區間。
範圍應根據分析方法的具體應用和線性、準確度、精密度結果及要求確定。對於有毒的、具特殊功效或藥理作用的成分,其範圍應大於被限定含量的區間。溶出度或釋放度中的溶出量測定,範圍應爲限度的±20%。
2.1.8 八、耐用性
耐用性係指在測定條件有小的變動時,測定結果不受影響的承受程度,爲使方法用於常規檢驗提供依據。開始研究分析方法時,就應考慮其耐用性。如果測試條件要求苛刻,則應在方法中寫明。典型的變動因素有:被測溶液的穩定性,樣品提取次數、時間等。液相色譜法中典型的變動因素有:流動相的組成比例或pH值,不同廠牌或不同批號的同類型色譜柱,柱溫,流速及檢測波長等。氣相色譜法變動因素有:不同廠牌或批號的色譜柱、固定相,不同類型的擔體,柱溫,進樣口和檢測器溫度等。薄層色譜的變動因素有:不同廠牌的薄層板,點樣方式及薄層展開時溫度及相對溼度的變化等。
經試驗,應說明小的變動能否通過設計的系統適用性試驗,以確保方法有效。
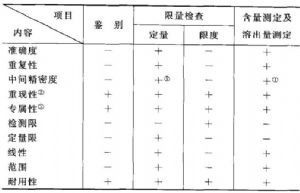
③重現性只有在該分析方法將被法定標準採用時做。③如一種方法不夠專屬,可用其他分析方法予以補充。上表中列舉了在不同類型的分析方法驗證中被認爲是最
重要的項目,“-”表示通常不需要驗證的項目,“+”表示通常需要驗證的項目,如遇特殊情況,仍應根據具體分析對象和情況而定。
3 附錄XVIII B 中藥注射劑安全性檢查法應用指導原則
本指導原則爲中藥注射劑臨牀使用的安全性和製劑質量可控性而定。
中藥注射劑安全性檢查包括熱原(或細菌內毒素)、異常毒性、降壓物質、過敏反應物質、溶血與凝聚等項。根據處方、工藝、用法及用量等設定相應的檢查項目並進行適用性研究。
3.1 一、中藥安全性檢查項目的設定
靜脈用注射劑 應設熱原(或細菌內毒素)、異常毒性、過敏反應、溶血與凝聚等安全性檢查項,除功能主治中具有與降血壓相關內容的注射劑外,還應考慮設降壓物質檢查項。
由於中藥注射劑中致人體發熱成分和干擾細菌內毒素檢查法的因素複雜多變,一般首選熱原檢查項,但若該藥本身的藥理作用或對家兔的毒性反應影響熱原檢測,可選擇細菌內毒素檢查項。
3.2 二、安全性檢查方法和檢查限值確定
檢查方法和檢查限值可按以下各項目內容要求進行研究。研究確定限值後,至少應進行3批以上供試品的檢查驗證。
3.2.1 1.熱原或細菌內毒素檢查
本法系利用家兔(或鱟試劑)測定供試品所含的熱原(或細菌內毒素)的限量是否符合規定。不合格供試品在臨牀應用時可產生熱原反應而造成嚴重的不良後果。
3.2.1.1 檢查方法
參照熱原檢查法(2010年版藥典一部附錄XIII A)或細菌內毒素檢查法(2010年版藥典一部附錄XIII D)。
3.2.1.2 設定限值前研究
熱原檢查應做適用性研究,求得對家兔無毒性反應、不影響正常體溫和無解熱作用劑量;細菌內毒素檢查應進行干擾試驗,求得最大無干擾濃度。
3.2.1.3 設定限值
熱原和細菌內毒素檢查的限值根據臨牀1小時內最大用藥劑量計算。熱原檢查限值可參照臨牀劑量計算,一般爲人用每千克體重每小時最大供試品劑量的3~5倍,供試品注射體積每千克體重一般不少於0.5ml,不超過10ml。細菌內毒素檢查限值按規定要求計算,根據藥品和適應症(如抗感染、抗腫瘤、心血管藥等急重病症用藥、兒童老人用藥、複合用藥、大輸液等)的不同,限值可適當嚴格,至計算值的1/3~1/2,以保證安全用藥。
熱原限值劑量應不影響正常體溫,細菌內毒素測定濃度應無干擾反應。如有干擾或影響,可在品種項下增加稀釋濃度、調節pH和滲透壓或緩慢注射等排除干擾或影響的特殊規定。
3.2.2 2.異常毒性檢查
本法系將一定量的供試品溶液注入小鼠體內,規定時間內觀察小鼠出現的死亡情況,以判定供試品是否符合規定。供試品的不合格表明藥品中混有超過藥物本身毒性的毒性雜質,臨牀用藥將可能增加急性不良反應。
3.2.2.1 檢查方法
參照異常毒性檢查法(2010年版藥典一部附錄XIII E)。
3.2.2.2 設定限值前研究
參考文獻數據並經單次靜脈注射給藥確定該注射劑的急性毒性數據(LD50或LD、及其可信限)。有條件時,由多個實驗室或多種來源動物試驗求得LD50和LD1數據。注射速度0.1ml/s,觀察時間爲72小時。如其他給藥途徑或延長觀察時間,應進行相應途徑或相應觀察時間的急性毒性試驗。
3.2.2.3 設定限值
異常毒性檢查的限值應低於該注射劑本身毒性的最低致死劑量,考慮到實驗室間差異、動物反應差異和製劑的差異,建議限值至少應小於LD1可信限下限的1/3(建議採用1/3~1/6),如難以計算得最低致死量,可採用小於LD50。可信限下限的1/4(建議採用1/4~1/8)。如半數致死量與臨牀體重劑量之比小於20可採用LD50可信限下限的1/4或LD1可信限下限的1/3。靜脈注射最大劑量0.8ml/20g仍未見毒性反應或死亡,可以此作爲檢查限值。
如對動物、給藥途徑和給藥次數、觀察指標和時間等方法和限值有特殊要求時應在品種項下另作規定。
3.2.3 3.降壓物質檢查
本法系通過靜脈注射限值劑量供試品,觀察對麻醉貓的血壓反應,以判定供試品中所含降壓物質的限值是否符合規定。供試品的不合格表明藥品中含有限值以上的影響血壓反應的物質,臨牀用藥時可能引起急性降壓不良反應。
3.2.3.1 檢查方法
參照降壓物質檢查法(2010年版藥典一部附錄XIII F)。
3.2.3.2 設定限值前研究
供試品按一定注射速度靜脈注射不同劑量後(供試品溶液與組胺對照品溶液的注射體積一般應相同,通常爲0.2~1ml/kg),觀察供試品對貓血壓反應的劑量反應關係,求得供試品降壓物質檢查符合規定的最大劑量(最大無降壓反應劑量)。
3.2.3.3 設定限值
一般以臨牀單次用藥劑量的1/5~5倍作爲降壓反應物質檢查劑量限值,急重病症用藥儘可能採用高限。
特殊情況下,如供試品有一定降壓作用,則可按最大無降壓反應劑量的1/2~1/4作爲限值劑量;供試品原液靜脈注射1ml/kg劑量未見降壓反應,該劑量可作爲給藥限值。
3.2.4 4.過敏反應檢查
本法系將一定量的供試品皮下或腹腔注射入豚鼠體內致敏,間隔一定時間後靜脈注射供試品進行激發,觀察豚鼠出現過敏反應的情況,以此判定供試品是否符合規定。供試品不合格表明注射劑含有過敏反應物質,臨牀用藥時可能使患者致敏或產生過敏反應,引起嚴重不良反應。
3.2.4.1 檢查方法
3.2.4.2 設定限值前研究
測定供試品對豚鼠腹腔(或皮下)和靜脈給藥的無毒性反應劑量。必要時,可採用注射劑的半成品原輔料進行致敏和激發研究,確定致敏方式和次數,在首次給藥後14、21、28天中選擇最佳激發時間。
3.2.4.3 設定限值
致敏和激發劑量應小於該途徑的急性毒性反應劑量,適當參考臨牀劑量。一般激發劑量大於致敏劑量。常用腹腔或鼠鼷部皮下注射途徑致敏,每次每隻0.5ml,每隻1ml靜脈注射激發。如致敏劑量較小,可適當增加致敏次數,方法和限值的特殊要求應在品種項下規定。
3.2.5 5.溶血與凝聚檢查
本法系將一定量供試品與2%兔紅細胞混懸液混合,溫育一定時間後,觀察其對紅細胞的溶血與凝聚反應以判定供試品是否符合規定。
3.2.5.1 檢查方法
參照溶血與凝聚檢查法(2010年版藥典一部附錄XIII H)。
3.2.5.2 設定限值前研究
對注射劑原液和稀釋液進行溶血與凝聚實驗研究,指標除目測外可增加比色法和顯微鏡下觀察的方法,同時觀察溶血和凝聚,確定無溶血和凝聚的最大濃度。
3.2.5.3 設定限值
4 附錄XVIII C 中藥生物活性測定指導原則
生物活性測定法是以藥物的生物效應爲基礎,以生物統計爲工具,運用特定的實驗設計,測定藥物有效性的一種方法,從而達到控制藥品質量的作用。其測定方法包括生物效價測定法和生物活性限值測定法。
中藥的藥材來源廣泛、多變,製備工藝複雜,使得中藥製劑的質量控制相對困難,此外,中藥含有多種活性成分和具有多種藥理作用,因此,僅控制少數成分不能完全控制其質量和反映臨牀療效。爲了使中藥的質量標準能更好地保證每批藥品的臨牀使用安全有效,有必要在現有含量測定的基礎上增加生物活性測定,以綜合評價其質量。
本指導原則的目的是規範中藥生物活性測定研究,爲該類研究的實驗設計、方法學建立等過程和測定方法的適用範圍提供指導性的原則要求。
4.1 基本原則
4.1.1 符合藥理學研究基本原則
建立的生物活性測定方法應符合藥理學研究的隨機、對照、重複的基本原則;具備簡單、精確的特點;應有明確的判斷標準。
4.1.2 體現中醫藥特點
鼓勵應用生物活性測定方法探索中藥質量控制,擬建立的方法的測定指標應與該中藥的“功能與主治”相關。
4.1.3 品種選擇合理
擬開展生物活性測定研究的中藥材、飲片、提取物或中成藥應功能主治明確,其中,優先考慮適應症明確的品種,對中藥注射劑、急重症用藥等應重點進行研究。
4.1.4 方法科學可靠
優先選用生物效價測定法,不能建立生物效價測定的品種可考慮採用生物活性限值測定法,待條件成熟後可進一步研究採用生物效價測定法。
4.2 基本內容
4.2.1 1.實驗條件
4.2.1.1 試驗系選擇
生物活性測定所用的試驗系,包括整體動物、離體器官、血清、微生物、組織、細胞、亞細胞器、受體、離子通道和酶等。試驗系的選擇與試驗原理和測定指標密切相關,應選擇背景資料清楚、影響因素少、檢測指標靈敏和成本低廉的試驗系統。應儘可能研究各種因素對試驗系的影響,採取必要的措施對影響因素進行控制。
如採用實驗動物,儘可能使用小鼠和大鼠等來源多,成本低的實驗動物,並說明其種屬、品系、性別和年齡。實驗動物的使用,應遵循“優化、減少、替代”的“3R”原則。
4.2.1.2 供試品選擇
應選擇工藝穩定,質量合格的供試品。若爲飲片,應基源清楚。應至少使用3批供試品。
4.2.1.3 標準品或對照品選擇
如採用生物效價測定法,應有基本同質的標準品以測定供試品的相對效價,標準品的選擇應首選中藥標準品,也可以考慮化學藥作爲標準品。如採用生物活性限值測定法,可採用中藥成分或化學藥品作爲方法可靠性驗證用對照品。採用標準品或對照品均應有理論依據和/或實驗依據。國家標準中採用的標準品或對照品的使用應符合國家有關規定要求。
4.2.2 2.實驗設計
4.2.2.1 設計原理
所選實驗方法的原理應明確,所選擇的檢測指標應客觀、專屬性強,能夠體現供試品的功能與主治或藥理作用。
4.2.2.2 設計類型
如採用生物效價測定法,應按中國藥典二部附錄生物檢定統計法(2010年版藥典一部附錄Ⅺ V)的要求進行實驗設計研究;如採用生物活性限值測定法,試驗設計可考慮設供試品組、陰性對照組或陽性對照組,測定方法使用動物模型時,應考慮設置模型對照組。重現性好的試驗,也可以不設或_僅在複試時設陽性對照組。
4.2.2.3 劑量設計
如採用生物效價測定法,供試品和標準品均採用多劑量組試驗,並按生物檢定的要求進行合理的劑量設計,使不同劑量之間的生物效應有顯著性差異。如採用生物活性限值測定法,建議只設一個限值劑量,限值劑量應以產生生物效應爲宜;但在方法學研究時,應採用多劑量試驗,充分說明標準中設定限值劑量的依據。
4.2.2.4 給藥途徑
一般應與臨牀用藥途徑一致。如採用不同的給藥途徑,應說明理由。
4.2.2.5 給藥次數
根據藥效學研究合理設計給藥次數,可採用多次或單次給藥。
4.2.2.6 指標選擇
4.2.3 3.結果與統計
試驗結果評價應符合生物統計要求。生物效價測定法應符合中國藥典二部附錄生物檢定統計法(2010年版藥典二部附錄Ⅺ V)的要求,根據樣品測定結果的變異性決定效價範圍和可信限率(FL%)限值;生物活性限值測定法,應對誤差控制進行說明,明確試驗成立的判定依據,對結果進行統計學分析,並說明具體的統計方法和選擇依據。
4.2.4 4.判斷標準
生物效價測定,應按品種的效價範圍和可信限率(FL%)限值進行結果判斷。生物活性限值測定,應在規定的限值劑量下判定結果,初試結果有統計學意義者,可判定爲符合規定;初試結果沒有統計學意義者,可增加樣本數進行一次複試,複試時應增設陽性對照組,複試結果有統計學意義,判定爲符合規定,否則爲不符合規定。
4.3 方法學驗證
4.3.1 1.測定方法影響因素考察
應考察測定方法的各種影響因素,通過考察確定最佳的試驗條件,以保證試驗方法的專屬性和準確性。根據對影響因素考察結果,規定方法的誤差控制限值或對統計有效性進行說明。
4.3.2 2.精密度考察
4.3.2.1 重複性
按確定的測定方法,至少用3批供試品、每批3次或同批供試品進行6次測定試驗後對結果進行評價。生物活性測定試驗結果判斷應基本一致。
4.3.2.2 中間精密度
考察實驗室內部條件改變(如不同人員、不同儀器、不同工作日和實驗時間)對測定結果的影響,至少應對同實驗室改變人員進行考察。
4.3.2.3 重現性
生物活性測定試驗結果必須在3家以上實驗室能夠重現。
4.3.3 3.方法適用性考察
5 附錄XVIII D 抑菌劑效力檢查法指導原則
抑菌劑效力檢查法系用於測定滅菌、非滅菌製劑中抑菌劑的活性,以評價最終產品的抑菌效力,同時也可用於指導生產企業在研發階段製劑中抑菌劑濃度的確定。
如果藥物本身不具有充分的抗菌活性,那麼應根據製劑特性(如水溶液製劑)添加適宜的抑菌劑,以防止製劑在正常貯藏和使用過程中可能發生的微生物污染和繁殖使藥物發生變質而對使用者造成危害,尤其是多劑量包裝的製劑。
在藥品生產過程中,抑菌劑不能用於替代藥品生產的GMP管理,不能作爲非滅菌製劑降低微生物污染的唯一途徑,也不能作爲控制多劑量包裝製劑滅菌前的生物負載的手段。
所有抑菌劑都具有一定的毒性,製劑中抑菌劑的量應爲最低有效量。同時,爲保證用藥安全,最終包裝容器中的抑菌劑有效濃度應低於對人體有害的濃度。
在製劑通則中要求具有抗菌活性的製劑,不管是添加的抑菌劑,還是藥物本身具有抗菌活性,在藥物研發階段,均應確認其抗菌效力。抑菌劑的抗菌效力在貯存過程中有可能因藥物的成分或包裝容器等因素影響而提高或降低,因此,應驗證最終容器中的抑菌劑效力在效期內不因貯藏條件而降低。本試驗方法和抑菌劑抑菌效力判斷標準用於包裝未啓開的成品製劑。
5.1 產品分類
進行本試驗的藥品分爲四類(見表1),以便標準的制定和執行。
5.2 培養基
5.2.1 培養基的製備
5.2.1.1 1.胰酪腖大豆肉湯培養基(TSB)
酪蛋白腖17.0g 磷酸二氫鉀2.5g大豆木瓜蛋白酶消化物3.0g 氯化鈉5.0g葡萄糖2.5g 水1000ml除葡萄糖外,取上述成分混合,微溫溶解,調pH值約7.0,煮沸,加入葡萄糖溶解後,搖勻,濾清,調節pH值使滅菌後爲7.3±0.2,分裝,滅菌。
5.2.1.2 2.胰酪腖大豆瓊脂培養基(TSA)
胰酪腖15.0g、氯化鈉5.0g、大豆木瓜蛋白酶水解物5.0g、瓊脂15.0g、純化水1000ml
除瓊脂外,取上述成分,混合,微溫溶解,調節pH值使滅菌後在25℃的pH值爲7.3±0.2,加入瓊脂,加熱溶化後,搖勻,分裝,滅菌。[1]
5.2.1.3 3.沙氏葡萄糖液體培養基、沙氏葡萄糖瓊脂培養基
照微生物限度檢查法(附錄XIII C)製備。
5.2.2 培養基的適用性檢查
5.2.2.1 抑菌劑效力測定
用培養基應進行培養基的適用性檢查,包括成品培養基、由脫水培養基或按處方配製的培養基均應檢查。菌種 試驗所用的菌株傳代次數不得超過5代(從菌種保藏中心獲得的冷凍乾燥菌種爲第0代),並採用適宜的菌種保藏技術進行保存,以保證試驗菌株的生物學特性。
銅綠假單胞菌(Pseudomonas aeruginosa)[CMCC(B)10 104]
大腸埃希菌(Escherichia coli)[CMCC(B) 44 102]
金黃色葡萄球菌(Staphylococcus aureus)[CMCC(B)26 003]
白色念珠菌(Candida albicans)[CMCC(F)98 001]
黑麴黴(Aspergillus niger)CCMCC(F) 98 003]
5.2.2.2 菌液製備
接種大腸埃希菌、金黃色葡萄球菌、銅綠假單胞菌的新鮮培養物至胰酪腖大豆肉湯培養基中,30~35℃培養18~24小時;接種白色念珠菌的新鮮培養物至沙氏葡萄糖液體培養基中,20~25℃培養24~48小時。上述培養物用0.9%無菌氯化鈉溶液製成每1ml含菌數爲50~100cfu的菌懸液。接種黑麴黴的新鮮培養物至沙氏葡萄糖瓊脂斜面培養基中,20~25℃培養5~7天,加入3~5ml含0.05%(ml/ml)聚山梨酯80的0.9%無菌氯化鈉溶液,將孢子洗脫。然後,用適宜方法吸出孢子懸液至無菌試管內,用含0.05%(ml/ml)聚山梨酯80的0.9%無菌氯化鈉溶液製成每1ml含孢子數50~100cfu的孢子懸液。
菌液製備後若在室溫下放置,應在2小時內使用;若保存在2~8℃,可在24小時內使用。黑麴黴孢子懸液可保存在2~8℃,在驗證過的貯存期內使用。
5.2.2.3 適用性檢查
取大腸埃希菌、金黃色葡萄球菌、銅綠假單胞菌各50~100cfu,分別注入無菌平皿中,立即傾注胰酪腖大豆瓊脂培養基,每株試驗菌平行製備2個平皿,混勻,凝固,置30~35℃培養48小時,計數;取白色念珠菌、黑麴黴各50~100cfu,分別注入無菌平皿中,立即傾注沙氏葡萄糖瓊脂培養基,每株試驗菌平行製備2個平皿,混勻,凝固,置20~25℃培養72小時,計數;同時,用對應的對照培養基替代被檢培養基進行上述試驗。
5.2.2.4 結果判定
若被檢培養基上的菌落平均數不小於對照培養基上菌落平均數的70%,且菌落形態大小與對照培養基上的菌落一致,判該培養基的適用性檢查符合規定。
5.3 抑菌劑效力測定
5.3.1 菌種
同培養基的適用性檢查,若需要,製劑中常見的污染微生物也可作爲試驗菌株。
5.3.2 菌液製備
接種銅綠假單胞菌、金黃色葡萄球菌、大腸埃希菌的新鮮培養物至胰酪腖大豆肉湯培養基或胰酪腖大豆瓊脂培養基中,30~35℃培養18~24小時;接種白色念珠菌於沙氏葡萄糖液體培養基或沙氏葡萄糖瓊脂培養基中,20~25℃培養24~48小時。若爲瓊脂培養物,加入適量的0.9%無菌氯化鈉溶液將瓊脂表面的培養物洗脫,然後,用適宜方法吸出菌懸液至無菌試管內,加入適量的0.9%無菌氯化鈉溶液並採用比濁法製成每1ml含菌數約爲108cfu的菌懸液。若爲液體培養物,用離心法收集菌體,並用0.9%無菌氯化鈉溶液沖洗,採用比濁法製成每1ml含菌數約爲108cfu的菌懸液。接種黑麴黴的新鮮培養物至沙氏葡萄糖瓊脂培養基中,23~28℃培養5~7天,加入3~5ml含0.05%(ml/ml)聚山梨酯80的0.9%無菌氯化鈉溶液,將孢子洗脫,然後,用適宜方法吸出孢子懸液至無菌試管內,加入適量的含0.05%(ml/ml)聚山梨酯80的0.9%無菌氯化鈉溶液並採用比濁法製成每1ml含孢子數108cfu的孢子懸液。同時採用平皿法測定1ml菌懸液的菌數。
菌液製備後若在室溫下放置,應在2小時內使用;若保存在2~8℃,可在24小時內使用。黑麴黴的孢子懸液可保存在2~8℃,在1周內使用。
5.3.3 供試品接種
抑菌劑效力可能受試驗用容器特徵的影響,如容器的材質、形狀、體積及封口的方式等。因此,只要供試品每個包裝容器的裝量足夠試驗用,同時容器便於按無菌操作技術接入試驗菌液、混合及取樣等,一般應將試驗菌直接接種於供試品原包裝容器中進行貯存。若因供試品的性狀或每個容器裝量等因素需將供試品轉移至無菌容器時,該容器的材質不得影響供試品的特性(如吸附作用),特別應注意不得影響供試品的pH,pH對抑菌劑的活性影響很大,同時容器的口徑大小應便於供試品的進出及混勻。
取包裝完整的供試品至少5份,直接接種試驗菌,或取適量供試品分別轉移至5個適宜的無菌容器中(若試驗菌株數超過5株,應增加相應的供試品份數),每一容器接種一種試驗菌,1、2、3類供試品中1g或1ml接種菌量爲105~106cfu,4類供試品中1g或1ml接種菌量爲103~104cfu,接種菌液的體積不得超過供試品體積的0.5%~1%,充分混合,使供試品中的試驗菌均勻分佈。然後將接種的供試品在試驗期間置20~25℃,避光貯存,貯存溫度的變化應儘可能控制在最小範圍,並防止被污染。
5.3.4 存活菌數測定
根據產品類型,在供試品剛接種(0時)及表2規定的間隔時間,分別從上述每個容器中取供試品1ml(g),用pH7.0無菌氯化鈉一蛋白腖緩衝液稀釋成1: 10、1:102、1: 103等稀釋級。採用平皿法或薄膜過濾法(照2010年版藥典一部附錄XIII C微生物限度檢查法,其中測定細菌用胰酪腖大豆瓊脂培養基,測定真菌用沙氏葡萄糖瓊脂培養基)測定每份供試品中所含的菌數。菌數測定方法應進行驗證,驗證方法按微生物限度檢查法(2010年版藥典一部附錄XIII C)中的“計數方法的驗證”進行,其中測定細菌用胰酪腖大豆瓊脂培養基,測定真菌用沙氏葡萄糖瓊脂培養基。
根據菌數測定結果,計算1ml(g)供試品各試驗菌所加的菌數及各間隔時間的菌數,並換算成lg值。
5.3.5 結果判斷
抑菌劑效力根據各間隔時間的菌數lg值相對於初始值(0時菌數lg值)減少程度進行評價(表2),試驗結果按有效數字的修約規則進舍,保留小數點後1位有效數字。結果符合表2要求可判定該產品抑菌效力符合規定。
1類供試品 | |
7天菌數下降不少於1.0 lg,14天菌數下降不少於3.0 lg,14天到28天菌數不增加 | |
與初始值比,7、14、28天菌數均不增加 | |
2類供試品 | |
14天菌數下降不少於2.0 lg,14天到28天菌數不增加 | |
與初始值比,14、28天菌數均不增加 | |
3類供試品 | |
14天菌數下降不少於1.0 lg,14天到28天菌數不增加 | |
與初始值比,14、28天菌數均不增加 | |
4類供試品 | |
與初始值比,14、28天菌數均不增加 | |
注:表中“不增加”是指對前一個測定時間,試驗菌增加的數量不超過0.5 lg。
6 附錄XVIII E 藥品微生物檢驗替代方法驗證指導原則
本指導原則是爲所採用的試驗方法能否替代藥典規定的方法用於藥品微生物的檢驗提供指導。
隨着微生物學的迅速發展,製藥領域不斷引入了一些新的微生物檢驗技術,大體可分爲三類:(1)基於微生物生長信息的檢驗技術,如生物發光技術、電化學技術、比濁法等;(2)直接測定被測介質中活微生物的檢驗技術,如固相細胞技術法、流式細胞計數法等;(3)基於微生物細胞所含有特定組成成分的分析技術,如脂肪酸測定技術、核酸擴增技術、基因指紋分析技術等。這些方法與傳統檢查方法比較,或簡便快速,或具有實時或近實時監控的潛力,使生產早期採取糾正措施及監控和指導優良生產成爲可能,同時新技術的使用也促進了生產成本降低及檢驗水平的提高。
在控制中藥微生物質量中,微生物實驗室出於各種原因如成本、生產量、快速簡便及提高藥品質量等需要而採用非藥典規定的檢驗方法(即替代方法)時,應進行替代方法的驗證,確認其應用效果優於或等同於藥典的方法。
6.1 微生物檢驗的類型及驗證參數
藥品微生物檢驗方法主要分兩種類型:定性試驗和定量試驗。定性試驗就是測定樣品中是否存在活的微生物,如無菌檢查及控制菌檢查。定量試驗就是測定樣品中存在的微生物數量,如菌落計數試驗。
由於生物試驗的特殊性,如微生物檢驗方法中的抽樣誤差、稀釋誤差、操作誤差、培養誤差和計數誤差都會對檢驗結果造成影響,因此,中藥質量標準分析方法驗證指導原則(2010年版藥典一部附錄XVIII A)不完全適宜於微生物替代方法的驗證。藥品微生物檢驗替代方法的驗證參數見表1。

儘管替代方法的驗證參數與中藥質量標準分析方法驗證參數有相似之處,但是其具體的內容是依據微生物檢驗特點而設立的。替代方法驗證的實驗結果需進行統計分析,當替代方法屬於定性檢驗時,一般採用非參數的統計技術;當替代方法屬於定量檢驗時,需要採用參數統計技術。
進行微生物替代方法的驗證時,若替代方法只是針對藥典方法中的某一環節進行技術修改,此時,需要驗證的對象僅是該項替代技術而不是整個檢驗方法。如無菌試驗若改爲使用含培養基的過濾器,然後通過適宜的技術確認活的微生物存在,那麼,驗證時僅需驗證所用的微生物回收系統而不是整個無菌試驗方法。
6.2 替代方法驗證的一般要求
在開展替代方法對樣品檢驗的適用性驗證前,有必要對替代方法有一個全面的瞭解。首先,所選用的替代方法應具備必要的方法適用性證據,表明在不合樣品的情況下,替代方法在不同類型的微生物檢驗中所具有的專屬性、精密度和檢測限等參數。這些證據或由替代方法的研發者提供,或南方法使用者完成。
使用者在基本確認替代方法的適用性後,應採用樣品按表l規定的參數逐一進行驗證,以確認替代方法可否用於該樣品的檢驗。驗證至少使用2個批號的樣品,每批樣品應平行進行至少3次獨立實驗。
在開展各參數驗證時,涉及的菌種除應包括微生物限度檢查法(2010年版藥典一部附錄XIII C)和無菌檢查法(2010年版藥典一部附錄XIII B)中培養基適用性檢查規定的菌株外,還應根據替代方法及樣品的特點增加相應的菌株。各菌種應分別進行驗證。
6.3 樣品中微生物定性檢驗方法的驗證
6.3.1 1.專屬性
微生物定性檢驗的專屬性是指檢測樣品中可能存在的特定微生物種類的能力。當替代方法以微生物生長作爲判斷微生物是否存在時,其專屬性驗證時應確認所用培養基的促生長試驗,還應考慮樣品的存在對檢驗結果的影響。當替代方法不是以微生物生長作爲判斷指標時,其專屬性驗證應確認檢測系統中的外來成分不得干擾試驗而影響結果,如確認樣品的存在不會對檢驗結果造成影響。採用替代方法進行控制菌的檢驗,還應選擇與控制菌具有類似特性的菌株作爲驗證對象。
6.3.2 2.檢測限
微生物定性檢驗的檢測限是指在替代方法設定的檢驗條件下,樣品中能被檢出的微生物的最低數量。由於微生物所具有的特殊性質,檢測限是指在稀釋或培養之前初始樣品所含有的微生物數量,而不是指檢驗過程中某一環節的供試液中所含有的微生物數量。例如,微生物限度檢查中規定不得檢出沙門菌,對檢測限而言,是指每10g樣品中能被檢出的沙門菌的最低數量。
檢測限確定的方法是在樣品中接種較低濃度的試驗菌(每單位不超過5cfu),然後分別採用藥典方法和替代方法對該試驗菌進行檢驗,以檢出與否來比較兩種方法的差異。試驗菌的接種量鬚根據試驗而定,以接種後採用藥典方法50%的樣品可檢出該試驗菌爲宜。檢測限驗證至少應重複進行5次。對於同一種試驗菌可採用卡方檢驗(γ2)來評價兩種方法的檢測限是否存在差異。
6.3.3 3.重現性
微生物定性檢驗的重現性是指相同的樣品在正常的實驗條件(如實驗地點、實驗人員、儀器、試劑的批次等)發生變化時,所得檢驗結果的精密度。重現性可視爲微生物檢驗方法在檢驗結果上抵抗操作和環境變化的能力。方法使用者應優先測定該驗證參數。在樣品中接種一定數量的試驗菌(接種量應在檢測限以上),採用藥典方法和替代方法,分別由不同人員,在不同時間,使用不同的試劑(或儀器)進行檢驗,採用卡方檢驗(γ2)來評價兩種方法的重現性是否存在差異。驗證過程中,應關注樣品的一致性。
6.3.4 4.耐用性
微生物定性檢驗的耐用性是指當方法參數有小的刻意變化時,檢驗結果不受影響的能力,爲方法正常使用時的可靠性提供依據。方法使用者應優先測定該驗證參數。與藥典方法比較,若替代方法檢驗條件較爲苛刻,則應在方法中加以說明。替代方法與藥典方法的耐用性比較不是必須的,但應單獨對替代方法的耐用性進行評價,以便使用者瞭解方法的關鍵操作點。
6.4 樣品中微生物定量檢驗方法的驗證
微生物定量檢驗一般都涉及菌落計數。對計數結果進行數據處理時通常需要使用統計的方法。由於菌落計數服從泊松分佈,因此採用泊松分佈的統計方法對計數結果進行數據處理優於採用正態分佈的統計方法。檢驗者往往習慣採用正態分佈的統計方法,因此也可以通過對數轉換或平方根加1的方法將原始數據轉換爲正態分佈數據後再進行統計分析。兩種統計方法都適用於微生物數據的統計分析。
6.4.1 1.準確度
微生物定量檢驗的準確度是指替代方法的檢驗結果與藥典方法檢驗結果一致的程度。準確度的確認應在檢測的範圍內,通常用微生物的回收率(%)來表示。
檢測範圍內的準確度都應符合要求,準確度驗證的方法是:製備試驗菌的菌懸液,菌懸液的濃度應選擇爲能夠準確計數的最高濃度,然後系列稀釋至較低濃度(如小於10cfu/ml)。例如,菌落計數平皿法的替代方法,在製備高濃度菌懸液時,其濃度可以是103cfu/ml,並系列稀釋至100cfu/ml。每個試驗菌應至少選擇5個菌濃度進行準確度確認,替代方法的檢驗結果不得少於藥典方法檢驗結果的70%,也可以採用合適的統計學方法表明替代方法的回收率至少與藥典方法一致。當替代方法的回收率高於藥典方法時,有必要結合專屬性項下的有關內容對準確度進行評價。
6.4.2 2.精密度
微生物定量檢驗的精密度是指在檢驗範圍內,對同一個均勻的樣品多次重複取樣測定,其檢驗結果的一致程度,通常採用標準偏差或相對標準偏差來表示,也可以採用其他適宜的方式。
精密度驗證的方法是:製備試驗菌的菌懸液,菌懸液的濃度應選擇爲能夠準確讀數的最高濃度,然後系列稀釋至較低濃度(如小於10cfu/ml)。每個試驗菌選擇其中至少5個濃度的菌懸液進行檢驗。每一個濃度至少應進行10次重複檢驗,以便能夠採用統計分析方法得到標準偏差或相對標準偏差。一般情況下,可以接受的相對標準偏差(RSD)應不大於35%。不考慮特殊的檢驗結果,替代方法的相對標準偏差(RSD)應不大於藥典方法。例如,藥典菌落計數平皿法其可接受的相對標準偏差(RSD)與含菌濃度的關係見表2。
表2 不同含茵濃度下預期的相對標準偏差
cfu/皿 | 預期RSD |
<10 | <35% |
10~30 | <25% |
30~300 | <15% |
6.4.3 3.專屬性
微生物定量檢驗的專屬性是指通過檢測適宜的試驗菌,以證明檢驗方法與其設定目的相適應的能力。例如,菌落計數平皿法其設定目的在於檢出一定數量的微生物,則其專屬性驗證應證明當樣品中存在一定數量的試驗菌時,通過平皿法檢驗,能夠檢出試驗菌,而樣品的存在不會對結果造成影響。專屬性驗證時,應能夠設計出可能使替代方法出現假陽性的實驗模型來挑戰替代方法,從而確認替代方法的適用性。當替代方法不依賴微生物生長出菌落或出現混濁就可以定量時(如不需要增菌或在1~50cfu範圍內就可直接測定菌數的定量方法),以上驗證方式就顯得更爲重要。
6.4.4 4.定量限
微生物定量檢驗的定量限是指樣品中能被準確定量測定的微生物最低數量。由於無法得到含有已知微生物數量的實驗樣品,因此,在定量限驗證時,應選擇在檢驗範圍內至少5個菌濃度,每個濃度重複取樣測定不少於5次,替代方法的定量限不得大於藥典方法。需要注意的是,由於細菌計數和菌落數服從泊松分佈,可能存在計數結果的誤差,因此替代方法的定量限僅需證實在相近的低限度下其靈敏度至少相當於藥典方法。
定量限驗證的方法是:在檢驗範圍的低限制備5份不同含菌濃度的菌懸液,每份菌懸液分別用藥典方法和替代方法進行不少於5次檢驗,採用統計方法比較替代方法的檢驗結果與藥典方法結果的差異,從而評價替代方法的定量限。
6.4.5 5.線性
微生物定量檢驗的線性是指在一定範圍內,檢驗結果與樣品中微生物數量成比例關係的程度。線性驗證時必須覆蓋能夠準確測定的所有濃度範圍。每株試驗菌應選擇至少5個濃度,每個濃度至少測定5次。根據以上實驗數據,以檢驗結果爲因變量,以樣品中微生物的預期數量爲自變量進行線性迴歸分析,計算相關係數r。當相關係數不能準確評估線性時,只能確定簡單大約的關係值。替代方法的相關係數不得低於0.95。
6.4.6 6.範圍
微生物定量檢驗的範圍是指能夠達到一定的準確度、精密度和線性,檢驗方法適用的高低限濃度或數量的區間。
6.4.7 7.重現性
微生物定量檢驗的重現性是指相同的樣品在正常的實驗條件(如實驗地點、實驗人員、儀器、試劑的批次等)發生變化時,所得檢驗結果的精密度。重現性可視爲微生物檢驗方法在檢驗結果上抵抗操作和環境變化的能力。方法使用者應優先測定該驗證參數。在樣品中接種一定數量的試驗菌(接種量應在定量限以上),採用藥典方法和替代方法,分別由不同人員,在不同時間,使用不同的試劑(或儀器)進行檢驗,對檢驗結果進行統計分析,以相對標準偏差(RSD)來評價兩種方法的重現性差異。驗證過程中,應關注樣品的一致性。
6.4.8 8.耐用性
微生物定量檢驗的耐用性是指當方法參數有小的刻意變化時,檢驗結果不受影響的能力,爲方法正常使用時的可靠性提供依據。方法使用者應優先測定該驗證參數。與藥典方法比較,若替代方法檢驗條件較爲苛刻,則應在方法中加以說明。替代方法與藥典方法的耐用性比較不是必須的,但應單獨對替代方法的耐用性進行評價,以便使用者瞭解方法的關鍵操作點。
7 附錄XVIII F 微生物限度檢查法應用指導原則
爲更好應用微生物限度檢查法(2010年版藥典一部附錄XIII C),特制定本指導原則。
微生物限度檢查法可用於判斷非規定滅菌製劑及原料、輔料是否符合藥典的規定,也可用於指導製劑、原料、輔料的微生物質量標準的制定,及指導生產過程中間產品微生物質量的監控。本指導原則將對標準和方法中的特定內容及標準的應用做進一步的說明。
1.微生物限度檢查過程中,如需要使用表面活性劑、滅活劑及中和劑,在確定其能否適用於所檢樣品及其用量時,除應證明該試劑對所檢樣品的處理有效外,還須確認該試劑不影響樣品中可能污染的微生物的檢出(即無毒性),因此無毒性確認試驗的菌株不能僅侷限於驗證試驗菌株,而應當包括產品中可能污染的微生物。
2.供試液製備方法、抑菌成分的消除方法及細菌、黴菌及酵母菌計數方法應儘量選擇微生物限度檢查法中操作簡便、快速的方法,同時,所選用的方法應避免損傷供試品中污染的微生物。對於抑菌作用較強的供試品,在供試品溶液性狀允許的情況下,應儘量選用薄膜過濾法進行試驗。
3.微生物限度檢查法(2010年版藥典一部附錄XIII C)收載的離心沉澱法僅適用於製備細菌計數或控制菌(細菌)檢查用的供試液,規定的500轉/分鐘、不超過3分鐘只用於去除供試液中的沉澱物。採用該方法時,供試液中的樣品顆粒大小、黏稠度及污染的微生物大小、轉速等直接影響着樣品中微生物的回收,易造成檢驗結果不能真實反映供試品的污染情況。因此,供試液製備時儘量避免使用該方法,更不宜採用高速離心沉降集菌。
4.對照培養基係指按培養基處方特別製備、質量優良的培養基,用於培養基適用性檢查。由中國藥品生物製品檢定所研製及分發。
5.進行驗證試驗時,若因沒有適宜的方法消除供試品中的抑菌作用而導致微生物回收的失敗,應採用能使微生物生長的更高稀釋級供試液進行方法驗證試驗。此時更高稀釋級供試液的確認要從低往高的稀釋級進行,但最高稀釋級供試液選擇應根據供試品應符合的微生物限度標準和菌數報告規則,如供試品應符合的微生物限度標準是1g細菌數不得過1000cfu,那麼最高稀釋級是1: 10-3。
若採用允許的最高稀釋級供試液進行驗證試驗還存在1株或多株試驗菌的回收率達不到要求,那麼應選擇回收情況最接近要求的方法進行供試品的檢測。如某種產品對某試驗菌有較強的抑菌性能,採用薄膜過濾法的回收率爲40%,而採用培養基稀釋法的回收率爲30%,那麼應選擇薄膜過濾法進行該供試品的檢測。在此情況下,生產單位或研製單位應根據原輔料的微生物質量、生產工藝及產品特性進行產品的風險評估,以保證檢驗方法的可靠性,從而保證產品質量。
6.微生物限度檢查法中控制菌檢查法沒有規定進一步確證疑似致病菌的方法。若供試品檢出疑似致病菌,確證的方法應選擇已被認可的菌種鑑定方法,如細菌鑑定一般依據《伯傑氏細菌鑑定手冊》。
7.在藥品的生產、貯存、銷售及新藥標準制訂、進口藥品標準複覈、考察藥品質量、仲裁中,除在品種項下及製劑通則項下另有規定外,其微生物限度均以藥典的“藥品微生物限度標準”(2010年版藥典一部附錄XIII C)爲依據。
8.用於手術、燒傷及嚴重創傷的局部給藥製劑應符合無菌檢查法要求。對用於創傷程度難以判斷的局部給藥製劑,若沒有證據證明藥品不存在安全性風險,那麼該藥品應符合無菌檢查法要求。
9.含動物類原藥材粉的口服中藥製劑要求不得檢出沙門菌。其中的動物類原藥材粉是指除蜂蜜、王漿、動物角、阿膠外的所有動物類原藥材粉,如牡蠣、珍珠等貝類,海蜇、冬蟲夏草、人工牛黃等。
10.制定藥品的微生物限度標準時,除了依據“藥品微生物限度標準”(2010年版藥典一部附錄XIII C)外,還應綜合考慮原料來源、性質、生產工藝條件、給藥途徑及微生物污染對患者的潛在危險等因素,提出合理安全的微生物限度標準,因此,必要時,特殊品種爲保證其療效、穩定性及避免對患者的潛在危害性,應制定更嚴格的微生物限度標準,並在品種項下規定,如吸入粉霧劑,從使用者的安全性考慮,應按無菌產品的要求進行控制。制定輔料、中藥提取物的微生物限度標準時,除參照相應制劑的微生物限度標準外,還應綜合考慮相應制劑及其生產工藝的特性。
8 附錄XVIII G 藥品微生物實驗室質量管理指導原則
藥品微生物實驗室質量管理[2]指導原則用於指導藥品微生物檢驗實驗室的質量控制。
藥品微生物的檢驗結果受很多因素的影響,如樣品中微生物可能分佈不均勻、微生物檢驗方法的誤差較大等。因此,在藥品微生物檢驗中,爲保證檢驗結果的可靠性,必須使用經驗證的檢測方法並嚴格按照藥品微生物實驗室質量管理指導原則要求進行試驗。
藥品微生物實驗室規範包括以下幾個方面:人員、培養基試劑、菌種、環境、設備、樣品、檢驗方法、污染廢棄物處理、檢測結果質量保證和檢測過程質量控制、實驗記錄、結果的判斷、檢測報告、文件[2]等。
8.1 人員
從事藥品微生物試驗工作的人員應具備微生物學或相近專業知識的教育背景。
實驗人員應依據所在崗位和職責接受相應的培訓,在確認他們可以承擔某一試驗前,他們不能獨立從事該項微生物試驗。應保證所有人員在上崗前接受勝任工作所必需的設備操作、微生物檢驗技術等方面的培訓,如無菌操作、培養基製備、消毒、滅菌、注平板、菌落計數、菌種的轉種、傳代和保藏、微生物檢查方法及鑑定基本技術等,經考覈合格後方可上崗。
實驗人員應經過實驗室生物安全方面的培訓,保證自身安全,防止微生物在實驗室內部污染。
實驗室應制定所有級別實驗人員的繼續教育計劃,保證知識與技能不斷的更新。[2]
檢驗人員必須熟悉相關檢測方法、程序、檢測目的和結果評價。微生物實驗室的管理者其專業技能和經驗水平應與他們的職責範圍相符。如;管理技能、實驗室安全、試驗安排、預算、實驗研究、實驗結果的評估和數據偏差的調查、技術報告書寫等。
實驗室應通過參加內部質量控制、能力驗證或使用標準菌株等方法客觀評估檢驗人員的能力,必要時對其進行再培訓並重新評估。當使用一種非經常使用的方法或技術時,有必要在檢測前確認微生物檢測人員的操作技能。
所有人員的培訓、考覈內容和結果均應記錄歸檔。
8.2 培養基
培養基是微生物試驗的基礎,直接影響微生物試驗結果。適宜的培養基製備方法、貯藏條件和質量控制試驗是提供優質培養基的保證。
8.2.1 1.培養基的製備
微生物實驗室使用的[2]培養基可按處方配製,也可使用按處方生產的符合規定的脫水培養基。
在製備培養基時,應選擇質量符合要求的脫水培養基或單獨配方組分進行配製。脫水培養基應附有處方和使用說明,配製時應按使用說明上的要求操作以確保培養基的質量符合要求,不得使用結塊或顏色發生改變的脫水培養基。脫水培養基或單獨配方組分應在適當的條件下貯藏,如低溫、乾燥和避光,所有的容器應密封,尤其是盛放脫水培養基的容器。商品化的成品培養基除了應附有處方和使用說明外,還應註明有效期、貯藏條件、適用性檢查試驗的質控菌和用途。爲保證培養基質量的穩定可靠,各脫水培養基或各配方組分應準確稱量,並要求有一定的精確度。配製培養基最常用的溶劑是純化水,特殊情況下,可能需要用去離子水和蒸餾水。應記錄各稱量物的重量和水的使用量。
配製培養基所用容器不得影響培養基質量,一般爲玻璃容器。[2]培養基配置所用容器和配套器具應潔淨,可用純化水沖洗玻璃器皿以消除清潔劑和外來物質的殘留。對熱敏感的培養基如糖發酵培養基其分裝容器一般應預先進行滅菌,以保證培養基的無菌性。
脫水培養基應完全溶解於水中,再行分裝與滅菌。配製時若需要加熱助溶,應注意不要過度加熱,以避免培養基顏色變深。如需要添加其他組分時,加入後應充分混勻。
應按照生產商提供或使用者驗證的參數進行培養基的滅菌。商品化的成品培養基必須附有所用滅菌方法的資料。培養基滅菌一般採用溼熱滅菌技術,特殊培養基可採用薄膜過濾除菌。
培養基若採用不適當的加熱和滅菌條件,有可能引起顏色變化、透明度降低、瓊脂凝固力或pH的改變。因此,培養基應採用驗證的滅菌程序滅菌,培養基滅菌方法和條件,應通過無菌性試驗和促生長試驗進行驗證。此外,對高壓滅菌器的蒸汽循環系統也要加以驗證,以保證在一定裝載方式下的正常熱分佈。溫度緩慢上升的高壓滅菌器可能導致培養基的過熱,過度滅菌可能會破壞絕大多數的細菌和真菌培養基促生長的質量。滅菌器中培養基的容積和裝載方式也將影響加熱的速度。因此,應根據滅菌培養基的特性,進行全面的滅菌程序驗證。
應確定每批培養基滅菌後的pH值(冷卻至室溫25℃測定)。若培養基處方中未列出pH值的範圍,除非經驗證表明培養基的pH值允許的變化範圍很寬,否則,pH值的範圍不能超過規定值土0.2。
製成平板或分裝於試管的培養基應進行下列檢查:容器和蓋子不得破裂,裝量應相同,儘量避免形成氣泡,固體培養基表面不得產生裂縫或漣漪,在冷藏溫度下不得形成結晶,不得污染微生物等。應檢查和記錄批數量、有效期及培養基的無菌檢查。
8.2.2 2.培養基的貯藏
自配的培養基應標記名稱、批號、配製日期、製備人[2]等信息,並在已驗證的條件下貯藏。商品化的成品培養基標籤上應標有名稱、批號、生產日期、失效期及培養基的有關特性,生產商和使用者應根據培養基使用說明書上的要求進行貯藏,所採用的貯藏和運輸條件應使成品培養基最低限度的失去水分並提供機械保護。
培養基滅菌後若貯藏在高壓滅菌器中,質量可能會受影響,一般不提倡這種存放法。瓊脂培養基不得在0℃或0℃以下存放,因爲冷凍可能破壞凝膠特性。培養基應避光保存,若要長期保存,應置於密閉容器中以防止水分流失。瓊脂平板最好現配現用,如置冰箱保存,一般不超過1周,且應密閉包裝,若延長保存期限,保存期需經驗證確定。
固體培養基滅菌後的再融化只允許1次,以避免因過度受熱造成培養基質量下降或微生物污染。培養基的再融化一般採用水浴或流通蒸汽加熱。若採用其他溶解方法,應對其進行評估,確認該溶解方法不影響培養基質量。[2]融化的培養基應置於45~50℃的水浴中,不得超過8小時。傾注培養基時,應擦乾培養基容器外表面的水分,避免容器外壁的水滴進入培養基中造成污染。
使用過的培養基(包括失效的培養基)應按照國家污染廢物處理相關規定進行。
8.2.3 3.質量控制試驗
實驗室應對試驗用培養基建立質量控制程序,以確保所用培養基質量符合相關檢測的需要。
實驗室配製或商品化的成品培養基的質量依賴於其製備過程,採用不適宜方法製備的培養基將影響微生物的生長或復甦,從而影響試驗結果的可靠性。
所有配製好的培養基均應進行質量控制試驗。實驗室配製的培養基的常規監控項目是pH、適用性檢查試驗,定期的穩定性檢查以確定有效期。培養基在有效期內應依據適用性檢查試驗確定培養基質量是否符合要求。有效期的長短將取決於在一定存放條件下(包括容器特性及密封性)的培養基其組成成分的穩定性。
除藥典附錄另有規定外,在實驗室中,若採用已驗證的配製和滅菌程序製備培養基且過程受控,那麼同一批脫水培養基的適用性檢查試驗可只進行一次。如果培養基的製備過程未經驗證,那麼每一批培養基均要進行適用性檢查試驗,試驗的菌種可根據培養基的用途從相關附錄中進行選擇,也可增加從生產環境及產品中常見的污染菌株。
培養基的質量控制試驗若不符合規定,應尋找不合格的原因,以防止問題重複出現。任何不符合要求的培養基均不能使用。
用於環境監控的培養基須特別防護,最好要雙層包裝和終端滅菌,如果不能採用終端滅菌的培養基,那麼在使用前應進行100%的預培養以防止外來的污染物帶到環境中及避免出現假陽性結果。
8.3 試劑
微生物實驗室應有試劑接收、檢查和貯藏的程序,以確保所用試劑質量符合相關檢查要求。
實驗用的關鍵試劑,在開啓和貯藏過程中,應對每批試劑的適用性進行驗證。實驗室應對試劑進行管理控制,保存和記錄相關資料。
實驗室應標明所有試劑、試液及溶液的名稱、製備依據、適用性、濃度、效價、貯藏條件、製備日期、有效期及製備人。[2]
8.4 菌種
試驗過程中,生物樣本可能是最敏感的,因爲它們的活性和特性依賴於合適的試驗操作和貯藏條件。實驗室菌種的處理和保藏的程序應標準化,使盡可能減少菌種污染和生長特性的改變。按統一操作程序製備的菌株是微生物試驗結果一致性的重要保證。
藥品微生物檢驗用的試驗菌應來自認可的國內或國外菌種保藏機構的標準菌株,或使用與標準菌株所有相關特性等效的可以溯源的[2]商業派生菌株。
標準菌株的復活或培養物的製備應按供應商提供的說明或按已驗證的方法進行。從國內或國外菌種保藏機構獲得的標準菌株經過復活並在適宜的培養基中生長後,即爲標準儲備菌株。標準儲備菌株應進行純度和特性確認。標準儲備菌株保存時,可將培養物等份懸浮於抗冷凍的培養基中,並分裝於小瓶中,建議採用低溫冷凍乾燥、液氮貯存、超低溫冷凍(低於-30℃)等方法保存。低於-70℃或低溫冷凍乾燥方法可以延長菌種保存時間。標準儲備菌株可用於製備每月或每週1次轉種的工作菌株。冷凍菌種一旦解凍轉種製備工作菌株後,不得重新冷凍和再次使用。
工作菌株的傳代次數應嚴格控制,不得超過5代(從菌種保藏機構獲得的標準菌株爲第0代),以防止過度的傳代增加菌種變異的風險。1代是指將活的培養物接種到微生物生長的新鮮培養基中培養,任何亞培養的形式均被認爲是轉種或傳代一次。必要時,實驗室應對工作菌株的特性和純度進行確認。
工作菌株不可替代標準菌株,標準菌株的商業衍生物僅可用作工作菌株。標準菌株如果經過確認試驗證明已經老化、退化、變異、污染等或該菌株已無使用需要時,應及時滅菌銷燬。[2]
實驗室必須建立和保存其所有菌種的進出、收集、貯藏、確認試驗以及銷燬的記錄,應有菌種管理的程序文件(從標準菌株到工作菌株),該程序包括:標準菌種的申購記錄;從標準菌株到工作菌株操作及記錄;菌種必須定期轉種傳代,並做純度、特性等實驗室所需關鍵指標的確認,並記錄;每支菌種都應註明其名稱、標準號、接種日期、傳代數;菌種生長的培養基和培養條件;菌種保藏的位置和條件;其他需要的程序。
{
8.5 環境
微生物實驗室應具有進行微生物檢測所需的適宜、充分的設施條件。實驗環境應保證不影響檢驗結果的準確性。工作區域與辦公區域應分開。
微生物實驗室應專用,並與其他領域分開尤其是生產領域。
8.5.1 1.實驗室的佈局和運行
微生物實驗室的佈局與設計應充分考慮到試驗設備安裝、良好微生物實驗室操作規範和實驗室安全的要求。實驗室佈局設計的基本原則是既要最大可能防止微生物的污染,又要防止檢驗過程對環境和人員造成危害,同時還應考慮活動區域的合理規劃及區分,避免混亂和污染,以提高微生物實驗室操作的可靠性。
微生物實驗室的設計和建築材料應考慮其適用性,以利清潔、消毒、滅菌並減少污染的風險。潔淨或無菌室應配備獨立的空氣機組或空氣淨化系統,以滿足相應的檢驗要求,包括溫度和溼度的控制,壓力、照度和噪聲等都應符合工作要求。空氣過濾系統應定期維護和更換,並保存相關記錄。微生物實驗室應劃分成相應的潔淨區域和活菌操作區域,同時應根據試驗目的,在時間或空間上有效分隔不相容的試驗活動,將交叉污染的風險降低到最低。
活菌操作區應該配備生物安全櫃,以避免危害性的生物因子對實驗人員和實驗環境造成的危害。一般情況下,藥品微生物檢驗的實驗室應有符合無菌檢查法(2010年版藥典三部附錄XIII B)和微生物限度檢查法(2010年版藥典三部附錄XIII C)要求的、用於具有開展無菌檢查、微生物限度檢查、無菌採樣等檢測活動的、獨立設置的潔淨室(區)或隔離系統,併爲上述檢驗配備相應的陽性菌實驗室、培養室、試驗結果觀察區、培養基及實驗用具準備(包括滅菌)區、樣品接收和貯藏區、標準菌株貯藏區、污染物處理區和文檔處理區等輔助區域,同時,應對上述區域明確標識。
微生物實驗的各項工作應在專屬的區域進行,以降低交叉污染、假陽性結果和假陰性結果出現的風險。一些樣品若需要證明微生物的生長或進一步分析培養物的特性,如再培養、染色、微生物鑑定或其他確定試驗均應在實驗室的活菌操作區進行。任何出現微生物生長的培養物不得在實驗室無菌區域內打開。對染菌的樣品及培養物應有效隔離以減少假陽性結果的出現。病原微生物的分離鑑定工作應在二級生物安全實驗室進行。}[2]
{實驗室應對進出潔淨區域的人和物建立控制程序和標準操作規程,對可能影響檢驗結果的工作(如潔淨度驗證及監測、消毒、清潔維護等)能夠有效地控制、監測並記錄。微生物實驗室使用權限應限於經授權的工作人員,實驗人員應瞭解潔淨區域的正確進出的程序,包括更衣流程;該潔淨區域的預期用途、使用時的限制及限制原因;適當的潔淨級別。
8.5.2 2.環境監測
微生物實驗室應按相關國家標準制定完整的潔淨室(區)和隔離系統的驗證和環境監測標準操作規程,環境監測項目和監測頻率及對超標結果處理應有書面程序。監測項目應涵蓋到位,包括對空氣懸浮粒子、浮游菌、沉降菌、表面微生物及物理參數(溫度、相對溼度、換氣次數、氣流速度、壓差、噪聲等)的有效地控制和監測。
8.5.3 3.清潔、消毒和衛生
微生物實驗室應有制定清潔、消毒和衛生的標準操作規程,規程中應涉及環境監測結果。
實驗室在使用前和使用後應進行消毒,並定期監測消毒效果,要有足夠洗手和手消毒設施。應有對有害微生物發生污染的處理規程。
所用的消毒劑種類應滿足潔淨實驗室相關要求並定期更換。理想的消毒劑既能殺死廣泛的微生物、對人體無毒害、不會腐蝕或污染設備,又應有清潔劑的作用、性能穩定、作用快、殘留少、價格合理。所用消毒劑和清潔劑的微生物污染狀況應進行監測,並在規定的有效期內使用,A級和B級潔淨區應當使用無菌的或經無菌處理的消毒劑和清潔劑。}[2]
8.6 設備
微生物實驗室應配備與檢驗能力和工作量相適應的儀器設備,其類型、測量範圍和準確度等級應滿足檢驗所採用標準的要求,設備的安裝和佈局應便於操作,易於維護、清潔和校準,並保持清潔和良好的工作狀態。用於試驗的每臺儀器、設備應該有唯一標識。
儀器設備應有合格證書[2],實驗室在儀器設備完成相應的檢定、校準、驗證、確認其性能,並形成相應的操作、維護和保養的標準操作規程後方可正式使用,儀器設備使用和日常監控要有記錄。
8.6.1 1.設備的維護
爲保證儀器設備處於良好工作狀態,應定期對其進行維護和性能驗證,並保存相關記錄。儀器設備若脫離實驗室或被檢修,恢復使用前應對其檢查或校準,以保證性能符合要求。[2]
微生物實驗室所用的儀器應根據日常使用的情況進行定期的校準,並記錄。校準的週期和校驗的內容根據儀器的類型和設備在實驗室產生的數據的重要性的不同而不同。重要的儀器設備,如培養箱、冰箱等,應由專人負責,保證其運行狀態正常和受控,同時應有相應的備用設備以保證試驗菌株和微生物培養的連續性,特殊設備如高壓滅菌器、隔離器、生物安全櫃等實驗人員應經培訓後持證上崗。[2]對於培養箱、冰箱、高壓滅菌鍋等影響實驗準確性的關鍵設備應在其運行過程中對關鍵參數(如溫度、壓力)進行連續觀測和記錄,有條件的情況下儘量使用自動記錄裝置。如果發生偏差,應評估對以前的檢測結果造成的影響並採取必要的糾正措施。對於一些容易污染微生物的儀器設備如水浴鍋、培養箱、冰箱和生物安全櫃等應定期進行清潔和消毒。
對試驗需用的無菌器具應實施正確的清洗、滅菌措施,並形成相應的標準操作規程,無菌器具應有明確標識並與非無菌器具加以區別。
{實驗室的某些設備(例如培養箱、高壓滅菌器和玻璃器皿等)應專用,除非有特定預防措施,以防止交叉污染。
8.6.2 2.校準、性能驗證和使用監測
微生物實驗室所用的儀器應根據日常使用的情況進行定期的校準,並記錄。校準的週期和校驗的內容根據儀器的類型和設備在實驗室產生的數據重要性不同而不同。儀器上應有標籤說明校準日期、維修日期和重新校準日期。
8.6.2.1 溫度測量裝置
溫度不但對實驗結果有直接的影響,而且還對儀器設備的正常運轉和正確操作起關鍵因素。相關的溫度測量裝置如培養箱和高壓滅菌器中的溫度計、熱電耦和鉑電阻溫度計,應
具有可靠的質量並進行校準以確保所需的精確度,溫度設備的校準應遵循國家或國際標準。
溫度測量裝置可以用來監控冰箱、超低溫冰箱、培養箱、水浴鍋等設備的溫度,應在使用前驗證此類裝置的性能。
8.6.2.2 稱量設備
天平和標準砝碼應定期進行校準,天平使用過程應採用標準砝碼進行校準。每次使用完後應及時清潔,必要時用非腐蝕消毒劑進行消毒。
8.6.2.3 容量測定設備
微生物實驗室對容量測定設備如自動分配儀、移液槍、移液管等應進行檢定,以確保儀器準確度。對於已經校準或檢定證明符合使用要求的玻璃器具可以不進行檢定。標有各種使用體積的儀器需要對使用時的體積進行精密度的檢查,並且還要測定其重現性。
對於一次性使用的容量設備,實驗室應該從公認的和具有相關質量保證系統的公司購買。對儀器適用性進行初次驗證後,要對其精密度隨時進行檢查。必要時應該對每批定容設備進行適用性檢查。
8.6.2.4 生物安全櫃、層流超淨工作臺、高效過濾器
應由有資質的人員進行生物安全櫃、層流超淨工作臺及高效過濾器的安裝與更換,要按照確認的方法進行現場生物和物理的檢測,並定期進行再驗證。
實驗室生物安全櫃和層流超淨工作臺的通風應符合微生物風險級別及符合安全要求。應定期對生物安全櫃、層流超淨工作臺進行監測以確保其性能符合相關要求。實驗室應保存檢查記錄和性能測試結果。
8.6.2.5 其他設備
懸浮粒子計數器、浮游菌採樣器應定期進行校準;pH計、傳導計和其他類似儀器的性能應定期或在每次使用前確認;若溼度對實驗結果有影響,溼度計應按國家或國際標準進行校準;當所測定的時間對檢測結果有影響時,應使用校準過的計時儀或定時器;使用離心機時,應評估離心機每分鐘的轉數,若離心是關鍵因素,離心機應該進行校準。}[2]
{
8.7 樣品
8.7.1 1.樣品採集
試驗樣品的採集,應遵循隨機抽樣的原則,並在受控條件下進行抽樣,如有可能,抽樣應在具有無菌條件的特定抽樣區域中進行。抽樣時,須採用無菌操作技術進行取樣,防止樣品受到微生物的污染而導致假陽性的結果。抽樣的任何消毒過程(如抽樣點的消毒)不能影響樣品中微生物的檢出。
抽樣的容器應貼有唯一性的標識,註明樣品名稱、批號、抽樣日期、採樣容器、抽樣人等。抽樣應由經過培訓的人員使用無菌設備在無菌條件下進行無菌操作。抽樣環境狀況應監測並記錄,同時還需記錄採樣時間。}[2]
{
8.7.2 2.樣品儲存和運輸
待檢樣品應在合適的條件下貯藏並保證其完整性,儘量減少污染的微生物發生變化。樣品在運輸過程中,應保持原有(規定)的儲存條件或採取必要的措施(如冷藏或冷凍)。應明確規定和記錄樣品的貯藏和運輸條件。
8.7.3 3.樣品的確認和處理
實驗室在收到樣品後應根據有關規定儘快對樣品進行檢查,並記錄被檢樣品所有相關信息,如:接收日期及時間、接收時樣品的狀況、採樣操作的特徵(包括採樣日期和採樣條件等)、貯藏條件。
如果樣品存在數量不足、包裝破損、標籤缺失、溫度不適等,實驗室應在決定是否檢測或拒絕接受樣品之前與相關人員溝通。樣品的包裝和標籤有可能被嚴重污染,因此搬運和儲存樣品時應小心以避免污染的擴散,容器外部的消毒應不影響樣品的完整性。樣品的任何狀況在檢驗報告中應有說明。
選擇具有代表性的樣品,根據有關的國家或國際標準,或者使用經驗證的實驗方法,儘快進行檢驗。
實驗室應按照書面管理程序對樣品進行保留和處置。如果實驗用的是已知被污染的樣品,應該在丟棄前進行滅菌。
8.8 檢驗方法
8.8.1 檢驗方法選擇
藥品微生物檢驗時,應根據檢驗目的選擇適宜的方法進行樣品檢驗。
8.8.2 檢驗方法的驗證
藥典方法或標準中規定的方法是經過驗證的,當進行樣品檢驗時,應進行方法適用性確認。
如果檢驗方法不是藥典或標準中規定的方法,使用前應進行替代方法的驗證,確認其應用效果優於或等同於藥典方法。替代方法的驗證按藥品微生物檢驗替代方法驗證指導原則(2010年版藥典三部附錄XVIII E)進行。
實驗室對所用商業檢測系統如試劑盒等應保留確認數據,這些確認數據可由製造者提供或由第三方機構評估,必要時,實驗室應對商業檢測系統進行確認。}[2]
{
8.9 污染廢棄物處理
實驗室應有妥善處理廢棄樣品、過期(或失效)培養基和有害廢棄物的設施和制度,旨在減少檢查環境和材料的污染。污染廢棄物的最終處理必須符合國家環境和健康安全規定。實驗室還應針對類似於帶菌培養物溢出的意外事件制定處理規程。如:活的培養物灑出必須就地處理,不得使培養物污染擴散。}[2]
{
8.10 檢測結果的質量保證和檢測過程的質量控制
8.10.1 1.內部質量控制
標準的一致性,實驗室應制定對所承擔的工作進行連續評估的程序。
實驗室應定期對實驗環境的潔淨度、培養基的適用性、滅菌方法、菌株純度和活性(包括性能)、試劑的質量等進行監控並詳細記錄。
實驗室應定期對檢測人員進行技術考覈。可以通過加標試樣的使用、平行實驗和參加能力驗證等方法使每個檢測人員所檢測項目的可變性處於控制之下,以保證檢驗結果的一致性。
8.10.2 2.外部質量評估
實驗室應參加與檢測範圍相關的國家能力驗證或實驗室之間的比對實驗來評估檢測水平,通過參加外部質量評估來評定檢測結果的偏差。}[2]
8.11 實驗記錄
實驗結果的可靠性依賴於試驗嚴格按照標準操作規程進行,而標準操作規程應指出如何進行正確的試驗操作。實驗記錄應包含所有關鍵的實驗細節,以便確認數據的完整性。實驗室原始記錄至少應包括以下內容:實驗日期、檢品名稱、實驗人員姓名、標準操作規程編號或方法、實驗結果、偏差(存在時)、實驗參數(所使用的設備、菌種、培養基和批號以及培養溫度等)、主管/複覈人簽名。
實驗記錄上還應顯示出檢驗標準的選擇,如果使用的是藥典標準,必須保證是現行有效的標準。
試驗所用的每一個關鍵的實驗設備均應有記錄,設備日誌或表格應設計合理,[2]以滿足試驗記錄的追蹤性,設備溫度(水浴、培養箱、滅菌器)必須記錄,且具有追溯性。
實驗記錄寫錯時,用單線劃掉並簽字。原來的數據不能抹去或被覆蓋。
所有實驗室記錄應以文件形式保存並防止意外遺失,正規的記錄應存放在特定的地方並有登記。
8.12 結果的判斷和檢測報告
由於微生物試驗的特殊性,在實驗結果分析時,對結果應進行充分和全面的評價。所有影響結果觀察的微生物條件和因素應完全考慮,包括與規定的限度或標準有很大偏差的結果;微生物在原料、輔料或試驗環境中存活的可能性;及微生物的生長特性等。特別要了解[2]實驗結果與標準的差別是否有統計學意義。
若發現實驗結果不符合藥典各品種項下要求或另外建立的質量標準,應進行原因調查。引起微生物污染結果不符合標準的原因主要有兩個:試驗操作錯誤或產生無效結果的試驗環境條件;產品本身的微生物污染總數超過規定的限度或檢出控制菌。
異常結果出現時,應進行偏差調查。偏差調查時[2]應考慮實驗室環境、抽樣區的防護條件、樣品在該檢驗條件下以往檢驗的情況、樣品本身具有使微生物存活或繁殖的特性等情況。此外,回顧試驗過程,也可評價該實驗結果的可靠性及實驗過程是否恰當。如果試驗操作被確認是引起實驗結果不符合的原因,那麼應制定改錯方案以解決問題,按照正確的操作方案進行實驗,在這種情況下,對試驗過程及試驗操作應特別認真地進行監控。
如果依據分析調查結果發現試驗有錯誤而判實驗結果無效,那麼這種情況必須記錄。實驗室也必須認可複試程序,如果需要,可按相關規定重新抽樣,但抽樣方法不能影響不符合規定結果的分析調查。
微生物實驗室檢測報告應該符合檢測方法的要求。實驗室應準確、清晰、明確和客觀地報告每一項或每一份檢測的結果。檢測報告的信息應該完整。[2]
8.13 文件
文件應當充分表明試驗是在實驗室裏按可控的檢查法進行的,一般包括以下方面:人員培訓與資格確認;設備驗收、驗證、檢定(或校準期間覈查)和維修;設備使用中的運行狀態(設備的關鍵參數);培養基製備、貯藏和質量控制;菌種管理;檢驗規程中的關鍵步驟;數據記錄與結果計算的確認;質量責任人對試驗報告的評估;數據偏離的調查。
9 附錄XVIII H 國家藥品標準物質製備指導原則
(附錄XVIII H 國家藥品標準物質製備指導原則 由《中華人民共和國藥典》(2010年版 第二增補本)新增)
本指導原則用於規範和指導國家藥品標準物質的製備,保證國家藥品標準的執行。
9.1 一、國家藥品標準物質品種的確定
9.2 二、候選國家藥品標準物質原料的選擇
1.原料的選擇應滿足適用性、代表性及可獲得性的原則。
2.原料的性質應符合使用要求。
3.原料的均勻性、穩定性及相應特性量值範圍應適合該標準物質的用途。
9.3 三、候選國家藥品標準物質的製備
1.根據候選藥品標準物質的理化性質,選擇合理的製備方法和工藝流程,防止相應特性量值的變化,並避免被污染。
2.對不易均勻的候選藥品標準物質,在製備過程中除採取必要的均勻措施外,還應進行均勻性初檢。
3.對相應特性量值不穩定的候選藥品標準物質,在製備過程中應考察影響穩定性的因素,採取必要的措施保證其穩定性,並選擇合適的儲存條件。
4.當候選藥品標準物質製備量大時,爲便於保存可採取分級分裝。
5.候選藥品標準物質供應者須具備良好的實驗條件和能力,並應提供以下資料。
(1)試驗方法、量值、試驗重複次數、必要的波譜及色譜等資料;
(2)符合穩定性要求的儲存條件(溫度、溼度和光照等);
(3)候選藥品標準物質引溼性研究結果及說明;
(4)加速穩定性研究結果;
(5)有關物質的鑑別及百分比,國家藥品標準中主組分的相對響應因子等具體資料;
9.4 四、候選國家藥品標準物質的標定
候選藥品標準物質按以下要求進行標定,必要時應與國際標準物質進行比對。
9.4.1 1.化學結構或組分的確證
(1)驗證已知結構的化合物需要提供必要的理化參數及波譜數據,並提供相關文獻及對比數據。如無文獻記載,應提供完整的結構解析過程。
(2)對於不能用現代理化方法確定結構的藥品標準物質,應選用適當的方法對其組分進行確證。
9.4.2 2.理化性質檢查
應根據藥品標準物質的特性和具體情況確定理化性質檢驗項目,如性狀、熔點、比旋度、晶型以及乾燥失重、引溼性等。
9.4.3 3.純度及有關物質檢查
應根據藥品標準物質的使用要求確定純度及有關物質的檢查項,如反應中間體、副產物及相關雜質等。
9.4.4 4.均勻性檢驗
凡成批製備並分裝成最小包裝單元的候選藥品標準物質,必須進行均勻性檢驗。對於分級分裝的候選藥品標準物質,凡由大包裝分裝成最小包裝單元時,均應進行均勻性檢驗。
9.4.5 5.定值
符合上述要求後,方可進行定值。
定值的測量方法應經方法學考察證明準確可靠。應先研究測量方法、測量過程和樣品處理過程所固有的系統誤差和隨機誤差,如溶解、分離等過程中被測樣品的污染和損失;對測量儀器要定期進行校準,選用具有可溯源的基準物;要有可行的質量保證體系,以保證測量結果的溯源性。
(1)定值原則
在測定一個候選化學標準品/對照品含量時,水分、有機溶劑、無機雜質和有機成分測定結果的總和應爲100%。
①採用高準確度的絕對或權威測量方法定值測量時,要求兩個以上分析者在不同的實驗裝置上獨立
地進行操作。
研究不同原理的測量方法的精密度,對方法的系統誤差進行估計,採取必要的手段對方法的準確度進行驗證。
③多個實驗室協作定值
參加協作標定的實驗室應具有候選藥品標準物質定值的必備條件及相關實驗室資質。每個實驗室應採用規定的測量方法。協作實驗室的數目或獨立定值組數應符合統計學的要求。
9.5 五、候選國家藥品標準物質的穩定性考察
1.候選藥品標準物質應在規定的儲存或使用條件下,定期進行相應特性量值的穩定性考察。
2.穩定性考察的時間間隔可以依據先密後疏的原則。在考察期間內應有多個時間間隔的監測數據。
(1)當候選藥品標準物質有多個特性量值時,應選擇易變的和有代表性的特性量值進行穩定性考察;
(2)選擇不低於定值方法精密度和具有足夠靈敏度的測量方法進行穩定性考察;
10 附錄XVIII J 中藥材DNA條形碼分子鑑定法指導原則
(附錄XVIII J 中藥材DNA條形碼分子鑑定法指導原則由《中華人民共和國藥典》(2010年版 第三增補本)新增)
DNA條形碼分子鑑定法是利用基因組中一段公認的、相對較短的DNA序列來進行物種鑑定的一種分子生物學技術,是傳統形態鑑別方法的有效補充。由於不同物種的DNA序列是由腺嘌呤(A)、鳥嘌呤(G)、胞嘧啶(C)、胸腺嘧啶(T)四種鹼基以不同順序排列組成,因此對某一特定DNA片段序列進行分析即能夠區分不同物種。
中藥材DNA條形碼分子鑑定通常是以核糖體DNA第二內部轉錄間隔區(ITS2)注1爲主體條形碼序列鑑定中藥材的方法體系,其中植物類中藥材選用ITS2/ITS爲主體序列,以葉綠體psbA-trnH注2爲輔助序列,動物類中藥材採用細胞色素C氧化酶亞基i (COI)注3爲主體序列,ITS2爲輔助序列。
10.1 一、儀器的一般要求
所用儀器有電子天平、離心機、聚合酶鏈式反應(polymerase chain reaction,PCR)儀、電泳儀和測序儀。
DNA序列測定用測序儀,是一臺具有自動灌膠、自動進樣、自動數據收集分析等全自動電腦控制的測定DNA片段中鹼基順序或大小,以及定量用精密儀器。測序方法主要採用雙脫氧鏈終止法,又稱Sanger法。4種雙脫氧核苷酸(ddNTP)的鹼基分別用不同的熒光進行標記,在通過毛細管時,不同長度的DNA片段上的4種熒光基團被激光激發,發出不同顏色的熒光,被電荷藕合元件圖像傳感器(charge-coupled device,CCD)檢測系統識別,並直接翻譯成DNA序列,獲得供試品的峯圖文件和序列文件。
10.2 二、測定步驟
本法主要包括供試品處理、DNA提取、DNA條形碼序列PCR擴增、電泳檢測和序列測定、序列拼接及結果判定,主要步驟如下。
10.2.1 1.供試品處理
按藥材和飲片取樣法(附錄Ⅱ A)取樣。爲防止外源微生物污染,藥材和飲片一般使用75%乙醇擦拭表面後晾乾,或採取其他有效去除微生物污染的方法。稱取10~100mg備用。供試品具體取樣部位根據不同藥材特性作出相應規定。
10.2.2 2.DNA提取
DNA的提取包括使用研鉢或研磨儀破碎細胞,粉碎成細粉,用試劑盒法進行DNA的分離和純化等步驟,目前常用試劑盒包括植物基因組DNA提取試劑盒和動物組織/細胞基因組DNA提取試劑盒,實驗選用的試劑盒須能夠提取到滿足後續實驗要求的模板DNA。
由於植物類中藥材種類繁多,可根據所鑑定的中藥材的具體情況對提取方法加以改進。例如:植物細胞內含有大量多糖、多酚等次生代謝產物,這些物質在提取DNA的過程中與DNA共沉澱,形成黏稠的膠狀物,難以溶解或氧化產生褐變,嚴重影響DNA提取的產量與質量,以及後續的PCR擴增實驗。但如在提取DNA過程中加入抗氧化劑β-巰基乙醇,則可抑制氧化反應,避免其褐化。再如:PVP(聚乙烯吡咯烷酮)是酚的絡合物,能與多酚形成一種不溶的絡合物質,有效去除多酚,減少DNA提取過程中酚的污染;同時它也能和多糖結合,有效去除多糖。因此若將PVP和β-巰基乙醇配合使用,能夠有效地防止DNA提取過程中多酚及多糖的污染。此外,乙二胺四乙酸(EDTA)能螫合Mg2+或Mn2+,從而抑制DNA酶(DNase)活性,防止DNA被其降解;在天然狀態下,DNA與蛋白質以DNA蛋白質複合物(DNP)的形式存在,十六烷基三甲基溴化銨(CTAB)是一種陽離子去污劑,可溶解細胞膜,並與DNA形成複合物,使細胞中的DNP釋放出來,該複合物在高鹽溶液(>0.7mol/L NaCl)中能充分溶解,存在於液相中,通過有機溶劑抽提,去除蛋白質、多糖、酚類等雜質後加入乙醇沉澱即可使DNA分離出來。三羥甲基氨基甲烷(Tris-HCl)(pH值8.0)溶液可提供一個緩衝環境,防止DNA被降解。
根、根莖、莖木類、皮類 通常根和根莖組織中多酚、多糖含量高,在研磨時多酚極易氧化成醌類,使DNA帶有一定顏色,在純化過程中很難去除,影響後續的PCR反應,所以在提取根及根莖類藥材DNA時一定要注意多糖、多酚的去除。提取此類藥材DNA時水浴時間一般爲90分鐘,對於質地堅硬的根、根莖類和莖木類藥材,可以延長水浴時間並降低水浴溫度,如56℃水浴8~12小時,使得DNA充分釋放到緩衝溶液中。此外,根莖類藥材由於富含纖維和澱粉等貯藏物質,需加大樣品量才能提取到足量DNA,可用大體積離心管(5ml或15ml)抽提。皮類中藥材組織中富含薄壁組織和纖維等,加液氮不易研磨成細粉,需適當增加樣品量,同時應增加β-巰基乙醇和PVP的使用量。
葉、花、全草類 該類藥材採用試劑盒法一般都能成功提取其DNA,對於保存時間較久的葉、花、全草類藥材可適當增加水浴時間,同時適當降低水浴溫度,如56℃水浴8~12小時。
果實、種子類 果實及種子類中藥材中多富含油脂,研磨時易被氧化,且易黏着在研鉢壁上,損失較大,提取時需增加樣品量。另外,對研磨後的材料可用丙酮浸提,去除脂溶性酚類化合物。
動物藥材 肌肉類動物藥材如海龍、蛇類、蛤蚧等,需使用75%乙醇擦拭表面消除外源性污染,待乙醇揮發後進行充分磨碎。含有脂類較多的動物內臟器官如蛤蟆油,首先用不含蛋白酶K和十二烷基硫酸鈉(SDS)的緩衝液浸泡藥材,SDS是一種陰離子表面活性劑,在55~65℃條件下能裂解細胞,釋放出核酸;然後在試劑盒消化緩衝液中增加SDS含量,有利於脫去脂類。角甲類藥材如龜甲、鱉甲和鹿茸等,由於DNA含量較低,樣品量要適當增大,也可用大體積離心管抽提。殼類藥材如石決明、瓦楞子、蛤殼等,由於存在共生或寄生生物,提取前需進行去除。
10.2.3 3.PCR擴增
植物類中藥材及其基原物種擴增ITS2或psbA-trnH序列,動物類中藥材及其基原物種擴增COI序列,通用引物及擴增條件如下,特殊規定見各藥材項下。
ITS2序列擴增正向引物ITS2F:5'-ATGCGATACTTG-GTGTGAAT-3';反向引物 ITS3R:5'-GACGCTTCTC-CAGACTACAAT-3'。psbA-trnH序列擴增正向引物ps-bAF: 5'-GTTATGCATGAACGTAATGCTC-3';反向引物trnHR:5'-CGCGCATGGTGGATTCACAATCC-3'。COI序列擴增正向引物HC02198: 5'-TAAACTTCAGGGTGAC-CAAAAAATCA-3';反向引物LCO1490:5'-GGTCAA-CAAATCATAAAGATATTGG-3'。
PCR反應體系以25μl爲參照,包括:1×PCR緩衝液(不含MgCI2),2.0mmol/L MgCl2,0.2mmol/L dNTPs,0.1μmol/L引物對,模板DNA,1.0 U Taq DNA聚合酶,加滅菌雙蒸水至25μl。設置未加模板DNA的PCR反應爲陰性對照。
ITS2序列擴增程序:94℃5分鐘;94℃30秒,56℃30秒,72℃45秒,35~40個循環;72℃10分鐘。psbA-trnH序列擴增程序:94℃5分鐘;94℃1分鐘,55℃1分鐘,72℃1.5分鐘,30個循環;72℃7分鐘。COI序列擴增程序:94℃1分鐘;94℃1分鐘,45℃1.5分鐘,72℃1.5分鐘,5個循環;94℃1分鐘,50℃1.5分鐘,72℃1分鐘,35個循環;72℃5分鐘。
10.2.4 4.PCR產物檢測
採取瓊脂糖凝膠電泳方法檢測PCR產物。電泳後,PCR產物應在相應的DNA條形碼序列長度位置(具體見各藥材項下)出現一條目的條帶,陰性對照應無條帶。
在紫外燈下迅速切取目的條帶所在位置的凝膠,採用瓊脂糖凝膠DNA回收試劑盒進行純化。
10.2.5 5.測序
使用DNA測序儀對目的條帶進行雙向測序,PCR擴增引物作爲測序引物,測序原理同Sanger測序法。有目的條帶的樣品在測序儀上進行雙向測序。
10.2.6 6.中藥材DNA條形碼序列獲得
(1)序列拼接 對雙向測序峯圖應用有序列拼接功能的專業軟件進行序列拼接,去除引物區。
(2)序列質量與方向 爲確保DNA條形碼序列的可靠性,需去除測序結果兩端信號弱或重疊峯區域,序列方向應與PCR擴增正向引物方向一致,獲得相應的DNA序列。
10.2.7 7.結果判定
將獲得的序列與國家藥品管理部門認可的中藥材DNA條形碼標準序列比對。
10.3 三、方法學驗證
應符合《中國藥典》2010年版一部“附錄XVIII A中藥質量
10.3.1 1.影響因素考察
考察DNA條形碼分子鑑定法的影響因素,包括DNA提取(樣品量、水浴溫度和水浴時間)、PCR條件(變性時間、退火溫度與時間及延伸時間)和產物純化(考察不同純化試劑盒),保證實驗方法的準確性。
10.3.2 2.方法適用性考察
採用DNA條形碼分子鑑定法對20批次以上藥材或基原物種進行測定,積累數據,確定種內序列變異大小,保證該測定方法的適用性。
10.3.3 3.基原物種對比驗證
以分類學家確認的基原物種葉片爲對象,採用該方法獲得DNA條形碼數據,與相應藥材產生的DNA條形碼數據進行對比,避免內生真菌等污染,保證結果準確性。
10.4 四、注意事項
(1)實驗場所應具備分子生物學實驗室的基本條件。
(2)本法暫不適用於混合物與炮製品的鑑定及硫磺燻蒸等造成不適用的情況。
(3)爲防止外源微生物污染,實驗前須將實驗用具進行高壓滅菌,並用75%乙醇擦拭藥材表面。有些藥材本身含有內生真菌,如果內生真菌存在於藥材的外圍組織,則選用內部組織進行實驗。如果真菌遍佈整個藥材,植物類藥材需選用psbA-trnH條形碼(真菌內不含有該基因片段),不能選用ITS2序列。爲進一步確保實驗結果不被真菌污染,實驗者可在GenBank數據庫應用BLAST方法對所獲ITS2序列進行檢驗,以確保序列鑑定準確。
(4)本法用於鑑定藥材的基原物種,不能確定藥用部位。(5)必要時結合其他鑑別方法綜合判斷。
(6)種內閾值的確定。同一物種的不同樣品間存在一定的變異範圍,即種內變異閾值。不同物種,不同條形碼序列均會影響種內變異範圍。各基原物種的種內變異範圍(種內遺傳距離閾值)應在藥材品種項下具體明確。
10.5 【附註】
1. ITS2:ITS(internal transcribed spacer of nuclear ribosomal DNA)爲內部轉錄間隔區,是核糖體RNA(rRNA)基因非轉錄區的一部分。ITS位於18S rRNA基因和28S rRNA基因之間,中部被5.8S rRNA基因一分爲二,即ITS1(thefirst internal transcribed spacer)區和ITS2(the second internal transcribed spacer)區。5.8S、18S和28S進化速率較慢,常用於探討科級和科級以上等級的系統發育問題。而間隔區ITS(包括ITS1和ITS2)進化速率較快,一般用於研究屬間、種間甚至居羣間等較低分類等級的系統關係。
2.psbA-trnH:psbA-trnH基因間區是位於葉綠體基因psbA基因和trnH基因之間的一段非編碼區,該間區進化速率較快,常用於植物屬間、種間的系統發育研究。
3.COI:COI爲線粒體基因組的蛋白質編碼基因,全稱爲細胞色素C氧化酶亞基Ⅰ (cytochrome C oxidase subunit I),由於該基因進化速率較快,常用於分析親緣關係密切的種、亞種及地理種羣之間的系統關係。