1 拼音
G B Z / T 3 2 8 — 2 0 2 3 fàng shè gōng zuò rén yuán zhí yè jiàn kāng jiǎn chá wài zhōu xiě lín bā xì bāo wēi hé jiǎn cè fāng fǎ yǔ shòu zhào jì liàng gū suàn biāo zhǔn
2 英文參考
Standard for the method of micronucleus detection in lymphocytes on occupational health examination for radiation workers and exposure dose estimation
3 基本信息
ICS 13.100
CCS C 60
中華人民共和國家職業衛生標準GBZ/T 328—2023《放射工作人員職業健康檢查外周血淋巴細胞微核檢測方法與受照劑量估算標準》(Standard for the method of micronucleus detection in lymphocytes on occupational health examination for radiation workers and exposure dose estimation)由中華人民共和國國家衛生健康委員會於2023年03月07日《關於發佈《低能射線裝置放射防護標準》等5項標準的通告》(國衛通〔2023〕1號)發佈,自2023年09月01日起實施。本標準代替 WS/T 187—1999。
4 發佈通知
國衛通〔2023〕1號
現發佈《低能射線裝置放射防護標準》等5項標準,編號和名稱如下:
一、強制性國家職業衛生標準
GBZ 115—2023 低能射線裝置放射防護標準(代替GBZ 115—2002)
二、推薦性國家職業衛生標準
GBZ/T 328—2023 放射工作人員職業健康檢查外周血淋巴細胞微核檢測方法與受照劑量估算標準(代替WS/T 187—1999)
三、強制性衛生行業標準
WS 816—2023 醫用質子重離子放射治療設備質量控制檢測標準
WS 817—2023 正電子發射斷層成像(PET)設備質量控制檢測標準
WS 818—2023 錐形束X射線計算機體層成像(CBCT)設備質量控制檢測標準
上述1項推薦性標準自2023年9月1日起施行,WS/T 187—1999同時廢止;4項強制性標準自2024年3月1日起施行,GBZ 115—2002同時廢止。
特此通告。
國家衛生健康委
2023年3月7日
5 前言
本標準代替WS/T 187—1999《淋巴細胞微核估算受照劑量方法》。與WS/T 187—1999相比,除結構調整和編輯性改動外,主要技術變化如下:
a) 在範圍中增加了“放射工作人員職業健康檢查和受照劑量估算中,外周血淋巴細胞微核的標本製備、微核檢測、結果評價、劑量估算方法和質量控制。”適用範圍增加了“放射工作人員職業健康檢查微核檢測”(見第 1 章);
b) 增加了規範性引用文件(見第 2 章);
c) 術語和定義中刪除了“生物劑量計”和“松胞素-B”(見 WS/T 187—1999 的 2.1 和 2.5),增加了“生物劑量估算”“常規培養微核法” 和“微核率”(見 3.1、3.3 和 3.6),更改了“微核”(見 3.2,見 WS/T 187—1999 的 2.3)
d) 刪除了“劑量-效應曲線的建立方法”(見 WS/T 187—1999 的第 3 章);
e) 增加了“標本採集與微量全血培養”“微核標本製備”“微核分析”“檢測結果判斷”“檢測報告與歸檔”“劑量-效應標準曲線的建立”“劑量估算”和“質量控制”(見第 4 章~第11 章);
f) 更改了“CB 微核法估算受照劑量的原則”(見第 12 章,WS/T 187—1999 的第 4 章);
g) 更改了正確使用本標準的說明(見附錄 D,WS/T 187—1999 的附錄 A);
h) 增加了附錄 A 主要儀器設備和試劑配製(見附錄 A);
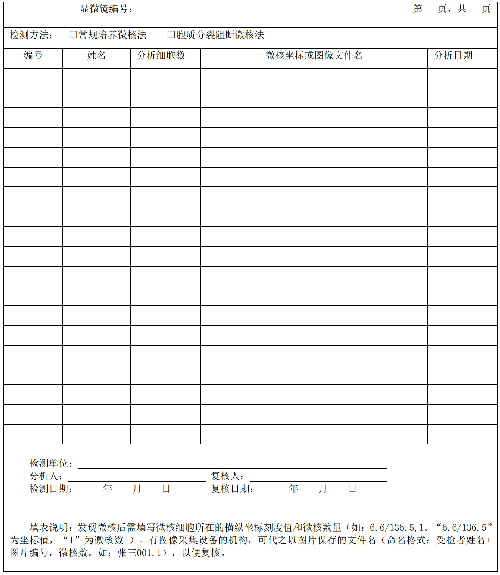
i) 增加了附錄 B 微核分析記錄表和微核檢測報告單(見附錄 B);
j) 增加了附錄 C 放射事故受照人員生物劑量估算應用示例(見附錄 C);
k) 增加了參考文獻。
本標準由國家衛生健康標準委員會放射衛生標準專業委員會負責技術審查和技術諮詢,由中國疾病預防控制中心負責協調性和格式審查,由國家衛生健康委職業健康司負責業務管理、法規司負責統籌管理。
本標準起草單位:中國醫學科學院放射醫學研究所、中國疾病預防控制中心輻射防護與核安全醫學所、河南省職業病防治研究院、蘇州大學。
本標準主要起草人:劉強、劉青傑、呂玉民、郝建秀、王彥、李爽、韓林、陳娜、李旭光、姜恩海。
本標準於1999年首次發佈爲WS/T 187—1999,本次爲第一次修訂。
6 標準正文
放射工作人員職業健康檢查外周血淋巴細胞微核檢測方法與受照劑量估算標準
6.1 1 範圍
本標準規定了放射工作人員職業健康檢查和受照劑量估算中,外周血淋巴細胞微核的標本製備、微核檢測、結果評價、劑量估算方法和質量控制。
本標準適用於放射工作人員職業健康檢查微核檢測和急性全身外照射受照人員的劑量估算。
6.2 2 規範性引用文件
下列文件中的內容通過文中的規範性引用而構成本標準必不可少的條款。其中,注日期的引用文件,僅該日期對應的版本適用於本標準;不注日期的引用文件,其最新版本(包括所有的修改單)適用於本標準。
GBZ/T 248 放射工作人員職業健康檢查外周血淋巴細胞染色體畸變檢測與評價
6.3 3 術語和定義
下列術語和定義適用於本標準。
3.1
生物劑量估算 biological dose estimation
用具有穩定劑量-效應關係的分子或亞細胞結構變化等生物學指標定量估算受照射個體的輻射吸收劑量的方法。
3.2
微核 micronucleus
由於基因組DNA損傷導致細胞分裂後期滯後的染色體斷片、一個或多個染色體不能隨有絲分裂進入子細胞,而在細胞質中形成直徑小於主核的三分之一且完全與主核分開的圓形或橢圓形小核。
3.3
常規培養微核法 routine micronucleus method
採用微量全血培養法培養淋巴細胞,培養結束後經低滲、固定、製片和染色進行觀察和分析微核的方法。
3.4
胞質分裂阻斷微核法 cytokinesis-block micronucleus method
CB 微核法
在培養的淋巴細胞完成第一次有絲分裂前,向培養體系中加入松胞素-B,阻滯胞質分裂,培養結束後經低滲、固定、製片和染色,只計數和分析雙核淋巴細胞中微核的方法。
3.5
微核細胞 micronucleus cell
如採用常規培養微核法,指胞質中含有微核的轉化淋巴細胞;如採用CB微核法,指胞質中含有微核的雙核淋巴細胞。
3.6
微核率 micronucleus frequency
如採用常規培養微核法,指每1000個轉化的淋巴細胞中含有的微核數;如採用CB微核法,指每1000個雙核淋巴細胞中含有的微核數。
3.7
劑量-效應曲線 dose-effect curve
6.4 4 標本採集與微量全血培養
6.4.1 4.1 主要儀器和試劑配製
主要儀器和試劑配製參見附錄A。
6.4.2 4.2 外周靜脈血採集
採集靜脈血約2 mL,肝素抗凝,顛倒混勻,靜脈血保存最佳溫度是18 ℃~24 ℃,72 h內送達實驗室。
6.4.3 4.3 微量全血培養步驟
4.3.1 將採集的靜脈血 0.3 mL~0.5mL 加入 4mL~5mL 含植物血凝素和 10%~20%胎牛血清的洛斯維帕克紀念研究所-1640(RPMI-1640)培養基中,在培養容器上編號並註明培養開始時間和日期,輕輕搖勻,37 ℃±0.5 ℃恆溫培養。
4.3.2 如採用常規培養微核法,培養至 68 h~72 h 收穫細胞。
4.3.3 如採用胞質分裂阻斷微核法,培養至 40 h~44 h,加入松胞素-B,使其終濃度爲 6 μg/mL,繼續培養至 72 h 收穫細胞。
6.5 5 微核標本製備
6.5.1 5.1 低滲
吸棄培養液上清,搖勻,每管加入4 mL 37℃預溫的KCl低滲液(常規培養法低滲液濃度宜爲0.075mol/L,CB微核法低滲液濃度宜爲0.1 mol/L),輕輕吹打均勻,立即加入新配製的固定液0.5 mL~1 mL(甲醇:冰醋酸體積比3:1),混勻,移至10 mL~15 mL離心管中,水平離心機離心8 min~10 min,離心力爲200 g~250 g。
6.5.2 5.2 固定
棄上清,搖勻,加入4.5 mL固定液,固定20 min~30 min,水平離心機離心8 min~10 min,離心力爲200 g~250 g。離心後可用固定液洗滌細胞,以減少細胞懸液中的雜質。
6.5.3 5.3 製片
棄上清,視細胞數量酌情加入固定液數滴,充分混勻,將細胞懸液均勻滴在潔淨乾燥載玻片上,室溫乾燥。
6.5.4 5.4 編號
6.5.5 5.5 染色
用體積比爲8%~10%的瑞氏-吉姆薩染液或吉姆薩染液染色8 min~10 min,輕輕沖洗,室溫乾燥。
6.6 6 微核分析
6.6.1 6.1 閱片
盲法閱片。按顯微鏡載物臺刻度座標,從右至左逐列或逐行對每張微核標本玻片進行掃描式閱片,常規培養微核法尋找轉化的單核淋巴細胞,如果採用CB微核法,即尋找雙核淋巴細胞,對每位受檢者至少分析1000個轉化淋巴細胞。
6.6.2 6.2 雙核淋巴細胞的判定標準
細胞應爲雙核細胞,同一個雙核細胞中的兩個細胞核應具有各自完整的核膜,並位於相同的細胞質邊界內,兩個細胞核大小、質感和染色強度應大致相等,兩個細胞核完全分離,或者可由一個或多個核質橋連接,核質橋不超過核直徑的1/4,兩個細胞核重疊時,應看到各自的完整核膜。雙核細胞的細胞質邊界或細胞膜應完整,並與相鄰細胞的細胞質邊界明顯區分。
6.6.3 6.3 微核的判定標準
微核應遊離於胞質中,與主核完全分開,直徑爲主核的1/16~1/3,與主核不連接,不重疊(重疊或相切時,應看到各自的完整核膜),無折光性,與染料顆粒等雜質相區別,着色深淺與主核相同或略淺。
6.6.4 6.4 分析和記錄
常規培養微核法觀察轉化的單核淋巴細胞,CB微核法觀察雙核淋巴細胞,如發現微核,應在微核分析記錄表中記錄顯微鏡座標,有條件的機構可拍照,在微核分析記錄表中記錄圖片文件名,以備複覈。微核分析記錄表樣式參見附錄B。
6.7 7 檢測結果判斷
7.1 常規培養法微核率的正常參考值範圍 0~6‟;CB 法微核率的正常參考值範圍 0~30‟。
7.2 對檢測結果超出正常參考值範圍者,可檢查外周血淋巴細胞染色體畸變。
6.8 8 檢測報告與歸檔
8.1 對每位受檢者應出具外周血微核檢測報告單。檢測報告單樣式參見附錄 B。
8.2 檢測的微核標本應保存兩年。微核記錄表等原始資料應建檔長期保存,並建立電子檔案。
6.9 9 劑量-效應標準曲線的建立
6.9.1 9.1 樣品要求
採血前應獲取志願者的知情同意。志願者2名~4名健康成年人,非放射工作者,男女各半,年齡在18歲~60歲,無煙酒嗜好,半年內無急慢性疾病史、無射線和化學毒物接觸史,近一個月內無病毒感染史。抽取靜脈血6 mL~8 mL,注入肝素抗凝管。
6.9.2 9.2 照射、培養和分析
9.2.1 應提供可靠的、明確的照射樣品的物理劑量。受照樣品應與照射源保持一定的距離以達到均勻照射的目的。有條件的實驗室應建立包括不同輻射類型(如 X 射線、γ 射線、中子)、不同劑量率(低 LET輻射)的劑量-效應標準曲線。對於低 LET 輻射,劑量範圍選擇 0.25 Gy~5.0 Gy,劑量率介於 0.3 Gy/min~1.O Gy/min 之間,選擇不少於 8 個劑量點,其中,0.25 Gy~1.0 Gy 範圍內刻度曲線的劑量點不少於 4個。劑量點可選擇 0.25 Gy、0.5 Gy、0.75 Gy、1.0 Gy、2.0 Gy、3.0 Gy、4.0 Gy 和 5.0 Gy。對於高LET 輻射,劑量範圍選擇 0.05 Gy~3.0 Gy,劑量點可選擇 0.05 Gy、0.1 Gy、0.5 Gy、1.0 Gy、1.5 Gy、2.0 Gy、2.5 Gy 和 3.0 Gy。
9.2.2 培養方法同本標準第 4 章。
9.2.3 微核標本製備、分析和記錄按照本標準第 5 章和第 6 章中所述方法進行。

式中:
6.9.3 9.3 劑量-效應標準曲線擬合
對X或γ射線誘導的微核與受照射劑量之間的劑量-效應關係以擬合一次方程或二次多項式爲宜,按照公式(2)或公式(3)進行擬合。
a) 一次方程模式
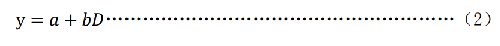
式中:
y——微核率,(‟);
a——本底微核率;
b——迴歸係數;
D——吸收劑量,單位爲戈瑞(Gy)。
b) 二次多項式模式
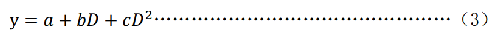
式中:
y——微核率,(‟);
a——本底微核率;
b——迴歸係數;
D——吸收劑量,單位爲戈瑞(Gy);
c——迴歸係數。
6.10 10 劑量估算
6.10.1 10.1 微核標本的製備
所要估算劑量樣品的微核標本製備方法均應與建立劑量-效應曲線的方法相同。
6.10.2 10.2 微核率、微核率的不確定度的計算
當分析細胞數足夠多時(一般要求≥1000),微核檢測值符合泊松分佈,微核率和微核率的不確定度分別按照公式(4)和公式(5)計算:
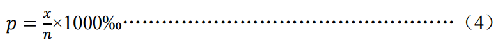
式中:
p——微核率,(‰);

式中:
p——微核率,(‰);
6.10.3 10.3 微核率的置信限計算

式中:
p——微核率,(‟);
當置信限下限<0時,覆蓋區間下限默認爲0。
6.10.4 10.4 受照劑量的估算
將所要估算劑量的標本中得到的微核率及95%置信限的上下限代入建立的劑量-效應標準曲線,估算出受照劑量。放射事故受照人員生物劑量估算示例參見附錄C。
6.11 11 質量控制
11.1 進行微核標本製備與分析的實驗室應有 2 名(含)以上專業技術人員,掌握電離輻射生物效應和細胞遺傳學基礎知識,熟練掌握顯微鏡下微核分析技術。每個微核需 2 名專業技術人員相互確認。
11.2 標本應有唯一性編號,標本分析完畢後,應置於玻片盒內保存,並做好記錄。
11.4 正確使用本標準的說明參見附錄 D。
6.12 12 CB 微核法估算劑量的原則
12.1 事故後應儘早取血,不宜超過 4 周。
12.2 培養條件、製片方法和微核的判斷標準應與建立劑量-效應曲線時相同。對估算劑量的個體,至少應分析 500 個以上的雙核淋巴細胞。對受照劑量較大的個體,如達不到上述細胞數,可全片計數所有雙核淋巴細胞。
7 附錄A(規範性)主要儀器設備和試劑配製
7.1 A.1 主要儀器設備
A.1.1 超淨工作臺:用於細胞接種。
A.1.5 冰箱:至少具備-20℃和4℃條件,用於儲存實驗用試劑。
A.1.6 水浴鍋:用於細胞低滲。
7.2 A.2 主要試劑的配製
A.2.1 RPMI-1640培養基、低滲液、固定液、磷酸鹽緩衝液和吉姆薩染液的配製參照GBZ/T 248的規定。
A.2.2 松胞素-B儲存液:松胞素-B儲存液應避光保存。松胞素-B的分子式爲C29H37NO5,不溶於水,易溶於二甲基亞碸,在培養體系中適宜的濃度可以抑制細胞運動和細胞質分裂,而不影響細胞核分裂。將松胞素-B溶於二甲基亞碸中,濃度爲2mg/mL,-20℃儲存,用前融化,生理鹽水稀釋,加入培養體系後的終濃度爲6μg/mL。
9 附錄C(資料性)放射事故受照人員生物劑量估算應用示例
某人受60Co γ射線一次全身照射,照後48h內取血,採用微量全血法培養淋巴細胞,分析800個雙核淋巴細胞,發現微核514個,估算其生物劑量。
每細胞微核數爲0.6425×1000‟=642.5‟,微核率的不確定度爲√ /800×1000‟=28.3‟。
微核率的95%置信限爲642.5‟±1.96×28.3‟,即587.0‟~698.0‟。
根據本實驗室所建立的60Co γ射線照射離體血建立的CB微核劑量-效應曲線:
Y = 17.9119+33.3838D+42.8809D2,該曲線的劑量範圍爲0.1 Gy~5.0 Gy,劑量率爲0.38 Gy/min,Y爲微核率(‟),D爲劑量(Gy)。
將642.5‟、587.0‟和698.0‟分別代入Y項,解方程後求出平均劑量爲3.45 Gy,下限爲3.27 Gy,上限爲3.61 Gy,估算劑量結果均值爲3.45Gy,95%置信水平的劑量範圍爲:3.27 Gy~3.61 Gy。
9.1 附錄D(規範性)正確使用本標準的說明
D.1 本標準對常規培養微核和CB微核技術進行了規定,建議本標準的使用單位在放射工作人員的職業健康檢查中視本單位情況選擇具體的培養方法,在應急劑量估算中採用CB微核法進行劑量估算。
D.3 兩種微核法的正常參考值個體差異較大,隨年齡變化的波動也較大,各單位可參考本標準中規定的正常參考值,也可根據本實驗室的總結分析結果來確定其正常參考值。對於檢測結果的判斷,各單位也可根據其確定的正常參考值進行判斷是否異常。
D.4 微量全血培養過程的培養時間給出了時間段範圍,各實驗室可依據本實驗室的具體情況而定。
D.5 本標準規定了標本製備過程中KCl低滲液的濃度、固定液成分和染色時間,各實驗室可依據本實驗室的具體情況而定。
D.6 本標準第 9 章給出了劑量-效應標準曲線的擬合包括一次方程或二次多項式,在實踐應用中常用二次多項式進行生物劑量估算。
10 參考文獻
[1] ISO 17099:2014 Radiological protection - Performance criteria for laboratories using the cytokinesis block micronucleus (CBMN) assay in peripheral blood lymphocytes for biological dosimetry,ISO,2014.
[2] IAEA. Cytogenetic dosimetry: applications in preparedness for and response to radiation emergencies - A Manual. Technical Document Publications, IAEA,Vienna 2011.