3 基本信息
ICS 11.020
C 50
中華人民共和國衛生行業標準WS/T 224—2018《真空採血管的性能驗證》(Performance verification of vacuum tubes for venous blood specimen)由中華人民共和國國家健康委員會於2018年04月27日《關於發佈〈真空採血管的性能驗證〉等4項推薦性衛生行業標準的通告》(國衛通〔2018〕7號)發佈,自2018年11月01日起實施。本標準代替 WS/T 224—2002。
4 發佈通知
關於發佈《真空採血管的性能驗證》等4項推薦性衛生行業標準的通告
國衛通〔2018〕7號
現發佈《真空採血管的性能驗證》等4項推薦性衛生行業標準,編號和名稱如下:
WS/T 224—2018 真空採血管的性能驗證(代替WS/T 224—2002)
WS/T 404.4—2018 臨牀常用生化檢驗項目參考區間 第4部分:血清總膽紅素、直接膽紅素
WS/T 573—2018 感染性疾病免疫測定程序及結果報告
上述標準自2018年11月1日起施行。
特此通告。
國家衛生健康委員會
2018年4月27日
5 前言
本標準按照GB/T 1.1-2009給出的規則起草。
本標準代替WS/T 224-2002《真空採血管及其添加劑》。
與WS/T 224-2002相比,除編輯性修改外主要變化如下:
——增加了真空採血管的臨牀評價指標(見4.4~4.6和4.8);
——刪除了原標準中部分由生產廠商測試的內容(2002年版4~7和9-13);
——修改了管體強度標準,將相對離心力提高到3000g(見4.3,2002年版8.1)。
本標準起草單位:廣東省人民醫院、中山大學孫逸仙紀念醫院、廣州醫科大學附屬第一醫院、同濟大學附屬同濟醫院。
本標準主要起草人:鄒偉民、李紅玉、林勇平、萬海英、鄧冠華。
6 標準正文
6.1 1 範圍
本標準適用於臨牀實驗室在正式使用新採血管前對其進行性能驗證。對正在使用的採血管的檢測結果有疑問、查找原因可能與採血管相關時,也可採用本標準對採血管進行性能驗證。
6.2 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅注日期的版本適用於本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
6.3 3 術語和定義
下列術語和定義適用於本文件。
3.1
添加劑 additive
在一個標本採集管中,添加的任何促進一個預定功能(如防止凝血或糖酵解)的試劑。
注:儘管容器蓋不被認爲是一種添加劑,但它可能含有或塗覆添加劑,若它們進入標本中接觸,應被認爲是添加劑。
3.2
促凝劑 clot activator
用於激發凝血機制的試劑。
3.3
抗凝劑 anticoagulant
3.4
偏倚 bias
3.5
管蓋 tube closure
密閉容器的組件。
注:管蓋的作用使採血後容器的口部與外界形成隔離以確保安全,一般管蓋內部還有一個能與容器口部形成密封的塞體以保護血樣,本標準稱其爲管蓋而不稱其爲塞子,目的是突出其安全作用。
3.6
公稱液體容量 nominal liquid capacity,NLC
3.7
重量測定分析法 gravimetric analysis
通過稱重和校正液體的質量密度測定液體體積的方法。
注:本文件中,以1000mL水的質量爲1000g。
3.8
抽吸量 draw volume,DV
注:在標準條件(溫度18℃~25℃,標準大氣壓)下,真空採血管採水到平衡時的總重量。
3.9
真空採血管 vacuum tube
3.10
採血管附加物 receptacle accessory
示例:放入血清或血漿採血管中的小型塑料惰性球(或分離膠),用於離心後從血液中分離血清或血漿。
3.11
樣本 sample
研究中實際觀測或調查的一部分個體。通過檢查、研究和分析樣本的特徵來反映總體情況。
3.12
驗證 verification
通過提供客觀證據對規定要求已得滿足的認定。
6.4 4 真空採血管的性能驗證
6.4.1 4.1 外觀
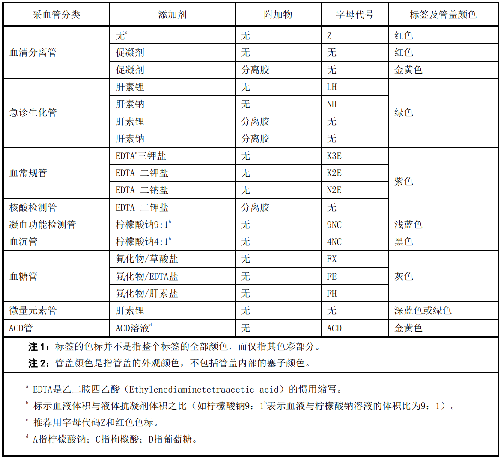
試管應透明,無異物;試管無變形和破損;標識應清晰(真空採血管標籤及管蓋顏色國際通用標準參見附錄A);管蓋無脫落;採血管內的分離膠的膠體應呈凝膠狀。
6.4.2 4.2 抽吸量
6.4.2.1 4.2.1 要求
抽吸量應準確,抽吸量與公稱液體容量的相對偏倚應在-10%~10%之間。
6.4.2.2 4.2.2 驗證方法
6.4.2.2.1 4.2.2.1 試劑
水,符合GB/T 6682的三級水的要求,溫度在18℃~25℃。
6.4.2.2.2 4.2.2.2 儀器
500mL燒杯;考察管;濾紙;分析天平;20G(內徑38mm)標準雙向軟連接採血針。
6.4.2.2.3 4.2.2.3 取樣
採用一次抽樣方案取樣,隨機抽取30支,按照標準操作進行採水,記錄相關數據。
6.4.2.2.4 4.2.2.4 步驟(重量測定分析法)
a) 將 500mL 的燒杯裝滿水;
b) 將 1~30 支管進行編號且稱重,這爲採血管的初始重量,記爲 Wi1,其中 i 爲 1~30;
c) 將採血針的靜脈穿刺針(穿透一個純膠塞)浸入盛滿水的燒杯中,另一端的管塞穿刺針刺穿真空採血管的膠塞進行採水,保持採血管的高度與水液麪的高度大致一致,採水達到平衡時拔管;
d) 依次將編號爲 1~30 的採血管進行採水,注意燒杯內水的液麪高度與採血管的液麪高度保持在同一水平線上;
e) 採水完畢,用濾紙吸取膠塞表面可能殘留的水分;
f) 然後將採水後編號爲 1~30 的採血管進行稱重,這是真空採血管採水後的重量,記爲 Wi2,其中 i 爲 1~30;
g) 抽吸量的計算見式(1):

式中:
Wi1----採血管的初始重量,單位爲克(g);
Wi2----採血管採水後的重量,單位爲克(g);
i ----自然數編號,範圍爲1~30;
DV----抽吸量,單位爲克(g);
N ----檢測對象的總量,即 N=30。
注:本標準中,以 1000mL 水的質量爲 1000g。
h) 抽吸量與公稱液體容量之間的相對偏差(relative deviation,簡寫爲 RD),其計算見式(2):
RD=(DV-NLC)/NLC×100% ................................. (2)
式中:
RD ----相對偏差;
DV ----抽吸量,單位爲克(g);
NLC----公稱液體容量,單位爲毫升(mL)。
6.4.3 4.3 管體強度
6.4.3.1 4.3.1 要求
採血管在水平式離心機下應能承受 3000g 的相對離心力,即測試採血管在充裝水至刻度線的條件下,用水平式離心機採用 3000g 的相對離心力,離心 10min 而不發生破裂或泄露。
6.4.3.2 4.3.2 驗證方法
6.4.3.2.1 4.3.2.1 試劑
水,符合GB/T 6682的三級水的要求,溫度在18℃~25℃。
6.4.3.2.2 4.3.2.2 儀器
500mL燒杯;水平離心機,最大能提供5000g相對離心力。
6.4.3.2.3 4.3.2.3 步驟
a) 隨機抽取 30 支採血管充裝水至刻度線,並保持採血管外觀乾淨,無液體;
b) 將 30 支採血管放入水平離心機中,注意離心機的平衡;
c) 設置離心參數,當轉速穩定時的最大相對離心力爲 3000g,離心時間爲 10min(例:離心半徑爲 17cm,轉速爲 4000r/min,離心 10min);
6.4.4 4.4 血清分離管纖維蛋白掛壁
6.4.4.1 4.4.1 要求
按照 4.4.2.2 的步驟進行測試,血清分離管離心後不應出現纖維蛋白掛壁。
注:若採用分離膠促凝管進行測試時,可以增加評估分離膠的性能。
6.4.4.2 4.4.2 驗證方法
6.4.4.2.1 4.4.2.1 儀器
考察管;採血針;醫用消毒用具;40 個靜脈血標本;水平離心機;試管架。
6.4.4.2.2 4.4.2.2 步驟
a) 試驗條件:溫度爲 18℃~25℃,壓力爲當地的環境大氣壓;
b) 將採血管進行編號,考察管依次爲 1~40;
c) 按照標準的採血操作流程進行採血,每個人採 1 支管,採血後立刻進行搖勻(按照製造商規定的搖勻次數),然後豎直放置在試管架上靜置;
d) 當全部 40 個人採完血後,開始記時;
e) 30min 後將 40 支管一次全部放入離心機中進行離心操作;
g) 離心完畢,取出 40 支管觀察並記錄有無纖維蛋白掛壁現象。
6.4.5 4.5 溶血情況
6.4.5.1 4.5.1 要求
按照 4.4.2.2 的步驟進行測試,採血管採血後進行離心,不應出現溶血(排除臨牀原因)。
6.4.5.2 4.5.2 驗證方法
a) 按照 4.4.2.1、4.4.2.2a)~f)的內容進行操作;
6.4.6 4.6 抗凝管的凝血情況
6.4.6.1 4.6.1 要求
按照 4.4.2.2 的步驟進行採血,抗凝管中充分混勻的血液標本在顯微鏡下觀察應無凝塊。
6.4.6.2 4.6.2 驗證方法
a) 按照 4.4.2.1、4.4.2.2 a)~d)的內容進行操作;
注:4.4~4.6三項指標的評價可以結合臨牀性能評價一起進行測試。
6.4.7 4.7 無菌
6.4.7.1 4.7.1 要求
真空採血管內腔應無菌,即按照 4.7.2.3 的步驟進行測試,結果判定爲合格。
6.4.7.2 4.7.2 驗證方法
6.4.7.2.1 4.7.2.1 試劑
75%酒精溶液;75%酒精棉球;硫乙醇酸鹽液體培養基;改良馬丁培養基;0.9%無菌氯化鈉溶液。
6.4.7.2.2 4.7.2.2 儀器
隔水式恆溫培養箱;生化培養箱;生物顯微鏡;自動高壓滅菌器;電熱恆溫乾燥箱;酒精燈;火機;鑷子。
6.4.7.2.3 4.7.2.3 步驟
b) 供試液的製備:含液體的採血管如凝血功能檢測管、血沉檢測管,以其管內含有的液體爲供試液;不含液體的¢16mm×100mm 採血管用 5mL0.9%無菌氯化鈉溶液進行振盪溶解,作爲供試液備用;不含液體的¢13mm×100mm 的採血管用 4mL0.9%無菌氯化鈉溶液進行振盪溶解,作爲供試液備用;不含液體的¢13mm×75mm 的採血管用 3mL0.9%無菌氯化鈉溶液進行振盪溶解,作爲供試液備用;
c) 供試樣品的培養:將供試液置於裝有硫乙醇酸鹽液體培養基、改良馬丁培養基的容器中進行培養;
d) 培養及觀察:上述含培養基的容器按規定的溫度(細菌 30℃~35℃,真菌 23℃~28℃)培養14d。培養期間應逐日觀察並記錄是否有菌生長。若出現異常時則每天上、下午各觀察一次。
如在加入供試品後或在培養過程中,培養基出現渾濁,培養 14d 後,不能從外觀上判斷有無菌生長,可取該培養液適量轉種至同種新鮮培養基中或劃線接種於斜面培養基上,細菌培養 2d,真菌培養 3d,觀察接種的同種新鮮培養基是否再出現渾濁或斜面上有無菌生長;或用接種環取培養液塗片,染色,鏡檢,進行判斷是否有菌生長。
e) 陰性對照:取同一批號空白硫乙醇酸鹽流體培養基、改良馬丁培養基各一支作爲陰性對照。陰性對照不得有菌生長。
f) 陽性對照:在生物安全櫃操作,接種金黃色葡萄球菌至營養肉湯培養基中,30℃~35℃培養18h~24h。用 0.9%無菌氯化鈉溶液製成小於 100CFU/mL 的菌懸液。菌懸液製備後保存在 2℃~8℃,24h 內使用。接種 1mL 小於 100CFU 的金黃色葡萄球菌菌懸液於硫乙醇酸鹽流體培養基中,應生長良好。
g) 結果判定:當供試品管液體均顯澄清,陰性對照管液體均顯澄清,陽性對照管液體顯渾濁時供試品管爲合格;當陰性對照管液體顯澄清,陽性對照管液體顯渾濁,供試品管液體顯渾濁時供試品管爲不合格;當陰性對照管液體顯渾濁或陽性對照管液體顯澄清時,實驗無效。
6.4.8 4.8 結果可比性
6.4.8.1 4.8.1 確定需要進行結果比對的檢測項目
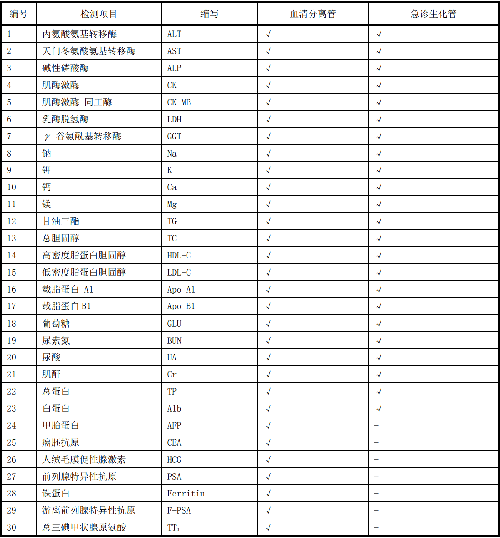
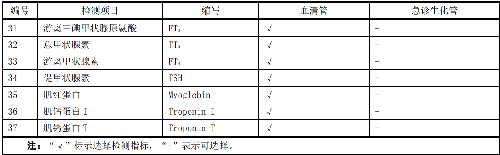
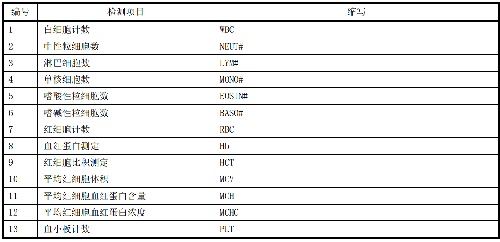
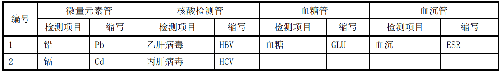
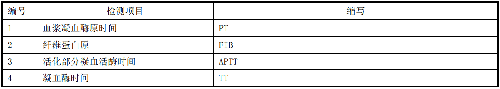
一般情況下,應對臨牀檢測報告上的檢測項目進行可比性驗證,可優先對附錄B中的檢測項目進行驗證。
6.4.8.2 4.8.2 確定用於檢測的檢測儀器
實施結果比對時,應對用於檢測臨牀樣本的檢測系統進行可比性驗證。
6.4.8.3 4.8.3 比對樣本
6.4.8.3.1 4.8.3.1 樣本選擇
6.4.8.3.2 4.8.3.2 樣本濃度水平
樣本濃度應在方法的線性範圍內,並覆蓋醫學決定水平。分析樣本的濃度應儘可能在線性範圍內均勻分佈。
6.4.8.4 4.8.4 要求
可比性驗證的可接受標準應滿足臨牀需要,同時考慮檢測系統的性能狀況。
不同項目分析質量要求可採用國家認可機構設置的分析質量的最低標準。
採血管不同項目比對結果的相對偏倚若符合分析質量要求,表明考察管可滿足臨牀應用要求。
6.4.8.5 4.8.5 驗證方法
6.4.8.5.1 4.8.5.1 採血管選擇
只需使用兩種不同的採血管一個批號的產品同時採血進行實驗,一種是比對管,一種是考察管。
6.4.8.5.2 4.8.5.2 樣本要求
至少分析20個不同的臨牀患者樣本。只有在室內質控合格的情況下,實驗室數據纔有效。
6.4.8.5.3 4.8.5.3 線性迴歸分析
4.8.5.3.1 擬合線性迴歸方程以比對管的檢測值爲X,考察管的檢測值爲Y進行線性擬合。利用所有樣本測定的有效數據,線性迴歸方程見式(3):
Y=bX+a ......................................... (3)
式中:
b----直線的斜率;
a----直線的截距;
Y----考察管的檢測值。
4.8.5.3.2 計算線性迴歸相關係數利用所有樣本測定值進行線性迴歸後得相關係數(以r或R2 表示)。
4.8.5.3.3 線性迴歸相關係數判定如果r≥0.975(或R2≥0.95),則認爲選擇的數據範圍適合,數據滿足要求。該分析的誤差可以由數據範圍給以適當補償,並且可以採用簡單的線性迴歸方程來評價斜率和截距。
如果R2<0.95,那麼必須通過分析另外一些樣品以擴大數據範圍,然後再檢查全部數據系列,如仍然R2 <0.95,則應尋找待評價方法存在的缺陷,糾正後重新進行試驗。
6.4.8.5.4 4.8.5.4 相對偏倚的計算及判定
4.8.5.4.1 相對偏倚的計算將醫學決定水平(以Xc表示)代入式(3),得到預期偏倚(以Bx表示),其計算見式(4):
Bx=a+(b-1)Xc ..................................... (4)
式中:
Xc----醫學決定水平;
b ----式(3)中的直線的斜率;
a ----式(3)中的直線的截距。
從而相對偏倚(relative bias,簡寫爲Rb)的計算見式(5):
Rb=Bx/Xc×100%...................................... (5)
式中:
Xc----醫學決定水平;
Rb----相對偏倚。
4.8.5.4.2 相對偏倚的判定不同檢測項目的相對偏倚應符合國家認可機構設置的分析質量的最低標準。
6.4.8.6 4.8.6 可比性驗證結果不符合要求的處理措施
對於不符合可比性驗證要求的採血管,應分析原因,必要時採取相應的糾正措施,其後應對其進行比對,確認比對結果符合分析質量要求。
9 參考文獻
[1] Validation and Verification of Tubes for Venous and Capillary Blood Specimen Collection; Approved Guideline. CLSI document GP34-A.
[2] Method Comparison and Bias Estimation Using Patient Samples; Approved Guideline – Second Edition (Interim Revision). CLSI document EP09-A2-IR.
[3] Procedures for the Handling and Processing of Blood Specimens for Common Laboratory Tests; Approved Guideline – Fourth Edition. CLSI document GP44-A4.
[4] User Verification of Performance for Precision and Trueness; Approved Guideline – Second Edition. CLSI document EP15-A2.
[5] Tubes and Additives for Venous and Capillary Blood Specimen Collection; Approved Standard – Sixth Edition. CLSI document GP39-A6.
[6] YY/T 0314—2007 一次性使用人體靜脈血樣採集容器