3 基本信息
ICS 11.020
CCS C 05
中華人民共和國衛生行業標準 《WS/T 795—2022 兒科輸血指南》(Guideline for pediatric transfusion)由中華人民共和國國家衛生健康委員會於2022年01月21日《關於發佈《輸血相容性檢測標準》等3項推薦性衛生行業標準的通告》(國衛通〔2022〕1號)發佈,自2022年06月01日起實施。
4 發佈通知
關於發佈《輸血相容性檢測標準》等3項推薦性衛生行業標準的通告
國衛通〔2022〕1號
現發佈《輸血相容性檢測標準》等3項推薦性衛生行業標準,編號和名稱如下:
輸血相容性檢測標準:WS/T 794—2022
兒科輸血指南:WS/T 795—2022
上述標準自2022年6月1日起施行。
特此通告。
國家衛生健康委
2022年1月21日
5 前言
本標準由國家衛生健康標準委員會血液標準專業委員會負責技術審查和技術諮詢,由國家衛生健康委醫療管理服務指導中心負責協調性和格式審查,由國家衛生健康委員會醫政醫管局負責業務管理、法規司負責統籌管理。
本標準起草單位:中南大學湘雅三醫院、首都醫科大學附屬北京兒童醫院、中國醫學科學院血液病醫院(中國醫學科學院血液學研究所)、蘇州大學附屬兒童醫院、浙江大學醫學院附屬兒童醫院、復旦大學附屬兒科醫院、中國醫學科學院阜外醫院、上海交通大學醫學院附屬上海兒童醫學中心、河北省兒童醫院。
本標準主要起草人:桂嶸、何慶南、黑明燕、楊明華、竺曉凡、盧俊、徐曉軍、袁天明、張蓉、王旭、劉晉萍、王靜、邵智利、黃蓉、趙明一。
6 標準正文
兒科輸血指南
6.1 1 範圍
本標準提供了新生兒貧血、血小板減少症、溶血病和兒童血液病、造血幹細胞移植、重症與大出血、心臟手術的輸血閾值或適應證,兒童用血需求、血液輸注與監護及輸血後評價方面的指導和建議,並給出了相關信息。
本標準適用於開展兒科輸血治療的醫療機構和向其供應血液的血站。
6.2 2 規範性引用文件
下列文件中的內容通過文中的規範性引用而構成本標準必不可少的條款。其中,注日期的引用文件,僅該日期對應的版本適用於本標準;不注日期的引用文件,其最新版本(包括所有的修改單)適用於本標準。
6.3 3 術語和定義
下列術語和定義適用於本標準。
3.1
明顯出血 significant bleeding
按照附錄A提供的出血程度分級標準判斷爲2級以上(含2級)的出血。
3.2
輸血閾值 transfusion threshold
注1:患者的血紅蛋白、血細胞比容、血小板計數或纖維蛋白原檢測結果高於輸血閾值時,一般能安全地避免輸血;低於輸血閾值時,輸血利大於弊的可能性較大。
注2:輸血閾值可以是一個範圍,較低的輸血閾值稱爲嚴緊輸血閾值,較高的輸血閾值稱爲寬鬆輸血閾值。
6.4 4 縮略詞
下列縮略詞適用於本標準。
AIHA:自身免疫性溶血性貧血(Autoimmune Hemolytic Anemia)
APTT:活化部分凝血活酶時間(Activated Partial Thromboplastin Time)
ECMO:體外膜氧合(Extracorporeal Membrane Oxygenation)
FFP:新鮮冰凍血漿(Fresh Frozen Plasma)
Fib:纖維蛋白原(Fibrinogen)
Hb:血紅蛋白(Hemoglobin)
Hct:血細胞比容(Hematocrit)
HLA:人類白細胞抗原(Human Leukocyte Antigen)
HSC:造血幹細胞(Hemopoietic Stem Cell)
INR:國際標準化比值(International Normalized Ratio)
PLT: 血小板(Platelet)
PT:凝血酶原時間(Prothrombin Time)
SpO2:經皮動脈血氧飽和度(Percutaneous Arterial Oxygen Saturation)
TSB:血清總膽紅素(Total Serum Bilirubin)
WHO:世界衛生組織(World Health Organization)
6.5 5 總則
5.1 兒童患者是一類異質性羣體,處在生長發育的不同階段,在血容量、血液組成成分水平、免疫系統成熟度以及機體對低血容量和缺氧的生理反應等方面均存在很大差異,對輸血要求高,容易發生輸血不良反應。因此兒科疾病的輸血實踐不僅不同於成人患者,而且更加錯綜複雜。5.2 應科學、全面地評估兒童患者的病情和輸血需求、獲益及風險,堅持非必要不輸血和非必要不多輸血的原則,採取措施避免或減少輸血,審慎選用嚴緊或者寬鬆的輸血閾值和適宜的血液成分,適時評估輸血療效。
5.3 兒童患者輸血不良反應的臨牀表現比成人患者更加隱匿,不易發現,應注意防範,密切觀察,及時處理。
6.6 6 新生兒輸血
6.6.1 6.1 新生兒貧血
6.1.1 早產兒尤其是低出生體重早產兒貧血很常見。除了早產兒自身的原因外,醫源性失血是導致其貧血的重要原因。應採取積極措施,減少醫源性失血,記錄和監控醫源性失血量。
6.1.2 宜根據早產兒的健康狀況,包括胎齡、出生日(周)齡、心肺功能、大腦和內臟血液循環的血氧狀態、失血(包括醫源性失血)狀態、其他疾病等,綜合分析和權衡貧血的危害、輸血的益處及潛在風險,審慎選用嚴緊或者寬鬆的紅細胞輸血閾值。
6.1.3 對於超低出生體重兒貧血,宜遵守本標準第 6.1.2 條提出的輸血指導原則,結合表1 建議的紅細胞輸血閾值,選用嚴緊或者寬鬆的紅細胞輸血閾值。對於接受大手術或存在大出血(估計失血量超過自身血容量的 10%)、原因不明的乳酸酸中毒(動脈血乳酸≥4 mmol/L)等危急病情的患兒,可採用更加寬鬆的輸血閾值。
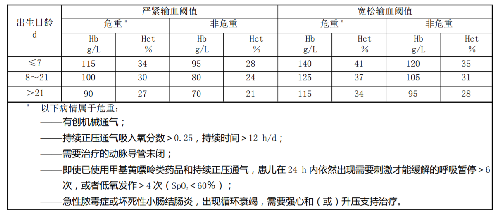
6.1.4 對於其他新生兒貧血,宜遵守本標準第 6.1.2 條提出的輸血指導原則,採用比超低出生體重兒貧血更爲嚴緊的紅細胞輸血閾值。
6.6.2 6.2 新生兒血小板減少症
6.2.1 對於極重度血小板減少症(PLT<25×109/L)的早產兒,在針對病因治療的同時,宜給予輸注血小板。
6.2.2 對於 PLT≥25×109/L、無出血表現的新生兒,不宜常規給予輸注血小板。
6.6.3 6.3 新生兒溶血病
6.3.1 對於晚期早產(出生胎齡≥35 周)和足月產的溶血病患兒,宜根據患兒具體病情,結合表2建議的換血血清總膽紅素(TSB)閾值,作出是否需要換血的判斷。
表 2 晚期早產(出生胎齡≥35 周)或足月產溶血病患兒換血TSB 閾值病情
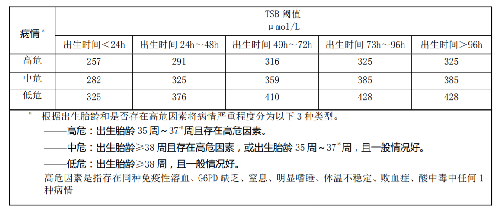
6.3.2 對於低出生體重(<2 500 g)的溶血病患兒,宜根據患兒具體病情,結合表3 建議的換血TSB 閾值,作出是否需要換血的判斷。
表 3 低出生體重溶血病患兒換血 TSB 閾值6.3.3 對於已出現急性膽紅素腦病臨牀表現的患兒,即使其 TSB 水平未達到換血閾值,或者在準備換血期間其 TSB 水平已明顯下降,也宜儘快爲其實施換血。
6.3.4 在準備換血的同時,宜先給予患兒強光療 4 h~6 h,如果患兒 TSB 水平未下降甚至持續上升,宜儘快爲其實施換血。
6.3.5 宜採用符合本標準第 11.2 條建議的組合血液爲患兒實施換血。
6.3.6 換血量宜爲患兒自身血容量的 2 倍(約爲 150 mL/kg~180 mL/kg)。
6.7 7 血液病患兒輸血
6.7.1 7.1 再生障礙性貧血
7.1.1 對於病情穩定的患兒,紅細胞輸血閾值宜爲 Hb<70 g/L。
7.1.2 對於存在氧耗增加的病情(如感染、發熱、疼痛等)的患兒,紅細胞輸血閾值宜適當提高。
a) 對於病情穩定的患兒,血小板輸血閾值宜爲 PLT<10×109/L;
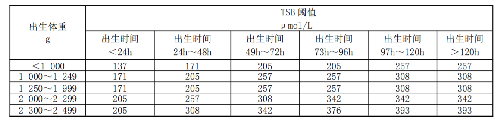
b) 對於存在發熱、感染、明顯出血或正在接受抗胸腺細胞球蛋白治療的患兒,血小板輸血閾值宜爲 PLT<20×109/L。
6.7.2 7.2 地中海貧血
7.2.1.1 宜對輸血依賴型地中海貧血患兒進行全面的血型鑑定和抗體篩查,爲其專門制訂輸血方案,將輸血方案納入整體診療計劃,並根據患兒健康狀況和治療效果適時調整。
7.2.1.2 對於出現以下任何 1 種病情的患兒,宜爲其啓動輸血方案。
a) 間隔 2 周以上的 2 次血常規均爲 Hb<70 g/L,且排除存在引起Hb 下降的其他病情(如感染等)。
b) 出現以下任何 1 種臨牀表現:
3) 過度骨髓內造血引起的併發症(如病理性骨折和麪容改變);4) 明顯的髓外造血。
7.2.1.3 啓動輸血方案後,患兒通常需要每 2 周~5 周輸血 1 次。宜根據患兒Hb 水平的下降趨勢、本次輸血後和下次輸血前宜達到或維持的 Hb 水平,估算所需輸血量。
本次輸血後的Hb水平宜達到130 g/L~150 g/L。
下次輸血前的Hb水平宜維持在95 g/L~105 g/L。
7.2.1.4 宜爲患兒選用與其 ABO、RhD 同型,且與其 C、c、E、e 抗原表型匹配的紅細胞輸注,以避免患兒產生針對這些抗原的同種免疫。
7.2.2.1 對於非輸血依賴性地中海貧血患兒,宜對患兒的生長發育、併發症和輸血利弊等情況綜合分析,決定是否給予輸注紅細胞。不宜單純以 Hb 水平作爲輸血的決定依據,除非患兒Hb<50 g/L。
7.2.2.2 對於出現 Hb 可能快速下降的病情(如感染、手術)的患兒,宜給予輸注紅細胞。
7.2.2.3 對於出現以下病情的患兒,宜考慮爲其增加輸血頻次,並在取得穩定的臨牀療效後再次評估可否逐漸減少直至停止輸血:
a) 脾臟迅速增大(每年脾臟增大超過 3 cm)伴 Hb 下降;
c) 運動耐量下降;
e) 骨骼改變;
f) 溶血危象頻發;
g) 生活質量差。
7.2.2.4 對於可能出現或已經出現以下併發症的患兒,可考慮給予輸注紅細胞:
a) 血栓或腦血管疾病;
c) 髓外造血性假瘤;
d) 腿部潰瘍。
7.2.3 宜爲患兒選擇與其 ABO、RhD 同型,且與其 C、c、E、e 抗原表型匹配的紅細胞輸注,以避免患兒產生針對這些抗原的同種免疫。
6.7.3 7.3 自身免疫性溶血性貧血(AIHA)
7.3.1 AIHA 患兒存在自身抗體,其輸血相容性檢測和適合輸注血液選擇的難度和耗時大幅增加。宜根據患兒輸血相容性檢測情況、貧血及其臨牀表現的嚴重程度和病情進展速度等綜合分析,確定具體輸血時機。
如果在不能排除存在同種抗體或不能明確同種抗體特異性的情況下給予輸血,可能增加同種抗體引發患兒發生溶血性輸血反應的風險。因此在這種情況下時宜避免或減少輸血。如果已排除患兒存在同種抗體或已明確同種抗體特異性,輸血適應證可適當放寬。
7.3.2 對於急性 AIHA 且出現嚴重貧血症狀的患兒,宜給予輸注紅細胞。
7.3.3 對於慢性 AIHA 患兒,紅細胞輸注適應證如下:
a) Hb>70 g/L,不宜給予輸注紅細胞;
b) Hb 50 g/L~70 g/L,且具有不能耐受的貧血症狀,宜考慮給予輸注紅細胞;
c) Hb<50 g/L,宜給予輸注紅細胞。
7.3.4 宜根據 AIHA 患兒輸血相容性檢測情況和輸血需求的緊急程度,選用適宜的紅細胞輸注:
a) 對於血型檢測尚未完成,需要緊急輸血的患兒,可選用 O 型洗滌紅細胞;
b) 對於血型已確定,同種和(或)自身抗體檢測尚未完成,需要緊急輸血的患兒,輸注紅細胞血型選擇的最低要求是 ABO、RhD 血型與患兒相容;其他血型宜爲C、c、E、e、Jka和Jkb抗原表型匹配,也可爲 C、c、E 和 e 抗原表型匹配;
c) 對於不具有同種抗體,且自身抗體不具特異性的患兒,宜選用與患兒ABO、RhD 同型的紅細胞;
d) 對於具有 1 種或數種特異性同種抗體的患兒,宜選用與患兒 ABO、RhD 同型且患兒所具有的同種抗體對應抗原爲陰性的紅細胞;
e) 對於具有特異性自身抗體且有進行性溶血的患兒,宜輸注與患兒ABO、RhD 同型且自身抗體對應抗原爲陰性的紅細胞。
7.3.5 給予 AIHA 患兒輸注紅細胞時,宜選用較小劑量(3 mL/kg~5 mL/kg),緩慢輸注,密切觀察患兒反應情況,注意防範發生循環超負荷和溶血性輸血反應等輸血不良反應的風險。
7.3.6 對於極嚴重的 AIHA 患兒,如果藥品和輸血治療無效,宜爲其實施血漿置換。
6.7.4 7.4 葡萄糖-6-磷酸脫氫酶缺乏症
患兒出現下列任何1種病情時,宜給予輸注紅細胞:
a) Hb<60 g/L;
6.7.5 7.5 急性白血病和骨髓增生異常綜合徵
7.5.1 患兒 Hb<70 g/L 時,宜給予輸注紅細胞。
a) PLT<10×109/L,宜給予預防性輸注血小板;存在明顯出血、發熱、高白細胞血癥、PLT快速下降、凝血功能異常(如急性早幼粒細胞白血病)等病情時宜適當提高血小板輸血閾值;
b) 對於擬接受大型侵入性操作或手術的患兒,血小板輸血閾值宜爲PLT 40×109/L~50×109/L;
c) 對於擬接受小型侵入性操作(如骨髓穿刺活檢和中心靜脈置管拔除)的患兒,宜維持其PLT>20×109/L。
6.7.6 7.6 免疫性血小板減少症
7.6.1 不宜給予預防性輸注血小板。患兒出現明顯出血和(或)急需侵入性操作或手術且其他治療方法無效時,宜根據具體病情評估決定是否給予輸注血小板。
7.6.2 出現嚴重出血(如內臟出血、顱內出血)時,宜給予輸注血小板。
6.7.7 7.7 血栓性血小板減少性紫癜
7.7.1 宜儘快爲患兒實施血漿置換。無法爲其實施血漿置換時,可給予輸注FFP。
7.7.2 不宜給予輸注血小板。在發生危及生命的出血時可考慮給予輸注血小板。
6.7.8 7.8 血友病
7.8.1 對於血友病 A 型患兒,宜首選凝血因子Ⅷ藥品。無該類藥品可用時,可選用冷沉澱凝血因子或FFP。
7.8.2 對於血友病 B 型患兒,宜首選凝血因子Ⅸ藥品或凝血酶原複合物藥品。無該類藥品可用時,可選用 FFP。
7.8.3 對於在確診前急需治療的疑似血友病患兒,可給予輸注 FFP。
6.8 8 造血幹細胞(HSC)移植患兒輸血
6.8.1 8.1 紅細胞輸血閾值
對於病情穩定、非手術的患兒,紅細胞輸血閾值宜爲 Hb<70 g/L 。如果患兒存在終末期器官損傷或感染的風險,宜考慮將紅細胞輸血閾值提高爲Hb<80 g/L。
6.8.2 8.2 血小板輸血閾值
患兒PLT<10×109/L時,即使沒有存在出血危險因素,也宜給予預防性輸注血小板。存在其他出血危險因素(如感染、使用抗生素或存在其他止凝血功能異常)時,宜適當提高血小板輸血閾值。
6.8.3 8.3 血液成分的選擇
8.3.1 在 HSC 移植前或植活後,宜根據患兒當前的血型鑑定結果選擇與其ABO 同型的血液成分輸注。
8.3.2 在 HSC 移植的血型轉變期間,宜監測患兒血型抗原和抗體的變化狀態,並根據ABO 血型抗體效價,權衡輸注所選血型的血液對造血重建和輸血效果的影響,實時調整輸血方案。可優先選擇表4列出的血液成分血型。如果患兒或捐獻者含有ABO血型之外的其他同種抗體,宜爲患兒選擇相應抗原爲陰性的紅細胞輸注。
表 4 HSC 移植接受者與捐獻者 ABO 血型相容性類型及移植期間優先選擇輸注的血液成分血型相容類型
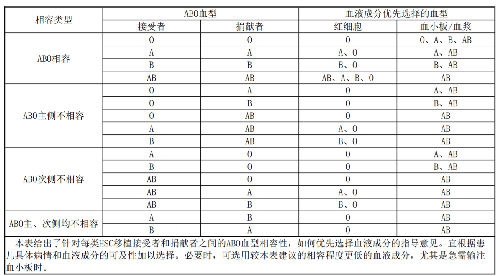
本表給出了針對每類HSC移植接受者和捐獻者之間的ABO血型相容性,如何優先選擇血液成分的指導意見。宜根據患兒具體病情和血液成分的可及性加以選擇。必要時,可選用較本表建議的相容程度更低的血液成分,尤其是急需輸注血小板時。
8.3.3 宜根據 11.3 中給出的推薦爲患兒提供輻照血液。
6.9 9 重症及大出血患兒輸血
6.9.1 9.1 一般重症
9.1.1 對於危重症和有出現危重症風險的患兒,Hb<50 g/L 時應給予輸注紅細胞,Hb 50 g/L~70g/L 時宜結合具體病情考慮是否給予輸注紅細胞。
9.1.2 對於血流動力學不穩定的患兒,宜適當提高紅細胞輸血閾值。
6.9.2 9.2 膿毒症休克
9.2.1 對於血流動力學穩定的患兒,紅細胞輸血閾值宜爲 Hb<70 g/L。
9.2.2 對於無出血表現的患兒,不宜給予預防性輸注血小板。
6.9.3 9.3 急性腦創傷重症
9.3.1 紅細胞輸血閾值宜爲 Hb 70 g/L~100 g/L。
9.3.2 關於擬接受神經外科手術患兒的血小板輸血閾值,新生兒宜爲 PLT<100×109/L,其他兒童宜爲 PLT 75×109/L~100×109/L。
6.9.4 9.4 體外膜氧合(ECMO)
宜將患兒血液指標維持在以下水平:
a) Hct 30%~40%;
b) PLT>80×109/L;
c) Fib 1.0 g/L~1.5 g/L。
6.9.5 9.5 無生命危險的出血及失血性休克
6.9.5.1 9.5.1 無生命危險的出血
9.5.1.1 患兒 Hb<50 g/L,應給予輸注紅細胞。
9.5.1.2 患兒 Hb 50 g/L~70 g/L,宜結合其具體病情考慮給予輸注紅細胞。
6.9.5.2 9.5.2 失血性休克
9.5.2.1 宜根據兒童患者失血性休克的救治需求,制訂失血性休克兒童患者血液管理方案。
9.5.2.2 對於失血性休克患兒,在獲得實驗室檢測結果前宜考慮早期輸注FFP 和血小板。對於非創傷性失血性休克患兒,紅細胞和FFP的輸注容量比例宜爲2∶1,例如紅細胞40mL/kg,FFP 20 mL/kg。
對於創傷性失血性休克患兒,紅細胞和FFP的輸注容量比例宜爲1∶1,例如紅細胞20 mL/kg,FFP20 mL/kg。
患兒初始復甦後如果仍然持續存在活動性出血,宜考慮輸注血小板和冷沉澱凝血因子,其劑量爲每輸注40 mL/kg紅細胞後,輸注血小板15 mL/kg~20 mL/kg和冷沉澱凝血因子10 mL/kg。如有必要,可按照該比例重複輸注血液成分,直至出血得到控制爲止。
一旦獲得患兒實驗室檢測結果,宜根據檢測結果調整血液成分輸注比例。輸血治療目標爲Hb>80 g/L、Fib>1.5 g/L、PT<參考區間中點值的1.5倍、PLT>75×109/L。在復甦過程中宜密切監測復甦是否適宜和是否存在循環超負荷。
6.10 10 心臟手術患兒輸血
6.10.1 10.1 術前患者血液管理措施
10.1.1 術前宜詳細詢問患兒病史和做體格檢查,評估患兒止凝血功能障礙和貧血風險。
10.1.2 宜積極治療術前缺鐵性貧血。不宜常規使用促紅細胞生成素糾正術前貧血。
10.1.3 對出血風險高及體外循環時間較長的患兒,宜行血管性血友病檢測。必要時加做凝血因子水平檢測或血栓彈力圖檢測等。
10.1.4 宜詳細瞭解患兒術前用藥情況,對術前服用抗凝藥品、抗血小板藥品和其他可能影響止凝血功能藥品的患兒,宜根據具體情況採取相應管理措施。
6.10.2 10.2 術中患者血液管理措施
10.2.2 對於需要體外循環的患兒,宜預防性使用抗纖溶藥品,但不宜使用大劑量方案。
10.2.3 減輕體外循環過程的血液稀釋程度對減少異體輸血至關重要。在體外循環過程中宜採取以下患者血液管理措施:
a) 宜優化體外循環管路,避免血液過度稀釋;在體外循環過程中,新生兒Hct 宜>25%,其他患兒 Hct 宜>21%;體外循環停機前,新生兒 Hct 宜>33%,其他患兒Hct 宜>25%;b) 體外循環不宜常規預充 FFP;
c) 對於術前存在凝血因子缺乏的患兒,如果無相應凝血因子藥品可用,且患兒抗凝血酶水平嚴重低下,體外循環宜預充 FFP;
d) 採用無血液預充時,宜使用膠體液,有助於維持患兒膠體滲透壓和減少異體輸血;e) 宜在體外循環中行傳統超濾,或在體外循環後行 5 min 以上的改良超濾,以提升患兒Hb水平。
10.2.4 宜使用術中回收式自體輸血。宜用無菌生理鹽水將體外循環管路中的存留血液進行沖洗、回收,經血液回收機洗滌後回輸給患兒。
10.2.5 術中宜採取以下抗凝及監測措施:
a) 充分的抗凝對保證體外循環期間患兒安全和避免消耗性凝血至關重要。肝素初始劑量宜爲400 U/kg,在體外循環過程中宜維持激活全血凝固時間>480 s。對於非抗凝血酶缺乏的肝素耐藥患兒,宜追加肝素 100 U/kg;對抗凝血酶缺乏的肝素耐藥患兒,宜輸注抗凝血酶藥品或 FFP 10 mL/kg;
b) 在體外循環結束中和肝素時,魚精蛋白用量與肝素總用量的比例不宜超過1∶1,首次魚精蛋白劑量宜爲總量的 50%,防止過量的魚精蛋白抑制患兒凝血和血小板功能。10.2.6 經使用魚精蛋白拮抗後仍出血較多時,宜使用血栓彈力圖評估止凝血狀態,以指導治療。
6.10.3 10.3 術後患者血液管理措施
6.10.3.1 10.3.1 紅細胞輸注適應證
10.3.1.1 宜結合患兒疾病類型、術後臨牀症狀和體徵、實驗室檢查結果等綜合評估是否需要輸注紅細胞。
10.3.1.2 對於接受先天性心臟病手術的新生兒,當其術後 Hb<110 g/L 時,宜給予輸注紅細胞。
10.3.1.3 對於接受簡單畸形心臟病手術的除新生兒以外的其他患兒,當其術後Hb<80 g/L 時,宜給予輸注紅細胞。
10.3.1.4 對於接受複雜畸形心臟病(包括合併心功能不全及肺動脈高壓)手術,或者接受姑息性心臟病手術的除新生兒以外的其他患兒,當其術後 Hb≤100 g/L 時,宜給予輸注紅細胞。
6.10.3.2 10.3.2 血小板輸注適應證
體外循環結束中和肝素後,患兒出血較多,PLT<100×109/L時,宜給予輸注血小板。宜及時評估患兒的血小板功能,當血小板功能低下時,宜適當提高血小板輸血閾值。
6.10.3.3 10.3.3 FFP 輸注適應證
患兒發生出血,且PT和(或)APTT>參考區間中點值的1.5倍,或INR值>1.5,或血栓彈力圖提示患兒存在凝血因子缺乏時,宜給予輸注FFP。
6.10.3.4 10.3.4 纖維蛋白原補充適應證
WS/T 795—20229患兒發生出血,且血漿Fib<1.5 g/L和(或)存在纖維蛋白原功能低下時,宜給予輸注冷沉澱凝血因子或纖維蛋白原藥品。無冷沉澱凝血因子或纖維蛋白原藥品可用時,可給予輸注FFP。10.3.5 減少醫源性失血
宜減少採集患兒血液標本的量和頻率,採用小容量採血管、合併檢測管及牀旁檢測。
6.11 11 兒童用血需求
6.11.1 11.1 總體需求
11.1.1 爲兒童患者選擇更加適用的血液成分,對於輸血更加安全有效是十分必要的。需要注意的是,其應用前提是不存在輸血延誤引發的風險,應權衡所需血液的可及性和輸血的緊迫性。
11.1.4 宜有兒童用血規格血液成分(例如 0.5 U 紅細胞、1 U~2 U 濃縮血小板或0.2 治療量單採血小板、50 mL 血漿類成分血)可供選用。
11.1.5 宜根據臨牀需要,附有關於血液成分的實際容量(mL)、紅細胞成分血的Hb 濃度和Hct、血小板成分血的血小板計數等的補充說明。
11.1.6 宜提供聯袋血液,爲近期內需要多次輸血的患兒提供來源於單個獻血者的紅細胞。
6.11.2 11.2 用於換血的血液
除了符合11.1的建議以外,用於患兒換血的血液還宜符合以下建議:
a) 對於 ABO 血型不合導致的新生兒溶血病,宜選用以 O 型紅細胞和AB 型FFP 組合的血液;
b) 對於 Rh 血型不合導致的新生兒溶血病,宜選用以 ABO 血型與新生兒相同、Rh 血型與患兒生母相同的紅細胞和 AB 型 FFP 組合的血液;
6.11.3 11.3 輻照血液
11.3.1 對於具有以下任何 1 種病情的患兒,宜使用輻照血液。
a) 接受親屬來源血液成分。
1) 從化放療預處理開始至移植後 6 個月且淋巴細胞計數>1×109/L;
2) 存在慢性移植物抗宿主病;
g) 自體骨髓或外周血 HSC 移植,從化放療預處理開始至移植後 3 個月。
h) 任何臨牀分期的霍奇金氏淋巴瘤患兒。
i) 使用嘌呤類似物(氟達拉濱、克拉屈濱和脫氧助間型黴素)治療的患兒。
11.3.2 宜使用輻照後 24 h 內的輻照血液。
6.11.4 11.4 洗滌紅細胞
11.4.1 對於具有以下病情的患兒,宜使用洗滌紅細胞:
a) 對血漿成分過敏;
b) IgA 缺乏;
c) 接受者和捐獻者 ABO 血型不相容 HSC 移植的血型轉換期;
11.4.2 宜選用以 0.9%氯化鈉溶液懸浮的洗滌紅細胞。不宜選用以紅細胞保存液懸浮的紅細胞。
6.11.5 11.5 新鮮紅細胞
對於具有以下病情的患兒,宜使用保存時間小於7 d的新鮮紅細胞:
b) 大量輸血;
6.12 12 血液輸注與監護
6.12.1 12.1 靜脈通路
12.1.1 兒科輸血宜根據患兒血管條件和輸注速度選擇合適管徑的輸血導管,選擇患兒表淺粗大的靜脈置管。
12.1.2 對於剛出生的新生兒,宜選擇臍靜脈置管,用於輸液、輸血和監測中心靜脈壓。當不能使用患兒臍靜脈置管時,宜選用其小隱靜脈置管。
12.1.3 對於新生兒溶血病患兒,宜採用外周動靜脈同步換血或臍靜脈置管換血。
6.12.2 12.2 過濾器和輸血器
12.2.1 所有血液成分輸注均宜使用標準過濾器(170μm~260μm)。
12.2.2 輸血器的塑料管路爲無效腔容量,在計算輸血量時宜包括該部分容量。
12.2.3 當使用生理鹽水沖洗輸血管路時,宜在生理鹽水進入患兒體內前即停止,以減少血液稀釋。
6.12.3 12.3 輸注速度與微量輸血泵的使用
12.3.1 宜根據患兒的耐受程度、病情需要和血液成分類型選擇適宜的輸注速度。在患兒發生休克、嚴重出血等救治需要快速輸血時,應嚴密監護和評估患兒的心肺功能。對於存在嚴重貧血、心肺功能不全及循環超負荷高危患兒,應少量多次緩慢輸注。
12.3.2 一般情況下,紅細胞輸注速度爲 5 mL/(kg·h),最大輸注速度≤150 mL/h,血漿、血小板和冷沉澱凝血因子的輸注速度爲 10 mL/(kg·h)~20 mL/(kg·h)。輸血開始15 min 內宜採用更加緩慢的輸注速度。輸注開始 15 min 後如未出現輸血不良反應,可將輸注速度提高至推薦輸注速度。注:本條給出的推薦輸注速度不適用於爲緊急搶救、大出血、新生兒換血和接受ECMO治療的患兒提供輸血治療等情況。
12.3.4 如果 1 袋血液的輸注時間已長達 4 h 但仍未輸注完畢,此時宜停止輸注並將該袋血液廢棄。
6.12.4 12.4 血液加溫
新生兒換血、大量輸血時宜使用血液加溫儀對輸注血液加溫。需要注意的是,使用血液加溫儀時,宜注意避免輸注不暢引起血液加熱過度而造成的物理溶血問題。
6.12.5 12.5 輸血監護與輸血不良反應處理
12.5.1 實施輸血的醫護人員應接受過血液成分輸注和輸血不良反應處理的培訓,掌握WS/T 624所述的輸血不良反應,能發現和處理可能出現的輸血不良反應。
12.5.2 宜保證所有輸血患兒都能受到直接觀察。對不能或者難以對輸血不良反應症狀做溝通的新生兒和嬰幼兒宜加強輸血過程監護。
12.5.3 對於新生兒,宜在輸血前、中、後監測其血糖,必要時給予葡萄糖輸注,以防止發生低血糖;宜監測血鈣、血鉀水平,防止發生低血鈣、高血鉀或低血鉀。
12.5.5 對於出現輕度反應的患兒,如發熱(體溫≥38℃且升高 1℃~2℃)和(或)瘙癢或皮疹而沒有其他表現,宜暫停輸血並給予適當對症治療,如情況好轉繼續輸血。
12.5.6 對於出現嚴重反應的患兒應停止輸血,迅速給予治療,不應等待調查結果。
12.5.7 輸血依賴型地中海貧血患兒容易發生鐵超載,宜予密切關注,制定和實施鐵螯合治療方案,以避免出現因鐵沉積導致肝功能或心功能損害。
6.13 13 輸血後評價
13.1 輸血後,應適時綜合評價輸血的合理性、有效性和安全性。
13.2 宜對輸血決策的合理性進行回顧性評價,內容包括輸血適應證、血液成分選擇、輸注劑量和速度等。
13.3 宜評價輸血是否取得預期療效,內容包括臨牀評價和實驗室評價兩個方面。臨牀評價內容主要是作爲輸血決策依據的臨牀表現是否改善。
實驗室評價內容主要是作爲輸血決策和血液成分與劑量選擇依據的血液檢測指標是否改善,輸注目標是否達到預期(見表5)。宜權衡實驗室評價需求和患兒對醫源性失血的耐受程度。如果輸血後未取得預期療效,宜對可能影響輸血療效的因素進行全面分析和評估,內容包括輸血適應證、血液成分品種、輸注劑量和速度、病情變化、進一步診療措施(包括再次輸血)等。對於疑難病例,宜組織多學科(包括輸血科)專家會診。
13.4 宜對患兒輸血前、中、後的生命體徵變化情況,有無新的臨牀表現等進行分析和判斷,確認患兒是否出現急性輸血不良反應。
13.5 宜密切關注患兒是否出現疑似遲發性輸血不良反應的臨牀表現,以及時發現和處理。13.6 宜關注並囑患兒監護人關注輸血傳播感染風險,宜在輸血後 3~6 個月進行輸血傳播感染的隨訪檢測。
表 5 一般情況患兒血液成分輸注劑量及血液檢測指標改善預期a

7 附錄A(規範性)WHO 出血程度分級標準(修改版)
表A.1提供了WHO出血程度分級標準(修改版)的具體內容。
WHO 出血程度分級標準(修改版)
| 分級 | 出血特徵 |
| 1 級 | 1~2 個孤立、散在、未融合成片的局部瘀點或紫癜 |
| 口咽、鼻出血,出血時間<30 min | |
| 2 級 | 黑便、嘔血、咯血、大便含鮮血、肌肉骨骼或軟組織出血,出血發生後 24 h 內無需輸注紅細胞,血液動力學穩定 |
| 口咽、鼻出血,出血時間>30 min | |
| 有症狀或出血的口腔黏膜血泡 | |
| 多處瘀斑,每處>2 cm,或有 1 處>10 cm | |
| 瀰漫性瘀點或紫癜 | |
| 目視檢查可見血尿 | |
| 侵入性操作或手術部位異常出血 | |
| 陰道意外出血,出血 24 h 內血液浸透 2 塊護墊以上 | |
| 體腔液目視檢查可見含有少量血液 | |
| 視網膜出血,但視力不受影響 | |
| 3 級 | 出血發生後 24 h 內需要將輸注紅細胞作爲出血的針對治療措施,血液動力學穩定體腔液目視檢查可見含有大量血液 |
| 計算機斷層掃描顯示腦出血,但無神經症狀和體徵 | |
| 4 級 | 出血導致身體虛弱,包括視網膜出血導致視野缺損 |
| 非致命性腦出血伴有神經症狀和體徵 | |
| 出血導致血液動力學不穩定性(低血壓,收縮壓或舒張壓降低>30 mmHg) | |
| 任何部位的致命性出血 |
8 參考文獻
[1] 中華醫學會兒科學分會新生兒學組,《中華兒科雜誌》編輯委員會. 新生兒高膽紅素血癥診斷和治療專家共識[J]. 中華兒科雜誌, 2014, 52(10): 745-748
[2] 中華醫學會血液學分會血栓與止血學組. 成人原發免疫性血小板減少症診斷與治療中國指南(2020年版)[J]. 中華血液學雜誌, 2020, 41(8): 617-623
[3] 中華醫學會血液學分會血栓與止血學組. 血栓性血小板減少性紫癜診斷與治療中國專家共識(2012年版)[J]. 中華血液學雜誌, 2012, 33(11): 983-984
[4] 中華醫學會血液學分會紅細胞疾病(貧血)學組.自身免疫性溶血性貧血診斷與治療中國專家共識(2017年版)[J].中華血液學雜誌,2017,38(4): 265-267
[5] 中華醫學會血液學分會血栓與止血學組, 中國血友病協作組. 血友病治療中國指南(2020年版)[J]. 中華血液學雜誌, 2020, 41(4): 265-271
[6] 中國心胸血管麻醉學會血液管理分會. 心血管手術患者血液管理專家共識[J]. 中國輸血雜誌, 2018, 31(4): 321-325
[7] 中華預防醫學會出生缺陷預防與控制專業委員會新生兒篩查學組, 中國醫師協會醫學遺傳醫師分會臨牀生化遺傳專業委員會,中國醫師協會青春期醫學專業委員會臨牀遺傳學組.葡萄糖-6-磷酸脫氫酶缺乏症新生兒篩查、診斷和治療專家共識[J]. 中華兒科雜誌, 2017, 55(6): 411-414
[8] New HV, Berryman J, Bolton-Maggs PH, et al. Guidelines on transfusionforfetuses, neonates and older children[J]. Br J Haematol. 2016, 175(5): 784-828
[9] New HV, Stanworth SJ, Gottstein R, et al. British Society for HaematologyGuidelines on transfusion for fetuses, neonates and older children (Br J Haematol.2016;175: 784-828). Addendum August 2020 [J]. Br J Haematol, 2020, 191(5):725-727
[10] Killick SB, Bown N, Cavenagh J, et al. Guidelines for the diagnosisandmanagement of adult aplastic anaemia[J]. Br J Haematol, 2016, 172(2): 187-207
[11] Schiffer CA, Bohlke K, Anderson KC. Platelet Transfusion for PatientswithCancer: American Society of Clinical Oncology Clinical Practice GuidelineUpdateSummary[J]. J Oncol Pract, 2018, 14(2): 129-133
[12] Estcourt LJ, Birchall J, Allard S, et al. Guidelines for the use of platelettransfusions[J]. Br J Haematol, 2017, 176(3): 365-394
[13] Padmanabhan A, Connelly-Smith L, Aqui N, et al. Guidelines on theUseofTherapeutic Apheresis in Clinical Practice - Evidence-Based Approach from the WritingCommittee of the American Society for Apheresis: The Eighth Special Issue[J].JClinApher, 2019;34(3): 171-354
[14] Valentine SL, Bembea MM, Muszynski JA, et al. Consensus recommendationsforRBCtransfusion practice in critically ill children from the pediatric criticalcaretransfusion and anemia expertise initiative[J]. Pediatr Crit Care Med, 2018, 19(9):884-898
[15] Faraoni D, Meier J, New HV, et al. Patient Blood Management for NeonatesandChildren Undergoing Cardiac Surgery: 2019 NATA Guidelines [J]. J Cardiothor Vasc An,2019,33(12):3249-3263
[16] Foukaneli T, Kerr P, Bolton-Maggs PH, et al. Guidelines on the useofirradiated blood components[J]. Br J Haematol, 2020, 191(5): 704-724
[17] Kirpalani H, Bell EF, Hintz SR, et al. Higher or Lower Hemoglobin TransfusionThresholds for Preterm Infants[J]. New Engl J Med, 2020, 383(27): 2639-2651
[18] Franz AR, Engel C, Bassler D, et al. Effects of Liberal vs RestrictiveTransfusion Thresholds on Survival and Neurocognitive Outcomes in Extremely Low-BirthWeight Infants: The ETTNO Randomized Clinical Trial[J]. JAMA, 2020, 324(6): 560-570
[19] Curley A, Stanworth SJ, Willoughby K, et al. Randomized trial of platelettransfusion thresholds in neonates[J]. New Engl J Med, 2019, 380(3): 242-251
[20] Karam O , Nellis ME. Transfusion management for children supportedbyextracorporeal membrane oxygenation[J]. Transfusion, 2021, 61(3): 660-664
[21] Cohn CS, Delaney M, Johnson ST, et al. Technical Manual (AABB), 20th Edition[M].Bethesda: American Association of Blood Banks, 2020: 771
[22] Cappellini MD, Farmakis D, Porter J, et al. 2021 Guidelines for the managementof transfusion dependent thalassaemia (TDT). 4th ed. [M/OL]. Cyprus: ThalassaemiaInternational Federation, 2021: 51. [2021-08-06]. https://thalassaemia.org.cy/wpcontent/uploads/2021/06/GUIDELINE-4th-DIGITAL-BY-PAGE.pdf
[23] Taher A, Musallam K, Cappellini MD. Guidelines for the ManagementofNon Transfusion Dependent Thalassaemia (NTDT). 2nd ed. [M/OL]. Cyprus: ThalassaemiaInternational Federation, 2017: 17-18. [2021-08-06]. https://thalassaemia.org.cy/wpcontent/uploads/2017/10/NTDT-final-combined-1.pdf
[24] The C17 Guidelines Committee. Guideline for platelet transfusion thresholdsfor pediatric hematology/oncology patients[M/OL]. Edmonton: C17 Council, 2011: 4.[2021-08-06]. http://www.c17.ca/application/files/6916/2006/0819/C17_Platelet_Guideline_English_Complete_2011.pdf