3 註解
自由能(free energy)是熱力學上的一個重要狀態函數,是表徵物質系統在等溫過程中最多可能做若干功的物理量。
自由能分爲兩種:
(1)亥姆霍茲自由能,在物理學中稱爲自由能,而在化學中常稱爲“功函”。
(2)吉布斯自由能,在物理學中常稱爲“熱力勢”,而在化學中稱爲自由能。凡物質系統的狀態實際發生的變化,其自由能必減少,在其自由能達到最小值時,即趨於熱平衡。一個物質系統在等溫過程中,所含自由能越多,可做的功越多;所含的自由能越少,可做的功越少。人體是一個物質系統,其能量代謝與轉化遵循熱力學定律,在人體的能量代謝過程中,要不斷地合成、儲存和釋放自由能。人體自由能含量的多少,是人的生命活力強弱的能量基礎。中醫學的氣化學說和陰藏精、陽化氣的理論,在一定程度上反映了人體合成和釋放自由能的生命過程。
自由能在物理化學中,按照亥姆霍茲的定容自由能F與吉布斯的定壓自由能G的定義,G=F PV (p爲壓力,V爲體積)。在生物的反應中,因爲△(PV)可以忽略不計,所以兩者是相同的。只有這樣,F的變化△F=△U-T△S才成爲主要討論的問題(U、T、S分別是該系統的內能、絕對溫度、熵)。△F給出了生物反應中釋放出來可用於做功的能量上限。其變化量(一般用△G*表示)在生物學上使用時必須注意下列事項:
(1)水的活度,可隨意設爲1.0進行計算:
(2)因[H]=1M並不符合實際情況,一般認爲[H]=10-7M(pH7),爲了區別其符號寫成△G0′;
(3)例如反應,因各種成分並非標準濃度(1M),把實際濃度代入下式後其值△G′就有問題了;
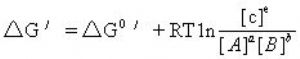
(5)把△G0改爲用平衡常數(Keq)表示,往往是很有用的。例如在25℃下
△G0=-RT1nKeq=-1363log10Keq