2 基本信息
ICS 11.020
C 50
中華人民共和國衛生行業標準 WS/T 514—2017《臨牀檢驗方法檢出能力的確立和驗證》(Establishment and verification of detection capability for clinical laboratory measurement procedures)由中華人民共和國國家衛生和計劃生育委員會於2017年01月15日《關於發佈〈臨牀實驗室質量指標〉等5項推薦性衛生行業標準的通告》(國衛通〔2017〕1號)發佈,自2017年07月01日起實施。
3 發佈通知
關於發佈《臨牀實驗室質量指標》等5項推薦性衛生行業標準的通告
國衛通〔2017〕1號
現發佈《臨牀實驗室質量指標》等5項推薦性衛生行業標準,其編號和名稱如下:
WS/T 497—2017 侵襲性真菌病臨牀實驗室診斷操作指南
WS/T 498—2017 細菌性腹瀉臨牀實驗室診斷操作指南
WS/T 514—2017 臨牀檢驗方法檢出能力的確立和驗證
上述標準自2017年7月1日起施行。
特此通告。
國家衛生計生委
2017年1月25日
4 前言
本標準按照GB/T 1.1—2009給出的規則起草。
本標準起草單位:華中科技大學同濟醫學院附屬同濟醫院、北京民航總醫院、中國醫學科學院北京協和醫院、首都醫科大學附屬北京同仁醫院、衛生部臨牀檢驗中心。
本標準主要起草人:管青、王學晶、邱玲、劉向禕、張傳寶、李輝軍。
5 標準全文
5.1 1 範圍
本標準規定了臨牀檢驗方法檢出能力的確立和驗證的技術要求及操作過程。
5.2 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅注日期的版本適用於本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
WS/T 403—2012 臨牀生物化學檢驗常規項目分析質量指標
5.3 3 術語和定義
下列術語和定義適用於本文件。
3.1
參考值 reference value
注:參考值可來自於:
c) 基於科學或工程組織贊助下合作實驗工作中的約定值或認證值;
d) 當a)、b)、c)不能獲得時,則用(可測)量的期望值,即規定測量總體的均值。
3.2
準確度 accuracy
注1:當術語“準確度”用於一組測量結果時,由隨機誤差分量和系統誤差即偏移分量組成;
3.3
偏移 bias
系統測量誤差的估計值。
3.4
空白 blank
3.5
空白限 limit of blank
注:並非樣本中實際被測物的濃度,空白限也被稱作淨狀態變量臨界值(critical value of net state variable)。
3.6
檢出限 limit of detection
由給定測量程序獲得的測得值,其聲稱的物質成分不存在的誤判概率爲β,聲稱的物質成分存在的誤判概率爲α。
注1:國際理論和應用化學聯合會(IUPAC)推薦的α和β的默認值爲0.05。
注2:也被稱作檢測低限、最小可檢測濃度(或值),縮寫爲LoD。
3.7
定量限 limit of quantitation
滿足聲明的精密度和正確度,在聲明的實驗條件下能夠可靠定量的分析物的最低濃度。
注:又稱定量檢出限。
3.8
注1:在實驗室醫學中,被測量的規範要求包含種類(例如質量、濃度)、攜帶特徵(例如全血、血漿)以及對應的化學實體(例如分析物)。
注2:被測量可具有生物活性。
3.9
測量範圍 measuring interval
在規定的條件下,由具有一定的儀器不確定度的測量儀器或測量系統能夠測量出的一組同類量的量值。
3.10
精密度 precision
在規定條件下,對同一或類似被測對象重複測量所得示值或測量值間的一致程度。
注1:精密度的度量通常以不精密度來表達,其量值以規定測量條件下的標準差、方差或變異係數來表示。
注2:規定條件可以是測量重複性條件、期間測量精密度條件、測量復現性條件。
注3:精密度用於定義測量重複性、期間測量精密度條件、測量復現性條件。
3.11
正確度 trueness
無窮多次重複測量所得量值的平均值與一個參考量值間的一致程度。
5.4 4 縮略語
下列縮略語適用於本文件。
CLSI:美國臨牀和實驗室標準協會(Clinical and Laboratory Standards Institute)
CV:變異係數(coefficient of variation)
IVD:體外診斷(in vitro diagnostic)
LoB:空白限(limit of blank)
LoD:檢出限(limit of detection)
LoQ:定量限(limit of quantitation)
RMS:均方根(root mean square)
SD:標準差(standard deviation)
TE:總誤差(total error)
5.5 5 總述
5.5.1 5.1 檢出能力概述
5.1.1 檢出能力包含針對檢測限低值附近的檢測準確性進行評估的一組性能參數LoB、LoD和LoQ。這3個參數之間的主要差異在於LoB和LoD是基於檢測方法的變異和I類及Ⅱ類錯誤設置的統計學術語,而LoQ的確立與定量分析項目的臨牀應用需求及方法建立者選擇的可接受目標有關。
5.1.2 在大多數情況下,LoB應小於LoD,而LoQ可等於或高於LoD,但不能小於LoD。小於LoD的結果應報告爲“未檢出”。
5.1.3 在某些特殊情況下,LoB、LoD和LoQ的概念沒有實際意義,例如凝血檢測項目中的凝血酶原時間和部分活化凝血酶原時間,這些檢測項目影響因素衆多且無法去單獨衡量,因此不需去評價其LoB、 LoD和LoQ。
5.1.4 對可能會檢測多種樣本類型的檢測方法可使用一種樣本類型確立其檢出能力,再來驗證另一種樣本類型的檢出能力。針對不同樣本類型有不同檢出能力的方法,應對每種樣本類型確立各自的檢出能力。
5.5.2 5.2 標本選擇原則
5.2.1 空白標本和低值標本應能反映出患者陰性標本檢測結果的一致性。空白標本爲不含被測量的標本,實驗室比較容易得到的空白標本包括實驗室純水、超純水、商業化生理鹽水、檢驗系統清洗緩衝液。理想的空白標本是被證實不含特定被測量的商業化標本稀釋液。
5.2.2 可通過稀釋或添加標本的方法來獲得所需最低檢測濃度的低值標本和空白標本,並假設這些標本檢測的結果和陰性患者標本的結果相似。
5.2.3 選擇低值患者標本時應保證標本量充足。建議將標本分裝並冰凍保存(-20℃到-70℃),每次試驗前取用以保持穩定性和一致性。
5.5.3 5.3 數據收集和複查原則
5.3.1 實驗數據是在不同實驗條件下通過大量檢測而獲得的,可運用不同的方法來設計試驗過程,例如每天在不同的檢測儀器上用不同批號的試劑進行檢測,也可以用某一臺儀器對某一批號的試劑進行檢測。
5.3.2 實驗數據在某些特殊情況可以通過獲得儀器原始反應信號並通過脫機路徑將其轉化爲檢測結果。
5.3.3 在完成一個檢測流程後應立即對數據進行檢查以發現可能的操作失誤或結果遺漏,除檢測方法本身產生的錯誤外,其他原因產生的異常數據宜在當日重新檢測並替換,任何重測數據都應和原始數據一起被記錄。
5.3.4 所有數據收集完成後應充分考察,並應進行適當的統計分析以排除離羣值。
5.6 6 LoB和LoD的確立
5.6.1 6.1 經典方案
5.6.1.1 6.1.1 試驗設計
試驗設計方案如下:
a)使用同一設備,在多個工作日中用多個批號的試劑重複檢測一系列空白標本。針對每個批號試劑計算LoB的估計值,選擇最大的LoB(2~3個批號試劑)或結合所有批號試劑的數據(4個或4個以上批號試劑)的估計LoB作爲最終報告值。
b)使用同一設備,在多個工作日中用多個批號的試劑重複檢測一系列低值標本。針對每個批號試劑計算LoD的估計值,選擇最大的LoD(2~3個批號試劑)或結合所有批號試劑的數據(4個或4個以上批號試劑)的估計LoD作爲最終報告值。
c) 試驗方案最低要求:2個試劑批號;1臺儀器;3天試驗;4個空白標本;4個低值標本;每個標本重複檢測2次(分別在不同的天和不同的試劑批號);每個試劑批號至少60個空白測量結果(綜合所有空白標本、試驗日期及檢測系統);每個試劑批號至少60個低值測量結果(綜合所有低值標本、試驗日期及檢測系統)。
注:以上最簡單的設計方案不能得到要求的每個批號60個總重複檢測。建立者應根據特定的測量程序和可獲得資源增加一個或多個設計因子(如儀器系統、試劑批號、校準頻率、操作者等),以提供充足的測量結果數。
d) 每個試劑批號共60個空白結果和60個低值結果是最低要求,如果此條件滿足,空白標本和低值標本的檢測結果數不一定相同。
e) 如果達不到以上要求,操作者應增加重複檢測數以保證數據的嚴謹和可靠。
5.6.1.2 6.1.2 數據分析
數據分析過程包括以下幾步驟:
a) 選擇合適的α和β值以用於確定LoB和LoD估計值(通常α=β=0.05);
b) 審覈所有試劑批號的空白標本結果總的分佈,明確是否可以使用參數統計方法;
c) 選擇數據統計方法(參數或非參數);
d) 根據研究數據中試劑批號數量的不同,計算LoB。
5.6.1.3 6.1.3 LoB的計算
5.6.1.3.1 6.1.3.1 總述
根據空白標本測量結果分佈選擇數據分析方法計算LoB。非參數統計方法沒有分佈要求,適用於所有的數據集。
5.6.1.3.2 6.1.3.2 非參數統計方法
如果只有2~3個試劑批號,則對每個批號分別執行步驟a)~d)。如果有4個或4個以上的試劑批號,結合所有批號的數據執行步驟a)~d)。
a) 將B個空白標本的檢測結果按從小到大的方式進行排序,B表示整個數據集的總數:X1、X2、X3……XB。
b) 按照預期的Ⅰ類錯誤風險概率α,計算空白標本結果分佈的百分位數(PctB)(如α=0.05,P= 0.95)。
c) 根據PctB計算相應的排列位置,如排列位置=0.5+B×0.95。
d)LoB即爲步驟c)中計算得到的排列位置對應的測量結果,如果該排列位置不是整數,則LoB通過該非整數兩邊的整數排列位置的插入值進行計算。如B=60,排列位置=0.5+60×0.95=57.5,則LoB應根據第57和58位數計算得到,即LoB=X57+0.5(X57-X58)-0.5(X57+X58)。如果B=65,排列位置=0.5+65×0.95-62.25,LoB=X62+0.25(X63-X62)。
e) 如果包含2~3個試劑批號,則選擇每個試劑批號計算所得的LoB最大值。如果有4個或4個以上的試劑批號,則利用所有數據按步驟a)~d)計算LoB。
5.6.1.3.3 6.1.3.3 參數統計方法
如果只有2~3個試劑批號,則對每個批號分別執行步驟a)~b)。如果有4個或4個以上的試劑批號,結合所有批號的數據執行步驟a)~b),具體如下:
b) 按以下公式計算LoB,見式(1):

式中:
CP——正態分佈95百分位數的乘數因子(用觀察SD代替真實未知人羣SD的校準因子),其計算方法見式(2):

式中:
B——數據集空白結果的總數;
注1:1.645表示α=0.05時,正態分佈的95百分位數對應的界值。
c) 如果包含2~3個試劑批號,則選擇每個試劑批號計算所得的LoB最大值。如果有4個或4個以上的試劑批號,則利用所有數據按步驟a)~b)計算LoB。
5.6.1.4 6.1.4 LoD的計算
5.6.1.4.1 6.1.4.1 總述
如低值標本的測量結果呈方差齊性,LoD的計算應採用參數統計方法。反之則需採用非參數分析(見6.1.4.3)或精密度曲線方法(見6.2),或者選擇更合適的標本,重複該研究。
5.6.1.4.2 6.1.4.2 參數統計方法
6.1.4.2.1 如果可能,在計算前將數據轉化成正態分佈的形式。
6.1.4.2.2 如果只有2~3個試劑批號,則對每個批號分別執行步驟a)~c)。如果有4個或4個以上的試劑批號,結合所有批號的數據執行步驟a)~c)。具體如下:
a) 計算數據集中每個低值標本的SD。
b) 計算所有的J個低值標本的數據集SDL,見式(3):

式中:
J——低值標本數;
ni——第i個低值標本所有結果數;
c) 按以下公式計算LoD,見式(4):

![]()
式中:
CP——正態分佈95百分位數的乘數因子(用觀察SD代替真實未知人羣SD的校準因子),其計算方法見式(5):

式中:
J——低值標本數。
注1:1.645表示β=0.05時,正態分佈的95 th位數的界值,如果β改變,應改變對應的乘數。
d) 如果包含2~3個試劑批號,則選擇每個試劑批計算所得的LoD最大值。如果有4個或4個以上的試劑批號,則利用所有數據按步驟a)~c)計算LoD。
以上LoB與LoD的計算實例可以參見附錄A。
5.6.1.4.3 6.1.4.3 LoD衍生方法:非參數統計方法
6.1.4.3.1 如果測量結果的變異性不能接近正態分佈,也不能通過轉化得到近似正態分佈,則應採用非參數方法。
6.1.4.3.2 採集數據以後,按照6.1.3.2確定LoB,每個試劑批號的所有低值標本的結果形成一個單獨的分佈,計算LoB以下的結果百分數。如果該百分數低於預期的Ⅱ類錯誤,則該批號的LoD爲所有低值標本結果分佈的中位數。
6.1.4.3.3 如果包含2~3個試劑批號,則選擇每個試劑批號計算所得的LoD最大值。如果有4個或4個以上的試劑批號,則利用所有數據計算LoD。
6.1.4.3.4 典型的Ⅱ類錯誤β=0.05要求低於LoB值的低值標本分佈結果應少於5%。如果一個或以上試劑批號不能滿足Ⅱ類錯誤的要求,則新用一批濃度較高的低值標本重新進行該研究。重新進行的研究不需要再重複計算LoB的部分。直到每個批號或所有批號的結果分佈滿足Ⅱ類錯誤要求時終止檢測。分析物的濃度即爲測量程序的LoD。
5.6.2 6.2 精密度曲線方案
5.6.2.1 6.2.1 方案簡介
6.2.1.1 如果測量結果的分佈服從相對正態分佈,但在預期LoD範圍內有所改變時,或者建立者對 LoD沒有很明確的初始估計,希望得到較使用經典方法更寬的測量濃度範圍時,可採用精密度曲線方法。
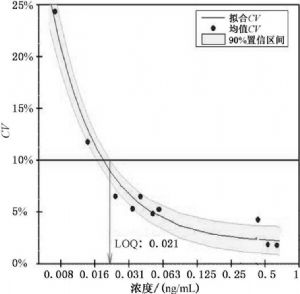
6.2.1.2 連續20 d檢測一組分析物濃度平均分佈的患者標本,獲得不同濃度下實驗室內變異估計值。6.2.1.3 選擇包含假定LoD的預期測量濃度範圍的患者標本,通常較經典方法採用的範圍更寬。然後以y軸爲實驗室內變異,x軸爲各個平均分析物濃度來繪製精密度曲線圖,如圖1所示。數據採用二階多項式進行修整,然後利用遞歸的方式從預期的SD計算試驗的LoD值。如果試驗LoD值與形成預期 SD的分析物濃度擬合,則該值可作爲測量程序的LoD的估計值。
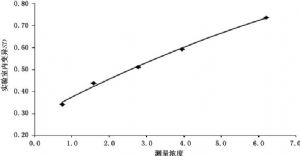
圖1 精密度曲線示例
5.6.2.2 6.2.2 試驗設計
按照技術和統計上可靠的精密度方案處理一組患者標本或類似物重複檢測結果,獲得實驗室內變異的估計值。如果研究中包含2~3個試劑批號,則計算每個批號的LoD,選擇LoD最大值。如果有4個或4個以上的試劑批號,則利用所有數據計算LoD。最基本的試驗設計包括:
a) 2個試劑批號;
b) 1個儀器系統;
c) 5天實驗;
d) 5個標本;
注:以上最簡單的設計方案不能得到要求的每個批號的40個總數據。建立者應根據特定的測量程序和可獲得的資源增加一個或多個設計因子(如儀器系統、試劑批號、校準頻率、操作者等),以提供充足的測量結果數。
5.6.2.3 6.2.3 精密度模型
應根據檢測樣本分析物的濃度範圍來選擇合適的模型。應用最廣的3種模型爲線性模型、二次方模型及Sadler精密度曲線模型,後者描述見式(6):

式中:
B1、B2、B3——模型中估計的參數;
5.6.2.4 6.2.4 數據分析
按照以下步驟估計LoD值:
a) 選擇精密度曲線的模型;
b) 評價模型確保進一步分析的適用性;
c) 從LoB濃度開始逐漸增加,迭代計算實驗室內變異SD及相關的LoD;
d) 如果預期的SD對應的LoD值等於分析物濃度時,將該值作爲LoD的估計值。
5.6.3 6.3 概率單位方案
5.6.3.1 6.3.1 方案簡介
6.3.1.1 概率單位方案適用於當測量程序的檢出能力以比例(陽性結果數/重複檢測的總數)的形式表示時,如果用LoB定義陽性結果,則該方法可用於直接分析物定量。
6.3.1.2 典型的概率單位方案遵循有限稀釋的劑量反應曲線,對已知測量濃度的標本進行系列稀釋,然後測量程序對這些稀釋物進行重複檢測,得到兩種結果:檢出或未檢出。對每個稀釋濃度,計算“檢出”測量結果數/總的重複測量數的比例(命中率)。將這些命中率轉化爲累積正態概率單位,並用迴歸模型對各自的測量濃度進行修勻。最後用迴歸模型計算預期命中率(如0.95)的測量濃度,即LoD。如圖2所示。

注:左圖的曲線解釋了假定的試驗結果,有圖爲通過概率單位方法確定分子測量程序的LoD的迴歸分析。
6.3.1.3 概率單位分析適用於臨牀實驗室檢測某些感染物質的分子生物學技術或其他利用PCR技術進行擴增和檢測的測量程序。這種測量程序沒有陰性標本結果的分佈,因爲此類結果通常報告爲0。這種情況下,空白標本檢測結果的第95百分位數爲0,LoB按定義設爲0。
6.3.1.4 評價分子測量程序的檢出能力時應包括所有相關基因型的代表性標本,對各個有意義的基因型分別估計LoD,然後選擇最大的LoD作爲整體測量程序的LoD估計值。
5.6.3.2 6.3.2 試驗設計
對來源於多個已知分析物濃度的獨立標本的重複檢測結果進行分析。如測量程序在3d內未達到測量標本數的最低要求,可增加檢測天數。如果研究包含2~3個試劑批號,計算每個批號的LoD,如果有4個或4個以上的試劑批號,結合所有數據估計LoD。LoB可以默認爲0,並通過多個陰性患者標本進行確認,也可以採用經典方法,利用陰性患者標本進行確定。最基本的試驗設計包括:
a) 兩個試劑批號;
b)一個儀器系統;
c) 3天實驗;
g) 每個試劑批號每個陽性標本每個稀釋度重複檢測20次(所有的檢測日期);
h) 每個試劑批號每個陰性標本重複檢測2次(所有的檢測日期)。
5.6.3.3 6.3.3 數據分析
按照下面的步驟進行分析,得到最終的LoB和LoD:
a) 選擇估計LoB的α錯誤風險和估計LoD的β錯誤風險(通常α=β=0.05);
b) 根據選擇的方法定義或計算LoB;
c) 計算每個試劑批號的LoD;
d) 選擇最大的LoD作爲測量程序的最終LoD估計值。
5.7 7 LoQ的確立
5.7.1 7.1 總述
7.1.1 LoQ是僅適用於定量測量程序的性能屬性。報告LoQ估計值時應包括相應的準確度目標。 LoQ的確定具有一定的靈活性,可接受要求越嚴格,LoQ值越大。
7.1.2 評價LoQ可依照評價LoD的經典方法(見6.1.1),也有很多其他方法可用於估計LoQ。無論選擇哪種設計方法,都應與測量程序及其應用相適應,技術和統計學上可靠,並應與預期準確度目標和最低設計要求相一致。
7.1.3 建立測量程序時應評價LoQ,實驗室可採用不同於方法建立者最初選擇的準確度目標,確立自身特定的LoQ。根據可接受目標,LoQ可以等於或高於(但絕不會低於)LoD。
5.7.2 7.2 準確度目標規範
7.2.1 準確度目標規範通常以TE來表示,TE的計算可依據兩種被廣泛接受的模型:Westgard模型[見式(7)]和均方根(RMS),或方差模型[見式(8)]。這兩種方法都結合了測量程序的偏移和精密度估計,在特定的分析物濃度進行評價。如果合適,也可採用其他的LoQ定義。
Westgard模型:

RMS模型:

式中:
TE——允許總誤差;
Bias——偏移;
s——標準差。
7.2.2 偏移宜通過標準品或具有參考值的標本進行評估,也可採用公認議值標準品。如上述情況不可得,也可採用其他如患者標本作爲起始材料,其濃度由參考測量程序或其他可接受準確度的程序確定或可溯源至參考測量程序。也可使用這些材料的稀釋物,假定稀釋液與測量程序兼容,並在低濃度範圍具有線性。
7.2.4 精密度估計反映了重複性和日間變異,宜包括其他來源的變異,如操作者之間、校準週期間等。僅包括重複性的精密度估計不適用於LoQ研究。
7.2.5 對LoQ應提供其相關的準確度目標。沒有一種準確度目標適用於所有的測量程序及其應用。準確度目標的來源包括基於臨牀用途的(如心肌肌鈣蛋白的10%實驗室內變異)、基於TE的質量目標(如GB/T 20470—2006或WS/T 403—2012)及基於生物學變異的質量目標。
5.7.3 7.3 試驗設計
7.3.1 選擇一個靶濃度作爲試驗的LoQ,並根據該濃度製備多個低值標本,分別在多天用一個或多個儀器系統,多個試劑批號進行重複檢測。對每個試劑批號的檢測結果計算TE,如果滿足既定目標,則將均值報告爲測量程序的LoQ。最基本的試驗設計包括:
a) 兩個試劑批號;
b)一個儀器系統;
c) 3天實驗;
注:以上給出的設計方案爲最基本的試驗方案,根據特定的測量程序和期望的結果以及統計的嚴格性,可增加試驗設計的因子數,各兇子的水平數或重複測量的次數。
7.3.2 建立者可增加更多的因子或增加重複檢測數,以提高LoQ估計的嚴謹性。
5.7.4 7.4 數據分析
7.4.1 如果研究包含2~3個試劑批號,對每個試劑批號分別分析數據,如果有4個或4個以上的批號,則結合所有數據進行分析。計算方式如下:
a) 計算每個批號每個低值水平標本的所有重複檢測結果的均值(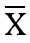
Bias=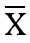
c) 利用Westgard TE模型計算每個標本的TE;
e) 將每個試劑批號的TE與既定準確度目標進行比較,對每個試劑批號,如果最低濃度的標本滿足準確度規範,則將其作爲該批號的LoQ;
f)選擇所有批號中最大的LoQ(2~3個試劑批號時)或結合所有數據分析得到的LoQ(4個或4個以上試劑批號)作爲測量程序最終的LoQ。
7.4.2 如果有一個或以上的試劑批號不能滿足準確度目標,則應用一批新的較高的分析物濃度重複整個研究過程。
5.7.5 7.5 衍生方法:LoD和LoQ的綜合評價
7.5.1 根據測量程序及其相關的準確度目標,可採用一種衍生方法,利用精密度曲線方法(見6.2)將 LoQ評價作爲LoD評價的一部分。該衍生方法唯一的變化是低值標本必須是已知分析物濃度的,以便計算偏移。
7.5.2 選擇合適的標本完成試驗設計,按照7.4中的步驟a)~c)計算每個批號每個標本的TE估計值。以TEs爲y軸,標本分析物濃度爲x軸,得到TE曲線,採用合適的迴歸模型或圖表差值進行修勻。利用曲線或迴歸模型,確定相應準確度目標下的分析物濃度,並將其報告爲該測量程序的LoQ。
以上LoQ的確立方法可參見附錄B。
5.8 8 檢出能力聲明的驗證
5.8.1 8.1 總則
8.1.1 驗證試驗用於保證測量程序在標準實踐中的性能與建立者提供的聲明一致。
8.1.2 採用一個儀器系統一個試劑批號在多天內對小數量的標本進行重複檢測。計算與聲明一致的測量結果比例,與適當的臨界值進行比較,以判斷驗證的結果。如果觀察的比例小於規定臨界值,則表明性能不符合聲明。
8.1.3 以下描述的驗證方案均基於最低的可接受試驗設計要求。根據特定的測量程序及期望的統計嚴格性,可適當地增加試驗設計因子數、因子的水平數或重複測量次數。
8.1.4 除了正式的驗證試驗,還可以從其他視角驗證測量程序的檢測能力,如包括低值分析物水平的能力驗證結果等。
5.8.2 8.2 LoB聲明的驗證
5.8.2.1 8.2.1 方案要求
最基本的試驗方案應包括:
a)一個試劑批號;
b)一個儀器系統;
c) 3天實驗;
5.8.2.2 8.2.2 數據分析
數據分析方式如下:
a) 保證檢測結束時有足夠的測量結果進行數據分析,至少應包括20個空白標本結果;
c) 將得到的百分比與附錄E中臨界值比較,如果沒有匹配的測量結果總數(N),選擇最接近的值;
e) 如果觀察百分比小於附錄E中的值,則驗證失敗。查找原因,如有必要,諮詢測量程序建立者,根據驗證結果,執行新的驗證研究或利用評價方案確立LoB。
以上LoB聲明的驗證參見附錄C。
5.8.3 8.3 LoD聲明的驗證
5.8.3.1 8.3.1 方案要求
最簡單的試驗設計應包括:
a)一個試劑批號;
b)一個儀器系統;
c) 3天實驗;
d) 2個LoD聲明濃度附近的標本;
f) 總計20個低值重複檢測結果。
如果提供了LoD聲明,按照8.2進行驗證。如果驗證通過,則使用該聲明;如果驗證失敗或未提供LoD聲明,則可按照6.1要求先確立LoD。
以上LoD聲明的驗證參見附錄C。
5.8.3.2 8.3.2 數據分析
數據分析方式如下:
a) 保證檢測結束時有足夠的測量結果進行數據分析,至少應包括20個低值標本結果;
b) 計算低值測量結果等於或超過LoD聲明的百分比;
c) 將得到的百分比與附錄E的臨界值比較,如果沒有匹配的測量結果總數(N),選擇最接近的值;
e) 如果觀察百分比小於附錄E中的值,則驗證失敗,查找原因。如有必要,諮詢測量程序建立者,根據驗證結果,執行新的驗證研究或利用評價方案確立LoD聲明。
5.8.4 8.4 LoQ聲明的驗證
8.4.1 以下方案適用於基於TE準確度目標的LoQ聲明驗證。僅基於精密度目標的LoQ聲明可通過 CLSI EP15中的精密度試驗進行驗證。
8.4.2 方案要求
最簡單的試驗設計應包括:
a) 一個試劑批號;
b) 一個儀器系統;
c) 3天實驗;
d) 2個LoQ聲明濃度附近的標本;
f) 總計20個低值重複檢測結果。
8.4.3 數據分析
數據分析方式如下:
a) 保證檢測結束時有足夠的測量結果進行數據分析。至少應包括20個標本結果;
b) 對每個標本計算靶值±允許TE;
c) 計算每個標本落在允許總誤差範圍內的檢測結果個數,然後計算所有標本檢測結果滿足LoQ聲明的可接受標準的比例;
d) 將得到的百分比與附錄E的臨界值比較,如果沒有匹配的測量結果總數(N),選擇最接近的值;
f) 如果觀察百分比小於附錄E中的值,則驗證失敗。查找原因。如有必要,諮詢測量程序建立者,根據驗證結果,執行新的驗證研究或利用評價方案確立LoQ聲明。
以上LoQ聲明的驗證參見附錄D。
5.9 附錄A(資料性附錄)利用經典方法評價
A.1 初始精密度試驗表明A診斷試劑廠商肌鈣蛋白Ⅰ在測量範圍下限的樣本檢測結果具有一致的重複性,故採用經典方法評價LoB和LoD。採用本標準中6.1.1中最低要求方案C):2個試劑批號;1臺儀器;3天試驗;5個空白標本與5個低值標本,每個標本重複檢測2次(分別在不同的天和不同的試劑批號);每個試劑批號至少60個空白測量結果和60個低值標本測量結果。
空白標本來源於該檢驗系統清洗緩衝液。對該廠家肌鈣蛋白Ⅰ濃度爲0的校準品重複測量20次,最大觀察值爲0.007 ng/mL,將該值作爲LoB初始估計值,同時確定選擇低值標本的期望濃度範圍爲0.007 ng/mL~0.030 ng/mL(LoB的1~5倍)。從另一獨立的方法比較研究5例落在該範圍內的標本。
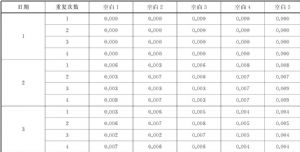
表A.2(續) 單位爲ng/mL


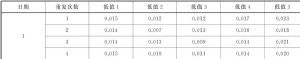
表A.4(續) 單位爲ng/mL
A.2 LoB的評價。數據處理採用非參數統計方法,步驟見下:
a) 對2個試劑批號分別估計LoB,將5個空白標本的所有測量結果按從低到高的順序進行 排序;
b) 採用典型的Ⅰ類錯誤風險α=0.05,其相應的百分位數爲:PctB=1-α=0.95;
c) 該百分位數對應的排列位置計算如下:排列位置=0.5+(B×PctB)=0.5+(60×0.95)=57.5
d) 因排列位置必須是整數,通過插入至57.5相鄰的整數57和58計算該排列位置對應的值,即LoB估計值。
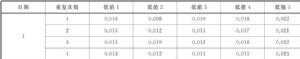
表A.5包含了空白測量結果的上面5個排列,0.008和0.010分別爲批號1和批號2的LoB估計值。選擇較大的0.010作爲該測量程序的LoB。
表A.5 空白標本檢測結果的排列位置和LoB 單位爲ng/mL

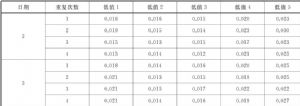
A.3 LoD的評價。按本標準6.1.4.3提供的方案,計算分析每個試劑批號的低值標本結果,表A.6給出了每個標本的SDs。彙集這些結果計算SDL,利用L=60,J=5計算乘數因子cb。結合上面報告的 LoB估計值計算每個批號的LoD,即試劑批號1和2分別爲0.0173和0.0141。取較大的0.0173作爲測量程序的LoD估計值。
表A.6 低值標本檢測結果的SDs和LoD計算 單位爲ng/mL
附錄B(資料性附錄)利用經典方法評價
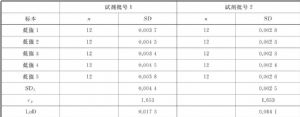
以A診斷試劑廠商肌鈣蛋白Ⅰ測量程序爲例,準確度目標定義爲實驗室內不精密度=10%(CV),採用本標準7.3.1方案給出的最低要求。
研究開始時對兩個試劑批號進行校準。從健康人中獲取9個血清標本池,其濃度覆蓋了測量範圍的下限區域。將標本池分成小份,並冷凍於-40℃。以隨機的順序檢測每個標本池的新鮮解凍血清,每個分析批用2個試劑批號進行檢測,收集連續20個工作日的數據。計算每個試劑批號每個標本的均值和實驗室內不精密度(SDWL),結果見表B.1,每個試劑批號的精密度曲線見圖B.1、圖B.2。
表B.1 觀察不精密度估計值總結


根據精密度曲線形狀,利用功效函數模型對數據進行修勻,然後利用迴歸分析估計每個試劑批號的功效曲線模型參數,從而得到滿足相應不精密度要求時不同批號試劑的分析物濃度,如:
試劑批號1 X=0.021 ng/mL
試劑批號2 X=0.018 ng/mL
也可以直接從精密度曲線(10%準確度目標)中分析物濃度與曲線的交點得到。
選擇最大的0.021 ng/mL作爲測量程序的LoQ。
附錄C(資料性附錄)驗證
B診斷試劑廠商超敏肌鈣蛋白Ⅰ檢測系統聲明的LoB=0.7 pg/mL~1.3 pg/mL,LoD=1.1 pg/mL~1.9 pg/mL,α=β=0.05。
LoB聲明驗證:連續3d檢測對2個空白標本(用廠家專用樣本稀釋液代替)重複檢測4次,所有數據來源於1個儀器系統和1個批號的試劑。檢測結果按濃度升序進行排序,見表C.1。
表C.1 LoB/LoD驗證的空白和低值標本結果 單位爲pg/mL
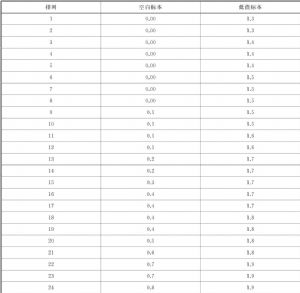
將空白標本的結果與廠商LoB聲明(LoB=0.7 pg/mL~1.3 pg/mL)進行比較,表明所有結果都滿足該聲明,即100%的結果滿足聲明,該百分數超過了本標準附錄E測量結果總數與臨界值觀察比例對
照表中的要求,24個標本選擇的95%可信區間的87%(見表E.1),即廠家LoB聲明得到驗證。N=24時選擇30對應的值。
LoD聲明驗證:連續3d檢測對2個低值患者標本重複檢測4次,所有數據來源於1個儀器系統和1個批號的試劑。檢測結果按濃度升序進行排序,見表C.l。
類似地,大於或等於LoD聲明的陽性結果百分數爲22/24=91.7%,高於表l中的87%,即LoD聲明也通過驗證。
附錄D(資料性附錄)驗證
B診斷試劑廠商超敏肌鈣蛋白Ⅰ檢測系統LoQ聲明值爲4.7 pg/mL(基於10% CV準確度目標)。假定α=β= 0.05。
LoQ驗證:採用本標準8.4.2介紹的實驗方案,選取5個低值患者標本,用已知的準確度可接受的測量程序得到這5個標本的靶值,分別計算其允許不精密度範圍。將每個標本的結果與允許不精密度範圍進行比較,計數超過範圍的結果個數。
各個標本的檢測結果、靶值、允許誤差範圍及超出範圍的結果個數見表D.1。
表D.1 LoQ驗證的結果 單位爲pg/mL
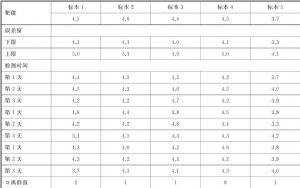
由表D.1可知,一共有5個標本超過誤差窗,即滿足準確度目標的比例爲40/45=89%,而N=45的最低百分數爲88%(見表E.1,取N=40和N=50中的較大者),因此LoQ聲明通過驗證。
附錄E(資料性附錄)測量結果總數與臨界值觀察比例對照表
測量結果總數與臨界值觀察比例對照表見表E.1。
表E.1 測量結果總數與臨界值觀察比例對照表