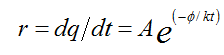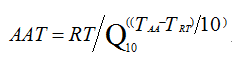1 拼音
wú yuán zhí rù xìng yī liáo qì xiè huò jià shòu mìng shēn bào zī liào zhǐ dǎo yuán zé
《無源植入性醫療器械貨架壽命申報資料指導原則》由國家食品藥品監督管理局於2011年3月24日食藥監辦械函[2011]116號印發。
2 一、前言
醫療器械貨架壽命具有保持醫療器械終產品正常發揮預期功能的重要作用,一旦超過醫療器械的貨架壽命,就意味着該器械可能不再具有已知的性能指標及預期功能,在使用中具有潛在的風險。爲進一步明確對無源植入性醫療器械產品註冊申報資料的技術要求,指導申請人/生產企業對無源植入性醫療器械貨架壽命有關注冊申報資料進行準備,特制定本指導原則。無源非植入性醫療器械有關貨架壽命註冊申報資料的準備可根據實際情況參照執行。
本指導原則系對無源植入性醫療器械貨架壽命的一般性要求,未涉及其他技術要求。對於產品其他技術要求有關注冊申報資料的準備,申請人/生產企業還需參考相關的法規和指導性文件。如有其他法規和指導性文件涉及某類醫療器械貨架壽命的具體規定,建議申請人/生產企業結合本指導原則一併使用。
本指導原則系對申請人/生產企業和審查人員的指導性文件,但不包括註冊審批所涉及的行政事項,亦不作爲法規強制執行。如果有能夠滿足相關法規要求的其他方法,也可採用,但應提供詳細的研究資料和驗證資料。申請者/生產企業應在遵循相關法規的前提下使用本指導原則。
本指導原則是在現行法規和標準體系以及當前認知水平下制定的,隨着法規和標準的不斷完善,以及科學技術的不斷髮展,本指導原則相關內容也將進行適時的調整。
4 三、基本要求
4.1 (一)貨架壽命影響因素
影響醫療器械貨架壽命的因素主要包括外部因素和內部因素。此處列舉了部分與無源植入性醫療器械密切相關的影響因素,但不僅限於以下內容:
外部因素主要包括:
1.儲存條件,例如溫度、溼度、光照、通風情況、氣壓、污染等;
2.運輸條件,例如運輸過程中的震動、衝撞;
3.生產方式,採用不同方式生產的同一醫療器械產品可能具有不同的貨架壽命;
4.生產環境,如無菌醫療器械生產場所的潔淨度、溫度和溼度、微生物及懸浮粒子負荷等;
5.包裝,例如在不同尺寸容器中包裝的產品可能具有不同的貨架壽命;
6.原輔材料來源改變的影響,如採購單位、採購批號改變;
7.其他影響因素,如生產設備改變的影響及設備所用清洗劑、模具成型後不清洗的脫模劑的影響。
內部因素一般包括:
1.醫療器械中各原材料/組件的自身性能,各原材料/組件隨時間的推移而發生退化,導致其化學性能、物理性能或預期功能的改變,進而影響醫療器械整體性能。如某些高分子材料和組合產品中的藥物、生物活性因子等。
3.醫療器械中各原材料/組件與包裝材料(包括保存介質,如角膜接觸鏡的保存液等)之間可能發生的相互作用。
4.生產工藝對醫療器械中各原材料/組件、包裝材料造成的影響,如生產過程中採用的滅菌工藝等。
5.醫療器械中含有的放射性物質和其放射衰變後的副產物對醫療器械中原材料/組件、包裝材料的影響。
內部因素和外部因素均可不同程度地影響醫療器械產品的技術性能指標,當超出允差後便可造成器械失效。由於影響因素很多,生產企業不可能將全部影響醫療器械貨架壽命的因素進行規避,但應儘可能將各因素進行有效控制,使其對醫療器械技術性能指標造成的影響降至最低。
需要強調的是,並不是所有的醫療器械均需要有一個確定的貨架壽命。當某一醫療器械的原材料性能和包裝材料性能隨時間推移而不會發生顯著性改變時,則可能沒有必要確定一個嚴格的貨架壽命,而當某一醫療器械的穩定性較差或臨牀使用風險過高時,其貨架壽命則需要進行嚴格的驗證。對於以無菌狀態供應的無源植入性醫療器械,生產企業應指定一個經過驗證的確定的貨架壽命。
4.2 (二)貨架壽命驗證過程
醫療器械貨架壽命的驗證貫穿該器械研發的整個過程,生產企業應在醫療器械研發的最初階段考慮其貨架壽命,並在產品的驗證和改進過程中不斷進行確認。
首先,生產企業要爲醫療器械設定保證運輸、儲存和預期功效的貨架壽命。
其次,生產企業需對用於生產和包裝醫療器械的材料、組件和相關生產工藝,以及涉及到的參考資料進行全面評估。如必要,還需進行實驗室驗證和調整生產工藝。
生產企業根據評估結果設計醫療器械的貨架壽命驗證方案,並依據方案所獲得的驗證結果確定該醫療器械的貨架壽命。如驗證結果不能被生產企業所接受,則需對其進行改進,並於改進後重新進行驗證。
最後,生產企業需要制定嚴格的質量體系文件以確保產品在貨架壽命內進行儲存、運輸和銷售。
生產企業應認真保存醫療器械貨架壽命驗證過程中涉及的各種文件和試驗數據,以便在申請註冊時和對貨架壽命進行重新評價時提供詳細的支持性資料。
4.3 (三)貨架壽命驗證內容
4.3.1 1.驗證試驗類型
醫療器械貨架壽命的驗證試驗類型通常可分爲加速穩定性試驗和實時穩定性試驗兩類。
(1)加速穩定性試驗
加速穩定性試驗是指將某一產品放置在外部應力狀態下,通過考察應力狀態下的材料退化情況,利用已知的加速因子與退化速率關係,推斷產品在正常儲存條件下的材料退化情況的試驗。
加速穩定性試驗設計是建立在假設材料變質所涉及的化學反應遵循阿列紐斯(Arrhenius)反應速率函數基礎上的。該函數以碰撞理論爲基礎,確認化學反應產生變化的反應速率的增加或降低按照以下公式進行:
r:反應進行的速率;A:材料的常數(頻率因子); :表觀活化能(eV);k:波爾茲曼常數(0.8617×10-4eV/K);t:絕對溫度。
大量化學反應的研究結果表明溫度升高或降低10℃會導致化學反應速率增加一倍或減半。則可根據阿列紐斯反應速率函數建立加速老化簡化公式:
AAT:加速老化時間;RT:實時老化時間;Q10:溫度升高或降低10℃的老化係數;TAA:加速老化溫度;TRT:正常儲存條件下溫度。
上述公式反映了加速穩定性試驗中加速老化時間與對應的貨架壽命的關係。其中,Q10一般設定爲2。當生產企業對醫療器械和包裝的材料的評估資料不齊備時,Q10可保守設定爲1.8。如生產企業在加速穩定性試驗中設定的Q10大於2,則應同時提供詳細的相關研究資料。
此外,設定較高的加速老化溫度可減少加速穩定性試驗的時間。但是,由於較高的溫度可能導致醫療器械原材料/組件和包裝材料的性質發生改變或引發多級或多種化學反應,造成試驗結果的偏差。因此,加速老化溫度一般不應超過60℃。如生產企業在加速穩定性試驗中設定了更高的加速老化溫度,亦應提供詳細的相關研究資料。
需要說明的是,當醫療器械的原材料/組件在高溫狀態下易發生退化和損壞時,則不應採用加速穩定性試驗驗證其貨架壽命。
(2)實時穩定性試驗
實時穩定性試驗是指將某一產品在預定的儲存條件下放置,直至監測到其性能指標不能符合規定要求爲止。
實時穩定性試驗中,生產企業應根據產品的實際生產、運輸和儲存情況確定適當的溫度、溼度、光照等條件,在設定的時間間隔內對產品進行檢測。由於中國大部分地區爲亞熱帶氣候,推薦驗證試驗中設定的溫度、溼度條件爲:25℃±2℃,60%RH±10%RH。
無源植入性醫療器械的實時穩定性試驗和加速穩定性試驗應同時進行。實時穩定性試驗結果是驗證產品貨架壽命的直接證據。當加速穩定性試驗結果與其不一致時,應以實時穩定性試驗結果爲準。
4.3.2 2.驗證試驗檢測/評價項目
無論加速穩定性試驗還是實時穩定性試驗,生產企業均需在試驗方案中設定檢測項目、檢測方法及判定標準。檢測項目包括產品自身性能檢測和包裝系統性能檢測兩方面。前者需選擇與醫療器械貨架壽命密切相關的物理、化學檢測項目,涉及產品生物相容性可能發生改變的醫療器械,需進行生物學評價。如適用,可採用包裝封口完整性檢測用於替代無菌檢測。後者則包括包裝完整性、包裝強度和微生物屏障性能等檢測項目。其中,包裝完整性檢測項目包括染色液穿透法測定透氣包裝的密封泄漏試驗、目力檢測和氣泡法測定軟性包裝泄漏試驗等;包裝強度測試項目包括軟性屏障材料密封強度試驗、無約束包裝抗內壓破壞試驗和模擬運輸試驗等。
生產企業在試驗過程中應設立多個檢測時間點(一般不少於3個)對無源植入性醫療器械進行檢測。可採用零點時間性能數據作爲檢測項目的參照指標。
4.3.3 3.進行驗證試驗的產品
醫療器械貨架壽命驗證試驗應採用與常規生產相同的終產品進行。驗證的醫療器械應至少包括三個代表性批次的產品,推薦採用連續三批。生產企業可對試驗產品進行設計最差條件下的驗證試驗以保證試驗產品可代表最惡劣的生產情況,如進行一個標準的滅菌週期後,附加一個或多個滅菌週期,或採用幾種不同的滅菌方法。
4.3.4 4.驗證試驗中採用的統計處理方法
生產企業應在驗證試驗方案中設定每一檢測項目的檢測樣品數量以確保檢測結果具有統計學意義,並在試驗報告中提供相關信息。
4.4 (四)參考標準
建議醫療器械生產企業儘可能採用國家標準、行業標準和公認的國際標準中規定的方法/措施對其醫療器械產品貨架壽命進行驗證,以減少驗證結果的偏差,提高驗證結論的準確性。附件中列舉了可能在貨架壽命驗證過程中涉及的部分標準,但不僅限於所列內容。
4.5 (五)註冊時應提交的技術文件
生產企業在無源植入性醫療器械首次註冊時需提供詳細的貨架壽命驗證資料,一般包括以下內容:
1.與申請註冊產品貨架壽命相關的基本信息。包括該醫療器械原材料/組件、包裝材料、生產工藝、滅菌方法(如涉及)、貨架壽命、儲存運輸條件等;
2.生產企業在該醫療器械貨架壽命驗證過程中對相關影響因素的評估報告;
3.實時穩定性試驗的試驗方案及試驗報告,同時提供試驗方案中檢測項目、檢測判定標準、檢測時間點及檢測樣本量的確定依據和相關研究資料;
4.如適用,可提供加速穩定性試驗的試驗方案和試驗報告,同時提供加速穩定性試驗的試驗方案中檢測項目、檢測判定標準、加速老化參數、檢測時間點及檢測樣本量的確定依據和相關研究資料;
6.生產企業認爲應在註冊時提交的其他相關支持性資料。
生產企業可在申請註冊產品的貨架壽命技術文件中使用其生產的其他醫療器械產品的貨架壽命研究資料及驗證資料,但應同時提供二者在原材料、包裝材料、生產工藝、滅菌方法(如涉及)等與貨架壽命相關的信息對比資料和二者在貨架壽命方面具有等同性的論證資料。
5 四、名詞解釋
1. 植入性醫療器械(Implantable Medical Device)
是指任何通過外科手術達到下列目的的醫療器械:全部或部分插入人體或自然腔道中,或爲替代上表皮或眼表面;此類醫療器械,通過外科手段在術後置留體內30天以上,並只能通過內科或外科手段取出。(該定義不適用於有源植入性醫療器械)
2.貨架壽命(Shelf Life)
是指醫療器械形成終產品後能夠發揮擬定作用的時間段。貨架壽命的終點是產品有效期限。超過此期限後,醫療器械產品將可能不再具有預期的性能參數及功能。
6 五、參考文獻
1.ClarkGS, Shelf Life of Medical Devices, FDA, April 1991
2.Container and Closure System IntegrityTesting in Lieu of Sterility Testing as a Component of the Stability Protocolfor Sterile Products, FDA, February 2008
3.Guidance Technical Files and DesignDossiers for
Non Active Medical Devices, TüV SüD Product Service GmbH, July2008
4.化學藥物穩定性研究技術指導原則 2005.3