3 基本信息
ICS 11.020
C 55
中華人民共和國衛生行業標準WS/T 677—2020《人羣維生素D缺乏篩查方法》(Method for vitamin D deficiency screening)由中華人民共和國國家衛生健康委員會於2020年05月06日《關於發佈〈人羣維生素D缺乏篩查方法〉等2項推薦性衛生行業標準的通告》(國衛通〔2020〕8號)發佈,自2020年11月01日起實施
4 發佈通知
關於發佈《人羣維生素D缺乏篩查方法》等2項推薦性衛生行業標準的通告
國衛通〔2020〕8號
現發佈《人羣維生素D缺乏篩查方法》等2項推薦性衛生行業標準,編號和名稱如下:
上述標準自2020年11月1日起施行。
特此通告。
國家衛生健康委
2020年5月6日
5 前言
本標準按照 GB/T 1.1—2009 給出的規則起草。
本標準起草單位:中國疾病預防控制中心營養與健康所、寧波市疾病預防控制中心、深圳市慢性病防治中心、深圳市計量質量檢測研究院、南京醫科大學、中糧營養健康研究院。
本標準主要起草人:楊麗琛、楊曉光、胡貽椿、金米聰、楊國武、周繼昌、汪之頊、賈健斌、王俊、陳曉紅、張協光、莫俊鑾、毛德倩、付志成、王睿、丁葉、周明、陳競、張森。
6 標準正文
6.1 1 範圍
本標準規定了人羣維生素D缺乏和不足篩查的指標、參考判定值和檢測方法。
6.2 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅注日期的版本適用於本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
GB/T 603 化學試劑 試驗方法中所用製劑及製品的製備
6.3 3 術語和定義
下列術語和定義適用於本文件。
3.1
25-羥基維生素 D 25-hydroxyvitamin D;25(OH)D
血液中維生素 D 的主要循環形式,穩定性好,是公認的評價人體維生素 D 營養狀況的可靠指標,主要包括兩種形式:25(OH)D2、25(OH)D3,其中 25(OH)D3是血液中維生素 D 的主要存在形式。
3.2
維生素 D 缺乏 vitamin D deficiency
當人體血清(或血漿)25-羥基維生素 D 含量低於缺乏的參考判定值時,可判定爲維生素 D 缺乏。
3.3
維生素 D 不足 vitamin D insufficiency
當人體血清(或血漿)25-羥基維生素 D 含量低於正常人羣的參考判定值,但高於缺乏參考判定值時,可判定爲維生素 D 不足。
6.4 4 人羣維生素 D 營養狀況判定指標及參考判定值
6.5 5 測定方法
6.5.1 5.1 血液標本的採集與保存
6.5.2 5.2 第一法:液相色譜串聯質譜法
6.5.3 5.3 第二法:化學發光免疫法
6.5.4 5.4 第三法:酶聯免疫法
7 附錄A(規範性附錄)血液標本的採集與保存
7.1 A.1 標本採集
A.1.1 血液標本的採集:空腹靜脈血,取血方法依據 WS/T 225 以及檢測方法的要求採集空腹靜脈血 1mL。
A.1.2 採血管:根據所需血清或血漿,使用不同採血管分裝。
7.2 A.2 血清、血漿保存
標本於2 ℃~8 ℃可穩定7 d,-20 ℃可穩定12個月。若標本不能及時檢測,建議適量分裝後於-70 ℃以下存放標本,僅一次凍融。
8 附錄B(規範性附錄)液相色譜串聯質譜法
8.1 B.1 原理
血清(血漿)中的25(OH)D2和25(OH)D3經甲醇/乙腈沉澱蛋白,採用正己烷萃取,氮氣吹乾,用初始流動相復溶,使用液相色譜法分離,串聯質譜多反應監測模式(MRM)檢測,同位素內標法定量,該方法可以分別測定25(OH)D2和25(OH)D3。
8.2 B.2 試劑和溶液
除非另有說明,本方法所有試劑均爲分析純,水符合GB/T 6682中一級用水規定,溶液按照GB/T 603配製。
8.2.1 B.2.1 試劑
B.2.1.1 25(OH)D2標準品(C28H44O2,CAS:21343-40-8):純度>98%或有證標準物質。
B.2.1.2 25(OH)D3標準品(C27H44O2,CAS:19356-17-3):純度>98%或有證標準物質。
B.2.1.3 同位素內標[2H3]-25(OH)D2標準品(C28H412H3O2,CAS:1217467-39-4):純度>98%。
B.2.1.4 同位素內標[2H3]-25(OH)D3標準品(C27H412H3O2,CAS:140710-94-7):純度>98%。
B.2.1.5 甲醇(CH3OH):色譜純。
B.2.1.6 正己烷(C6H14):色譜純。
B.2.1.7 甲酸(HCOOH):色譜純。
B.2.1.9 氮氣(N2):純度≥99.9%。
B.2.1.12 乙腈(CH3CN):色譜純。
B.2.1.15 標準儲備溶液(10 μg/mL):分別稱取25(OH)D2和25(OH)D3標準品1 mg(精確至0.01 mg)於2個100 mL容量瓶中,用甲醇溶解並定容至刻度。此溶液中25(OH)D2和25(OH)D3的濃度爲10 μg/mL。溶液轉移至試劑瓶中後,-20 ℃下避光保存,備用。
B.2.1.16 同位素內標標準儲備溶液(10 μg/mL):分別稱取同位素內標[2H3]-25(OH)D2和[2H3]-25(OH)D31 mg(精確至0.01 mg)於2個100 mL容量瓶中,用甲醇溶解並定容至刻度。此溶液中[2H3]-25(OH)D2和[2H3]-25(OH)D3的濃度爲10 μg/mL。溶液轉移至試劑瓶中後,-20 ℃下避光保存,備用。
B.2.1.17 標準系列溶液:分別準確移取25(OH)D2(10 μg/mL)和25(OH)D3(10 μg/mL)5 μL、10 μL、25 μL、50μL、125 μL、250 μL和500 μL於7個10 mL容量瓶中,用甲醇稀釋並定容至刻度。此係列溶液的25(OH)D2和25(OH)D3的濃度爲5 ng/mL、10 ng/mL、25 ng/mL、50 ng/mL、125 ng/mL、250 ng/mL和500ng/mL。
B.2.1.18 混合同位素內標溶液(100 ng/mL):分別準確吸取同位素內標[2H3]-25(OH)D2儲備溶液(10μg/mL)和[2H3]-25(OH)D3儲備溶液(10 μg/mL)各100 μL於10 mL容量瓶中,用甲醇稀釋並定容至刻度。
此溶液的同位素內標[2H3]-25(OH)D2和[2H3]-25(OH)D3的濃度均爲100 ng/mL。溶液轉移至試劑瓶中後,-20℃下避光保存,備用。
8.2.2 B.2.2 儀器和設備
B.2.2.1 分析天平,感量:0.0001 g。
B.2.2.2 分析天平,感量:0.00001 g。
B.2.2.3 液相色譜-串聯質譜聯用儀。
B.2.2.6 旋渦混合器。
B.2.2.7 移液槍或移液器。
8.3 B.3 分析步驟
8.3.1 B.3.1 樣品製備
取血清(血漿)樣品200 μL至2 mL離心管中,加入20μL混合同位素內標溶液,渦旋振盪30 s。加入400 μL沉澱劑(甲醇+乙腈,1+1),室溫下渦旋振盪混勻30 s;加入1.2 mL正己烷,室溫下渦旋振盪5 min,然後在4 ℃和離心力大於12000×g下離心5 min;吸取1.0 mL上清液至1.5 mL離心管中,室溫下用氮氣吹至幹;用100 μL初始流動相復溶,渦旋振盪30 s,4 ℃和離心力大於12000×g下離心5 min,上清液轉移至進樣瓶中待LC-MS/MS分析。
8.3.2 B.3.2 標準工作溶液製備
取7個2 mL離心管,分別加入180 μL空白替代血清樣品(1%BSA牛血清白蛋白水溶液),以及20 μL標準系列溶液(B.2.1)和20 μL混合同位素內標溶液,此係列相當於0.5 ng/mL~50 ng/mL濃度範圍。旋渦振盪30 s。以下操作同B.3.1。
8.3.3 B.3.3 液相色譜-串聯質譜聯用儀參數設置
B.3.3.1 液相色譜分析參考條件:
a) 色譜柱:C18柱(柱長 100 mm,柱內徑 2.1 mm,填料粒徑 1.7 μm,或者具同等柱效的色譜柱);
b) 流動相:A 相:含 0.1%甲酸的水溶液;B 相:含 0.1%甲酸的甲醇溶液;
c) 梯度洗脫:見表 B.1;
d) 流速:0.30 mL/min;
e) 柱溫:40 ℃;
f) 進樣體積:10 μL。
| 時間/min | 流動相A/% | 流動相B/% |
| 0 | 15 | 85 |
| 2.0 | 3 | 97 |
| 3.5 | 3 | 97 |
| 4.0 | 15 | 85 |
| 7.0 | 15 | 85 |
B.3.3.2 質譜測定參考條件:
c) 氣簾氣:0.25 MPa;
d) 噴霧電壓:4000 V;
e) 去溶劑氣溫度:450 ℃;
f) 霧化氣:0.35 MPa;
g) 去溶劑氣:0.35 MPa;
h) MRM 離子對參數見表 B.2 所示。
| 目標化合物 | 母離子/(m/z) | 定量離子/(m/z) | 去簇電壓/eV | 碰撞能量/eV |
| 25(OH)D2 | 413.2 | 355.2a 337.1 | 90 90 | 15 15 |
| [2H3]-25(OH)D2 | 416.2 | 358.2a 340.1 | 95 95 | 36 15 |
| 25(OH)D3 | 401.2 | 257.2a 365.3 | 100 100 | 19 22 |
| [2H3]-25(OH)D3 | 404.2 | 257.2a 368.3 | 100 100 | 19 20 |
| a 定量離子。 | ||||
8.3.4 B.3.4 定性測定
在同一色/質譜條件下進行標準溶液和樣品溶液的測定,如果樣品溶液中檢出的色譜峯的保留時間與標準溶液中檢出的色譜峯的保留時間一致,所選擇的離子對的質荷比也一致,而且樣品溶液中定性離子對的相對丰度與濃度相當的標準溶液中的定性離子對的相對丰度比較,相對偏差也不超過表B.3規定的範圍,則可判定樣品溶液中存在該物質。
| 相對離子丰度 | >50% | >20%~50% | >10%~20% | ≤10% |
| 允許相對偏差 | ±20% | ±25% | ±30% | ±50% |
8.3.5 B.3.5 工作曲線的製作
在B.3.3的液相色譜和串聯質譜分析條件下,將B.3.2得到的標準工作溶液由低濃度到高濃度進行進樣分析,以25(OH)D2和25(OH)D3色譜峯與其對應的同位素內標色譜峯的峯面積比值-濃度進行線性迴歸,得到標準工作溶液的直線擬合方程,其線性相關係數應大於0.99。
8.3.6 B.3.6 樣品測定
在B.3.3的液相色譜和串聯質譜分析參考條件下,將B.3.1得到的待測樣品溶液進樣分析,按內標法計算待測試樣溶液中目標物的質量濃度。待測試樣溶液中的目標物的質量濃度應在標準工作曲線的線性範圍內,超過線性範圍則應適當稀釋樣品後再重複處理測定。
8.3.7 B.3.7 空白試驗
以1%BSA牛血清白蛋白水溶液代替血清(血漿)樣品,按B.3.1的步驟做空白試驗。
8.4 B.4 質量控制
8.4.1 B.4.1 內部質控
實驗室應制定測試結果質量控制程序,明確內部質量控制的內容、方式和要求。隨同樣品檢測需測定質量控制樣品,繪製質量控制圖,觀察測試工作的穩定性、系統偏差及趨勢,及時發現異常現象並採取相應的改進措施。
8.4.2 B.4.2 外部質控
實驗室應參加國內外實驗室認可機構組織的能力驗證活動,參加國際間、國內同行間的實驗室比對試驗。根據外部評審、能力驗證、考覈、比對等結果評估檢驗結果的質量並採取相應的改進措施。
8.5 B.5 分析結果的計算
血清(血漿)樣品中25(OH)D2和25(OH)D3的質量濃度按式(B.1)計算:
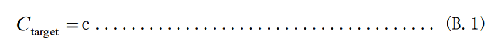
式中:
Ctarget——血清(血漿)樣品中目標物的濃度,單位爲納克每毫升(ng/mL);
c——工作曲線中查出的樣品濃度,單位爲納克每毫升(ng/mL);
注:結果用平行測定的算術平均值表示,保留小數點後一位,血漿(血清)中25(OH)D總含量爲25(OH)D2和25(OH)D3含量相加。
8.6 B.6 精密度
在重複性條件下獲得的兩次獨立測定結果的絕對差值不得超過算術平均值的10%。
8.7 B.7 檢出限和定量限
本方法25(OH)D2、25(OH)D3檢出限均爲0.15 ng/mL,定量限均爲0.5 ng/mL。
8.8 B.8 回收率
本方法的添加回收率爲84.0%~106.0%。
8.9 B.9 25-羥基維生素D2和 25-羥基維生素D3標準溶液LC-MS/MS色譜圖
25(OH)D2和 25(OH)D3標準溶液的 LC-MS/MS 色譜圖見圖 B.1,[2H3]-25(OH)D2和[2H3]-25(OH)D3標準溶液的 LC-MS/MS 色譜圖見圖 B.2。
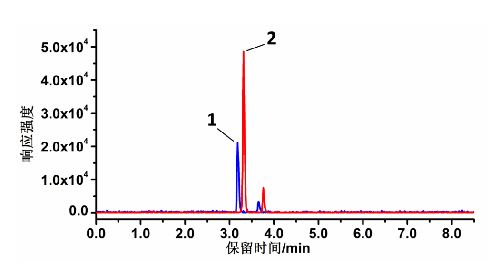
說明:
1——峯 1 爲 25(OH)D3;
2——峯 2 爲 25(OH)D2
圖 B.1 25(OH)D2和 25(OH)D3標準溶液 LC-MS/MS 圖
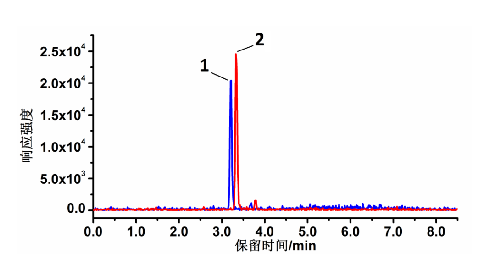
說明:
1——峯 1 爲[2H3]-25(OH)D3;
2——峯 2 爲[2H3]-25(OH)D2
圖 B.2 [2H3]-25(OH)D2和[2H3]-25(OH)D3標準溶液 LC-MS/MS 圖
9 附錄C(規範性附錄)化學發光免疫法
9.1 C.1 原理
依據化學檢測體系中25(OH)D濃度與體系的化學發光強度在一定條件下呈線性定量關係的原理,利用儀器對體系化學發光強度的檢測,進而確定25(OH)D含量的分析方法。
9.2 C.2 儀器和材料
C.2.3 25(OH)D定標液、質控品。
C.2.4 儀器基礎試劑和耗材。
9.3 C.3 分析步驟
C.3.1 按化學發光免疫分析儀器操作說明和試劑盒使用說明,準備儀器、試劑、標準品和質控品等。
C.3.2 進行化學發光免疫分析儀系統測試以及25(OH)D總量檢測試劑盒定標。
C.3.3 血清(血漿)標本應達到室溫,混合均勻後進行測定,確保樣品杯中無氣泡。爲了防止液體揮發影響結果,所有樣品、標準品、質控品上機後都應在2h內測定。
C.3.4 嚴格按儀器操作說明要求進行標準品、質控品及樣品的測定,並讀取、保存、計算檢測結果。
9.4 C.4 質量控制
9.4.1 C.4.1 內部質控
實驗室應制定測試結果質量控制程序,明確內部質量控制的內容、方式和要求。隨同樣品檢測需測定質量控制樣品,繪製質量控制圖,觀察測試工作的穩定性、系統偏差及趨勢,及時發現異常現象並採取相應的改進措施。
9.4.2 C.4.2 外部質控
實驗室應參加國內外實驗室認可機構組織的能力驗證活動,參加國際間、國內同行間的實驗室比對試驗。根據外部評審、能力驗證、考覈、比對等結果評估檢驗結果的質量並採取相應的改進措施。
10 附錄D(規範性附錄)酶聯免疫法
10.1 D.1 原理
樣本中25(OH)D與其抗體結合,通過洗液除去非結合物,再加入酶標記的抗原或抗體,此時,能固定下來的酶量與樣品中25(OH)D的量相關。通過加入與酶反應的底物顯色後,於特定波長下檢測吸光度,根據顏色的深淺可以分析樣品中25(OH)D總量。
10.2 D.2 儀器和材料
D.2.1 恆溫培養箱、酶標儀、洗板機。
D.2.3 總25(OH)D標準品、質控品。
10.3 D.3 分析步驟
D.3.1 按血清(血漿)25(OH)D酶聯免疫試劑盒使用說明準備儀器、標準品、質控品、試劑等。
D.3.2 血清(血漿)標本應達到室溫,混合均勻後進行測定,確保樣品杯中無氣泡。爲了防止液體揮發影響結果,所有樣品、標準品、質控品上機後都應在2小時內測定。
D.3.3 嚴格按儀器和試劑盒操作說明要求進行標準品、質控品及樣品的測定,並讀取、保存、計算檢測結果。
10.4 D.4 質量控制
10.4.1 D.4.1 內部質控
實驗室應制定測試結果質量控制程序,明確內部質量控制的內容、方式和要求。隨同樣品檢測需測定質量控制樣品,繪製質量控制圖,觀察測試工作的穩定性、系統偏差及趨勢,及時發現異常現象並採取相應的改進措施。
10.4.2 D.4.2 外部質控
實驗室應參加國內外實驗室認可機構組織的能力驗證活動,參加國際間、國內同行間的實驗室比對試驗。根據外部評審、能力驗證、考覈、比對等結果評估檢驗結果的質量並採取相應的改進措施。