2 英文參考
Mass spectrometry[WS/T 455—2014 衛生監測與評價名詞術語]
3 概述
質譜法是將氣體分子經電子流轟擊,把分子中的電子打掉一個使成帶正電荷的分子離子,然後裂解成一系列的碎片離子,再通過磁場使不同質荷比的正離子分離並記錄其相對強度,畫出質譜圖,以此進行元素分析、分子量測定、分子式確定和分子結構推斷等的方法。質譜法已成爲中藥化學成分結構測定常用的重要手段之一。
質譜法是使待測化合物產生氣態離子,再按質荷比(m/z)將離子分離、檢測的分析方法,檢測限可達10-15~10-12 mol數量級。質譜法可提供分子質量和結構的信息,定量測定可採用內標法或外標法。
5 質譜儀
質譜儀的主要組成如圖所示。在由泵維持的10-3~10-6 Pa真空狀態下,離子源產生的各種正離子(或負離子),經加速,進入質量分析器分離,再由檢測器檢測。計算機系統用於控制儀器,記錄、處理並儲存數據,當配有標準譜庫軟件時,計算機系統可以將測得的質譜與標準譜庫中圖譜比較,獲得可能化合物的組成和結構信息。
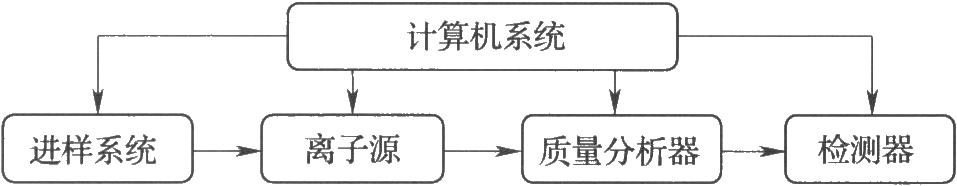
圖 質譜儀的主要組成
5.1 進樣系統
樣品導入應不影響質譜儀的真空度。進樣方式的選擇取決於樣品的性質、純度及所採用的離子化方式。
5.1.1 直接進樣
室溫常壓下,氣態或液態化合物的中性分子通過可控漏孔系統,進入離子源。吸附在固體上或溶解在液體中的揮發性待測化合物可採用頂空分析法提取和富集,程序升溫解吸附,再經毛細管導入質譜儀。
揮發性固體樣品可置於進樣杆頂端小坩堝內,在接近離子源的高真空狀態下加熱、氣化。採用解吸離子化技術,可以使熱不穩定的、難揮發的樣品在氣化的同時離子化。
多種分離技術已實現了與質譜的聯用。經分離後的各種待測成分,可以通過適當的接口導入質譜儀分析。
5.1.2 氣相色譜-質譜聯用(GC-MS)
氣相色譜分離後的流出物呈氣態,待測化合物的分子大小也適宜於質譜分析。在使用毛細管氣相色譜柱及高容量質譜真空泵的情況下,色譜流出物可直接引入質譜儀。
5.1.3 液相色譜-質譜聯用(LC-MS)
使待測化合物從色譜流出物中分離、形成適合於質譜分析的氣態分子或離子需要特殊的接口。粒子束(PBI)、移動帶(MBD、大氣壓離子化(API)是可用的液相色譜-質譜聯用接口。爲減少污染,避免化學噪聲和電離抑制,流動相中所含的緩衝鹽或添加劑通常應具有揮發性,且用量也有一定的限制。
(1)粒子束接口 液相色譜的流出物在去溶劑室霧化、脫溶劑後,僅待測化合物的中性分子被引入質譜離子源。粒子束接口適用於分子量小於1000的弱極性化合物的分析,測得的質譜可以由電子轟擊離子化或化學離子化產生。電子轟擊離子化質譜含有豐富的結構信息。
(2)移動帶接口 流速爲0.5~1.5ml/min的液相色譜流出物,均勻地滴加在移動帶上,蒸發、除去溶劑後,待測化合物被引入質譜離子源。移動帶接口不適宜於極性大或熱不穩定化合物的分析,測得的質譜可以由電子轟擊離子化或化學離子化或快原子轟擊離子化產生。
(3)大氣壓離子化接口 電噴霧離子化、大氣壓化學離子化是目前液相色譜-質譜聯用廣泛採用的大氣壓離子化接口技術。由於兼具離子化功能,這些接口又稱爲大氣壓離子源,將在離子化方式中介紹。
5.1.4 超臨界流體色譜-質譜聯用(SFC-MS)
目前,超臨界流體色譜-質譜聯用主要採用大氣壓化學離子化或電噴霧離子化接口,色譜流出物通過一個位於柱子和離子源之間的加熱限流器轉變爲氣態,進入質譜儀分析。5.毛細管電泳-質譜聯用(CE-MS)
幾乎所有的毛細管電泳操作模式均可與質譜聯用。選擇接口時,應注意毛細管電泳的低流速特點並使用揮發性緩衝液。電噴霧離子化是毛細管電泳與質譜聯用最常用的接口技術。
5.2 離子化方式
根據待測化合物的性質及擬獲取的信息類型,可以選擇不同的離子化方式,使待測化合物生成氣態正離子或負離子,進一步質譜分析。某些情況下,進樣和離子化在同一過程中完成,很難明確區分。
5.2.1 電子轟擊離子化(EI)
處於離子源的氣態待測化合物分子,受到一束能量(通常是70eV)大於其電離能的電子轟擊而離子化。質譜中往往含有待測化合物的分子離子及具有待測化合物結構特徵的碎片離子。電子轟擊離子化適用於熱穩定的、易揮發化合物的離子化,是氣相色譜-質譜聯用最常用的離子化方式。當採用粒子束或移動帶等接口時,電子轟擊離子化也可用於液相色譜-質譜聯用。
5.2.2 化學離子化(Cl)
離子源中的試劑氣分子(如甲烷、異丁烷和氨氣)受高能電子轟擊而離子化,進一步發生離子-分子反應,產生穩定的試劑氣離子,再使待測化合物離子化。化學離子化可產生待測化合物(M)的(M+H)+或(M-H)-特徵離子或待測化合物與試劑氣分子產生的加合離子。與電子轟擊離子化質譜相比,化學離子化質譜中碎片離子較少,適宜於採用電子轟擊離子化無法得到分子質量信息的化合物分析。
5.2.3 快原子轟擊(FAB)或快離子轟擊離子化(LSIMS)
高能中性原子(如氬氣)或高能銫離子,使置於金屬表面、分散於惰性黏稠基質(如甘油)中的待測化合物離子化,產生(M+H)+或(M-H)-特徵離子或待測化合物與基質分子的加合離子。快原子轟擊或快離子轟擊離子化非常適合於各種極性的、熱不穩定化合物的分子質量測定及結構表徵,廣泛應用於分子量高達10000的肽、抗生素、核苷酸、脂質、有機金屬化合物及表面活性劑的分析。
快原子轟擊(FAB)或快離子轟擊離子化用於液相色譜-質譜聯用時,需在色譜流動相中添加1%~10%的甘油,且必須保持很低流速(1~10μl/min)。
5.2.4 基質輔助激光解吸離子化( MALDI)
將溶於適當基質中的供試品塗布於金屬靶上,用高強度的紫外或紅外脈衝激光照射,使待測化合物離子化。基質輔助激光解吸離子化主要用於分子量在100000以上的生物大分子分析,適宜與飛行時間分析器結合使用。
5.2.5 電噴霧離子化(ESI)
離子化在大氣壓下進行。待測溶液(如液相色譜流出物)通過一終端加有幾千伏高壓的毛細管進入離子源,氣體輔助霧化,產生的微小液滴去溶劑,形成單電荷或多電荷的氣態離子。這些離子再經逐步減壓區域,從大氣壓狀態傳送到質譜儀的高真空中。電噴霧離子化可在1μl/min~1ml/min流速下進行,適合極性化合物和分子量高達100000的生物大分子研究,是液相色譜-質譜聯用、毛細管電泳-質譜聯用最成功的接口技術。
反相高效液相色譜常用的溶劑,如水、甲醇和乙腈等都十分有利於電噴霧離子化,但純水或純有機溶劑作爲流動相不利於去溶劑或形成離子;在高流速情況下,流動相含有少量水或至少20%~30%的有機溶劑有助於獲得較高的分析靈敏度。
5.2.6 大氣壓化學離子化(APCI)
原理與化學離子化相同,但離子化在大氣壓下進行。流動相在熱及氮氣流的作用下霧化成氣態,經由帶有幾千伏高壓的放電電極時離子化,產生的試劑氣離子與待測化合物分子發生離子-分子反應,形成單電荷離子。正離子通常是(M+H)+,負離子則是(M-H)-。大氣壓化學離子化能夠在流速高達2ml/min下進行,是液相色譜-質譜聯用的重要接口之一。
電噴霧離子源與大氣壓化學離子源常共用一個真空接口,很容易相互更換。選擇電噴霧離子化還是大氣壓化學離子化,分析者不僅要考慮溶液(如液相色譜流動相)的性質、組成和流速,待測化合物的化學性質也至關重要。電噴霧離子化更適合於在溶液中容易電離的極性化合物,容易形成多電荷離子的化合物和生物大分子(如蛋白質、多肽等)可以採用電噴霧離子源。大氣壓化學離子化常用於分析分子量小於1500的小分子或弱極性化合物(如甾醇類和類胡蘿蔔素等),主要產生的是(M+H)+或(M-H)-離子,很少有碎片離子。
相對而言,電噴霧離子化更適合於熱不穩定的樣品,而大氣壓化學離子源易與正相液相色譜聯用。許多中性化合物同時適合於電噴霧離子化及大氣壓化學離子化,且均具有相當高的靈敏度。無論是電噴霧離子化還是大氣壓化學離子化,選擇正離子(Positive ion)或負離子(Negative ion)電離模式,主要取決於待測化合物自身性質。
5.3 質量分析器
在高真空狀態下,質量分析器將離子按質荷比分離。質量範圍、分辨率是質量分析器的兩個主要性能指標。質量範圍指質譜儀所能測定的質荷比的範圍,分辨率表示質譜儀分辨相鄰的、質量差異很小的峯的能力。常用的質量分析器有扇形磁場分析器、四極杆分析器、離子阱分析器、飛行時間分析器和傅里葉變換分析器。
5.3.1 扇形磁場分析器
離子源中產生的離子經加速電壓(V)加速,聚焦進入扇形磁場(磁場強度B)。在磁場的作用下,不同質荷比的離子發生偏轉,按各自的曲率半徑(r)運動:
m/z=B2r2/2V
改變磁場強度,可以使不同質荷比的離子具有相同的運動曲率半徑(r),進而通過狹縫出口,達到檢測器。
扇形磁場分析器可以檢測分子量高達15000的單電荷離子。當與靜電場分析器結合、構成雙聚焦扇形磁場分析器時,分辨率可達到105。
5.3.2 四極杆分析器
分析器由四根平行排列的金屬桿狀電極組成。直流電壓(DC)和射頻電壓(RF)作用於電極上,形成了高頻振盪電場(四極場)。在特定的直流電壓和射頻電壓條件下,僅一定質荷比的離子可以穩定地穿過四極場,到達檢測器。改變直流電壓和射頻電壓大小,但維持它們的比值恆定,可以實現質譜掃描。
四極杆分析器可檢測的分子量上限通常達4000,分辨率約爲103。
5.3.3 離子阱分析器
四極離子阱(QIT)由兩個端蓋電極和位於它們之間的環電極組成。端蓋電極處在地電位,而環電極上施加射頻電壓(RF),以形成三維四極場。選擇適當的射頻電壓,四極場可以儲存質荷比大於某特定值的所有離子。採用“質量選擇不穩定性”模式,提高射頻電壓值,可以將離子按質量從高到低依次射出離子阱。揮發性待測化合物的離子化和質量分析可以在同一四極場內完成。通過設定時間序列,單個四極離子阱可以實現多級質譜(MSn)的功能。
線性離子阱(LIT)是二維四極離子阱,結構上等同於四極質量分析器,但操作模式與三維離子阱相似。四極線性離子阱具有更好的離子儲存效率和儲存容量,可改善的離子噴射效率及更快的掃描速度和較高的檢測靈敏度。
由電噴霧離子化或基質輔助激光解吸離子化產生的生物大分子離子,可以藉助離子引導等方式,進入離子阱分析器分析。離子阱分析器與四極杆分析器具有相近的質量上限,分辨率爲103~104。
5.3.4 飛行時間分析器( TOF)
具有相同動能、不同質量的離子,因飛行速度不同而實現分離。當飛行距離一定時,離子飛行需要的時間與質荷比的平方根成正比,質量小的離子在較短時間到達檢測器。爲了測定飛行時間,將離子以不連續的組引入質量分析器,以明確起始飛行時間。離子組可以由脈衝式離子化(如基質輔助激光解吸離子化)產生,也可通過門控系統將連續產生的離子流在給定時間引入飛行管。
現代飛行時間分析器具有質量分析範圍寬(分子量上限約15000)、離子傳輸效率高(尤其是譜圖獲取速度快)、檢測能力多重、儀器設計和操作簡便、質量分辨率高(約爲104)的特點,已成爲生物大分子分析的主流技術。
5.3.5 傅里葉變換分析器( FTMS)
離子在一定強度的磁場中作迴旋運動,運行軌道隨着共振交變電場而改變。當交變電場的頻率和離子迴旋頻率相同時,離子被穩定加速,軌道半徑越來越大,動能不斷增加。關閉交變電場,軌道上的離子在電極上產生交變的像電流。利用計算機進行傅里葉變換,將像電流信號轉換爲頻譜信號,獲得質譜。
待測化合物的離子化和質量分析可以在同一分析器內完成。傅里葉變換分析器適用於分子量高於10000的化合物,分辨率可高達106,質荷比測定精確到千分之一。
5.4 串聯質譜法
串聯質譜法(MS-MS)是時間上或空間上兩級以上質量分析的結合。空間串聯由兩個以上的質量分析器構成,如三級四極杆串聯質譜,其中第一級質量分析器(MS1)選取的前體離子,進入碰撞室活化、裂解,產生的碎片離子被第二級質量分析器(MS2)分析、獲得MS-MS譜。在時間串聯質譜中,前體離子的選取、裂解及碎片離子的分析在同一質量分析器(如四極離子阱分析器)中完成。前體離子的裂解可以通過亞穩裂解、碰撞誘導解離、表面誘導解離、激光誘導解離等方式實現。
串聯質譜法並不侷限於兩級質譜分析,多級質譜實驗常表示爲MSn。實際應用中,串聯質譜法可以通過產物離子掃描(Product-ion scan)、前體離子掃描(Precursor-ion scan)、中性丟失掃描(Neutral-loss scan)及選擇反應檢測(Selected-reaction monitoring,SRM)等方式獲取數據,但值得注意的是時間串聯質譜儀不能進行前體離子掃描和中性丟失掃描。
串聯質譜技術在未知化合物的結構解析、複雜混合物中待測化合物的鑑定、碎片裂解途徑的闡明以及低濃度生物樣品的定量分析方面具有很大優勢。在藥物領域的應用也很多,如通過產物離子掃描,可以獲得藥物、雜質或污染物的前體離子的結構信息,有助於未知化合物的鑑定;產物離子掃描還可用於肽和蛋白質碎片的氨基酸序列檢測。當質譜與氣相色譜或液相色譜聯用時,若色譜儀未能將化合物完全分離,串聯質譜法可以通過選擇性的測定某組分的特徵性前體離子,獲取該組分的結構和量的信息,而不會受到共存組分的干擾。
在藥物代謝研究中,串聯質譜技術可用於尋找具有相同結構特徵的代謝物分子。由於代謝物可能包含作爲中性碎片丟失的相同基團(如羧酸類均易丟失中性二氧化碳分子),採用中性丟失掃描可以發現所有可能的代謝物。若丟失的相同碎片是離子,則前體離子掃描方式可幫助找到所有丟失該碎片離子的前體離子。
選擇反應離子檢測(SRM)可消除生物基質對低濃度待測化合物定量分析的干擾。如藥物代謝動力學研究中,待測藥物的某離子信號可能被基質中其他化合物的離子信號掩蓋,通過MS1和MS2選擇性的檢測特徵的前體離子和產物離子,可實現待測物的專屬、靈敏分析。
5.5 信號檢測和數據獲取
來自質量分析器的離子束經檢測器轉化爲電信號、放大,再由數據處理系統儲存並顯示爲質譜圖。通過測定待測化合物離子的質荷比和相對丰度,質譜法可以實現對供試品的定性和定量分析。
中性分子丟失或捕獲一個電子,即形成了一個與母體分子質量相同的分子離子。通過高分辨質譜儀(分辨率>104)或使用參照化合物峯匹配測定,可以獲得待測化合物的分子組成和分子質量信息。分子離子斷裂不同的鍵產生各種碎片離子,裂解模式(或碎片模式)與分子結構有關。通過測定碎片離子的質量及其相對丰度,獲取裂解特徵,可以推測或確證待測化合物的分子結構。
通過測定某一特定離子或多個離子的丰度,並與已知標準物質的響應比較,質譜法可以實現高專屬性的定量分析。外標法和內標法是質譜常用的定量方法,內標法具有更高的準確度。質譜法所用的內標化合物可以是待測化合物的結構類似物或穩定同位素標記物。前者的優點是費用較低,但使用穩定同位素(如2H、13C、15N)標記物可以獲得更高的分析精密度和準確度,尤其當採用FAB或LC-MS離子化技術(如電噴霧離子化)時。穩定同位素標記物是指標記物在樣品製備、分離、離子化的過程中,始終保留同位素標記。
相對於全掃描技術,選擇性離子檢測(SIM)用於定量分析更具優勢。SIM技術使質譜儀將更多的時間用於檢測選定質荷比離子的離子流,因而提高了分析靈敏度。選擇反應檢測(SRM)是複雜混合物中微量待測化合物準確定量的重要技術手段。當同時檢測兩對及以上的前體離子一產物離子時,選擇反應檢測(SRM)又稱爲多反應監測(MRM),可以同時、專屬、靈敏地定量測定供試品中多個組分。
6 參考資料
- ^ [1] 中華人民共和國國家衛生和計劃生育委員會.WS/T 455—2014 衛生監測與評價名詞術語[Z].2014-11-15.