3 標準基本信息
ICS 11.020
C 59
中華人民共和國衛生行業標準 WS 294—2016《脊髓灰質炎診斷》(Diagnosis for poliomyelitis)由中華人民共和國國家衛生和計劃生育委員會於2016年04月26日發佈,自2016年10月20日起實施。本標準代替WS 294—2008。
4 前言
本標準3.3.1、3.3.2、第5章爲強制性條款,其餘爲推薦性條款。
本標準按照GB/T 1.1—2009給出的規則起草。
本標準代替WS 294—2008《脊髓灰質炎診斷標準》。
本標準白實施之日起,WS 294—2008同時廢止。
本標準與WS 294—2008相比,主要技術變化如下:
——增加了縮略語CPE、L20B、NPEV、RD、VP;
——增加了“或近期當地發生脊髓灰質炎野病毒輸入事件”(見3.1.1);
——增加了“既往未接種或未全程接種OPV或IPV”(見3.1.2);
——將“潛伏期爲3 d~35 d(一般爲5 d~14 d)”移入“臨牀表現”部分(見3.2.1,2008年版的3.1.2);
——修改了“早期可有發熱、咽部不適,嬰幼兒可煩躁不安”爲“早期可有發熱、咽部不適,患者可煩 躁不安”(見3.2.2,2008年版的3.2.1);
——刪除了“且未發現其他病因”(見3.2.4,2008年版的3.2.3);
——增加了“或IPV”和“未接觸疫苗病毒”(見3.3.2);
——修改了臨牀診斷病例,除臨牀表現或實驗室檢測3.3.2外,需要考慮流行病學史(見5.2,2008年版的5.2);
——將“合格糞便標本”修改爲“糞便、咽部、腦脊液或脊髓組織”[見5.4b),2008年版的5.4.2];
——修改了“與OPV有關的其他病例”(見5.5,2008年版的5.5);
——根據脊髓灰質炎流行病學特徵的變化,在附錄A中,對脊髓灰質炎的病原學、流行病學和臨牀表現中的有關描述予以訂正(見附錄A);
——根據WHO實驗室操作手冊,對脊髓灰質炎病毒的分離與定型方法進一步予以標準化(見附錄B)。
本標準起草單位:山東省疾病預防控制中心、中國疾病預防控制中心、濟南市傳染病醫院。
本標準主要起草人:徐愛強、許文波、李黎、梁曉峯、羅會明、余文周、張勇、陶澤新、陳士俊、溫寧、汪海波。
本標準所代替標準的歷次版本發佈情況爲:
——GB 16394—1996:
——WS 294—2008。
5 標準正文
脊髓灰質炎診斷
5.1 1 範圍
本標準規定了脊髓灰質炎的診斷依據、診斷原則、診斷和鑑別診斷。
本標準適用於全國各級各類醫療衛生機構及其T作人員對脊髓灰質炎的診斷。
5.2 2 縮略語
下列縮略語適用於本文件。
AFP:急性弛緩性麻痹(acute flaccid paralysis)
CPE:致細胞病變效應(cytopathic effect)
cVDPVs:循環的疫苗衍生脊髓灰質炎病毒(circulatingvaccine-derived polioviruses)
GBS:吉蘭-巴雷綜合徵(又稱格林-巴利綜合徵)(Guillain-Barre syndrome)
IgG:免疫球蛋白Gcimmunoglobulin G)
IgM:免疫球蛋白M(immunoglobulin M)
IPV:脊髓灰質炎滅活疫苗(poliovirus vacclne,inactivated)
iVDPV:免疫缺陷者疫苗衍生脊髓灰質炎病毒(immunodeficiency vaccine-derived poliovirus)
L20B:轉人脊髓灰質炎病毒受體基因的鼠肺細胞(mouse L cells expressing the human poliovirus receptor)
NPEV:非脊髓灰質炎腸道病毒(non-polio enterovirus)
OPV:口服脊髓灰質炎減毒活疫苗(oral poliovirus vaccine,live)
VAPP:疫苗相關麻痹型脊髓灰質炎(vaccine-associated paralytic poliomyelitis)
VDPV:疫苗衍生脊髓灰質炎病毒(vaccine-derived poliovirus)
VP:病毒蛋白(virus protein)
5.3 3 診斷依據
5.3.1 3.1 流行病學史(參見附錄A)
3.1.1 與確診的脊髓灰質炎患者有接觸史;近期曾經到過世界衛生組織(WHO)近期公佈的脊髓灰質炎流行地區,或近期當地發生脊髓灰質炎野病毒輸入事件。
3.1.2 既往未接種或未全程接種OPV或IPV。
5.3.2 3.2 臨牀表現(參見附錄A)
3.2.1 潛伏期爲3 d~35 d(一般爲5 d~14 d)。
3.2.2 早期可有發熱、咽部不適,患者可煩躁不安、腹瀉或便祕、多汗、噁心、肌肉痠痛等症狀。
3.2.3 熱退後(少數可在發熱過程中)出現不對稱性弛緩性麻痹。神經系統檢查發現肢體和(或)腹肌不對稱性(單側或雙側)弛緩性麻痹,軀體或肢體肌張力減弱、肌力下降、深部腱反射減弱或消失,但無感覺障礙。
3.2.4 麻痹60 d後隨訪仍殘留弛緩性麻痹(後期可出現肌萎縮)。
5.3.3 3.3 實驗室檢測
3.3.1 發病後從糞便、咽部、腦脊液、腦或脊髓組織中分離到病毒,並鑑定爲脊髓灰質炎野病毒(見附錄B)。
3.3.2 發病前6周內未接種過OPV或IPV,發病後未再接種OPV或IPV,未接觸疫苗病毒,麻痹後1個月內從腦脊液或血液中查到抗脊髓灰質炎病毒IgM抗體,或恢復期血清中和抗體或特異性IgG抗體滴度比急性期≥4倍升高(見附錄C)。
5.4 4 診斷原則
根據流行病學史、臨牀表現、實驗室檢測等進行綜合分析做出診斷。
5.5 5 診斷
5.5.1 5.1 疑似病例
15歲以下病因不明的任何AFP病例,包括臨牀初步診斷爲GBS的病例,任何年齡臨牀懷疑爲脊髓灰質炎的病例。
5.5.2 5.2 臨牀診斷病例
符合下列一項可診斷爲臨牀診斷病例:
a) 疑似病例並同時符合3.1和3.2。
b) 疑似病例並同時符合3.1和3.3.2。
5.5.3 5.3 確診病例
疑似病例並同時符合3.3.1。
5.5.4 5.4 排除病例
符合下列一項可排除脊髓灰質炎診斷:
a) 疑似病例經實驗室和臨牀檢查有確鑿證據診斷爲非脊髓灰質炎的其他疾病。
b) 疑似病例的糞便、咽部、腦脊液、腦或脊髓組織未分離到脊髓灰質炎野病毒,或麻痹後1個月內腦脊液或血液特異性IgM抗體陰性,或恢復期血清中和抗體或特異性IgG抗體滴度比急性期無4倍升高者。
5.5.5 5.5 與OPV有關的其他病例
5.5.1 服苗者VAPP病例:疑似病例近期曾有OPV免疫史,且在服用OPV後4 d~35 d內發熱,6 d~40 d 出現急性弛緩性麻痹,臨牀表現符合3.2。麻痹後未再服用OPV,從糞便、咽部、腦脊液、腦或脊髓組織標本中分離到脊髓灰質炎疫苗病毒,該病毒和原始疫苗病毒Sabin株相比,Ⅰ型和Ⅲ型脊髓灰質炎病毒VP1編碼區核苷酸序列變異≤9個,Ⅱ型脊髓灰質炎病毒VP1編碼區核苷酸序列變異≤5個。
5.5.2 服苗接觸者VAPP病例:疑似病例曾與OPV免疫者在服苗後35 d內有密切接觸史,接觸6 d~60 d後出現急性弛緩性麻痹;或發病前40 d未服過OPV,臨牀表現符合3.2。麻痹後未再服用OPV,從糞便、咽部、腦脊液、腦或脊髓組織標本中分離到脊髓灰質炎疫苗病毒,該病毒和原始疫苗病毒Sabin株相比,Ⅰ型和Ⅲ型脊髓灰質炎病毒VP1編碼區核苷酸序列變異≤9個,Ⅱ型脊髓灰質炎病毒VP1編碼區核苷酸序列變異≤5個。
5.5.3 VDPV病例:疑似病例臨牀表現符合3.2,發病後從糞便、咽部、腦脊液、腦或脊髓組織中分離到 VDPV,其中,VDPV是指Ⅰ型和Ⅲ型脊髓灰質炎病毒,與原始疫苗病毒Sabin株比較,VP1編碼區核苷酸序列變異≥10個,且<135個(變異率>1%,且<15%);Ⅱ型脊髓灰質炎病毒,與原始疫苗病毒 Sabin株比較,VP1編碼區核苷酸序列變異≥6個,且<135個(變異率>0.6%,且<15%)。
5.6 6 鑑別診斷
主要應與具備AFP臨牀表現的神經系統和肌肉疾病相鑑別。常見的包括GBS、急性脊髓炎、外傷性神經炎、週期性麻痹、其他腸道病毒感染引致的麻痹等。在鑑別診斷時,應結合流行病學史(如與脊髓灰質炎病例有接觸史、疫苗接種史等)、臨牀表現(如發病的前驅症狀、麻痹及恢復狀況和神經反射及感覺功能檢查等)及實驗室檢測(如病毒分離、抗體檢測等)等方面資料加以綜合判斷。
6 附錄
6.1 附錄A(資料性附錄)脊髓灰質炎病原學、流行病學和臨牀表現
6.1.1 A.1 病原學
脊髓灰質炎是由脊髓灰質炎病毒引起的急性腸道傳染病。脊髓灰質炎病毒(Poliovirus,PV)屬於小核糖核酸病毒科、腸道病毒屬,同屬的其他病毒如柯薩奇病毒(Coxsackievirus)和埃可病毒(Echovirus)與其在生物學、物理化學以及流行病學方面有許多相似之處。脊髓灰質炎病毒直徑爲20 nm~30 nm,內含單股正鏈的核糖核酸,無包膜。在電子顯微鏡下呈小網球形顆粒狀,其衣殼蛋白由60個結構相同的亞單位組成,每一亞單位又由病毒蛋白VP1、VP2、VP3和VP4組成,其中VP1在病毒表層暴露最充分,是引起中和反應最主要的抗原決定簇,是構成病毒的最主要抗原。按其抗原性不同,可分爲Ⅰ型、Ⅱ型、Ⅲ型共3個血清型,型間無交叉免疫。目前WHO推薦使用RD和L20B兩種傳代細胞分離脊髓灰質炎病毒。該病毒僅感染人,無其他動物宿主;病毒在-70℃的低溫下可保存活力達8年之久,在4℃冰箱中可保存數週至數月,在污水和污物中可生存6個月;但對乾燥很敏感,故不宜用冷凍乾燥法保存。該病毒不耐熱,加熱56℃30 min可使之滅活,煮沸和紫外線照射可迅速將其殺死;能耐受一般濃度的化學消毒劑,如70%酒精及5%煤酚皁液;耐酸、耐乙醚和氯仿等脂溶劑,但對高錳酸鉀、過氧化氫、漂白粉等敏感,可將其迅速滅活。
預防脊髓灰質炎所用的疫苗包括OPV和IPV,是根據脊髓灰質炎病毒3個血清型病毒分別製備後按不同比例配製而成。通常的脊髓灰質炎病例是指野病毒引致的病例,以工型最多(佔80%~90%),其次爲Ⅲ型,1999年以後全球無Ⅱ型引發的病例或流行。此外,源白OPV的疫苗病毒可能使服苗者及其接觸者發生VAPP病例;在一定條件下,源白OPV的VDPV是由於疫苗病毒在免疫覆蓋率不高的情況下,在易感者體內複製而導致神經毒力增強(回升)。VDPV可導致一些未免疫者或未全程免疫者發病,甚至發生循環(cVDPVs)。
6.1.2 A.2 流行病學
脊髓灰質炎的傳染源爲病人、隱性感染者和病毒攜帶者。由於病毒攜帶者、無症狀的隱性感染和無麻痹型患者不易被發現,因此在傳播該病上起重要作用。本病的潛伏期爲3 d~35 d,一般爲5 d~14 d。患者白髮病前2 d~3 d至發病後3周~6周都有傳染性,退熱後傳染性減小。病毒主要存在於患者的脊髓和腦部,在鼻咽部、腸道粘膜與淋巴結內亦可查到。感染者一般通過糞便排出病毒,數量多且持續時間長,可達3周~6周,少數長達3個月~4個月;糞口途徑是本病的主要傳播途徑,在發病的早期咽部排毒可經飛沫傳播。人對脊髓灰質炎病毒普遍易感,感染後出現不同的臨牀表現,其中主要是隱性感染者及不易診斷的輕型患者,麻痹型患者甚少。人感染後能產生對同型病毒的持久免疫力。
在實施疫苗免疫之前,脊髓灰質炎呈自然流行狀態,發病率高,在一些國家和地區成爲地方性流行的傳染病。一年四季均可發生,夏、秋季爲流行高峯。我國7月~9月發病最多,一般以5歲以下兒童爲主。在普及兒童OPV免疫之後,發病率顯著下降。1988年,世界衛生大會通過全球消滅脊髓灰質炎目標的決議;2000年我國已經實現了無脊髓灰質炎的目標,進入到消滅該病的後期階段。但是,在全球消滅脊髓灰質炎之前,我國仍然存在發生輸入性野病毒引致的脊髓灰質炎病例的風險,且輸入性疫情一旦擴散,還可能引致大年齡組兒童甚至成人發病;此外,使用OPV可能引致VAPP病例和VDPV病例,但VAPP病例和VDPV病例不屬於脊髓灰質炎野病毒病例。
VAPP病例多見於首劑服苗者,其發生率極低,且往往見於免疫功能低下兒童。
VDPV病例發生率極低,主要發生在使用OPV且免疫接種率水平不高地區的未免疫或未全程免疫的兒童。目前WHO對VDPV通行的鑑定標準爲經核苷酸序列分析,與原始疫苗病毒Sabin株相比,Ⅰ型和Ⅲ型VDPV VP1編碼區核苷酸序列變異≥10個,且<135個(變異率>1%,且<15%),Ⅱ型 VDPV VP1編碼區核苷酸序列變異≥6個,且<135個(變異率>0.6%,且<15%)。現已證實有3種 VDPV:由免疫缺陷病患者長期排出體外的iVDPV、不明來源的VDPV和引起循環的cVDPVs。其中, cVDPVs是指由相關的疫苗衍生脊髓灰質炎病毒引起2例或2例以上VDPV病例的事件,稱爲疫苗衍生脊髓灰質炎病毒循環。此外,當脊髓灰質炎疫苗病毒變異尚未達到VDPV標準時,如Ⅰ型和Ⅲ型 VP1編碼區核苷酸序列變異6個~9個,視爲脊髓灰質炎疫苗病毒高變異株。
發生脊髓灰質炎野病毒輸入性疫情和cVDPVs屬突發公共衛生事件,應按照國務院《突發公共衛生事件應急條例》、國家衛生和計劃生育委員會的有關規定進行應急處置。發現脊髓灰質炎疫苗病毒高變異株時,也應按照國家衛生和計劃生育委員會的相關要求進行處理。
6.1.3 A.3 臨牀表現
6.1.3.1 A.3.1 隱性感染(無症狀型)
佔全部感染者的90%~95%。感染後無症狀出現,不產生病毒血癥,不侵人中樞神經系統,但從咽部和大便中可分離出病毒,體內可查到特異性中和抗體,相隔2周~4周至4倍以上增長。
6.1.3.2 A.3.2 頓挫型(輕型)
約佔4%~8%。病毒未侵襲中樞神經組織。臨牀症狀缺乏特異性,可出現:
a) 上呼吸道炎症狀,如不同程度的發熱,咽部不適、充血及咽後壁淋巴組織增生,扁桃體腫大等;
c) 流感樣症狀,頭痛、乏力、關節、肌肉痠痛等。症狀持續1 d~3 d,白行恢復。
6.1.3.3 A.3.3 無麻痹型
病毒侵入中樞神經系統,除具有頓挫型症狀外,還出現神經系統症狀但不發生麻痹,體溫較高,頭痛加劇,多汗,嘔吐,煩躁不安或嗜睡,全身肌肉疼痛,腓腸肌觸痛,皮膚感覺過敏,不願撫抱,動之即哭,神情緊張,頸背肌痛、頸強直,不能屈曲,克氏徵( Kernig's sign)和布氏徵(Brudzinski's sign)陽性。肌腱反射開始大多正常或活躍,後期可減弱。腹壁反射減弱或消失。腦脊液檢查顯示壓力、蛋白、細胞數輕度升高,糖、氯化物正常。患者通常在3 d~5 d內退熱,腦膜刺激徵及病理反射可持續1周~2周。
6.1.3.4 A.3.4 麻痹型
A.3.4.1 分期
麻痹型約佔感染者的1%~2%,其特徵爲在無麻痹型臨牀表現基礎上,出現累及脊髓前角灰質、腦及腦神經的病變,導致肌肉麻痹。通常的脊髓灰質炎病例是指麻痹型病例。本型分爲以下5期:
a)前驅期。本期症狀與頓挫型相似,兒童以發熱伴上呼吸道感染及胃腸炎症狀爲主,約1/3有雙峯熱;成人以發熱伴全身肌肉痠痛及皮膚感覺過敏爲主。經1 d~4 d發熱,再經1 d~6 d無熱期後進入麻痹前期。
b)麻痹前期。本期特徵與無麻痹型相似,體溫再度上升或持續下降,並出現神經系統的症狀、體徵,肌肉疼痛以活動和體位變化時最明顯,故於起坐時用雙上肢向後支撐身體而呈特殊的“三角架徵”,腦膜刺激徵及霍伊內(Hoyne)徵陽性,亦可短暫意識障礙,多汗、尿瀦留等表現,此期腦脊液多有改變。
c) 麻痹期。一般在第2次發熱1 d~2 d後體溫開始下降或在高熱和肌痛處於高峯時發生麻痹,短期內(一般3 d~4 d)麻痹達到最嚴重程度,但在熱退後麻痹不再進展,根據病變部位可分爲4型:
1) 脊髓型。此型最爲多見,麻痹多爲下運動神經元性,多表現爲急性弛緩性麻痹,其特點爲:
——發生於單肢或數肢,以下肢多見;
——近端大肌羣較遠端小肌羣麻痹出現早而重;
——不伴有感覺障礙;
——發生上行性麻痹者,即由下肢向上蔓延至腹、背、頸部而達延髓者,則預後嚴重;
2) 腦幹型。本型在麻痹型中佔6%~25%,常與脊髓型同時發生。由於病變在腦幹的不同部位,可產生顱神經麻痹、呼吸中樞麻痹、血管運動中樞麻痹等不同症狀。
3) 腦炎型。個別病例可僅表現爲腦炎,也可與腦幹型或脊髓型同時存在。瀰漫性腦炎表現爲意識不清、高熱、譫妄、震顫、驚厥、昏迷、強直性麻痹等。侷限性腦炎表現爲大腦定位症狀,恢復後可長期出現閱讀不能症、陣攣或癲癇大發作等。
4)混合型。兼有脊髓型麻痹和腦幹型麻痹的臨牀表現,可出現肢體麻痹、腦神經麻痹、呼吸中樞損害、血管運動中樞損害等。
d) 恢復期。常見於癱瘓後1周~2周麻痹肢體逐漸恢復,肌力逐步增強,一般白肢體遠端開始,腱反射也漸趨正常。輕者經1個月~3個月即可恢復,重症常需12個月~18個月甚或更久的時間才能恢復。
e) 後遺症期。本期指起病滿2年以後,有些受損肌羣由於神經損傷過甚而致功能不能恢復。出現持久性癱瘓和肌肉萎縮,並可因肌肉攣縮導致肢體或軀幹畸形,骨骼發育也受到阻礙。
b) 1級(次全麻痹),刺激肌肉時,肌腱或肌體略見收縮或觸之有收縮感,但不引起動作;
c) 2級(重度麻痹),肢體不能向上抬舉,只能在平面上移動;
d) 3級(中度麻痹),可自動向上抬舉,但不能承受任何壓力;
e) 4級(輕度麻痹),可自動向上抬舉,亦能承受一定壓力,但不能對抗阻力;
f) 5級,肌力正常。
6.2 附錄B(規範性附錄)脊髓灰質炎病毒的分離與定型
6.2.1 B.1 標本的採集、運送
在病人出現麻痹後14 d內採集2份糞便標本,2次採集的間隔至少爲24 h,每份標本量5 g~8 g。 採集的糞便標本應放在無菌的容器內,4℃以下冷藏保存並帶冰運送,採集後應按規定貼好標籤,7d內送到指定的實驗室進行病毒分離。
6.2.2 B.2 病毒的分離
B.2.1 在50 mL耐氯仿的塑料(帶蓋)離心管上標記標本號。
B.2.2 在每支離心管中加入10 mL的pH 7.2~7.4的PBS(+)緩衝液、1g直徑約爲3 mm的玻璃珠和1 mL的氯仿。
B.2.3 在生物安全櫃中將2g左右的糞便標本加入到標記好的離心管中(確保離心管上的標號與原始標本的標號一致)。擰緊蓋後劇烈機械振盪20 min,製成20%的糞便懸液。
B.2.4 3000r/min條件下,在冷凍離心機中離心20 min,在生物安全櫃中吸出不含氯仿的上清液,分別裝入2個有外螺旋蓋的凍存管中,1管存於4℃~8℃以備接種細胞,另1管在-20℃條件下保存備用。
B.2.5 將每份糞便標本懸液同時接種到生長良好並至少75%以上融合成單層的RD細胞和L20B細胞上,每管接種0.2 mL糞便標本懸液,每種細胞至少接種2管,正確標記每支試管(包括標本的編號、日期、傳代數等);對每一種細胞標記1管作爲陰性對照。
B.2.6 試管放36℃的孵箱中傾斜5°靜置培養。
B.2.7 每天使用倒置顯微鏡觀察細胞狀態,記錄接種標本的細胞和陰性對照細胞出現的所有變化,包括記錄以1+~4+表示受感染細胞比例的CPE(1+代表<25%的細胞出現CPE;2+代表25%~50%的細胞出現CPE; 3+代表50%~75%的細胞出現CPE; 4+代表75%~1000/的細胞出現CPE)、毒性反應、老化或者污染。
B.2.8 如果觀察至少5d後仍未出現CPE,在同一細胞系上進行盲傳,隨後再觀察5d(每一份原始糞便標本接種兩管相同細胞後,即使兩管結果都爲陰性,也不能合併後進行再傳代)。在判定每一份細胞培養物爲陰性並丟棄之前,觀察細胞形態時間不少於10 d。
B.2.9 在標本接種後任何階段出現特徵性的腸道病毒CPE,如細胞變網,折光增強,從細胞培養管壁脫離,應記錄觀察到的結果,並觀察CPE發展到至少75%的細胞受到感染(≥3+CPE)。在這個階段,使用另一細胞系傳第二代。同一份標本接種到兩管相同細胞系的細胞培養管,同一天內都出現≥3+ CPE時,此時可以合併,再傳至另一種細胞系的細胞培養管中,細胞培養管內含新更換的1 mL維持液。
B.2.10 L20B細胞上出現CPE的陽性細胞培養物,轉種到RD細胞上,然後在36℃孵育,並每天觀察 CPE(圖B.1)。大部分的RD細胞將會出現特徵性的腸道病毒CPE,觀察直至出現≥3+CPE。隨後在-20℃冷凍細胞培養管,直至將其送型內鑑定實驗室進行血清型別鑑定和型內鑑定。少部分病毒在 L20B細胞上出現CPE,但將其傳至RD細胞上CPE不會重現。RD細胞培養物應在接種後連續觀察5d後報告陰性結果。
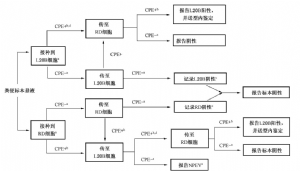
a 觀察至少5d;
b 觀察至出現≥3+CPE(通常1 d~2 d,最多5d;如果出現毒性反應或污染,需重新接種);
c 未出現病變時,至少傳兩代,每代5 d;
d 合併陽性分離物(兩管在同一天出現3+CPE),然後傳至RD細胞上;
e 根據診斷和工作的需要,可對分離到的NPEV進行血清型鑑定。
B.2.11 RD細胞上出現CPE的陽性細胞分離物,轉種到L20B細胞上,然後在36℃孵育,並每天觀察 CPE(圖B.1)。如果觀察至少5d後,L20B細胞仍然沒有出現CPE,那麼這份細胞培養物可以被認爲不含有脊髓灰質炎病毒,並以NPEV報告。某些情況下,特徵性的腸道病毒CPE會在L20B細胞上出現,觀察直至出現≥3+ CPE。然後將該細胞培養物再次傳代至RD細胞上,繼續觀察至CPE的出現,此過程的目的是將脊髓灰質炎病毒從混合有其他腸道病毒的混合物中分離出來,並且擴增脊髓灰質炎病毒的滴度。任何出現≥3+CPE的陽性RD細胞培養物需保存在-20℃直至將其送至型內鑑定實驗室。少部分的RD細胞培養物,觀察5 d後仍然爲陰性結果,這時應報告爲陰性結果。
B.2.12 除腸道病毒外,某些病毒(如呼腸孤病毒、腺病毒或某些非腸道病毒也可在鼠肺細胞上生長,但這樣的病毒產生的CPE與腸道病毒產生的特徵性CPE明顯不同。如果定型結果不能確定或無法解釋,應將此標本送上級脊髓灰質炎實驗室進行進一步分析。
6.2.3 B.3 脊髓灰質炎病毒血清型別鑑定和型內鑑定
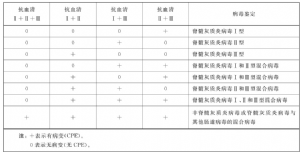
B.3.1 型內鑑定實驗室將接到兩種不同種類的病毒分離物進行鑑定,即:在任何階段中L20B細胞上出現CPE的標本,和病毒分離物傳至RD細胞上,CPE重現的病毒分離物(種類分別是L20B+RD+病毒分離物和RD+L20B+RD+病毒分離物)。
B.3.2 按照WHO脊髓灰質炎實驗室手冊第四版補充材料描述的熒光定量PCR方法對所有L20B+ RD+病毒分離物進行型別和型內鑑定。在PCR實驗之前,不用進行傳代和血清型鑑定。
B.3.3 使用熒光定量PCR方法對RD+L20B+RD+病毒分離物進行鑑定時,需要限定使用條件:某份標本只獲得了該種陽性分離物,或者同一份標本的相應的L20B+RD+病毒分離物的PCR結果是陰性或NPEV。
B.3.4 按WHO的規定,只有被指定的國家實驗室或WHO地區參比實驗室的型內鑑定結果才被認可,故具體操作步驟從略。
6.2.4 B.4 脊髓灰質炎病毒中和試驗鑑定血清型別
B.4.1 準備4份組合脊髓灰質炎病毒標準抗血清,各組的組合如下:
a) 組合抗Ⅰ+Ⅱ+Ⅲ型3個型的血清,每型血清在0.05 mL內含20個單位的中和抗體;
b)組合抗Ⅰ+Ⅱ型血清,每型血清在0.05 mL內含20個單位的中和抗體;
c) 組合抗Ⅰ+Ⅲ型血清,每型血清在0.05 mL內含20個單位的中和抗體;
d) 組合抗Ⅱ+Ⅲ型血清,每型血清在0.05 mL內含20個單位的中和抗體。 B.4.2 將4組抗血清儲存液分別加入到如圖B.2所示的1列~8列,A行~D行中去,每孔50μL,加不同的組合血清時需要更換吸尖。
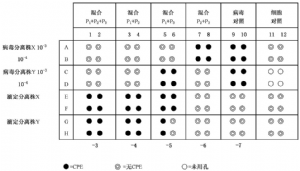
B.4.3 加50μL維持液到病毒對照孔中,A9~D10;加50μL維持液到回滴孔中,E1~H10;加100μL維持液到細胞對照孔中,G11~H12,然後蓋上蓋子。
B.4.4 按10-1~10-7標記7支稀釋管,取0.9 mL維持液到1號~2號管和5號~7號管中,取1.8 mL維持液到3號和4號管中,用無菌移液器和帶濾芯的移液管加0.1 mL病毒懸液到第一個管(10-1稀釋度)中,換一個吸尖,輕輕地並徹底地混勻,避免產生氣溶膠。
B.4.5 取0.1 mL到第2個管子中,丟棄使用過的吸尖,重複稀釋的步驟直到第7管,注意取0.2 mL到第3管和第4管中。
B.4.6 在第9和第10列,E和F行中加入1號病毒標本10-7稀釋度的病毒到4個回滴孔中,在第7和第8列,E和F行中加入1號病毒標本10-6稀釋度的病毒到4個回滴孔中,依此類推。
B.4.7 取一個病毒可以使用同一支帶濾芯的吸尖,順序爲從高稀釋度向低稀釋度加,即10-7~10-3,加入50 μL的病毒到待測孔中:標本1的10-3稀釋度加入到A1~A10,10-4稀釋度加入到B1~B10等等;重複上兩個步驟,加入2號病毒標本,G和H行作病毒滴度回滴,2號病毒10-3稀釋度加入到C1孔~ C10孔,10-4稀釋度加入到D1孔~D10孔。
B.4.8 蓋上蓋子,在36℃孵育1 h~3 h,在孵育期間,用胰酶消化細胞,並製備細胞懸液,濃度大約爲1.5×10-5個/mL細胞,每塊板子至少需要10 mL。加入100μL細胞懸液到每個待測和對照孔中,如果不使用CO2孵箱,要使用無毒性的封口膜封閉板子。
B.4.9 在36℃孵育。
B.4.10 使用倒置顯微鏡每天觀察並記錄有無CPE的產生,在病毒對照孔出現100% CPE時(通常在3 d~5 d),繼續觀察並記錄24 h。
6.3 附錄C(規範性附錄)脊髓灰質炎病毒特異性IgM抗體測定
6.3.1 C.1 原理
脊髓灰質炎病毒感染機體,IgM抗體的免疫應答反應最早在感染後10 d~15 d即可被捕捉ELISA法檢測到。一般持續1個月後消失。在疑似脊髓灰質炎病人血液中,尤其是腦脊液中查到IgM抗體是一種早期快速特異的診斷方法。但目前所測的IgM抗體不能區別疫苗株和野毒株,故IgM陽性的意義,只有在明確近期無服苗和未接觸過疫苗病毒的情況下才能應用。但從腦脊液中查到特異性IgM抗體,如血腦屏障正常,則即可結合病史診斷爲疫苗相關病例或爲野病毒病例。在AFP患者因故未收集到合格的大便標本如在麻痹1個月內血液IgM抗體陰性可排除診斷。
6.3.2 C.2 操作步驟
C.2.1 加0.1 mL抗人IgM μ鏈抗體於塑料微孔板,37℃過夜。
C.2.2 倒掉液體,不洗,用10%牛血清的0.05%吐溫(Tween-20)生理鹽水0.2 mL封閉每孔,放於37℃。
C.2.3 1h後倒去上述牛血清封閉液加1:100稀釋的待測病人血清(或1:2稀釋的待測病人腦脊液),37℃作用1.5 h~2 h。
C.2.4 倒出待測血清(或腦脊液),用0.05%吐溫生理鹽水液洗3次,然後分別於上述孔內分別加已知Ⅰ型、Ⅱ型和Ⅲ型的脊髓灰質炎抗原,每型加2孔,每孔0.1 mL,置4℃過夜。
C.2.5 吸出抗原,洗3次後,各相應孔加已知對應的抗血清(即加Ⅰ型病毒抗原孔加Ⅰ型抗血清,Ⅱ型抗原孔加Ⅱ型血清……)0.1 mL。
C.2.6 37℃1 h~1.5 h後倒去抗體,洗3次後各加酶標抗抗體0.1 mL。
C.2.7 37℃結合1 h~1.5 h後倒出酶標抗體,用洗液洗3次,加鄰苯二胺底物,每孔0.1 mL。
C.2.8 避光作用5 min~15 min。
C.2.9 待加正常細胞爲對照抗原的孔,即將顯色之時各孔立即加0.05 mL 2 mol/L硫酸終止反應。
6.3.3 C.3 測定
在490 mm光源下測定OD值。
6.3.4 C.4 結果判定
6.3.5 C.5 說明
具體說明如下:
7 參考文獻
[1] David L.Heymann.Control of Communicable Diseases Manual(18th Edition).2004
[2] Olen M.Kew,Peter F.Wright,Vadim I.Agol,et al.Circulating Vaccine-derived Polioviruses:
Current State of Knowledge.Bulletin of the WH02004;82(1):16-23
[3] WHO.WHO-recommendated Standards for Surveillance of Selected Vaccine-preventable Diseases.2003
[4] WHO.Polio Laboratory Manual.4th Edition,2004.Document World Health Oraganization/IVB/04.10.Geneva,Switzerland
[5] WHO.Supplement to the WHO Polio Laboratory Manual,An Alternative Test Algorithm for Poliovirus Isolation and Characterization http://apps.who.int/immunization_monitoring/Supplement_polio_lab_manual.pdf
[6] WHO.16th Informal Consultation of the Global Polio Laboratory Network.22-23 September 2010.Geneva, Switzerland.WHO/HQ
[7] WHO.Polio Vaccines and Polio Immunization in the Pre-eradication Era: WHO PositionPaper. Wkly Epidemiol Rec 2010; 85 (23):213-228
[8] WHO.Polio Vaccines:WHO Position Paper,January 2014.Wkly Epidemiol Rec2014; 89(9):73-92