2 註解
任何自發的氧化還原反應(ΔrGm<0)均爲電子從還原劑轉移到氧化劑的過程。例如將Zn片插入H2SO4溶液中,Zn與H2SO4便發生下列反應:
Zn(s)+2H(aq)=Zn2(aq)+H2(g)
由於Zn和H2SO4直接接觸,電子從Zn原子直接轉移給H離子,因而得不到有序的電子流。隨着氧化還原反應的進行,溶液溫度將有所升高,即反應中放出的化學能轉變爲熱能。
在盛有ZnSO4溶液的燒杯中放入Zn片,在另一燒杯中將鍍有鉑黑的鉑片放入稀硫酸溶液中,並於25℃下不斷通入純氫氣以使鉑黑吸附達到飽和。用鹽橋把兩個燒杯聯通起來,當接通外電路時,發現有電流通過。這種藉助氧化還原反應將化學能直接轉變成電能的裝置稱爲原電池。
Zn(s)=Zn2(aq)+2e-負極(也叫陽極)
其電子流向外電路的電極稱爲負極,所以這裏Zn電極爲負極(又因爲發生氧化反應的叫陽極,所以Zn電極也叫陽極)。
2H(aq)+2e-=H2(g) 正極(也叫陰極)
接受從外電路流入的電子的電極稱爲正極,所以這裏氫電極爲正極(又因爲發生還原反應的叫陰極,所以氫電極也叫陰極)。
Zn(s)+2H(aq)=Zn2(aq)+H2(g)
由上例可見,任何一個自發進行的氧化還原反應原則上都可以組成原電池。氧化劑與其對應的被還原的產物(如H和H2)組成電池的正極,還原劑與其被氧化的產物(如Zn與Zn2)組成電池的負極:
原電池的裝置也可用電池符號來表示,例如上述原電池的電池符號爲
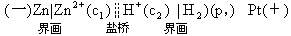
習慣上把電池的負極寫在左邊,正極寫在右邊,以“|”表示相界面,以“
 ”表示鹽橋。
”表示鹽橋。
半電池中必須包含兩類物質,一類是還原態物質,另一類是相應的氧化態物質。氧化態物質與還原態物質組成氧化還原電對,簡稱電對,以“氧化態/還原態”來表示。例如鋅電極的電對爲Zn2/Zn,這類電極稱金屬電極。
非金屬元素及其離子組成非金屬電極。例如,電對:H/H2,電極符號爲H|H2,Pt,這裏Pt不參加電極反應,只起吸附氣體和傳遞電子的作用,所以叫惰性電極。有時也可用石墨等作惰性電極。

在金屬表面覆蓋一層該金屬的難溶鹽,然後浸入含有該難溶鹽的負離子的溶液中,可構成難溶鹽電極。如:電對:AgCl/Ag,電極符號爲Ag|AgCl,Cl-;甘汞電極的電對:Hg2Cl2/Hg,電極符號爲Pt,Hg(1)|Hg2Cl2,Cl-。