2 註解
表示化學反應和熱效應關係的化學方程式,叫做熱化學方程式。 1摩碳和1摩氧氣在25℃、1.01×105Pa下生成1摩二氧化碳,放出393kJ的熱。它的熱化學方程式是
C(固) O2 (氣)=CO2 (氣) 393kJ
放出熱量用 表示,吸收熱量用-表示。化學反應的熱效應跟反應進行的條件(溫度、壓力)有關。因此,必須註明反應時的溫度和壓力。如果溫度是25℃,壓力是101kPa,習慣上不用註明。化學反應的熱效應跟反應物、生成物的物態有關。因此,書寫熱化學方程式時必須在各物質化學式的右側註明物態(固、液或氣)。根據法定計量單位,物態應改寫爲s、l、g(分別表示固、液、氣)。例如,
C(s) O2 (g)=CO2 (g) 393kJ
在熱化學方程式中,化學式前邊的係數都指物質的量,可以是整數或簡單分數。例如,
2H2 (g) O2 (g)=2H2 O(g) 483.6kJ

熱化學方程式還常用△H(焓變)表示,它的符號跟熱力學習慣一致。看書或查表時應注意區分所採用的不同符號,以免弄錯。例如,
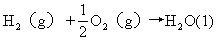 △H=-285.8kJ/mol
△H=-285.8kJ/mol
注:①熱化學方程式通常用→表示。②符號△H右上角的表示標準狀態,讀作“零扒”。③△H爲負值時表示放熱,正值時表示吸熱。這跟現行中學教材的 、-號意義相反。