2 附錄Ⅸ A 溶液顏色檢查法
藥物溶液的顏色及其與規定顏色的差異能在一定程度上反映藥物的純度。本法系將藥物溶液的顏色與規定的標準比色液相比較,或在規定的波長處測定其吸光度,以檢查其顏色。
品種項下規定的“無色或幾乎無色”,其“無色”係指供試品溶液的顏色與所用溶劑相同,“幾乎無色”係指淺於用水稀釋1倍後的相應色調1號標準比色液。
2.1 第一法
除另有規定外,取各品種項下規定量的供試品,加水溶解,置於25ml的納氏比色管中,加水稀釋至10ml。另取規定色調和色號的標準比色液10ml,置於另一25ml的納氏比色管中,兩管同置白色背景上,自上向下透視,或同置白色背景前,平視觀察;供試品管呈現的顏色與對照管比較,不得更深。如供試品管呈現的顏色與對照管的顏色深淺非常接近或色調不盡一致,使目視觀察無法辨別二者的深淺時,應改用第三法(色差計法)測定,並將其測定結果作爲判定依據。
2.1.1 比色用重鉻酸鉀液
精密稱取在120℃乾燥至恆重的基準重鉻酸鉀0.4000g,置500ml量瓶中,加適量水溶解並稀釋至刻度,搖勻,即得。每1ml溶液中含0.800mg的K2Cr2O7。
2.1.2 比色用硫酸銅液
取硫酸銅約32.5g,加適量的鹽酸溶液(1→40)使溶解成500ml,精密量取10ml,置碘量瓶中,加水50ml、醋酸4ml與碘化鉀2g,用硫代硫酸鈉滴定液(0.1mol/L)滴定,至近終點時,加澱粉指示液2ml,繼續滴定至藍色消失。每1ml硫代硫酸鈉滴定液(0.1mol/L)相當於24.97mg的CuSO4·5H2O。根據上述測定結果,在剩餘的原溶液中加適量的鹽酸溶液(1→40),使每1ml溶液中含62.4mg的CuSO4·5H2O,即得。
2.1.3 比色用氯化鈷液
取氯化鈷約32.5g,加適量的鹽酸溶液(1→40)使溶解成500ml,精密量取2ml,置錐形瓶中,加水200ml,搖勻,加氨試液至溶液由淺紅色轉變至綠色後,加醋酸-醋酸鈉緩衝液( pH6.0)10ml,加熱至60℃,再加二甲酚橙指示液5滴,用乙二胺四醋酸二鈉滴定液(0.05mol/L)滴定至溶液顯黃色。每1ml乙二胺四醋酸二鈉滴定液(0.05mol/L)相當於11.90mg的CoCl2·6H2O。根據上述測定結果,在剩餘的原溶液中加適量的鹽酸溶液(1→40),使每1ml溶液中含59.5mg的CoCl2·6H2O,即得。
2.1.4 各種色調標準貯備液的製備
按表1精密量取比色用氯化鈷液、比色用重鉻酸鉀液、比色用硫酸銅液與水,搖勻,即得。
表1 各種色調標準貯備液的配製
色調 | 比色用氯 化鈷液/ml | 比色用重鉻 酸鉀液/ml | 比色用硫酸 銅液/ml | 水/ml |
黃綠色 黃色 橙黃色 橙紅色 棕紅色 | 1.2 4.0 10.6 12.0 22.5 | 22.8 23.3 19.0 20.0 12.5 | 7.2 0 4.0 0 20.0 | 68.8 72.7 66.4 68.0 45.0 |
各種色調色號標準比色液的製備 按表2精密量取各色調標準貯備液與水,搖勻,即得。
表2 各種色調色號標準比色液的配製
色號 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
貯備液/ml 加水量/ml | 0.5 9.5 | 1.0 9.0 | 1.5 8.5 | 2.0 8.0 | 2.5 7.5 | 3.0 7.0 | 4.5 5.5 | 6.0 4.0 | 7.5 2.5 | 10.0 0 |
2.2 第二法
除另有規定外,取各品種項下規定量的供試品,加水溶解使成10ml,必要時濾過,濾液照分光光度法於規定波長處測定,吸光度不得超過規定值。
2.3 第三法(色差計法)
本法是通過色差計直接測定溶液的透射三刺激值,對其顏色進行定量表述和分析的方法。當目視比色法較難判定供試品與標準比色液之間的差異時,應考慮採用本法進行測定與判斷。
供試品與標準比色液之間的顏色差異,可以通過分別比較它們與水之間的色差值來得到,也可以通過直接比較它們之間的色差值來得到。
現代顏色視覺理論認爲,在人眼視網膜上有三種感色的錐體細胞,分別對紅、綠、藍三種顏色敏感。顏色視覺過程可分爲兩個階段:第一階段,視網膜上三種獨立的錐體感色物質,有選擇地吸收光譜不同波長的輻射,同時每一物質又可單獨產生白和黑的反應,即在強光作用下產生白的反應,無外界刺激時產生黑的反應;第二階段,在神經興奮由錐體感受器向視覺中樞的傳導過程中,這三種反應又重新組合,最後形成三對對立性的神經反應,即紅或綠、黃或藍、白或黑的反應。最終在大腦皮層的視覺中樞產生各種顏色感覺。
自然界中的每種顏色都可以用選定的、能刺激人眼中三種受體細胞的紅、綠、藍三原色,按適當比例混合而成。由此引入一個新的概念——三刺激值,即在給定的三色系統中與待測色達到色匹配所需要的三個原刺激量,分別以X、Y、Z表示。通過對衆多具有正常色覺的人體(稱爲標準觀察者,即標準眼)進行廣泛的顏色比較試驗,測定了每一種可見波長(400~760nm)的光引起每種錐體刺激的相對數量的色匹配函數,這些色匹配函數分別用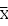 (λ)、
(λ)、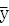 (λ)、
(λ)、 (λ)來表示。把這些色匹配函數組合起來,描繪成曲線,就叫做CIE色度標準觀察者的光譜三刺激值曲線(圖1)。
(λ)來表示。把這些色匹配函數組合起來,描繪成曲線,就叫做CIE色度標準觀察者的光譜三刺激值曲線(圖1)。

圖1 CIE 1931色度標準觀察者的光譜三刺激值曲線(10°視場)
色匹配函數和三刺激值間的關係以下列方程表示:
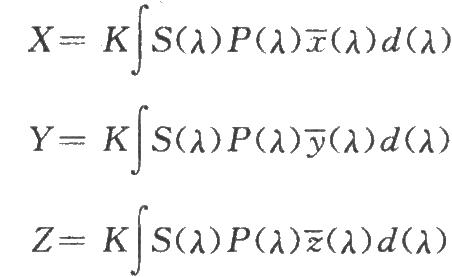
式中K爲歸化係數;
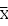 (λ)、
(λ)、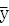 (λ)、
(λ)、 (λ)爲標準觀察者的色匹配函數;d(λ)爲波長間隔,一般採用10nm或5nm。
(λ)爲標準觀察者的色匹配函數;d(λ)爲波長間隔,一般採用10nm或5nm。
當某種顏色的三刺激值確定之後,則可用其計算出該顏色在一個理想的三維顏色空間中的座標,由此推導出許多組的顏色方程(稱爲表色系統)來定義這一空間。如:CIE1931-XYZ表色系統,CIE1964補充標準色度系統,CIE1976L*a*b*色空間(CIELab均勻色空間),Hunter表色系統等。
爲便於理解和比對,人們通常採用CIELab均勻色空間來表示顏色及色差。該色空間由直角座標L*a*b*構成。在三維色座標系的任一點都代表一種顏色,其與參比點之間的幾何距離代表兩種顏色之間的色差(圖2和圖3)。相等的距離代表相同的色差值。用儀器法對供試品溶液與其規定的標準比色液的顏色進行比較時,需比較的參數就是空白對照液的顏色和供試溶液或其規定的標準比色液顏色在均勻色空間中的差值。

圖2 L*a*b*色品圖

圖3 L*a*b*色空間和色差△E*
在CIELab均勻色空間中,三維色座標L*、a*、b*與三刺激值X、Y、Z和色差之間的關係如下:
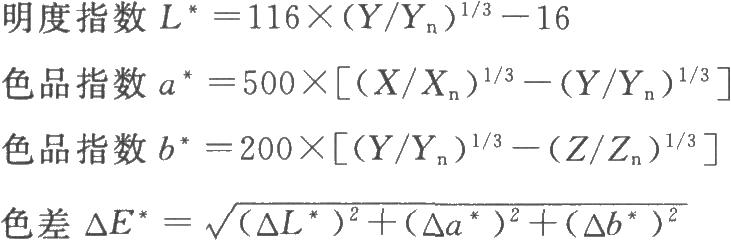
以上公式僅適用於X/Xn、Y/Yn、Z/Zn>0.008856時。式中 X、Y、Z爲待測溶液的三刺激值;
Xn、Yn、Zn爲完全漫反射體的三刺激值;△E*爲供試品溶液與標準比色液的色差;△L*爲供試品溶液與標準比色液的明度指數之差,其
中△L*爲正,表示供試品溶液比標準比色液顏色亮(鮮豔);
△a*、△b*爲供試品溶液色與標準比色液色的色品指數之差,其中△a*、△b*爲正,表示供試品比標準比色液顏色更深(飽和)。
色差計的工作原理簡單地說即是模擬人眼的視覺系統,利用儀器內部的模擬積分光學系統,把光譜光度數據的三刺激值進行積分而得到顏色的數學表達式,從而計算出L*、a*、b*值及對比色的色差。圖4爲色差計光學系統示意圖。在儀器使用的標準光源與日常觀察供試品所使用光源光譜功率分佈一致(比如晝光),其光電響應接收條件與標準觀察者的色覺特性一致(比如10°視場)的條件下,用儀器方法測定顏色,不但能夠精確、定量地測定顏色和色差,而且比目測法更爲科學客觀,且不隨時間、地點、人員變化而發生變化。
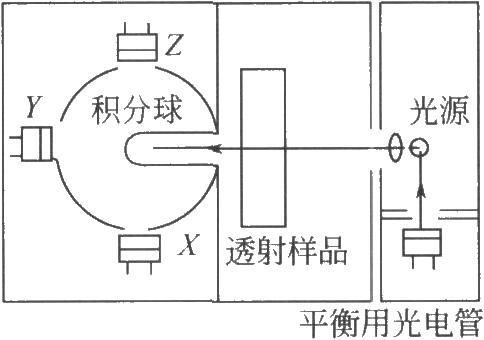
2.3.1 1.對儀器的一般要求
使用的測色儀器一般爲光電積分型色差計,照明觀察條件爲o/d條件或d/o條件,D65光源照明,10°視場,可直接測出三刺激值X、Y、Z,並能直接計算給出L*、a*、b*和△E*及供試品溶液的色調色號。
因溶液的顏色隨着被測定溶液的液層厚度而變,所以除另有規定外,測量透射色時,應使用1cm厚度液槽。
爲保證測量的可靠性,應定期對儀器進行全面的檢定。在每次測量時,要用無彩色物質如水或空氣對儀器進行校準,並規定它在所有波長下的透射率均爲1.000。
室溫時,在D65爲光源、10°視場條件下,水或空氣的三刺激值分別爲:
X=94.81;Y=100.00;Z=107.32
2.3.2 2.測定法
除另有規定外,用水對儀器進行校準,取按各品種項下規定的方法分別製得的供試品溶液和標準比色液,置儀器上進行測定,供試品溶液與水的色差值△E*應不超過相應色調的標準比色液與水的色差值△E*。
如品種項下規定的色調有兩種,且供試品溶液的實際色調介於兩種規定色調之間,且難以判斷更傾向何種色調時,將測得的供試品溶液與水的色差值(△E*)與兩種色調標準比色液與水的色差值的平均值[△E*≤(△Es1*△Es2*)/2)比較,不得更深。
3 附錄Ⅸ B 澄清度檢查法
澄清度檢查法系將藥品溶液與規定的濁度標準液相比較,用以檢查溶液的澄清程度。[1]
品種項下規定的“澄清”,係指供試品溶液的澄清度與所用溶劑相同,或不超過0.5號濁度標準液的濁度。“幾乎澄清”,係指供試品溶液的濁度介於0.5號至1號濁度標準液的濁度之間。
3.1 第一法(目視法)①
注①新增儀器法作爲第二法,原方法作爲第一法(目視法)。
除另有規定外,按各品種項下規定的濃度要求,在室溫條件下將用水稀釋至一定濃度的供試品溶液與等量的濁度標準液分別置於配對的比濁用玻璃管(內徑15~16mm,平底,具塞,以無色、透明、中性硬質玻璃製成)中,在濁度標準液製備5分鐘後,在暗室內垂直同置於傘棚燈下,照度爲1000lx,從水平方向觀察、比較。除另有規定外,供試品溶解後應立即檢視。第一法無法準確判定二者的澄清度差異時,改用第二法進行測定並以其測定結果進行判定。[1]
濁度標準貯備液的製備 稱取於105℃乾燥至恆重的硫酸肼1.00g,置100ml量瓶中,加水適量使溶解,必要時可在40℃的水浴中溫熱溶解,並用水稀釋至刻度,搖勻,放置4~6小時;取此溶液與等容量的10%烏洛托品溶液混合,搖勻,於25℃避光靜置24小時,即得。該溶液置冷處避光保存,可在2個月內使用,用前搖勻。
濁度標準原液的製備 取濁度標準貯備液15.0ml,置1000ml量瓶中,加水稀釋至刻度,搖勻,取適量,置1cm吸收池中,照紫外-可見分光光度法(附錄Ⅳ A),在550nm的波長處測定,其吸光度應在0.12~0.15範圍內。該溶液應在48小時內使用,用前搖勻。
濁度標準液的製備 取濁度標準原液與水,按下表配製,即得。濁度標準液應臨用時製備,使用前充分搖勻。
級號 | 0.5 | 1 | 2 | 3 | 4 |
濁度標準原液/ml | 2.50 | 5.0 | 10.0 | 30.0 | 50.0 |
水/ml | 97.50 | 95.0 | 90.0 | 70.0 | 50.0 |
{
3.2 第二法(儀器法)②
注②新增第二法(儀器法)。
供試品溶液的濁度可採用儀器法測定。溶液中不同大小、不同特性的微粒物質包括有色物質均可使入射光產生透射和散射,通過測定透射光或散射光的強度,可以檢查供試品溶液的濁度。儀器測定模式通常有三種類型,透射光式、散射光式和透射光一散射光比較測量模式(比率濁度模式)。
3.2.1 1.儀器的一般要求
採用適宜的散射光式濁度儀,光源峯值波長約爲860nm左右;測量範圍應包含0.01~100NTU。在0~10NTU範圍內分辨率應爲0.01NTU;在10~100NTU範圍內分辨率應爲0.1NTU。
3.2.2 2.適用範圍及檢測原理
本法採用散射光式濁度儀,適用於低、中濁度無色供試品溶液的濁度測定(濁度值爲100NTU以下的供試品)。因爲高濁度的供試品會造成多次散射現象,使散射光強度迅速下降,導致散射光強度不能正確反映供試品的濁度值。0.5號至4號濁度標準液的濁度值範圍約爲0~40NTU。
採用散射光式濁度儀測定時,入射光和測定的散射光呈90°夾角,入射光強度和散射光強度關係式爲:
I=K'TI0
式中I爲散射光強度,單位爲cd; I0爲入射光強度,單位爲cd;K'爲散射係數;T爲供試品溶液的濁度值,單位爲NTU(NTU是基於福爾馬肼濁度標準液測定的散射濁度單位,福爾馬肼濁度標準液即爲第一法中的濁度標準貯備液)。在入射光強度I0不變的情況下,散射光強度I與濁度值成正比,因此,可以將濁度測量轉化爲散射光強度的測量。
3.2.3 3.系統的適用性試驗
儀器應定期(一般每月一次)對濁度標準液的線性和重複性進行考察,採用0.5號至4號濁度標準液進行濁度值測定,濁度標準液的測定結果(單位NTU)與濃度間應呈線性關係,線性方程的相關係數應不低於0.999;重複測定5次0.5號至4號濁度標準液,0.5號和1號濁度標準液測量濁度值的相對標準偏差應不大於5%,2~4號濁度標準液測量濁度值的相對標準偏差不大於2%。
3.2.4 4.測定法
按照儀器介紹要求並採用規定的濁度液進行儀器校正。溶液劑直接取樣測定;原料藥或其他劑型按照個論項下的標準規定製備供試品溶液,應臨用時製備。分別取供試品溶液和相應濁度標準液進行測定,測定前應搖勻,讀取濁度值。供試品溶液濁度值不得大於相應濁度標準液的濁度值。}[1]
4 附錄Ⅸ C 不溶性微粒檢查法
本法系在可見異物檢查符合規定後,用以檢查靜脈用注射劑(溶液型注射液、注射用無菌粉末、注射用濃溶液)及供靜脈注射用無菌原料藥中不溶性微粒的大小及數量。
本法包括光阻法和顯微計數法。當光阻法測定結果不符合規定或供試品不適於用光阻法測定時,應採用顯微計數法進行測定,並以顯微計數法的測定結果作爲判定依據。
光阻法不適用於黏度過高和易析出結晶的製劑,也不適用於進入傳感器時容易產生氣泡的注射劑。對於黏度過高,採用兩種方法都無法直接測定的注射液,可用適宜的溶劑經適當稀釋後測定。
4.1 試驗環境及檢測
試驗操作環境應不得引入外來微粒,測定前的操作應在層流淨化臺中進行。玻璃儀器和其他所需的用品均應潔淨、無微粒。本法所用微粒檢查用水(或其他適宜溶劑),使用前須經不大於1.0μm的微孔濾膜濾過。
取微粒檢查用水(或其他適宜溶劑)50ml,按相應檢查法項下規定的方法測定。光阻法要求每10ml中含10μm及10μm以上的不溶性微粒應在10粒以下,含25μm及25μm以上的不溶性微粒應在2粒以下。顯微計數法要求每50ml中含10μm及10μm以上的不溶性微粒應在20粒以下,含25μm及25μm以上的不溶性微粒應在5粒以下。否則表明微粒檢查用水(或其他適宜溶劑)、玻璃儀器或試驗環境不適於進行微粒檢查,應重新處理,檢測符合規定後方可進行供試品檢查。
4.2 第一法(光阻法)
當液體中的微粒通過一窄小的檢測區時,與液體流向垂直的入射光,由於被微粒阻擋而減弱,因此由傳感器輸出的信號降低,這種信號變化與微粒的截面積大小相關,光阻法檢查注射劑中不溶性微粒即依據此原理。
4.2.1 對儀器的一般要求
測量粒徑範圍爲2~100μm,檢測微粒濃度爲0~10000個/ml。
4.2.2 儀器的校正與檢定
所用儀器應至少每6個月校正一次。
(1)取樣體積 待儀器穩定後,取多於取樣體積的微粒檢查用水置於取樣杯中,稱定重量,通過取樣器由取樣杯中量取一定體積的微粒檢查用水後,再次稱定重量。以兩次稱定的重量之差計算取樣體積。連續測定3次,每次測得體積與量取體積的示值之差應在±5%以內。測定體積的平均值與量取體積的示值之差應在±3%以內。也可採用其他適宜的方法校正,結果應符合上述規定。
(2)微粒計數 取相對標準偏差不大於5%,平均粒徑爲10μm的標準粒子,製成每1ml中含1000~1500微粒數的懸浮液,靜置2分鐘脫氣,開啓攪拌器,緩慢攪拌使其均勻(避免氣泡產生),依法測定3次,記錄5μm通道的累計計數,第一次數據不計,後兩次測定結果的平均值與已知粒子數之差應在士20%以內。
(3)傳感器分辨率 取相對標準偏差不大於5%,平均粒徑爲10μm的標準粒子(均值粒徑的標準差應不大於1μm),製成每1ml中含1000~1500微粒數的懸浮液,靜置2分鐘脫氣,開啓攪拌器,緩慢攪拌使其均勻(避免氣泡產生),依法測定8μm、10μm和12μm三個通道的粒子數,計算8μm與10μm兩個通道的差值計數和10μm與12μm兩個通道的差值計數,上述兩個差值計數與10μm通道的累計計數之比都不得小於68%。若校正結果不符合規定,應重新調試儀器後再次進行校正,符合規定後方可使用。
如所使用儀器附有自檢軟件,可進行自檢。
4.2.3 檢查法
(1)標示裝量爲25ml或25ml以上的靜脈用注射液或注射用濃溶液 除另有規定外,取供試品,用水將容器外壁洗淨,小心翻轉20次,使溶液混合均勻,立即小心開啓容器,先倒出部分供試品溶液沖洗開啓口及取樣杯,再將供試品溶液倒入取樣杯中,靜置2分鐘或適當時間脫氣,置於取樣器上(或將供試品容器直接置於取樣器上)。開啓攪拌,使溶液混勻(避免氣泡產生),依法測定至少3次,每次取樣應不少於5ml,記錄數據;另取至少2個供試品,同法測定。每個供試品第一次數據不計,取後續測定結果的平均值計算。
(2)標示裝量爲25ml以下的靜脈用注射液或注射用濃溶液除另有規定外,取供試品,用水將容器外壁洗淨,小心翻轉20次,使溶液混合均勻,靜置2分鐘或適當時間脫氣,小心開啓容器,直接將供試品容器置於取樣器上,開啓攪拌或以手緩緩轉動,使溶液混勻(避免產生氣泡),由儀器直接抽取適量溶液(以不吸入氣泡爲限),測定並記錄數據;另取至少3個供試品,同法測定。第一個供試品的數據不計,取後續測定結果的平均值計算。
(1)、(2)項下的注射用濃溶液如黏度太大,不便直接測定時,可經適當稀釋後,依法測定。
也可採用適宜的方法,在層流淨化臺上小心合併至少3個供試品的內容物(使總體積不少於25ml),置於取樣杯中,靜置2分鐘或適當時間脫氣,置於取樣器上。開啓攪拌,使溶液混勻(避免氣泡產生),依法測定至少4次,每次取樣應不少於5ml。第一次數據不計,取後續測定結果的平均值,根據取樣體積與每個容器的標示裝置體積,計算每個容器所含的微粒數。
(3)靜脈注射用無菌粉末 除另有規定外,取供試品,用水將容器外壁洗淨,小心開啓瓶蓋,精密加入適量微粒檢查用水(或適宜的溶劑),小心蓋上瓶蓋,緩緩振搖使內容物溶解,靜置2分鐘或適當時間脫氣,小心開啓容器,直接將供試品容器置於取樣器上,開啓攪拌或以手緩緩轉動,使溶液混勻(避免氣泡產生),由儀器直接抽取適量溶液(以不吸入氣泡爲限),測定並記錄數據;另取至少3個供試品,同法測定。第一個供試品的數據不計,取後續測定結果的平均值計算。
也可採用適宜的方法,取至少3個供試品,在層流淨化臺上用水將容器外壁洗淨,小心開啓瓶蓋,分別精密加入適量微粒檢查用水(或適宜的溶劑),緩緩振搖使內容物溶解,小心合併容器中的溶液(使總體積不少於25ml),置於取樣杯中,靜置2分鐘或適當時間脫氣,置於取樣器上。開啓攪拌,使溶液混勻(避免氣泡產生),依法測定至少4次,每次取樣應不少於5ml。第一次數據不計,取後續測定結果的平均值,計算每個容器所含的微粒數。
(4)供注射用無菌原料藥 按各品種項下規定,取供試品適量(相當於單個製劑的最大規格量),置取樣杯或適宜的容器中,照上述(3)法,自“精密加入適量微粒檢查用水(或適宜的溶劑),緩緩振搖使內容物溶解”起,依法操作,測定並記錄數據;另取至少三份供試品,同法測定。第一次數據不計,取後續測定結果的平均值,計算每份所含的微粒數。
4.2.4 結果判定
(1)標示裝量爲100ml或100ml以上的靜脈用注射液 除另有規定外,每1ml中含10μm及10μm以上的微粒不得過25粒,含25μm及25μm以上的微粒不得過3粒。
(2)標示裝量爲100ml以下的靜脈用注射液、靜脈注射用無菌粉末、注射用濃溶液及供注射用無菌原料藥 除另有規定外,每個供試品容器(份)中含10μm及10μm以上的微粒不得過6000粒,含25μm及25μm以上的微粒不得過600粒。
4.3 第二法(顯微計數法)
4.3.1 對儀器的一般要求
4.3.1.1 層流淨化臺
高效空氣過濾器孔徑0.45μm,氣流方向由裏向外,應定期檢查風速及淨化臺上空氣中的微粒數。
4.3.1.2 顯微鏡
雙筒大視野顯微鏡,目鏡內附標定的測微尺(每格5~10μm)。座標軸前後、左右移動範圍均應大於30mm.顯微鏡裝置內附有光線投射角度、光強度均可調節的照明裝置。檢測時放大100倍。
4.3.1.3 微孔濾膜
白色,孔徑0.45μm、直徑25mm或13mm,一面印有間隔3mm的格柵;膜上如有10μm及10μm[2]以上的不溶性微粒,應在5粒以下,並不得有25μm及25μm[2]以上的微粒,必要時,可用微粒檢查用水沖洗使符合要求。
4.3.2 檢查前的準備
試驗環境檢測符合規定後,在層流淨化臺上將濾器用微粒檢查用水(或其他適宜溶劑)沖洗至潔淨,用平頭無齒鑷子夾取測定用濾膜,用微粒檢查用水(或其他適宜溶劑)沖洗後,置濾器托架上;固定濾器,倒置,反覆用微粒檢查用水(或其他適宜溶劑)沖洗濾器內壁,瀝乾後安裝在抽濾瓶上,備用。
4.3.3 檢查法
(1)標示裝量爲25ml或25ml以上的靜脈用注射液或注射用濃溶液 除另有規定外,取供試品,用水將容器外壁洗淨,在層流淨化臺上小心翻轉20次,使溶液混合均勻,立即小心開啓容器,用適宜的方法抽取或量取供試品溶液25ml,沿濾器內壁緩緩注入經預處理的濾器(濾膜直徑25mm)中。靜置1分鐘,緩緩抽濾至濾膜近幹,再用微粒檢查用水25ml,沿濾器內壁緩緩注入,洗滌並抽濾至濾膜近幹,然後用平頭鑷子將濾膜移置平皿上(必要時,可塗抹極薄層的甘油使濾膜平整),微啓蓋子使濾膜適當乾燥後,將平肛閉合,置顯微鏡載物臺上。調好入射光,放大100倍進行顯微測量,調節顯微鏡至濾膜格柵清晰,移動座標軸,分別測定有效濾過面積上最長粒徑大於10μm和25μm的微粒數。另取至少2個供試品,同法測定,計算測定結果的平均值。
(2)標示裝量爲25ml以下的靜脈用注射液或注射用濃溶液除另有規定外,取供試品,用水將容器外壁洗淨,在層流淨化臺上小心翻轉20次,使混合均勻,立即小心開啓容器,用適宜的方法直接抽取每個容器中的全部溶液,沿濾器內壁緩緩注入經預處理的濾器(濾膜直徑13mm)中,照上述(1)同法測定。
(3)靜脈注射用無菌粉末及供注射用無菌原料藥 除另有規定外,照光阻法中檢查法的(3)或(4)製備供試品溶液,同上述(1)操作測定。
4.3.4 結果判定
(1)標示裝量爲100ml或100ml以上的靜脈用注射液除另有規定外,每1ml中含10μm及10μm以上的微粒不得過12粒,含25μm及25μm以上的微粒不得過2粒。
(2)標示裝量爲100ml以下的靜脈用注射液、靜脈注射用無菌粉末、注射用濃溶液及供注射用無菌原料藥 除另有規定外,每個供試品容器(份)中含10μm及10μm以上的微粒不得過3000粒,含25μm及25μm以上的微粒不得過300粒。
5 附錄Ⅸ D 結晶性檢查法
固態物質分爲結晶質和非晶質兩大類。可用下列方法檢查物質的結晶性。
5.1 第一法(偏光顯微鏡法)
許多晶體具有光學各向異性,當光線通過這些透明晶體時會發生雙折射現象。
取供試品顆粒少許,置載玻片上,加液狀石蠟適量使晶粒浸沒其中,在偏光顯微鏡下檢視,當轉動載物臺時,應呈現雙折射和消光位等各品種項下規定的晶體光學性質。
5.2 第二法(X射線粉末衍射法)
結晶質呈現特徵的衍射圖(尖銳的衍射峯),而非晶質的衍射圖則呈彌散狀。測定方法見2010年版藥典二部附錄Ⅸ F。
6 附錄Ⅸ E 粒度和粒度分佈測定法
本法用於測定原料藥和藥物製劑的粒子大小或粒度分佈。其中第一法、第二法用於測定藥物製劑的粒子大小或限度,第三法用於測定原料藥或藥物製劑的粒度分佈。
6.1 第一法(顯微鏡法)
本法中的粒度,系以顯微鏡下觀察到的長度表示。
6.1.1 目鏡測微尺的標定
照顯微鑑別法(2010年版藥典一部附錄Ⅱ C)標定。[3]
6.1.2 測定法
取供試品,用力搖勻,黏度較大者可按各品種項下的規定加適量甘油溶液(1→2)稀釋,照該劑型或各品種項下的規定,量取供試品,置載玻片上,覆以蓋玻片,輕壓使顆粒分佈均勻,注意防止氣泡混入,半固體可直接塗在載玻片上,立即在50~100倍顯微鏡下檢視蓋玻片全部視野,應無凝聚現象,並不得檢出該劑型或各品種項下規定的50μm及以上的粒子。再在200~500倍的顯微鏡下檢視該劑型或各品種項下規定的視野內的總粒數及規定大小的粒數,並計算其所佔比例(%)。
6.2 第二法(篩分法)
篩分法一般分爲手動篩分法、機械篩分法與空氣噴射篩分法。手動篩分法和機械篩分法適用於測定大部分粒徑大於75μm的樣品。對於粒徑小於75μm的樣品,則應採用空氣噴射篩分法或其他適宜的方法。
機械篩分法系採用機械方法或電磁方法,產生垂直振動、水平圓周運動、拍打、拍打與水平圓周運動相結合等振動方式。空氣噴射篩分法則採用流動的空氣流帶動顆粒運動。篩分試驗時需注意環境溼度,防止樣品吸水或失水。對易產生靜電的樣品,可加入0.5%膠質二氧化硅和(或)氧化鋁等抗靜電劑,以減小靜電作用產生的影響。
6.2.1 1.手動篩分法
(1)單篩分法 稱取各品種項下規定的供試品,置規定號的藥篩中(篩下配有密合的接收容器),篩上加蓋。按水平方向旋轉振搖至少3分鐘,並不時在垂直方向輕叩篩。取篩下的顆粒及粉末,稱定重量,計算其所佔比例(%)。
(2)雙篩分法 取單劑量包裝的5袋(瓶)或多劑量包裝的1袋(瓶),稱定重量,置該劑型或品種項下規定的上層(孔徑大的)藥篩中(下層的篩下配有密合的接收容器),保持水平狀態過篩,左右往返,邊篩動邊拍打3分鐘。取不能通過大孔徑篩和能通過小孔徑篩的顆粒及粉末,稱定重量,計算其所佔比例(%)。
6.2.2 2.機械篩分法
除另有規定外,取直徑爲200mm規定號的藥篩和接收容器,稱定重量,根據供試品的容積密度,稱取供試品25~100g,置最上層(孔徑最大的)藥篩中(最下層的篩下配有密合的接收容器),篩上加盞。設定振動方式和振動頻率,振動5分鐘。取各藥篩與接收容器,稱定重量,根據篩分前後的重量差異計算各藥篩上和接收容器內顆粒及粉末所佔比例(%)。重複上述操作直至連續兩次篩分後,各藥篩上遺留顆粒及粉末重量的差異不超過前次遺留顆粒及粉末重量的5%或兩次重量的差值不大於0.1g;若某一藥篩上遺留顆粒及粉末的重量小於供試品取樣量的5%,則該藥篩連續兩次的重量差異應不超過20%。
6.2.3 3.空氣噴射篩分法
每次篩分時僅使用一個藥篩。如需測定顆粒大小分佈,應從孔徑最小的藥篩開始順序進行。除另有規定外,取直徑爲200mm規定號的藥篩,稱定重量,根據供試品的容積密度,稱取供試品25~100g,置藥篩中,篩上加蓋。設定壓力,噴射5分鐘。取藥篩,稱定重量,根據篩分前後的重量差異計算藥篩上顆粒及粉末所佔比例(%)。重複上述操作直至連續兩次篩分後,藥篩上遺留顆粒及粉末重量的差異不超過前次遺留顆粒及粉末重量的5%或兩次重量的差值不大於0.1g;若藥篩上遺留的顆粒及粉末重量小於供試品取樣量的5%,則連續兩次的重量差異應不超過20%。
6.3 第三法(光散射法)
單色光束照射到顆粒供試品後即發生散射現象。由於散射光的能量分佈與顆粒的大小有關,通過測量散射光的能量分佈(散射角),依據米氏散射理論和弗朗霍夫近似理論,即可計算出顆粒的粒度分佈。本法的測量範圍可達0.02~3500μm。所用儀器爲激光散射粒度分佈儀。
6.3.1 1.對儀器的一般要求
散射儀 光源發出的激光強度應穩定,並且能夠自動扣除電子背景和光學背景等的干擾。
採用粒徑分佈特徵值[d(0.1)、d(0.5)、d(0.9)]已知的“標準粒子”對儀器進行評價。通常用相對標準偏差(RSD)表徵“標準粒子”的粒徑分佈範圍,當RSD小於50%(最大粒徑與最小粒徑的比率約爲10:1)時,平行測定5次,“標準粒子”的d(0.5)均值與其特徵值的偏差應小於3%,平行測定的RSD不得過3%;“標準粒子”的d(0.1)和d(0.9)均值與其特徵值的偏差均應小於5%,平行測定的RSD均不得過5%;對粒徑小於10μm的“標準粒子”,測定的d(0.5)均值與其特徵值的偏差應小於6%,平行測定的RSD不得過6%;d(0.1)和d(0.9)的均值與其特徵值的偏差均應小於10%,平行測定的RSD均不得過10%。
6.3.2 2.測定法
根據供試品的性狀和溶解性能,選擇溼法測定或幹法測定;溼法測定用於測定混懸供試品或不溶於分散介質的供試品,幹法測定用於測定水溶性或無合適分散介質的固態供試品。
6.3.2.1 溼法測定
根據供試品的特性,選擇適宜的分散方法使供試品分散成穩定的混懸液;通常可採用物理分散的方法如超聲、攪拌等,通過調節超聲功率和攪拌速度,必要時可加入適量的化學分散劑或表面活性劑,使分散體系成穩定狀態,以保證供試品能夠均勻穩定地通過檢測窗口,得到準確的測定結果。
只有當分散體系的雙電層電位(ζ電位)處於一定範圍內,體系才處於穩定狀態,因此,在製備供試品的分散體系時,應注意測量體系ζ電位,以保證分散體系的重現性。
溼法測量所需要的供試品量通常應達到檢測器遮光度範圍的8%~20%;最先進的激光粒度儀對遮光度的下限要求可低至0.2%。
6.3.2.2 幹法測定
通常採用密閉測量法,以減少供試品吸潮。選用的幹法進樣器及樣品池需克服偏流效應,根據供試品分散的難易,調節分散器的氣流壓力,使不同大小的粒子以同樣的速度均勻穩定地通過檢測窗口,以得到準確的測定結果。
對於化學原料藥,應採用噴射式分散器。在樣品盤中先加入適量的金屬小球,再加入供試品,調節振動進樣速度、分散氣壓(通常爲0~0.4MPa)和樣品出口的狹縫寬度,以控制供試品的分散程度和通過檢測器的供試品量。
幹法測量所需要的供試品量通常應達到檢測器遮光度範圍的0.5%~5%。
6.4 【附註】
(1)儀器光學參數的設置與供試品的粒度分佈有關。粒徑大於10μm的微粒,對系統折光率和吸光度的影響較小;粒徑小於10μm的微粒,對系統折光率和吸光度的影響較大。在對不同原料和製劑的粒度進行分析時,目前還沒有成熟的理論用於指導對儀器光學參數的設置,應由實驗比較決定,並採用標準粒子對儀器進行校準。
(2)對有色物質、乳化液和粒徑小於10μm的物質進行粒度分佈測量時,爲了減少測量誤差,應使用米氏理論計算結果,避免使用以弗朗霍夫近似理論爲基礎的計算公式。
(3)對粒徑分佈範圍較寬的供試品進行測定時,不宜採用分段測量的方法,而應使用涵蓋整個測量範圍的單一量程檢測器,以減少測量誤差。
7 附錄Ⅸ F X射線粉末衍射法
化合物的晶體,無論是單晶還是多晶,都有它自己特定的X射線衍射圖。衍射極大(點或線)間的距離及其相對強度可用作結晶物質的定性或定量分析。粉末衍射是用於結晶物質鑑別和純度檢查的常用技術,單晶衍射則主要用於分子量和晶體結構的測定。
固態物質分爲結晶質和非晶質兩大類。在晶體中,分子或原子在三維空間做週期性的有序排列,形成所謂晶格結構。非晶質有時又稱爲玻璃質或無定形物質,它們不具有晶格結構。
由於非晶質中分子的無序排列,散射的X射線相干性差,導致衍射圖呈彌散狀,這與結晶質具有特徵的衍射圖有明顯區別。
有些化合物存在不止一種晶格結構。雖然在一定的溫度和壓力下,只有一種晶型在熱力學上是穩定的,但由於從亞穩態轉變爲穩態的過程在通常情況下非常緩慢,因此,許多結晶質藥物常存在多晶現象。
除同質多晶外,許多化合物還能形成溶劑化物,此時,溶劑分子參與晶體的晶格結構。與同質多晶體一樣,溶劑化物也有它特徵的衍射圖。
一束準直的單色X射線照射旋轉單晶或粉末晶體時,便發生衍射現象,發生衍射的條件應符合布拉格方程:

式中dhkl爲面間距(hkl爲晶面指數);
θ爲掠射角。
用於X射線衍射的輻射源通常是以銅、鉬、鐵、鉻等元素爲陽極靶材料的真空管,其中以銅靶常用於有機化合物。一般多采用靶元素的Kα輻射,爲保證輻射的單色性,必須採用適當的濾光片,用以去除Kβ輻射(如銅靶配鎳濾光片)。輻射源的選擇應根據供試品的吸收特性和不產生原子熒光爲宜。當單色X射線照射單晶時,只有有限數目的晶面處於符合布拉格方程的位置。但當照射到大量的隨機取向的微晶粒時,每族晶面即可產生一個衍射圓錐。衍射圖可用感光膠片、輻射計、影像板或電感耦合探測器等面探測器記錄。當使用膠片時,衍射角可由膠片上量取並經計算測定,衍射強度則由測微光度計讀取。使用輻射計或面探測器時,衍射角、衍射強度及面間距均可由粉末衍射儀方便地讀取。
存在多種影響衍射強度的因素。總的說來,被任何一族晶面衍射的X射線強度決定於結構因子和實驗條件。前者包括;①晶胞中原子的位置;②原子的散射因子;③供試品對X射線的吸收和極化因子。後者包括:①入射X射線的波長及其強度;②供試品的結晶度、密度和體積;③實驗溫度;④記錄強度數據的實驗裝置等。
試樣的製備及有關實驗技術 一般來說,晶粒的特定外形使試樣在樣品架上顯示某種程度的優勢取向。這種現象在針狀晶和片狀晶中顯得尤爲突出。試樣的擇優取向可影響各個晶面的相對衍射強度。用瑪瑙研鉢把供試品小心地研磨成細粉可有效地改善晶粒取向的隨機性。
爲能準確地測定衍射角,可用少量標準物質與試樣混合,在衍射圖上測定標準物質的各面間距離,並與文獻值比較,以此對試樣的衍射數據和衍射儀進行校正。
定量測定時採用標準曲線法。內標物質的選擇應遵循與供試品的衍射圖不發生任何重疊的原則,同時它們的密度與對X射線的吸收特性也應基本相同。由於基質對X射線有吸收,因此在製作標準曲線與測定供試品時,基質的取用量也應大致相同。通常,供試品的取用量與基質之比以不超過10%爲宜。但由於本法的定量精度差,故通常僅用於少數特定的定量問題,如結晶度的測定和同質多晶混合物的相對量測定等。
結晶物質的鑑別可通過比較供試品與已知物質的衍射圖完成。各衍射線的衍射角(2θ)、相對強度和麪間距是進行鑑別的依據。供試品與參照品的衍射角偏差應在衍射儀的允差範圍內,衍射線的相對強度偏差有時可達20%。進行鑑別時,有兩種情況應特別留意,即:①研磨供試品的壓力有時可造成晶型轉變,從而導致衍射圖變化;②有些同質多晶體的衍射圖,彼此間的差別也許並不顯著。遇此情況,作出結論時必須十分謹慎。
對於大多數有機結晶物質,衍射角(2θ)的記錄範圍通常取0°~40°;對於無機鹽,如有必要可把記錄範圍適當放寬。
8 附錄Ⅸ G 滲透壓摩爾濃度測定法
生物膜,例如人體的細胞膜或毛細血管壁,一般具有半透膜的性質,溶劑通過半透膜由低濃度溶液向高濃度溶液擴散的現象稱爲滲透,阻止滲透所需施加的壓力,即爲滲透壓。在涉及溶質的擴散或通過生物膜的液體轉運各種生物過程中,滲透壓都起着極其重要的作用。因此,在製備注射劑、眼用液體制劑等藥物製劑時,必須關注其滲透壓。處方中添加了滲透壓調節劑的製劑,均應控制其滲透壓摩爾濃度。
靜脈輸液、營養液、電解質或滲透利尿藥(如甘露醇注射液)等製劑,應在藥品介紹上標明其滲透壓摩爾濃度,以便臨牀醫生根據實際需要對所用製劑進行適當的處置(如稀釋)。正常人體血液的滲透壓摩爾濃度範圍爲285~310mOsmol/kg,0.9%氯化鈉溶液或5%葡萄糖溶液的滲透壓摩爾濃度與人體血液相當。
溶液的滲透壓,依賴於溶液中溶質粒子的數量,是溶液的依數性之一,通常以滲透壓摩爾濃度(Osmolality)來表示,它反映的是溶液中各種溶質對溶液滲透壓貢獻的總和。
滲透壓摩爾濃度的單位,通常以每千克溶劑中溶質的毫滲透壓摩爾來表示,可按下列公式計算毫滲透壓摩爾濃度(mOsmol/kg):
式中,n爲一個溶質分子溶解或解離時形成的粒子數。在理想溶液中,例如葡萄糖n=1,氯化鈉或硫酸鎂n=2,氯化鈣n=3,枸櫞酸鈉n=4。
在生理範圍及稀溶液中,其滲透壓摩爾濃度與理想狀態下的計算值偏差較小;隨着溶液濃度的增加,與計算值比較,實際滲透壓摩爾濃度下降。例如0.9%氯化鈉注射液,按上式計算,毫滲透壓摩爾濃度是2×1000×9/58.4=308mOsmol/kg,而實際上在此濃度時氯化鈉溶液的,n稍小於2,其實際測得值是286mOsmol/kg;複雜混合物,如水解蛋白注射液的理論滲透壓摩爾濃度不容易計算,因此通常採用實際測定值表示。
8.1 1.滲透壓摩爾濃度的測定
通常採用測量溶液的冰點下降來間接測定其滲透壓摩爾濃度。在理想的稀溶液中,冰點下降符合△Tf=Kf·m的關係,式中,△Tf爲冰點下降,Kf爲冰點下降常數(當水爲溶劑時爲1.86),m爲重量摩爾濃度。而滲透壓符合P0=K0·m的關係,式中,P0爲滲透壓,K0爲滲透壓常數,m爲溶液的重量摩爾濃度。由於兩式中的濃度等同,故可以用冰點下降法測定溶液的滲透壓摩爾濃度。
8.1.1 儀器
採用冰點下降的原理設計的滲透壓摩爾濃度測定儀通常由製冷系統、用來測定電流或電位差的熱敏探頭和振盪器(或金屬探針)組成。測定時將測定探頭浸入供試溶液的中心,並降至儀器的冷卻槽中。啓動製冷系統,當供試溶液的溫度降至凝固點以下時,儀器採用振盪器(或金屬探針)誘導溶液結冰,自動記錄冰點下降的溫度。儀器顯示的測定值可以是冰點下降的溫度,也可以是滲透壓摩爾濃度。
8.1.2 標準溶液的製備
取基準氯化鈉試劑,於500~650℃乾燥40~50分鐘,置乾燥器(硅膠)中放冷至室溫。根據需要,按表中所列數據精密稱取適量,溶於1kg水中,搖勻,即得。
每1kg水中氯化 鈉的重量/g | 冰點下降 溫度△T/℃ | |
3.087 6.260 9.463 12.684 15.916 19.147 22.380 | 100 200 300 400 500 600 700 | 0.186 0.372 0.558 0.744 0.930 1.116 1.302 |
8.1.3 供試品溶液
供試品如爲液體,通常可直接測定;如其滲透壓摩爾濃度大於700mOsmol/kg或爲濃溶液,可用適宜的溶劑(通常爲注射用水)稀釋至表中測定範圍內;如爲固體(如注射用無菌粉末),可採用藥品標籤或介紹中的規定溶劑溶解並稀釋至表中測定範圍內。需特別注意的是,溶液經稀釋後,粒子間的相互作用與原溶液有所不同,一般不能簡單地將稀釋後的測定值乘以稀釋倍數來計算原溶液的滲透壓摩爾濃度。例如,甘露醇注射液、氨基酸注射液等高滲溶液和注射用無菌粉末可用適宜的溶劑(如注射用水)溶解、稀釋後測定,並在各品種項下規定具體的溶解或稀釋方法。
8.1.4 測定法
按儀器介紹操作,首先取適量新沸放冷的水調節儀器零點,然後由表中選擇兩種標準溶液(供試品溶液的滲透壓摩爾濃度應介於兩者之間)校正儀器,再測定供試品溶液的滲透壓摩爾濃度或冰點下降值。
8.2 2.滲透壓摩爾濃度比的測定
供試品溶液與0.9%(g/ml)氯化鈉標準溶液的滲透壓摩爾濃度比率稱爲滲透壓摩爾濃度比。用滲透壓摩爾濃度測定儀分別測定供試品溶液與0.9% (g/ml)氯化鈉標準溶液的滲透壓摩爾濃度OT與OS,方法同滲透壓摩爾濃度測定法,並用下列公式計算滲透壓摩爾濃度比:
滲透壓摩爾濃度比測定用標準溶液的製備 精密稱取經500~650℃乾燥40~50分鐘並置乾燥器(硅膠)中放冷的基準氯化鈉0.900g,加水使溶解並稀釋至100ml,搖勻,即得。
9 附錄Ⅸ H 可見異物檢查法
可見異物係指存在於注射劑、眼用液體制劑中,在規定條件下目視可以觀測到的不溶性物質,其粒徑或長度通常大於50μm。
注射劑、眼用液體制劑應在符合藥品生產質量管理規範(GMP)的條件下生產,產品在出廠前應採用適宜的方法逐一檢查並同時剔除不合格產品。臨用前,也在自然光下目視檢查(避免陽光直射),如有可見異物,不得使用。
可見異物檢查法有燈檢法和光散射法。一般常用燈檢法,也可採用光散射法。燈檢法不適用的品種,如用深色透明容器包裝或液體色澤較深(一般深於各標準比色液7號)的品種可選用光散射法。
實驗室檢測時應避免引入可見異物。當製備注射用無菌粉末和無菌原料藥供試品溶液時,或供試品溶液的容器不適於檢測(如不透明、不規則形狀容器等),需轉移至適宜容器中時,均應在100級的潔淨環境(如層流淨化臺)中進行。
9.1 第一法(燈檢法)
燈檢法應在暗室中進行。檢查裝置 如下圖所示。
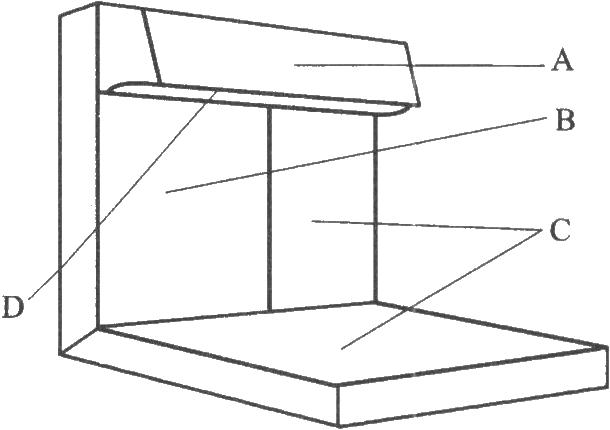
圖 燈檢法示意
A.帶有遮光板的日光燈光源(光照度可在1000~4000lx範圍內調節);
B.不反光的黑色背景;
C.不反光的白色背景和底部(供檢查有色異物);
D.反光的白色背景(指遮光板內側)。
9.1.1 檢查人員條件
遠距離和近距離視力測驗,均應爲4.9或4.9以上(矯正後視力應爲5.0或5.0以上);應無色盲。
9.1.2 檢查法
溶液型、乳狀液及混懸型製劑 除另有規定外,取供試品20支(瓶),除去容器標籤,擦淨容器外壁,必要時將藥液轉移至潔淨透明的適宜容器內;置供試品於遮光板邊緣處,在明視距離(指供試品至人眼的清晰觀測距離,通常爲25cm),分別在黑色和白色背景下,手持供試品頸部輕輕旋轉和翻轉容器使藥液中可能存在的可見異物懸浮(但應避免產生氣泡),輕輕翻搖後即用目檢視,重複3次,總時限爲20秒。供試品裝量每支(瓶)在10ml及10ml以下的,每次檢查可手持2支(瓶)。
注射用無菌粉末 除另有規定外,取供試品5支(瓶),用適宜的溶劑及適當的方法使藥粉全部溶解後,按上述方法檢查。配帶有專用溶劑的注射用無菌粉末,應先將專用溶劑按溶液型製劑檢查合格後,再用以溶解注射用無菌粉末。
無菌原料藥 除另有規定外,按抽樣要求稱取各品種製劑項下的最大規格量5份,分別置潔淨透明的適宜容器內,用適宜的溶劑及適當的方法使藥物全部溶解後,按上述方法檢查。
注射用無菌粉末及無菌原料藥所選用的適宜溶劑應無可見異物。如爲水溶性藥物,一般使用不溶性微粒檢查用水(參見附錄Ⅸ C不溶性微粒檢查法)進行溶解製備;如爲其他溶劑,則應在各品種項下中作出規定。溶劑量應確保藥物溶解完全並便於觀察。
注射用無菌粉末及無菌原料藥溶解所用的適當方法應與其製劑使用說明書中注明的臨牀使用前處理的方式相同。如除振搖外還需其他輔助條件,則應在各品種項下中作出規定。用無色透明容器包裝的無色供試品溶液,檢查時被觀察樣品所在處的光照度應爲1000~1500lx,用透明塑料容器包裝或用棕色透明容器包裝的供試品溶液或有色供試品溶液,檢查時被觀察樣品所在處的光照度應爲2000~3000lx;混懸型供試品或乳狀液,檢查時被觀察樣品所在處的光照度應增加至約4000lx。
9.1.3 結果判定
各類注射劑、眼用液體制劑 在靜置一定時間後輕輕旋轉時均不得檢出煙霧狀微粒柱,且不得檢出金屬屑、玻璃屑、長度或最大粒徑超過2mm的纖維和塊狀物等明顯可見異物。微細可見異物(如點狀物、2mm以下的短纖維和塊狀物等)如有檢出,除另有規定外,應分別符合下列規定:
溶液型靜脈用注射液、注射用濃溶液 20支(瓶)檢查的供試品中,均不得檢出明顯可見異物。如檢出微細可見異物的供試品僅有1支(瓶),應另取20支(瓶)同法複試,均不得檢出。
溶液型非靜脈用注射液 被檢查的20支(瓶)供試品中,均不得檢出明顯可見異物。如檢出微細可見異物,應另取20支(瓶)同法複試,初、複試的供試品中,檢出微細可見異物的供試品不得超過2支(瓶)。
溶液型滴眼劑 被檢查的20支(瓶)供試品中,均不得檢出明顯可見異物。如檢出微細可見異物,應另取20支(瓶)同法複試,初、複試的供試品中,檢出微細可見異物的供試品不得超過3支(瓶)。
混懸型、乳狀液型注射液及滴眼劑 被檢查的20支(瓶)供試品中,均不得檢出金屬屑、玻璃屑、色塊、纖維等明顯可見異物。
臨用前配製的溶液型和混懸型滴眼劑,除另有規定外,應符合相應的可見異物規定。
注射用無菌粉末 被檢查的5支(瓶)供試品中,均不得檢出明顯可見異物。如檢出微細可見異物,每支(瓶)供試品中檢出微細可見異物的數量應符合下表的規定;如有1支(瓶)不符合規定,另取10支(瓶)同法複試,均應符合規定。
配帶有專用溶劑的注射用無菌粉末,專用溶劑應符合相應的溶液型注射液的規定。
無菌原料藥 5份檢查的供試品中,均不得檢出明顯可見異物。如檢出微細可見異物,每份供試品中檢出微細可見異物的數量應符合下表的規定;如有1份不符合規定,另取10份同法複試,均應符合規定。
9.2 第二法(光散射法)
當一束單色激光照射溶液時,溶液中存在的不溶性物質使入射光發生散射,散射的能量與不溶性物質的大小有關。本方法通過對溶液中不溶性物質引起的光散射能量的測量,並與規定的閾值比較,以檢查可見異物。
不溶性物質的光散射能量可通過被採集的圖像進行分析。設不溶性物質的光散射能量爲E,經過光電信號轉換,即可用攝像機採集到一個錐體高度爲H,直徑爲D的相應立體圖像。散射能量E爲D和H的一個單調函數,即E=f(D,H)。同時,假設不溶性物質的光散射強度爲q,攝像曝光時間爲T,則又有E=g(q,T)。由此可以得出圖像中的D與q、T之間的關係爲D=w(q,T),也爲一個單調函數關係。在測定圖像中的D值後,即可根據函數曲線計算出不溶性物質的光散射能量。
9.2.1 儀器裝置和檢測原理
儀器由旋瓶裝置、激光光源、圖像採集器、數據處理系統和終端顯示系統組成,並配有自動上瓶和下瓶裝置。
供試品通過上瓶裝置被送至旋瓶裝置,旋瓶裝置應能使供試品沿垂直中軸線高速旋轉一定時間後迅速停止,同時激光光源發出的均勻激光束照射在供試品上;當藥液渦流基本消失,瓶內藥液因慣性繼續旋轉,圖像採集器在特定角度對旋轉藥液中懸浮的不溶性物質引起的散射光能量進行連續攝像,採集圖像不少於75幅;數據處理系統對採集的序列圖像進行處理,然後根據預先設定的閾值自動判定超過一定大小的不溶性物質的有無,或在終端顯示器上顯示圖像供人工判定,同時記錄檢測結果,指令下瓶裝置自動分檢合格與不合格供試品。儀器校準 儀器應具備自動校準功能,在檢測供試品前須採用標準粒子進行校準。
除另有規定外,分別用粒徑爲40μm和60μm的標準粒子對儀器進行標定。根據標定結果得到曲線方程並計算出與粒徑50μm相對應的檢測像素值。
當把檢測像素參數設定爲與粒徑50μm相對應的數值時,對60μm的標準粒子溶液測定3次,應均能檢出。
9.2.2 檢查法
溶液型注射液 除另有規定外,取供試品20支(瓶),除去不透明標籤,擦淨容器外壁,置儀器上瓶裝置上,根據儀器的使用說明書選擇適宜的測定參數,啓動儀器,將供試品檢測3次並記錄檢測結果。凡儀器判定有1次不合格者,須用燈檢法作進一步確認。用深色透明容器包裝或液體色澤較深等燈檢法檢查困難的品種不用燈檢法確認。
注射用無菌粉末 除另有規定外,取供試品5支(瓶),用適宜的溶劑及適當的方法使藥物全部溶解後,按上述方法檢查。
無菌原料藥 除另有規定外,稱取各品種製劑項下的最大規格量5份,分別置潔淨透明的專用玻璃容器內,用適宜的溶劑及適當的方法使藥物全部溶解後,按上述方法檢查。設置檢測參數時,一般情況下取樣視窗的左右邊線和底線應與瓶體重合,上邊線與液麪的彎月面成切線;旋轉時間的設置應能使液麪漩渦到底,以能帶動固體物質懸浮並消除氣泡;靜置時間的設置應儘可能短,但不能短於液麪漩渦消失的時間,以避免氣泡干擾並保證攝像啓動時固體物質仍在轉動;嵌瓶鬆緊度參數與瓶底直徑(mm)基本相同,可根據安瓿質量調整,如瓶體不平正,轉動時瓶體搖動幅度較大,氣泡易產生,則應將嵌瓶鬆緊度調大以減小搖動,但同時應延長旋轉時間,使漩渦仍能到底。
9.2.3 結果判定
同燈檢法。
10 附錄Ⅸ J 質譜法
質譜法是使待測化合物產生氣態離子,再按質荷比(m/z)將離子分離、檢測的分析方法,檢測限可達10-15~10-12 mol數量級。質譜法可提供分子質量和結構的信息,定量測定可採用內標法或外標法。
質譜儀的主要組成如圖所示。在由泵維持的10-3~10-6 Pa真空狀態下,離子源產生的各種正離子(或負離子),經加速,進入質量分析器分離,再由檢測器檢測。計算機系統用於控制儀器,記錄、處理並儲存數據,當配有標準譜庫軟件時,計算機系統可以將測得的質譜與標準譜庫中圖譜比較,獲得可能化合物的組成和結構信息。
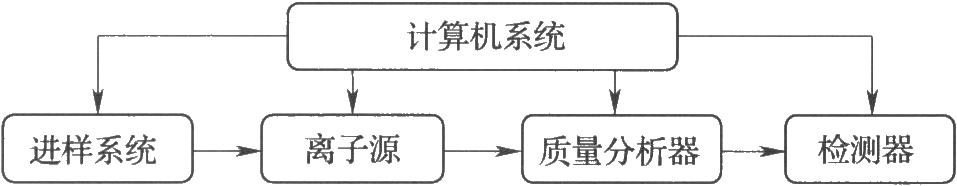
圖 質譜儀的主要組成
10.1 一、進樣系統
樣品導入應不影響質譜儀的真空度。進樣方式的選擇取決於樣品的性質、純度及所採用的離子化方式。
10.1.1 1.直接進樣
室溫常壓下,氣態或液態化合物的中性分子通過可控漏孔系統,進入離子源。吸附在固體上或溶解在液體中的揮發性待測化合物可採用頂空分析法提取和富集,程序升溫解吸附,再經毛細管導入質譜儀。
揮發性固體樣品可置於進樣杆頂端小坩堝內,在接近離子源的高真空狀態下加熱、氣化。採用解吸離子化技術,可以使熱不穩定的、難揮發的樣品在氣化的同時離子化。
多種分離技術已實現了與質譜的聯用。經分離後的各種待測成分,可以通過適當的接口導入質譜儀分析。
10.1.2 2.氣相色譜-質譜聯用(GC-MS)
氣相色譜分離後的流出物呈氣態,待測化合物的分子大小也適宜於質譜分析。在使用毛細管氣相色譜柱及高容量質譜真空泵的情況下,色譜流出物可直接引入質譜儀。
10.1.3 3.液相色譜-質譜聯用(LC-MS)
使待測化合物從色譜流出物中分離、形成適合於質譜分析的氣態分子或離子需要特殊的接口。粒子束(PBI)、移動帶(MBD、大氣壓離子化(API)是可用的液相色譜-質譜聯用接口。爲減少污染,避免化學噪聲和電離抑制,流動相中所含的緩衝鹽或添加劑通常應具有揮發性,且用量也有一定的限制。
(1)粒子束接口 液相色譜的流出物在去溶劑室霧化、脫溶劑後,僅待測化合物的中性分子被引入質譜離子源。粒子束接口適用於分子量小於1000的弱極性化合物的分析,測得的質譜可以由電子轟擊離子化或化學離子化產生。電子轟擊離子化質譜含有豐富的結構信息。
(2)移動帶接口 流速爲0.5~1.5ml/min的液相色譜流出物,均勻地滴加在移動帶上,蒸發、除去溶劑後,待測化合物被引入質譜離子源。移動帶接口不適宜於極性大或熱不穩定化合物的分析,測得的質譜可以由電子轟擊離子化或化學離子化或快原子轟擊離子化產生。
(3)大氣壓離子化接口 電噴霧離子化、大氣壓化學離子化是目前液相色譜-質譜聯用廣泛採用的大氣壓離子化接口技術。由於兼具離子化功能,這些接口又稱爲大氣壓離子源,將在離子化方式中介紹。
10.1.4 4.超臨界流體色譜-質譜聯用(SFC-MS)
目前,超臨界流體色譜-質譜聯用主要採用大氣壓化學離子化或電噴霧離子化接口,色譜流出物通過一個位於柱子和離子源之間的加熱限流器轉變爲氣態,進入質譜儀分析。5.毛細管電泳-質譜聯用(CE-MS)
幾乎所有的毛細管電泳操作模式均可與質譜聯用。選擇接口時,應注意毛細管電泳的低流速特點並使用揮發性緩衝液。電噴霧離子化是毛細管電泳與質譜聯用最常用的接口技術。
10.2 二、離子化方式
根據待測化合物的性質及擬獲取的信息類型,可以選擇不同的離子化方式,使待測化合物生成氣態正離子或負離子,進一步質譜分析。某些情況下,進樣和離子化在同一過程中完成,很難明確區分。
10.2.1 1.電子轟擊離子化(EI)
處於離子源的氣態待測化合物分子,受到一束能量(通常是70eV)大於其電離能的電子轟擊而離子化。質譜中往往含有待測化合物的分子離子及具有待測化合物結構特徵的碎片離子。電子轟擊離子化適用於熱穩定的、易揮發化合物的離子化,是氣相色譜-質譜聯用最常用的離子化方式。當採用粒子束或移動帶等接口時,電子轟擊離子化也可用於液相色譜-質譜聯用。
10.2.2 2.化學離子化(Cl)
離子源中的試劑氣分子(如甲烷、異丁烷和氨氣)受高能電子轟擊而離子化,進一步發生離子-分子反應,產生穩定的試劑氣離子,再使待測化合物離子化。化學離子化可產生待測化合物(M)的(M+H)+或(M-H)-特徵離子或待測化合物與試劑氣分子產生的加合離子。與電子轟擊離子化質譜相比,化學離子化質譜中碎片離子較少,適宜於採用電子轟擊離子化無法得到分子質量信息的化合物分析。
10.2.3 3.快原子轟擊(FAB)或快離子轟擊離子化(LSIMS)
高能中性原子(如氬氣)或高能銫離子,使置於金屬表面、分散於惰性黏稠基質(如甘油)中的待測化合物離子化,產生(M+H)+或(M-H)-特徵離子或待測化合物與基質分子的加合離子。快原子轟擊或快離子轟擊離子化非常適合於各種極性的、熱不穩定化合物的分子質量測定及結構表徵,廣泛應用於分子量高達10000的肽、抗生素、核苷酸、脂質、有機金屬化合物及表面活性劑的分析。
快原子轟擊(FAB)或快離子轟擊離子化用於液相色譜-質譜聯用時,需在色譜流動相中添加1%~10%的甘油,且必須保持很低流速(1~10μl/min)。
10.2.4 4.基質輔助激光解吸離子化( MALDI)
將溶於適當基質中的供試品塗布於金屬靶上,用高強度的紫外或紅外脈衝激光照射,使待測化合物離子化。基質輔助激光解吸離子化主要用於分子量在100000以上的生物大分子分析,適宜與飛行時間分析器結合使用。
10.2.5 5.電噴霧離子化(ESI)
離子化在大氣壓下進行。待測溶液(如液相色譜流出物)通過一終端加有幾千伏高壓的毛細管進入離子源,氣體輔助霧化,產生的微小液滴去溶劑,形成單電荷或多電荷的氣態離子。這些離子再經逐步減壓區域,從大氣壓狀態傳送到質譜儀的高真空中。電噴霧離子化可在1μl/min~1ml/min流速下進行,適合極性化合物和分子量高達100000的生物大分子研究,是液相色譜-質譜聯用、毛細管電泳-質譜聯用最成功的接口技術。
反相高效液相色譜常用的溶劑,如水、甲醇和乙腈等都十分有利於電噴霧離子化,但純水或純有機溶劑作爲流動相不利於去溶劑或形成離子;在高流速情況下,流動相含有少量水或至少20%~30%的有機溶劑有助於獲得較高的分析靈敏度。
10.2.6 6.大氣壓化學離子化(APCI)
原理與化學離子化相同,但離子化在大氣壓下進行。流動相在熱及氮氣流的作用下霧化成氣態,經由帶有幾千伏高壓的放電電極時離子化,產生的試劑氣離子與待測化合物分子發生離子-分子反應,形成單電荷離子。正離子通常是
(M+H)+,負離子則是(M-H)-。大氣壓化學離子化能夠在流速高達2ml/min下進行,是液相色譜-質譜聯用的重要接口之一。
電噴霧離子源與大氣壓化學離子源常共用一個真空接口,很容易相互更換。選擇電噴霧離子化還是大氣壓化學離子化,分析者不僅要考慮溶液(如液相色譜流動相)的性質、組成和流速,待測化合物的化學性質也至關重要。電噴霧離子化更適合於在溶液中容易電離的極性化合物,容易形成多電荷離子的化合物和生物大分子(如蛋白質、多肽等)可以採用電噴霧離子源。大氣壓化學離子化常用於分析分子量小於1500的小分子或弱極性化合物(如甾醇類和類胡蘿蔔素等),主要產生的是(M+H)+或(M-H)-離子,很少有碎片離子。
相對而言,電噴霧離子化更適合於熱不穩定的樣品,而大氣壓化學離子源易與正相液相色譜聯用。許多中性化合物同時適合於電噴霧離子化及大氣壓化學離子化,且均具有相當高的靈敏度。無論是電噴霧離子化還是大氣壓化學離子化,選擇正離子(Positive ion)或負離子(Negative ion)電離模式,主要取決於待測化合物自身性質。
10.3 三、質量分析器
在高真空狀態下,質量分析器將離子按質荷比分離。質量範圍、分辨率是質量分析器的兩個主要性能指標。質量範圍指質譜儀所能測定的質荷比的範圍,分辨率表示質譜儀分辨相鄰的、質量差異很小的峯的能力。常用的質量分析器有扇形磁場分析器、四極杆分析器、離子阱分析器、飛行時間分析器和傅里葉變換分析器。
10.3.1 1.扇形磁場分析器
離子源中產生的離子經加速電壓(V)加速,聚焦進入扇形磁場(磁場強度B)。在磁場的作用下,不同質荷比的離子發生偏轉,按各自的曲率半徑(r)運動:
m/z=B2r2/2V
改變磁場強度,可以使不同質荷比的離子具有相同的運動曲率半徑(r),進而通過狹縫出口,達到檢測器。
扇形磁場分析器可以檢測分子量高達15000的單電荷離子。當與靜電場分析器結合、構成雙聚焦扇形磁場分析器時,分辨率可達到105。
10.3.2 2.四極杆分析器
分析器由四根平行排列的金屬桿狀電極組成。直流電壓(DC)和射頻電壓(RF)作用於電極上,形成了高頻振盪電場(四極場)。在特定的直流電壓和射頻電壓條件下,僅一定質荷比的離子可以穩定地穿過四極場,到達檢測器。改變直流電壓和射頻電壓大小,但維持它們的比值恆定,可以實現質譜掃描。
四極杆分析器可檢測的分子量上限通常達4000,分辨率約爲103。
10.3.3 3.離子阱分析器
四極離子阱(QIT)由兩個端蓋電極和位於它們之間的環電極組成。端蓋電極處在地電位,而環電極上施加射頻電壓(RF),以形成三維四極場。選擇適當的射頻電壓,四極場可以儲存質荷比大於某特定值的所有離子。採用“質量選擇不穩定性”模式,提高射頻電壓值,可以將離子按質量從高到低依次射出離子阱。揮發性待測化合物的離子化和質量分析可以在同一四極場內完成。通過設定時間序列,單個四極離子阱可以實現多級質譜(MSn)的功能。
線性離子阱(LIT)是二維四極離子阱,結構上等同於四極質量分析器,但操作模式與三維離子阱相似。四極線性離子阱具有更好的離子儲存效率和儲存容量,可改善的離子噴射效率及更快的掃描速度和較高的檢測靈敏度。
由電噴霧離子化或基質輔助激光解吸離子化產生的生物大分子離子,可以藉助離子引導等方式,進入離子阱分析器分析。離子阱分析器與四極杆分析器具有相近的質量上限,分辨率爲103~104。
10.3.4 4.飛行時間分析器( TOF)
具有相同動能、不同質量的離子,因飛行速度不同而實現分離。當飛行距離一定時,離子飛行需要的時間與質荷比的平方根成正比,質量小的離子在較短時間到達檢測器。爲了測定飛行時間,將離子以不連續的組引入質量分析器,以明確起始飛行時間。離子組可以由脈衝式離子化(如基質輔助激光解吸離子化)產生,也可通過門控系統將連續產生的離子流在給定時間引入飛行管。
現代飛行時間分析器具有質量分析範圍寬(分子量上限約15000)、離子傳輸效率高(尤其是譜圖獲取速度快)、檢測能力多重、儀器設計和操作簡便、質量分辨率高(約爲104)的特點,已成爲生物大分子分析的主流技術。
10.3.5 5.傅里葉變換分析器( FTMS)
離子在一定強度的磁場中作迴旋運動,運行軌道隨着共振交變電場而改變。當交變電場的頻率和離子迴旋頻率相同時,離子被穩定加速,軌道半徑越來越大,動能不斷增加。關閉交變電場,軌道上的離子在電極上產生交變的像電流。利用計算機進行傅里葉變換,將像電流信號轉換爲頻譜信號,獲得質譜。
待測化合物的離子化和質量分析可以在同一分析器內完成。傅里葉變換分析器適用於分子量高於10000的化合物,分辨率可高達106,質荷比測定精確到千分之一。
10.4 四、串聯質譜法
串聯質譜法(MS-MS)是時間上或空間上兩級以上質量分析的結合。空間串聯由兩個以上的質量分析器構成,如三級四極杆串聯質譜,其中第一級質量分析器(MS1)選取的前體離子,進入碰撞室活化、裂解,產生的碎片離子被第二級質量分析器(MS2)分析、獲得MS-MS譜。在時間串聯質譜中,前體離子的選取、裂解及碎片離子的分析在同一質量分析器(如四極離子阱分析器)中完成。前體離子的裂解可以通過亞穩裂解、碰撞誘導解離、表面誘導解離、激光誘導解離等方式實現。
串聯質譜法並不侷限於兩級質譜分析,多級質譜實驗常表示爲MSn。實際應用中,串聯質譜法可以通過產物離子掃描(Product-ion scan)、前體離子掃描(Precursor-ion scan)、中性丟失掃描(Neutral-loss scan)及選擇反應檢測(Selected-reaction monitoring,SRM)等方式獲取數據,但值得注意的是時間串聯質譜儀不能進行前體離子掃描和中性丟失掃描。
串聯質譜技術在未知化合物的結構解析、複雜混合物中待測化合物的鑑定、碎片裂解途徑的闡明以及低濃度生物樣品的定量分析方面具有很大優勢。在藥物領域的應用也很多,如通過產物離子掃描,可以獲得藥物、雜質或污染物的前體離子的結構信息,有助於未知化合物的鑑定;產物離子掃描還可用於肽和蛋白質碎片的氨基酸序列檢測。當質譜與氣相色譜或液相色譜聯用時,若色譜儀未能將化合物完全分離,串聯質譜法可以通過選擇性的測定某組分的特徵性前體離子,獲取該組分的結構和量的信息,而不會受到共存組分的干擾。
在藥物代謝研究中,串聯質譜技術可用於尋找具有相同結構特徵的代謝物分子。由於代謝物可能包含作爲中性碎片丟失的相同基團(如羧酸類均易丟失中性二氧化碳分子),採用中性丟失掃描可以發現所有可能的代謝物。若丟失的相同碎片是離子,則前體離子掃描方式可幫助找到所有丟失該碎片離子的前體離子。
選擇反應離子檢測(SRM)可消除生物基質對低濃度待測化合物定量分析的干擾。如藥物代謝動力學研究中,待測藥物的某離子信號可能被基質中其他化合物的離子信號掩蓋,通過MS1和MS2選擇性的檢測特徵的前體離子和產物離子,可實現待測物的專屬、靈敏分析。
10.5 五、信號檢測和數據獲取
來自質量分析器的離子束經檢測器轉化爲電信號、放大,再由數據處理系統儲存並顯示爲質譜圖。通過測定待測化合物離子的質荷比和相對丰度,質譜法可以實現對供試品的定性和定量分析。
中性分子丟失或捕獲一個電子,即形成了一個與母體分子質量相同的分子離子。通過高分辨質譜儀(分辨率>104)或使用參照化合物峯匹配測定,可以獲得待測化合物的分子組成和分子質量信息。分子離子斷裂不同的鍵產生各種碎片離子,裂解模式(或碎片模式)與分子結構有關。通過測定碎片離子的質量及其相對丰度,獲取裂解特徵,可以推測或確證待測化合物的分子結構。
通過測定某一特定離子或多個離子的丰度,並與已知標準物質的響應比較,質譜法可以實現高專屬性的定量分析。外標法和內標法是質譜常用的定量方法,內標法具有更高的準確度。質譜法所用的內標化合物可以是待測化合物的結構類似物或穩定同位素標記物。前者的優點是費用較低,但使用穩定同位素(如2H、13C、15N)標記物可以獲得更高的分析精密度和準確度,尤其當採用FAB或LC-MS離子化技術(如電噴霧離子化)時。穩定同位素標記物是指標記物在樣品製備、分離、離子化的過程中,始終保留同位素標記。
相對於全掃描技術,選擇性離子檢測(SIM)用於定量分析更具優勢。SIM技術使質譜儀將更多的時間用於檢測選定質荷比離子的離子流,因而提高了分析靈敏度。選擇反應檢測(SRM)是複雜混合物中微量待測化合物準確定量的重要技術手段。當同時檢測兩對及以上的前體離子一產物離子時,選擇反應檢測(SRM)又稱爲多反應監測(MRM),可以同時、專屬、靈敏地定量測定供試品中多個組分。
11 附錄Ⅸ K 核磁共振波譜法
核磁共振(NMR)波譜是一種基於特定原子核在外磁場中吸收了與其裂分能級間能量差相對應的射頻場能量而產生共振現象的分析方法。核磁共振波譜通過化學位移值、譜峯多重性、偶合常數值、譜峯相對強度和在各種二維譜及多維譜中呈現的相關峯,提供分子中原子的連接方式、空間的相對取向等定性的結構信息。核磁共振定量分析以結構分析爲基礎,在進行定量分析之前,首先對化合物的分子結構進行鑑定,再利用分子特定基團的質子數與相應譜峯的峯面積之間的關係進行定量測定。
帶正電荷的原子核在作自旋運動時,可產生磁場和角動量,其磁性用核磁矩μ表示,角動量P的大小與自旋量子數I有關(核的質量數爲奇數,I爲半整數;核的質量數爲偶數,I爲整數或0),其空間取向是量子化的;μ也是一個矢量,方向與P的方向重合,空間取向也是量子化的,取決於磁量子數m的取值(m=I,I-1,……-I,共有2I+1個數值)。對於1H、13C等I=1/2的核,只有兩種取向,對應於兩個不同的能量狀態,粒子通過吸收或發射相應的能量在兩個能級間躍遷。
當自旋量子數I≠0的磁核處於一個均勻的外磁場H0中時,磁核因受到磁場的作用力而圍繞着外磁場方向作旋轉運動,同時仍然保持本身的自旋。這種運動方式稱爲拉摩進動。原子核的進動頻率由下式決定:
ω0=γH0
其中γ爲旋磁比,是原子核的基本屬性之一。不同原子核的γ值不同,其值越大,核的磁性越強,在核磁共振中越容易被檢測。如果提供一個射頻場,其頻率(ν)滿足:
△E=hν=μH0/I
其中h爲普朗克常數,則:
v=ω0/2π=γH0/2π
即射頻場的頻率正好等於在磁場H0中的核進動頻率,那麼核就能吸收這一射頻場的能量,導致在兩個能級間躍遷,產生核磁共振現象。
核磁共振波譜是一專屬性較好但靈敏度較低的分析技術。低靈敏度的主要原因是基態和激發態的能量差非常小,通常每十萬個粒子中兩個能級間只差幾個粒子(當外磁場強度約爲2T時)。
11.1 核磁共振波譜儀
常見的有兩類核磁共振波譜儀:經典的連續波(CW)波譜儀和現代的脈衝傅里葉變換(PFT)波譜儀,目前使用的絕大多數爲後者。其組成主要包含超導磁體、射頻脈衝發射系統、核磁信號接收系統和用於數據採集、儲存、處理以及譜儀控制的計算機系統(如圖)。
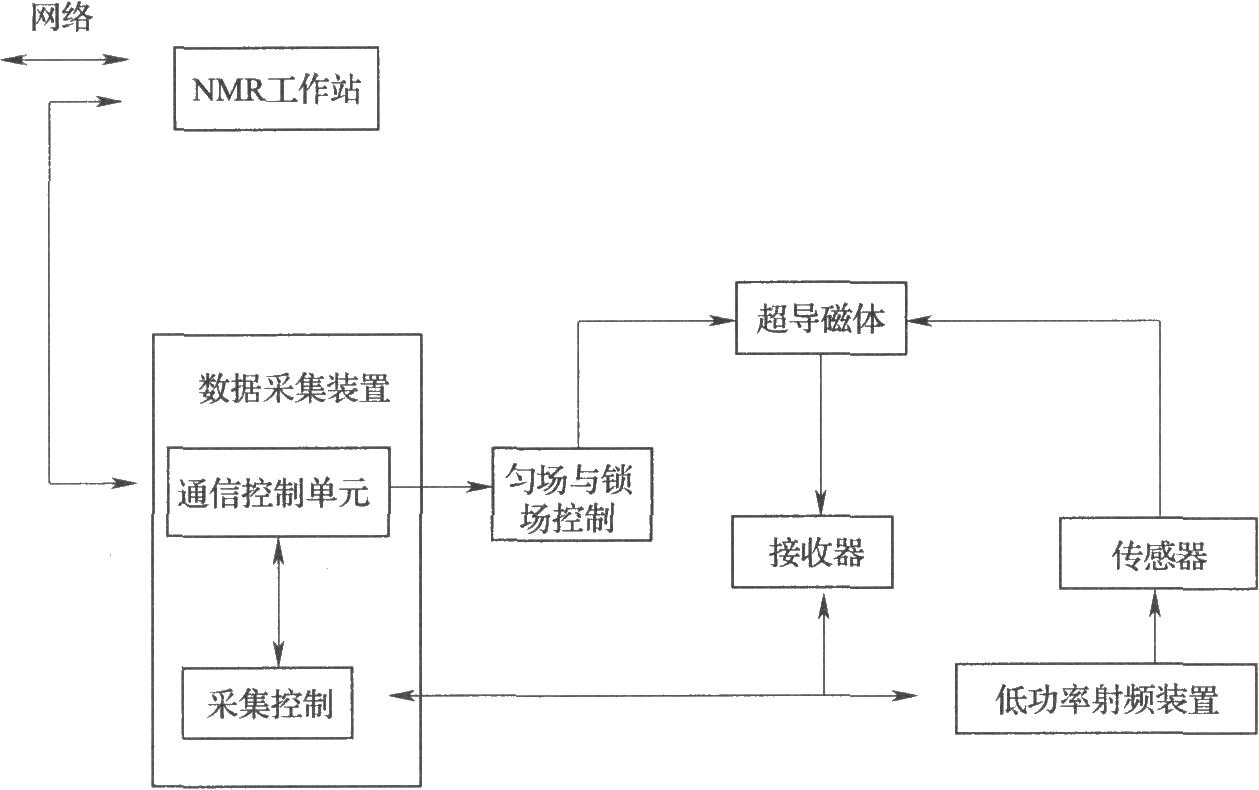
圖PFT核磁共振波譜儀的主要組成
在脈衝核磁共振波譜儀上,一個覆蓋所有共振核的射頻能量的脈衝將同時激發所有的核,當被激發的核回到低能態時產生一個自由感應衰減(FID)信號,它包含所有的時間域信息,經模數轉換後通過計算機進行傅里葉變換得到頻(率)譜。
實驗中按照儀器操作規程設置譜儀參數,如脈衝傾倒角和與之對應的脈衝強度、脈衝間隔時間、數據採樣點(分辨率)、採樣時間等。採集足夠的FIDs,由計算機進行數據轉換,調整相位使盡可能得到純的吸收峯,用參照物校正化學位移值,用輸出設備輸出譜圖。
11.2 核磁共振譜
核磁共振信號(峯)可提供四個重要參數:化學位移值、譜峯多重性、偶合常數值和譜峯相對強度。處於不同分子環境中的同類原子核具有不同的共振頻率,這是由於作用於特定核的有效磁場由兩部分構成:由儀器提供的特定外磁場以及由核外電子雲環流產生的磁場(後者一般與外磁場的方向相反,這種現象稱爲“屏蔽”)。處於不同化學環境中的原子核,由於屏蔽作用不同而產生的共振條件差異很小,難以精確測定其絕對值,實際操作時採用一參照物作爲基準,精確測定樣品和參照物的共振頻率差。在核磁共振波譜中,一個信號的位置可描述爲它與另一參照物信號的偏離程度,稱爲化學位移。
共振頻率與外磁場強度H0成正比,磁場強度不同,同一化學環境中的核共振頻率不同。爲了解決這個問題,採用位移常數δ來表示化學位移:
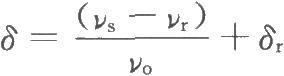
νr爲參照物中磁核的共振頻率;
νo爲儀器的輸出頻率,MHz;
δr爲參照物的化學位移值。
常用的化學位移參照物是四甲基硅烷(TMS),其優點是化學惰性;單峯;信號處在高場,與絕大部分樣品信號之間不會互相重疊干擾;沸點很低(27℃),容易去除,有利於樣品回收。而對於水溶性樣品,常用3-三甲基硅基丙酸鈉-d4(TSP)或2,2-二甲基-2-硅戊基-5-磺酸鈉(DSS),其化學位移值也非常接近於零。DSS的缺點是其三個亞甲基質子有時會干擾被測樣品信號,適於用作外參考。
化學位移僅表示了磁核的電子環境,即核外電子雲對核產生的屏蔽作用,但未涉及同一分子中磁核間的相互作用。這種磁核間的相互作用很小,對化學位移沒有影響,但對譜峯的形狀有着重要影響。這種磁核之間的相互干擾稱爲自旋-自旋偶合,由自旋偶合產生的多重譜峯現象稱爲自旋裂分,裂分間距(赫茲)稱爲偶合常數J,偶合常數與外磁場強度無關。偶合也可發生在氫核與其他核(I≠0)之間,如19F、13C和31P等。
核磁共振信號的另一個特徵是它的強度。在合適的實驗條件下(見“測定方法”),譜峯面積或強度正比於引起此信號的質子數,因此可用於測定同一樣品中不同質子或其他核的相對比例,以及在加入內標後進行核磁共振定量分析。
11.3 測定方法
在熟悉核磁共振理論的基礎上,應多瞭解樣品的性質,並嚴格遵守操作規程,正確操作儀器。不正確的樣品製備、譜儀調整及參數設置會導致譜圖數據的分辨率和靈敏度降低,甚至給出假峯和錯誤數據。
通常應用最多的是1H(質子)核磁共振波譜,其他還包括19F、31P、13C核磁共振波譜以及各種二維譜等。測定前,一般須先將供試品製成合適的溶液。
11.3.1 溶劑選擇
合適的溶劑除了對樣品有較好的溶解度外,其殘留的信號峯應不干擾所分析樣品的信號峯。氘代溶劑同時提供異核鎖信號。應儘可能使用高氘代度、高純度的溶劑,並注意氘原子會對其他原子信號產生裂分。常用的核磁共振波譜測定用氘代溶劑及其殘留質子信號的化學位移見下表。
溶劑名稱 | 殘留質子信號δ(ppm) | 可能殘留的水峯δ(ppm)* | |
氘代三氯甲烷 氘代甲醇 氘代丙酮 氘代二甲基亞碸 氘代乙腈 氘代苯 氘代二氧六環 氘代乙酸 氘代三氟乙酸 氘代吡啶 | CDCl3 CD3OD (CD3)2CO DMSO-d6 CD3CN C6D6 D2O 二氧六環-d8 CD3CO2D CF3CO2D C5D5N DMF-d7 | 7.26 3.31 2.05 2.50 1.94 7.16 / 3.55 2.05, 8.5* 12.5* 7.18, 7.55, 8.70 2.77, 2.93, 8.05 | 1.56 4.87 2.84 3.33 2.13 / 4.79 / / / 4.80 / |
*活潑質子的化學位移值是可變的,取決於溫度和溶質的變化。適用於氫譜(1H NMR)的溶劑同樣也適用於氟譜(19FNMR),常見的有CDCl3、CD3OD、D2O、DMSO-d6、DMF-d7、酸和鹼等,通常不含氟的溶劑均可使用。同時應注意含氟樣品中氟原子對其他核的J-偶合。
11.3.2 樣品製備
按各品種項下的要求。樣品的濃度取決於實驗的要求及儀器的類型,測定非主要成分時需要更高的濃度。供試液的體積取決於樣品管的大小及儀器的要求,通常樣品溶液的高度應達到線圈高度的2倍以上。選用符合定量要求的核磁管,常用外徑爲5mm或10mm,長度爲15cm或20cm的核磁管。當樣品量較少時可選用微量核磁管。
11.3.3 測定
將樣品管放入譜儀中,先進行樣品和譜儀的調諧,再仔細對譜儀勻場,使譜儀達到最佳工作狀態。設置合適的實驗參數,採樣,完成後再進行圖譜處理,並分段積分。
同一個實驗通常可同時得到定性和定量數據。對於核磁共振定量分析,實驗參數的正確設置非常重要,以保證每個峯的積分面積與質子數成正比。必須保證有足夠長的弛豫時間,以使所有激發核都能完全弛豫,因而定量分析通常需要更長的實驗時間。
11.3.4 定性和定量分析
核磁共振波譜分析可廣泛應用於結構確證,熱力學、動力學和反應機理的研究,以及用於定量分析。
11.3.4.1 1.定性分析
核磁共振波譜是一個非常有用的結構解析工具,化學位移提供原子核環境信息,譜峯多重性提供相鄰基團情況以及立體化學信息,偶合常數值大小可用於確定基團的取代情況,譜峯強度(或積分面積)可確定基團中質子的個數等。一些特定技術,如雙共振實驗、化學交換、使用位移試劑、各種二維譜等,可用於簡化複雜圖譜、確定特徵基團以及確定偶合關係等。
對於結構簡單的樣品可直接通過氫譜的化學位移值、偶合情況(偶合裂分的峯數及偶合常數)及每組信號的質子數來確定,或通過與文獻值(圖譜)比較確定樣品的結構,以及是否存在雜質等。與文獻值(圖譜)比較時,需要注意一些重要的實驗條件,如溶劑種類、樣品濃度、化學位移參照物、測定溫度等的影響。對於結構複雜或結構未知的樣品,通常需要結合其他分析手段,如質譜等方能確定其結構。
11.3.4.2 2.定量分析
與其他核相比,1H核磁共振波譜更適用於定量分析。在合適的實驗條件下,兩個信號的積分面積(或強度)正比於產生這些信號的質子數:

式中A1、A2爲相應信號的積分面積(或強度);N1、N2爲相應信號的總質子數。
如果兩個信號來源於同一分子中不同的官能團,式(1)可簡化爲:

式中,n1、n2分別爲相應官能團中的質子數。如果兩個信號來源於不同的化合物,則
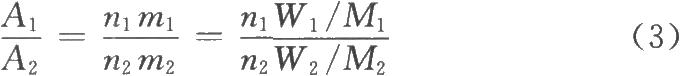
式中m1、m2分別爲化合物1和化合物2的分子個數;W1、W2分別爲其質量;
M1、M2分別爲其分子量。
由式(2)和(3)可知,核磁共振波譜定量分析可採用絕對定量和相對定量兩種模式。
在絕對定量模式下,將已精密稱定重量的樣品和內標混合配製溶液,測定,通過比較樣品特徵峯的峯面積與內標峯的峯面積計算樣品的含量(純度)。合適的內標應滿足如下要求:有合適的特徵參考峯,最好是適宜寬度的單峯;內標物的特徵參考峯與樣品峯分離;能溶於分析溶劑中;其質子是等權重的;內標物的分子量與特徵參考峯質子數之比合理;不與待測樣品相互作用等。常用的內標物有:1,2,4,5-四氯苯、1,4-二硝基苯、對苯二酚、對苯二酸、苯甲酸苄酯、順丁烯二酸等。內標物的選擇依據樣品性質而定。
相對定量模式主要用於測定樣品中雜質的相對含量(或混合物中各成分相對含量),由式(3)來計算。
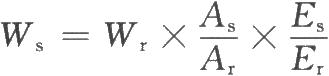
式中Wr爲內標物的重量;
As和Ar分別爲供試品特徵峯和內標峯的平均峯面積;
Es和Er分別爲供試品和內標物的質子當量重量(質量)(以分子量除以特徵峯的質子數計算得到)。
11.3.4.2.1 (2)相對定量模式
由下式計算供試品中各組分的摩爾百分比:式中A1和A2分別爲各品種項下所規定的各特徵基團共振峯的平均峯面積;n1、n2分別爲各特徵基團的質子數。
