2 註解
在一定溫度下,難溶電解質在它的飽和溶液中達成溶解平衡時,離子濃度(嚴格說應爲離子活度)的冪乘積,叫溶度積,習慣上用Ksp表示。例如MmNn(固體) mMnnNm-,。則有Ksp=[Mn]m[Nm-]n。溶度積數值的大小表示電解質在溶劑中的溶解能力。在一定溫度下,一種物質的Ksp是常數。例如在25℃,Ksp(AgCl)=1.56×10-10,Ksp(CaCO3)=8.7×10-9。難溶電解質在溶劑中,當溶解和沉澱的速率相等時,便在固體和溶液中離子間達成動態平衡,這時的溶液是飽和溶液。根據平衡移動原理,可以得到:(1)當[Mn]m[Nm-]n>Ksp時,溶液呈過飽和狀態,將析出沉澱。(2)當[Mn]m[Nm-]n=Ksp時,溶液呈飽和狀態,表面上看溶液中既沒有沉澱析出,沉澱也不溶解。(3)當[Mn]m[Nm-]n<Ksp時,溶液呈不飽和狀態,存在於溶液中的沉澱將溶解。這三條規律合起來就叫溶度積原理。它是解決難溶電解質溶解問題的依據。根據溶度積的值可以估計和比較同類難溶電解質的溶解度大小:溶度積越小,表示該物質溶解度越小;還可以判斷在一定條件下沉澱的生成和溶解的可能性以及判斷體系中有多種離子共存時各種離子生成沉澱的先後次序。
mMnnNm-,。則有Ksp=[Mn]m[Nm-]n。溶度積數值的大小表示電解質在溶劑中的溶解能力。在一定溫度下,一種物質的Ksp是常數。例如在25℃,Ksp(AgCl)=1.56×10-10,Ksp(CaCO3)=8.7×10-9。難溶電解質在溶劑中,當溶解和沉澱的速率相等時,便在固體和溶液中離子間達成動態平衡,這時的溶液是飽和溶液。根據平衡移動原理,可以得到:(1)當[Mn]m[Nm-]n>Ksp時,溶液呈過飽和狀態,將析出沉澱。(2)當[Mn]m[Nm-]n=Ksp時,溶液呈飽和狀態,表面上看溶液中既沒有沉澱析出,沉澱也不溶解。(3)當[Mn]m[Nm-]n<Ksp時,溶液呈不飽和狀態,存在於溶液中的沉澱將溶解。這三條規律合起來就叫溶度積原理。它是解決難溶電解質溶解問題的依據。根據溶度積的值可以估計和比較同類難溶電解質的溶解度大小:溶度積越小,表示該物質溶解度越小;還可以判斷在一定條件下沉澱的生成和溶解的可能性以及判斷體系中有多種離子共存時各種離子生成沉澱的先後次序。
BA(s)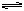 B (aq) A-(aq)
B (aq) A-(aq)

Kspφ稱爲標準溶度積常數,簡稱溶度積。若向難溶鹽BA中加水,當B ,A-離子的濃度之積小於溶度積Kspφ時,沉澱溶解;等於溶度積時達到飽和。若將含B 離子與A-離子的溶液混合,其離子濃度的乘積大於溶度積時,超過的部分就變成難溶性鹽BA沉澱出來。綜上所述歸納如下:
1){c(B )/cφ}{c(A-)/cφ}<{Kspφ(BA)}不飽和溶液,無沉澱;
2){c(B )/cφ}{c(A-)/cφ}={Kspφ(BA)}飽和溶液;
3){c(B )/cφ}{c(A-)/cφ}>{Kspφ(BA)}沉澱從溶液中析出。以上3點就是溶度積規則,用來判斷沉澱的生成與溶解能否發生。
若在難溶鹽BA的飽和溶液中,加入同種離子(例如B 或A-),則{c(B )/cφ}{c(A-)/cφ}>{Kspφ(BA),剩餘離子形成BA沉澱下來。難溶鹽的溶解度由於共同離子的存在而減少,稱爲同離子效應,即由於同離子效應使溶解平衡向左(生成固體方向)移動:
BA(s)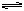 B (aq) A-(aq)
B (aq) A-(aq)
若在難溶鹽BA的飽和溶液中,加入易溶鹽如KNO3,BA的溶解度增大,這種效應叫做鹽效應。
假如加入的鹽能產生同離子效應,又能產生鹽效應的話,同離子效應大於鹽效應。
難溶鹽以通式BxAy表示,則
BxAy(s)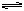 xB (aq) yA-(aq)
xB (aq) yA-(aq)
Kspφ(BxAy)={c(B )/cφ}x{c(A-)/cφ}y