1 拼音
huà zhuāng pǐn zhōng guò yǎng huà qīng de jiǎn cè fāng fǎ
《化妝品中過氧化氫的檢測方法》由國家食品藥品監督管理局於2012年1月18日國食藥監保化[2012]13號發佈。
3 2 方法提要
試樣採用水浸提,部分上清液與三苯基膦衍生反應,衍生溶液經濾膜過濾,用液相色譜分離,紫外檢測器檢測,峯面積定量,以標準曲線法計算含量,得到樣品中過氧化氫的含量。本方法對過氧化氫的檢出限爲0.0012μg,定量下限爲0.004μg。若取0.2g樣品,過氧化氫的最低檢出濃度爲60μg /g,最低定量濃度爲200μg /g 。
4 3 試劑和溶液
除非另有說明,所用試劑均爲分析純,水爲一級實驗用水。
3.1 乙腈,色譜純。
3.2 三苯基膦溶液,稱取三苯基膦1.3g,用乙腈(3.1)溶解,定容至25mL,濃度爲0.2mol/L,現用現配。
3.3 氧化三苯基膦溶液,稱取氧化三苯基膦0.0003g,用乙腈(3.1)溶解,定容至100mL,濃度爲0.00001mol/L。
3.4 過氧化氫,濃度爲3%,使用前需要進行標定,標定方法見附錄。
3.5 過氧化氫標準儲備液:稱取標定過的過氧化氫對照品(3.4)1.5g,精確到0.0001g,置於25 mL棕色容量瓶中,用水定容,搖勻,配製成質量濃度爲1.8mg/mL的標準儲備溶液。
3.6 過氧化氫標準工作液:配製濃度分別爲3.6mg/L、9.0 mg/L、18mg/L、36mg/L、54 mg/L、90 mg/L、180 mg/L的標準工作液。
6 5 分析步驟
5.1 樣液的製備
5.1.1 樣品前處理
稱取樣品約0.05g~0.2g(精確至0.001g),含過氧化氫3%以下稱取0.2g,含過氧化氫3%~6%稱取0.1g,含過氧化氫6%~12%稱取0.05g,置於100mL容量瓶中,加入約50 mL水,振搖至樣品完全溶解,用水定容,搖勻備用。面膜等半固體樣品可以稱取樣品於50mL燒杯,加入約20mL,用玻璃棒將樣品攪碎,用水轉移至100mL容量瓶中,定容,搖勻備用。
分別移取過氧化氫標準工作液(3.6)和樣液(5.1.1)各1mL於10mL棕色容量瓶中,加入1mL三苯基膦乙腈溶液(3.2),振搖,繼續加入5mL乙腈(3.1),振搖,用水定容,搖勻。置於暗處室溫反應30min。
5.2 測定
5.2.1 色譜參考條件
色譜柱:C18色譜柱,4.6mm ×250 mm,5 mm;
流動相:乙腈+水(60+40)(體積比);
流速:1.0mL/min;
檢測波長:225nm;
進樣量:10mL。
5.2.2 標準曲線的繪製
吸取10mL氧化三苯基膦溶液(3.3),注入高效液相色譜儀,確定氧化三苯基膦的保留時間。衍生化反應結束後,立即開始色譜分析,分別吸取10mL過氧化氫標準工作液衍生液(5.1.2)注入高效液相色譜儀,2h內完成上機分析。在上述色譜條件下測定其峯面積,記錄氧化三苯基膦的峯面積,以標準溶液濃度爲橫座標、氧化三苯基膦的峯面積爲縱座標,繪製標準工作曲線。
衍生化反應結束後,立即開始色譜分析,吸取10mL樣液(5.1.2)注入高效液相色譜儀,2h內完成上機分析。在上述色譜條件下測定其峯面積。利用迴歸方程式計算樣液中過氧化氫的濃度。
5.3 平行實驗
10 附錄:過氧化氫含量的標定方法
10.1 1 範圍
10.2 2 過氧化氫含量的測定原理
H2O2分子中含有一個過氧鍵—O—O—,既可在一定條件下作爲氧化劑,又可在一定條件下作爲還原劑。在稀H2SO4介質中,室溫條件下KMnO4可將H2O2定量氧化,反應方程式爲:
5H2O2+ 2MnO4-+6H+=2Mn2++ 5O2+ 8H2O
該反應開始時速度較慢,滴入第一滴後溶液不易褪色,隨着反應的進行,生成的Mn2+對反應有催化作用,反應速度加快,故能順利滴定,當滴定到溶液中有稍過量的MnO4-後,溶液出現微紅色顯示終點,通過消耗KMnO4溶液的濃度和體積,可以計算過氧化氫的含量。
10.3 3 試劑和溶液
3.1 硫酸溶液,取10mL濃硫酸緩慢加入150mL水中,搖勻,備用。
稱量1.0g固體KMnO4,置於大燒杯中,加水至300mL(由於要煮沸使水蒸發,可適當多加些水),煮沸約1小時,靜置冷卻後用微孔玻璃漏斗或玻璃棉漏斗過濾,濾液裝入棕色細口瓶中,貼上標籤,一週後標定。保存備用。
準確稱取0.13~0.16g基準物質Na2C2O4三份,分別置於250mL的錐形瓶中,加約30mL水和3mol·L-1H2SO410mL,蓋上表面皿,在石棉鐵絲網上慢慢加熱到70~80℃(剛開始冒蒸氣的溫度),趁熱用高錳酸鉀溶液滴定。開始滴定時反應速度慢,待溶液中產生了Mn2+後,滴定速度可適當加快,直到溶液呈現微紅色並持續半分鐘不褪色即終點。根據Na2C2O4的質量和消耗KMnO4溶液的體積計算KMnO4濃度。用同樣方法滴定其他二份Na2C2O4溶液,相對平均偏差應在0.2%以內。
10.4 4 儀器和設備
4.1 酸式滴定管,50mL。
10.5 5 實驗步驟
稱取 0.3g過氧化氫,精確值0.0001g,置於250mL錐形瓶中,加入20~30mL水,振搖,加入100mLH2SO4溶液,振搖,用KMnO4標準溶液[c(1/5KMnO4)=0.1mol/L]滴定至微紅色,半分鐘內不退色爲終點。記錄消耗KMnO4溶液的體積,平行測定3次,極差應小於0.1mL,根據KMnO4標準溶液濃度和消耗的體積,計算過氧化氫的含量。
10.6 6 計算公式
過氧化氫質量分數按下式計算:
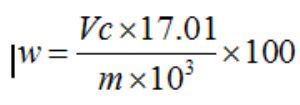
式中:w—— 過氧化氫的質量分數,%;