3 標準基本信息
ICS 11.100
C 50
中華人民共和國衛生行業標準 WS/T 405-2012《血細胞分析參考區間》(Reference intervals for blood cell analysis)由中華人民共和國衛生部於2012年12月25日發佈,自2013年08月01日起實施。
4 標準正文
4.1 前言
本標準按照GB/T 1.1-2009給出的規則起草。
本標準由衛生部臨牀檢驗標準專業委員會提出。
本標準起草單位:中國醫科大學附屬第一醫院、衛生部臨牀檢驗中心、復旦大學附屬中山醫院、北京大學第三醫院、四川大學華西醫院、中國人民解放軍第四軍醫大學附屬第一醫院、廣東省中醫院。
本標準起草人:尚紅、彭明婷、陳文祥、潘柏申、張捷、王蘭蘭、郝曉柯、黃憲章、申子瑜、李臣賓、趙敏、穆潤清。
4.2 1 範圍
本標準適用於醫療衛生機構實驗室血細胞分析檢驗結果的報告和解釋,有關體外診斷廠商也可參照使用。
4.3 2 規範性引用文件
下列文件對於本文件的應用是必不可少的。凡是注日期的引用文件,僅注日期的版本適用於本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改單)適用於本文件。
CLSI EP9-A2 用患者樣本進行方法比較和偏差估計:批准指南——第二版(Method comparison and bias estimation using patient samples:approved guideline-Second edition)
4.4 3 術語和定義
WS/T 402界定的術語和定義適用於本文件。
4.5 4 參考區間
4.2 中國成年人羣血細胞分析參考區間建立過程的相關信息參見附錄A。
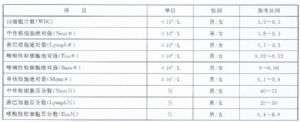
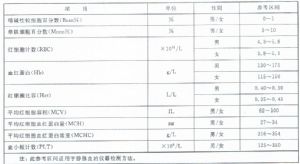
4.6 5 參考區間應用
4.6.1 5.1 一般原則
注1:參考區間建立研究工作量和成本巨大,目前普遍認爲,臨牀實驗室引用參考區間比自己建立參考區間更爲現實、合理。
注2:本參考區間標準基於中國成年人羣多中心研究結果。
5.1.2 使用本文件的參考區間標準前應進行必要的驗證或評估。
注1:外部參考區間在實驗室的適用性主要取決於實驗室檢驗結果和服務人羣與建立參考區間時的檢驗結果和參考人羣的可比性。
注2:只有存在恆定的系統偏倚(檢驗結果正確度)才影響參考區間的適用性,過大的實驗室內變異是實驗室分析質量問題,不是參考區間適用性問題。
4.6.2 5.2 參考區間評估、驗證和使用
5.2.1 按WS/T 402的有關規定進行參考區間評估和驗證。
5.2.2對本實驗室分析質量和服務人羣進行評估,若有理由認爲與參考區間研究的分析質量和參考人羣有足夠可比性,可直接使用本文件的參考區間。
5.2.3若對分析質量和人羣可比性不確定或實驗室管理體系要求對引用的參考區間進行試驗驗證,可按下列步驟進行參考區間驗證:
a) 篩選合格參考個體不少於20名,篩選標準參見附錄A的A.2.2;
c) 按適當方法檢查並剔除離羣值(若有,則另選參考個體補足);
注:離羣值檢驗採用Dixon方法:首先將檢測結果按照大小排序並計算極差R,然後分別計算最大值和最小值與其相鄰數值之差D;若D/R≥1/3,則將最大值或最小值視爲離羣值予以剔除;將餘下數據重複前述步驟進行離羣值檢驗,直至剔除所有離羣值。
d) 如選擇20個合格的參考個體,將20個檢驗結果與參考區間比較,若超出參考區間的數據不超過2個,則通過驗證;若超過2個,則另選20名合格參考個體重新按照上述判斷標準進行驗證。如參考個體多於20個,超出參考區間的數據不超過10%則通過驗證;若超過10%的數據超出參考區間,則另選至少20名合格參考個體,重新按照上述判斷標準進行驗證。驗證結果若符合要求,可直接使用參考區間,否則應查找原因。
5.2.4 驗證本文件參考區間的實驗室分析質量基本要求見附錄B。
4.6.3 5.3 參考區間未通過驗證時的處理程序
5.3.1 對未通過驗證的情況,應首先評價分析質量尤其是正確度,若證實是檢測系統導致的分析質量問題,應改進或更換分析系統。分析質量評價可採用下列方式:
5.3.2 實驗室在引用本文件的參考區間時還應注意下列情況:
a) 新生兒及兒童:白細胞和紅細胞計數結果隨年齡增長有明顯變化;
b) 高海拔地區:高海拔地區人羣血紅蛋白和紅細胞計數等參數的結果明顯高於其他地區;
c) 以末梢採血方式採集時;
d) 由於民族、生活習慣、地區差異等因素造成血細胞分析結果明顯變化。
5 附錄
5.1 附錄A(資料性附錄)參考區間建立過程的相關信息
5.1.1 A.1 參考區間建立
本文件參考區間按WS/T 402的要求採用多中心的研究方式建立,主要包括以下步驟:
a) 選擇參考個體,組成參考樣本組;
5.1.2 A.2 參考個體選擇
A.2.1 參考樣本組的選擇
設計總體參考人羣爲我國成年健康人羣,參考樣本組選自東北、華北、西北、華東、華南和西南6地區城鄉居民,每地區入選參考個體總計約720人,每十歲年齡段的參考個體數至少120人,男女比爲1:1,年齡範圍爲20歲~79歲。
A.2.2 參考個體的選擇
各中心分別在所在地區募集足夠的可能參考個體,徵得知情同意,進行參考個體的篩選組成參考樣本組。
通過問卷調查、體格檢查、實驗室檢查、影像檢查(如胸部透視)檢查篩選參考個體,滿足以下要求:
a) 自覺健康;
b) 無血液系統疾病(貧血、白血病、血小板異常疾病等)、變態反應性疾病(蕁麻疹、支氣管哮喘、過敏性皮炎等)、呼吸系統疾病(急性呼吸道感染、肺結核、慢性阻塞性肺疾病等)、泌尿系統疾病(尿路感染、腎小球腎炎、腎病綜合徵等)、消化系統疾病(腸炎、病毒性肝炎、肝硬化、慢性腹瀉、消化性潰瘍、黃疸等)、風溼性疾病(類風溼性關節炎、系統性紅斑狼瘡等)、甲狀腺疾病(甲狀腺功能亢進症、甲狀腺功能減退症等)、寄生蟲感染、惡性腫瘤和遺傳性疾病、高血壓[收縮壓≥140mmHg和(或)舒張壓≥90mmHg];
c) 近期未曾手術或服用藥物;
f) 無酗酒(長期飲酒或2周內大量飲酒)、嗜煙(吸菸量>20支/d);
g) 近期無劇烈運動或重體力勞動;
h) 無慢性理化損傷(如長期暴露於電離輻射環境)或長期接觸化學物質(苯、鉛等);
5.1.3 A.3 血液樣品採集與處理
血液樣品採集與處理原則按WS/T 225-2009有關要求執行,具體要求如下:
b) 採血:受檢者取坐位,採用真空採血方式自肘前靜脈採血,要求使用含乙二胺四乙酸鹽(EDTA)抗凝劑的採血管;
c) 實驗室排除不合格標本(如採集量不足、肉眼觀察有血凝塊、溶血、脂血、高膽紅素;顯微鏡下有血小板聚集的標本)的影響。
5.1.4 A.4 血液樣品的檢測
按《醫療機構臨牀實驗室管理辦法》及儀器介紹的要求制定所在實驗室的血細胞分析檢測程序並予以實施。
5.1.5 A.5 參考值處理與參考區間建立
A.5.1 可能離羣值檢查:按照Dixon方法檢查並剔除各組離羣值。
A.5.2 分組判斷:按Ichihara等的方法對性別、年齡、地區各組參考值進行組一組檢驗,判斷是否需要分組,同時結合臨牀判斷。將不需分組的參考值合併,確定實際參考樣本組。
A.5.3 參考限和參考區間建立:採用中間95%區間做參考區間。用非參數方法計算各實際參考樣本組參考值的2.5百分位數和97.5百分位數並計算其90%置信區間,根據臨牀意見對參考限進行適當取整形成參考區間。
5.2 附錄B(規範性附錄)驗證與建立血細胞分析參考區間的實驗室分析質量基本要求
5.2.1 B.1 血液分析儀的性能驗證和校準
B.1.1 血液分析儀投入使用前,應按照WS/T 406對其性能進行驗證。
B.1.2 血液分析儀的試劑、校準品和消耗品宜配套使用;使用非配套檢測系統時,應按CLSI EP9-A2的要求與配套檢測系統的結果進行比對。
B.1.3 血液分析儀的校準應符合WS/T 347-2011的要求。
5.2.2 B.2 檢驗程序的質量保證
B.2.1 室內質量控制
B.2.1.1 質控品的選擇:宜使用配套質控品,使用非配套質控品時應評價其質量和適用性;
B.2.1.2 質控品的濃度水平:至少使用2個濃度水平(正常和異常水平)的質控品;
B.2.1.3 質控頻度:應根據實驗室檢驗標本的數量定期實施,檢測當天至少1次;
B.2.1.4 質控數據的管理:質控數據按批次或每月統計1次。
B.2.2 室間質量評價
實驗室應參加衛生部臨牀檢驗中心和(或)當地臨牀檢驗中心組織的室間質量評價並通過。
B.2.3 實驗室內部結果可比性
不同檢測系統應定期(至少半年)進行結果比對。確認血細胞分析各檢測系統的性能指標符合要求後,至少使用20份臨牀樣本(含正常和異常標本)進行比對(可分批進行),比對結果應符合WS/T 406。
6 參考文獻
[1] WS/T 225-2002 臨牀化學檢驗血液標本的收集與處理
[2] 醫療機構臨牀實驗室管理辦法(2006年)衛生部
[3] 葉應嫵,王毓三,申子瑜.全國臨牀檢驗操作規程.3版.南京:東南大學出版社,2006.
[4] Clinical and Laboratory Standards Institute (CLSI). Defining, establishing,and verifying reference intervals in the clinical laboratory; Approved Guideline-Third Edition.CLSI document C28-A3c.CLSI, Wayne,PA, USA, 2010
[5] Lahti A. Partitioning biochemical reference data into subgroups: comparison of existing methods. Clin Chem Lab Med. 2004;42:725-733.
[6] Ichihara K,Boyd JC. An appraisal of statistical procedures used in derivation of reference intervals. Clin Chem Lab Med. 2010 Nov;48(11):1537-51.