7 概述
同種異體小腸移植(簡稱小腸移植)在1964年即開始用於臨牀,由於當時在移植技術、免疫排斥、感染與腸功能恢復等方面沒能很好地解決,阻礙了腸移植進一步在臨牀的應用,成爲大器官移植中成功較晚的一個。1990年,加拿大Grant報道了1例存活1年以上的肝腸聯合移植者,並認爲肝腸移植後可增加免疫耐受性。其後美國Todo比較了肝腸聯合移植與單獨小腸移植,卻認爲後者的技術操作較簡單,術後恢復亦較爲順利。文獻中雖陸續有成功的病例報道,但迄今(2003年)尚不足千例,進展甚爲緩慢。
8 小腸相關解剖
小腸係指胃幽門至盲腸間的腸管,含十二指腸,空腸與迴腸。空腸與迴腸是小腸的主要部分,通稱小腸。空腸與迴腸是腹腔中面積最大,高度活動的器官。起始於Treitz韌帶(十二指腸空腸曲)盤曲於中腹部與下腹部,部分爲大網膜及結腸所覆蓋。若患者無腹部手術史,手術時從左上腹取出的小腸多爲空腸,從盆腔取出者多半爲迴腸。空腸與迴腸間無明顯的分界線,但在結構上有若干區別點(表1.6.5-0-1)。手術時,可藉助這些區別點,辨認空、迴腸。腸管有一定的伸縮性,故在活體與標本測量的長度不一致。一般測量的結果是空、迴腸長6m。現在認爲最適合的方法是從鼻放置細聚乙烯管讓其自然到達回盲部,測量其長度。用此方法測得空、迴腸的長度爲2.6m。小腸上部的2/5爲空腸,下部3/5爲迴腸。

小腸系膜甚寬,附着於第2腰椎左側腹後壁,向右斜行至右骶髂關節之下。腸繫膜內含有血管、神經、淋巴管、淋巴結及脂肪。腸繫膜附着部能防止扭轉,影響循環。手術時,根據系膜的走向能辨別遊離腸段的近、遠端。腸繫膜根部至腸緣的距離在小腸起始部爲最短,末端迴腸部亦較短,而跨過脊柱的部分爲最長,一般不超過20~25cm。
小腸的血供來自上腸繫膜動脈,它是腹主動脈的第2個大分支。上腸繫膜動脈自胰腺的鉤狀突部穿出,跨過十二指腸第3段,進入小腸系膜根部,然後分出右結腸動脈,回結腸動脈和10~20個小動脈分支(圖1.6.5-0-1)。前2支動脈經腹膜後或系膜根部供應升結腸、盲腸及末端迴腸。因此,當腸繫膜上動脈損傷或梗死時,隨損害部分的高低可引起空腸、迴腸、在半結腸或部分空腸、迴腸的缺血壞死。

小腸動脈分支位於小腸系膜內,形成吻合網(動脈弓),再由動脈弓分出直支到達腸壁內。小腸上部系膜動脈弓僅一個(初級弓),直支較長,周圍脂肪較少,愈向遠端小腸動脈弓愈多。由初級弓分出動脈支吻合爲2級、3級弓,動脈直支較短(圖1.6.5-0-2)。系膜內脂肪亦較多。在腸繫膜緣,血管又再分支。腸管壁的血管與環形肌層平行走行,先後穿過漿膜,肌層和黏膜下層。主要的動脈分支與直支被破壞後,這些血管供應的腸管便易發生壞死。

小腸靜脈的分佈與動脈大致相同。最後匯合成爲腸繫膜上靜脈。它與上動脈並行,在胰頸的後方與脾靜脈匯合形成門靜脈。腸繫膜上靜脈損傷或發生栓塞時,也可致小腸靜脈充血、壞死和腹膜炎。
小腸腸壁分爲漿膜、肌肉和黏膜3層。肌肉又分爲外層縱肌和內層環肌。黏膜下層爲較強的彈力纖維與結締組識。不論用哪種方式縫合腸壁,縫線必需通過這一層。
小腸黏膜下層有聚合淋巴結與淋巴板(Peyer’s patches),尤以迴腸部爲多。小腸部的淋巴流入腸壁、鄰近血管弓部與上腸繫膜動脈主幹部等3個部位的淋巴結,然後進入乳糜池。
小腸的主要生理功能是消化和吸收。除胰液、膽液及胃液等可繼續在小腸內起消化作用外,小腸黏膜腺體也能分泌含有多種酶的鹼性腸液。其中主要的是多肽酶(腸肽酶)。它能將多肽變爲可由腸黏膜吸收的氨基酸。食糜在小腸內分解爲葡萄糖、氨基酸、脂肪酸後,即被小腸黏膜吸收。小腸黏膜上有很多絨毛。每一個絨毛被柱狀上皮細胞多層覆蓋,含有一個毛細血管襻和淋巴管(乳糜管),因而使吸收面積大爲增加,構成近10萬m2的吸收面積。葡萄糖、氨基酸及40%脂肪酸系由毛細血管吸收,經過門靜脈到達肝內。其餘60%脂肪酸則由乳糜管吸收,到達乳糜池及胸導管內。除食物外,胃液、膽液、胰液,腸液內的電解質,以及攝入的大量電解質也在小腸內被吸收進入血液循環。小腸被大量切除後,營養的吸收將受到影響。吸收最差的是脂肪,其次是蛋白質。碳水化合物是易被吸收的營養物質。根據臨牀實踐,空腸與迴腸保留100cm以上,並有回盲部,經過機體的代償,仍能維持營養的消化,吸收。末段迴腸對蛋白質、脂肪、碳水化合物有良好的吸收功能,並具有對某些微量物質(銅、維生素B12)與膽汁的特定吸收功能。因此,大量小腸切除後,雖然切除的長度相當,但營養不良在迴腸被切除的病例較爲明顯。
小腸是產生免疫球蛋白的場所,特別是IgA。一般認爲它由laminal propria的血漿細胞產生。
小腸也可以產生縮膽素(cholecys tokinin)、促胰酶素(pancreozymin)、腸高糖素(enteroglucagon)、腸血管活性肽(VIP vasoactive intestinal peptide)、胃抑制多肽(GIP gastric inhibitory polypetide)、生長抑素(somatostatin)等物質。這些物質直接影響消化系統其他器官如膽囊、胰腺等的功能。
腸黏膜尚具有屏障功能,能阻擋腸腔內細菌、毒素越過腸壁進入淋巴系統或門靜脈內。
小腸由自主神經系統支配。交感神經纖維自第9、第10脊髓節分出,進入上腸繫膜神經節。節後神經伴隨腸繫膜上動脈進入小腸。副交感神經節前纖維通過迷走神經與腸內神經叢的神經元相接。刺激副交感神經,則增加腸管之張力和運動及腸腺分泌。刺激交感神經,則腸管之張力鬆弛,運動受抑制,且血管收縮。腸內神經包括腸肌內Auerbach神經叢和黏膜下Meissner神經叢兩部分。刺激腸肌叢部分使腸管平滑肌收縮,刺激黏膜下叢部分抑制平滑肌。
小腸的肌肉有節段性收縮和蠕動兩種運動型式。前者是局部周徑收縮。上段小腸每分鐘約收縮9次,遠段小腸每分鐘收縮11次。這一動作使腸內容物得到攪拌,使之與更大範圍的黏膜相接觸。蠕動爲小腸自上而下的收縮,每分鐘1或2次,1次數釐米。在消化吸收過程,小腸有自上而下的環形收縮,起自胃或十二指腸,每分鐘推移6~8cm,每次持續4~5min。小腸的運動受肌漿蛋白因子(myogentic factor)、神經原性因子(neurogenic factor)與內分泌因子(hormonal factors)的調控。
綜上所述,小腸是人體吸收營養的主要器官,它具有極其強大的代償功能。儘管如此,外科醫師在處理小腸病變時,仍應考慮到這些功能的重要性,要儘量保留可保留的腸管。
9 適應症
小腸移植被認爲是治療不可逆轉腸衰竭的合理方法,腸衰竭是指那些病人的腸道因解剖或功能的關係而不能維持機體最低的營養需要甚至水、電解質的平衡。它包含短腸綜合徵、廣泛慢性炎性腸道疾病、嚴重系膜血管疾病,腸神經、肌肉以及先天性腸道畸形。
10 禁忌症
由於小腸移植是一複雜的手術。因此,它除有一般腹部大手術的禁忌證外,對腹腔內有廣泛粘連;原已有不適宜於應用免疫抑制劑的疾病;高度營養不良已損及重要器官以及高齡體弱患者(>50歲)應慎重選擇。
11 術前準備
1.供腸的準備。供體在術前可以給予免疫抑制劑如環孢素A(CsA)、FK506等。腸道可作準備,應用緩瀉劑與抗生素以清除腸內容物,還可給予足量肝素以防血凝。但從非腦死亡供體獲得供腸時難以做到這些準備。
2.免疫抑制劑的應用。受體在術前宜先接受免疫抑制劑治療,CsA,FK506可在術前1~2d給予。腸道也做清潔、抑菌的準備。營養不良者應先做術前營養支持。手術日,在手術開始時給予預防性廣譜抗生素,手術開始後給予大劑量甲潑尼龍500~1000mg靜注持續滴入;CSA或FK506等亦在手術開始時給予。CsA爲靜注6mg/(kg·d)(靜脈注射劑的藥效3倍於口服制劑),亦有給予前列腺素E10.6μg/(kg·min)或ATG(Anti thymoglobulin),OKTs等。當前,可採取FK506或CsA與甲潑尼龍,驍悉、賽尼哌(人源化IL2受體阻斷劑)聯合。所有免疫抑制劑應根據血藥濃度與病人的體徵、症狀與肝腎功能進行調整。
3.防治感染。在免疫抑制劑應用的情況下,器官移植病人的感染發生率甚高,抗感染的要點是防止感染,一切操作嚴格按無菌技術要求進行,加強消毒隔離制度,應用廣譜抗生素。
4.促進腸功能的恢復。腸移植的目的是建立一個能維持機體營養需要與其他功用的新腸襻。無疑,維持營養是最主要的。營養的吸收功能涉及到很多方面,其中最主要的是腸黏膜形態和功能的恢復。促進供腸黏膜在形態與功能方面的恢復是腸移植後着重處理的核心問題。腸黏膜是耐受缺血能力尤其是熱缺血較差的一種組織。在我國,從屍體獲得供腸尚不能完全避免熱缺血。爲此要設法使供腸的黏膜及早渡過退化、再生恢復到正常的過程。經過一可耐受的熱缺血(<6min)和總缺血時間(<17hr)後吸收功能有變化,術後2周內其吸收功能明顯受損,4周時纔開始恢復。顯示有一個由炎症退變到修復再生至正常的過程,歷時約2個月。缺血時間越長,其功能恢復緩慢甚至不能恢復。故在術中要求儘量縮短熱缺血與恢復血循環的時間。木糖吸收試驗是當前檢測腸吸收功能的有效方法。在腸功能未恢復前,腸外營養是主要的營養途徑,待腸內營養開始後即可緩慢撤去腸外營養至腸內營養能完全供給營養時爲止。理論上,谷氨醯胺是腸黏膜所必需的組織營養素,它能幫助腸黏膜的修復,當腸蠕動恢復後即可從高位空腸造口緩慢灌入,早期氨基酸的吸收較葡萄糖、脂肪爲好,以氨基酸爲氮源的腸道製劑較合適。食糜能刺激黏膜絨毛的再生,及時給予口服飲食甚爲必要。
腸道營養可促進腸黏膜細胞的增生,有利於維護腸黏膜屏障功能,當腸黏膜屏障功能發生障礙時,易有腸細菌易生,導致全身性炎症反應、膿毒症,也爲誘發排斥反應的發生。
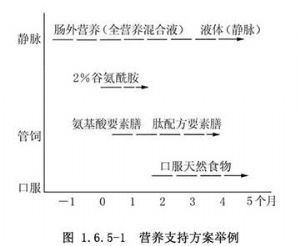
從營養支持方案舉例(圖1.6.5-1)中可以看出,營養支持的梗概。
13 手術步驟
小腸移植尚不是定性的手術,它可以是單一的小腸移植,也可以是與其他器官的聯合移植,最常見的是肝腸聯合移植,由於長期應用腸外營養,導致肝臟損害至衰竭,文獻中報道的腸移植與肝膽聯合移植的數量相等。
如同其他器官移植一樣,整個手術可分爲供體手術、受體手術與圍手術期處理3部分。現就單獨小腸移植作一介紹。
13.1 1.供體手術
理想的供體應是年齡相似,體型相似,同性別,以便移植腸容積、長短、血管的口徑與宿主相同。要求血型相同,最好做HLA配型和淋巴毒試驗。但是,在當前供體有困難的條件下采用非腦死亡供體時,難以如此要求,然血型必須相同。
(1)爲縮短熱缺血時間,獲取供腸時,手術組應緊密配合動作迅速。先向供體腹壁傾倒大量碘伏消毒皮膚,做“十”字大切口(圖1.6.5-2),進腹腔後立即放入大量無菌碎冰塊(圖1.6.5-3)。

(2)分離出髂動脈分叉上腹主動脈,結紮下端,立即插入導管灌入4℃林格液1000ml壓力爲120cmH2O後再灌入UW液(威斯康汀大學溶液)(圖1.6.5-4)。

(3)在膈下結紮阻斷腹主動脈,使灌注液逆行注入腸繫膜上動脈(SMA)。然後沿右結腸及左結腸旁溝切開後腹膜,將整個腸襻、脾、胰、十二指腸、胃一併掀起。在肝門部鉗夾切斷肝、十二指腸韌帶,也鉗夾切斷兩側腎血管,切斷上腸繫膜動脈段上下的主動脈與下腔靜脈,以血管鉗封閉幽門下十二指腸及迴腸並切斷。將整個小腸、胰、脾等取出浸泡在4℃UW液中,並從主動脈段再插入導管,灌入UW液約1000ml,要求在短暫的時間內完成腸繫膜血管牀的灌洗,小腸及其腸繫膜應無血色,完成整個小腸及附近器官的獲取,一般約需10min。將供腸等轉送至手術室做進一步處理。分離出SMA在開口部帶有Carrel主動脈片,腸繫膜上靜脈(SMV)分離到門靜脈部,注意防止血管骨骼化,但旁支及周圍組織應清除乾淨(圖1.6.5-5)。

(4)切斷的腸繫膜緣血管應妥善止血。切除胰腺、十二指腸及空腸近端、迴腸遠端各50cm,剩下小腸3~4m。敞開腸管的兩端,以4℃含卡那黴素2g的0.5%甲硝唑100ml溶液做腸腔內灌注,並可灌注UW液。
在修整供腸的整個過程應浸泡在4℃UW液中進行,並注意保持液體的溫度在4℃,嚴格按無菌技術操作。
13.2 2.受體手術
根據病人腹內病變的複雜程度,在供體整理前數小時或同時開始手術,一般要求受體的移植牀應在供體整理妥善前完成,以縮短供體的缺血時間。不可讓整理好的供腸等待受體牀的準備。
按要求選擇切口,多數採用腹正中長切口,便於向上、下、左、右延伸。進腹後首先將需要切除的腸襻清除。除MSV有栓塞者外,應注意顯露與保護腸繫膜上靜脈的殘留部分,觀察靜脈的粗細及殘留長度,考慮是否可留做吻合用,然後再考慮其他步驟。
在選擇小腸移植的手術方式時主要考慮的是腸繫膜靜脈迴流;供腸的長度;供腸與受體腸的吻合是一期完成還是分期完成等問題。
腸繫膜靜脈的迴流:通常移植腸只有動脈與靜脈兩根主要的血管要進行吻合,動脈的吻合僅考慮吻合的位置要合適,操作方便,保證有充足的血供即可。靜脈的吻合部則要考慮是門靜脈系統還是體靜脈系統,後者如髂總血管,顯露方便,位置淺。在技術操作上無大困難,有如腎異位移植。但其主要缺點是腸繫膜血流直接返回體靜脈系統,反流血中的營養素及某些因子不能直接進入肝臟,對肝臟與營養都不利,且腸繫膜靜脈血中含有大量的氨,直接進入到體靜脈系統後易引起高氨血癥。因此大多數學者主張腸繫膜靜脈血宜反流至門脈系統進肝。爲此,供腸繫膜的血管與宿主的血管吻合通常有下列4種形式:
①供腸腸繫膜上動脈、靜脈分別與宿主的髂總動脈、髂總靜脈或是腹主動脈,下腔靜脈吻合(圖1.6.5-6)。靜脈血流直接返回至體靜脈系統。

②供腸MSV與宿主MSV做對端或端-側吻合,根據宿主的MSV口徑而定。供腸MSA與宿主腎動脈平面下腹主動脈端-側吻合,只要宿主的MSV能用於吻合,這一術式操作不困難,靜脈反流合理,較多被採用(圖1.6.5-7)。

③供腸MSV與宿主的門靜脈做端-側吻合,MSA與宿主的腹主動脈做端-側吻合。這一術式用於宿主的MSV不適合做吻合時用。靜脈的反流通暢,直接進門靜脈是其優點,但需將整個胰、十二指腸向內掀起,操作範圍稍大,MSA相應地要吻合在較高的腹主動脈平面上,增加了操作的難度(圖1.6.5-8)。

④在少數情況下,將宿主的脾切除,供腸的MSA、MSV與脾動、靜脈斷端做對端吻合。動物實驗與臨牀應用均有這種術式,缺點是脾動脈、靜脈口徑較小,血循環量不足,也易有吻合口狹窄。尤不適用於成年人(圖1.6.5-9)。

不論吻合在何部位,均應考慮到宿主血管吻合口與血管本身管徑,是否能有足夠的動脈血供應,靜脈能否使血流及時反流而不致淤血,通常應以供體MSV與MSA的管徑爲準。血管吻合以5-0高分子線連續外翻吻合,術時注意防止血栓的形成,並儘量避免漏血、補針。吻合時,一般宜先吻合靜脈,在吻合血管時,從動脈置管灌注4℃血漿,將供腸血管內的UW保存液排除出血管不致返回至受體循環系統。由於全腸管約可灌入1400~1800ml血液,因此,開放循環前應通知麻醉師,預先補充血容量,以免驟然出現低血容量的現象。術後是否應用抗凝劑應根據手術野創傷的範圍與滲血程度,病人的凝血情況而定,通常在血容量充足,吻合口操作滿意時,一般都不需在術後應用抗凝劑。
供腸的長度:它曾是一個討論較多的問題,長度愈長,其中所含的淋巴組織愈多,可能排異越重。且有時是由活體供腸,長度的切取有一定的限度。但是,移植腸的長度術後要能維持營養,供腸的功能是否能全部恢復也值得加以考慮,同時現在的臨牀經驗也不足,究竟以多長爲合適,尚無定論。有報道活體供腸僅長60cm者,而屍體供腸多是全小腸移植。早期報道的病例,都以小腸移植爲主,但在無結腸的病人,術後常有腹瀉加重的情況。因此,在無結腸的病人可與小腸一併移植回盲部、盲腸、升結腸,或更多的結腸,有利於液體的吸收減少腹瀉,但增加了細菌易位、感染的危險。多數作者多不贊同移植結腸。
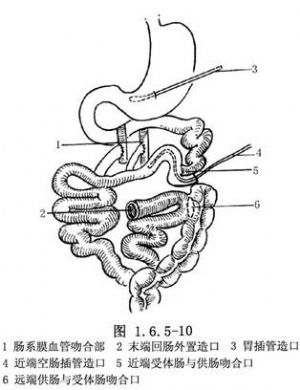
一期或二期完成腸吻合:動物實驗時多采用二期完成移植。一期手術時先吻合動靜脈,供腸兩斷端暫時外置有利於觀察及實驗研究用,其後,待肯定供腸成活後再二期手術將供腸與受體腸吻合完成移植。臨牀上雖也有灌食與觀察的需要,但如採用二期手術,尤其在已經應用較多的免疫抑制劑及腎上腺皮質激素後,對控制感染與切口癒合都將有影響。因此,現在多采用一期完成供腸與宿主腸的吻合。但爲腸道灌食,可在近端做腸插管造口,供腸遠端與宿主腸做側-端或側-側吻合後,再將末端提出外置造口做觀察窗用(圖1.6.5-10)。末端迴腸造口可在急性排斥的易發期後,吸收情況有好轉的情況下復位關閉,一般在移植後6個月左右進行。
14 術後處理
同種異體小腸移植術後做如下處理:
在術後早期應用全腸外營養的基礎上即開始從腸道灌入谷氨醯胺液以促進受損害腸黏膜的恢復,待腸功能有所改善時加灌以結晶氨基酸組成的要素膳,因氨基酸較易被吸收,其後改爲肽配方的要素膳以有利於腸黏膜功能的恢復,根據腸吸收的情況增加口服天然飲食,並抽出腸外輸注液中的營養成份僅補充攝入水分的不足。各類營養相互之間有一相互重疊的過程。在這過程中應該有細緻的監測。
術後,除按腹部手術處理外,重點是免疫抑制劑的應用與抗感染。免疫抑制劑可以是環孢素A+硫唑嘌呤,有的還在這兩種三聯用藥方案外,再加ATG成爲四聯方案。我們應用的是FK506+甲潑尼龍+驍悉。由於小腸移植尚處於臨牀開始應用階段,免疫抑制劑的應用方案,有待進一步完善。小腸移植後,急性排斥率高達87.5%且多在術後1個月後發生。除此,尚有GVHD(供體對宿主的反應病)與慢性排斥發生,爲了防止慢性排斥的發生,需要服用維持劑量的免疫抑制劑。常用的是CsA,全血藥濃度維持在200μg/ml,或是應用FK506。全血藥濃度維持10~15mg/L。
腸移植後有較高的腸道細菌易位的發生率,尤其在有排斥反應腸黏膜屏障發生損害時更易發生。如有發生,不但要應用抗菌藥物,還得加大免疫抑制劑的劑量。除細菌感染外,由於應用大量免疫抑制劑藥物,很易發生鉅細胞病毒感染,如肺炎,腸炎等,鉅細胞病毒腸炎可導致嚴重的腹瀉。
15 併發症
小腸移植後的併發症除一般腹部手術後的併發症外,主要有排斥反應、感染和腹瀉。
15.1 1.排斥反應(rejeerion)
(1)供體對宿主的反應症(GVHD guest versus host disease):GVHD是器官移植中供體對宿主的反應,較多出現在骨髓移植與腸移植。在鼠模型動物實驗中,GVHD較常有出現。在臨牀病例中發生率較低。主要表現爲全身症狀、皮疹。皮疹病理切片可顯示皮層與表皮層交界部有淋巴細胞浸潤伴基層細胞退變。
(2)急性排斥(acute rejection):由於腸壁與系膜中有較多的淋巴組織,故小腸移植排斥的發生率較高。第7屆國際小腸移植會議(2001年)報道全球註冊的小腸移植共656例,排斥發生率爲88%。Todo報道15例、16次腸移植中,排斥的發生率高達93.8%(15/16),術後第1個月的發生率爲87.5%、(14/16),3個月時爲28.6%(4/14),6個月時爲36.4%,但在12個月時7例病人中仍有3例發生急性排斥,表現爲發熱、腹痛、嘔吐與水樣瀉,重者可有腸麻痹、腸道出血、感染性休克與ARDS樣表現。診斷主要是依據腸黏膜活檢,病理切片觀察。治療是以大劑量腎上腺皮質激素衝擊,增大免疫抑制CsA或FK506,與給予OKTs,抗淋巴細胞球蛋白,抗胸腺細胞球蛋白等。治療適當,多數病人能夠恢復。
(3)慢性排斥:慢性排斥的主要病變是小血管壁增厚,腸壁纖維化,症狀爲不可控制的腹瀉、腹痛、間歇出現膿毒血癥,進行性體重下降與間歇性腸道出血,腸鏡檢查示腸管黏膜有假膜形成,黏膜皺襞增厚,慢性潰瘍到腸腔呈管狀。如血管造影顯示系膜血管弓有節段性狹窄,提示移植腸段應切除。
15.2 2.感染
小腸移植後除因免疫功能受抑制易有一般化膿性感染如肺炎與靜脈導管有關的感染外,尚易有因腸道細菌易位引起的感染、黴菌感染與鉅細胞病毒感染(cytomega lovirus infectien),細菌易位引起感染多與排斥有關,發生排斥時腸黏膜屏障功能受損,易有細菌易位。黴菌感染與細菌易位、應用免疫抑制劑與大劑量抗生素有關。鉅細胞病毒在人羣中有較高的攜帶率,器官移植後可因免疫抑制劑的應用而發生感染,常表現爲肺炎或腸炎。因此,有學者主張在術後應用更昔洛韋(ganiclovir)或免疫球蛋白預防,診斷主要是依賴鉅細胞病毒抗體試驗。
15.3 3.腹瀉
腸移植後腹瀉的原因甚多,除排斥與鉅細胞病毒感染外,還可以有菌羣失調、黴菌感染。更可以由於神經被切斷,淋巴管切斷,激素失調,腸黏膜功能恢復不全等引起。因此,術後發生腹瀉者甚多,可應用止瀉劑,如複方苯乙哌啶、洛哌丁胺、白陶土、次碳酸鉍等,有時還難以奏效,也有應用生長抑素者。有些病人切除了小腸與大部結腸而僅移植了小腸,小腸代償功能緩慢,腹瀉的時間可較長,在這些病人可同時移植回盲部與部分結腸(圖1.6.5-11,1.6.5-12)。

