3 b型流感嗜血桿菌結合疫苗藥典標準
3.1 品名
3.1.1 中文名
3.1.2 漢語拼音
b Xing Liuganshixueganjun Jiehe Yimiao
3.1.3 英文名
Haemophilus Influenzae Type b Conjugate Vaccine
3.2 定義、組成及用途
本品系用純化的b型流感嗜血桿菌(Hib)莢膜多糖抗原,通過己二酰肼與破傷風類毒素蛋白共價結合製成。用於預防b型流感嗜血桿菌引起兒童的感染性疾病,如腦膜炎、肺炎等。
3.3 1 基本要求
生產和檢定用設施、原材料及輔料、水、器具、動物等應符合“凡例”的有關要求。
3.4 2 製造
3.4.1 2.1 菌種
生產用菌種應符合“生物製品生產檢定用菌毒種管理規程”的有關規定。
3.4.1.1 2.1.1 名稱及來源
採用b型流感嗜血桿菌CMCC 58547或CMCC 58534株。
3.4.1.2 2.1.2 種子批的建立
3.4.1.3 2.1.3 種子批的傳代
主種子批啓開後傳代次數不超過5代,工作種子批啓開後至接種發酵罐培養傳代次數不得超過5代。
3.4.1.4 2.1.4 種子批的檢定
3.4.1.4.1 2.1.4.1 培養特性
菌種在普通營養瓊脂培養基上不生長,在含羊血的巧克力培養基或在Hib綜合瓊脂培養基上生長,生長需要X因子(氯化血紅素)、V因子(β輔酶A);衛星試驗陽性,菌落呈灰白色、半透明、光滑凸起,溼潤,邊緣規則。
3.4.1.4.2 2.1.4.2 染色鏡檢
應爲革蘭氏陰性短小桿菌,有莢膜,有時連成線狀,亦可有單個陰性球菌。
3.4.1.4.3 2.1.4.3 生化反應
發酵葡萄糖、木糖、半乳糖,產酸不產氣。不發酵蔗糖、乳糖和果糖(2010年版藥典三部附錄XIV)。賴氨酸脫羧酶反應呈陰性。
3.4.1.4.4 2.1.4.4 血清學試驗
將在35~37℃培養的菌苔,與Hib免疫血清進行玻片凝集試驗,應有強凝集反應。
3.4.1.5 2.1.5 種子批的保存
3.4.2 2.2 原液
3.4.2.1 2.2.1 生產用種子
啓開工作種子批菌種,一經適當傳代檢查培養特性和染色鏡檢後接種在液體或固體Hib綜合培養基上,製備數量適宜的生產用種子。
3.4.2.2 2.2.2 生產用培養基
採用Hib綜合培養基。
3.4.2.3 2.2.3 培養
採用培養罐液體培養,在培養過程中取樣進行純菌試驗、塗片革蘭氏染色鏡檢,如發現污染雜菌,應廢棄。
3.4.2.4 2.2.4 收穫及殺菌
於對數生長期的後期或靜止期的前期收穫,取樣進行菌液濃度測定及純菌檢查,然後於培養物中加入適宜濃度的甲醛溶液或脫氧膽酸鈉溶液殺菌,以確保殺菌完全及不損傷Hib莢膜多糖爲宜。
3.4.2.5 2.2.5 多糖提取和純化
3.4.2.5.1 2.2.5.1 去核酸
將已殺菌的培養物,離心去菌體後收集上清液,採用十六烷基三甲基溴化銨沉澱收集複合多糖。
3.4.2.5.2 2.2.5.2 沉澱多糖
乙醇沉澱收集粗製多糖,或超濾濃縮後乙醇沉澱,取上清液,然後加入適宜濃度的乙醇溶液沉澱多糖,並依次用無水乙醇、丙酮洗滌沉澱物,乾燥後即爲粗製多糖,-20℃或以下保存。
3.4.2.5.3 2.2.5.3 多糖純化
將粗製多糖溶解於1/10飽和醋酸鈉溶液中,然後按適當比例用冷酚溶液重複抽提數次。收集上清液,並透析或超濾脫酚,再加乙醇至最終濃度爲60%~80%,離心後收集沉澱物,或超濾濃縮後乙醇沉澱,取上清液,然後加入60%~80%的乙醇溶液沉澱多糖,依次用無水乙醇、丙酮洗滌,真空乾燥,所得固體即爲精製多糖。
3.4.2.5.4 2.2.5.4 多糖檢定
按3.1項進行。
3.4.2.5.5 2.2.5.5 保存及有效期
3.4.2.6 2.2.6 多糖衍生
3.4.2.6.1 2.2.6.1
將精製多糖溶解後,按適宜比例加入溴化氰進行活化,然後向反應液中加入適宜濃度的己二酰肼溶液,反應過夜。再將反應液超濾或透析。可凍幹收集固體衍生物。
3.4.2.6.2 2.2.6.2 多糖衍生物檢定
按3.2項進行。
3.4.2.6.3 2.2.6.3 保存及有效期
3.4.2.7 2.2.7 載體蛋白
載體蛋白爲破傷風類毒素。破傷風類毒素原液製造和檢定應符合“吸附破傷風疫苗”2.1~2.2項規定。
可採用柱色譜法或其他經批准的方法對破傷風類毒素原液進一步純化,並配製至適宜濃度。
3.4.2.8 2.2.8 多糖蛋白結合物的製備
3.4.2.8.1 2.2.8.1 結合
多糖衍生物與破傷風類毒素蛋白等量混合,加入碳二亞胺( EDAC)進行反應,然後透析或超濾透析。
3.4.2.8.2 2.2.8.2 結合物純化
結合物用柱色譜純化,收集Vo附近的洗脫液,合併各次色譜收穫的洗脫液即爲純化的結合物,除菌過濾後,即爲結合物原液。
3.4.2.9 2.2.9 原液檢定
按3.3項檢定。
3.4.2.10 2.2.10 保存及有效期
3.4.3 2.3 半成品
3.4.3.1 2.3.1 配製
用氯化鈉注射液稀釋多糖蛋白結合物原液,每1ml疫苗溶液含多糖應不低於20μg。
3.4.3.2 2.3.2 半成品檢定
按3.4項進行。
3.4.4 2.4 成品
3.4.4.1 2.4.1 分批
3.4.4.2 2.4.2 分裝
3.4.4.3 2.4.3 規格
3.4.4.4 2.4.4 包裝
3.5 3 檢定
3.5.1 3.1 多糖檢定
3.5.1.1 3.1.1 鑑別試驗
採用免疫雙擴散法(2010年版藥典三部附錄Ⅷ C),本品應與b型流感嗜血桿菌免疫血清形成明顯沉澱線。
3.5.1.2 3.1.2 化學檢定
3.5.1.2.1 3.1.2.1 固體總量
依法測定(2010年版藥典三部附錄Ⅶ M)。
3.5.1.2.2 3.1.2.2 核糖含量
以D-核糖爲對照,應爲320~410mg/g(2010年版藥典三部附錄Ⅷ J)。
3.5.1.2.3 3.1.2.3 磷含量
應爲68~90mg/g(2010年版藥典三部附錄Ⅶ A)。
3.5.1.2.4 3.1.2.4 蛋白質含量
應小於10mg/g(2010年版藥典三部附錄Ⅵ B第二法)。
3.5.1.2.5 3.1.2.5 核酸含量
應小於10mg/g,核酸在波長260nm處的吸收係數(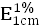 )爲200(2010年版藥典三部附錄Ⅱ A)。
)爲200(2010年版藥典三部附錄Ⅱ A)。
3.5.1.2.6 3.1.2.6 多糖分子大小測定
採用瓊脂糖CL-4B凝膠柱(1.6cm×100cm)測定,KD≤0.5的多糖回收率應不低於50%(2010年版藥典三部附錄Ⅷ G)。
3.5.1.3 3.1.3 細菌內毒素檢查
應不高於25EU/μg(2010年版藥典三部附錄Ⅻ E)。
3.5.2 3.2 多糖衍生物檢定
3.5.2.1 3.2.1 己二酰肼含量
應爲16~45μg/mg(2010年版藥典三部附錄Ⅷ K)。
3.5.2.2 3.2.2 氰化物殘留量
應不高於10ng/mg(2010年版藥典三部附錄Ⅵ X)。
3.5.3 3.3 結合物原液檢定
3.5.3.1 3.3.1 鑑別試驗
採用免疫雙擴散法(2010年版藥典三部附錄Ⅷ C),本品應與b型流感嗜血桿菌免疫血清及破傷風類毒素免疫血清形成明顯沉澱線。
3.5.3.2 3.3.2 化學檢定
3.5.3.2.1 3.3.2.1 多糖含量
以D-核糖爲對照,按核糖含量計算結合物中多糖含量,應不低於28μg/ml(2010年版藥典三部附錄Ⅷ J)。
3.5.3.2.2 3.3.2.2 蛋白質含量
應不低於48μg/ml(2010年版藥典三部附錄Ⅵ B第二法)。
3.5.3.2.3 3.3.2.3 多糖與蛋白質的比值
按3.3.2.1和3.3.2.2測定結果計算,應爲0.30~0.59。
3.5.3.2.4 3.3.2.4 高分子結合物含量
高分子結合物應爲80%~100%或遊離多糖≤20%(2010年版藥典三部附錄Ⅷ L)。
3.5.3.2.5 3.3.2.5 多糖分子大小測定
採用瓊脂糖CL-4B凝膠柱(1.6cm×100cm)測定,KD值應不高於0.20,KD值小於0.20的洗脫液回收率應不低於60%(2010年版藥典三部附錄Ⅷ G)。
3.5.3.2.6 3.3.2.6 EDAC殘留量
採用N.Wilchek方法測定,EDAC殘留量應低於10μmol/L(2010年版藥典三部附錄Ⅵ Y)。
3.5.3.3 3.3.3 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.5.3.4 3.3.4 細菌內毒素檢查
應不高於5FU/μg(2010年版藥典三部附錄Ⅻ E)。
3.5.4 3.4 半成品檢定
3.5.4.1 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.5.5 3.5 成品檢定
3.5.5.1 3.5.1 鑑別試驗
採用免疫雙擴散法(2010年版藥典三部附錄Ⅷ C),應與b型流感嗜血桿菌免疫血清及破傷風類毒素免疫血清形成明顯沉澱線。
3.5.5.2 3.5.2 物理檢查
3.5.5.2.1 3.5.2.1 外觀檢查
應爲無色透明液體,無異物。
3.5.5.2.2 3.5.2.2 裝量
依法檢查(2010年版藥典三部附錄Ⅰ A),應不低於標示量。
3.5.5.3 3.5.3 化學檢定
3.5.5.3.1 3.5.3.1 pH值
應爲5.0~7.0(2010年版藥典三部附錄Ⅴ A)。
3.5.5.3.2 3.5.3.2 氯化鈉含量
應爲7.5~9.5g/L(2010年版藥典三部附錄Ⅶ G)[1]。
3.5.5.3.3 3.5.3.3 多糖含量
以D-核糖爲對照,按核糖含量計算供試品中多糖含量,每1次人用劑量應爲10~15μg(2010年版藥典三部附錄Ⅷ J)。
3.5.5.3.4 3.5.3.4 高分子結合物含量
高分子結合物應爲80%~100%或遊離多糖≤20%(2010年版藥典三部附錄Ⅷ L)。
3.5.5.3.5 3.5.3.5 多糖分子大小測定
採用瓊脂糖CL-4B凝膠柱(1.6cm×100cm),KD值小於0.2的洗脫液回收率應大予60%(2010年版藥典三部附錄Ⅷ G)。
3.5.5.4 3.5.4 效力試驗
每批疫苗皮下注射體重12~14g NIH(或BALb/c)小鼠10只,另取同批小鼠10只作爲對照,注射0.85%氯化鈉溶液。於第1、14天皮下注射兩次,每次注射劑量爲含2.5μg多糖的Hib結合疫苗,於第21~28天經眼眶後靜脈採血,以ELISA法測定抗Hib IgG抗體,以0.85%氯化鈉溶液對照組小鼠血清的A值求出Cutoff值,疫苗組應有80%以上小鼠的血清抗Hib IgG抗體水平高於Cutoff值。
3.5.5.5 3.5.5 無菌檢查
依法檢查(2010年版藥典三部附錄Ⅻ A),應符合規定。
3.5.5.6 3.5.6 熱原檢查
依法檢查(2010年版藥典三部附錄Ⅻ D),注射劑量按家兔體重每1kg注射1.0μg多糖,應符合規定。
3.5.5.7 3.5.7 異常毒性檢查
依法檢查(2010年版藥典三部附錄Ⅻ F),應符合規定。
3.5.5.8 3.5.8 細菌內毒素檢查
每1次人用劑量應不高於25EU(2010年版藥典三部附錄Ⅻ E)。
3.6 4 保存、運輸及有效期
3.7 5 使用說明
【藥品名稱】
通用名稱:b型流感嗜血桿菌結合疫苗
英文名稱:Haemophilus Influenzae Type b Conjugate Vaccine
漢語拼音:b Xing Liuganshixueganjun Jiehe Yimiao
【成分和性狀】
本品系用純化的b型流感嗜血桿菌莢膜多糖與破傷風類毒素共價結合而成。爲無色透明液體[1]。
【接種對象】
【作用與用途】
本疫苗接種後,可使機體產生體液免疫應答。用於預防由b型流感嗜血桿菌引起的侵襲性感染(包括腦膜炎、肺炎、敗血症、蜂窩組織炎、關節炎、會厭炎等)。
【規格】
每瓶爲0.5ml,每1次人用劑量爲0.5ml,含純化b型流感嗜血桿菌莢膜多糖應不低於10μg.
臀部外上方1/4處或上臂外側三角肌肌內注射。
自2 (3)月齡開始,每隔1個月或2個月接種1次(0.5ml),共3次,在18個月時進行加強接種1次;6~12月齡兒童,每隔1個月或2個月注射1次(0.5ml),共2次,在18個月時進行加強接種1次;1~5週歲兒童,僅需注射1次(0.5ml)。
【不良反應】
注射後一般反應輕微,接種部位可出現輕微紅腫、硬結、壓痛,偶有局部瘙癢感,一般不需特殊處理,即自行消退。必要時可對症治療。
全身反應:主要爲發熱反應(多在38.5℃以下),偶有煩躁、嗜睡、嘔吐、腹瀉、食慾不振,偶見非典型的皮疹,一般可自行緩解。
【禁忌】
(1)患急性疾病、嚴重慢性疾病、慢性疾病的急性發作期和發熱者。
(2)已知對該疫苗的任何成分過敏,特別對破傷風類毒素過敏者。
【注意事項】
(1)以下情況者慎用:家族和個人有驚厥史者、患慢性疾病者、有癲癇史者、過敏體質者。
(2)使用前應充分搖勻,如出現搖不散的凝塊,異物,疫苗瓶有裂紋、標籤不清或過期失效者,均不得使用。
(3)接受免疫抑制治療或免疫缺陷患者注射本疫苗可能影響疫苗的免疫效果。
(4)應備有腎上腺素等藥物,以備偶有發生嚴重過敏反應時急救用。接受注射者在注射後應在現場觀察至少30分鐘。
(6)在任何情況下,疫苗中的破傷風類毒素不能代替常規破傷風類毒素的免疫接種。
(7)嚴禁凍結。
【貯藏】
於2~8℃避光保存和運輸。
【包裝】
【有效期】
24個月。
【執行標準】
【批准文號】
【生產企業】
企業名稱:
生產地址:
郵政編碼:
電話號碼:
傳真號碼:
網 址:
3.8 版本
《中華人民共和國藥典》2010年版
4 參考資料
- ^ [1] 國家藥典委員會.中華人民共和國藥典:2010年版:第一增補本[M].北京:中國醫藥科技出版社,2010.